Nomenclatura Para entender la Nomenclatura Química es
Anuncio
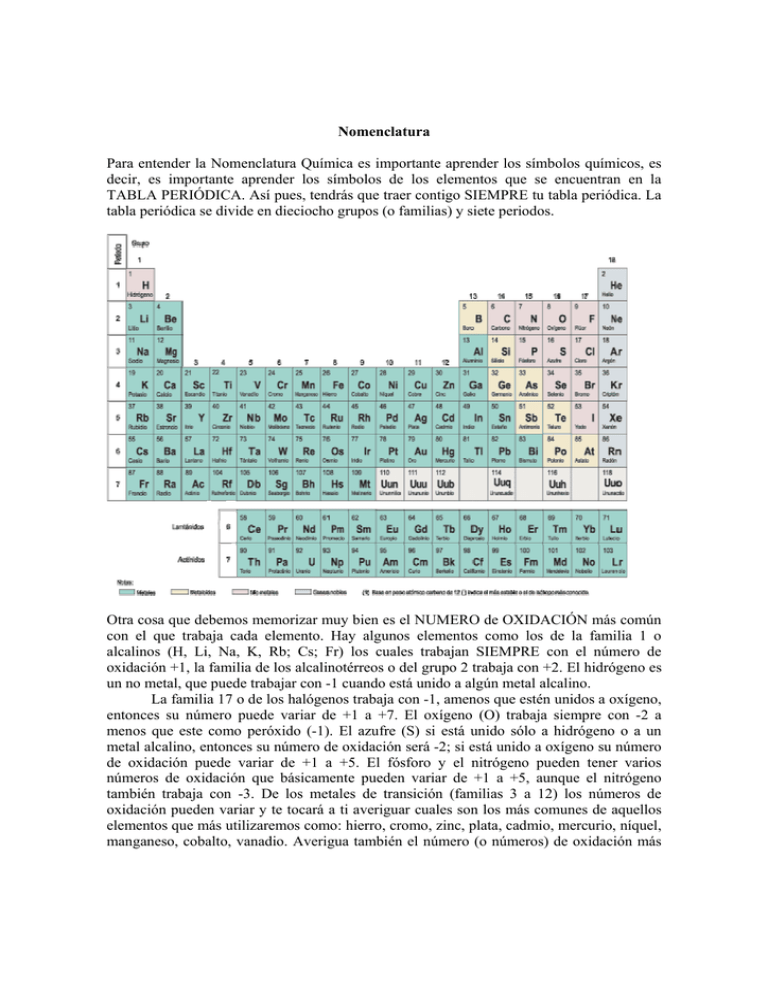
Nomenclatura Para entender la Nomenclatura Química es importante aprender los símbolos químicos, es decir, es importante aprender los símbolos de los elementos que se encuentran en la TABLA PERIÓDICA. Así pues, tendrás que traer contigo SIEMPRE tu tabla periódica. La tabla periódica se divide en dieciocho grupos (o familias) y siete periodos. Otra cosa que debemos memorizar muy bien es el NUMERO de OXIDACIÓN más común con el que trabaja cada elemento. Hay algunos elementos como los de la familia 1 o alcalinos (H, Li, Na, K, Rb; Cs; Fr) los cuales trabajan SIEMPRE con el número de oxidación +1, la familia de los alcalinotérreos o del grupo 2 trabaja con +2. El hidrógeno es un no metal, que puede trabajar con -1 cuando está unido a algún metal alcalino. La familia 17 o de los halógenos trabaja con -1, amenos que estén unidos a oxígeno, entonces su número puede variar de +1 a +7. El oxígeno (O) trabaja siempre con -2 a menos que este como peróxido (-1). El azufre (S) si está unido sólo a hidrógeno o a un metal alcalino, entonces su número de oxidación será -2; si está unido a oxígeno su número de oxidación puede variar de +1 a +5. El fósforo y el nitrógeno pueden tener varios números de oxidación que básicamente pueden variar de +1 a +5, aunque el nitrógeno también trabaja con -3. De los metales de transición (familias 3 a 12) los números de oxidación pueden variar y te tocará a ti averiguar cuales son los más comunes de aquellos elementos que más utilizaremos como: hierro, cromo, zinc, plata, cadmio, mercurio, níquel, manganeso, cobalto, vanadio. Averigua también el número (o números) de oxidación más común para elementos como: estaño, galio, indio, plomo, boro, carbono, aluminio, silicio, arsénico. Cuando un elemento pierde o gana electrones forma los que llamamos iones positivos o cationes y iones negativos o aniones; de estos cationes y aniones hay algunos que son muy comunes y que tendrás que aprender a reconocer rápidamente, estos son: a) aniones: Los aniones normalmente están formados por no metales y para nombrarlos se toma la raíz del nombre del elemento y se le añade un sufijo. Las raíces que debes considerar son: B bor C Si carb silic N nitr P fosf As arsen O ox S sulf Se selen H F Cl Br hidro fluor clor brom a. aniones monoatómicos: aquellos que están formados por átomos iguales o átomos del mismo elemento. Para nombrarlos decimos ion, la raíz del elemento y le añadimos el sufijo –uro cuando no estan relacionados a oxígeno e –ido cuando se relacionan a éste. O2- ion oxido N3- ion nitruro H ion hidruro Cl- ion cloruro S2- ion sulfuro Los aniones poli-atómicos son aquellos formados átomos diferentes o de elementos diferentes CN- ion cianuro O22- ion peroxido OH- ion hidróxido b. aniones poli atómicos que contienen oxígeno, sus nombres terminan en –ato o –ito. La terminación -ato es usada para el oxianión que tiene al elemento central con número de oxidación más alto. La terminación –ito es usada para el oxianión que tiene al elemento central con número de oxidación más bajo. NO3- nitrato aquí el nitrógeno (que es el elemento central) tiene número de oxidación +5. NO2- nitrito aquí el nitrógeno (que es el elemento central) tiene número de oxidación +3. SO42- sulfato aquí el azufre (que es el elemento central) tiene número de oxidación +6. SO32- sulfito aquí el azufre (que es el elemento central) tiene número de oxidación +4. _________________________________________________________________________ Paréntesis informativo: ¿Cómo determinas el número de oxidación del azufre en el compuesto sulfato de sodio Na2SO4? • Primero considera que la molécula es neutra, es decir no tiene carga ni positiva ni negativa. • Después considera los números de oxidación de aquellos elementos que sabes que son fijos, por ejemplo el sodio que su número de oxidación siempre es +1, y el oxigeno que su número de oxidación siempre es -2. • Ahora cuenta los átomos que tienes de cada uno de ellos. Si tienes dos átomos de sodio, tendrás dos cargas positivas. Si tienes cuatro oxígenos tendrás [(4O X -2)= -8] -8 cargas negativas, entonces -8 +2 (del sodio)= -6 necesitas 6 cargas positivas para que la molécula sea neutra. Por lo que el azufre debe tener un número de oxidación de +6. ¿Qué sucede con los cationes y los aniones? ¿Cómo determinas el número de oxidación del átomo central? Debes considerar que NO son especies neutras y hay que tomar en cuenta la carga ya sea positiva o negativa al momento de determinar el número de oxidación del átomo central. Ahora te toca a ti resolver el mayor número de ejemplos posibles. Cuando se tienen más de dos oxianiones con el mismo átomo central se le debe añadir el prefijo per- al oxianion que tiene el mayor número de átomos y el prefijo hipo- al que tiene el menor número de átomos. ion perclorato ClO4ClO3ion clorato ion clorito ClO2 ion hipoclorito ClOCrO42- ion cromato Cr2O72ion dicromato en el caso del dicromato se unen dos iones cromato para formar este ion. El SCN- ion tiocianato es de los pocos iones que no tienen oxígeno y que su terminación es -ato b) cationes: a. los cationes que se forman de los átomos metálicos tienen el mismo nombre que el metal. Zn2+ ion zinc Al3+ ion aluminio Na+ ion sodio Fe2+ Fe3+ b. Si el metal puede formar cationes con diferentes cargas, la carga positiva se escribe entre paréntesis y con números romanos. ion hierro (II) Cu+ ion cobre (I) ion hierro (III) Cu2+ ion cobre (II) Esta es la nomenclatura moderna, pero también te puedes encontrar la nomenclatura antigua en donde las terminaciones son –oso para el número de oxidación más bajo e –ico para el número de oxidación más alto. Cu+ ion cuproso Fe2+ ion ferroso Fe3+ ion ferrico Cu2+ ion cuprico c. cationes formados por átomos no metálicos cuyos nombres terminan en –io. H3O+ ion hidronio NH4+ ion amonio Para escribir una fórmula química primero debes poner al catión (aunque sea compuesto) y después al anión (aunque sea compuesto), ejemplos (la parte subrayada es el catión): HCl; NaBr; (NH4)2SO4; K2Cr2O7. Para nombrar a los compuestos químicos primero debemos nombrar al anión y después al catión. Debemos tener cuidado con los subíndices (incluidos los que están fuera de los paréntesis). Así pues, debemos considerar la notación latina: di (2), tri (3), tetra (4), penta (5), hexa (6), hepta (7), etc. cuando en subíndice está más cerca del átomo y la notación griega (bis (2), tris (3), tetrakis (4), pentakis (5), etc) cuando el subíndice está más alejado del átomo*. HCl cloruro de hidrógeno NaBr bromuro de sodio (NH4)2SO4 sulfato de amonio (nomenclatura común) ó tetraoxosulfato de diamonio (nomenclatura semi-sistemática) *Cu(ClO4)2 perclorato cuprico, perclorato de cobre(II) ó bis-tetraoxoclorato de cobre (II) N2O4 tetroxido de dinitrógeno P4S10 decasulfuro de fósforo NF3 trifluoruro de nitrógeno Para nombrar a los oxo-ácidos la terminación –ato se cambia por –ico y la terminación –ito se cambia por –oso. Así pues si tenemos el ión sulfato (SO42-) y le añadimos el catión (H+) para formar el ácido (H2SO4) lo nombraremos de la siguiente forma: ácido sulfúrico Anión ClO- ión hipoclorito ClO2- ión clorito ClO3- ión clorato Ácido correspondiente HClO Ácido hipocloroso HClO2 ácido cloroso HClO3 ácido clorico