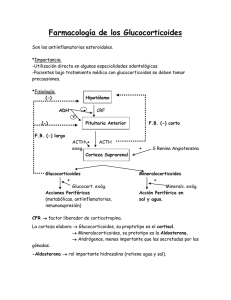
Glucocorticoides - Sibdi - Universidad de Costa Rica
Anuncio

GLUCOCORTICOIDES Elaborado por: Dra. Gabriela Villalobos Chaves Farmacéutica CIMED Centro Nacional de Información de Medicamentos Agosto, 2003 GLUCOCORTICOIDES Elaborado por: Dra. Gabriela Villalobos Chaves Farmacéutica CIMED Centro Nacional de Información de Medicamentos Instituto de Investigaciones Farmacéuticas Facultad de Farmacia Universidad de Costa Rica Agosto, 2003 Índice Introducción ________________________________________________________ 1 La Corteza Suprarrenal ______________________________________________ 2 • Generalidades • Metabolismo de los corticosteroides • Regulación de la secreción de cortisol - El Eje Hipotálamo-Hipófisis anterior-Corteza suprarrenal - Hormona liberadora de corticotropina - Adrenocorticotropina - Patrones de secreción de cortisol Acciones fisiológicas y efectos farmacológicos de los Glucocorticoides _________8 • Generalidades • Mecanismos intracelulares • Efectos sobre el metabolismo • Efectos sobre tejidos y órganos • Respuestas inflamatorias e inmunes Toxicidad _________________________________________________________ 17 • Supresión del tratamiento • Uso continuo de dosis suprafisiológicas de corticosteroides Aplicaciones Terapéuticas ___________________________________________ 23 • Absorción, transporte, metabolismo y eliminación • Usos terapéuticos - Terapia de reemplazo - Enfermedades no endocrinas • Precauciones • Recomendaciones para el paciente Interacciones de los glucocorticoides __________________________________ 37 Enfermedades de la corteza suprarrenal _______________________________ 44 • Síndrome de Cushing • Enfermedad de Addison Introducción Los corticosteroides se encuentran en la actualidad dentro de los medicamentos de mayor uso para muchas enfermedades, debido a su capacidad para ejercer efectos sobre casi todos los sistemas y a la diversidad de sus acciones. Los efectos adversos graves que pueden observase durante la terapia prolongada con corticosteroides o por la supresión de la misma, los convierte en medicamentos de sumo cuidado y de consideración cuidadosa en cuanto a los riesgos y beneficios relativos en cada paciente. Por otro lado, estos efectos secundarios también han creado cierto temor en cuanto a su uso en los pacientes, aún cuando en muchos casos la terapia no presenta problemas colaterales serios. Los corticosteroides y sus derivados sintéticos biológicamente activos difieren en sus actividades metabólicas (glucocorticoides) y de regulación de electrolitos (mineralocorticoides). En este folleto se mencionarán únicamente los compuestos con actividad glucocorticoide ya que son los que más aplicación terapéutica poseen. Los glucocorticoides son potentes supresores de la inflamación. Éstos pueden evitar o suprimir la inflamación en respuesta a múltiples fenómenos incitantes, entre ellos, estímulos radiantes, mecánicos, químicos, infecciosos e inmunitarios. Aunque el uso de glucocorticoides como antiinflamatorios no ataca la causa fundamental de la enfermedad, la supresión de la inflamación posee enorme utilidad clínica, y ha hecho que esos compuestos figuren entre los que se prescriben con mayor frecuencia. De modo similar, los glucocorticodes son inmensamente útiles para tratar enfermedades que se originan de reacciones inmunitarias indeseables, incluyendo padecimientos que sobrevienen de modo predominante por inmunidad humoral, como urticaria. (2) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 1 La Corteza Suprarrenal GENERALIDADES Las glándulas suprarrenales son órganos endocrinos multifuncionales que segregan diversos esteroides, que pueden dividirse en corticosteroides, basados en un núcleo de 21 carbonos y en corticoides sexuales, principalmente andrógenos, basados en un núcleo de 19 carbonos. Los corticosteroides se dividen tradicionalmente en aquellos con acciones glucocorticoides, de los cuales el cortisol (hidrocortisona) es el ejemplo endógeno más importante, y aquellos que son primariamente mineralocorticoides, de los cuales la aldosterna es el más importante. (3) Numerosas observaciones experimentales y clínicas han demostrado que las glándulas suprarrenales son imprescindibles para la vida. Sus secreciones desempeñan una amplia variedad de funciones fisiológicas, como regulación de la glucosa sanguínea, recambio proteico, metabolismo de la grasa, equilibrio de sodio, potasio y calcio, modulación de la respuesta tisular ante lesiones o infecciones y, sobre todo, supervivencia ante cualquier estrés. (1) Cada glándula suprarrenal se localiza inmediatamente por encima del riñón ipsolateral y su peso conjunto es de 6 a 10 g. Cada glándula está formada por dos entidades funcionales distintas. La zona externa, o corteza, representa del 80 al 90% del peso. Deriva del tejido mesentérico y es la fuente de las hormonas corticosteroides. La zona interna, o médula, representa el 10 al 20% restante. (1) Las principales hormonas de la corteza son: 1. El glucocorticoide, cortisol, que posee acciones fundamentales sobre el metabolismo hidrocarbonado y proteico y en la adaptación al estrés. 2. El mineralocorticoide, aldosterona, vital para mantener el volumen del líquido extracelular y los niveles normales de potasio. 3. Precursores de esteroide sexuales, que contribuyen a mantener los caracteres sexuales secundarios. (1,2) METABOLISMO DE LOS CORTICOSTEROIDES La concentración plasmática basal matutina de cortisol es de 5 a 20 µg/dl; por la tarde suele descender por debajo de 5 µg/dl. La hormona circula unida en un 90% a una globulina específica ligadora de corticosteroides denominada transcortina. La concentración de transcortina y, por tanto, de cortisol plasmático total aumenta durante el embarazo y con la administración de estrógenos. (1) El cortisol está en equilibrio con su análogo biológicamente inactivo, 11-ceto cortisona, gracias a la enzima 11β-OH deshidrogenasa. Esta enzima, presente en muchos tejidos, convierte la cortisona exógena en una fuente eficaz de cortisol. La conversión del cortisol en cortisona en el riñón es importante para evitar que el cotisol ejerza actividad mineralocorticoide en los receptores de aldosterona a los que se une. La mayor parte del cortisol y de la cortisona se metabolizan en el hígado; sus metabolitos son conjugados y excretados con la orina en forma de glucurónidos. La cuantificación de estos metabolitos Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 2 urinarios, conocidos en conjunto como 17-hidroxicorticoides, proporciona también una estimación de la secreción de cortisol, siempre que las funciones hepática y renal estén intactas. (1) REGULACIÓN DE LA SECRECIÓN DE CORTISOL: El Eje Hipotálamo-Hipófisis anterior-Corteza suprarrenal El patrón de secreción del cortisol es muy complejo. El estimulador inmediato de la secreción de cortisol es la adrenocorticotropina (ACTH) de la hipófisis anterior. El estimulador inmediato más importante de la secreción de ACTH es el neuropéptido hipotalámico hormona liberadora de corticotropina (CRH). Por tanto, existe un eje hipotalámico-hipofisario-suprarrenal (HPA) y las tres hormonas mencionadas forman un clásico circuito de retroalimentación negativa. El cortisol (o cualquier análogo glucocorticoide, como dexametasona o prednisona): 1. Inhibe en minutos, por retroalimentación sobre la hipófisis, la liberación de ACTH al bloquear la acción estimuladora de la CRH sobre las células corticotrofas. 2. Inhibe más lentamente (en horas), por retroalimentación, la síntesis de ACTH al bloquear la transcripción de su gen. 3. Bloquea, por retroalimentación sobre el hipotálamo, la liberación y probablemente la síntesis de CRH. (1,11) Hay tres niveles característicos de regulación del eje referido: ritmo diurno de la esteroidogénesis basal, retroacción negativa por glucocorticoides suprarrenales e incrementos notorios de la esteroidogénesis en respuesta al estrés. (2) Los estímulos como la inflamación, dolor, infección y hasta el estrés mental conducen a activación del eje HPA. Estos estímulos causan excitación del hipotálamo, que responde liberando CRH. La CRH actúa luego en la pituitaria anterior para inducir la síntesis y liberación de la enzima adrenocorticotrópica (ACTH). La ACTH estimula la liberación de glucocorticoides por la corteza adrenal. (9,11) (ver figura 1) El neuropéptido arginina vasopresina (AVP) estimula también la secreción de ACTH y, por tanto, de cortisol en ciertas situaciones, y el cortisol reduce por retroalimentación negativa la liberación de AVP. (1,2) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 3 Figura 1. Regulación de la secreción de cortisol por el eje HPA. Diversas aferencias recibidas por el hipotálamo estimulan la secreción de hormona liberadora de corticotropina (CRH), que a su vez aumenta la de adrenocorticotropina (ACTH) y, por tanto, la de cortisol. Hormona liberadora de corticotropina (CRH) La CRH es un péptido de 41 aminoácidos sintetizado a partir de una prepro-CRH. La CRH pasa a las venas porta hipofisiarias y llega hasta las células corticotrofas. Tras haberse unido a un receptor de la membrana plasmática, la CRH estimula la liberación de corticotropina (ACTH) desde sus gránulos secretores, empleando calcio y adenosina monofosfato cíclico (AMPc) como segundos mensajeros, además de estimular la síntesis de ACTH. Cuando no hay presencia de CRH se secreta una muy pequeña cantidad de corticotropina. (1,8) Además de esta función endocrina, y quizá relacionada funcionalmente con ella, la CRH ejerce otras acciones sobre el sistema nervioso central, como estimulación de la actividad del sistema nervioso simpático, aceleración de los reflejos motores, mejora en la atención y la función cognoscitiva, disminución de la fiebre y del apetito, supresión de la función reproductora y de la actividad sexual, supresión de la liberación de la hormona del crecimiento y alteraciones del comportamiento. Los niveles de CRH plasmática periféricos son muy bajos, pero reflejan una retroalimentación negativa, ya que aumentan ligeramente en caso de deficiencia de cortisol y disminuyen con la administración de glucocorticoides. (1,8) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 4 Adrenocorticotropina (ACTH) La ACTH es un péptido de 39 aminoácidos que estimula la síntesis y la liberación inmediata de cortisol, andrógenos suprarrenales, sus precursores y aldosterona. Sin embargo, sólo el cortisol ejerce retroalimentación negativa sobre hipotálamo e hipófisis. La corticotropina es el regulador de la secreción de glucocorticoides por la glándula adrenal. (1, 2, 8,11) La ACTH se sintetiza a partir de un gran precursor denominado propiomelanocortina (POMC), que da lugar a la cosecreción de diversos productos, entre ellos las β-endorfinas. Tras unirse a su receptor en la membrana plasmática suprarrenal, la ACTH estimula la generación de AMPc, que es el principal segundo mensajero de sus acciones. (1,2) El calcio y los derivados de fosfatidilinositol pueden desempeñar papeles complementarios. Los efectos finales de la ACTH se efectúan a través de productos proteicos resultantes de una cascada de fosforilaciones enzimáticas catalizadas por proteína cinasa A y C. Entre estos productos se incluyen activadores enzimáticos, factores de transcripción y factores de crecimiento. La ACTH estimula al momento de la captación de colesterol por la célula, la hidrólisis de los ésteres de colesterol, el transporte del colesterol a las mitocondrias, la reacción limitante de la desmolasa P-450 scc y el paso crítico de la 11-hidroxilación en la síntesis del cortisol. La ACTH modifica también la morfología de la célula corticosuprarrenal al actuar sobre su citoesqueleto y poner las vacuolas del colesterol en contacto con las mitocondrias. La estimulación continua por ACTH provoca hiperplasia de la corteza suprarrenal. (1) Patrones de secreción de cortisol El cortisol se segrega en pulsos, siguiendo un patrón diurno. Los picos de secreción de cortisol son inducidos por pulsos de ACTH, causados a su vez por la liberación pulsátil de CRH. Estos pulsos originan un patrón circadiano de cortisol. Los niveles plasmáticos máximos de ACTH y cortisol se alcanzan unas 2 horas antes de despertar, entre las 4 y las 6 AM; el nivel mínimo de ACTH y cortisol se alcanza justo antes de dormir (ver figura 2). El pico matutino de cortisol representa el 50% de la secreción total diaria. La duración de este pico suele variar si se modifica sistemáticamente el sueño-vigilia. El ritmo circadiano es intrínseco y se genera en el hipotálamo, probablemente en el núcleo supraquiasmático. La retroalimentación negativa puede modificar el ajuste de este centro: los glucocorticoides exógenos suprimen y la deficiencia previa de cortisol acentúa el pico de ACTH matutino. La pérdida de conciencia y la exposición constante a la luz o a la oscuridad también amortiguan el ritmo circadiano. (1) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 5 Figura 2. Patrón pulsátil y diurno de secreción de ACTH y cortisol. El cortisol es necesario para la supervivencia del organismo sometido a un estrés. En presencia de infección severa, trauma, quemadura, enfermedad o cirugía, hay un aumento en la producción de cortisol de hasta seis veces el nivel normal. El dolor intenso y el ejercicio prolongado también inducen liberación de cortisol, mientras que la situación de analgesia inducida por las endorfinas bloquea la respuesta del cortisol y los efectos supresores de la retroalimentación negativa. Las aferencias estresantes que estimulan la liberación de CRH (y de AVP) son mediadas por varios neurotransmisores. (1,11) Las respuestas dependientes de la CRH y la ACTH pueden verse alteradas por lesiones en la cabeza, depresores del sistema nervioso central, o infarto pituitario. La síntesis de cortisol puede ser afectada por múltiples mecanismos. El agente anestésico etomidato y el antifúngico ketoconazol inhiben la actividad de las enzimas participantes en la síntesis del cortisol. La hemorragia adrenal puede ocurrir en pacientes enfermos, especialmente en aquellos con septicemia y coagulopatía subyacente, y la insuficiencia adrenal puede ocurrir si hay una extensa destrucción de tejido adrenal causada por tumores o infecciones. Los altos niveles de citoquinas en paciente con sepsis pueden también inhibir directamente la síntesis adrenal de cortisol (ver figura 3). (11) La activación del proceso de inmunidad mediada por células también aumenta la liberación de ACTH y cortisol. Algunas linfocinas, entre ellas diversas interleucinas, estimulan la secreción de ACTH. Las situaciones de estrés, como infecciones y traumatismos titulares, se acompañan de respuestas inmunes mediadas por células, donde el cortisol es un importante modulador de estas respuestas. Por ello existe una relación de retroalimentación significativa entre los sistemas endocrino e inmune. (1) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 6 Figura 3. Actividad del eje Hipotálamo-Hipófisis anterior-Corteza suprarrenal en condiciones normales (Panel A), durante una respuesta adecuada al estrés (Panel B), y durante una respuesta inapropiada a enfermedad crítica (panel C) (11) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 7 Acciones fisiológicas y efectos farmacológicos de los Glucocorticoides GENERALIDADES Las acciones de los corticosteroides son muchas y están difundidas. Sus efectos diversos incluyen: alteraciones del metabolismo de carbohidratos, proteínas y lípidos; conservación del equilibrio de líquidos y electrolitos, y preservación de la función normal de los sistemas cardiovascular e inmunitario, riñones, músculo estriado, así como los sistemas endocrino y nervioso. Además, por mecanismos que no se entienden por completo, los corticosteroides permiten al organismo resistir circunstancias que generan estrés, como estímulos nocivos y cambios ambientales. Los corticoides también tienen efecto a nivel de la absorción y excreción de calcio, produciendo una disminución de las reservas de calcio en el organismo. (2,3) Los corticosteroides se agrupan según sus potencias relativas de retener Na+ , acciones sobre el metabolismo de hidratos de carbono (es decir, deposición de glucógeno en hígado y glucogénesis) y efectos antiinflamatorios. En el siguiente cuadro se listan los estimados de las potencias de esteroides representativos en esas acciones. Cuadro 1 Potencias relativas y dosis equivalentes de corticosteroides representativos Potencia antiinflamatoria Potencia para retener Na+ Duración de acción* 1 1 B 20 Cortisona 0.8 0.8 B 25 Fludrocortisona Prednisona 10 4 125 0.8 I I ‡ 5 Prednisolona 4 0.8 I 5 6α-metilprednisolona 5 0.5 I 4 Triamcinolona 5 0 I 4 Betametasona 25 0 P 0.75 Dexametasona 25 0 P Compuesto Cortisol Dosis equivalente † mg 0.75 * B, breve (es decir, vida media biológica de 8 a 12 h); I, intermedia (esto es, vida media biológica de 12 a 36 h); P, prolongada (o sea, vida media biológica de 36 a 72 h). Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 8 † Esas relaciones de dosis sólo se aplican al uso por vía oral o intravenosa, puesto que las potencias de los glucocorticoides pueden diferir mucho después de administración por vía intramuscular o intraarticular. ‡ Este compuesto no se utiliza para obtener efectos glucocorticoides. Fuente: Las bases farmacológicas de la terapéutica, 2003. Los corticosteroides interactúan con proteínas receptoras específicas en tejidos blanco para regular la expresión de genes con capacidad de respuesta a corticosteroides, lo cual modifica las cifras y la disposición de las proteínas sintetizadas por los diversos tejidos blanco. Como consecuencia del tiempo necesario para que haya cambios de la expresión de genes y de la síntesis de proteína, casi ninguna de las acciones de los corticosteroides es inmediata, pero quedan de manifiesto luego de varias horas. Este hecho tiene importancia clínica porque regularmente se observa un retraso antes de que queden de manifiesto los efectos beneficiosos del tratamiento con corticosteroides. Si bien estos últimos actúan de modo predominante para incrementar la expresión de genes precondicionados, hay ejemplos bien documentados en los cuales los glucocorticoides disminuyen la transcripción de dichos genes. En contraste con esos efectos genómicos, algunas acciones de los corticosteroides pueden ser inmediatas y están mediadas por receptores unidos a membrana. (2) Aunque se conocen muchos efectos importantes del cortisol, no están claras las razones exactas de su acción conservadora de vida. La hormona es claramente necesaria para mantener la producción de glucosa a partir de proteínas y la respuesta vascular. Además, la hormona influye sobre el metabolismo de las grasas, el funcionamiento del sistema nervioso central, el recambio esquelético, la hematopoyesis, el funcionamiento muscular, la función renal y las respuestas inmunes. Se ha empleado el término permisiva para describir la acción del cortisol, indicando que la hormona no iniciaría directamente, sino que permitiría, ciertos procesos fundamentales, por ejemplo: • El cortisol no estimula directamente la glucogenólisis. Sin embargo, en presencia de cortisol aumenta la glucogenólisis estimulada por el glucagón. • El cortisol no modifica por sí mismo la actividad de la enzima tirosina transaminasa. Sin embargo, el sustrato de la enzima, la tirosina, sólo induce a la tirosina transaminasa en presencia de cortisol. (1) MECANISMOS INTRACELULARES El receptor de glucorticoide es una proteína citoplasmática de 777 aminoácidos con tres dominios funcionales y varios subdominios. (8, 9,10) En casi todos los efectos del cortisol intervienen mecanismos de transcripción. El cortisol entra en las células diana por difusión facilitada y se liga a un receptor tipo 1 o tipo 2 en el citoplasma y/o en el núcleo. El complejo cortisol-receptor debe sufrir un proceso de activación antes de poder ligarse a una molécula de ADN determinada. La acción hormonal es directamente proporcional al grado de unión al ADN, y la respuesta final es el aumento o la disminución de la transcripción de ácidos ribonucleicos mensajeros (ARNm) específicos. Aunque otros esteroides pueden unirse a un receptor de cortisol y los relectores Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 9 de otros esteroides pueden unirse a una zona similar de la misma molécula de ADN, para inducir la acción del cortisol es necesaria la combinación específica de cortisol, uno de sus receptores y una molécula de ADN con capacidad de respuesta. (1) EFECTOS SOBRE EL METABOLISMO El efecto más importante del cortisol es estimular la conversión de proteínas en glucosa y el almacenamiento de la glucosa en forma de glucógeno; de ahí la denominación glucocorticoide. El receptor tipo 2 o glucocorticoide (RG) interviene en estas acciones. Estimula todas las fases del proceso: movilización de proteínas a partir del músculo, entrada de los aminoácidos liberados en la vía gluconeogénica hepática, conversión de piruvato en glucógeno y eliminación del amonio liberado por el metabolismo de los aminoácido precursores. El cortisol aumenta la actividad de las enzimas implicadas en cada uno de estos pasos. En algunos casos, la hormona “permite” la inducción de la enzima por el sustrato; en otros, el cortisol aumenta directamente la transcripción del gen de la enzima diana. Estos efectos de los glucocorticoides sobre el metabolismo intermediario pueden considerarse como protectores de los tejidos dependientes de glucosa (p ej, cerebro y corazón) contra la inanición (1, 2,9) La presencia de cortisol es indispensable para mantener los niveles plasmáticos de glucosa y para la supervivencia durante el ayuno prolongado. Sin la hormona puede producirse la muerte por hipoglucemia, una vez consumidos los depósitos de glucógeno. Sin embargo, durante el ayuno se produce sólo un leve aumento de la secreción de cortisol; por tanto, niveles habituales de la hormona pueden movilizar eficazmente los aminoácidos y promover la gluconeogénesis. Por otro lado, los niveles plasmáticos de cortisol aumentan con rapidez en respuesta a la hipoglucemia aguda. En este caso, el cortisol amplifica las acciones glucogenolíticas del glucagón y la adrenalina y actúa de forma sinérgica con estas hormonas para recuperar los depósitos hepáticos de glucógeno. (1,2) En consonancia con su función preventiva de la hipoglucemia, el cortisol es un potente antagonista de la insulina. El cortisol inhibe la captación estimulada por la insulina de glucosa en el músculo y el tejido adiposo y bloquea el efecto supresor de la insulina sobre la producción hepática de aquélla. La interacción entre el cortisol y la insulina es compleja. Ambas hormonas favorecen el almacenamiento hepático de glucógeno al aumentar la actividad glucógeno sintetasa. Sin embargo, sus efectos sobre la expresión de los genes de la enzima gluconeogenética, fosfoenolpiruvato carboxinasa, y de la enzima liberadora de glucosa, glucosa 6-fosfatasa, son opuestos. Por tanto, el cortisol favorece la liberación hepática de glucosa, mientras que la insulina la inhibe. El resultado neto del exceso de cortisol es una elevación de la concentración plasmática de glucosa y un aumento compensador de los niveles plasmáticos de insulina. Si el aumento de insulina es insuficiente, puede desarrollarse diabetes mellitus o agravarse si ya existía. (1,2) El cortisol representa también un complejo papel en el metabolismo de las grasas. La presencia de cortisol “permite” la movilización máxima de las grasas por la hormona de crecimiento, la adrenalina y otros factores lipolíticos durante el ayuno. Sin embargo, el cortisol aumenta también mucho el apetito y estimula la lipogénesis en ciertos depósitos del tejido adiposo. Por tanto, en el síndrome de Cushing el exceso de cortisol provoca acúmulo Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 10 de grasa, hay aumento de ésta última en la parte posterior del cuello (“giba de búfalo”), la cara (“facies de luna”), y el área supraventricular, junto con pérdida de grasa en las extremidades. (1,2) Así pues, el cortisol es una hormona catabólica, antianabólica y diabetógena. En situaciones de estrés, el cortisol acentúa la hiperglucemia producida por otras hormonas y acelera fuertemente la pérdida de proteínas corporales. Estas acciones se amplifican si existe una deficiencia simultánea de secreción de insulina. (1) EFECTOS SOBRE LOS TEJIDOS Y ÓRGANOS • Músculo estriado Es necesario cierto nivel basal de cortisol, para mantener la contractilidad normal y el trabajo máximo en el músculo estriado; la disminución de la capacidad para trabajar es un signo notorio de la insuficiencia corticosuprarrenal. En pacientes con enfermedad de Addison, la debilidad y fatiga son síntomas frecuentes, y se cree que manifiestan en su mayor parte falta de adecuación del sistema circulatorio. Las cantidades excesivas de glucocorticodes también alteran la función muscular. En el aldosterismo primario, la debilidad muscular depende de modo primario de hipopotasemia. En contraste, el exceso de glucocorticoides durante periodos prolongados, sea a consecuencia de tratamiento con glucocorticoides o hipercorticismo endógeno, tiende a causar disminución del músculo estriado por medio de mecanismos desconocidos. Este efecto, denominado miopatía por esteroides, explica en parte la debilidad y fatiga que se notan en pacientes cushingoides. (1,2) • Hueso El principal efecto del cortisol es disminuir la formación ósea. En menor medida, el cortisol aumenta la resorción ósea. El resultado neto del exceso de cortisol puede ser una gran reducción de la masa ósea y, en niños con síndrome de Cushing, una reducción también del crecimiento lineal. El cortisol disminuye la síntesis de 1,25(OH)2 vitamina D y bloquea su acción; por tanto, se producirá un déficit de absorción de calcio por el tracto gastrointestinal. Al mismo tiempo, aumenta la excreción urinaria de calcio. Por tanto, existe menos calcio disponible para la mineralización ósea. El cortisol inhibe también la diferenciación de los precursores mesenquimales a osteoblastos y la síntesis de colágeno por estas células. (1) • Sistema cardiovascular Las acciones más notorias de los glucocorticoides sobre le sistema cardiovascular dependen de los cambios (inducidos por mineralocorticoides) de la excreción renal de Na+ como queda de manifiesto en el aldosterismo primario. La hipertensión resultante puede originar un grupo diverso de efectos adversos sobre el sistema cardiovascular, entre ellos aterosclerosis aumentada, hemorragia cerebral, apoplejía y miocardiopatía hipertensiva. Todavía no se entiende por completo el mecanismo que fundamenta la Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 11 hipertensión, pero la restricción de Na+ en la dieta puede disminuir de modo considerable la presión arterial. (2) El cortisol es necesario para mantener la presión arterial normal. La hormona permite una mayor respuesta de las arteriolas a la acción constructora de la estimulación adrenérgica y optimiza además el rendimiento miocárdico. El cortisol ayuda a mantener el volumen sanguíneo al disminuir la permeabilidad del endotelio vascular. (1) El hiposuprarrenalismo por lo general se relaciona con hipotensión y disminución de la respuesta a vasoconstrictores, como noradrenalina y angiotensina II. Por el contario, en sujetos con excreción excesiva de glucocorticoides se observa hipertensión; esto sobreviene en la mayoría de los enfermos con síndrome de Cushing, así como en un subgrupo de pacientes tratados con glucocorticodes sintéticos (incluso con los que carecen de cualquier efecto mineralocorticoide importante). (2) • Riñón El cortisol aumenta la tasa de filtrado glomerular. La hormona es fundamental también para la excreción rápida de una sobrecarga acuosa, al inhibir la secreción de hormona antidiurética (ADH) y la acción de ésta sobre los conductos colectores. Con ello disminuye el aclaramiento de agua libre. Debido en gran parte a estas acciones permisivas sobre la función tubular los glucocorticoides también generan efectos sobre el equilibrio de líquidos y electrolitos. Clínicamente, la ausencia de cortisol puede inducir retención hídrica, con la consiguiente hiponatremia. (1,2) • Sistema nervioso central Los corticosteroides generan diversas acciones indirectas sobre el sistema nervioso central mediante conservación de la presión arterial, de las cifras plasmáticas de glucosa y de las concentraciones de electrolitos. (2) El receptor tipo 1 de cortisol está presente en todo el encéfalo y a mayor concentración en el hipocampo, la sustancia reticular activadora y núcleos autonómicos del tronco encefálico. El cortisol modula el funcionamiento perceptual y emocional. La deficiencia de cortisol acentúa la agudeza aditiva, olfatoria y gustativa; estas acciones sugieren que la hormona puede presentar normalmente un efecto amortiguante. El aumento diurno de los pulsos de CRH y de los niveles de cortisol justo antes del despertar es importante para la vigilia normal y para la iniciación de las actividades diarias. Clínicamente un exceso de cortisol puede producir insomnio y bien euforia o depresión. A veces puede llegar a provocar psicosis franca. (1) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 12 • Feto El cortisol posee efectos permisivos importantes sobre la maduración intrauterina del tracto gastrointestinal, pulmones, sistema nervioso central, retina y piel. El cortisol facilita en el momento oportuno la preparación del pulmón fetal para una respiración satisfactoria inmediatamente después del nacimiento. Aumenta la tasa de desarrollo de los alvéolos pulmonares, el aplanamiento de las células que los revisten y el adelgazamiento de los tabiques pulmonares. Aumenta, sobre todo, la síntesis de surfactante, un fosfolípido imprescindible para mantener la tensión superficial alveolar. El cortisol facilita también la maduración de la capacidad enzimática de la mucosa intestinal desde el patrón fetal al patrón adulto. Esto permite que el recién nacido digiera los disacáridos presentes en la leche. (1) Disminución de formación ósea Aumento de resorción ósea Disminución de la masa muscular Modulación del tono muscular y la alerta Disminución del tejido conjuntivo CORTISOL Aumento de la filtración glomerular y del aclaramiento de agua libre Inhibición de la respuesta inmune Aumento del tono arterial; disminución de la permeabilidad endotelial Figura 4. Efectos del cortisol sobre tejidos y órganos. (1) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 13 RESPUESTAS INFLAMATORIAS E INMUNES Las propiedades antiinflamatorias e inmunosupresoras de los glucocorticoides los convierten en agentes terapéuticos invaluables en numerosas enfermedades, aunque éstos no ataquen la causa fundamental de la enfermedad. El cortisol influye mucho sobre la compleja serie de reacciones inducidas por traumatismos titulares, irritantes químicos, proteínas extrañas e infecciones. El efecto más importante es la inhibición de pasos cruciales de la respuesta tisular ante una lesión. (1,2) Los glucocorticoides tienen influencia sobre el tráfico de leucocitos circulantes y las células inmunes accesorias. Los glucocorticoides suprimen la activación inmunológica de estas células, inhiben la producción de citoquinas y otros mediadores de la inflamación, y producen resistencia a las citoquinas. Los glucocorticoides afectan preferiblemente ciertos grupos de linfocitos T; suprimen la función de linfocitos Th del tipo 1 y estimulan la apoptosis de eosinófilos y ciertos grupos de células T. Éstos también inhiben la expresión de moléculas de adhesión y de sus correspondientes receptores y potencian la reacción de fase aguda. Todos estos efectos dependen de alteraciones a nivel de transcripción en los genes susceptibles a glucorticoides o cambios en la estabilidad del RNA mensajero de numerosas proteínas inflamatorias. Por ejemplo, los glucocorticoides suprimen la producción de interleucina-6 y de interleucina-1β mediante la disminución de la velocidad de transcripción de los genes de estas interleucinas y la estabilidad del RNA mensajero. La supresión de los genes de la fosfolipasa A2, la ciclooxigenasa 2, y la oxido nítrico sintasa 2, por los glucorticoides, disminuyen la producción de prostanoides, factor activador de plaquetas, y óxido nítrico- tres moléculas claves en la respuesta inflamatoria. (2,8, 9, 10,12) (ver Cuadro 2) Las consecuencias clínicas de la administración de cortisol son dificultar la capacidad inmediata de los tejidos para eliminar sustancias e invasores nocivos o de aislarlos del resto del organismo. Por tanto, el tratamiento a largo plazo con dosis farmacológicas de cualquier glucocorticoide aumenta la susceptibilidad a infecciones oportunistas, permite su diseminación y las enmascara. También puede alterase la cicatrización de las heridas. (1) Los glucocorticoides diminuyen o previenen la respuesta de los tejidos a los procesos inflamatorios, por lo que reducen el desarrollo de los síntomas de inflamación sin afectar la causa subyacente. Estos fármacos inhiben la acumulación de células inflamatorias, incluyendo macrófagos y leucocitos. También inhiben la fagocitocis, la liberación de enzima lisomal, y la síntesis y/o liberación de los mediadores químicos de la inflamación. (4) Los glucocorticoides son inmensamente útiles para tratar enfermedades que se originan de reacciones inmunitarias indeseables. Estas enfermedades varían desde padecimientos que sobrevienen de modo predominante por inmunidad humoral, como urticaria, hasta los mediados por mecanismos inmunitarios celulares, como rechazo de trasplante. (2) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 14 Cuadro 2 Efectos de los glucocorticodes sobre componentes de las reacciones inflamatoria/inmunitaria. (2) TIPO DE CÉLULA Macrófagos y monocitos Células endoteliales Basófilos Fibroblastos Linfocitos FACTOR COMENTARIOS Ácido arquidónico y sus Inhibidos en parte por inducción metabolitos (prostaglandinas y glucocorticoide de una proteína (lipocortina) que inhibe a la leucotrienos) fosfolipasa A2. Citocinas, entre ellas: La producción y liberación quedan bloqueadas. Las citocinas ejercen interleucina (IL)-1, IL-6 y múltiples efectos sobre la TNF-α inflamación (p ej, activación de células T, estimulación de la proliferación de fibroblastos) Incluyen el tercer componente del Reactivos de fase aguda complemento. Molécula de adherencia de ELAM-1 e ICAM-1 son moléculas leucocitos endoteliales-1 de adherencia intracelular críticas (ELAM-1) y molécula de para la localización de leucocitos. adherencia intracelular-1 (ICAM-1) Igual que la anterior, para Reactivos de fase aguda macrófagos y monocitos. Igual que la anterior, para Citocinas (p.ej, IL-1) macrófagos y monocitos. Derivados del ácido Igual que la anterior, para macrófagos y monocitos. araquidónico Histamina Los glucocorticoides bloquean la Leucotrieno C4 liberación dependiente de IgE. Metabolitos del ácido Igual que la anterior, para araquidónico macrófagos y monocitos. Los glucocorticoides también suprimen la síntesis de DNA y la proliferación de fibroblastos inducidas por factor del crecimiento. Citocinas (IL-1, IL-2, IL-3, IL- Igual que la anterior, para 6, TNF-α, GM-CSF, interféron macrófagos y monocitos. gamma) IL, interleucina; TNF-α, factor de necrosis tumoral alfa; GM-CSF, factor estimulante de colonias de granulocitos/macrófagos. Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 15 Los mecanismos a través de los cuales el cortisol suprime las respuestas se ponen de manifiesto en los siguientes ejemplos: 1. El cortisol induce una fosfoproteína denominada lipocortina que inhibe la enzima fosfolipasa A2. Esta enzima genera ácido araquidónico. Dado que este último sirve como precursor para la síntesis de prostaglandinas y compuestos relacionados, disminuye la producción de estos mediadores de la inflamación. 2. El cortisol disminuye la producción de interleucina-1 al reprimir la expresión del gen de esta linfocina. De este modo, el cortisol puede bloquear toda la cascada de la inmunidad mediada por células, así como la generación de fiebre. 3. El cortisol estabiliza los lisosomas y, por tanto, reduce la liberación de enzimas capaces se degradar cuerpos extraños. 4. El cortisol bloquea el reclutamiento de neutrófilos al inhibir su capacidad para ligar péptidos qumiotácticos. La hormona altera además la capacidad fagocítica y antibacteriana de los neutrófilos. 5. El cortisol disminuye la proliferación de los fibroblastos y su capacidad para sintetizar y depositar fibrillas titulares, evitando así la encapsulación de los invasores. (5) En este punto es evidente una paradoja. Por una parte, es fundamental el aumento de secreción de cortisol para la supervivencia de individuos gravemente lesionados, traumatizados o infectados, debido a sus acciones metabólicas. Por otra parte, muchos de los mecanismos de defensa tisular inducidos en esas situaciones son inhibidos por los niveles elevados de cortisol. (1) Esto sugiere que pueden ser necesarios niveles permisivos más bajos para que se inicie la respuesta ante el estrés. Posteriormente deben segregarse niveles mayores de cortisol para limitar las reacciones celulares y tisulares con el fin de que ellas mismas no dañen gravemente al individuo. (1) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 16 Toxicidad El uso terapéutico de corticosteroides origina dos clases de efectos tóxicos: los que sobrevienen por supresión del tratamiento esteroideo, y los que aparecen por uso continuo de dosis suprafisiológicas. Los efectos adversos de esas dos categorías ponen en peligro la vida y necesitan valoración cuidadosa de los riesgos y beneficios en cada paciente. (2) SUPRESIÓN DEL TRATAMIENTO La complicación más grave del cese de esteroides, es la insuficiencia suprarrenal aguda, la cual depende de una supresión demasiado rápida de corticosteroides, luego de un tratamiento prolongado, ante el cual ha quedado suprimido el eje hipotalámico-hipofisiariosuprarrenal. También puede presentarse por una disminución en la dosis o un aumento en los requerimientos de corticosteroides asociado con estrés por infección, trauma accidental o quirúrgico. Hay gran variación entre los enfermos con respecto al grado de supresión suprarrenal, y la duración de la misma, después de un tratamiento con corticosteroides, lo que dificulta conocer el riesgo relativo en cualquier paciente dado. Sin embargo, este efecto debe ser anticipado en cualquier paciente que reciba más de 30 mg de hidrocortisona al día (ó 7.5 mg de prednisolona ó 0.75 mg de dexametasona al día o su equivalente) por más de tres semanas. Muchos enfermos se recuperan de la supresión del HPA inducida por corticosteroides en el transcurso de varias semanas a meses. Sin embargo, en algunos individuos, el tiempo necesario para la recuperación puede ser de un año o más. (2, 3,11) Además de esta forma más grave de supresión, un síndrome característico de supresión de glucocorticoides consta de fiebre, mialgias, artralgias, pérdida de peso y malestar general, que puede ser difícil de distinguir de las enfermedades fundamentales por las cuales se instituyó el tratamiento con esteroides. (2,3) Por último, el pseudotumor cerebral, un síndrome clínico que incluye incremento de la presión intracraneal con papiledema, es un padecimiento infrecuente que a veces se relaciona con disminución del tratamiento con corticosteroides o con supresión del mismo. (2) En tratamientos prolongados o después de la administración de dosis altas de corticosteroides, la dosis se disminuirá paulatinamente antes de interrumpir por completo su administración. (3,5) El “UK Committe on Safety of Medicines” recomienda que las dosis moderadas de corticosteroides (hasta 40 mg diarios de prednisona o su equivalente), por hasta tres semanas pueden eliminarse sin disminución paulatina de la dosis, aunque pueden requerirse dosis protectoras en caso de cualquier estrés que se presente hasta una semana después de eliminado el tratamiento. La interrupción gradual debe considerarse, aún después de periodos cortos de tiempo, si se administran dosis más altas, o en pacientes con otros riesgos para insuficiencia adrenocortical, incluyendo aquellos que hayan recibido cursos repetidos de corticosteroides sistémicos, aquellos que han recibido corticosteroides a menos de un año después de haber terminado una terapia prolongada con corticosteroides, o aquellos que toman la dosis regularmente en la noche, cuando el efecto supresor es mayor. La interrupción del tratamiento no debe ser abrupta en ningún paciente que reciba corticosteroides por más de tres semanas. (3) La interrupción del tratamiento va a depender de la repuesta del paciente, la dosis, la enfermedad tratada, y la duración de la terapia. (3,5) La dosis del corticosteroide sistémico Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 17 puede reducirse rápidamente a valores fisiológicos (tradicionalmente considerados 7.5 mg de prednisona diarios o su equivalente). Luego deben disminuirse más lentamente para permitir que el eje HPA se recupere. Las recomendaciones para la reducción inicial, en términos de prednisolona, varían desde disminuciones tan pequeñas como 1 mg al mes hasta 2.5 a 5 mg cada 2 a 7 días. Los síntomas que se atribuyan a una interrupción acelerada deben tratarse volviendo a una dosis alta de corticosteroides y continuar la reducción a una menor velocidad. (3) En reportes sobre la inhibición de la función del eje HPA asociado con la administración de corticosteroides se describen varios regímenes para la interrupción del tratamiento. Por ejemplo, pacientes que han sido tratados por semanas o meses se les puede reducir la dosis de prednisolona 2.5 a 5 mg cada 2 a 3 días, o, para aquellos con tratamientos más prolongados, la reducción puede ser más gradual en un rango de 2.5 mg cada 1 a 3 semanas. Otra propuesta puede ser convertir gradualmente la terapia diaria en una terapia de días alternos reduciendo progresivamente la cantidad de corticosteroide recibido en cada segundo día, y ya que la terapia alternada esté establecida la dosis puede reducirse hasta alcanzar, por ejemplo, una dosis de 1 mg en días alternos por una semana. (3) USO CONTINUO DE DOSIS SUPRAFISIOLÓGICAS DE CORTICOSTEROIDES Además de las consecuencias que aparecen por la supresión del eje HPA, hay varias otras complicaciones que sobreviene por tratamiento prolongado con corticosteroides: incluyen anormalidades de líquidos y electrolitos, hipertensión, hiperglucemia, incremento de la sensibilidad a infecciones, osteoporosis, miopatía, alteraciones conductuales, cataratas, interrupción del crecimiento, así como el hábito característico originado por dosis excesivas que incluye redistribución de grasas, estrías, equimosis, acné e hirsutismo. (2) Equilibrio de líquidos y electrolitos Las alteraciones del equilibrio de líquidos y electrolitos son comunes con los corticosteroides naturales, como cortisona e hidrocortisona, pero son menos frecuentes con los glucocorticoides sintéticos, que tienen poca o ninguna actividad mineralocorticoide. (3) Entre los efectos adversos de los glucocorticoides esta la movilización de calcio y fósforo, pérdida muscular y agotamiento de nitrógeno; hiperglicemia con un aumento o precipitación del estado diabético. Los requerimientos de insulina en pacientes diabéticos se incrementan. La hiperglucemia con glucosuria por lo general pueden tratarse con dieta, insulina, o ambas, y su aparición no debe constituir un factor importante en la decisión de continuar la terapéutica con corticosteroides, o de iniciarla en diabéticos. A menudo se reportan incrementos en el apetito. (2,3) Reacciones inmunitarias El deterioro en la reparación de tejidos y la función inmune puede conducir a un retraso en la cicatrización de la herida, y un incremento en la susceptibilidad a infecciones. El incremento en la susceptibilidad a cualquier tipo de infección, incluye septicemia, tuberculosis, micosis, e infecciones virales, las cuales han sido reportadas en pacientes con Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 18 tratamiento de corticosteroides. Las infecciones además podrían estar enmascaradas por los efectos antiinflamatorios, analgésicos y antipiréticos de los glucocorticoides. Recientemente se ha prestado especial atención al incremento en la severidad de varicela, con un posible desenlace fatal, en pacientes no inmunizados que reciben terapia con corticosteroides sistémicos. (3) En presencia de infecciones conocidas que generan consecuencias de cierta magnitud, los glucocorticoides sólo han de proporcionarse si es absolutamente necesario, en adición a tratamiento antimicrobiano o antimicótico apropiado y eficaz. (2) Posible riesgo de úlceras pépticas Hay considerable debate acerca del vínculo entre úlceras pépticas y tratamiento con glucocorticoides. El posible comienzo insidioso, con hemorragia y perforación, los tornan problemas terapéuticos. La estimación del riesgo generado por los corticosteroides ha sido objeto de muchos estudios. Un informe indica que la mayoría de los pacientes que presentó hemorragia gastrointestinal en tanto recibía corticosteroides, también recibió AINEs, que se sabe favorecen la ulceración. De este modo la participación patógena de los corticosteroides aún está abierta a debate. Aún así, es prudente ejercer vigilancia especial en cuanto a la formación de úlcera péptica en quienes reciben tratamiento con corticosteroides, en especial cuando se administran junto con AINEs. (2,3) Miopatía La miopatía, caracterizada por debilidad de los músculos de la parte proximal de las extremidades, se observa en ocasiones en sujetos que toman corticosteroides a dosis grandes y forman parte del cuadro clínico en individuos con síndrome de Cushing. Puede ser de gravedad suficiente como para alterar la ambulación y es una indicación para suspender el tratamiento. Se ha enfocado la atención en la miopatía de los músculos respiratorios por administración de esteroides en pacientes con asma o con enfermedad pulmonar obstructiva crónica. Ésta complicación puede disminuir la función respiratoria. En quienes presentan miopatías por esteroides, la recuperación puede ser lenta e incompleta. (2) Cambios conductuales Las alteraciones conductuales se observan a menudo después de administrar glucocorticoides y en sujetos que tienen síndrome de Cushing a consecuencia de hipercorticismo endógeno. Esas alteraciones pueden adoptar muchas formas, entre ellas nerviosismo, insomnio, cambios del estado de ánimo y psicosis manifiesta. Se observan con cierta frecuencia tendencias suicidas. Un antecedente de enfermedad psiquiátrica no impide el uso de esteroides en pacientes en quienes están por lo demás indicados. Por el contrario, la ausencia de un antecedente de enfermedad psiquiátrica no asegura que un enfermo dado no presentará trastornos psiquiátricos en tanto recibe esteroides. (2) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 19 Cataratas Constituyen una complicación bien establecida de la terapéutica con glucocorticoides; se relacionan tanto con la dosificación como con la duración del tratamiento. Los niños parecen tener riesgo particular. El cese de la terapéutica puede no generar resolución completa de las opacidades y las cataratas suelen evolucionar a pesar de que el tratamiento disminuya o sea interrumpido. (2) Osteoporosis La osteoporosis, complicación de la corticoterapia, que a menudo es grave, se observa en personas de todas las edades y depende de la dosis y la duración de dicho tratamiento. Un cálculo razonable es que 30 a 50% de todas las personas que reciben glucocorticoides terminan por mostrar fracturas osteoporóticas. (2,20) Los glucocorticoides producen un aumento en el riego de fracturas espontáneas de 1:4 (3,15). Los compuestos en cuestión afectan de manera preferente el hueso trabecular y la franja cortical de los cuerpos vertebrales. Los sitios en que ocurren con mayor frecuencia las fracturas son las costillas y las vértebras. (2,20) Los glucocorticoides disminuyen la densidad de huesos por múltiples mecanismos como inhibición de la acción de esteroides gonadales, menor absorción de calcio en vías gastrointestinales e inhibición de la formación de hueso, por los efectos supresores que ejercen sobre los osteoblastos. Además, la inhibición de la captación de calcio por intestinos, propiciada por los glucocorticoides, hace que aumenten en forma secundaria los niveles de hormona paratiroidea y, con ello, se intensifique la resorción de hueso. (2) La pérdida de hueso vinculada con los glucocorticoides surge predominantemente en los primeros seis meses de tratamiento, razón por la cual habrá que emprender la valoración densitométrica y las medidas profilácticas en el momento en que se inicia el tratamiento o muy poco después. Muchas autoridades recomiendan que el ingreso de calcio sea como mínimo 1 500 mg de dicho mineral/día por alimentos, además de complementos del mineral y vitamina D, a razón de 400 UI/día, realizar ejercicio regularmente y evitar el consumo del cigarrillo y alcohol en exceso. (2,21) El progreso más importante para evitar la osteoporosis por glucocorticoides es el empleo provechoso de los bifosfonatos. Se han demostrado que algunos agentes disminuyen el deterioro de la densidad ósea entre quienes reciben glucocorticoides. En particular, se ha demostrado la eficacia del alendronato y el etidronato cíclico, en la prevención primaria y la recuperación de la densidad ósea en personas que reciben por largo tiempo glucocorticoides. (2) Osteonecrosis La osteonecrosis (conocida también como necrosis avascular o aséptica), es una complicación relativamente común de la corticoterapia. La incidencia varía según en pacientes con diferentes estados (alcohólicos y pacientes con enfermedades del tejido conectivo, especialmente LES, tienen una mayor susceptibilidad). (18,19) La cabeza del fémur es la estructura afectada con mayor frecuencia, pero el proceso también altera la cabeza del humero y la porción distal del fémur. Algunos de los síntomas iniciales son Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 20 dolor y rigidez articulares, y hay que pensar en la aparición de tal cuadro en individuos que reciben glucocorticoides y que en forma repentina muestran dolor de cadera, hombro o rodilla. El riesgo aumenta con el tiempo que dure la corticoterapia y las dosis de los compuestos usados, pero la osteonecrosis también se observa a veces cuando se administran por lapsos breves dosis altas de glucocorticoides. La osteonecrosis por lo común evoluciona, y casi todos los pacientes afectados necesitan al final alguna forma de reemplazo articular. (2) Regulación del crecimiento y desarrollo Puede sobrevenir por administración de dosis relativamente pequeñas de glucocorticoides en niños. Aun se desconoce el mecanismo preciso de este hecho. Se necesitan más estudios para explorar los posibles efectos de la exposición a corticosteroides “in útero”. Estudios en animales de experimentación han demostrado que la exposición prenatal a glucocorticoiddes muestra relación con paladar hendido y desarrollo neuronal alterado; lo que conduce en última instancia a anormalidades conductuales complejas. De este modo, si bien las acciones de los glucocorticoides para favorecer la diferenciación celular poseen actividades fisiológicas importantes en el desarrollo de seres humanos durante el período neonatal, persiste la posibilidad de que la exposición prenatal a esteroides pueda causar anormalidades leves del desarrollo fetal. (2) Efectos tras administración tópica Han ocurrido reacciones de hipersensibilidad con corticosteroides, principalmente cuando se administran tópicamente. (3) La mayoría de los corticosteroides aplicados tópicamente (incluyendo los inhalados) pueden, bajo ciertas circunstancias, absorberse en cantidades suficientes para producir efectos sistémicos. La aplicación tópica de preparaciones de corticosteroides en los ojos ha producido úlceras corneales, aumento de la presión intraocular y disminución de la función visual. Tras la aplicación de corticosteroides sobre la piel se ha reportado pérdida del colágeno cutáneo y atrofia subcutánea; también hipopigmentación local en pieles muy pigmentadas después de la inyección intradérmica y la aplicación tópica de corticosteroides potentes. Sequedad, irritación, epistaxis, y raramente ulceración o perforación del septum nasal han ocurrido tras el uso intranasal de estas drogas. También pueden ocurrir alteraciones en el olfato y el gusto. Ronquera y candidiasis de la boca o la garganta pueden ocurrir en pacientes que reciben corticosteroides inhalados. (3) Otros efectos adversos incluyen irregularidades menstruales, amenorrea, hiperhidrosis, adelgazamiento de la piel, hipertensión intracraneal benigna y pancreatitis aguda. Un incremento en la coagulación sanguínea puede conducir a complicaciones tromboembólicas. (3) Dosis altas de corticosteroides, o de corticotropina, pueden producir síntomas Cushoides típicos de la hiperactividad de la corteza adrenal, con “cara en forma de luna”, algunas veces con hirsutismo, joroba de búfalo, enrojecimiento, equimosis, estrías y acné (ver más Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 21 adelante Síndrome de Cushing). La administración intravenosa rápida de dosis altas de corticosteroides puede causar colapso cardiovascular. (3) La administración intratecal de estos fármacos se ha asociado con aracnoiditis. (3) Los efectos adversos de los corticosteroides dependen de la posología y duración del tratamiento y, con excepción de las cataratas y la osteopenia, se minimizan administrando esta medicación a días alternos una vez que se ha controlado la enfermedad (se administra el doble de la dosis diaria, pero en días alternos). (6) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 22 Aplicaciones Terapéuticas ABSORCIÓN, TRANSPORTE, METABOLISMO Y ELIMINACIÓN La hidrocortisona y muchos congéneres, incluso los análogos sintéticos, son eficaces cuando se administran por vía oral. La mayoría de los corticosteroides usados sistémicamente son los compuestos hidroxi (alcoholes). Son relativamente insolubles en agua y la sal sódica del éster fosfato o succinato se usa generalmente para proveer formas hidrosolubles para inyecciones o soluciones. Estos ésteres se hidrolizan fácilmente en el organismo. (3) Algunos ésteres hidrosolubles de la hidrocortisona y sus congéneres sintéticos se administran por vía intravenosa para alcanzar con rapidez cifras altas del medicamento en los líquidos corporales. Se obtienen efectos más prolongados mediante inyección por vía intramuscular de suspensiones de hidrocortisona, así como de sus congéneres y sus ésteres. Cambios menores de la estructura química pueden alterar mucho la velocidad de absorción, el tiempo de inicio de la acción y la duración del efecto. (2,3) Los glucocorticoides también se absorben a la circulación sistémica desde sitios de administración local, como espacios sinoviales, saco conjuntival, piel y vías respiratorias. Cuando la administración es prolongada, o bien el sitio de aplicación se cubre con un vendaje oclusivo, o cuando hay áreas grandes de la piel afectadas, la absorción puede bastar para originar efectos sistémicos, incluso supresión del eje hiptalámico-hipofisiariosuprarrenal. (2) Luego de la absorción, bajo circunstancias normales, 90% o más del cortisol en plasma se une de manera reversible a proteína. Únicamente la fracción de corticosteroide no unida puede entrar en las células para mediar efectos del corticosteroide. Dos proteínas plasmáticas explican la mayor parte de la capacidad de unión a esteroide: la proteína de unión a corticosteroide (CGB, también denominada transcortina) y la albúmina. La CGB es una globulina alfa secretada por el hígado, que tiene afinidad alta por los esteroides, pero capacidad total relativamente baja de unión, en tanto que la albúmina, también producida en el hígado, posee afinidad reducida pero capacidad de unión relativamente grande. A concentraciones normales o bajas de corticosteroides, la mayor parte de la hormona está unida a proteína. A cifras más altas de esteroides, se excede la capacidad de unión a proteína, y una fracción mucho mayor del esteroide existe en estado libre. Los corticosteroides compiten entre sí por sitios de unión en la CGB. Esta última tiene afinidad relativamente alta por el cortisol y casi todos sus congéneres sintéticos, y afinidad baja por la aldosterona y los metabolitos esteroides conjugados con glucorónido; de ese modo se encuentran porcentajes más grandes de estos últimos esteroides en la forma libre. (2) Todos los esteroides suprarrenocorticales y sus congéneres sintéticos con actividad biológica sufren inactivación principalmente en el hígado. Los ésteres y glucorónidos sulfato resultantes forman derivados hidrosolubles, y son las formas predominantes que se excretan en la orina. En seres humanos, ni la excreción biliar ni la fecal poseen importancia cuantitativa. (2) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 23 USOS TERAPÉUTICOS Con la excepción del tratamiento de reposición en el estado de deficiencia, el uso de glucocorticoides es en gran parte empírico. Con base en experiencia clínica extensa, pueden proponerse diversos principios terapéuticos. En primer lugar, dado el número de efectos adversos potenciales y la gravedad de los mismos, la decisión de instituir tratamiento con glucocorticoides siempre exige consideración cuidadosa de los riesgos y beneficios relativos en cada paciente. Para cualquier enfermedad, y en cualquier individuo, la dosis apropiada para alcanzar un efecto terapéutico dado debe determinarse mediante ensayo y error, y revalorarse periódicamente a medida que se modifica la actividad de la enfermedad fundamental, o conforme aparecen complicaciones de la terapéutica. Una única dosis de glucocorticoides, incluso grande, carece virtualmente de efectos peligrosos, y un tratamiento breve (de hasta una semana), en ausencia de contraindicaciones específicas, tiene pocas probabilidades de resultar peligroso. A medida que el tratamiento con glucocorticoides se aumenta más allá de una semana, hay incrementos (relacionados con el tiempo y con la dosis) de la incidencia de efectos minusvalidantes y en potencia letales. Salvo en quienes reciben tratamiento de reemplazo o de sustitución, los glucocorticoides no son específicos ni curativos, y en su lugar proporcionan paliación en virtud de sus efectos antiinflamatorios e inmunosupresores. Por último, el cese repentino de los glucocorticoides después de tratamiento prolongado se relaciona con riesgo importante de insuficiencia suprarrenal, que puede resultar letal. (2) Tratamiento de reemplazo La insuficiencia suprarrenal puede sobrevenir por lesiones estructurales o funcionales de la corteza suprarrenal (insuficiencia suprarrenal primaria), o por lesiones estructurales o funcionales de la parte anterior de la hipófisis, o del hipotálamo (insuficiencia suprarrenal secundaria). En países desarrollados, la insuficiencia suprarrenal primaria muy a menudo es consecuencia de alguna enfermedad suprarrenal autoinmunitaria, en tanto que en los países en desarrollo la adrenalitis tuberculosa es la causa es más frecuente. Otras causas incluyen extirpación de las suprarrenales, síndrome de inmunodeficiencia adquirida y adrenoleucodistrofia ligada al X. La insuficiencia suprarrenal secundaria que es consecuencia de disfunción hipofisiaria o hipotalámica suele surgir en forma más insidiosa que la de tipo primario. (2) · Insuficiencia suprarrenal aguda El tratamiento debe instaurarse inmediatamente en cuanto se haya hecho un diagnóstico provisional de insuficiencia corticosuprarrenal. Se inyectan 100 mg de hidrocortisona en forma de éster hidrosoluble (generalmente el succinato o el fosfato) por vía i.v. en 30 seg, seguidos de una infusión de 1 litro de solución de dextrosa al 5% en cloruro sódico al 0,9% con 100 mg de éster de hidrocortisona a lo largo de 2 h. Se sigue administrando solución de cloruro sódico al 0,9% hasta que estén corregidas la deshidratación y la hiponatremia. Durante la rehidratación puede descender el K sérico, lo que exige una reposición cuidadosa. El tratamiento con hidrocortisona se administra de forma continuada hasta una dosis total de >300 mg en 24 h. No son necesarios los mineralcorticoides cuando se Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 24 administra hidrocortisona a dosis altas. Al estabilizarse el estado clínico del paciente, cabe recurrir a la inyección intramuscular de hidrocortisona en dosis de 25 mg cada 6 a 8 horas. Después de este lapso, los pacientes son tratados en la misma forma que se haría en quienes tienen insuficiencia suprarrenal crónica (ver más adelante) (2,5) Para tratar insuficiencia suprarrenal aguda sospechada, pero no confirmada, en vez de hidrocortisona cabe utilizar 4 mg de fosfato sódico de dexametasona, porque esta última no muestra reacción cruzada en los métodos para valorar cortisol o en el uso de la prueba de estimulación con cosintropina para valorar el eje HPA. (2) · Insuficiencia suprarrenal crónica El cuadro inicial en quienes muestran la insuficiencia crónica incluye muchas de las manifestaciones que aparecen en la crisis suprarrenal, aunque menos intensas. Los pacientes en estos casos necesitan recibir diariamente corticosteroides. Los regímenes tradicionales de reposición han utilizado dosis de hidrocortisona de 20 a 30 mg/día. Suelen administrarse 20 mg de hidrocortisona v.o. por la mañana y 10 mg por la tarde. Puede ser necesaria una dosificación diaria de 40 mg. Deben evitarse las dosis nocturnas porque pueden producir insomnio. En condiciones normales, la hidrocortisona se secreta en cantidades máximas en las primeras horas de la mañana y mínimamente por la noche. Con base en las estimaciones revisadas de la producción diaria de cortisol y estudios clínicos que indican que los grados sutiles de exceso de glucocorticoides disminuyen la densidad ósea en individuos que reciben regímenes corrientes de reposición, muchas autoridades en la materia recomiendan usar una dosis diaria de 20 mg de hidrocortisona, en dos fracciones (p ej, 15 mg al despertarse por la mañana y 5 mg al anochecer) o tres dosis (10 mg al despertarse por la mañana, 5 mg al mediodía y 5 mg a finales de la tarde). Otros prefieren utilizar glucocorticoides de larga duración como la prednisona o la dexametasona, por que ningún régimen que utilice corticosteroides de acción breve “reproduce” los niveles máximos de cortisol sérico que surgen normalmente antes de que el sujeto se despierte por la mañana. No se ha demostrado en forma rigurosa la superioridad de cualquiera de los regímenes mencionados. (2) A pesar de que algunos individuos con insuficiencia suprarrenal primaria pueden ser conservados con un régimen de hidrocortisona e ingestión libre de sodio, casi todos los pacientes necesitan también mineralocorticoides como forma de reposición y se usa para este fin el acetato de fludrocortisona, 0,1 a 0,2 mg v.o. una vez al día. Este mineralcorticoide sustituye a la aldosterona, que normalmente secretan las personas sanas. A menudo es necesario reducir la dosis inicial de fludrocortisona a 0,05 mg cada dos días a causa del edema maleolar, pero el paciente suele adaptarse y después puede tomar las dosis mayores. La fludrocortisona produce hipertensión en algunos pacientes. Esto debe tratarse reduciendo la dosis e iniciando un tratamiento de la hipertensión sin fármacos diuréticos. (2,5) A menudo las dosis corrientes de glucocorticoides se ajustan en sentido ascendente en individuos que reciben fármacos que incrementan su eliminación metabólica (como fenilhidantoína, barbitúricos, rifampicina). También se necesitan ajustes de dosis para compensar el “agobio” que interponen enfermedades intercurrentes y es esencial la orientación precisa del enfermo para llevar a la práctica dichos ajustes. Todos los sujetos en insuficiencia suprarrenal deben utilizar un brazalete de alerta u otro medio de identificación Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 25 en que se señale el diagnóstico y datos de su régimen de corticosteroides. Ante circunstancias que generan estrés leve, como una infección viral aguda acompañada de fiebre, accidentes, y estrés mental es necesario duplicar la dosis diaria. En presencia de infecciones importantes, se debe triplicar la dosis. Cuando las náuseas y los vómitos hacen que el individuo sea incapaz de retener medicamnetos por vía oral durante más de 12h, es necesario enseñar al enfermo a suministrarse glucocorticoides por vía parenteral. Es muy recomendable que él y sus parientes reciban la orientación para la administración parenteral de dexametasona (4 mg por vía subcutánea o intramuscular) y debe establecerse contacto de inmediato con el médico. Con base en datos empíricos, en su mayor parte, se ajustan las dosis de glucocorticoides cuando las personas con insuficiencia suprarrenal son sometidas a operaciones planeadas o de suma urgencia. En estos casos se busca que las dosis mayores se acerquen o rebasen la secreción máxima de cortisol que es de 200 mg/día; un régimen corriente sería usar 100 mg de hidrocortisona por vía parenteral cada 6 a 8 horas. Después de la intervención quirúrgica la dosis se disminuye a la mitad cada día, hasta llegar a los niveles corrientes de mantenimiento. (2, 5,11) · Hiperplasia suprarrenal congénita El término anterior denota a un grupo de trastornos genéticos en que hay deficiencia en la actividad de algunas de las enzimas necesarias para la biosíntesis de corticosteroides. La menor producción de cortisol, aldosterona, o ambas y el hecho de que no se inhiba la retroacción negativa, origina una mayor liberación de corticotropina, angiotensina II o ambas. Como resultado, hay producción excesiva de otros esteroides hormonalmente activos. La hiperplasia suprarrenal congénita (CAH) incluye una gama de trastornos cuyo cuadro clínico inicial, datos de laboratorio y tratamiento dependen de la deficiencia de algunas de las enzimas esteroidogénicas precisas. (2) Todos los paciente con CAH clásica requieren tratamiento de sustitución con hidrocortisona o un congénere idóneo, y los que tienen pérdida de sodio, también necesitan mineralocorticosteroides como forma de reposición. La dosis diaria habitual de hidrocortisona es de alrededor de 0.6 mg/kg/día en dos o tres fracciones. El mineralocorticoide administrado es acetato de fludrocortisona, 0.05 a 0.2 mg/día. (2) Aplicaciones terapéuticas en enfermedades no endocrinas Las enfermedades inflamatorias como el asma y la artritis se caracterizan a nivel molecular por un aumento crónico en la expresión de múltiples citoquinas, quimoquinas, quininas y sus receptores, moléculas de adhesión y enzimas inflamatorias como la óxido nítrico sintasa inducible (iNOS) y la ciclooxigenasa inducible (COX-2). A nivel celular, las regiones inflamadas muestran un flujo substancial de varias células inflamatorias, dilatación arterial, aumento del flujo sanguíneo, derrame de proteínas plasmáticas y edema. Estos parámetros de la inflamación son efectivamente reducidos por el tratamiento con glucocorticoides por mecanismos tanto directos como indirectos. (9,13) Los corticosteroides son actualmente la terapia más efectiva para las enfermedades atópicas. Sin embargo, los efectos secundarios sistémicos limitan la dosis que pueden administrase durante períodos prolongados de tiempo, por lo que, en inicios de los 70‘s se Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 26 desarrollaron los esteroides tópicos, que tienen efectos anti-inflamatorios locales. Los corticosteroides inhalados han mejorado dramáticamente la terapia del asma y actualmente son la primera línea de tratamiento en casos de asma persistente para todas las edades. (10, 12) Los esteroides nasales son además, el tratamiento más efectivo para la rinitis alérgica. Sin embargo, los esteroides tópicos se han asociado con atrofia dérmica, lo que restringe su uso en casos de dermatitis atópica. Los nuevos corticosteroides inhalados para el asma, incluyendo budenosida, fluticasona propionato y mometasona furoato, tienen un alto nivel de acción antiinflamatoria con mínimos efectos adversos debido a que la fracción deglutida de la droga es removida en gran medida por metabolismo hepático. Sin embargo, estas drogas son absorbidas de la mucosa pulmonar o nasal y por lo tanto pueden presentar algunos efectos sistémicos a dosis altas. Cabe recordar que los corticosteroides no son curativos, por lo que la inflamación recurre cuando éstos son discontinuados. (10) En las proximas indicaciones se proporcionan dosis aproximadas de un glucocorticoide representativo (regularmente prednisona). Esta elección no es un apoyo de una preparación de glucocorticoide particular sobre otros congéneres, sino que sólo se efectúa con propósitos ilustrativos. (2) · Cuadros reumáticos Los glucocorticoides se utilizan ampliamente para tratar diversos trastornos reumáticos y constituyen la piedra angular de la terapéutica de las enfermedades reumáticas inflamatorias más graves, como lupus eritematoso sistémico y diversos trastornos vasculíticos como poliarteritis nodosa, granulomatosis de Wegener y arteritis de células gigantes. Para esos trastornos más graves, la dosis inicial de glucocorticoides debe ser suficiente para suprimir la enfermedad con rapidez, y minimizar el daño tisular resultante. Al principio se utiliza a menudo prednisona (1 mg/kg/día en dosis divididas), por lo general hasta una dosis diaria única, con disminución progresiva subsecuente hasta una dosis mínima eficaz según se determina por variables clínicas. (2) Hay controversias respecto a la participación de los glucocorticoides en la artritis reumatoide, en particular debido a las acciones adversas graves y debilitantes relacionadas con el uso prolongado de estos medicamentos. Los corticoides no previenen de manera predecible la progresión de la destrucción articular, aunque un informe reciente sugiere que pueden retrasar su aparición. Además, se produce un efecto de rebote grave tras la retirada de los corticoides en la fase activa de la enfermedad. Algunos expertos recomiendan glucocorticoides sólo en casos de enfermedad progresiva que no muestra respuesta a los tratamientos de primera elección como fisioterapia y AINEs. En este caso los glucocorticoides proporcionan alivio hasta que otros antirreumáticos de acción más lenta (metotrexato, sales de oro) surtan efecto. La dosis inicial típica es de 5 a 10 mg de prednisona/día. Cuando hay una exacerbación aguda, pueden emplearse dosis más altas de glucocorticoides (habitualmente 20 a 40 mg/día de prednisona o equivalente) y después disminuir rápidamente la dosis. Las inyecciones intraarticulares de ésteres de corticoides pueden ayudar a controlar de manera temporal la sinovitis local en una o dos articulaciones especialmente dolorosas. El acetónido de triamcinolona (dosis que van de 5 a 20 mg) es el que suprime la inflamación por un período más prolongado. También son efectivos otros corticoides de depósito. Las preparaciones solubles de 21-fosfato de prednisolona o dexametasona no son recomendables, dado el aclaramiento rápido en la articulación y por Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 27 su duración de acción tan corta. Debido a que los ésteres de corticoides son cristalinos, puede aumentar la inflamación local de forma transitoria en las horas siguientes a la infiltración hasta en el 2% de los casos. (2,5) En enfermedades articulares degenerativas no inflamatorias (p ej, osteoartritis), o en diversos síndromes dolorosos regionales (p ej, tendonitis o bursitis), pueden administrarse glucocorticoides mediante inyección local para tratar el brote episódico de la enfermedad. Es importante minimizar la frecuencia del suministro de esteroides locales siempre que sea posible, ya que el uso excesivo de la articulación en la que se ha hecho la infiltración (posible gracias a la disminución del dolor) puede acelerar la destrucción articular. Se recomienda que las inyecciones por vía intraarticular se efectúen a intervalos de al menos tres meses para minimizar esas complicaciones. (2,5) Los glucocorticoides constituyen un componente de importancia del tratamiento de casi todos los síndromes vasculíticos, a menudo con otros inmunosupresores como ciclofosfamida. Es necesario ser cautos al usar glucocorticoides en algunas formas de vasculitis (p ej, poliarteritis nodosa), en las cuales las infecciones fundamentales por virus de la hepatitis pueden tener una participación patógena. Aun cuando los glucocorticoides están indicados en tales circunstancias, hay al menos una consideración teórica de que dichos medicamentos llegan a complicar la evolución de la infección viral al suprimir el sistema inmunitario. Los glucocorticoides de acción más breve, como prednisona y metilprednisolona, se prefieren en lugar de los esteroides de acción más prolongada como dexametasona, con el fin de facilitar la eliminación progresiva del compuesto, la conversión a regímenes de tratamiento en días alternos, o ambos aspectos. (2) · Asma bronquial Con frecuencia se utilizan corticosteroides en asma bronquial. A veces se emplean en enfermedad pulmonar obstructiva crónica (EPOC), en particular cuando hay algunos datos de obstrucción reversible. La información que apoya la eficacia de los corticosteroides resulta mucho más convincente para el asma bronquial que para la EPOC. Su empleo aumentado en asma refleja una apreciación mayor de la participación de la inflamación en la inmunopatogenia de este trastorno. (2) En crisis de asma graves que requieren hospitalización, la terapéutica enérgica con glucocorticoides por vía parenteral se considera esencial, aún cuando el inicio de la reacción se retrasa de 6 a 12 h. Al principio se administran 60 a 120 mg de metilprednisolona (o su equivalente) IV, seguidos por dosis diarias V.O. de prednisolona (40 a 60 mg) conforme se resuelve la crisis aguda. Posteriormente se procede a efectuar la disminución gradual y progresiva de la dosis, y la supresión se planea para 10 días a dos semanas luego del inicio del tratamiento con esteroides. En general, posteriormente es posible tratar a los enfermos con su régimen médico previo, luego de la intervención. (2) Las exacerbaciones agudas menos graves de asma (así como los brotes agudos de EPOC) suelen tratarse con períodos breves de glucocorticoides por vía oral. En adultos, se administran 40 a 60 mg de prednisona a diario durante cinco días; asimismo, es posible que se requiera otra semana de tratamiento con dosis más bajas. Cuando se suprime la exacerbación aguda, los glucocorticoides regularmente pueden disminuirse de modo progresivo con rapidez sin que haya efectos nocivos importantes. Cualquier supresión de la función suprarrenal casi siempre desaparece en una a dos semanas. En la terapéutica de Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 28 asma bronquial crónica grave (o, con menor frecuencia, de EPOC) que no se controla por medio de otras medidas, puede requerirse administración a largo plazo de glucocorticoides. Al igual que con otros usos a largo plazo de estos compuestos, se utiliza la dosis más baja eficaz, y es necesario tener cuidado cuando se intenta la supresión. (2) Los esteroides, sobre todo cuando se administran en aerosol, bloquean la respuesta tardía (no la precoz) a los alergenos inhalados y pueden producir una hiperreactividad bronquial posterior. El tratamiento prolongado hace que se reduzca de forma progresiva esta hiperreactividad. (5) En muchos pacientes, el uso de esteroides inhalados (con mayor frecuencia dipropionato de beclometasona, acetónido de triamcinolona, flunisolida o budesonida) puede reducir la necesidad de corticoesteroides por vía oral, o reemplazarlos por completo. (2) Los esteroides inhalados están indicados para la prevención a largo plazo de los síntomas y para la supresión, el control y la eliminación de la inflamación. Reducen de forma notable la necesidad de tratamiento de mantenimiento con esteroides orales, salvo en los casos más graves, pero no se utilizan para el asma agudo. Los efectos adversos locales de los esteroides inhalados incluyen la disfonía y la candidiasis oral, pero estos efectos se pueden prevenir o aliviar haciendo que el paciente emplee un espaciador o haga gárgaras con agua tras la inhalación. (2,5) · Cuadros renales La utilidad de los glucocorticoides ante nefropatía también ha motivado considerables debates. Las personas con síndrome nefrótico consecutivo a enfermedad con cambio mínimo, por lo general muestran buena respuesta al tratamiento con esteroides y, en la actualidad, los glucocorticoides se aceptan de manera uniforme como tratamiento de primera elección tanto en adultos como en niños. Las dosis diarias iniciales de prednisona son de 1 a 2 mg/kg de peso durante seis semanas, seguidas por disminución progresiva y gradual de la dosis en el transcurso de seis a ocho semanas, aunque algunos nefrólogos recomiendan tratamiento en días alternos. El cese de la terapéutica con esteroides suele complicarse por recaída de la enfermedad, según se manifiesta por la proteinuria recurrente. En la nefropatía consecutiva a lupus eritematoso sistémico, regularmente también se hace un intento terapéutico con glucocorticoides. (2) Los estudios con respecto a otras formas de nefropatía, como glomerulonefritis membranosa y membranoproliferativa, y esclerosis focal, han proporcionado datos contradictorios acerca de la participación de los glucocorticoides. (2) · Cuadros alérgicos El inicio de acción de los glucocorticoides en enfermedades alérgicas es tardío. Las manifestaciones de enfermedades alérgicas de duración limitada, como fiebre del heno, enfermedad del suero, urticaria, dermatitis por contacto, reacciones farmacológicas, picaduras de abeja, y edema angioneurótico, pueden suprimirse por medio de dosis adecuadas de glucocorticoides administradas como complementos del tratamiento primario. Ante enfermedad grave, son apropiados los glucocorticoides por vía I.V. (metilprednisolona, 125 mg cada 6 h, o su equivalente). En enfermedad menos grave, los Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 29 antihistamínicos son los fármacos más adecuados. En la rinitis alérgica, los esteroides por vía intranasal también pueden proporcionar alivio de los síntomas. (2) · Cuadros infecciosos Aún cuando parecería paradójico usar glucocorticoides inmunosupresores en enfermedades infecciosas, hay un número limitado de situaciones en las cuales están indicados en el tratamiento de infecciones por microorganismos patógenos específicos. Un ejemplo notorio de este tipo de efectos beneficiosos se observa en pacientes con SIDA que presentan neumonía por Pneumocystis carinii, e hipoxia de moderada a grave. La adición de glucocorticoides al régimen antibiótico mejora la oxigenación y disminuye la incidencia de insuficiencia respiratoria y la mortalidad. En forma semejante, disminuyen claramente la incidencia de deterioro neurológico a largo plazo vinculado con la meningitis por Haemophilus influenzae de tipo b en lactantes y niños de dos meses de vida o mayores. (2) · Cuadros oculares Los glucocorticoides se utilizan con frecuencia para suprimir la inflamación en el ojo y pueden preservar la visión cuando se usan de manera apropiada. Se administran por vía local en enfermedades de la parte externa del ojo y del segmento anterior del mismo, y alcanzan concentraciones terapéuticas en el humor acuoso después de instilación en el fondo del saco conjuntival. En general, se recomienda que el uso ocular de glucocorticoides se efectúe bajo la supervisión de un oftalmólogo. (2) Una prescripción habitual consta de solución (oftálmica) de fosfato sódico de dexametasona al 0.1%, dos gotas en el saco conjuntival cada cuatro horas durante la vigilia, y fosfato sódico de dexametasona al 0.05% en ungüento (oftálmico) al acostarse. En inflamaciones del segmento posterior se requiere tratamiento por vía sistémica, y las dosis características de prednisona o su equivalente son de 30 mg/día, administrados por vía oral en dosis divididas. (2) El tratamiento con glucocorticoides por vía local suele incrementar la presión intraocular en ojos normales y exacerba la hipertensión intraocular en sujetos con antecedentes de glaucoma. Cuando se aplican este tipo de fármacos durante más de dos semanas, es necesario vigilar la presión intraocular. (2) La administración de glucocorticoides por vía local en individuos con conjuntivitis bacteriana, viral o micótica, puede enmascarar datos de progresión de la infección. Los glucocorticoides están contraindicados en la queratitis por herpes simple porque la progresión de la enfermedad puede generar opacidad irreeversible de la córnea. Los esteroides por vía local no han de usarse para tratar laceraciones y abrasiones mecánicas del ojo porque retrasan la cicatrización y favorecen la aparición de infección y la diseminación de la misma. (2) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 30 · Cuadros cutáneos Los glucocorticoides son muy eficaces en el tratamiento de una amplia variedad de dermatosis inflamatorias. Como resultado, se dispone de muchas preparaciones y concentraciones de glucocorticoides de potencias variables por vía local. (2) Un régimen característico en una erupción eccematosa consta de hidrocortisona al 1% en ungüento, aplicada por vía local dos veces al día. La eficacia aumenta por medio de la aplicación del esteroide local bajo una película oclusiva, como una cubierta de plástico; lamentablemente, los vendajes oclusivos también incrementan el riesgo de absorción sistémica, y éste puede constituir un problema importante cuando se aplican los glucocorticoides más potentes en piel inflamada. (2) Entre las dermatosis inflamatorias en que están indicados los corticosteroides se encuentran: dermatitis seborreica y atópica, neurodermatitis localizada, dermatitis por contacto o irritante, prurito anogenital, psoriasis, líquen plano, lupus eritematoso discoide. Estos fármacos pueden empeorar la clínica del acné, la rosácea y de algunas infecciones fúngicas. (5,7) Aunque se comercializan esteroides tópicos con distintas potencias, se debe empezar en general por los más potentes salvo en el caso de las lesiones localizadas en la cara o en áreas intertriginosas, donde se producen con más frecuencia efectos secundarios. Los glucocorticoides de potencia media o alta sólo se deben emplear en la cara durante períodos de tiempo cortos. Se deben aplicar dos o tres veces al día, o de un modo más frecuente en determinadas dermatosis. Si el esteroide es muy potente, se puede aplicar con menos frecuencia. Para que la eficacia obtenida sea máxima, se deben aplicar las cremas frotando hasta que se evaporen. (5) (ver cuadro 3 y 4) Los glucocorticoides se administran por vía sistémica en episodios graves de trastornos dermatológicos agudos, así como en exacerbaciones de trastornos crónicos. En esas circunstancias, la dosis por lo general es de 40 mg/día de prednisona. (2) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 31 Cuadro 3 Cuadro 4 Criterios de selección de formulaciones de corticoides tópicos. (7) Forma farmacéutica Piel glabra Zonas vellosas Palmas y plantas de pie Zonas infectadas Zonas intertriginosas Pomada/Ungüento *** *** ** * ** ** ** ** *** *** ** ** * * Crema * ** Loción Solución Gel ***= Uso preferente. ** = Uso aceptable. * = Útil a veces. Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 32 · Cuadros del tubo digestivo El tratamiento con glucocorticoides está indicado en algunos pacientes con enfermedad inflamatoria intestinal (colitis ulcerosa crónica y enfermedad de Crohn). Los glucocorticoides pueden resultar beneficiosos en individuos que no muestren reacción ante un tratamiento más conservador. En colitis ulcerosa leve puede proporcionarse hidrocortisona (100 mg) mediante un enema de retención, con efectos beneficiosos. En exacerbaciones agudas más graves, suele utilizarse prednisona por vía oral (10 a 30 mg/día). Para pacientes muy graves, con fiebre, anorexia, anemia y alteraciones del estado nutricional, deben emplearse dosis mayores (60 a 120 mg/día de prednisona). (2) · Cuadros hepáticos El uso de corticosteroides en hepatopatía ha despertado muchas controversias. Está claro que los glucocorticoides resultan beneficiosos en hepatitis crónica activa autoinmunitaria, en la cual hasta 80% de los enfermos muestra remisión histológica cuando reciben tratamiento con prednisona (40 a 60 mg/día al principio, con disminución lenta y progresiva hasta una dosis de sostén de 7.5 a 10 mg/día después de que disminuyen las cifras séricas de transaminasas). No está por completo definida la participación de los corticosteroides en hepatopatía de origen alcohólico. En hepatopatía grave debe utilizarse prednisolona en lugar de prednisona, que requiere conversión en el hígado para tener actividad. (2) · Cuadros malignos Los glucocorticoides se utilizan en la quimioterapia de leucemia linfocítica aguda y linfomas, debido a sus efectos antilinfocíticos. Con mayor frecuencia, los glucocorticoides son un componente de la quimioterapia combinada que se administra bajo protocolos programados. (2) · Edema cerebral Los glucocorticoides son útiles en la reducción o la prevención del edema cerebral relacionado con parásitos y con neoplasias, en especial las metastásicas. Aunque suelen utilizarse para tratar edema cerebral causado por traumatismos o enfermedades cerebrovasculares, estudios clínicos controlados no apoyan su utilización en estas situaciones. (2) · Cuadros diversos Sarcoidosis. Se trata con corticosteroides (alrededor de 1mg/kg/día de prednisona, o una dosis equivalente de esteroides alternativos) para inducir remisión. Las dosis de sostén, que a menudo se requieren durante períodos prolongados, pueden ser tan bajas como de 10 mg/día de prednisona. (2) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 33 Trombocitopenia. Se utiliza prednisona (0.5 mg/kg) para disminuir la tendencia a la hemorragia. En pacientes con enfermedad más grave, y para el inicio de la terapéutica de la variante idiopática, se emplean dosis diarias de prednisona (1 a 1.5 mg/kg). (2) Destrucción autoinmunitaria de eritrocitos (anemia hemolítica con prueba de Coombs positiva). Quienes presentan este padecimiento reciben tratamiento con prednisona (1 mg/kg/día). En presencia de hemólisis grave pueden utilizarse dosis más grandes, con disminución lenta y progresiva a medida que se reduce la anemia. En sujetos que muestren reacción, tal vez se requieran dosis de sostén pequeñas durante varios meses.(2) Transplante de órgano. En el momento de la operación, se administran dosis altas de prednisona (50 a 100 mg), con otros inmunosupresores, y la mayoría de los enfermos permanece bajo un régimen de sostén que incluye dosis más bajas de glucocorticoides (2) Lesión de médula espinal. Estudios multicéntricos han indicado disminuciones notables en los defectos del sistema nervioso en sujetos con lesión aguda de médula espinal; los cuales reciben en término de 8 h de su lesión, grandes dosis de metilprednisolona (30mg/kg de peso, inicialmente, seguidos de un goteo de 5.4 mg/kg de peso por hora durante 23 h). La capacidad de los corticosteroides en dosis altas para aplacar la lesión del sistema nervioso quizá refleje la inhibición de la lesión celular mediada por radicales libres. (2) PRECAUCIONES • Los corticosteroides deben administrarse con precaución en presencia de insuficiencia cardiaca congestiva, infarto reciente del miocardio o hipertensión, pacientes con diabetes mellitus, epilepsia, glaucoma, hipotiroidismo, insuficiencia hepática, osteoporosis, úlcera péptica, psicosis o severos desórdenes afectivos, e insuficiencia renal. • En los niños, los corticosteroides pueden causar retraso en el crecimiento, por lo que la administración prolongada es raramente justificada. En los ancianos también pueden incrementarse la aparición de efectos adversos. • Los pacientes geriátricos pueden estar más propensos a desarrollar hipertensión durante la terapia con corticosteroides. Las mujeres posmenopáusicas están más propensas a padecer osteoporosis inducida por glucocorticoides. • Los corticosteroides usualmente están contraindicados en presencia de infecciones agudas difíciles de controlar. • A pacientes con tuberculosis activa o dudosa no se les debe administrar corticosteroides excepto, muy rara vez, en conjunto con un tratamiento con fármacos antituberculosos. • El riesgo de la varicela y de herpes zoster se incrementa en pacientes no inmunizados que reciben dosis terapéuticas de corticosteroides sistémicos, por lo que los pacientes deben evitar el contacto cercano con cualquier infección. Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 34 • Las vacunas vivas no se deben aplicar a pacientes que están recibiendo terapias con altas dosis de corticosteroides sistémicos, por lo menos hasta 3 meses después. • Las vacunas muertas o toxoides pueden aplicarse, sin embargo, la respuesta a la vacuna puede ser atenuada. • Los dolores de espalda pueden indicar osteoporosis. • Se deben tomar medias para compensar la inhabilidad adrenal de responder ante el estrés, como aumentar la dosis en enfermedad o en traumas (cirugía) • El riesgo de absorción sistémica debe ser considerado durante la aplicación tópica de corticoides. No deben ser aplicados con vendajes oclusivos en grandes áreas del cuerpo. La aplicación tópica por períodos prolongados debe evitarse (principalmente en niños). También debe tomarse en cuenta que los pañales y otras prendas infantiles impermeables pueden actuar como vendaje oclusivo. • Se debe tener precaución durante la aplicación local de corticosteroides en los ojos. (3) • Los corticosteroides atraviesan la placenta. Aunque no se han realizado estudios en humanos, existe evidencia de que dosis farmacológicas de corticosteroides pueden aumentar el riesgo de insuficiencia placentaria, disminución del peso del recién nacido, o muerte fetal. Sin embargo, los efectos teratogénicos en humanos no han sido confirmados. • Estudios en animales han mostrado que los corticosteroides incrementan la incidencia de paladar hendido, insuficiencia placentaria, abortos espontáneos y retraso en el crecimiento intrauterino. (4) • Los corticoides tópicos no son tratamiento adecuado de procesos infecciosos dermatológicos, incluso si cursan con inflamación. En el caso de infección concurrente en procesos susceptibles de corticoterapia estos medicamentos se usarán con precaución y nunca bajo vendaje oclusivo. Se instaurará el tratamiento antiinfeccioso correspondiente. En caso de que la infección no responda rápidamente al mismo, se suspenderá el corticoide hasta que el proceso infeccioso haya sido controlado. • Evitar el uso de corticoides tópicos, especialmente los potentes, en casos de acné, rosácea o dermatitis perioral. No aplicar tampoco en heridas o úlceras abiertas. (7) RECOMENDACIONES PARA EL PACIENTE • Tomar con comida para minimizar la irritación gastrointestinal. • No tomar más cantidad de medicamento que la prescrita. • Si olvida una dosis, y el esquema de dosificación es: _De día de por medio: Si el paciente recordó la dosis olvidada en la mañana, debe tomar lo más pronto posible la dosis; si recordó después, no debe tomarla hasta la mañana siguiente y el día después no debe tomar el fármaco y continuar como de costumbre. _Una vez al día: Debe tomar la dosis lo antes posible, al menos que se aproxime la toma siguiente. No debe tomar dos dosis juntas. Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 35 _Varias veces al día: Debe tomar la dosis lo antes posible, puede tomar las dos dosis juntas, si ya se aproxima la siguiente toma. • No dejar de tomar el medicamento sin consultar al médico. • Pacientes con terapia prolongada con corticoides (principalmente aquellos con actividad mineralocorticoide significante) pueden requerir una dieta con restricciones de sodio y/o suplementos de potasio. • Debido a que los corticoides promueven el catabolismo de proteínas, puede requerirse una dieta alta en éstas, durante tratamientos prolongados. • La administración de calcio y vitamina D, así como el ejercicio físico en casos donde la condición del paciente lo permita, pueden reducir el riesgo de osteoporosis inducida por corticoesteroides en terapias prolongadas. (4) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 36 Interacciones de los glucocorticoides Algunos fármacos que pueden ser afectados por los glucocorticoides son: anticolinesterasas, anticoagulantes, ciclosporina, glucósidos digitálicos, isoniazida, bolqueadores neuromusculares no despolarizantes, agentes excretores de potasio (ejemplo los diuréticos), salicilatos, somatrem y teofilina. (23) Fármacos que pueden afectar los glucocorticoides son: aminoglutetimida, barbituratos, colestiramina, anticonceptivos orales, efedrina, estrógenos, hidantoinas, ketoconazol, antibioticos macrólidos y rifampicina. (23) Las siguientes interacciones medicamentosas y/o problemas relacionados se han seleccionado en base a su potencial significativo clínico, las que están en negrilla tienen mayor importancia: • Acetaminofén: la inducción de enzimas hepáticas por parte de los corticoesteroides puede incrementar la formación de los metabolitos hepatotóxicos del acetaminofén, por lo que se aumenta el riesgo de hepatotoxicidad, cuando se utilizan terapias concomitantementes con dosis crónicas o altas de acetaminofén. (4) • Alcohol o AINE´s: el riesgo de ulceración o hemorragia puede incrementarse cuando estas sustancias se utilizan al mismo tiempo que los glucocorticoides. (3, 4,22) Sin embargo el uso de AINE´s en el tratamiento de la artritis puede proveer de un efecto aditivo terapéutico que permite la reducción de la dosis de glucocorticoides. (4,22) Un estudio realizado para valorar el efecto del uso crónico de rofecoxib sobre los parámetros farmacocinéticos de la prednisona oral o prednisolona intravenosa (una sola dosis), no mostró influencia clínica importante. La terapia combinada de rofecoxib y corticoesteroides, es en general bien tolerada. El estudio se realizó con dosis diez veces más altas de rofecoxib que las utilizadas para el tratamiento de la artritis reumatoide, sin embargo no se encontraron efectos clínicos importantes en la farmacocinética de la prednisona oral o prednisolona intravenosa. El área bajo la curva y la concentración plasmática máxima fueron iguales en los pacientes que recibieron el placebo que en los que recibieron rofecoxib. De este estudio se concluye que no se espera ningún efecto por el uso concomitante de rofecoxib y corticoesteroides. (27) • Aminoglutetimida: este medicamento suprime la función adrenal, por lo que la suplementación de glucocorticoides es requerida. La aminoglutetimida acelera el metabolismo de la dexametasona lo que sugiere que la vida media de ésta se reduce a la mitad. En lugar de la dexametasona se recomienda la hidrocortisona, ya que su metabolismo no se conoce que se altere por la aminoglutetimida y porque su actividad mineralocorticoide puede que se requiera. (4,22) • Anfotericina B, o inhibidores de la anhidrasa carbónica parenteral: el uso concomitante de corticoesteroides puede resultar en severa hipokalemia y debe ser administrado bajo precaución; además de monitorearse la función cardíaca y las concentraciones séricas de potasio. (3,4,22) El uso de hidrocortisona para controlar las reacciones adversas de la anfotericina B ha resultado en casos de insuficiencia cardiaca congestiva. (4) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 37 El uso concomitante de la acetazolamida y corticoesteroides puede incrementar el riesgo de hipernatremia y/o edema, debido a que los corticoesteroides causan retención de líquidos y sodio. (4) Se debe considerar la posibilidad de que el uso concomitante crónico de los corticoesteroides con los inhibidores de la anhidrasa carbónica puedan incrementar el riesgo de hipocalcemia y osteoporosis debido a que éstos también incrementan la excreción de calcio. (4) • Esteroides anabólicos o andrógenos: el uso concomitante de los glucocorticoides puede incrementar el riesgo de edema; y puede promover también la aparición de acné severo. (4) • Antiácidos: el uso crónico concomitante de prednisolona o dexametasona puede disminuir la absorción de estos dos últimos. La eficacia puede ser disminuida lo suficiente como para que se requiera ajuste de dosis en pacientes que reciben dosis pequeñas; sin embargo en pacientes que reciben dosis grandes no es probable que ocurra. (4,22) • Las resinas de intercambio iónico (colestiramina, colestipol) pueden disminuir la absorción oral del corticoide con inhibición de su efecto. (22) Si se adiciona el colestipol al tratamiento de un paciente con hipopituitarismio en tratamiento de mantenimiento con hidrocortisona, resulta en cefaleas, ataxia y letargia. (3) • Anticolinérgicos, especialmente atropina y compuestos relacionados: el uso prolongado concomitante puede incrementar la presión ocular. (4) • Anticoagulantes, coumarina o derivados de indanediona, heparina, streptokinasa o urokinasa: los efectos de las coumarinas o de los derivados de indanediona usualmente se diminuyen (aunque en algunos pacientes más bien se aumenta) cuando se utilizan concomitantemente con glucocorticoides; ajustes de dosis basados en la determinación de los tiempos de protrombina pueden ser necesarios durante y después de la terapia con glucocorticoides. (3,4) Potencialmente puede ocurrir hemorragia o ulceración gastrointestinal durante la terapia con glucocorticoides, y los efectos de los glucocorticoides en la integridad vascular, puede causar un aumento del riesgo en pacientes que se encuentran recibiendo terapia anticoagulante o trombolítica. (4) • Antidepresivos tricíclicos: estos medicamentos no alivian los disturbios mentales causados por los glucocorticoides, mas bien los exacerban. No se deben utilizar para el tratamiento de este efecto adverso. (4) • Agentes antidiabéticos orales o insulina: los glucocorticoides pueden incrementar la concentración de glucosa en sangre; por ello el ajuste de dosis de uno de los agentes o ambos es necesaria durante el uso concomitante. También se debe realizar un ajuste de dosis del o los agentes antidiabéticos cuando se descontinúe la terapia con glucocorticoides. (3,4,22) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 38 Los corticoesteroides (como la betametasona y cortisona) pueden producir una posible inhibición del efecto hipoglicemiante de la clorpropamida por antagonismo de sus efectos sobre la glicemia. (22) • Se sugiere que debe evitarse el uso concomitante de la talidomida con corticoesteroides: estudios han demostrado que en el tratamiento del eritema nodular leproso severo crónico, la dosis necesaria para suprimir los síntomas fue considerablemente reducida en 9 de cada 10 pacientes cuando recibían talidomida concomitantemente. (3) • Las dosis de antihipertensivos también puede ser necesario aumentarla cuando se usan concomitantemente con corticoesteroides. (3) • Agentes antitiroideos u hormonas tiroideas: cambios en el estatus tiroideo del paciente que ocurren como resultado de la administración, cambios en la dosis o descontinuación del tratamiento con la hormona tiroidea o con agentes antitiroideos, pueden necesitar ajuste de los glucocorticoides; esto debido a que la aclaración metabólica de los glucocorticoides se ve disminuida en pacientes hipotiroideos e incrementa en pacientes hipertiroideos. El ajuste de dosis debe de basarse en los resultados de las pruebas de la función tiroidea. (4) • Asparaginasa: los glucocorticoides, especialmente la prednisolona, pueden incrementar el efecto hiperglicémico de la asparaginasa y el riesgo de neuropatía y disturbios en la eritropoyesis. La toxicidad aparentemente es menos pronunciada cuando la asparaginasa es administrada después de estos medicamentos, y no antes o con los corticoesteroides. (4) • Anticonceptivos orales o estrógenos: los estrógenos pueden alterar el metabolismo y la unión a proteínas de los glucocorticoides, llevando a una disminución en el aclaramiento, aumento de la vida media de eliminación y un incremento en los efectos terapéuticos y tóxicos de los glucocorticoides. El ajuste de dosis se requiere durante y después del uso concomitante. (3,4,11,27) • Ciclosporina: se han observado convulsiones en pacientes que reciben ciclosporina y altas dosis de metilprednisolona. (4) La prednisolona y la prednisona pueden provocar una posible potenciación del efecto y/o toxicidad de la ciclosporina por inhibición de su metabolismo hepático. (3,22) Sin embargo, estudios realizados no muestran ninguna alteración en las concentraciones plasmáticas ni de los corticoesteroides ni de la ciclosporina. Estos resultados controversiales pueden deberse a los distintos métodos utilizados para la cuantificación. (3) • Glucósidos digitálicos: el uso concomitante con glucocorticoides puede incrementar la posibilidad de arritmias o toxicidad digitálica asociada a hipokalemia. (4,22) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 39 • Diuréticos: Los efectos natriuréticos y diuréticos de estos medicamentos pueden ser disminuidos por las acciones de retención de fluido y sodio de los corticoesteroides, y viceversa. (4,22) El uso concomitante con diuréticos excretores de potasio puede resultar en una severa hipokalemia, por lo que se recomienda monitorear las concentraciones séricas de potasio y las funciones cardiacas. (3, 4,22) Los efectos de los diuréticos ahorradores de potasio y/o corticoesteroides en la concentración sérica de potasio se ven disminuidos. Se recomienda monitorear los niveles de concentraciones séricas. (4) • Ácido fólico: los requerimientos pueden incrementar en pacientes que reciben terapia con corticoesteroides por períodos largos. (4) • Agentes inmunosupresores: el uso concomitante de los inmunosupresores con glucocorticoides puede incrementar el riesgo de infección y la posibilidad de la aparición de linfomas u otros desórdenes linfoproliferativos (estos neoplasmas se asocian con infecciones causadas por el virus de Epstein Barr.) Estudios con pacientes transplantados que reciben terapia de inmunosupresión, indican que el progreso del neoplasma es reversibles cuando se elimina la terapia o se disminuye la dosis del inmunosupresor. (4) • Agentes hepáticos inductores: el uso concomitante de inductores hepáticos como barbitúricos, carbamazepina, pirimidona, fenobarbital, fenitoina y/o rifampicina, pueden incrementar el metabolismo de los corticoesteroides, y eventualmente disminuir el efecto de los mismos. Se requiere ajuste de dosis de los glucocorticoides durante y después de su uso. (3,4,22,11) El uso concomitante de rifampicina y glucocorticoides incrementa la dosis de éstos últimos dos o tres veces más. (28) La efedrina produce una disminución de los niveles plasmáticos de dexametasona, con posible pérdida del control antiasmático. (3,22) • Isoniazida: los glucocorticoides, especialmente la prednisolona, puede aumentar el metabolismo hepático y/o excreción de la isoniazida, lo que lleva a una disminución de la concentración en plasma con posterior disminución de la efectividad. Se requiere un ajuste de dosis cuando se utilizan concomitantemente ambos fármacos. (3,4,22) • Mexiletin: el uso junto con glucocorticoides disminuye las concentraciones plasmáticas del mexiletin, debido a un aumento en el metabolismo hepático de éste último. (4) • Mitotano: este fármaco suprime la función adrenocortical y usualmente se requiere la suplementación de glucocorticoides a dosis mayores, debido a que el mitotano también aumenta el metabolismo hepático de los glucocorticoides. (4) • Agentes bloqueadores neuromusculares (no-despolarizantes): la hipokalemia inducida por los glucocorticoides puede incrementar el bloqueo que producen los Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 40 agentes bloqueadores neuromusculares, lo que posiblemente puede llevar a un aumento o prolongación de la depresión respiratoria o parálisis (apnea). Los niveles séricos de potasio deben ser determinados con anterioridad a la administración conjunta de ambos fármacos. (4,22) Se ha reportado antagonismo de los efectos de los bloqueadores neuromusculares pancuronium y vecuronium en pacientes en tratamiento con corticoesteroides. Esta interacción puede ocurrir con tratamientos a largo plazo, y es de esperarse que ocurra con todos los boqueadotes neuromusculares. (3) • Suplementos de potasio: el efecto de estos medicamentos se ve disminuido cuando se utilizan concomitante con los corticoesteroides. Se recomienda monitorear los niveles de potasio séricos. (4) • Ritodrina: el uso concomitante causa edema pulmonar en mujeres embarazadas. Se ha reportado muerte materna. Ambos medicamentos deben ser descontinuados al primer signo de edema pulmonar. (4) • Salicilatos: el uso concomitante de los salicilatos con los glucocorticoides en el tratamiento de la artritis provee de un beneficio terapéutico aditivo que permite la reducción de la dosis de glucocorticoides. Los glucocorticoides pueden incrementar la excreción de los salicilatos y reducir las concentraciones plasmáticas, por lo que se requiere un aumento en la dosis de los salicilatos. Debe tenerse cuidado cuando se suspenden los glucocorticoides o se disminuye la dosis porque puede ocurrir salicilismo (especialmente los pacientes que reciben dosis altas). (4) El riesgo de sufrir ulceraciones y hemorragias gastrointestinales aumenta con el uso concomitante de ambos medicamentos. (4) La prednisolona puede provocar una disminución de las concentraciones de salicilato, con pérdida de actividad, por posible aumento de su eliminación. (22) • Medicamentos o comidas con alto contenido de sodio: el uso concomitante con dosis farmacológicas de glucocorticoides puede resultar en edema y en aumento de la presión arterial. (4) • Somatrem o Somatropina: no se recomienda el uso de dosis grandes de corticoesteroides con somatrem o somatropin, debido a una inhibición en la respuesta de crecimiento. (4) • Estreptozocin: el uso concomitante con glucocorticoides puede incrementar el riesgo de hiperglicemia. (4) • Vacunas de virus vivo o inmunizaciones: la administración de vacunas de virus vivo atenuado a pacientes que están recibiendo dosis farmacológicamente inmunosupresoras de glucocorticoides no se recomienda, debido a que puede potenciar la replicación del virus; incrementándose el riesgo de que el paciente adquiera la enfermedad viral y/o disminuyendo la respuesta del paciente a los anticuerpos. El estado inmunológico del Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 41 paciente debe ser evaluado antes de administrar una vacuna de virus vivo atenuado. (4,22) La inmunización con la vacuna de polio oral en personas cercanas al paciente inmunosupreso (especialmente familiares) debe posponerse. (4) Otras inmunizaciones deben de suspenderse en estos pacientes debido a un aumento en el riesgo de complicaciones neurológicas y la posibilidad de una respuesta de anticuerpos nula o muy escasa. (4) • Se ha observado un aumento en las concentraciones plasmáticas y/o una disminución en la eliminación de la prednisolona y metilprednisolona cuando se usa concomitantemente con ketoconazol e itraconazol (también con la claritromicina); (3,27) lo que se relaciona con un aumento de los efectos supresores adrenales. Se ha sugerido una reducción del 50% de la dosis de la metilprednisolona intravenosa cuando se utiliza concomitantemente con el ketoconazol. Sin embargo algunos investigadores han encontrado que cuando se utiliza la prednisolona oral no se observan los mismos efectos. (3) El itraconazol es un potente inhibidor de CYP3A4 que incrementa considerablemente las concentraciones en plasma y disminuye la eliminación de la metilprednisolona. El uso concomitante de itraconazol y metilprednisolona puede incrementar el riesgo de efectos adversos relacionados con glucocorticoides. Un estudio realizado mostró el efecto del itraconazol en la farmacocinética y farmacodinámica de los glucocorticoides: aumentó la vida media de eliminación de la prednisolona en un 29%, y aumentó el ABC de la prednisona en sangre. Sin embargo, mostró que el itraconazol no varía el pico máximo de concentración ni el tiempo que dura en alcanzarse éste pico. La susceptibilidad de la prednisolona para interactuar con inhibidores del CYP3A4, es considerablemente menor que la de la metilprednisolona, por lo que se pueden utilizar el itraconazol y otros inhibidores de ésta isoenzima concomitante con prednisolona, sin observarse marcados cambios en los efectos de la prednisolona. (24) • La prednisona puede producir una alteración de los niveles de ciclofosfamida con posible inhibición o potenciación de su actividad, por alteración de su metabolismo. (22) Se ha encontrado que dosis únicas de prednisolona inhiben la activación de la ciclofosfamida, sin embargo después de un tratamiento largo, la tasa de activación se ve aumentada. Un estudio realizado en niños encontró que el pretratamiento con dexametasona se asocia con un aumento en la eliminación de ciclofosfamida. (3) • Los corticoesteroides, al ser inhibidores de la isoenzima CYP3A4, interfieren con el metabolismo de atorvastatina, lovastatina, cerivastatina y simvastatina. Como consecuencia se observa una disminución del metabolismo de las estatinas anteriores: incrementándose el efecto sobre los lípidos y potenciándose sus efectos adversos. (26) • Los antibióticos macrólidos retrasan la eliminación de los glucocorticoides, potenciando los efectos adversos de éstos últimos. El uso concomitante de la claritromicina resulta en una concentración plasmática significativamente mayor y una reducción del 65% de la eliminación de la metilprednisolona. Sin embargo, la claritromicina no afecta la eliminación de la prednisolona, de lo que se concluye que Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 42 para evitar los efectos adversos tipo esteroidales se debe administrar prednisona en vez de metilprednisolona durante el uso concomitante con claritromicina. (25) Sin embargo, no hay evidencia clínicamente significativa de interacción entre los macrólidos y los corticoesteroides. (3) • En cuanto a la administración concomitante de corticosteroides y β-agonistas se han demostrado in vitro tanto interacciones positivas como negativas. Sin embargo, en estudios clínicos las interacciones entre ambos tipos de drogas parecen ser predominantemente positivas: la administración del corticosteroide aumenta la respuesta broncodilatadora al β-agonista. (14) El uso concomitante de los agonistas beta 2 puede potenciar los efectos de hipokalemia. (3) • La dexametasona produce una disminución de los niveles plasmáticos de albendazol, con posible inhibición de su efecto, por inducción de su metabolismo hepático. (22) • El ritonavir puede incrementar las concentraciones de corticoesteroides en sangre. (3) Los corticoesteroides, en especial la dexametasona, puede inducir el metabolismo de los inhibidores de la proteasa del HIV resultado en concentraciones plasmáticas menores. (3) • Debe considerarse la posible potenciación de los efectos adversos como hipokalemia, por el uso concomitante de teofilina con corticoesteroides. En tres pacientes con asma severa aguda en tratamiento con aminofilina intravenosa, las concentraciones séricas aumentaron rápidamente de rangos terapéuticos a 40 y 50 µg/ml cuando se les administró hidrocortisona intravenosa. Estudios en pacientes sanos no mostraron cambios en los niveles séricos de teofilina luego de la administración concomitante de hidrocortisona, metilprednisolona o prednisona. Sin embargo, se observó una tendencia de aumento en la eliminación de la teofilina durante la terapia con corticoesteroides. (3) • Los corticoesteroides pueden disminuir las concentraciones de los salicilatos y diminuyen los efectos de los antimuscarínicos en la miastenia gravis. (3) Los corticoesteroides pueden alterar los valores de las siguientes determinaciones analíticas: (22) - Sangre: aumento de colesterol y glucosa. Disminución de calcio, potasio y hormonas tiroideas. - Orina: aumento de la glucosa. - Pruebas cutáneas: tuberculina, pruebas con parche para alergia, etc., puede inhibirse la reacción especialmente en tratamientos con dosis elevadas de corticoides. La mayoría de las interacciones de los glucocorticoides se deben a un efecto en el metabolismo mediado por la isoenzima CYP3A4. (27) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 43 Enfermedades de la corteza suprarrenal A continuación se describen de forma muy breve dos trastornos relacionados con el exceso o deficiencia de glucocorticoides. No se pretende hacer una revisión exhaustiva de ambos procesos patológicos si no solamente mencionar los aspectos más sobresalientes de estas enfermedades. La principal función de la corteza suprarrenal es producir glucocorticoides y mineralocorticoides, hormonas de las que el cortisol y la aldosterona son las más importantes en el hombre. Los glucocorticoides, así llamados por sus propiedades de regulación de carbohidratos, son indispensables para la sobrevivencia, al menos en circunstancias de estrés, y modulan el metabolismo intermedio, funciones hemodinámicas y procesos de desarrollo. Los mineralocorticoides regulan el equilibrio de sodio, potasio e hidrogeniones, y secundariamente modifican la presión arterial. El exceso o deficiencia de estos esteroides puede tener efectos fatales. El exceso y la deficiencia de glucocorticoides reciben los nombres de síndrome de Cushing y enfermedad de Addison respectivamente. (29) SÍNDROME DE CUSHING (HIPERCORTISOLISMO) El término “síndrome” de Cushing se refiere a las manifestaciones del exceso de corticosteroides, debidas comúnmente a dosis suprafisiológicas de glucocorticoides, y rara vez a una excesiva producción espontánea de los mismos por parte de la corteza suprarrenal. (17) Todos los casos de síndrome de Cushing endógeno, con independencia de su etiología, son consecuencia de un aumento de la producción de cortisol por la glándula suprarrenal. (16) Los casos adultos de síndromes de Cushing espontáneo tienen varias causas posibles: 1. Cerca del 70% se debe a “enfermedad” de Cushing, que se refiere a las manifestaciones de hipercortisolismo a causa de hipersecresión de ACTH por la hipófisis. Suele ser por un adenoma hipofisario benigno que es típicamente muy pequeño (<5mm.) Es cuando menos cinco veces más frecuente en la mujer que en el varón (17), siendo la edad de comienzo más frecuente el tercer y cuarto decenio de la vida. (16) 2. Cerca de 15% se debe a neoplasias no hipofisiarias (por ejemplo, carcinoma pulmonar de células pequeñas), que producen cantidades excesivas de ACTH ectópica. La hipopotasemia y la hiperpigmentación intensas se encuentran comúnmente en este grupo. (17) 3. Cerca de 15% no se relacionan con ACTH y son causados por la secreción excesiva de cortisol por parte de un tumor suprarrenal (adenoma o carcinoma) o raramente por hiperplasia nodular suprarrenal bilateral. Los adenomas suprarrenales por lo general son pequeños y producen principalmente cortisol, mientras que los carcinomas suprarrenales suelen ser grandes cuando se descubren y también pueden producir cantidades excesivas de andrógenos y producir hirsutismo y virilización. (17) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 44 Cuadro 5 Causas del Síndrome de Cushing (16) Hiperplasia suprarrenal A. Secundaria a hiperproducción hipofisaria de ACTH: a. Disfunción hipotálamo-hipofisaria b. Micro- o macroadenomas hipofisarios productores de ACTH. B. Secundario a tumores no endocrinos productores de ACTH o CRH (carcinoma broncógeno, carcinoma del timo, carcinoma pancreáticom adenoma bronquial.) Hiperplasia nodular suprarrenal Neoplasia suprarrenal a. Adenoma b. Carcinoma Causas exógenas iatrógenas a. Administración prolongada de glucocorticoides b. Administración prolongada de ACTH Cuadro clínico Signos y síntomas Muchos de los signos y síntomas del síndrome de Cushing se deben, obviamente, a la acción de los glucocorticoides. (16) La movilización del tejido periférico de soporte, la debilidad muscular y la fatiga, la osteoporosis, las estrías cutáneas y la fragilidad capilar son algunos de estos síntomas. Los dos últimos son secundarios a la debilitación y rotura de las fibras de colágeno de la dermis. La osteoporosis es en ocasiones muy intensa, y puede provocar el colapso en los cuerpos cerebrales, así como fracturas patológicas de otros huesos. (16) El hipercortisolismo fomenta el depósito de tejido graso en zonas muy características: obesidad “del tronco” (depósito de tejido graso en el lecho mesentérico), “cara de luna” pletórica (depósito de tejido graso en la parte superior de la cara), “joroba de búfalo” (depósito de tejido graso en la región interescapular) (16), cojinetes grasos supraclaviculares; abdomen protuberante y extremidades delgadas, oligomenorrea y amenorrea (o impotencia en el varón); debilidad, dolor de espalda, cefalea, hipertensión, acné e infecciones superficiales de la piel. Los pacientes tienen sed o poliuria (con o sin glucosuria), cálculos renales, glaucoma, estrías (en especial alrededor de muslos, mamas y abdomen) y facilidad para desarrollar moretones. Está retrasada la curación de heridas. Los Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 45 síntomas mentales pueden variar desde un aumento en la labilidad del ánimo hasta la psicosis franca, los pacientes son propensos a las infecciones. (17) El aumento de ACTH y de hormona β estimulante de los melanocitos produce una pigmentación similar a la que ocurre en enfermedad de Addison. Además de pigmentación generalizada, los puntos de presión (nudillos, codos, rodillas, sitios donde se apoya el cinturón o el tirante del sostén), areolas, genitales, membranas mucosas y cicatrices recientes se ven particularmente afectados. Dado que la producción de ACTH es sólo parcialmente autónoma en esta enfermedad, la hiperpigmentación es leve a moderada en etapas tempranas, pero podría ser más pronunciada después de la suprarrenalectomía o en tumores muy grandes. (29) En los niños es característico el cese del crecimiento lineal (5) Cuadro 6 Frecuencia de los signos y síntomas del síndrome de Cushing (porcentaje)(16) Hábito constitucional característico 97% Aumento de peso corporal 94% Fatiga y debilidad 87% Hipertensión (>150/90) 82% Hirsutismo 80% Amenorrea 77% Estrías cutáneas 67% Cambios de personalidad 66% Equimosis 65% Edemas 62% Poliuria y polidipsia 23% Hipertrofia del clítoris 19% Complicaciones El síndrome de Cushing, si no se trata, produce morbilidad grave e incluso la muerte. El paciente quizá sufra cualquiera de las complicaciones por hipertensión o diabetes sacarina. Se incrementa la susceptibilidad a infecciones. Las fracturas por compresión de la columna vertebral osteoporótica y la necrosis aséptica de la cabeza del fémur pueden provocar incapacidad importante. Es probable que se presente nefrolitiasis y psicosis. Después de la adrenalectomía bilateral para la enfermedad de Cushing, quizá crezca de modo progresivo un adenoma hipofisario, lo que provoca destrucción local (es decir, deterioro del campo visual) e hiperpigmentación. Esta complicación se conoce como síndrome de Nelson. (17) Tratamiento El tratamiento se dirige a corregir la hiperfunción de la hipófisis o la corteza suprarrenal y el enfoque necesario depende de la anomalía subyacente. (5) La enfermedad de Cushing se trata mejor mediante resección selectiva transesfenoidal del adenoma hipofisiario; después de la cual el resto de la hipófisis por lo general regresa a su Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 46 función normal. Sin embargo, los corticotrópicos normales se suprimen y se requieren de 6 a 36 meses para recuperar su función. Mientras tanto, es necesario el tratamiento de reemplazo con hidrocortisona. Los pacientes que son incapaces de presentar remisión se someten a adrenalectomía bilateral laparoscópica y también suelen recibir irradiación de la hipófisis, pero sólo se curan alrededor de 23% y las remisiones requieren hasta seis meses. Los enfermos que no son candidatos quirúrgicos quizá reciban una dosis de prueba de ketoconazol de 200 mg cada seis horas y se hace seguimiento de las enzimas hepáticas en busca de un aumento progresivo. (17) En circunstancias ideales, se localizan los tumores hipofisiarios durante la operación durante 90% de los pacientes y hay una respuesta exitosa a la intervención en 80% de ellos, incluyendo los tumores grandes. Es rara la mortalidad quirúrgica y hay complicaciones graves en menos del 2% de los pacientes. (29) Al principio debe apoyarse el estado general del paciente con la administración adecuada de potasio y una alta ingesta proteica. Si las manifestaciones clínicas son graves, puede ser razonable bloquear la secreción esteroidea con aminoglutetimida (250mg v.o. 2/d) o con ketoconazol (400 mg/d aumentando a un máximo de 1.200 mg/d). (5) Las neoplasias suprarrenales que secretan cortisol se tratan mediante resección laparoscópica. Hay supresión de la suprarrenal contralateral, de manera que se requiere reemplazo posoperatorio con hidrocortisona hasta que se presenta la recuperación. Los carcinomas suprarrenales metastásicos se tratan con mitotano y el ketoconazol o la metirapona tal vez ayuden a suprimir el hipercortisolismo en los casos de carcinoma suprarrenal no operable. (17) Los tumores ectópicos secretores de ACTH se deben eliminar por cirugía. Si esto no se puede hacer, el tratamiento con ketoconazol o metirapona (o ambos) puede al menos suprimir el hipercortisolismo. Sin embargo, la metirapona quizá exacerbe la virilización en la mujer. El análogo de somatostatina (octreótido), administrado por vía parenteral varias veces al día, suprime la secreción de ACTH en cerca de la tercera parte de los casos. (17) Existe un grave riesgo de aparición del Síndrome de Nelson, que se presenta en un 5 a un 10% de los pacientes sometidos a suprarrenalectomía por enfermedad de Cushing. El riesgo es menor en pacientes sometidos a irradiación de la hipófisis y es muy bajo en pacientes > 35 años de edad en el momento de la operación. En el síndrome de Nelson, la hipófisis continúa expandiéndose y causa un notable aumento en la secreción de ACTH y de hormona β estimulante de los melanocitos, lo que produce una intensa hiperpigmentación. (5) Pronóstico El mejor pronóstico de recuperación total es para pacientes en quienes se elimina un adenoma suprarrenal benigno y que sobreviven a la insuficiencia suprarrenal posterior a la suprarrenalectomía. Es probable que los pacientes con enfermedad de Cushing sanen mediante cirugía transesfenoidal, pero existe una frecuencia de fallas aproximada de 10 a 20%. Aquellos individuos que presentan remisión total después de cirugía transesfenoidal tienen alrededor de 15 a 20% de posibilidad de reincidencia en los 10 años siguientes. Inclusive los pacientes a quienes se efectúa suprarrenalectomía bilateral pueden presentar reincidencia de hipercortisolismo por crecimiento de un remanente suprarrenal, estimulado por las grandes cifras de ACTH que se presenta después de la suprarrenalectomía. El Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 47 pronóstico para los tumores ectópicos productores de ACTH depende del tipo de agresividad y del estado de las metástasis del tipo particular de tumor. (17) ENFERMEDAD CRÓNICA) DE ADDISON (INSUFICIENCIA CORTICOSUPRRRENAL La enfermedad de Addison es un trastorno raro ocasionado por destrucción de las cortezas suprarrenales. Se caracteriza por la deficiencia crónica de cortisol, aldosterona y andrógenos suprarrenales y causa pigmentación cutánea oscura que puede ser llamativa o sutil. La depleción de volumen y de sodio, así como el exceso de potasio se presentan tardíamente en la insuficiencia suprarrenal primaria. En contraste, si la insuficiencia suprarrenal crónica es secundaria a la insuficiencia hipofisaria (atrofia, necrosis, tumor) persiste la producción de mineralocorticoides (controlada por el sistema renina angiotensina) y no se presenta hipopotasemia. Además, si la ACTH no aumenta, no hay alteraciones pigmentarias en la piel. (17) Los casos más avanzados son fáciles de diagnosticar, pero el reconocimiento de las fases precoces de la enfermedad plantea verdaderos problemas. (16) La insuficiencia corticosuprarrenal primaria es relativamente rara, aparece a cualquier edad y afecta a ambos sexos con la misma frecuencia. (16) El término “enfermedad de Addison” debe reservarse para la insuficiencia suprarrenal debida a enfermedad suprarrenocortical. La destrucción autoinmunitaria de las glándulas suprarrenales es la causa más frecuente de la enfermedad de Addison en EUA (y es responsable de casi 80% de los casos espontáneos.) Puede ser aislada o bien presentarse como parte del síndrome poliglandular autoinmunitario (SPA). El SPA tipo I se inicia en la infancia temprana con candidiasis mucocutánea crónica seguida de hipoparatiroidismo y enfermedad de Addison entre los 10 y 12 años de edad. El SPA tipo II consiste en enfermedad de Addison, enfermedad tiroidea (hipertiroidismo 5%, hipotiroidismo 10%) o diabetes insulinodependiente (10%). Este síndrome también se conoce como “poliendocrinopatía autoinmunitaria-candidiasis-displasia ectodérmica (PACDE)". La combinación de enfermedad de Addison e hipotiroidismo se conoce como síndrome de Schmidt. (17) Otros problemas que se aprecian con la enfermedad autoinmunitaria de Addison son vitíligo, insuficiencia ovárica primaria prematura (40% de las mujeres menores de 50 años), insuficiencia testicular (5%) y anemia perniciosa (4%). (17) La tuberculosis era la causa principal de dicha enfermedad antes (70-90% de los casos). La relación es rara en la actualidad en EUA, pero frecuente donde la tuberculosis prevalece. (16, 17) Puede producirse hemorragia suprarrenal bilateral en pacientes que se encuentran bajo anticoagulantes, durante la cirugía a corazón abierto y durante otros traumatismos mayores. También puede aparecer cerca de una semana posoperatoria, presentándose con dolor, fiebre y choque. (17) Los casos raros incluyen carcinoma metastásico, coccidiodomicosis, histoplasmosis, infección por citomegalovirus (más frecuente en pacientes con SIDA), gomas sifilíticos, esclerodermia, enfermedad amiloide y hemocromatosis.(17) También se ha descrito afectación suprarrenal por Mycobacterium cellulare, criptococcus y sarcoma de Kaposi. Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 48 (16) La suprarrenoleucodistrofia es un trastorno genético ligado a X que afecta a cerca de uno en 20 000 varones. La enfermedad de Addison puede producirse años antes del inicio de síntomas neurológicos. (17) Los adultos con deficiencia hereditaria de cortisol debida a insensibilidad suprarrenal a la ACTH, pueden desarrollar acalasia, alacrima y enfermedad neurológica (síndrome de Allgrove). La deficiencia de cortisol suele presentarse durante la infancia, pero puede notarse por primera vez en la tercera década de la vida. Los adultos con hipoplasia suprarrenal congénita pueden tener hipogonadismo hipogonadotrópico, miopatía y pérdida de la audición de alta frecuencia. (17) Los pacientes con defectos hereditarios en las enzimas suprarrenales para la síntesis de cortisol desarrollan “hiperplasia suprarrenal congénita” a causa de la estimulación por ACTH. El defecto enzimático más común es P450c21 (21-hidroxilasa). Los sujetos con enzimas P450c21 gravemente defectuosas manifiestan deficiencia de mineralocorticoides (pérdida de sales), además de cortisol deficiente y andrógenos excesivos. Las mujeres con defectos enzimáticos más leves tienen cortisol adecuado, pero desarrollan hirsutismo durante la adolescencia o la edad adulta, y se dice que tienen hiperplasia suprarrenal congénita de “inicio tardío” (17) Cuadro clínico Signos y síntomas Los síntomas son debilidad y fatiga, pérdida de peso, mialgias, artralgias, fiebre, anorexia, náusea y vómito, ansiedad e irritabilidad mental. Algunos de estos síntomas pueden ser causados por altos valores séricos de IL-6. Las alteraciones pigmentarias consisten en oscurecimiento difuso en las partes no expuestas y en las expuestas o múltiples pecas. La hiperpigmentación es especialmente prominente en nudillos, codos, rodillas y parte posterior del cuello, así como en palmas y lecho ungueal. Los pezones y las areolas tienden a oscurecerse. También se oscurece la piel en áreas de presión tales como las líneas de cinturón y en los glúteos. Las cicatrices nuevas se pigmentan. Algunos pacientes tienen también vitíligo (10%) y son frecuentes también los cambios emocionales. Cuando hay hipogolicemia, quizá empeore la debilidad del paciente y su función mental, lo que rara vez lleva al coma y es posible la presencia de manifestaciones de otras enfermedades autoinmunitarias. Los pacientes tienden a ser hipotensos y ortostáticos, cerca de 90% tiene presiones arteriales sistólicas menores de 110 mm Hg; y la presión arterial superior a 130 mm Hg es rara. Otros datos incluyen corazón pequeño, hiperplasia de tejidos linfoides y escasez de vello axilar y púbico (especialmente en mujeres.) (17) Una crisis suprarrenal se caracteriza por una astenia profunda, dolores intensos en el abdomen, la espalda o las piernas, colapso vascular periférico y, finalmente, claudicación renal con azoemia. La temperatura corporal puede ser inferior a la normal, aunque a menudo existe una intensa hipertermia debida a una infección. La crisis se desencadena la mayoría de las veces por una infección aguda (especialmente con septicemia), traumatismos, procedimientos quirúrgicos y pérdida de Na+ debido a sudoración excesiva durante épocas de calor. (5) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 49 Cuadro 7 Frecuencia de los signos y síntomas del síndrome de la enfermedad de Addison (porcentaje) (16) ______________________________________________________________________ Debilidad Pigmentación de la piel Pérdida de peso Anorexia, náuseas, vómitos Hipotensión (< 110/70) Pigmentación de mucosas Dolor abdominal Necesidad imperiosa de sal Diarrea Estreñimiento Síncope Vitíligo 99% 98% 97% 90% 87% 82% 34% 22% 20% 19% 16% 9% Complicaciones Es más probable que se produzca cualquiera de las complicaciones de la enfermedad subyacente (por ejemplo, tuberculosis) y el paciente es sensible a infecciones intercurrentes que pueden precipitar una crisis. Las enfermedades autoinmunitarias relacionadas son comunes. (17) Tratamiento A. Terapéutica específica El tratamiento de restitución debe incluir una combinación de glucocorticoides y mineralocorticoides. En los casos leves puede ser adecuada la hidrocortisona sola. (17) 1. Hidrocortisona: es el medicamento de elección. La mayoría de los pacientes addisonianos se mantienen bien con 15-25 mg de hidrocortisona por vía oral diario en dos dosis, 2/3 por la mañana y 1/3 por la tarde o temprano por la noche. Algunos pacientes responden mejor a la prednisona a dosis cercanas a 3 mg en la mañana y 2 mg al atardecer. Sin embargo, en muchos enfermos no hay suficiente efecto sobre la retención de sal y requieren complementos de fludrocortisona o sal adicional en la dieta. (17) 2. Acetato de fludrocortisona: Este medicamento tiene un efecto potente de retención de sodio. La dosis es de 0.05 a 0.3 mg por vía oral diario o cada tercer día. Si se presenta hipotensión postural, hiperpotasemia, y pérdida de peso, se aumenta la dosis. Cuando sobreviene aumento de peso, edema, hipopotasemia o hipertensión, se disminuye. (17) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 50 B. Medidas generales Hay que tratar todas las infecciones de inmediato y de modo vigoroso, además aumentar la dosis de cortisona de manera adecuada. También se incrementan los glucocorticoides en casos de traumatismo, cirugía, procedimientos diagnósticos complicados u otras formas de estrés. La dosis máxima de hidrocortisona para un estrés intenso es de 50 mg, intravenosa o intramuscular, cada seis horas. En situaciones de estrés menor se emplean dosis menores, por vía oral o parenteral. La dosis se regresa a la ordinaria al ceder el estrés. (17) Los pacientes con suprarrenoleucodistrofia reciben tratamiento dietético y transplante de médula ósea. (17) Pronóstico Con la terapéutica de restitución adecuada, la esperanza de vida de los pacientes con enfermedad de Addison se ha prolongado de manera notable. La tuberculosis activa responde a la quimioterapia específica. La supresión del tratamiento o el aumento de las demandas por infección, traumatismo, cirugía u otros tipos de estrés pueden precipitar una crisis con un súbito desenlace mortal, a menos que se utilicen grandes dosis de corticosteroides parenterales. Sin embargo, con el tratamiento adecuado es posible que la mayoría de los pacientes tengan una vida activa plena. (17) Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 51 REFERENCIAS BIBLIOGRÁFICAS 1. Berne R, Levy M. Fisiología. 1998. 2ª edición. Harcourt Brace. Madrid, España. 2. Goodman y Gilman. Las bases farmacológicas de la Terapéutica.2003. 10ª edición. McGraw-Hill Interamericana. México D.F. 3. Sweetman S. Martindale. The Complete Drug Reference. 2002. 33th Edition. The Pharmaceutical Press. London, England. 4. Drug Information for the Health Care Professional (USP.DI). 2003. Volumen I. 23st Edition. Rand Mc Nally. Massachusetts, USA. 5. Beers M, Berkow R. Manual Merck de Diagnóstico y Terapéutica. 1999. 10ª edición. Ediciones Harcourt S.A. Madrid, España. 6. Carey Ch, Lee H, Woeltje K. Manual Washington de Terapéutica Médica. 1999. 10ª edición. Masson S.A. España. 7. Consejo General de Colegios Oficiales de Farmacéuticos. Guía de Prescripción. 1998. España. 8. Chrousos G. The Hypothalamic-Pituitary-Adrenal Axis and Immune-Mediated Inflammation. N Engl J Med. 1995; 332:1351-1363. 9. Newton R. Molecular Mechanisms of Glucocorticoid Action: What is Important? Thorax. 2000; 55 (7): 603-613. Idis Nº449772 10. Barnes P. New Directions in Allergic Diseases: Mechanisms-Based AntiInflammatory Therapies. J Allergy Clin Immunol. 2000; 106 (11): 5-16. Idis Nº450460 11. Cooper M, Stewart P. Corticosteroid Insufficiency In Acutely Ill Patients. N Eng J Med. 2003; 348 (8): 727-734. Idis Nº493136 12. Shepeherd J, Duddleston D, Hicks G, et al. Asthma: A Brief Overview. Am J Med Sci. 2002; 324 (4): 174-179. Idis Nº487656 13. Streetman D, Bhatt-Mhta V, Johnson C. Management of Acute, Severe Asthma in Children. Ann Pharmacotherapy. 2002, 36 (8): 1249-1260. Idis Nº485221 14. Taylor R, Hancox J. Interactions between corticosteroids and beta agonists. Thorax. 2000; 55 (7): 595-602. Idis Nº 449771 15. Walsh L, Lexis S, Wong C, et al. The Impact of Oral Corticosteroid Use on Bone Mineral Density and Vertebral Fracture. Am J Resp Crit Care Med. 2002; 166 (5): 691-695. Idis Nº487709. 16. Isselbacher KJ, Braunwald E, Wilson J. Principios de Medicina Interna. Volumen II. 13a Edición. Madrid, España: Interamericanan Mc Graw-Hill. 1994 17. Tierney L, McPhee y Papadakis, M. Diagnóstico clínico y tratamiento. 34a edición. México D.F., México: Editorial El Manual Moderno, S.A. de C.V. 1999 18. Capell H. Selected side effects: 5. Steroid therapy and osteonecrosis. Prescriber`s J. 1992; 32: 34-34. 19. Knight A. Images in clinical medicine: corticosteroid osteonecrosis. N Eng J Med. 1995; 333: 130. 20. Luker B, Raisz L. Glucocorticoid-induced osteoporosis: pathogenesis and management. Ann Intern Med. 1990; 112: 352-364. Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 52 21. American College of RheumatologynAd Hoc Committee on GlucocorticoidInduced Osteoporosis. Recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheum. 2001; 44: 1496-1503 22. Consejo General de Colegios Oficiales de Farmacéuticos. Base de Datos del Medicamento y Parafarmacia (BOT). Versión CD- ROM. Página oficial: www.portalfarma.com 23. Hebel S, Burnham T, Bell L, et al. Drug Facts and Comparasions. Pocket Versión. Sexta Edición. Editorial Facts and Comparasions. Missouri, 2002. 24. Varis T, Kivisto T, Neuvonen J. The effect of itraconazole on the opharmacokinetics and pharmacodynamics of oral prednisolone. Eur J Clin Pharmacol. 2000; 56(1): 57-60. Idis Nº 446826. 25. Fost A, Leung M, Martin J, et al. Inhibition of methylprednisolone elimination in the presence of clarithromycin therapy. J Allergy Clin Immunol. 1999; 103 (6): 1031-1035. Idis Nº 429998. 26. Chong H, Seeger D, Franklin C. Clinically relevant differences between the statins: implications for therapeutic selection. AM J Med. 2001; 111 (5): 390-400. Idis Nº 471063. 27. Schwartz I, Mukhopadhay S, Porras G, et al. Effect of Rofecoxib on prednisolone and prednisone pharmacokinetics in healthy subjects. J Clin Pharmacol. 2003; 43 (2): 187-192. 2003. Idis Nº 494429. 28. Finch K, Chrisman R, Baciewicz M, et al. Rifampicin and Rifabutin drug interactions: an update. Arch Intern Med. 2002; 162 (9): 985-992. Idis Nº 481409. 29. Wyngaarden y Smith. Tratado de medicina interna. Vol. II. 18ª. Edición. México: Interamericana McGraw-Hill. 1991 Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr 53 ANEXO ALGUNOS GLUCOCORTICOIDES DISPONIBLES EN EL MERCADO Glucocorticoide Amcinonida Beclometasona Betametasona Betametasona+ác salicílico Clobetasol Clobetasona Deflazacort Desonide Dexametasona Fludprednideno Fludprednideno+ác salicílico Flumetasona+ác salicílico Fluocinonida Fluorometolona Fluorometolona+Tetrizolina Fluticasona Halcinonida Hidrocortisona Metilprednisolona Mometasona Prednicarbato Nombre Comercial® Visderm Beconase, Beclo-Rino, Aldecina, Qvar Dereme Menaderm simple Celestone Diprospan Valerpan Diprosone, Betnovate, Bezonac, Celestoderm, Nobetzona Diprosalic Dermovate Eumovate Calcort Flezacor Tridesilon, Desowen, Dermosupril Alin Alergodex Mefamesona Dexamas Dexagil Dexaton Decadron, Maxidex, Cebenex Supracortin Salicortin Losalen Topsym FML, Aflarex Efemolina Flixonase Cutivate Halciderm Solu-Cortef Cort-Dome, Lacticare HC, Efficort Lipo, Gutisona, Nutracort Medrol Solu-Medrol, Depo-Medrol Nasonex, Uniclar Elocom, Elomet, Mometa, Mometzona Topimax Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr Presentación Crema Aerosol nasal Crema, gel, loción Crema Tabletas, inyectable, jarabe, gotas orales Inyectable Inyectable Crema Ungüento, loción Ungüento Crema Tabletas, gotas Tabletas Crema Inyectable, tabletas Tabletas Inyectable Inyectable Inyectable Inyectable Colirio Crema Crema, solución Crema Crema Colirio Colirio Aerosol nasal Crema Crema Inyectable Crema, loción Tabletas Inyectable Aerosol nasal Crema Crema 54 Prednisolona Prednisona Triamcinolona Triamcinolona Prelone, Fisopred Prednefrin, Sophipren, Econpred Meticorten, Gutisona Kenacort, Ledecort Nasacort Serie de Actualización Profesional 2003 CIMED-Centro Nacional de Información de Medicamentos, 20 años a su servicio INIFAR-Facultad de Farmacia, Universidad de Costa Rica. Teléfonos: (506) 207 5495 – 207 3330 – 207 3313. Fax: (506) 207 5700. Email: cimed@farma.ucr.ac.cr Jarabe Colirio Tabletas Inyectable Aerosol nasal 55