Inmunidad Innata
Anuncio

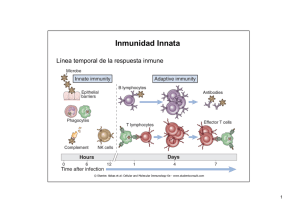
Inmunidad Innata Línea temporal de la respuesta inmune Sistema de Complemento Componente termosensible del plasma con la capacidad para aumentar la opsonización de microorganismos mediada por anticuerpos Activación en cascada por clivaje de precursores: AMPLIFICACION Tres vías de activación Sistema de Complemento Sistema de Complemento Cual es la consecuencia? Producción de inflamación Opsonización de microorganismos Efecto citotóxico directo sobre microorganismos Potenciación de la respuesta B Sistema de Complemento La activación del complemento por cualquiera de las tres vías conduce a: La generación de C3a y quimiotáctica y anafiláctica C5a que poseen actividad La generación de C3b y C4b que actúan como opsoninas La generación del complejo de ataque lítico (C5-C9) ¿En que se diferencian las tres vías? Clásica Activada por anticuerpos (IgM, IgG1-3) unidos al antígeno Actúa en etapas mas tardías de la infección ya que se empieza a observar una concentración mayor de anticuerpos a los 4-7 días post-infección Alterna Se activa, en forma directa, por ciertas estructuras presentes en la superficie de los microorganismos Opera en etapas tempranas cuando el organismo aún no ha podido generar grandes cantidades de anticuerpos ¿En que se diferencian las tres vías? De la lectinas Se activa por lectinas que se unen a la superficie de los microorganismos Todas las vías de activación conducen a la generación del complejo proteico denominado C3 convertasa que es central en la cascada de activación Vía Clásica Activada por anticuerpos circulantes unidos a antígenos Los anticuerpos libres NO la activan Complejo C1: Inicia cascada Vía Clásica Vía Clásica C1q se une a IgM o IgG1-3 que han sufrido un cambio conformacional por unión al antígeno IgM Polimérica C μ4 IgM forma pentameros y hexameros C μ3 Cμ2 Cμ 1 N.B. Only constant heavy chain domains are shown Cμ3 binds C1q to initiate activation of the classical complement pathway Cμ1 binds C3b to facilitate uptake of opsonised antigens by macrophages Cμ4 mediates multimerisation (Cμ3 may also be involved) Cambio de conformación de IgM mediada por el antígeno Planar or ‘Starfish’ conformation found in solution. Does not fix complement Staple or ‘crab’ conformation of IgM Conformation change induced by binding to antigen. Efficient at fixing complement Activación de la vía clásica Vía Clásica C1q activa a C1r que cliva y activa a C1s C1s cliva a C4 y C4b se une covalentemente a la superficie de la célula C4b unido a la membrana une a C2 que a su vez es clivado por C1s en C2a (fase fluida) y C2b. C2b forma con C4b unido en la membraba el complejo C3 convertasa Vía Clásica C3 convertasa escinde a C3 en: C3a (fase fluida) y C3b C3b se compleja con la C3 convertasa y forma el complejo C5 convertasa C5 convertasa cliva a C5 en: C5a (fase fluida) y C5b que inicia la formación del poro lítico Vía Clásica: RESUMEN Se activa por anticuerpos Se activa mas tardíamente C3 convertasa puede activar centenares de moléculas C3: AMPLIFICACION Vía Alterna La activación depende de la opsonización del microorganismo por C3b Ocurre en ausencia de anticuerpos La cascada de activación depende de si se activó o no la vía clásica: LA ACTIVACION DE LA VIA CLASICA ACTIVA LA VIA ALTERNA Vía Alterna Componentes: C3 Factor B Factor D Properdina Vía Alterna Si hay activación de la vía clásica se produce C3b por acción de la C3 convertasa clásica C3b unida covalentemente a la superficie celular se une al Factor B y este es clivado por el Factor D en Ba y Bb Bb queda unido a C3b formando C3bBb que es estabilizado por properdina : C3 convertasa de la vía alternativa C3bBb cliva a C3 generando mas C3b que amplifica la señal Vía Alterna Vía Alterna ¿Qué ocurre si no hay activación de la vía clásica? En fase fluida hay clivaje espontáneo de C3 a C3b y C3a en muy baja proporción C3b puede unirse a la superficie de células propias y extrañas lo que le permite formar la convertasa C3 de la vía alterna ¿Cómo distingue propio de extraño? Vía Alterna Vía Alterna Los inhibidores se encuentran en la membrana de células propias Inhiben la formación de la C3 convertasa Factor I: cliva a C3b unida a la membrana formando iC3b que es incapaz de continuar la cascada Vía Alterna Inhibición por desplazamiento Vía Alterna Factor H: Inhibe la formación de la C3 convertasa alterna Factor H: Soluble ¿Cómo reconoce lo propio? Solo se asocia a la membrana cuando esta posee altas concentraciones de ácido siálico: esto ocurre preferentemente en células eucariotas La incapacidad del Factor H de asociarse con la superficie de un microorganismo es la condición crítica permisiva que conduce a la activación de la vía alterna Vía de las Lectinas Activación de C4 y C2 en ausencia de anticuerpos y el complejo C1 Componentes: MBL (lectina que une manosa) MASP-1 MASP-2 MASP-1 y MASP-2 son proteasas que una vez unidas a MBL clivan a C4 y C2 que forman la convertasa C3 Vía de las Lectinas Semejanza estructural Lectinas Clásica Mecanismo de acción de C3 Marcado radiactivo de C3 Incubación de C3* con glóbulos rojos de oveja Solubilización de las membranas y electroforesis desnaturalizante Coomassie Autoradiografía a. Membranas sin marcar b. Membranas incubadas con C3 marcada c. C3 marcada d. Sobrenadante del tratamiento con C3 marcada Marcado radiactivo de C3 y de la membrana de los glóbulos rojos con dos isótopos de vida media distinta Incubación de C3* con glóbulos rojos de oveja marcados o no Solubilización de las membranas y electroforesis desnaturalizante a. Marca en C3 b. Doble marca c. Marca en glóbulos rojos d. Sobrenadante de la reacción ¿Cuál es la naturaleza de la unión? Marca radiactiva de alto peso molecular resistente a: Extracción salina Congelado/descongelado pH Detergentes Urea en la electroforesis Tratamiento con hidroxilamina Unión de tipo ester ¿Cómo afecta la actividad hemolítica si se evita la unión covalente? Inactivación con hidroxilamina (amina primaria) Medición de actividad hemolítica y de unión al glóbulo rojo Correlación de orden 1 entre inactivación y unión El tratamiento no afecta el procesamiento C3 ¿Cómo distinguir que polipéptido queda unido? La radiactividad se va al polipéptido α Modelo propuesto en la publicación original Resumiendo Fase final de la activación del complemento: formación del poro lítico (MAC) Componentes: C5, C6, C7, C8 y C9 Ensamblado del MAC (Membrane Attack Pore) El poro posee alrededor de 100 Å de diámetro y permite el libre paso de iones y agua generando lisis El canal se forma por la polimerización de C9 Componentes inhibitorios de la formación del MAC CD59 Proteína de membrana unida a glicofosfatidilinositol que se expresa en muchos tipos celulares pero está ausente en los microorganismos Se une a C8 e inhibe la polimerización de C9 Componentes inhibitorios de la formación del MAC Proteína-S Proteína plasmática que impide la inserción de C5b,6,7 en la membrana Actúa secuestrando el complejo La proteína-S secuestra complejo libre que es capaz de ensamblar el poro en membranas en las cuales no se ha iniciado la cascada Funciones del complemento Promover la fagocitosis de las células sobre las cuales se ha activado Estimular el proceso inflamatorio Inducir la lisis directa del microorganismo Opsonización y fagocitosis Los fragmentos C3b, iC3b y C4b unidos al microorganismo actúan como opsoninas Existen receptores específicos presentes en neutrófilos y macrófagos para estos fragmentos En fase sólida En suspensión Efecto sinérgico de IgG y C3b Estimulación de la respuesta inflamatoria Los fragmentos C3a, C4a y C5a inducen una inflamación aguda activando mastocitos y neutrófilos Estos péptidos actúan sobre receptores específicos presentes en una variedad de células para mediar su acción C5a es un potente inductor de la motilidad, adhesión y producción de productos reactivos del oxígeno por parte de neutrófilos Estimulación de la respuesta inflamatoria Los pequeños péptidos C3a, C4a y C5a pueden inducir vasodilatación e inflamación local C5a>C3a>C4a Aumentan el flujo sanguíneo, permeabilidad vascular y la unión de fagocitos al endotelio El aumento de flujo sanguíneo aumenta la acumulación de fluidos que a su vez incrementa el drenaje linfático que llevan al patógeno y sus antígenos al nodos linfáticos cercanos Estimulación de la respuesta inflamatoria El fragmento C3b generado por la C3 convertasa es a su vez clivado en C3d y C3g C3d y C3g son reconocidos por el receptor CR2 y funcionan estimulando la respuesta humoral aumentando la activación de los linfocitos B y promoviendo la captura de complejos antígeno-anticuerpo en los centros germinales Activación de linfocitos B por complemento Enfermedades por alteración del complemento • Rare • C1esterase deficiency with angioneurotic edema• Deficiencies in C2, C4 associated with AI diseases like Lupus • Homozygous C3 is lethal • Deficiencies in the alternate path very rare • Individual component deficiency in C5,C6,C7, C8 and C9 are associated with Neisserial bacteremia Activación de la respuesta inmune innata Respuesta inmune innata inducida Depende del patrón de citoquinas y quimiocinas que se producen en respuesta al patógeno Si esta respuesta no es suficientemente efectiva para limpiar la infección al menos la contiene hasta que se desarrolle una respuesta inmune adaptativa robusta Activación de la respuesta inmune innata Macrófago activado: cuando se “encuentra” con un microorganismo La combinación de receptores que el patógeno activa determina el patrón de citoquinas inducidas y por la tanto el tipo de respuesta Tumor Necrosis Factor-α (TNF-α) Citoquina muy importante que gatilla la contención local de la infección pero genera shock séptico si es liberado en forma sistémica Si la infección se hace sistémica (en sangre) los macrófagos liberan TNF-α que actúan sobre el hígado, bazo y otros tejidos induciendo vasodilatación y coagulación generalizada Ratones mutantes para TNF-α son resistentes al shock séptico pero incapaces de controlar infecciones locales Diferencias entre TNF-α local o sistémico Pirógenos endógenos TNF-α, IL-1,IL-6 Altas temperaturas Aumentan la temperatura corporal Inhibe el crecimiento microbiano Respuesta inmune adaptativa mas robusta Se protegen las células propias del efecto negativo del TNF-α Toll-like receptors (TLRs): cascada de señalización En sepsis por gram negativas: LPS es el principal inductor de TNF-α y por lo tanto responsable del shock séptico Aislamiento del gen responsable del shock séptico Ratones resistentes al shock séptico inducido por LPS Se mapea la mutación por genética clásica: Tlr4 Primera descripción de un Toll-like receptor humano Búsqueda in silico en mamíferos de un dominio similar al dominio Tir de los Toll de plantas e insectos Activación de NFκΒ frente a la transfección con hToll dominante positivo ¿Cómo se identifica MyD88? Componente central en la cascada de activación Dominio Tir del receptor de IL-1se sabia que usaba como adaptador el dominio Tir del MyD88 NF-κΒ Inducción de NF-κΒ en presencia de un MyD88 dominante negativo MyDNM: sin el dominio Tir Precipitación con anti- hToll Co-inmunoprecipitación de hToll con MyD88 MyD88-/- no puede activar citoquinas pro-inflamatorias MyD88-/- no tiene afectado la expresión de varios receptores del macrófago Producción de diferentes citoquinas por parte de macrófagos frente a un desafío con LPS Proliferación de linfocitos B frente a un desafío con LPS