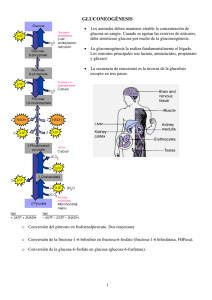
glucolisis y gluconeogenesis
Anuncio
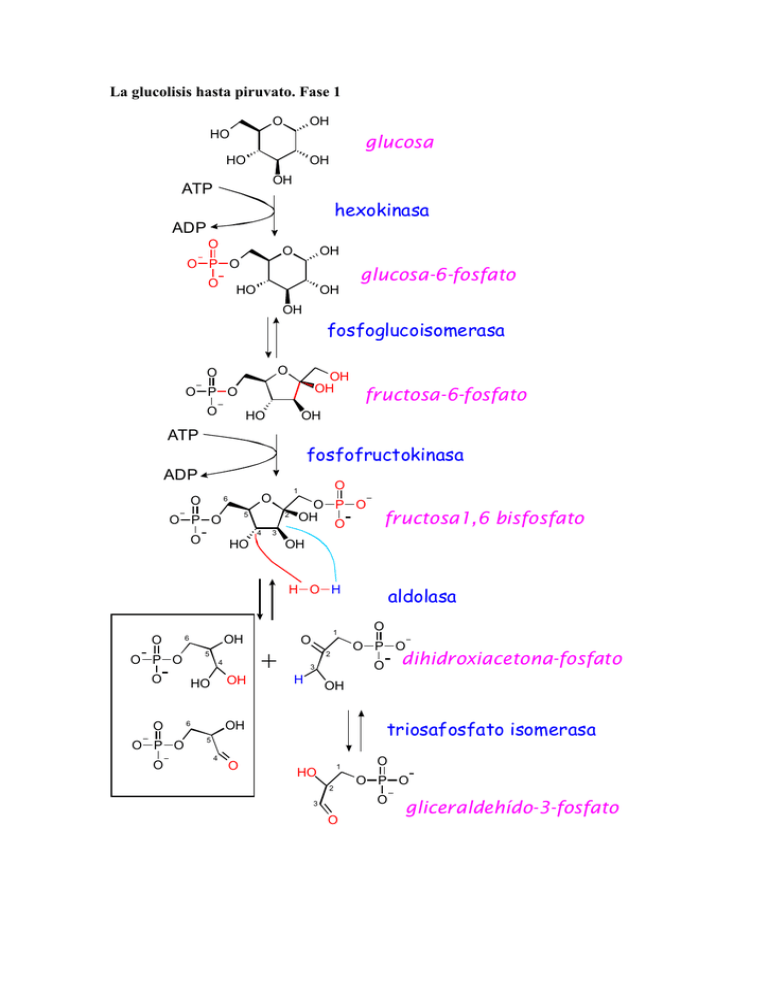
La glucolisis hasta piruvato. Fase 1 O HO OH glucosa HO OH OH ATP hexokinasa ADP O O O P O O OH HO OH glucosa-6-fosfato OH fosfoglucoisomerasa O O OH OH O P O O HO fructosa-6-fosfato OH ATP fosfofructokinasa ADP O 5 O P O 2 4 O O 1 O 6 3 HO O P O OH O fructosa1,6 bisfosfato OH H O H O 5 O P O 4 O O O P O O OH 6 OH HO + 1 O OH triosafosfato isomerasa 5 4 O dihidroxiacetona-fosfato O 3 OH 6 O O P O 2 H aldolasa 1 HO 2 O O P O O 3 O gliceraldehído-3-fosfato Fase II: O H2C O P O HC Pi NAD gliceraldehído-3-fosfato O HO CH x2 O gliceraldehído-3-fosfato deshidrogenasa O NADH H2C O P O O HO CH O O P C 1,3 bis fosfoglicerato O O O ADP fosfoglicerokinasa ATP O H2C O O HO CH C O P O 3-fosfoglicerato O fosfogliceromutasa H2C OH O O P O C O O HOH 2-fosfoglicerato O CH enolasa CH2 O O P fosfoenollpiruvato O C O ADP C O O piruvato kinasa ATP CH3 CH2 HO C O C C C O O O piruvato O Gluconeogénesis a partir de piruvato. Ruta hasta las triosasfosfato O 6 OH O P O 5 H OH NADH NADH ADP O C O P O C O H2C NAD OH O 3 O HO O P O 2 4 O NAD + Pi O 1 O ADP GlicerolKinasa ATP ATP H2C OH HO CH G l ic ero CH2 O O P O C O C O H2C OH lípid GDP + CO 2 os O GTP Fosfoenolpiruvato Carboxikinasa (PEPCK) mitocondrial y citosólica O O O O C C C C O H2 Piruvato Carboxilasa (mitocondrial) ADP + Pi Asp Asn Phe Tyr Ile Met Val Arg Glu His Pro ATP + CO3 H- O O NADH NAD OH O H3C C C O H lactato H3C C C O s C y er S ly G hr T p Tr H2N O H3C C C O H Ala Regulación de la glucolisis y gluconeogénesis en mamíferos La gluconeogénesis es importante sólo en hígado y, en menor medida, en el riñón. En los restantes tejidos tiene menor importancia, y en el músculo sirve fundamentalmente para rellenar las reservas de glucógeno. En el hígado y riñón la gluconeogénesis continúa hasta glucosa, dado que tienen glucosa-6-fosfatasa, que hidroliza la glucosa y permite su exportación. En el esquema siguiente se muestran sólo las reacciones sometidas a regulación. El sistema glucolisis/gluconeogénesis hepético está regulado en función de la homeostasis de glucosa, más que por las necesidades energéticas del propio órgano. En otros casos (levaduras, por ejemplo) la situación es completamente distinta, y la regulación depende de la relación ATP/ADP Enzima bifuncional: un solo polipéptido de 55 kD Fructosa-6-fosfato PFK-2/FBPasa 2 PP1 defosforilada PK A AMP P fosforilada AMP Fructosa 2,6 bisfosfato PFK-1 ATP citrato FBPasa 1 Fructosa 1,6 bisfosfato Fosfoenol piruvato P fosforilada Piruvato Kinasa L (inactiva) La síntesis de esta proteína se estimula por el glucagón PP1 PK A Alanina defosforilada Piruvato Kinasa L Piruvato Acetil-CoA PEPCK Oxalacetato Piruvato Carboxilasa PK: proteín kinasa A PP1: proteín fosfatasa 1 La hormonas hormonas glucagón e insulina presentan actividades opuestas: el glucagón activa la PKA e inhibe la PP1, incrementando la fosforilación y por ello la gluconeogénesis La insulina incrementa la defosforilación (activa a la PP1), y activa la glucolisis. En el músculo la situación es muy diferente: 1) No parece actuar “in vivo” el sistema de la fructosa 2,6 bisfosfato 2) La isoenzima muscular de la piruvato kinasas (PK M) no está sometida a regulación ni alostérica ni por modificación covalente. 3) El principal factor que marca la velocidad de la glucolisis muscular es la concentración de glucosa-6-fosfato.