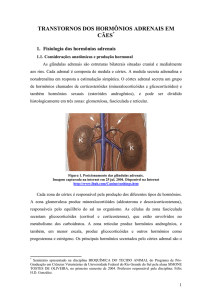
Cortex Supra-Renal: Anatomia, Embriologia e Fisiologia
Anuncio

Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 71 ... 76 Cortex Supra-Renal: Anatomia, Embriologia e Fisiologia Rui Tiago Cardoso1, Isabel Mangas Palma2 1 2 Aluno do 5º ano Curso de Medicina, Instituto de Ciências Biomédicas Abel Salazar Assistente Hospitalar de Endocrinologia Diabetes e Metabolismo, Serviço de Endocrinologia do Hospital Santo António, Centro Hospitalar do Porto Correspondência: Isabel Mangas Palma › isabel.m.mangas@gmail.com RESUMO As glândulas supra-renais têm um papel central nos mecanismos adaptativos do ser humano ao meio ambiente, bem como na regulação de diferentes processos fisiológicos, estando em estreita inter-relação com os demais órgãos endócrinos e com o sistema nervoso autónomo. No presente artigo abordamos, a título de revisão, a anatomia e embriologia das glândulas supra-renais e a fisiologia das hormonas produzidas e secretadas na região cortical. PALAVRAS-CHAVE Supra-renal; Cortisol; Aldosterona; Dehidroepiandrosterona. SUMMARY The adrenal glands play a very important role in the adaptive mechanisms of humans to the environment and in regulation of different physiologic processes. They are already in near interrelation with the other endocrine organs and the autonomous nervous system. In this article we focus the anatomy, embryology of the adrenal glands and the physiology of the hormones produced and secreted in the cortex. KEY WORDS Adrenal; Cortisol; Aldosterone; Dehydroepiandrosterona. ANATOMIA DAS GLÂNDULAS SUPRA – RENAIS As glândulas supra-renais localizam-se entre a face supero-medial dos rins e o diafragma. São envolvidas pela fáscia renal, através da qual se fixam ao diafragma, estando separadas dos rins pelo tecido fibroso da cápsula que as envolve1. A glândula supra-renal direita tem forma triangular, situa-se anterior ao dia- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO fragma, contacta com a veia cava inferior antero – medialmente e com o fígado antero - lateralmente1. A glândula supra-renal esquerda tem forma semi-lunar e tem relações anatómicas com o baço, estômago, pâncreas e com o pilar esquerdo do diafragma1. Cada glândula apresenta um cortex e uma medula, anatómica e funcionalmente distintos. Pesam cerca de quatro a seis gramas, 71 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 ocupando o cortex 80 a 90% do seu volume2. O cortex tem uma origem embrionária semelhante à das gónadas. É constituído por três zonas histológicas, denominadas de acordo com a disposição das células secretoras: zona glomerulosa, zona fasciculada e zona reticular2. A zona glomerulosa, zona externa do cortex supra-renal corresponde a aproximadamente 15% do mesmo e as suas células, agrupadas em “ninhos”, são pequenas, apresentando núcleos também pequenos relativamente às outras zonas. É responsável pela secreção de hormonas mineralocorticóides (aldosterona e desoxicorticosterona), principalmente a aldosterona. A aldosterona é secretada pela zona glomerulosa sob o controlo de três principais secretagogos, angiotensina II, potássio e em menor extensão ACTH. A produção desta hormona é exclusiva da zona glomerulosa uma vez que apenas aí se encontra a sintetase da aldosterona. A corticosterona e desoxicorticosterona, sintetizadas na zona fasciculada e glomerulosa, actuam também como mineralocorticoides. A actividade da aldosterona é controlada pelo sistema renina-angiotensina, por sua vez regulado pela mácula densa do túbulo contornado distal. As baixas concentrações plasmáticas de sódio e elevadas de potássio também podem estimular directamente a secreção de aldosterona a partir das células da zona glomerulosa3. A aldosterona liga-se a receptores intracelulares específicos, encontrados em poucos tecidos alvo (rim e epitélios de transporte do cólon e da bexiga), provocando a transcrição de DNA que codifica proteínas canais de sódio – e permite a reabsorção deste catião. É de realçar que a aldosterona apresenta um mecanismo distinto de acção, independente da transcrição de genes, que ocorre por estimulação do trocador iónico sódio-hidrogenião, através dos receptores 72 da aldosterona da membrana. O primeiro mecanismo designa-se lento e o segundo rápido3. A zona fasciculada é a zona média e mais larga das três zonas do cortex suprarenal e compreende aproximadamente 75% do cortex, variando em espessura sob diferentes condições fisiológicas2. As suas células são grandes e formam cordões radiais entre a rede fibrovascular. É responsável pela secreção de hormonas glicocorticóides, em especial o cortisol e também de esteróides sexuais apesar de em menor quantidade2. A síntese e secreção de cortisol são reguladas, de acordo com as necessidades, pela produção de ACTH, secretada pela adenohipófise3. A secreção de ACTH por sua vez é regulada pelo CRF (secretado no hipotálamo), pelo nível de glicocorticóides no plasma e pela ADH (que atinge a hipófise pelos vasos portais neurohipofisários curtos)3. A libertação de CRF é inibida pelos níveis sanguíneos elevados de glicocorticóides, por impulsos oriundos do SNC, por péptidos opióides, factores psicológicos e do meio ambiente3. Após penetrarem nas células, os glicocorticóides ligam-se a receptores citosólicos específicos (GRα e GRβ) encontrados em praticamente todos os tecidos. Após a ligação, estes receptores sofrem uma alteração conformacional e migram para o núcleo, ligando-se ao DNA inibindo ou induzindo a transcrição de genes específicos3. A zona reticulada é a região de menor espessura e mais interna do cortex supra – renal, apresentando células irregulares com pequeno conteúdo lipídico. A sua espessura varia de acordo com diferentes condições fisiológicas2. É responsável pela secreção de pequenas quantidades de androgénios e glicocorticóides. O suprimento sanguíneo das glândulas supra-renais é da responsabilidade das artérias supra-renais superior (origem na artéria frénica inferior), média (origem na artéria © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 mesentérica superior) e inferior (origem na artéria renal), que formam um plexo imediatamente abaixo da cápsula da glândula1,2. Quanto à drenagem venosa, as sinusóides da zona fasciculada convergem para um plexo profundo na zona reticulada, antes de drenarem para as pequenas vénulas que terminam na veia central da medula. A veia supra-renal direita converge na veia cava inferior e a esquerda na veia renal esquerda1,2. As glândulas supra-renais possuem um suprimento nervoso rico, proveniente do plexo celíaco e dos nervos esplâncnicos torácicos. Os nervos são principalmente fibras simpáticas pré-gânglionares mielinizadas que derivam dos cornos lateral da medula espinal e que são distribuídas para as células cromafins da medula supra-renal1. EMBRIOLOGIA DAS GLÂNDULAS SUPRA-RENAIS O cortex supra - renal deriva do mesotélio celómico situado entre o mesentério dorsal e o esboço gonádico. A primeira proliferação e migração ocorre à quinta semana de desenvolvimento embrionário, dando origem ao cortex fetal ou primitivo. A segunda proliferação e migração surge pelo terceiro mês de vida embrionária, formando-se o cortex permanente ou definitivo. O cortex fetal involui no período compreendido entre o nascimento e o segundo ano de vida, desenvolvendo-se então o cortex permanente5. Durante a gestação, formam-se no cortex supra-renal, derivados androgénicos sulfatados que são transformados na placenta em hormonas androgénicas e estrogénicas activas. Estas hormonas entram na circulação materna, tendo papel activo na regulação do equilíbrio endócrino durante a gravidez5. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO IMPORTÂNCIA FISIOLÓGICA DAS HORMONAS DO CORTEX SUPRARENAL 1. GLICOCORTICÓIDES O cortisol e a corticosterona são os principais representantes deste grupo e designam-se glicocorticóides dado que aumentam a produção hepática de glicose, estimulando o catabolismo lipídico e proteico, de forma a obter substratos para a gliconeogénese e reduzem a captação periférica da glicose.6 Os glicocorticóides actuam virtualmente em todos os tecidos humanos6. Na pele e tecido conjuntivo, os glicocorticóides inibem a divisão das células epidérmicas e síntese de DNA, reduzindo também a síntese e produção de colagénio. No músculo, os glicocorticóides causam atrofia (mas não necrose), e diminuição da síntese de proteínas musculares. Os glicocorticóides inibem a função dos osteoblastos, o que contribui para a osteopenia e osteoporose que caracteriza o seu excesso. A observação de doentes com excesso e deficiência de glicocorticóides revela que o cérebro é um importante órgão alvo para estes, com depressão, euforia, psicose, apatia, letargia, como manifestações importantes. Os glicocorticóides têm actividade antiinflamatória por inibição da produção de prostaglandinas e leucotrienos. Têm actividade imunossupressora por inibição da função linfocitária. Quando em altas quantidades deprimem funções biológicas não vitais como o crescimento e a função reprodutora (inibem a pulsatilidade de GnRH e libertação de LH e FSH). Além do seu papel no metabolismo energético, os glicocorticóides potenciam a acção vasoconstritora em resposta às catecolaminas, têm um efeito protector relativamente aos efeitos nocivos do stress, inibem a resposta inflamatória e a resposta imune específica. Tanto o cortisol como a corticosterona 73 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 são sintetizados a partir do colesterol, por uma cadeia de reacções químicas, catalizadas por enzimas na sua maioria pertencentes à família do Citocromo P 450. São secretados na forma livre, mas circulam no plasma ligados a proteínas. A principal proteína transportadora dos glicocorticóides é a transcortina ou CBG, contudo também podem circular ligados à albumina. A ligação às proteínas tem como função realizar o transporte e entrega das moléculas aos órgãos alvo, atrasar a sua clearance metabólica e impedir grandes oscilações na sua concentração. A CBG é uma α2-globulina sintetizada no fígado, que aumenta a sua produção durante a gravidez, contracepção hormonal, hipertiroidismo, diabetes mellitus, entre outros. O seu aumento origina uma diminuição temporária dos níveis séricos de cortisol, que condiciona um aumento da secreção de ACTH e consequentemente dos níveis de cortisol. A produção de CBG está diminuída nas situações de síndrome nefrótico, cirrose hepática, hipotiroidismo, entre outros6. Cerca de 96% do cortisol circulante encontra-se ligado à CBG, enquanto cerca de 4% circula livre no plasma, sendo a fracção de hormona ligada inactiva e a livre fisiologicamente activa6. A concentração matinal normal de cortisol é de 5-20 μg/dl. Como o cortisol se liga mais às proteínas transportadoras, que a corticosterona, é de esperar que a sua semivida em circulação seja superior à desta: 60 a 90 minutos versus 50 minutos6. Os glicocorticóides são metabolizados no fígado por conjugação com o ácido glicurónico ou pela adição de grupos sulfato, tornando-se hidrossolúveis e posteriormente excretados na urina e nas fezes6. A secreção de glicocorticóides ocorre em resposta à libertação de ACTH pela adenohipófise. A ACTH é um péptido com 39 aminoácidos e com uma semi-vida de aproximadamente 10 minutos, libertado em resposta ao CRF secretado pelo hipotálamo6. 74 O controlo da secreção de ACTH e CRF ocorre por três mecanismos: secreção episódica e ritmo diurno de ACTH, em resposta ao stress e por retroacção negativa dos níveis de cortisol6. A secreção circadiana de ACTH faz-se de forma pulsátil, com maior intensidade de manhã e menor durante a noite. O nível sérico de cortisol é máximo entre as 6 e as 8 horas da manhã, ainda durante o sono antes de despertar6. O ritmo diurno de secreção de ACTH mantém-se nos indivíduos com insuficiência supra-renal que se encontram sob terapêutica de substituição, não se verificando contudo, nos indivíduos com síndrome de Cushing e sendo exagerado nos pós-adrenalectomia6. O ritmo diurno de secreção de ACTH pode variar com os seguintes factores: padrão de sono, padrão de exposição à luz/escuro, alimentação, stress, trauma, fome, ansiedade, depressão, doenças neurológicas, doenças hepáticas, insuficiência renal crónica, alcoolismo, fármacos antiserotoninérgicos, entre outros6. Através de um mecanismo de retroacção negativa, níveis elevados de cortisol, condicionam uma diminuição de ACTH e também de CRF, conduzindo a uma diminuição da secreção de cortisol pelas glândulas supra-renais6. Tratamentos prolongados com corticoesteróides também inibem a secreção de ACTH, sendo esta inibição proporcional à potência do fármaco utilizado. Quando o tratamento termina, a glândula supra-renal encontra-se atrófica e a hipófise pode demorar meses a secretar níveis adequados de ACTH. Caso não seja feita uma redução gradual do fármaco, o paciente fica em risco de uma insuficiência supra-renal aguda6. 2. MINERALOCORTICÓIDES A principal função dos mineralocorticóides é regular a excreção de sódio de forma a manter um volume vascular adequado6. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 Esta tarefa é realizada conjuntamente com outros sistemas reguladores, que controlam a filtração e reabsorção tubular renal e que regulam a osmolaridade plasmática6. A aldosterona é o principal mineralocorticóide secretado pela glândula supra-renal. A desoxicorticosterona e a corticosterona também têm actividade mineralocorticóide6. A aldosterona tem um padrão de secreção fisiológico típico; diminuindo ao início da noite e aumentando numa fase mais avançada da noite, provavelmente devido a uma variação na actividade da renina plasmática. A aldosterona liga-se às proteínas plasmáticas (albumina e CBG) em menor extensão que os glicocorticóides. Por dia libertamse cerca de 15 mg de aldosterona, sendo a sua concentração plasmática total de 0,006 μg/dl e a fracção livre de 30 – 40%.6 A semivida da aldosterona é de 20-30 minutos, sendo metabolizada no fígado e excretada na urina, aproximadamente 1% na forma livre6. A sua secreção é regulada pelo sistema renina-angiotensina, pela concentração sérica de sódio e potássio (aumento de potássio e/ou diminuição de sódio) e em menor grau pela ACTH6. Os estímulos fisiológicos para que o sistema renina-angiotensina aumente a secreção de aldosterona são: diminuição da perfusão renal, diminuição do volume extracelular, restrição dietética de sódio e diminuição da pressão vascular arterial (hemorragia e hipotensão ortostática)6. A secreção de aldosterona também pode aumentar em situações patológicas designadas por hiperaldosteronismo secundário, tais como: insuficiência cardíaca congestiva, síndrome nefrótico e cirrose hepática6. O mecanismo de acção da aldosterona é complexo e não é completamente conhecido. A aldosterona liga-se ao receptor citosólico dos mineralocorticóides, que migra para o núcleo, permitindo a transcrição de determinadas sequências de DNA que são expressas em proteínas de membrana, cuja © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO função é promover a reabsorção de sódio e a excreção de potássio6. Os tecidos que expressam receptores mineralocorticóides são: rins, cólon, glândulas salivares e fígado (em alguma extensão)7. 3. ANDROGÉNIOS Os androgénios adrenais representam mais de 50% dos androgénios circulantes em mulheres pré menopausicas. Em homens esta contribuição é menor devido à produção testicular de androgénios. Os principais androgénios secretados pelo cortex supra-renal são a androstenediona, a dehidroepiandrosterona (DHEA), o sulfato de dehidroepiandrosterona (DHEAS) e a testosterona6. Por dia são produzidos em média, no cortex supra-renal, 4 a 14 mg de DHEA e 20 a 25 mg de DHEAS7. Existe no organismo humano uma contínua interconversão entre DHEA e DHEAS, mediada pela enzima DHEA sulfotransferase7. Os níveis séricos de DHEA e de DHEAS estão inversamente relacionados com a idade. O nível máximo verifica-se pelos trinta anos de vida, que desce para valores próximos dos 20% pelos setenta anos de idade7. Em geral a secreção dos androgénios acompanha a secreção de cortisol, sendo a ACTH o principal factor regulador da sua produção. São libertados na forma livre e circulam ligados, através de ligações fracas, predominantemente à albumina6. Existem, contudo factores, desconhecidos, que alteram a semi-vida e a variação destas hormonas em situações de doença7. São metabolizados quer por degradação, quer por conversão periférica em androgénios mais potentes como a testosterona e a dehidrotestosterona6. No homem são responsáveis por 30 a 50% dos androgénios circulantes, verificando-se valor relativo mais elevado na mulher7. A DHEA tem efeitos masculinizantes e anabólicos, contudo a sua potência é cerca de um quinto da potência dos esteróides tes- 75 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 ticulares. Em condições fisilógicas normais, o seu efeito é escasso. Na mulher, os esteróides de origem supra-renal (e ovárico) têm efeito na líbido e na actividade sexual6. A produção excessiva de androgénios tem efeito reduzido em homens adultos, sendo causa de hirsutismo em mulheres. Pode originar puberdade precoce em crianças do sexo masculino e masculinização de crianças do sexo feminino pré-púberes6. As glândulas supra-renais desempenham um papel fulcral na adaptação do ser humano ao stress, na regulação do metabolismo energético na manutenção do equilíbrio hidro-electrolítico, na função sexual, entre outros. A correlação anátomo-clínica das diferentes situações semiológicas e imagiológicas é possível graças ao conhecimento da sua estrutura. O estabelecimento de relações com outros órgãos de locais e funções distintas só existe tendo em conta a sua embriologia, isto é, baseia-se numa origem embrionária comum. Para finalizar, o conhecimento dos processos subjacentes à produção, secreção, transporte e mecanismo de acção das diferentes hormonas reveste-se de importância fundamental na estruturação do raciocínio clínico. 76 BIBLIOGRAFIA 1. 2. 3. 4. 5. 6. 7. Moore et al, ANATOMIA orientada para a clínica, GUANABARA KOGAN, 4ª Edição, 2001. Young et al, HISTOLOGIA Funcional, GUANABARA KOOGAN, 4ª Edição, 2001. Range et al, FARMACOLOGIA, CHURCHILL LIVINGSTONE, Tradução da 5ª Edição, 2004. Vander et al, HUMAN PHYSIOLOGY, McGRAWHILL, 9ª Edition, 2004. Monteiro, Apontamentos de Embriologia Humana, ICBAS, 2005. McPhee et al, Pathophysiology of Disease, LANGE, 5ª Edition, 2006. Lovas et al, Replacement therapy for Addison´s disease: recent developments, Expert Opin Invest Drug, 2008. SIGLAS ACTH – Adrenocorticotrophic Hormone CRF – Corticotropin Releasing Factor ADH – Antidiuretic Hormone SNC – Sistema Nervoso Central DNA – Desoxyrribonucleic Acid CBG – Corticosteroid-binding globulin DHEA – Dehidroepiandrostenediona DHEAS – Sulfato de Dehidroepiandrostenediona © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 77...87 Insuficiência do Cortex Supra-Renal: Fisiopatologia, diagnóstico e tratamento Rui Tiago Cardoso1, Isabel Mangas Palma2 1 2 Aluno do 5º ano Curso de Medicina do Instituto de Ciências Biomédicas Abel Salazar Assistente Hospitalar de Endocrinologia Diabetes e Metabolismo, Serviço de Endocrinologia do Hospital Santo António, Centro Hospitalar do Porto Correspondência: Isabel Mangas Palma › tlm. 919551799 › isabel.m.mangas@gmail.com RESUMO A insuficiência cortical supra-renal caracteriza-se por um défice de hormonas esteróides supra-renais e sua consequência na homeostasia do meio interno. No presente artigo, abordamos as principais causas e apresentações da insuficiência cortical supra-renal, bem como as considerações sobre o seu diagnóstico e tratamento, em diferentes contextos clínicos. PALAVRAS-CHAVE Insuficiência Supra-renal. Doença de Addison. Cortisol. Aldosterona. Dehidroepiandrosterona SUMMARY The adrenal cortex failure is marked by a deficit in adrenal steroid hormones, and its consequence in the internal environment homeostasis. In this article we focus the main causes and presentations of the adrenal cortex insufficiency, its diagnosis and treatment in different clinical settings. KEY WORDS Adrenal insufficiency. Addison’s disease. Cortisol. Aldosterone. Dehydroepiandrosterona. INTRODUÇÃO A insuficiência cortical supra-renal é uma entidade clínica com múltiplas etiologias, cujas repercussões decorrem de uma produção ou secreção insuficiente de hormonas do cortex supra-renal: glicocorticóides, androgénios e mineralocorticóides (na insuficiência de etiologia primária). Pode ser causada por uma doença primária das glândulas supra-renais ou, de forma secundária, por uma diminuição da estimulação das glândulas por défice de ACTH1. Podemos classificar a insuficiência cortical supra-renal em insuficiência primária © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO aguda (crise supra renal), insuficiência primária crónica (doença de Addison) e insuficiência secundária1. A deficiência de mineralocorticóides acompanha, invariavelmente, a insuficiência supra-renal primária. Na insuficiência secundária, que ocorre por deficiência de produção ou secreção de ACTH, a secreção de mineralocorticóides é preservada devido à acção do sistema renina-angiotensina-aldosterona. De seguida, vamos caracterizar as diferentes formas de insuficiência cortical supra-renal, focando a sua fisiopatologia, o seu diagnóstico e o seu tratamento. 77 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 INSUFICIÊNCIA PRIMÁRIA AGUDA DO CORTEX SUPRA-RENAL CRISE SUPRA-RENAL A crise supra-renal é uma entidade clínica que pode ocorrer em diversas situações, das quais se destacam: Pacientes com insuficiência supra-renal crónica, sob qualquer forma de stress, em que haja necessidades acrescidas de cortisol que a glândula não é capaz de compensar. Pacientes submetidos a tratamento prolongado com glicocorticóides exógenos, perante uma súbita retirada desse medicamento ou manutenção da dose em caso de stress agudo. A precipitação de uma crise pode ser devida à incapacidade da hipófise secretar ACTH em quantidade suficiente, ou das glândulas supra-renais compensarem a quantidade adicional de cortisol necessária, por se encontrarem atróficas. Aquando de uma hemorragia suprarenal maciça que destrua uma grande quantidade de cortex, poderá ocorrer insuficiência supra-renal, tal como nos recém nascidos com partos prolongados e traumáticos, nos doentes hipocoagulados e na coagulação intravascular disseminada. Surge também como complicação de uma infecção bacteriana, o Síndrome de WaterhouseFriederichsen, uma entidade rara, que pode ocorrer em qualquer idade, especialmente durante a infância. Esta entidade clínica ocorre no contexto de uma infecção bacteriana grave, geralmente associada a sepsis, por Neisseria meningitidis, Pseudomonas spp, Streptococus pneumoniae, Haemophilus influenzae ou Staphylococcus spp. Caracteriza-se por uma hipotensão rápida e progressiva e um quadro de coagulação intravascular disseminada e púrpura. Neste caso, a insuficiência supra-renal surge como consequência da hemorragia secundária à coagulação intravascular, da vasculite induzida pela endotoxina de bactérias Gram negativas ou de 78 alguma forma de vasculite causada por hipersensibilidade, sendo, em qualquer uma das situações, iniciada a hemorragia na medula de onde progride em direcção ao cortex. O quadro clínico e laboratorial da crise adrenal pode incluir diferentes aspectos: desidratação, hipotensão ou choque, náuseas, vómitos, perda de peso, anorexia, dor abdominal aguda, hipoglicemia inexplicável, febre inexplicável, hiponatrémia, hipercaliémia, azotémia, hipercalcémia, hiperpigmentação ou vitíligo, eosinofilia, sendo também associado a outras endocrinopatias. INSUFICIÊNCIA PRIMÁRIA CRÓNICA DO CORTEX SUPRA-RENAL DOENÇA DE ADDISON A Doença de Addison, descrita pela primeira vez em 1855 por Thomas Addison, foi por ele classificada como uma constelação de sintomas que incluía: “fraqueza e debilidade gerais, uma debilidade acentuada da função cardíaca e uma alteração peculiar da coloração da pele” associada a uma “doença das cápsulas supra-renais”1. Esta doença, incluída na lista de doenças raras, resulta da destruição progressiva do cortex supra-renal, apresentando uma incidência a nível mundial de 0.8 casos por 100,000 e prevalência de 4 a 11 casos por 100,000 habitantes – sem predominância de sexo ou faixa etária1,2,3. As suas manifestações são resultado de uma diminuição ou ausência de produção de cortisol, aldosterona e androgénios7. A adrenalite auto-imune, a tuberculose, os carcinomas metastáticos e a SIDA surgem como causa de aproximadamente 90% dos casos de doença de Addison (Tab. 1)1: © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 TABELA 1. Causas de insuficiência crónica do cortex supra-renal Auto-imune Esporádica Síndrome poliglandular auto-imune tipo I Síndrome poliglandular auto-imune tipo II Infecções Tuberculose Fungos Vírus (CMV/HIV) Metástases tumorais Doenças infiltrativas Hemorragia intra supra-renal Adrenoleucodistrofia Hipoplasia adrenal congénita Síndrome de resistência ao ACTH Adrenalectomia Bilateral Adaptado de Kronenberg et al, Williams Textbook of ENDOCRINOLOGY, 11th Edition, Saunders, 2008. A insuficiência auto-imune, responsável por 60 a 70% dos casos de insuficiência cortical supra-renal nos países desenvolvidos, decorre da destruição auto-imune das células produtoras de hormonas esteróides. Verificou-se a existência de vários tipos de auto-anticorpos contra enzimas esteroidogénicas, 21-Hidroxilase e 17-Hidroxilase, em 75% destes pacientes1 sendo também possível afirmar que 50% dos casos de doença de Addison auto-imune, ocorrem no contexto das síndromes poliglandulares autoimunes tipos I e II17. A síndrome poliglandular auto-imune do tipo I (doença de Addison, hipoparatiroidismo, candidíase mucocutânea crónica, hipoplasia dentária, alopécia, hipogonadismo primário) é uma doença rara, autossómica recessiva, causada por mutação no gene regulador AIRE localizado em 21q221,11. A síndrome poliglandular auto-imune tipo II (doença de Addison, hipotiroidismo primário, hipogonadismo primário, diabetes mellitus tipo I, anemia perniciosa e vitíligo), afecta predominantemente indivíduos jovens. É uma entidade poligénica e alguns estudos sugerem uma associação a polimorfismos do HLA1,11, cujas moléculas demonstraram estar envolvidas com a susceptibilidade e com a protecção genética à doença. Desde o primeiro trabalho publicado sobre este assunto em 1975, onde se destacava a associação do antigénio HLA-B8 com a © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO susceptibilidade à doença de Addison, foram realizados diferentes estudos que evidenciam a associação da doença ao antigénio HLA-DR3 e ao haplótipo DR3/DQ211. Estudos mais recentes comprovam que a existência de linkage desiquilibrium, ao nível da região promotora do CYPB27B1, também está associada à doença de Addison auto-imune7. Ainda relativamente à genética da doença de Addison auto imune, foi possível demonstrar o valor da enzima 21Hidroxilase na monitorização do processo auto-imune que, apesar de não estar directamente envolvida na destruição da glândula, constitui o principal auto-antigénio na insuficiência supra-renal primária9. A incidência da insuficiência suprarenal de causa tuberculosa tem vindo a diminuir nos países desenvolvidos devido à disponibilidade de fármacos anti-tuberculosos. Todavia, o aumento da incidência desta enfermidade nos países em vias de desenvolvimento, associado aos grandes fluxos migratórios e à emergência de estirpes multirresistentes, leva a que esta continue a tomar um papel relevante no diagnóstico diferencial. De um modo geral, esta doença ocasiona, no momento inicial, infecções activas em outros órgãos como os pulmões e o aparelho genito-urinário, sendo, posteriormente e por disseminação hematogénea, atingidas as glândulas supra-renais que se tornam volumosas devido aos extensos granulomas e caseo que então se formam e afectam tanto o cortex como a medula. Em 50% dos casos, verifica-se que este processo evolui para a fibrose e calcificação1. Os carcinomas metastáticos do pulmão e da mama constituem outra causa frequente de atingimento das glândulas supra-renais podendo, em alguns casos, levar a uma insuficiência cortical supra-renal crónica1. O atingimento destas glândulas por infecções oportunistas (Citomegalovirus, Mycobacterium avium, entre outros) ou por 79 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 complicações não infecciosas (sarcoma de Kaposi), torna superior o risco de desenvolver insuficiência supra-renal nos pacientes com SIDA1. Os fungos com papel mais relevante no desenvolvimento de doença de Addison são o Histoplasma capsulatum e o Coccidioides immitis, os quais substituem a arquitectura da glândula por uma reacção inflamatória granulomatosa1. A adrenoleucodistrofia, outra forma de insuficiência cortical supra-renal crónica, é uma doença genética ligada ao cromossoma X e tem uma prevalência de 1:20000. Afecta o funcionamento dos peroxissomas, resultando numa deficiente oxidação dos ácidos gordos de cadeia muito longa que se acumulam no cortex das glândulas suprarenais13. Doenças infiltrativas como a amiloidose, a sarcoidose e a hemocromatose também são potenciais causadoras de insuficiência cortical supra-renal. A doença de Addison cursa com o seguinte quadro clínico: início insidioso, manifestando-se apenas quando cerca de 90% do cortex das duas glândulas estiver destruído e os níveis circulantes de glicocorticóides e mineralocorticóides se encontrarem significativamente reduzidos1. As suas manifestações iniciais incluem fraqueza progressiva, cansaço, perda de peso e distúrbios gastrointestinais (anorexia, náuseas, vómitos e diarreia). Nos pacientes com doença supra-renal primária, elevados níveis circulantes de ACTH estimulam os melanócitos, causando hiperpigmentação da pele, especialmente nas áreas expostas ao sol e nas zonas de pressão como o pescoço, joelhos, cotovelos e articulações das mãos, o que não se verifica em pacientes com insuficiência supra-renal de causa hipotalâmica ou hipofisária. A diminuição da actividade mineralocorticóide origina hiponatrémia, hipercaliémia, acidose metabólica, diminuição do volume circulante e hipotensão. Pode tam- 80 bém ocorrer hipoglicemia por deficiente actividade glicocorticóide (Tab. 2)1. TABELA 2. Frequência dos sinais e sintomas de Insuficiência do Cortex Supra-renal Sintomas /Sinais/Alterações laboratoriais Frequência (%) Sintomas Fraqueza, cansaço, fadiga 100 Anorexia 100 Sintomas gastrointestinais 92 Náusea 86 Vómitos 75 Obstipação 33 Dor abdominal 31 Diarreia 16 Avidez por sal 16 Tonturas posturais 12 Dor muscular ou articular 6-13 Sinais Perda de peso 100 Hiperpigmentação 94 Hipotensão(PA sistolica < 110 mmHg) 88-94 Vitíligo 10-20 Calcificação auricular 5 Alterações laboratoriais Distúrbios electrolíticos 92 Hiponatrémia 88 Hipercaliémia 64 Hipercalcémia 6 Azotémia 55 Anemia 40 Eosinofilia 17 Adaptado de Kronenberg et al, Williams Textbook of ENDOCRINOLOGY, 11th Edition, Saunders, 2008. Particular atenção merecem as situações de stress como infecções, trauma ou cirurgias que podem desencadear uma crise suprarenal aguda com vómitos incontroláveis, dor abdominal, hipotensão, coma e colapso vascular. A morte pode ocorrer se não forem estabelecidas medidas de suporte adequadas e instituído o tratamento com corticoesteróides1. Relativamente ao prognóstico da doença de Addison, é possível afirmar que constitui uma condição potencialmente letal: verifica-se um acréscimo de mortalidade em casos de insuficiência supra-renal aguda e situações de stress (como as infecções), tal como o apontam os estudos mais recentes22. Por outro lado, observa-se também maior incidência de morte súbita em pacientes com diagnóstico realizado em idade jovem9. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 INSUFICIÊNCIA PRIMÁRIA CRÓNICA DO CORTEX SUPRA-RENAL DOENÇA DE ADDISON NA GRAVIDEZ 25 Com o advento da corticoterapia, um maior número de mulheres atinge a idade reprodutiva e tem uma condição clínica compatível com a gravidez, ultrapassando-se a diminuição da fertilidade. A doença de Addison afecta uma em cada doze mil gravidezes, sendo o seu diagnóstico difícil dado que, até ao terceiro trimestre de gravidez, os níveis de cortisol se mantêm elevados e os de ACTH estáveis. Alguns sinais que poderão alertar para o diagnóstico são: hipoglicemias, coma, albuminúria persistente, hiperemese gravídica, sem outra causa aparente. Nas gestantes com diagnóstico prévio de doença de Addison, deve ser feito o ajuste terapêutico de acordo com o estado clínico. O seguimento destas grávidas deve obedecer a monitorização clínica e laboratorial apertada, bem como a corticoterapia durante toda a gravidez. Ao longo do trabalho de parto, a dose de corticóide deve ser aumentada e mantida até ao sexto dia pós-parto, altura em que os níveis de cortisol retornam ao nível pré-gravídico. INSUFICIÊNCIA PRIMÁRIA CRÓNICA DO CORTEX SUPRA-RENAL tação clínica inicial ocorre sob a forma de um coma hiponatrémico. O tratamento substitutivo com glicocorticóides e, se necessário, com mineralocorticóides deve ser instituído de forma precoce, utilizando-se a menor dose que controle os sintomas e que, simultaneamente, permita um crescimento e desenvolvimento adequados. INSUFICIÊNCIA SECUNDÁRIA DO CORTEX SUPRA-RENAL A insuficiência secundária do cortex supra-renal ocorre na sequência de alterações patológicas do hipotálamo e/ou da hipófise que se traduzam numa diminuição da produção ou da secreção de ACTH. De entre as várias alterações destacam-se a doença metastática, a infecção, o enfarte e a irradiação1. A administração exógena de glicocorticóides durante longos períodos também suprime a secreção de ACTH e a função do cortex supra-renal1. (Tab. 3) TABELA 3. Causas secundárias de Insuficiência Cortical Supra-renal Terapêutica prolongada com glicocorticóides Hipopituitarismo Remoção selectiva de adenoma hipofisário secretor de ACTH Tumores hipofisários e cirurgia de tumores hipofisários, craniofaringiomas Apoplexia hipofisária Doença granulomatosa (tuberculose, sarcoidose, granuloma eosinófilo) Tumores secundários (mama, brônquios) Síndrome de Sheehan Irradiação hipofisária Deficiência isolada de ACTH DOENÇA DE ADDISON NA INFÂNCIA Adaptado de Kronenberg et al, Williams Textbook of ENDOCRINOLOGY, 11th 23, 24 Edition, Saunders, 2008. A insuficiência cortical supra-renal é rara durante a infância. Pode apresentar-se de forma insidiosa ou aguda, sendo a sintomatologia sobreponível à observada no adulto. A história familiar, consanguinidade, doenças de base e factores desencadeantes devem ser valorizados para um correcto diagnóstico diferencial. Estão descritos casos em que a apresen- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO INSUFICIÊNCIA DO CORTEX SUPRA-RENAL DIAGNÓSTICO Os achados clínicos na insuficiência cortical supra-renal são inespecíficos, exigindo um elevado nível de suspeita para se 81 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 proceder ao diagnóstico. Dado que é uma entidade potencialmente fatal, mas com tratamento, impõe-se sempre o seu diagnóstico diferencial quando houver clínica compatível18. Deve suspeitar-se de insuficiência cortical supra-renal em pacientes que apresentam hipotensão, perda de peso, hiponatrémia, hipercaliémia, ou quando há desenvolvimento destes sintomas após situações de stress como doença, lesão ou cirurgia18. Nas fases precoces de destruição das glândulas, as alterações laboratoriais são inaparentes ou escassas: a secreção hormonal pode ser normal, contudo, em situações de stress, a resposta é subnormal, podendo ser útil uma prova de estimulação com ACTH2. Em estadios mais avançados, observa-se uma diminuição das concentrações séricas de sódio, cloretos e bicarbonato, elevação da concentração de potássio e acidose metabólica. Em 6% dos pacientes ocorre hipercalcemia. No perfil analítico, verificam-se também alterações nas transaminases hepáticas e nos valores de TSH, que se apresentam moderadamente elevados, sem doença tiroideia concomitante22. Pode existir uma anemia microcítica, linfocitose relativa e eosinofilia moderada2. O status mineralocorticóide pode ser avaliado pela determinação da actividade da renina plasmática, elevada, e pelo doseamento da aldosterona, geralmente diminuída ou no limite inferior do normal5. A suspeita clínica deve ser confirmada com testes de diagnóstico. O nível plasmático basal matinal do cortisol e o cortisol livre urinário estão frequentemente no limite inferior do normal e não podem ser usados para excluir este diagnóstico. Contudo, um cortisol basal superior a 400 nmol/L (14.5 μg/dl) indica que o eixo hipotalamo, hipófise adrenal está intacto. O doseamento do cortisol apresenta várias limitações, das quais se destacam a secreção segundo um padrão pulsátil e circadiano, a existência de um grande interva- 82 lo de referência e também o facto de esta constituir uma hormona de “stress”18. O doseamento da ACTH, por sua vez, tem como desvantagens o facto de esta hormona apresentar uma semi-vida curta e ser lábil in-vitro18. Na prática clínica, todos os doentes com suspeita de insuficiência supra-renal devem ser submetidos a testes de estimulação com ACTH, contudo em doentes com suspeita de crise supra-renal, o tratamento deve ser iniciado imediatamente e os testes de confirmação efectuados mais tarde. Este teste consiste na administração intramuscular ou endovenosa, de 250 μg de cosyntropin e determinação do cortisol no tempo 0 e 30 minutos após injecção. Uma resposta normal é definida por um pico de cortisol maior que 550nmol/l (20 μg/dL). A resposta não é afectada pela hora do dia em que o teste é realizado, podendo ser efectuado em doentes que iniciaram terapêutica substitutiva com corticosteróides; no caso de esta ser hidrocortisona, deve ser alterada pois interfere no doseamento do cortisol. Se a resposta for anormal, pode proceder-se ao diagnóstico diferencial entre insuficiência supra-renal primária e secundária pela medição da concentração de aldosterona nas mesmas amostras sanguíneas. Na insuficiência secundária, o aumento normal na concentração de aldosterona corresponde a valores iguais ou superiores a 150 pmol/L. Na insuficiência primária os níveis de ACTH e péptidos associados encontram-se elevados, enquanto na secundária se encontram baixos ou “inapropriadamente normais”2. Estão também disponíveis radioimunoensaios para a detecção de anticorpos anti-21hidroxilase e outros antigénios em doentes com insuficiência supra-renal primária5. Na doença de Addison auto-imune, é importante avaliar a função de outros órgãos endócrinos para fazer o diagnóstico diferencial de síndromes poliglandulares auto-imunes5. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 A TAC pode revelar alterações estruturais das glândulas supra-renais4. A radiografia de tórax, a prova tuberculínica e um exame cultural de urina para pesquisa de Mycobacterium tuberculosis são exames importantes quando se suspeita de etiologia tuberculosa5. A adrenoleucodistrofia pode ser diagnosticada pela determinação da concentração sérica de ácidos gordos de cadeia muito longa5. Finalmente, quando se suspeita de insuficiência supra-renal de causa secundária, impõe-se a realização de RMN da hipófise e a avaliação da secreção da adenohipófise4. TRATAMENTO DA INSUFICIÊNCIA DO CORTEX SUPRA-RENAL TRATAMENTO DA CRISE SUPRARENAL A crise supra-renal é uma situação clínica que exige tratamento de tal modo emergente, que não deve ser atrasado pela realização de provas para obtenção de diagnóstico definitivo. Ao colher sangue para determinação dos electrólitos e glicose, deve também proceder-se à colheita de amostras para doseamento de ACTH e cortisol, antes de iniciar a corticoterapia. Se o paciente não estiver em estado crítico, pode realizarse o teste de estimulação com ACTH5. O tratamento da insuficiência suprarenal aguda inclui: Medidas de emergência5: • Estabelecer um acesso endovenoso com agulha de grande calibre; • Colher sangue para as análises previamente citadas, não esperando, como já foi referido, para intervir; • Infundir 2 a 3 L de soro fisiológico (ou glicose 5% em soro fisiológico) o mais rapidamente possível. Avaliar os © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO sinais de sobrecarga de volume pela medição da pressão venosa central ou periférica e pela auscultação pulmonar, diminuindo a velocidade de infusão se necessário; • Injectar 100mg de hidrocortisona endovenosa (EV) de imediato e a cada 6 horas; se não for possível por esta via, administrar via intramuscular (IM). • Providenciar outras medidas de suporte de acordo com a condição clínica do paciente. Medidas de suporte (após estabilizar o paciente)5,18: • Continuar a infusão de soro fisiológico a menor velocidade por 24 a 48 horas; • Pesquisar e tratar quaisquer causas que tenham precipitado a crise; • Em pacientes sem diagnóstico prévio de insuficiência cortical supra-renal, proceder à prova de estimulação com ACTH e determinar o tipo e causa de insuficiência; • Diminuir a dose de glicocorticóides geralmente após 24h, reduzir a hidrocortisona para 50 mg/IM de 6/6 horas e, posteriormente, se o doente tolerar a via oral, passar a hidrocortisona 40mg de manhã e 20 mg às 18 horas. Logo que possível, passar para a dose de substituição padrão. • Iniciar mineralocorticóide (fludrocortisona 0,1 mg via oral por dia), aquando da suspensão da fluidoterapia endovenosa na insuficiência primária; • Avaliar a pressão arterial a cada 4 a 6 horas. Segundo Clutter 18, se o diagnóstico de insuficiência supra-renal ainda não estiver determinado na altura da crise adrenal, deve ser administrada uma dose única de 10 mg de dexametasona por via EV e iniciada uma infusão rápida de soro fisiológico acrescido de soro glicosado a 5%. De seguida, é aconselhado realizar-se a prova de 83 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 estimulação com o ACTH. Após o doseamento do cortisol, inicia-se a administração de hidrocortisona 100 mg a intervalos fixos de 8 em 8 horas até sabermos o resultado da prova. TRATAMENTO DA INSUFICIÊNCIA CRÓNICA DO CORTEX SUPRA-RENAL O objectivo da terapêutica de substituição é repor as necessidades de esteróides supra-renais, num padrão de administração que se assemelhe ao da libertação endógena5. Recomenda-se a hidrocortisona como o glicocorticóide de escolha para a terapêutica substitutiva da insuficiência adrenal, portanto todos os pacientes com insuficiência cortical supra-renal devem repor o cortisol através da administração de hidrocortisona2, 5. Alguns autores sugerem que a dose de glicocorticóide deve ser ajustada ao peso do paciente, mas não existem dados que comprovem a superioridade deste regime em adultos2, 5, 22. A produção endógena de cortisol é de 815 mg/dia, como a biodisponibilidade da hidrocortisona administrada por via oral é de quase 100%, recomendam-se 15 a 25 mg/dia de hidrocortisona como dose de substituição, com uma dose moderadamente mais elevada para insuficiência primária versus secundária (20-25 mg vs 15-20 mg)2, 5. A dose de 30 mg ou mais de hidrocortisona, previamente usada como dose de substituição, deve ser considerada supra-fisiológica e com elevada probabilidade de efeitos indesejáveis16. A dose diária de hidrocortisona deve ser repartida em duas ou três administrações: dois terços da dose ao acordar e o terço restante pelas 18 horas, ou metade a dois terços da dose ao acordar e doses subsequentes ao almoço e durante a tarde. O esquema de duas tomas, com administração da segunda dose às 18h, leva a baixa dose de glicocorticóides durante a tarde e consequente aumento do cansaço. Os glico- 84 corticóides não devem ser dados ao deitar porque podem provocar distúrbios do sono2, 5. Apesar do esquema terapêutico adoptado ter como objectivo mimetizar as concentrações fisiológicas de glicocorticóides e o ritmo circadiano fisiológico, tal não acontece uma vez que as preparações de hidrocortisona têm um perfil farmacocinético indesejável, com um aumento da concentração para valores supra fisiológicos 1 a 2 horas após a administração, seguido de um rápido declínio com valores indetectáveis nas 57 horas seguintes. As preparações existentes também não permitem simular o aumento fisiológico do cortisol matinal. Com o objectivo de reproduzir de forma mais fidedigna a variação circadiana do cortisol, foi realizado um estudo em sete pacientes com doença de Addison, durante um período de três meses e utilizando uma bomba infusora subcutânea de hidrocortisona. Os resultados sugerem que os pacientes seleccionados beneficiariam do restabelecimento do ritmo circadiano de cortisol19. Recentemente, no sentido de se obterem concentrações séricas mais fisiológicas de glicocorticóides, foram desenvolvidos comprimidos de hidrocortisona de libertação prolongada (Chronocort ® e DuoCort ®), que já foram testados em estudos de Fase I22. A dose de glicocorticóides a administrar e a sua posologia devem ser decididas individualmente e tendo em conta a toma de outros fármacos, particularmente aqueles que aumentam ou diminuam a sua clearence. A rifampicina, fenobarbital, fenitoína, carbamazepina e o mitotano aumentam a clearence dos glicocorticóides por indução do CYP3A4 no fígado, sendo, neste caso, necessário aumentar a dose de hidrocortisona. Já os contraceptivos orais, estrogénios conjugados, eritromicina, indometacina, cetoconazol e o naproxeno diminuem a clearence dos glicocorticóides com consequente aumento das concentrações plasmáticas e necessidade de diminuir a dose de hidrocortisona21. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 Da mesma forma, o excesso de hormonas tiroideias causado por hipertiroidismo ou terapêutica com levotiroxina exógena aumenta o turnover cortisona/cortisol e pode requerer ajuste da dose. Pela mesma razão, o início do tratamento com glicocorticóides em doentes com hipopituitarismo deve preceder o início da substituição com levotiroxina, visto que o inverso pode precipitar uma crise adrenal. Glicocorticóides de acção prolongada também podem ser usados na terapêutica substitutiva. A equipotência das doses é a seguinte: 10mg de hidrocortisona equivale a 2 mg de prednisolona e a 0.25 mg dexametasona. A hidrocortisona também tem acção mineralocorticóide. Dos glicocorticóides sintéticos, a prednisolona tem reduzida acção e a dexametasona não tem acção mineralocorticóide, o que tem considerável importância no tratamento da insuficiência adrenal primária16. A terapêutica de substituição com glicocorticóides de acção prolongada é menos desejável, principalmente devido à desfavorável actividade dos glicocorticóides durante a noite e à sua elevada semi-vida biológica. Não há marcadores eficazes da acção dos glicocorticóides, pelo que a monitorização da terapêutica substitutiva com os mesmos é baseada na avaliação clínica de sinais e sintomas sugestivos de sub ou sobre substituição: fadiga, náusea, mialgia, falta de energia e perda de peso ou aumento de peso, obesidade central, osteoporose, alterações da tolerância à glicose e hipertensão, respectivamente. Nos doentes tratados com adequada dose de glicocorticóides, não é necessária a monitorização da densidade mineral óssea. O cortisol sérico e o ACTH não devem ser utilizados como instrumento de monitorização da substituição dos glicocorticóides, na insuficiência adrenal primária ou secundária. Os pacientes com insuficiência primária devem ainda receber mineralocorticóides: © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO fludrocortisona 0,1 mg por dia, via oral, associada à ingestão livre de cloreto de sódio. A dose pode variar entre os 0,05 e os 0,25 mg por dia toma única diária ou repartida por duas tomas, uma de manhã e outra ao início da tarde. Os objectivos da terapêutica com mineralocorticóides são a manutenção da pressão arterial adequada, em decúbito e em pé, bem como, a normocaliémia18. A monitorização do sódio e potássio e da actividade ou concentração da renina plasmática deve ser efectuada em intervalos regulares, com objectivo de a renina plasmática estar no limite superior do normal, reduzindo-se assim o risco de hipocaliémia, edema e hipertensão16, 22. A introdução da substituição com DHEA representa um avanço na terapêutica substitutiva da insuficiência supra-renal. A produção de DHEA pela supra-renal é a maior fonte de androgénios na mulher e a deficiência desta hormona origina significativa deficiência de androgénios nas mulheres afectadas. Nas mulheres com insuficiência do cortex supra-renal, primária ou secundária, os níveis de androgénios também se encontram baixos, pelo que alguns autores propõem acrescentar ao esquema terapêutico habitual 25 a 50 mg de DHEA, com o objectivo de melhorar a qualidade de vida das pacientes e a densidade mineral óssea. Esta prática foi recentemente fundamentada por um estudo randomizado em que o tratamento prolongado com DHEA evidenciou alguns efeitos benéficos em pacientes com doença de Addison. Contudo, a nível da fadiga e do desempenho cognitivo, a terapêutica com DHEA não evidenciou benefícios22. A substituição deve ser monitorizada através dos níveis plasmáticos de DHEA e, em mulheres, recorrendo também aos níveis de androstenediona, testosterona e SHBG, 24 horas após ingestão da toma matinal. O tratamento deve obter níveis dentro dos valores de referência em adultos saudáveis. 85 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 Finalmente, os pacientes devem ser educados relativamente à sua situação clínica, sintomatologia e ter autonomia no ajuste terapêutico, sob aconselhamento médico prévio, nas intercorrências que potencialmente possam desencadear uma necessidade acrescida de esteróides (regras para os dias de doença). Devem também ser portadores de informação relativa à sua patologia que permita o seu reconhecimento por terceiros em situações agudas. TRATAMENTO DA INSUFICIÊNCIA CRÓNICA DO CORTEX SUPRA- RENAL SITUAÇÕES PARTICULARES5 1. DOENÇAS FEBRIS MINOR OU SITUAÇÕES DE STRESS Os doentes sob terapêutica substitutiva com glicocorticóides devem ser educados para aumentar duas a três vezes a dose do glicocorticóide, sem alterar a dose do mineralocorticóide, perante uma doença febril minor ou uma situação de stress psicológico. Caso o quadro clínico se agrave, persista por mais de três dias ou curse com vómitos, deve proceder-se a avaliação médica. 2. TRAUMA OU SITUAÇÕES DE STRESS GRAVES Deve proceder-se à administração de 4 mg de dexametasona, via intramuscular, seguida de cuidados médicos adequados ao quadro clínico. 3. SITUAÇÕES DE DOENÇA COM INTERNAMENTO HOSPITALAR / CIRURGIA Em situação de doença moderada, deve administrar-se 50 mg de hidrocortisona de 12 em 12 horas, por via oral ou endovenosa, passando rapidamente à dose de manutenção à medida que o paciente recupera. 86 Em caso de doença grave, deve administrar-se 100 mg de hidrocortisona, por via endovenosa de 8 em 8 horas. Diminuir até à dose de manutenção, 50% a cada dia, atendendo à evolução clínica. Em caso de procedimentos minor sob anestesia local, ou procedimentos radiológicos, geralmente não é necessária suplementação extra. Contudo para procedimentos como o enema baritado, endoscopia, arteriografia deve administrar-se 100 mg de hidrocortisona endovenosa, em dose única, antes de se iniciar o procedimento. Por fim, em casos de cirurgia major, administrar 100mg de hidrocortisona, antes da indução anestésica, repetindo de 8 em 8 horas nas primeiras 24 horas. Reduzindo rapidamente a dose, 50% por dia, até à dose de manutenção. Tendo em conta a informação recolhida para a elaboração deste trabalho, podemos afirmar que, apesar de já ser possível a substituição de todas as linhas afectadas (glicocorticóides, mineralocorticóides e DHEA), o tratamento da insuficiência supra-renal ainda não é fisiológico, pois não é conseguida a reconstituição do ritmo circadiano do cortisol. Novas formulações de hidrocortisona (libertação prolongada), que permitem uma libertação sustentada da hidrocortisona e infusões subcutâneas contínuas de hidrocortisona, libertadas por um dispositivo programável apontam para um futuro promissor, em que a reprodução do nível normal fisiológico e circadiano de cortisol em doentes com insuficiência supra-renal será uma realidade. BIBLIOGRAFIA 1. 2. Kumar et al, Robbins & Cotran Patologia, Tradução da 7ª Edição, Saunders Elsevier, 2005. Fauci et al, HARRISON´S PRINCIPLES OF Internal Medicine, McGraw Hill, 17th Edition, 2008. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. Longmore et al, OXFORD HANDBOOK OF CLINICAL MEDICINE, 7th Edition, OXFORD UNIVERSITY PRESS, 2007. Silva et al, Insuficiência adrenal primária no adulto: 150 anos depois de Addison, Arq Bras Endocrinol Metab, 2004. Kronenberg et al, Williams Textbook of ENDOCRINOLOGY, 11ª Edition, Sanders, 2008. Laboratory Endocrine Testing Guidelines Alberta, Update, 2008. Dorin et al, Diagnosis of adrenal insufficiency, Ann Intern Med, 2003. Jennings et al, A haplotype of the CYP27B1 promoter is associated with autoimmune Addison’s disease but not with Graves’ disease in a UK population, Journ Mol End, 2005. Erichsen et al, Normal overall mortality rate in Addison´s disease, but young patients are at risk of premature death, Europ Jour Endoc, 2009. Eystein et al, The substract Binding Domain of 21-Hidroxilase, the Main Auto Antigen in Autoimmune Addison´s Disease, is an immunodominant T cell Epitope, Endocrinology, 2006. Alves et al, Associação do Sistema de Histocompatibilidade Humano (HLA) com Doenças Endócrinas Auto Imunes, Rev Bai Saú Publ, 2005. Silva et al, Doença de Addison em associação com tuberculose pulmonar – a propósito de um caso clínico, Casos Clínicos - Medicina Interna, 2007. Mendes et al, Evolução Fenotipica na Adrenoleucodistrofia, ACTA MÉDICA PORTUGUESA, 2003. Husebye et al, Immunology of Addison’s Disease and Premature Ovarian Failure, Endocrinol Metab Clin N AM, 2009 . Longui, Insuficiência Adrenal Primária na Infância, Cursos de Medicina, 2004. Reisch et al, Fine Tuning for Quality of Life: 21 st Century approach to treatment of Addison’s Disease, Endocrinol Metab Clin N AM, 2009. Tait et al, The genetics of autoimmune endocrine disease, Clinical Endocrinology, 2003. Green et al, The Washington Manual de Terapêutica Clínica, GUANABARA KOOGAN, 31ª Edição, 2005. Gurnell et al, Long-Term DHEA Replacement in Primary Adrenal Insufficiency: A Randomized © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 20. 21. 22. 23. 24. 25. Controlled Trial, J Clin Endocrinol Metab, 2008. Lovas et al, Continuous subcutaneous hydrocortisone infusion in Addison´s Disease, Eur Jour Endo, 2007. www.uptodateonline.com Lovas et al, Replacement therapy for Addison´s disease: recent developments, Expert Opin Invest Drug, 2008. Longui, Insuficiência Adrenal Primária na Infância, Cursos de Medicina, 2004. Esperon, Coma hiponatrémico como manifestação de Doença de Addison, Jornal de Pediatria, 2001. Mesquita et al, Doença de Addison e Gravidez, Arquivos de Medicina, 2005. SIGLAS ACTH – Adrenocorticotrophic Hormone DHEA – Dehidroepiandrostenediona DHEAS – Sulfato de Dehidroepiandrostenediona SHBG- Sex hormone binding globulin HLA – Human Leucocyte Antigen SIDA – Síndrome de Imunodeficiência Adquirida TAC – Tomografia Axial Computorizada RMN – Ressonância Magnética Nuclear 87 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 89 ... 98 Síndrome de Cushing Subclínica Léone Duarte1, José Silva Nunes2, Ana Filipa Lopes1, Fernando Malheiro3 1 2 3 Interna do Internato Complementar de Endocrinologia do Serviço de Endocrinologia, Diabetes e Metabolismo do Hospital de Curry Cabral, Lisboa Assistente Hospitalar do Serviço de Endocrinologia, Diabetes e Metabolismo do Hospital de Curry Cabral, Lisboa Director do Serviço de Endocrinologia, Diabetes e Metabolismo do Hospital de Curry Cabral, Lisboa Correspondência Léone Duarte › Serviço de Endocrinologia, Diabetes e Metabolismo do Hospital de Curry Cabral › Rua da Beneficiência, nº 8. 1069-166 Lisboa › Telefone: 217924379 / Fax: 217924377 › e-mail: leoneduarte@gmail.com RESUMO Os incidentalomas da supra-renal e a síndrome de Cushing subclínica têm sido objecto de estudo crescente nos últimos anos, dado que a descoberta casual de massas supra-renais e de alterações analíticas subtis se tornou muito frequente, pela ampla utilização de técnicas imagiológicas e laboratoriais de elevada sensibilidade. O objectivo deste artigo é fazer uma revisão sucinta da literatura publicada sobre este tema, nomeadamente em relação à sua definição, história natural, consequências clínicas, diagnóstico, abordagem terapêutica e seguimento. O adenoma cortical é o tipo mais frequente de incidentaloma da supra-renal. Em 5 a 20% dos casos, dependendo do protocolo do estudo e dos critérios de diagnóstico, verifica-se uma secreção autónoma de cortisol por estes adenomas. A secreção autonóma de glucocorticóides na ausência de sintomas e sinais específicos da síndrome de Cushing define a síndrome de Cushing subclínica. Com uma prevalência estimada de 79 casos por 100.000 pessoas, a síndrome de Cushing subclínica é muito mais frequente que a síndrome de Cushing clássica (1 caso por 100.000 pessoas). O diagnóstico, abordagem, impacto clínico e tratamento desta entidade são ainda muito controversos. No entanto, na síndrome de Cushing subclínica, temse verificado um aumento da incidência de consequências clínicas atribuíveis ao hipercortisolismo, tais como hipertensão arterial, obesidade, diminuição da tolerância à glicose, dislipidémia e síndrome metabólica, associadas a um aumento do risco cardiovascular. Deste modo, o hipercortisolismo subclínico pode ser nocivo, particularmente em indivíduos com outros factores de risco, geneticamente determinados ou adquiridos, podendo ter um papel importante na aceleração do processo aterosclerótico. A supra-renalectomia ou a vigilância regular e cuidada destes doentes, tendo como prioridades a prevenção cardiovascular e o tratamento das comorbilidades, são as opções terapêuticas actualmente válidas. Os doentes referenciados para cirurgia devem fazer terapêutica com corticosteróides no período perioperatório, dado o risco de insuficiência supra-renal pós-supra-renalectomia. PALAVRAS-CHAVE Síndrome Cushing subclínica; Incidentaloma supra-renal; Hipercortisolismo. ABSTRACT Adrenal incidentaloma and subclinical Cushing’s syndrome have been increasingly a matter of study in the last years, since the serendipitous discovery of an adrenal mass and the finding of laboratory abnormalities have become very frequent owing to the routine use of sensitive radiologic and laboratory techniques. The aim of this article was to review the published literature about subclinical Cushing’s syndrome, namely its definition, natural history, clinical consequences, diagnosis and management. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 89 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 Adrenocortical adenoma is the most frequent type of adrenal incidentaloma. In 5 to 20% of cases, depending on the study protocols and diagnostic criteria, there is an autonomous secretion of cortisol by these adenomas. Autonomous glucocorticoid production in the absence of specific signs and symptoms of Cushing’s syndrome defines subclinical Cushing’s syndrome. With an estimated prevalence of 79 cases per 100.000 persons, subclinical Cushing’s syndrome is much more frequent than classic Cushing’s syndrome (1 case per 100.000). The diagnosis, management, clinical impact and treatment of this entity are still very controversial. Nevertheless, an increased incidence of clinical consequences attributable to hypercortisolism, such as hypertension, obesity, impaired glucose tolerance, dislipidemia and metabolic syndrome, all associated with increased cardiovascular risk, have been detected in these patients. Subclinical hypercortisolism may be harmful, particularly to individuals with other risk factors, genetically determined or acquired, probably playing an important role in the progression of the atherosclerosis process. Adrenalectomy or regular and careful follow up, emphasizing cardiovascular prevention and comorbidity management, are the present valid treatment options. Patients undergoing adrenalectomy should receive glucocorticoid therapy perioperatively since the risk of adrenal insufficiency is of concern. KEYWORDS Subclinical Cushing’s Syndrome; Adrenal incidentaloma; Hypercortisolism. INTRODUÇÃO E MÉTODOS A ampla utilização na prática clínica de técnicas imagiológicas cada vez mais sofisticadas e sensíveis, como a ecografia, a tomografia computorizada (TC) e a ressonância nuclear magnética (RNM), tem levado ao diagnóstico cada vez mais frequente de massas supra-renais. Estas massas suprarenais têm sido designadas de incidentalomas, pelo facto de serem descobertas através de exames radiológicos realizados para estudo de outras situações clínicas que não a avaliação de doença supra-renal1. O adenoma cortical é o tipo mais frequente de incidentaloma da supra-renal. Em 5 a 20% dos casos, dependendo do protocolo do estudo e dos critérios de diagnóstico, verifica-se uma secreção autonóma de cortisol por estes adenomas, sem tradução clínica, dando origem à síndrome de Cushing subcliníca2. 90 O incidentaloma da supra-renal e a síndrome de Cushing subclínica têm despertado, nos últimos anos, crescente atenção por parte de clínicos e investigadores. Este facto deve-se à elevada prevalência destes tumores na população geral, principalmente em idades mais avançadas, mas também à importância que se tem vindo a reconhecer às chamadas “doenças subclínicas”. O diagnóstico precoce da síndrome de Cushing subclínica pode permitir o reconhecimento e tratamento de uma patologia e de entidades clínicas a ela associadas potencialmente perigosas3. O objectivo deste artigo é fazer uma revisão sucinta da literatura publicada sobre a síndrome de Cushing subclínica, nomeadamente em relação à sua definição, história natural, consequências clínicas, diagnóstico, abordagem terapêutica e seguimento. Esta revisão é realizada com base nos artigos indexados na MEDLINE e PubMed, publicados entre Janeiro de 1990 e © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 Novembro de 2008, com as seguintes palavras-chave: “subclinical Cushing’s syndrome”, “subclinical hypercortisolism” ou “adrenal incidentaloma”. DEFINIÇÃO A síndrome de Cushing subclínica define-se pela existência de secreção de cortisol de forma autónoma e desregulada, não completamente suprimida pelo feedback hipofisário, associada a adenomas da supra-renal diagnosticados incidentalmente, isto é, clinicamente silenciosos2. O termo síndrome de Cushing pré-clínico tem sido, por vezes, utilizado na literatura para designar a mesma entidade clínica. No entanto, esta designação é incorrecta porque implica o pressuposto que existe uma evolução para um hipercortisolismo clinicamente evidente. Tal não parece provável uma vez que a prevalência da síndrome de Cushing causada por um adenoma da glândula supra-renal é muito inferior à da síndrome de Cushing subclínica no incidentaloma da supra-renal4. A definição de síndrome de Cushing subclínica obedece deste modo a dois pressupostos: a ausência de um fenótipo evidente de Cushing e a presença de uma massa supra-renal diagnosticada incidentalmente. Contudo, o primeiro critério depende da prática e discernimento do clínico. Alguns sinais de hipercortisolismo, como o fácies lunar e a obesidade centrípeta, são de observação comum na população geral e podem facilmente ser ignorados e apenas atribuídos a uma hipersecreção de glucocorticóides após a descoberta (incidental) de uma massa supra-renal. O adenoma da suprarenal é a principal causa desta entidade clínica. No entanto, uma ligeira hipersecreção de glucocorticóides pode ocorrer também em doentes com massas supra-renais nãoadenomatosas, como o carcinoma suprarenal e o mielolipoma2,3. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO CONSEQUÊNCIAS CLÍNICAS E HISTÓRIA NATURAL Vários estudos têm sido realizados e publicados acerca das possíveis consequências clínicas e da história natural da síndrome de Cushing subclínica nos doentes com incidentalomas da supra-renal. Este tema está, ainda, envolto em muitas incertezas, nomeadamente relativamente ao seu diagnóstico, abordagem e impacto clínico. No entanto, é biologicamente plausível admitir que a exposição crónica a um excesso de cortisol (mesmo que ligeiro) poderá provocar, pelo menos em algum grau, algumas das consequências clínicas da síndrome de Cushing, tais como hipertensão arterial, obesidade, diminuição da tolerância à glicose e dislipidémia. Estas patologias estão frequentemente associadas, constituindo a síndrome metabólica, associada a um aumento do risco cardiovascular. Vários dados de séries de autópsias e estudos clínicos têm encontrado associações consistentes entre a síndrome de Cushing subclínica e manifestações da síndrome metabólica (tabela I)5-10. TABELA I: Manifestações da síndrome metabólica (as manifestações observadas em doentes com incidentalomas da supra-renal estão assinaladas com *). Hiperinsulinémia / Insulino-resistência * Obesidade centrípeta * Hipertensão arterial sistólica e diastólica * Padrão não dipper da pressão arterial Alterações do metabolismo glucídico * Diminuição do colesterol HDL * Alterações qualitativas do colesterol LDL (partículas LDL pequenas e densas) * Elevação dos triglicéridos * Hiperuricémia Disfunção endotelial Hipercoagulabilidade * Aumento da PCR e de outros marcadores inflamatórios Elevação do fibrinogénio * Microalbuminúria Aceleração do processo aterosclerótico * (Adaptado de TERZOLO M, BOVIO S, PIA A et al: Subclinical Cushing syndrome. Arq Bras Endocrinol Metab 2007; 51(8): 1272-9 2) Tauchmanovà et al. avaliaram 28 doentes com critérios de síndrome de Cushing subclínica (entre 126 indivíduos com incidentaloma da supra-renal) e verificaram 91 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 que a pressão arterial sistólica e diastólica, os níveis de glicémia em jejum, insulinémia em jejum, colesterol total, razão colesterol total/colesterol HDL, colesterol LDL, triglicéridos e fibrinogénio, o grau de insulinoresistência (calculado pelo homeostasis model assessment of insulin resistance HOMA-IR), a razão cintura/anca e a espessura íntima-média carotídea eram significativamente mais elevados nos doentes com síndrome de Cushing subclínica que nos controlos emparelhados. Inversamente, os níveis de colesterol HDL eram significativamente inferiores nos indivíduos com síndrome de Cushing subclínica. Estes autores verificaram ainda que, destes 28 indivíduos, 60.7% apresentavam hipertensão arterial, 71.4% alterações lipídicas, 28.6% diminuição da tolerância à glicose (na prova de tolerância à glicose oral clássica, com 75g de glicose), 35.7% diabetes tipo 2 e 53.6% alterações nos parâmetros hemostáticos. Seis doentes (21.4%) apresentavam evidências clínicas de doença cardiovascular (cardiopatia isquémica ou claudicação intermitente) e onze (39.3%) evidenciavam alterações electrocardiográficas e/ou alterações ultrassonográficas no ecodoppler carotídeo5. Noutro estudo retrospectivo multi-cêntrico envolvendo 210 doentes com adenomas da supra-renal clinicamente inaparentes, Terzolo et al. observaram uma prevalência de hipertensão arterial em 53.8%, de obesidade em 21.4% e de hiperglicémia em 22.4% dos casos. Os doentes com elevação dos níveis de cortisol sérico da meia-noite apresentavam níveis de glicémia em jejum e de pressão arterial sistólica mais elevados que os indivíduos com cortisol normal. A prevalência de doentes com pressão arterial controlada era menor e os níveis de hemoglobina glicada (HbA1c), nos indivíduos com diabetes, era significativamente superior nos doentes com hipercortisolémia6. Os mesmos autores já previamente tinham demonstrado que indivíduos não obesos e normoglicémicos com adenomas da supra-renal clinicamente ina- 92 parentes apresentavam uma maior prevalência de diminuição da tolerância à glicose, de hipertensão arterial sistólica e diastólica e de diminuição da sensibilidade à insulina, quando comparados com controlos emparelhados. Estas alterações não eram restritas aos doentes com síndrome de Cushing subclínica mas eram mais acentuadas nestes que nos que apresentavam adenomas não funcionantes7. Os autores defendem que a elevação da concentração do cortisol sérico da meia-noite pode ser considerado um marcador de sensibilidade à insulina e de um perfil de risco cardiovascular adverso nos doentes com adenomas da supra-renal clinicamente inaparentes3,6,7. Um aumento da concentração de adipocinas envolvidas no desenvolvimento da insulino-resistência e da aterosclerose (IL-6, resistina, TNF-α e MCP-1) foi demonstrado em indivíduos com incidentalomas da supra-renal, independentemente da presença de obesidade e adiposidade visceral, reforçando a associação entre os incidentalomas da supra-renal com hipercortisolismo subclínico e o aumento da incidência da síndrome de insulino-resistência11. A osteoporose é outra complicação bem conhecida do excesso de cortisol endógeno ou exógeno e, como tal, seria plausível considerar que os doentes com adenomas da supra-renal e hipercortisolismo subclínico evidenciassem uma diminuição na densidade mineral óssea. No entanto, os resultados dos estudos realizados e publicados nos últimos anos são divergentes, provavelmente devido aos diferentes métodos utilizados para avaliar a densidade mineral óssea, aos diferentes critérios de selecção dos doentes e controlos, bem como ao pequeno número de doentes estudados. Osella et al., num estudo realizado com 27 doentes com incidentalomas da supra-renal, não encontraram diferenças estatisticamente significativas na densidade mineral óssea comparativamente aos controlos, mesmo nos 8 doentes com critérios de síndrome de Cushing © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 subclínica12. No entanto, vários estudos recentes documentaram uma diminuição na densidade mineral óssea em doentes com hipercortisolismo subclínico, com consequente aumento do risco de osteopénia e osteoporose, principalmente em mulheres pós-menopaúsicas13-17. Como tal, a vigilância periódica da densidade mineral óssea nos doentes com síndrome de Cushing subclínica parece justificada pelo potencial aumento do risco de fracturas osteoporóticas. O espectro de manifestações da síndrome de Cushing subclínica varia desde alterações endócrinas ligeiras isoladas, sem repercussões clínicas, a uma síndrome de Cushing clínica clássica. A evolução do hipercortisolismo silencioso para a síndrome de Cushing clínica parece ocorrer raramente mas não é totalmente negligenciável. Barzon et al. estudaram 130 doentes com incidentalomas da supra-renal, com um follow-up entre 1 e 15 anos, e calcularam um risco cumulativo estimado de 12.5% após um ano para o desenvolvimento de síndrome de Cushing nos doentes com hipercortisolismo subclínico. Nos doentes com adenomas não funcionantes, o risco cumulativo estimado para o desenvolvimento de hipercortisolismo subclínico foi de 3.8% após um ano e de 6.6% após cinco anos18. No entanto, em outras séries, não se observou uma evolução do hipercortisolismo subclínico para uma síndrome de Cushing clássica, apesar do desenvolvimento de outras alterações endócrinas minor e, em alguns casos, do crescimento do adenoma19,20. O risco de desenvolvimento de hiperfunção é maior nos adenomas não funcionantes com dimensão igual ou superior a 3cm e quando a cintigrafia com [75Se] Methylnorcholesterol revela uma captação exclusiva pelo adenoma21. Num pequeno número de doentes pode verificar-se uma regressão espontânea das alterações no eixo hipotálamo-hipófisesupra-renal, sugerindo um possível padrão cíclico na hipersecreção de cortisol20. A interpretação dos resultados destes estudos deve ser ponderada com cautela. A © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO maioria destes estudos foi realizada a partir de séries reunidas em centros académicos, com amostras relativamente pequenas e com tempo e estratégias de follow-up variáveis. Consequentemente, não são estudos populacionais e, como tal, a generalização dos resultados não é totalmente correcta. Nos vários estudos analisados, verificou-se que os protocolos relativamente aos critérios de definição da síndrome de Cushing subclínica não eram semelhantes, tornando dificíl a sua interpretação e comparação. Relativamente à avaliação da sensibilidade à insulina, em nenhum dos estudos analisados esta foi realizada através da sua técnica-padrão, o clamp euglicémico hiperinsulinémico, embora os modelos utilizados tenham sido previamente validados para estudos epidemiológicos. Apesar das limitações referidas, as conclusões encontradas pelos vários estudos são muito semelhantes entre si relativamente à associação entre o hipercortisolismo subclínico e o desenvolvimento de insulino-resistência e dos vários factores de risco metabólicos e cardiovasculares associados. Tal facto reforça a importância da avaliação, vigilância e tratamento dos doentes com adenomas da suprarenal aparentemente não funcionantes. A realização de estudos prospectivos populacionais randomizados, de adequado poder epidemiológico, é fundamental para esclarecer, com maior rigor, as consequências clínicas e a história natural desta síndrome, nomeadamente em relação a um possível impacto na morbilidade e mortalidade destes doentes. DIAGNÓSTICO O diagnóstico da síndrome de Cushing subcliníca na prática clínica é extremamente difícil. As provas hormonais usadas no diagnóstico da síndrome de Cushing não têm sensibilidade suficiente para detectar hipersecreções subtis de cortisol. Por outro 93 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 supra-renal nos doentes com incidentalomas da supra-renal. Esta alteração endócrina tem sido amplamente usada no diagnóstico da síndrome de Cushing por ser um dos marcadores mais precoces e sensíveis de hipercortisolismo3. Recentemente tem sido investigado o valor da determinação do cortisol salivar da meia-noite no diagnóstico da síndrome de Cushing subclínica, com resultados positivos mas ainda não publicados27. Os níveis diminuídos de ACTH (adrenocorticotropina hipofisária) representam a autonomia funcional do adenoma suprarenal, com consequente supressão da síntese hipofisária de ACTH. No entanto, as dificuldades metodológicas laboratoriais na determinação da concentração de ACTH nos níveis próximos dos limites da técnica lado, a ausência de manifestações clínicas fidedignas torna difícil a interpretação de resultados positivos de provas e a distinção entre verdadeiros/positivos e falsos/positivos. Deste modo, a variabilidade biológica intrínseca à hipersecreção silenciosa de cortisol associa-se às dificuldades metodológicas, impossibilitando a definição uniforme desta entidade2. São várias as alterações funcionais do eixo hipotálamo-hipófise-supra-renal que têm sido associadas a esta síndrome, dependendo dos protocolos dos estudos realizados, dos critérios de diagnóstico utilizados e do número de doentes nas séries reportadas (tabela II). A perda do ritmo circadiano do cortisol representa a alteração do padrão diário TABELA II: Alterações do eixo hipotálamo-hipófise-supra-renal e prevalência da síndrome de Cushing subclínica em doentes com incidentalomas da supra-renal. nº de doentes Cortisol ACTH Não supressão do Diminuição da respos- Prevalência SCS urinário diminuída cortisol após PSDa ta da ACTH à CRH % aumentado % 66 1.5 Kasperlik- Zaluska, 1997 208 5.2 Terzolo, 199820 53 7.5 Rossi, 2000 65 1004 53 4.0 381 0.8 Autor, ano [ref. nº] Reincke, 199222 23 8 Mantero, 200024 Grossrubatscher, 2001 25 Bulow, 200226 7.5 12b 7.5 12 34 3.0 17 2.9 9.4 17 NR 6.0 17 23 25 NR 18.4 11 15 10 17 9.2 15 11 NR 5.7 NR 1.0 NR 1.0 c c b PSD: Prova de supressão com dexametasona; NR: não reportado; SCS: síndrome de Cushing subclínica. a – Prova de supressão nocturna com 1 mg de dexametasona com um limiar de cortisol de 5.0 µg/dl, excepto quando especificado de outra forma b – PSD com 8mg c – 17-hidroxicorticosteróides urinários de secreção de cortisol provocada pelo hipercortisolismo e é um marcador precoce desta hipersecreção. O aumento do cortisol livre na urina de 24 horas é também frequente mas é pouco sensível, pois depende da variabilidade diária na excreção de cortisol na urina, do débito urinário e da dificuldade em obter amostras completas de urina de 24 horas. O aumento do cortisol sérico determinado à meia noite é uma das alterações mais frequentes do eixo hipotálamo-hipófise- 94 não são negligenciáveis e limitam o seu valor diagnóstico. A resposta da ACTH e do cortisol à CRH (hormona de libertação da corticotropina) pode estar diminuída. No entanto, a prova com CRH não fornece informação adicional aos níveis basais de ACTH3. A diminuição dos níveis de dehidroepiandosterona sulfato (DHEAS) é provavelmente a alteração hormonal mais frequente nos doentes com incidentalomas da suprarenal. Esta alteração resulta da supressão da © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 ACTH pela secreção autónoma de cortisol e consequente diminuição na síntese de outras hormonas do córtex supra-renal. Actualmente, há controvérsia em considerar a diminuição da DHEAS um marcador indirecto da secreção autónoma de cortisol. Tal facto deve-se, em parte, ao declínio na secreção de DHEAS que se verifica com a idade que, consequentemente, influencia a interpretação deste dado laboratorial em populações com idade avançada. A prova de supressão com dexametasona tem sido amplamente utilizada no diagnóstico do hipercortisolismo endógeno, inclusivamente na detecção de alterações subtis na secreção de cortisol em doentes com incidentalomas da supra-renal. No entanto, os resultados dos vários estudos publicados nesta área não podem ser directamente comparados porque utilizaram diferentes protocolos (prova de supressão de 48 horas ou prova de supressão nocturna), diferentes doses de dexametasona (1, 2, 3 ou 8 mg) e diferentes cut-offs (5 e 1.8 μg/dl). Para avaliação da autonomia suprarenal na secreção de cortisol, actualmente recomenda-se a prova de supressão nocturna com 1mg de dexametasona 1,28, administrada às 23 horas da véspera e com colheita para determinação de cortisol sérico às 8 horas do dia seguinte. O valor de cut-off óptimo continua a ser debatido. Após a administração de dexametasona, a maioria dos invivíduos tem concentrações séricas de cortisol inferiores a 5 μg/dl (139.75 nmol/l), e este tem sido o valor standard acima do qual se tem definido a secreção autónoma de glucocorticóides clinicamente significativa. No entanto, alguns autores sugerem que este valor é demasiado elevado para detectar excessos subtis de cortisol, resultando numa elevada taxa de falsos negativos, e propuseram uma redução do cut-off para 1.8 μg/dl (49.7 nmol/l). A utilização de um valor de cut-off menor aumenta a probabilidade de diagnóstico do hipercortisolismo subclínico © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO mas à custa da diminuição da especificidade da prova, resultando num maior número de resultados falsos positivos 2,28. A Endocrine Society (Sociedade Americana de Endocrinologia), nas guidelines recentemente publicadas para o diagnóstico da síndrome de Cushing, recomenda a utilização da prova de supressão nocturna com 1mg de dexametasona e o cut-off de 1.8 μg/dl, defendendo a utilização de provas com maior sensibilidade para o rastreio29. Para ultrapassar o problema dos resultados falsos positivos, tem sido preconizada para o diagnóstico da síndrome de Cushing subclínica a demonstração de pelo menos dois resultados anormais concomitantes nas provas de avaliação do eixo hipotálamo-hipófise-supra-renal (tabela III)2,3,29. TABELA III: Diagnóstico de síndrome de Cushing subclínica. 1. Presença de massa supra-renal detectada incidentalmente (por ecografia, TC, RNM) 2. Ausência de sinais clínicos de hipercortisolismo (obesidade centrípeta, fácies lunar, bossa de búfalo, extremidades finas com hipotrofia muscular, estrias cutâneas de coloração púrpura) 3. Presença de 2 ou mais resultados anormais concomitantes nas provas de avaliação do eixo hipotálamo-hipófise-supra-renal: a. Prova de supressão nocturna com 1mg de dexametasona ⇒ Anormal se ≥ 5 µg/dl (139.75 nmol/l) ⇒ Duvidoso se ≥ 1.8 µg/dl (49.7 nmol/l) e <5 µg/dl ⇒ Ponderar mais testes diagnósticos ⇒ Normal se < 1.8 µg/dl (49.7 nmol/l) Se anormal ou duvidosa fazer uma ou mais das seguintes provas: b. Cortisol (sérico ou salivar) da meia-noite c. ACTH sérico d. Cortisol livre na urina de 24 horas e. Ritmo circadiano do cortisol f. DHEAS Contudo, outras sociedades médicas continuam a recomendar critérios ligeiramente diferentes para o diagnóstico desta entidade30. Várias combinações de provas podem ser realizadas mas, mesmo desta forma, o diagnóstico de hipersecreção de cortisol verdadeiramente relevante para admitir uma síndrome de Cushing subclínica é difícil. Para determinar a melhor abordagem diagnóstica desta entidade clínica seria necessário definir em que ponto a secreção de cortisol em excesso se torna significativa, provo- 95 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 cando morbilidade relevante. Actualmente ainda não existe uma resposta definida para esta questão, dado que a história natural desta patologia e o seu impacto na saúde e esperança média de vida ainda são grandemente desconhecidos. Na ausência de critérios compatíveis com síndrome de Cushing subclínica, recomenda-se uma reavaliação anual com a realização de uma prova de supressão nocturna com 1mg de dexametasona. Esta reavaliação deverá ser realizada mais precocemente se clinicamente se justificar. O risco de hiperfunção autónoma do adenoma parece estabilizar após 3 a 4 anos. No entanto, mais uma vez, estes dados são baseados em estudos com amostras de reduzidas dimensões e follow-up variável28. ABORDAGEM TERAPÊUTICA E SEGUIMENTO A abordagem terapêutica da síndrome de Cushing subclínica é, ainda, fundamentalmente empírica. Tal facto deve-se à ausência de estudos prospectivos randomizados, de adequado poder epidemiológico, que permitam a elaboração de linhas orientadoras para a abordagem adequada desta entidade clínica. A supra-renalectomia é uma opção terapêutica que deve ser considerada em doentes com idade inferior a 40 anos e nos doentes que apresentam alterações que podem potencialmente ser atribuídas a uma secreção autónoma de glucocorticóides: a) hipertensão arterial de início recente ou recentemente agravada; b) presença de diabetes mellitus, obesidade ou osteoporose, principalmente se estas alterações forem resistentes às terapêuticas médicas instituídas ou apresentarem uma rápida descompensação1,2. Os doentes com síndrome de Cushing subclínica submetidos a supra-renalectomia devem fazer terapêutica com corticosteróides no período perioperatório, dado o 96 risco de insuficiência supra-renal, que pode resultar numa falência hemodinâmica e mesmo na morte, se não tratada30. O hipercortisolismo mantido a longo prazo, mesmo que muito ligeiro, condiciona supressão da ACTH e consequente atrofia da glândula supra-renal contralateral, com elevado risco de desenvolvimento de insuficiência suprarenal após supra-renalectomia unilateral. No período pós-operatório, o doente deve ser monitorizado periodicamente para avaliação do restabelecimento funcional do eixo hipotálamo-hipófise-supra-renal, que pode eventualmente demorar semanas a meses. Após recuperação da função hipotálamohipófise-supra-renal endógena, procede-se ao ajuste e redução gradual das doses da corticoterapia de substituição. Em estudos reportando pequenas séries de casos com doentes submetidos a suprarenalectomia, é evidenciada uma melhoria nas alterações metabólicas e nos factores de risco cardiovascular, nomeadamente no controlo da pressão arterial, melhoria do perfil lipídico, diminuição dos níveis de fibrinogénio, melhoria do controlo glicémico, perda de peso e normalização dos marcadores de remodelação óssea5,8,10. No entanto, os efeitos do tratamento cirúrgico a longo prazo e o seu impacto na qualidade de vida dos doentes são ainda desconhecidos. São necessários estudos epidemiológicos, com maior número de doentes e maior período de follow-up, comparando a evolução dos doentes submetidos a supra-renalectomia com a evolução dos doentes sob tratamento conservador, para confirmação dos benefícios reportados e, deste modo, orientar a melhor abordagem terapêutica. Com os dados actualmente disponíveis, não é possível fazer uma recomendação fundamentada para a terapêutica cirúrgica nos doentes com síndrome de Cushing subclínica. A decisão deve ser considerada individualmente, com base nas comorbilidades apresentadas pelo doente, no julgamento clínico e na vontade do doente2. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 Dada a associação do hipercortisolismo subclínico com as alterações metabólicas e factores de risco cardiovascular previamente discutidos, a intervenção terapêutica desta entidade clínica tem, inevitavelmente, como prioridade a prevenção cardiovascular e o tratamento de comorbilidades associadas. Deste modo, os doentes não candidatos a cirurgia devem ser submetidos a uma vigilância regular e cuidada, envolvendo alterações do estilo de vida e terapêuticas farmacológicas apropriadas a cada situação em particular. 9. 10. 11. 12. REFERÊNCIAS BIBLIOGRÁFICAS 1. 2. 3. 4. 5. 6. 7. 8. YOUNG WF Jr: The incidentally discovered adrenal mass. N Engl J Med 2007; 356: 601-10. TERZOLO M, BOVIO S, PIA A et al. Subclinical Cushing syndrome. Arq Bras Endocrinol Metab 2007; 51(8): 1272-9. TERZOLO M, BOVIO S, REIMONDO G et al. Subclinical Cushing’s syndrome in adrenal incidentalomas. Endocrinol Metab Clin North Am 2005; 34: 423-39. ROSS NS. Epidemiology of Cushing’s syndrome and subclinical disease. Endocrinol Metab Clin North Am 1994; 23: 523-46. TAUCHMANOVA L, ROSSI R, BIONDI B et al. Patients with Subclinical Cushing’s syndrome due to adrenal adenoma have increased cardiovascular risk. J Clin Endocrinol Metab 2002; 87: 4872-8. TERZOLO M, BOVIO S, PIA A et al. Midnight serum cortisol as a marker of increased cardiovascular risk in patients with a clinically inapparent adrenal adenoma. Eur J Endocrinol 2005; 153: 307-15. TERZOLO M, PIA A, ALÌ A et al. Adrenal incidentaloma: a new cause of the metabolic syndrome? J Clin Endocrinol Metab 2002; 87: 9981003. ROSSI R, TAUCHMANOVA L, LUCIANO A et al. Subclinical Cushing’s syndrome in patients with adrenal incidentalomas: clinical and biochemical features. J Clin Endocrinol Metab 2000; 85: 1440-8. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 13. 14. 15. 16. 17. 18. CHIODINI I, TORLONTANO M, SCILLITANI A et al. Association of subclinical hypercortisolism with type 2 diabetes mellitus: a case-control study in hospitalized patients. Eur J Endocrinol 2005; 153: 837-44. MITCHELL I, AUCHUS R, JUNEJA K et al. “Subclinical Cushing’s syndrome” is not subclinical: improvement after adrenalectomy in 9 patients”. Surgery 2007; 142: 900-5. ERMETICI F, MALAVAZOS A, CORBETTA S et al. Adipokine levels and cardiovascular risk in patients with adrenal incidentaloma. Metabolism Clinical and Experimental 2007; 56: 686-92. OSELLA G, REIMONDO G, PERETTI P et al. The patients with incidentally discovered adrenal adenoma (incidentaloma) are not at increased risk of osteoporosis. J Clin Endocrinol Metab 2001; 86: 604-7. TORLONTANO M, CHIODINI I, PILERI M et al. Altered bone mass and turnover in female patients with adrenal incidentaloma: the effect of subclinical hypercortisolism. J Clin Endocrinol Metab 1999; 84: 2381-5. CHIODINI I, TAUMANOVÀ L, TORLONTANO M et al. Bone involvement in eugonadal male patients with adrenal incidentaloma and subclinical hypercortisolism. J Clin Endocrinol Metab 2002; 87: 5491-4. CHIODINI I, TORLONTANO M, CARNEVALE V et al. Bone loss rate in adrenal incidentalomas: a longitudinal study. J Clin Endocrinol Metab 2001; 86: 5337-41. HADJIDAKIS D, TSAGARAKIS S, ROBOTI C et al. Does subclinical hypercortisolism adversely affect the bone mineral density of patients with adrenal incidentalomas ? Clin Endocrinol (Oxf) 2003; 58: 72-7. BARDET S, ROHMER V, BOUX DE CASSON F et al. Densité minérale osseuse et marqueurs biologiques de remaniement osseux chez les patients porteurs d’incidentalome surrénalien: effet d’un hypercortisolisme infraclinique. Rev Méd Interne 2002; 23: 508-17. BARZON L, FALLO F, SONINO S, BOSCARO M. Development of overt Cushing’s syndrome in patients with adrenal incidentaloma. Eur J Endocrinol 2002; 146: 61-6. 97 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 19. LIBÈ R, DALL’ASTA C, BARBETTA L et al. Long-term follow-up study of patients with adrenal incidentalomas. Eur J Endocrinol 2002; 147: 489-94. 20. TERZOLO M, OSELLA G, ALÌ A et al. Subclinical Cushing’s syndrome in adrenal incidentaloma. Clin Endocrinol (Oxf) 1998; 48: 89-97. 21. BARZON L, SCARONI C, SONINO N et al. Risk factors and long-term follow-up of adrenal incidentalomas. J Clin Endocrinol Metab 1999; 84: 520-6. 22. REINCKE M, NIEKE J, KRESTIN JP et al. Preclinical Cushing’s syndrome in adrenal incidentalomas: comparison with adrenal Cushing’s syndrome. J Clin Endocrinol Metab 1992; 75: 826-32. 23. KASPERLIK-ZALUSKA AA, ROSLONOWSKA E, SLOWINSKA-SRZEDNICKA J et al. Incidentally discovered adrenal mass (incidentaloma): investigation and management of 208 patients. Clin Endocrinol (Oxf) 1997; 46: 29-37. 24. MANTERO F, TERZOLO M, ARNALDI G et al. A survey on adrenal incidentaloma in Italy. J Clin Endocrinol Metab 2000; 85: 637-44. 25. GROSSRUBATSCHER E, VIGNATI F, POSSA M et al. The natural history of incidentally discovered adrenocortical adenomas: a retrospective evaluation. J Endocrinol Invest 2001; 24: 846-55. 26. BULOW B, AHREN B. Adrenal incidentaloma – experience of a standardized diagnostic programme in the Swedish prospective study. J Intern Med 2002; 252: 239-46. 27. REIMONDO G, BOVIO S, MICOSSI I et al. Midnight salivary cortisol for diagnosis of subclinical Cushing’s syndrome in patients with clinically inapparent adrenocortical adenoma. 7th Congress of the European Federation of Internal Medicine, Rome, May 7-10, 2008. Eur J Intern Med 2008; 19S: S44. 28. GRUMBACH M, BILLER B, BRAUNSTEIN, G et al. NIH Conference – Management of the clinically inapparent adrenal mass (incidentaloma). Ann Intern Med 2003; 138: 424-9. 29. NIEMAN L, BILLER B, FINDLING J et al. The diagnosis of Cushing’s syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2008; 93: 1526-40. 30. TSUIKI M, TANABE A, TAKAGI S et al. Cardiovascular risks and their long-term clinical outcome in patients with subclinical Cushing’s syndrome. Endocrine Journal 2008; 55(4): 737-745. 98 31. McLEOD M, THOMPSON N, GROSS M et al. Sub-clinical Cushing’s syndrome in patients with adrenal gland incidentalomas: pitfalls in diagnosis and management. Am Surg 1990; 56: 398-403. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 99 ... 111 Feocromocitoma: actualizações no diagnóstico e tratamento Jacinta Santos1, Isabel Paiva2, Manuela Carvalheiro3 1 2 3 Interna Complementar de Endocrinologia Assistente Hospitalar Graduada de Endocrinologia Directora do Serviço de Endocrinologia, Diabetes e Metabolismo dos Hospitais da Universidade de Coimbra, EPE RESUMO O feocromocitoma é uma neoplasia rara, com origem nas células cromafins. Pode apresentar características de benignidade ou malignidade. A principal localização é na medula suprarenal, designando-se por paraganglioma quando tem origem nos gânglios do sistema nervoso simpático ou parassimpático. Em cerca de 25% dos casos aparentemente esporádicos, existem mutações que predispõem ao desenvolvimento de síndromas genéticas específicas (Neurofibromatose tipo 1, doença de von Hippel-Lindau, Neoplasias Endócrinas Múltiplas tipo 1 e 2 e Paraganglioma Familiar). A principal manifestação clínica é a hipertensão arterial. O diagnóstico bioquímico baseia-se na determinação das catecolaminas e metanefrinas plasmáticas e urinárias. Os principais exames imagiológicos destinados à localização do tumor são a TAC, RM, cintigrama com MIBG e PET. A supra-renalectomia é o único tratamento definitivo. É fundamental proceder à preparação médica pré-operatória através do bloqueio α e β e à estabilização hemodinâmica do doente. O feocromocitoma maligno tem um prognóstico variável, indolente ou rapidamente progressivo. Neste caso, as estratégias terapêuticas incluem a cirurgia citorreductora, o recurso ao MIBG e a quimioterapia, todos com eficácia limitada. PALAVRAS-CHAVE Feocromocitoma; Catecolaminas; Mutação; Hipertensão arterial; Rastreio; Suprarrenalectomia; Metastização. ABSTRACT Pheochromocytoma is a rare neoplasm, originated from chromaffin cells. It can present characteristics of benignity or malignity. The main location is on the adrenal medulla, being designated as a paraganglioma when it’s origin in on the sympathetic or parasympathetic ganglia of the nervous system. In about 25% of apparently sporadic cases, there are mutations that predispose to the development of specific genetic syndromes (Neurofibromatosis type 1, von Hippel-Lindau disease, Multiple Endocrine Neoplasia type 1 and 2 and Familiar Paraganglioma). The main clinical manifestation is arterial hypertension. Biochemical diagnosis is based on determination of plasmatic and urinary catecholamines and metanephrines. The most important imaging studies destined to localize the tumour are CT, MRI, MIBG scan and PET. Adrenalectomy is the only definitive treatment. It is highly important to perform medical preoperative preparation through α and β blockade and patient’s hemodynamic stabilization. Malignant pheochromocytoma has a variable prognosis, being indolent or rapidly progressive. In this case, therapeutic strategies include surgical debulking, MIBG therapy and chemotherapy, all with limited efficacy. KEYWORDS Pheocromocytoma; Catecholamines; Mutation; Arterial hypertension; Screening; Adrenalectomy; Metastization. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 99 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 INTRODUÇÃO Durante a fase de desenvolvimento embrionário, a medula supra-renal e os gânglios do sistema nervoso simpático têm uma origem comum, a partir da crista neural. As células endócrinas do sistema simpático-adrenal têm a capacidade de sintetizar e segregar catecolaminas. Estas células têm a designação de células cromafins, pelo facto de apresentarem uma reacção histoquímica característica, após contacto com agentes oxidantes.1 Segundo a classificação da Organização Mundial de Saúde, publicada em 2004, os feocromocitomas são tumores raros, com origem nas células produtoras de catecolaminas da medula supra-renal.1 Por outro lado, os paragangliomas são feocromocitomas de localização extra-supra-renal, que se desenvolvem a partir dos gânglios do sistema nervoso simpático.2 O diagnóstico do feocromocitoma é fundamental, pois embora constitua uma causa rara de hipertensão arterial, a cirurgia torna possível o seu tratamento definitivo. Em segundo lugar, cerca de 10 a 15% destes tumores são malignos, estando o diagnóstico e tratamento precoce associados a um melhor prognóstico. Paralelamente, o feocromocitoma pode constituir a primeira manifestação clínica de uma síndroma genética. Por último, as crises adrenérgicas características desta patologia estão associadas a elevada morbilidade cardiovascular.3 cada 100.000 adultos. Os dados obtidos do Registo Oncológico Nacional da Suécia apontam para uma incidência anual de 2 casos por milhão de pessoas. No entanto, dados obtidos a partir de autópsias realizadas em indivíduos da população geral sugerem que, na realidade, esta incidência é superior. Consequentemente, um número significativo de feocromocitomas não é diagnosticado em vida, pelo facto de os doentes serem assintomáticos, ou porque a hipertensão arterial não foi estudada.2 O tumor ocorre em todas as faixas etárias, embora seja mais frequente na idade adulta, sobretudo na 3ª e 4ª décadas de vida. No entanto, nos casos diagnosticados no decurso do estudo de incidentalomas da supra-renal, o diagnóstico é realizado em idades mais avançadas.3 A incidência é semelhante em ambos os sexos.3,4 CLASSIFICAÇÃO A maioria dos feocromocitomas são esporádicos, com origem na medula suprarenal. No entanto, entre 9 e 23% dos casos, o tumor desenvolve-se a partir de tecido cromafim extra-supra-renal.3,4 Embora a maioria destes tumores apresente características de benignidade, 26 a 35% dos casos são malignos. Na realidade, cerca de 10% dos doentes apresentam metastização na altura do diagnóstico.1,5 ETIOLOGIA – ASPECTOS GENÉTICOS PREVALÊNCIA A prevalência dos feocromocitomas não se encontra bem estabelecida, estando no entanto disponíveis os resultados de alguns estudos epidemiológicos efectuados em diferentes regiões geográficas. Num estudo publicado pela Clínica Mayo, em 1983, a prevalência anual desta patologia, no estado do Minnesota, EUA, é de 1 a 2 casos em 100 O feocromocitoma pode ser esporádico, ou surgir no contexto de uma síndroma genética específica. Estima-se que cerca de 25% dos doentes com feocromocitomas aparentemente esporádicos, sem história familiar da doença, sejam portadores de mutações germinativas que predispõem ao desenvolvimento de uma dessas síndromas. Nestas circunstâncias, este tumor pode ser © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 considerado “a ponta do iceberg”, sugerindo a existência de um quadro clínico subjacente mais vasto, a aguardar investigação diagnóstica.1 Neste contexto, as síndromas genéticas a considerar são a Neurofibromatose tipo 1, a Doença de von Hippel-Lindau, as Neoplasias Endócrinas Múltiplas (tipo 1 e tipo 2) e as Síndromas Feocromocitoma / Paraganglioma. 1. NEUROFIBROMATOSE TIPO 1 OU DOENÇA DE VON RECKLINGHAUSEN O diagnóstico da neurofibromatose tipo 1 (NF-1) ocorre habitualmente na infância e adolescência. Esta é uma patologia de transmissão autossómica dominante, causada por mutações inactivadoras do gene NF-1, localizado no braço longo do cromossoma 17. Trata-se de um gene supressor tumoral, que codifica a neurofibromina, uma proteína envolvida na inibição do gene Ras, que controla o crescimento e diferenciação celular. O diagnóstico clínico requer a presença de dois dos seguintes critérios: – Seis ou mais manchas cutâneas tipo “café com leite”; – Pelo menos dois neurofibromas cutâneos; – Um neurofibroma plexiforme; – Dois ou mais hamartomas benignos da íris; – Um glioma do nervo óptico; – Displasia ou pseudoartrose do osso esfenóide; – Familiar do primeiro grau com neurofibromatose.1 Nos portadores desta patologia, o feocromocitoma surge em 0,1 a 5,7% dos casos.2 No entanto, tratando-se de doentes com neurofibromatose e hipertensão arterial, a prevalência é bastante superior (20 a 50%). Relativamente à apresentação clínica, em 90% dos casos o feocromocitoma é benigno, em 84% trata-se de um tumor © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO único e 6% correspondem a paragangliomas. Estes tumores segregam essencialmente noradrenalina, sendo frequentemente assintomáticos, o que justifica o facto de poderem atingir elevadas dimensões.1 2. DOENÇA DE VON HIPPEL-LINDAU (VHL) Trata-se de uma patologia rara, de transmissão autossómica dominante, com uma incidência de um caso em cada 36.000 recém-nascidos. É condicionada por mutações no gene supressor tumoral VHL, localizado no braço curto do cromossoma 3. Este gene codifica a proteína VHL, envolvida na formação dos vasos sanguíneos, através da regulação do Factor Induzido pela Hipóxia (HIF-1α). Os portadores da mutação do gene VHL têm elevada predisposição para o desenvolvimento de tumores benignos e malignos em múltiplos órgãos. Os tumores característicos da doença de von Hippel-Lindau são os seguintes: – Hemangioblastomas da retina; – Hemangioblastomas do cerebelo e espinhal medula; – Feocromocitoma; – Carcinoma de células renais; – Tumores dos ilhéus pancreáticos; – Quistos e cistadenomas do rim, pâncreas e epidídimo.1 Relativamente ao feocromocitoma, é diagnosticado em cerca de 20% dos doentes portadores desta síndroma, sobretudo na segunda década de vida, podendo constituir a primeira manifestação clínica da doença. Habitualmente são benignos, segregando sobretudo noradrenalina. A localização preferencial é a glândula supra-renal, podendo ser bilaterais em 50% dos casos.1,2 De acordo com a sua expressão clínica, a Doença de von Hippel-Lindau pode ser classificada em quatro subtipos, destacando-se o feocromocitoma como elemento essencial na determinação desta classificação. 101 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 – VHL tipo 1: diagnóstico de hemangioblastomas da retina e do sistema nervoso central e de carcinoma renal, mas sem risco de feocromocitoma. – VHL tipo 2A: presença de hemangioblastomas e de feocromocitoma, associado a baixo risco de carcinoma renal. – VHL tipo 2B: presença de hemangioblastomas e de feocromocitoma, associado a elevado risco de carcinoma renal. – VHL tipo 2C: apenas desenvolvem feocromocitoma.1,6 3. NEOPLASIAS ENDÓCRINAS MÚLTIPLAS TIPO 1 (MEN 1) Esta síndroma é causada por uma mutação inactivadora do gene MEN-1, localizado no braço longo do cromossoma 11, que codifica a proteína menina. Transmite-se de modo autossómico dominante, caracterizando-se clinicamente pela presença de: hiperparatiroidismo primário, tumores dos ilhéus pancreáticos e adenomas hipofisários. Os feocromocitomas surgem raramente, tratando-se nesses casos de tumores únicos e benignos, produtores sobretudo de noradrenalina.1,8 4. NEOPLASIAS ENDÓCRINAS MÚLTIPLAS TIPO 2 (MEN 2) Trata-se também de uma síndroma de transmissão autossómica dominante, causada por uma mutação activadora do protooncogene RET, localizado no braço longo do cromossoma 11, que codifica um receptor tirosina-cinase, envolvido na regulação da proliferação celular e apoptose.1,2 De acordo com a expressão clínica, podemos estar perante uma Neoplasia Endócrina Múltipla tipo 2A ou tipo 2B. No primeiro caso, verifica-se a presença de carcinoma medular da tiróide em mais de 95% dos casos, hiperparatiroidismo em cerca de 35% e feocromocitoma em cerca de 50%. 102 No MEN 2B, para além do carcinoma medular da tiróide e do feocromocitoma, verifica-se tendência para o desenvolvimento de ganglioneuromas mucosos.1,2 Relativamente ao feocromocitoma, este desenvolve-se em cerca de 50% dos portadores da mutação, tratando-se habitualmente de um tumor benigno localizado na glândula supra-renal.1,8 Cerca de 50% dos doentes desenvolvem feocromocitomas bilaterais, de forma assíncrona, isto é, diferidos no tempo. Contrariamente ao que acontece nas outras síndromas genéticas, estes tumores segregam adrenalina em grande quantidade, condicionando manifestações clínicas mais precocemente. Por último, há a salientar o facto de as probabilidades de desenvolvimento de feocromocitoma serem diferentes, consoante a mutação específica do gene RET. Deste modo, destacam-se as mutações do codão 634 no MEN 2A e as mutações do codão 918 no MEN 2B, altamente predisponentes. 5. SÍNDROMAS FEOCROMOCITOMA / PARAGANGLIOMA Os paragangliomas são tumores raros. De acordo com a sua origem, são classificados em dois tipos: simpáticos e parassimpáticos. Os paragangliomas simpáticos são tumores derivados da cadeia simpática, localizados no tórax, abdómen ou pélvis, frequentemente malignos. O quadro clínico resulta do padrão de secreção de catecolaminas e das dimensões do tumor, com o consequente efeito de massa.1 Os paragangliomas parassimpáticos desenvolvem-se sobretudo nos gânglios parassimpáticos localizados na cabeça e pescoço, adjacentes aos grandes vasos sanguíneos. Esta é a localização preferencial, tratando-se habitualmente de tumores benignos, silenciosos do ponto de vista bio- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 químico, diagnosticados devido às consequências do efeito de massa, tais como nódulo cervical palpável ou paralisia de nervos craneanos. A nível torácico e abdominal, podem ter qualquer tipo de localização (peri-aórtica, peri-cava, peri-renal, mediastínica, intracardíaca, pulmonar, medular, duodenal, vesical,...). A clínica resulta essencialmente da secreção de catecolaminas. Por último, quando a localização é retroperitoneal são diagnosticados pela presença de dor e massa palpável. São essencialmente malignos, podendo metastizar para os pulmões, gânglios linfáticos e ossos. A Síndroma Paraganglioma Familiar resulta de mutações em genes que codificam subunidades da succinato desidrogenase (SDH) do complexo mitocondrial II, essencial no ciclo de Krebs e na cadeia respiratória mitocondrial.2 A transmissão processa-se de modo autossómico dominante em todos os casos. Esta síndroma pode ser classificada em três tipos, de acordo com o gene que sofreu mutação. • SDHB: gene localizado no braço curto do cromossoma 1, cuja mutação condiciona o desenvolvimento de paragangliomas simpáticos, sobretudo malignos. • SDHC: gene localizado no braço longo do cromossoma 1, cuja mutação condiciona o desenvolvimento de paragangliomas parassimpáticos da cabeça e do pescoço, essencialmente benignos. • SDHD: gene localizado no braço longo do cromossoma 11, cuja mutação condiciona o desenvolvimento de paragangliomas parassimpáticos familiares isolados da cabeça e pescoço, raramente malignos. A sua transmissão apresenta uma particularidade, o “imprinting genómico materno”, isto é, apenas os doentes do sexo masculino transmitem a patologia aos descendentes.1,9 © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Como previamente referido, cerca de 25% dos feocromocitomas e paragangliomas são hereditários, causados por mutações germinativas conhecidas. Actualmente, encontra-se disponível a pesquisa dos quatro principais genes envolvidos na sua patogénese: protooncogene RET, gene VHL, NF-1 e SDH. Deste modo, torna-se necessário estabelecer quais os indivíduos que deverão efectuar estudo genético. Estas indicações variam, de acordo com os autores, sendo recomendado pela maioria nas seguintes situações: diagnóstico do feocromocitoma em idade precoce; presença de tumores bilaterais; tumores de localização extra-suprarenal; tumores múltiplos; feocromocitomas malignos; história familiar de síndromas genéticas predisponentes.1 No quadro seguinte (Quadro 1) apresentam-se, resumidamente as Síndromas genéticas associadas a feocromocitoma. QUADRO 1 Síndroma MEN 2A MEN 2B VHL Paraganglioma familiar NEF 1 Mutação RET RET VHL SDHD, SDHB, SDHC NF-1 Risco de feocromocitoma 50% 50% 10 a 30% 20% 1 a 5% FISIOPATOLOGIA O feocromocitoma apresenta uma elevada taxa de produção de catecolaminas, podendo atingir um nível de secreção cerca de vinte vezes superior ao da glândula supra-renal normal.1 Esta hipersecreção persistente e autónoma, associa-se à ausência do mecanismo de inibição da tirosina hidroxilase por retrocontrolo negativo. Assim, as catecolaminas são produzidas em quantidades que excedem a capacidade de armazenamento pelas vesículas, acumulando-se no citoplasma, onde são submetidas a um processo de metabolização intracelular. Quer as catecolaminas em excesso, quer os 103 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 seus metabolitos sofrem difusão para a circulação sanguínea, atingindo os diferentes órgãos alvo, onde desencadeiam os seus efeitos. Há a destacar o predomínio de noradrenalina no interior das células tumorais, contrariamente ao que acontece nas células normais da medula supra-renal. Tradicionalmente, a hipertensão arterial induzida pelo feocromocitoma era interpretada como resultando apenas da acção das catecolaminas circulantes sobre os receptores do sistema cardiovascular, estando a actividade do sistema nervoso simpático (SNS) normal ou deprimida. Posteriormente, estudos clínicos e experimentais, mostraram que a actividade do SNS permanece intacta, podendo até ser potenciada, o que constitui um factor de manutenção da hipertensão arterial. Desta forma, a estimulação do sistema nervoso pelo stress, dor ou anestesia, poderá induzir uma libertação de catecolaminas nas fendas sinápticas, desencadeando uma crise hipertensiva.1 Os feocromocitomas têm a capacidade de segregar outros peptídeos, alguns dos quais podem contribuir para o quadro clínico. Destacam-se a PTHrP (hipercalcémia), a ACTH (síndroma de Cushing), a eritropoietina (eritrocitose), a IL-6 (febre) e o neuropeptídeo Y. Este último tem acção vasoconstrictora, através do aumento da resistência vascular periférica e coronária, por actuação em receptores acoplados à proteína G. A cromogranina A, não produzindo manifestações clínicas, tem sido encarada como um marcador tumoral potencial. Por último, em situações de feocromocitoma maligno, é frequente a existência de níveis elevados de Enolase Neurónio Específica (NSE).1,2 DIAGNÓSTICO DIFERENCIAL Os feocromocitomas apresentam manifestações clínicas muito variáveis, o que 104 implica considerar um conjunto de patologias ao estabelecer o diagnóstico diferencial. As principais patologias a ter em conta são: hipertensão arterial essencial, hipertensão renovascular por estenose da artéria renal, patologia psiquiátrica (nomeadamente ansiedade e distúrbio de pânico), hipertiroidismo, síndroma carcinóide, taquicardia paroxística, menopausa, enxaqueca, lesões intracraneanas, epilepsia, préeclampsia e eclampsia, hipoglicemia, ingestão de drogas (cocaína, anfetaminas, efedrina,...), infecções agudas, apneia obstrutiva do sono e mastocitose.1,2 DIAGNÓSTICO 1. CLÍNICO O quadro clínico é caracterizado por manifestações diversas, dependendo da variação da secreção hormonal, do padrão de libertação, e das diferenças individuais na sensibilidade às catecolaminas. Na prática, as manifestações resultam dos efeitos cardiovasculares, viscerais e metabólicos das catecolaminas, sendo semelhantes nos casos esporádicos e familiares. A principal diferença reside na idade de apresentação, mais precoce no segundo caso. A principal manifestação clínica é a hipertensão arterial, podendo ser paroxística (48%) ou persistente (29%), ligeira ou severa, frequentemente resistente à terapêutica antihipertensora instituída. Um aspecto a salientar é a ausência de correlação entre os níveis de catecolaminas circulantes e o grau de hipertensão arterial, o que pode ser justificado pelos seguintes factos: – diferenças individuais na sensibilidade dos vasos às catecolaminas; – mecanismo de “down regulation” (a libertação constante de catecolaminas condiciona redução da sensibilidade dos receptores adrenérgicos); © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 – resposta adaptativa com redução da volémia, secundária à vasoconstrição mantida; – secreção de substâncias vasodilatadoras pelo tumor, que modificam a resposta dos vasos às catecolaminas.3 Uma crise hipertensiva típica caracteriza-se pela elevação súbita da tensão arterial, de forma espontânea ou induzida por uma cirurgia, drogas, palpação abdominal ou algaliação. Os doentes referem cefaleias (80%), sudorese (70%) e palpitações (60%). A duração da crise é variável, desde minutos a horas. A periodicidade é também extremamente variável, desde vários episódios diários até intervalos de meses sem crises. No entanto, a tendência é para o aumento progressivo da frequência e da gravidade das crises.1,2,3 No que diz respeito a outras manifestações clínicas, destacam-se: ansiedade, taquicardia, arritmia, sensação de morte eminente, parestesias, tremor das extremidades, toracalgia, palidez ou rubor facial, tonturas, síncope, náuseas e dor abdominal. Cerca de 8% dos doentes encontram-se perfeitamente assintomáticos, habitualmente aqueles que têm formas familiares da doença, ou grandes tumores quísticos, no interior dos quais as catecolaminas são metabolizadas e fracamente libertadas. Os casos assintomáticos são diagnosticados, sobretudo, durante o estudo de incidentalomas da supra-renal.1,10 Destes, cerca de 5% revelam tratar-se de feocromocitomas. Relativamente aos tumores malignos, a sua apresentação clínica é semelhante à dos benignos, com excepção da existência de sintomas iniciais relacionados com a malignidade: dores ósseas, massas palpáveis, alterações neurológicas ou dispneia.3 Os episódios agudos cardiovasculares (arritmias, choque, miocardite, miocardiopatia dilatada, insuficiência cardíaca e edema agudo do pulmão) e neurológicos (convul- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO sões ou efeitos neurológicos focais) podem ser o quadro clínico de apresentação e inclusivamente constituir a causa de morte. Deste modo, estima-se que cerca de um terço dos feocromocitomas sejam diagnosticados apenas após a morte do doente.1,11 2. BIOQUÍMICO O objectivo da avaliação laboratorial, em doentes com clínica sugestiva de feocromocitoma, é demonstrar a produção excessiva de catecolaminas, principalmente noradrenalina e adrenalina. Na maioria dos casos, o diagnóstico é possível através do doseamento destas e dos seus metabolitos no plasma e na urina.3 Dada a heterogeneidade destes tumores, têm diferentes padrões qualitativos de secreção, assim como variação temporal na sua actividade. Apenas a combinação de vários testes permite aumentar a sensibilidade e especificidade.1 Catecolaminas livres urinárias e seus metabolitos Para detectar a presença de feocromocitoma, o doseamento da adrenalina, noradrenalina e seus metabolitos (metanefrina, normetanefrina e ácido vanilmandélico) são frequentemente necessários. A demonstração de um nível de noradrenalina urinária superior a 170 μg/24 horas, adrenalina superior a 35 μg/24 horas, metanefrinas totais superiores a 1,8 mg/24 horas e ácido vanilmandélico superior a 11 mg/24 horas tornam o diagnóstico de feocromocitoma altamente provável.1,4 Um aspecto a destacar é a interferência de fármacos, nomeadamente antidepressivos tricíclicos, inibidores da MAO, buspirona, descongestionantes nasais, levodopa e diuréticos nestes doseamentos, pelo que deverão ser interrompidos pelo menos duas semanas antes das colheitas. Para além disso, alguns alimentos, tais como o café, 105 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 chá, chocolate e baunilha podem também interferir.2,3 Há ainda a referir a possibilidade de elevação dos níveis de catecolaminas em situações de stresse e ansiedade, sendo as metanefrinas muito menos afectadas.1 Catecolaminas plasmáticas A maioria dos doentes com feocromocitomas hormonalmente activos apresentam elevação da adrenalina e da noradrenalina, alguns exclusivamente da noradrenalina e outros apenas da adrenalina. Estas diferenças reflectem variações na expressão da enzima responsável pela conversão da noradrenalina em adrenalina.1 A colheita de sangue deve ser efectuada em repouso, cerca de 20 minutos após a colocação do catéter numa veia periférica, devendo-se proceder à determinação da tensão arterial antes da colheita.3 Ainda assim, é impossível excluir um feocromocitoma se a colheita for realizada num período em que o doente está normotenso e assintomático. Paralelamente, catecolaminas plasmáticas normais num doente hipertenso e sintomático tornam pouco provável o diagnóstico de feocromocitoma.1 Metanefrinas plasmáticas fraccionadas As metanefrinas plasmáticas são continuamente produzidas e libertadas pelo tumor, em contraste com as catecolaminas plasmáticas, que são libertadas de modo intermitente. As técnicas recentes de cromatografia líquida de alta pressão (HPLC) permitem o doseamento das várias fracções das metanefrinas (metanefrina, normetanefrina e metoxitiramina, o metabolito da dopamina), separadamente. O valor diagnóstico da determinação fraccionada destes metabolitos é superior ao das metanefrinas totais, uma vez que permite uma melhor detecção de tumores que produzem predominante- 106 mente um dos três metabolitos. Apresenta elevada sensibilidade, funcionando como um excelente método de rastreio de feocromocitoma. Deverão efectuar o rastreio bioquímico desta patologia todos hipertensos jovens e os doentes com manifestações clínicas sugestivas, principalmente: paroxismos de palpitações, cefaleias e sudorese, hipertensão arterial lábil, história familiar de feocromocitoma, manifestações das síndromas genéticas associadas ao feocromocitoma, incidentaloma da supra-renal e crises de hipertensão ou arritmias desencadeadas por fármacos, pela anestesia, cirurgia ou parto. O principal problema destes doseamentos é a sua disponibilidade limitada. Perante um doseamento de metanefrina superior a 236 pg/mL ou normetanefrina superior a 400 pg/mL, a probabilidade de feocromocitoma é muito elevada, o que implica a imediata realização de exames complementares para estabelecer a sua localização.1,12 Cromogranina A sérica A cromogranina A tem sido sugerida como um doseamento alternativo, útil para o diagnóstico de feocromocitoma, uma vez que a sua secreção e determinação não são influenciadas pelos antihipertensores habitualmente utilizados. É considerado um marcador com elevada sensibilidade, porém com baixa especificidade. A sua eliminação ocorre por via renal, daí que em doentes insuficientes renais crónicos, um valor elevado possa constituir um falso positivo. Os níveis séricos deste marcador são directamente proporcionais à massa tumoral, e particularmente elevados em caso de malignidade. É sobretudo um marcador tumoral útil no seguimento destes doentes, uma vez que os seus níveis sofrem elevação no contexto de uma recidiva ou metastização.1,3 © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 Testes farmacológicos A indicação para realização de testes farmacológicos tem lugar em doentes que apresentem valores intermédios nos doseamentos de catecolaminas, habitualmente entre 500 e 2000pg/mL. Os testes de estimulação, com administração de histamina ou glucagon, são raramente utilizados. O glucagon estimula a produção de catecolaminas, sendo o teste positivo se ocorrer uma elevação três vezes superior ao valor inicial, ou se as catecolaminas se elevarem acima de 2000 pg/mL. Este teste apresenta elevada especificidade, mas baixa sensibilidade, sendo fundamental monitorizar a tensão arterial do doente durante a sua realização e ter disponível fentolamina para o tratamento de uma eventual crise hipertensiva que o teste possa desencadear. Os testes supressivos são considerados mais fisiológicos e seguros do que os de estimulação, sendo o teste da clonidina o mais utilizado. A clonidina é um agonista dos receptores α2 adrenérgicos localizados no cérebro e sistema nervoso simpático, com a capacidade de bloquear o tónus simpático, por inibição da libertação da noradrenalina. Através do teste da clonidina, pretendese detectar produção autónoma de catecolaminas. O teste é realizado com o doente em jejum, em decúbito dorsal, procedendo-se à determinação das catecolaminas e metanefrinas plasmáticas antes e 3 horas após a administração da clonidina oral numa dose de 0,3 mg por cada 70 Kg de peso corporal. Numa situação de normalidade, observa-se uma redução das catecolaminas plasmáticas superior a 50% do valor inicial e para níveis inferiores a 500 pg/mL. No caso da presença de feocromocitoma, não se verifica uma redução significativa destes valores, embora a tensão arterial possa diminuir.1 © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 3. TOPOGRÁFICO Somente após a confirmação bioquímica do feocromocitoma se deve partir para os exames imagiológicos destinados à sua localização. Habitualmente, recorre-se à combinação de dois exames imagiológicos e funcionais para uma localização precisa.1,3 TAC e RM A Tomografia Axial Computorizada (TAC) e a Ressonância Magnética (RM) são os exames de primeira linha, devendo-se proceder inicialmente ao estudo abdominal, uma vez que a localização mais frequente destes tumores é na medula suprarenal. Na TAC, os pequenos feocromocitomas medindo 1 a 2 cm, apresentam um aspecto homogéneo, com densidade de tecidos moles (40 a 50 UH) e captação uniforme do contraste. Os tumores maiores podem ser heterogéneos, com àreas de baixa densidade, nomeadamente por presença de zonas de necrose tumoral ou hemorragia.1,13 Na RM, os feocromocitomas são isointensos relativamente ao músculo e fígado em T1 e hiperintensos em T2.2 No caso de ausência de tumor intraabdominal, procede-se ao estudo das regiões cervical e torácica. Embora a TAC apresente uma elevada sensibilidade, a RM é superior, constituindo o método de eleição em crianças e grávidas, pela menor exposição à radiação. As suas principais desvantagens são o custo e as contra-indicações gerais da técnica (próteses metálicas, pacemaker, claustrofobia,...).1,3 Um aspecto a destacar é a presença de massas na supra-renal (incidentalomas) em 5 a 9% da população geral, 90% dos quais são benignos e 85% não funcionantes. No entanto, a sua identificação implica a realização de um estudo com o objectivo de excluir a existência de hipersecreção e de 107 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 malignidade (tumores primitivos ou metastização para a supra-renal).1 Cintigrama com I -MIBG e I123-MIBG 131 A meta-iodo-benzil-guanidina tem semelhança estrutural com a noradrenalina, sendo captada e concentrada nos grânulos de secreção. Este composto não é metabolizado, garantindo uma avaliação funcional do nódulo suspeito de feocromocitoma, após administração do composto marcado. Apresenta uma elevada sensibilidade (83 a 100%) e especifidade superior a 95%, o que permite confirmar a presença do feocromocitoma, detectar tumores pequenos e multifocais, por vezes não diagnosticados pela TAC e RM e pesquisar metástases. Os falsos positivos são raros, mas pode haver falsos negativos, resultantes da interacção com fármacos, nomeadamente o haloperidol e o labetalol.2 Tomografia com Emissão de Positrões (PET) A PET utiliza como marcador o 18 Ffluordeoxiglicose, um composto absorvido pelos tecidos metabolicamente activos. Este método tem menor especificidade que o cintigrama com MIBG, porque se verifica fixação em todos os tecidos com elevada taxa metabólica, nomeadamente na presença de infecção ou inflamação. Além disso, tratase de um método dispendioso.2 Cintigrama de pesquisa de receptores da somatostatina Cerca de 70% dos feocromocitomas expressam receptores da somatostatina, particularmente dos subtipos 2 e 4, daí que a utilização do octreótido, um análogo da somatostina, possa permitir a identificação destes tumores. No entanto, esta técnica tem uma baixa sensibilidade (25%).2 108 TERAPÊUTICA: Após a localização precisa do tumor, a etapa seguinte consiste na sua remoção cirúrgica, com o objectivo de estabelecer a cura definitiva nos casos benignos e de evitar a disseminação metastática nos malignos.1 PREPARAÇÃO PRÉ-OPERATÓRIA A preparação pré-operatória tem como objectivos controlar a hipertensão arterial, evitar a ocorrência de paroxismos e corrigir uma eventual hipovolémia, estabilizando o doente do ponto de vista hemodinâmico, antes de qualquer procedimento cirúrgico. Caso contrário, os doentes correm o risco de desenvolver hipotensão grave e mesmo choque hipovolémico, após a remoção do tumor, dado o consequente desaparecimento da vasoconstrição. 1. BLOQUEIO ALFA Tem como objectivo principal evitar a libertação súbita de catecolaminas durante a cirurgia. O fármaco de eleição é a fenoxibenzamina, um bloqueador α1 e α2 adrenérgico, não competitivo e de acção prolongada. A dose diária inicial é 10mg, devendo ser aumentada progressivamente, em cada três a cinco dias, até que a tensão arterial seja inferior a 140/90 mmHg. Os principais efeitos adversos são habitualmente bem tolerados, incluindo cefaleias, congestão nasal e taquicardia reflexa. Este fármaco deve ser suspenso 48 horas antes da cirurgia, devido à sua longa semi-vida. Durante a preparação do doente, a tensão arterial e a frequência cardíaca devem ser avaliadas diariamente. Os fármacos alternativos são a prazosina e a doxazosina, bloqueadores α1 específicos, competitivos e com menor duração de acção. Estes devem ser suspensos apenas 8 horas antes da cirurgia. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 Em alternativa, pode-se recorrer aos bloqueadores dos canais de cálcio, nomeadamente nifedipina, habitualmente bem tolerada.2,3 2. BLOQUEIO BETA O bloqueio dos receptores β está indicado no caso de se verificar o aparecimento ou persistência de taquicardia e arritmias. Deverá ser iniciado somente após o início do bloqueio β, uma vez que isoladamente pode desencadear uma crise hipertensiva. O fármaco de eleição é o propanolol.2,3 Cirurgia A supra-renalectomia é a única terapêutica definitiva, ao remover todos os focos de tecido tumoral. A cirurgia pode ser realizada por via aberta ou laparoscópica, esta última cada vez mais utilizada. Nas últimas décadas, verificou-se uma redução progressiva da mortalidade cirúrgica, que actualmente é de cerca de 2,4%. Para esta melhoria contribuiu o treino e diferenciação das equipas cirúrgicas, o uso adequado de hipotensores e o controlo hemodinâmico rigoroso intra e pós-operatório.1 Durante a cirurgia, é fundamental manter uma vigilância apertada dos parâmetros vitais, pela possibilidade de ocorrência de eventos potencialmente fatais: – Crise hipertensiva, como consequência do pneumoperitoneu, na laparoscopia, ou por manipulação directa do tumor. O tratamento tem de ser imediato, sendo o nitroprussiato de sódio o fármaco de eleição; – Hipotensão e choque, por redução brusca da volémia, previamente compensada pela vasoconstrição extrema; – Arritmias ventriculares e supra-ventriculares; – Hipoglicemias, resultantes da libertação súbita de catecolaminas no pós- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO operatório, com aumento da secreção de insulina.3 Avaliação pós-operatória Após a remoção da massa tumoral, as crises adrenérgicas devem cessar de imediato. No entanto, o doente pode manter uma hipertensão transitória, no pós-operatório precoce, pelo facto de ocorrer a libertação de reservas de catecolaminas a partir das terminações adrenérgicas. Se a hipertensão se mantiver para além desse período, a justificação pode ser a existência de um resíduo tumoral ou a eventual ocorrência de uma lesão da artéria renal durante a cirurgia, com indução de hipertensão renovascular. A normalização das catecolaminas e metanefrinas plasmáticas e urinárias apenas deverá ser avaliada, em média, dez dias após a intervenção cirúrgica. Se permanecerem elevadas, há que ponderar a hipótese de realização de um cintigrama com MIBG, para detecção de eventuais metástases.3 Tratamento do feocromocitoma maligno O tratamento do feocromocitoma maligno inclui a cirurgia citorreductora, o controlo farmacológico da sintomatologia, a radioterapia e a terapêutica sistémica antineoplásica. A cirurgia citorreductora (“debulking”) é considerada paliativa, mas permite reduzir a exposição aos elevados níveis de catecolaminas circulantes e pode, eventualmente, melhorar a resposta a outras terapêuticas. Os fármacos bloqueadores α adrenérgicos, os bloqueadores dos canais de cálcio e a α-metiltirosina permitem apenas uma melhoria clínica, através da redução da síntese de catecolaminas. A utilização da radioterapia convencional e dos outros métodos de acção local, nomeadamente a crioablação, tem como 109 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 objectivo aliviar as complicações locais, sobretudo as metástases ósseas, pois o feocromocitoma apresenta elevada resistência à radioterapia. Em contraste, a terapêutica com MIBG, um método introduzido em 1983, induz reduções tumorais, sobretudo parciais, em 24 a 45% dos casos. Deste modo, pode permitir alcançar a estabilização da doença e alívio da sintomatologia. Pode ser utilizada isoladamente ou associada à quimioterapia, apresentando uma ligeira toxicidade, particularmente trombocitopenia, náuseas e disfunção tiroideia. Em 1985, foi proposto um protocolo de quimioterapia que inclui ciclos de ciclofosfamida, vincristina e dacarbazina. Apesar da sua toxicidade, sobretudo a nível neurológico e medular, permite uma remissão parcial ou completa em 57% dos casos. No entanto, este benefício tem curta duração, com períodos de remissão inferiores a dois anos. Existem relatos esporádicos de outros protocolos, nomeadamente utilizando cisplatina, 5-fluoruracilo e talidomida, com eficácia limitada. Por último, os análogos da somatostina (octreótido e lanreótido) têm sido experimentados, também com eficácia limitada. Em resumo, não existe uma terapêutica eficaz para o feocromocitoma maligno, embora alguns doentes respondam favoravelmente à quimioterapia ou à radioterapia com MIBG. Uma vez que a história natural da doença é extremamente variável, nos casos de doença rapidamente progressiva, a abordagem de primeira linha deverá ser a quimioterapia e nos casos lentamente progressivos a terapêutica com MIBG. No caso de falência desta, poder-se-à então recorrer à quimioterapia. Os análogos da somatostatina são fármacos de última linha, com indicação caso falhem as outras terapêuticas.1,14 110 EVOLUÇÃO E PROGNÓSTICO O feocromocitoma é, em geral, um tumor benigno. Os factores associados ao bom prognóstico são o diagnóstico precoce, a excisão total do tumor primário e a excisão agressiva de tumores recidivantes e de metástases. O diagnóstico de doença maligna é estabelecido pela presença de metástases em locais onde normalmente não existe tecido cromafim. Os dados da literatura apontam para que 10 a 15% sejam malignos, sendo os órgãos preferenciais de metastização os gânglios linfáticos, fígado, ossos e pulmões. Os principais factores sugestivos de malignidade são os seguintes: elevadas dimensões do tumor (superior a 6 cm), invasão das estruturas locais verificada durante a cirurgia, localização extra-supra-renal, aneuploidia ou tetraploidia do DNA das células, reduzida expressão da subunidade inibina/activina βB e expressão do neuropepídeo Y.1 Os tumores benignos têm um excelente prognóstico, com sobrevida de 96% ao 5 anos.2 No que diz respeito aos malignos, a sobrevida média é bastante inferior, cerca de 44% aos 5 anos. O doente pode ter intervalos livres de sintomas de duração muito variável, desde meses a anos. Por outro lado, pode surgir metastização vários anos após a remoção cirúrgica de um tumor aparentemente benigno, o que demonstra a incapacidade de previsão de quais os tumores que evoluem para a malignidade.14 No caso do feocromocitoma maligno, a evolução da doença também é muito diversa, existindo doentes nos quais a progressão é extremamente rápida e progressiva, culminando com a morte, enquanto que em outros doentes é bastante indolente, ocorrendo lentamente ao longo de vários anos. 2,3,14 © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 SEGUIMENTO Dada a probabilidade de recorrência do feocromocitoma, o seguimento é para toda a vida do doente, particularmente quando se trata de formas hereditárias, ou de localização extra-supra-renal. O seguimento é clínico, bioquímico e imagiológico, devendo ser trimestral no primeiro ano, e anual nos primeiros cinco a dez anos.1 BIBLIOGRAFIA 1. 2. 3. 4. 5. 6. 7. 8. 9. Karagiannis A, Mikhaidilis DP, Athyros VG, Harsoulis F. 2007 Pheocromocytoma: an update on genetics and management. Endocrinol Related Cancer 14: 935-956. Gardner DG, Shoback D. 2007 Adrenal medulla & Paraganglia. Greenspan’s Basic & Clinical Endocrinology 8th edition 12: 421-469. Pereira MAA, Souza BF, Freire DS, Lucon AM. 2004 Feocromocitoma. Arq Bras Endocrinol Metab 48 (5): 751-775. Bravo EL, Tagle R 2003. Pheochromocytoma: state-of-the-art and future prospects. Endocrine Reviews 24: 539-553. Goldstein RE, O’Neill JA, Holcomb GW, Morgan WM et al. 1999 Clinical experience over 48 years with pheochromocytoma. Annals of Surgery 229: 755-764. Maher ER, Webster AR, Richards FM, Green JS et al. 1996 Phenotypic expression in von Hippel-Lindau disease: correlations with germline VHL gene mutations. Journal Medical Genetics 33: 328-332. Schussheim DH, Skarulis MC, Agarwal SK, Simonds WF et al. 2001 Multiple endocrine neoplasia type 1: new clinical and basic findings. Trends Endocrinol Metab 12: 173-178. Recasens M, Oriola J, Fernandez-Real JM, Roig J, Rodriguez- Hermosa JI et al. 2007 Asymptomatic bilateral adrenal pheochromocytoma in a patient with a germline V804M mutation in the RET proto-oncogene. Clinical Endocrinol 67: 29-33. Baysal BE, Willett-Brozick JE, Lawrence EC, Drovdlic CM et al. 2002 Prevalence of SDHB, SDHC and SDHD germline mutations in clinic patients with head and neck paragangliomas. J © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Medical Genetics 39: 178-183. 10. Kudva YC, Young WF, Grant CS and van Heerden JA. 1999 Adrenal incidentaloma: an important component of the clinical presentation spectrum of benign sporadic pheochromocytoma. Endocrinologist 9: 77-80. 11. Sutton MG, Sheps SG and Lie JT. 1981 Prevalence of clinically unsuspected pheochromocytoma: review of a 50-year autopsy series. Mayo Clinic Proceedings 56: 354-360. 12. Eisenhofer G, Goldstein DS, Walther MM, Friberg P et al. 2003 Biochemical diagnosis of pheochromocytoma: how to distinguish true from false positive test results. J Clin Endocrinol Metab 88: 2656-2666. 13. Dacie JE and White FE. 1993 Radiology of endocrine disease. Atlas of Endocrine imaging, pp 1-78. 14. Schollz T, Eisenhofer G, Pacak K, Dralle H and Lehnert H. 2007 Clinical review: Current treatment of malignant pheochromocytoma. J Clin Endocrinol Metab 92 (4): 1217-1225. 111 Artigos de Revisão Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 113 ... 129 Características clínico-laboratoriais e sobrevida em doentes com tumores neuroendócrinos do estômago Ana Candeias1, John Preto2, José Manuel Lopes3 Aluna do 6ºano do Mestrado Integrado em Medicina, Faculdade de Medicina da Universidade do Porto Serviço de Cirurgia do Hospital de São João, EPE, Faculdade de Medicina da Universidade do Porto (FMUP) 3 Serviço de Anatomia Patológica do Hospital de São João, EPE, Professor Associado da Faculdade de Medicina da Universidade do Porto (FMUP), Instituto de Patologia e Imunologia Molecular da Universidade do Porto (IPATIMUP) 1 2 Correspondência Ana Candeias › E-mail: catpinh@gmail.com RESUMO Os tumores neuroendócrinos (NETs) do estômago são neoplasias raras, correspondendo a <1% das neoplasias gástricas. Na maioria dos casos, os tumores neuroendócrinos do estômago derivam das células neuroendócrinas idênticas às células enterocromafins (Enterochromaffin-like ECL) que estão envolvidas no controlo da secreção ácida no estômago. Os NETs gástricos são classificados clinicamente em três tipos, de acordo com a patologia gástrica associada: o tipo I, que ocorre em doentes com gastrite crónica atrófica; o tipo II, que ocorre associado à sindroma de Zollinger-Ellison (ZES); e o tipo III, também designado de NET gástrico esporádico, que não se associa às patologias gástricas dos outros subtipos. Os NETs gástricos do tipo I e II ocorrem com hipergastrinemia. Apesar da gastrina poder causar hiperplasia e displasia das ECL não é suficiente para causar desenvolvimento tumoral. Cofactores como mutações, factores de crescimento e alterações nas proteínas do mesênquima têm vindo a ser propostos na patogenia dos NETs gástricos. Os NETs gástricos do tipo I são considerados tumores com comportamento benigno, com risco mínimo de metastização. Os NETs gástricos do tipo II e III cursam mais frequentemente com metastização à distância. A abordagem terapêutica depende do subtipo e do estadiamento dos NETs gástricos. Os tumores do tipo I e II podem ser tratados com remoção endoscópica ou exérese cirúrgica, dependendo da extensão local e considerando a causa da hipergastrinemia. Os NETs do tipo III têm indicação cirúrgica. Existem várias modalidades disponíveis para a terapêutica da doença metastática incluindo quimioterapia, radioterapia e radiologia de intervenção. O prognóstico dos NETs gástricos do tipo I e II é bom, com taxas de sobrevida cumulativa aos 5 anos de 78-100%. Os NETs gástricos do tipo III têm pior prognóstico, com taxa de sobrevida cumulativa aos 5 anos <50%. PALAVRAS-CHAVE Tumores neuroendócrinos do estômago; célula ECL; hipergastrinemia; gastrite crónica atrófica; síndroma de Zollinger-Ellison. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 113 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 ABSTRACT Gastric neuroendocrine tumors (NETs) are rare, representing less than 1% of all stomach neoplasms. Most gastric NETs derive from enterochromaffin-like (ECL) cells, involved in the control of gastric acid secretion. Gastric NETs are classified in three types based on the gastric pathology background: type I, chronic atrophic gastritis; type II, multiple endocrine neoplasia and ZollingerEllison syndrome; and sporadic type III, without any background pathology. Types I and II are associated with hypergastrinaemia. Despite gastrin can cause ECL hyperplasia and dysplasia, it is not sufficient for tumor development. Other cofactors for the development of gastric NETs have been proposed including genetic mutations, growth factors and factors from the mesenchyme. Type I tumors behavior is benign, with minimal risk for metastases. Type II and III are frequently associated with distant metastases. The therapeutic approach depends on tumour subtype and staging of gastric NETs. Type I and II may be treated with endoscopic excision or surgical resection depending on the local extension and considering the cause of hypergastrinaemia. Type III has surgical indication. There are several methods available for the treatment of metastatic disease including chemotherapy, radiotherapy and radiological intervention. The prognosis of type I and II is good, with 78-100% of 5-year cumulative survival rate. Type III neuroendocrine tumours have worse prognosis, with <50% of 5-year cumulative survival rate. KEY WORDS Gastric neuroendocrine tumors; ECL cell; hypergastrinaemia; chronic atrophic gastritis; ZollingerEllison syndrome. 1. INTRODUÇÂO Os tumores neuroendócrinos gastrointestinais têm origem em células neuroendócrinas que expressam certas proteínas, como a sinaptofisina e a cromogranina A, variando a sua produção hormonal consoante o tipo de célula neuroendócrina e a localização no tracto gastrointestinal.1 Os tumores neuroendócrinos do estômago são neoplasias raras que têm aumentado de incidência nos últimos anos.2,3 Têm origem geralmente em células neuroendócrinas idênticas às células enterocromafins (enterochromaffin-like – ECL), localizadas no corpo/fundo gástrico.4,5 As alterações neoplásicas das células ECL ocorrem, na maioria dos casos, associadas a hipergastrinemia.4 A relação da hipergastrinemia com o desenvolvimento de tumores neuroendócrinos gástricos tem sido associada com o uso frequente de inibidores de bomba de 114 protões (IBP) e a consequente hipergastrinemia por inibição da secreção ácida.6 Este trabalho tem como objectivo rever características clínico-laboratoriais e terapêuticas relevantes para a sobrevida em doentes com tumores neuroendócrinos do estômago. 2. EPIDEMIOLOGIA E ETIOLOGIA 2.1 EPIDEMIOLOGIA Os tumores neuroendócrinos (NETs) do estômago são neoplasias raras, correspondendo a menos de 1% das neoplasias gástricas.2 A incidência dos NETs gástricos ajustada à idade é de 0,2 por 100,000 habitantes/ano.3 No entanto, uma vez que a maioria destes tumores é assintomática, a incidência pode ser maior.7 Ao longo das últimas cinco décadas, © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 verificou-se um aumento da incidência dos NETs gástricos, correspondendo a cerca de 4,1% de todos os NETs registados durante esse período, e a 8,7 % dos NETs gastrointestinais de acordo com os dados mais recentes.2,3 Existem, contudo, dúvidas se este aumento poderá corresponder a um verdadeiro aumento de incidência ou a uma maior utilização de técnicas de endoscopia, radiologia e imunohistoquímica.3 A frequência dos NETs gástricos, por género e raça, indica um predomínio no género feminino (64,5%), como acontece com a maioria dos NETs (55,1%), sendo maior nos indivíduos de raça negra comparativamente aos de raça caucasiana (1\1,06RR).2 Apesar de não estar esclarecido, verificase que os doentes com NETs gástricos têm uma média de idade ao diagnóstico inferior à de outras neoplasias do estômago (63 e 69 anos, respectivamente).2 2.2 ETIOLOGIA A principal função do estômago é a digestiva e está dependente da secreção ácida que é regulada por células neuroendócrinas. A mucosa gástrica humana é constituída por, pelo menos, 6 tipos de células neuroendócrinas: as células idênticas às enterocromafins (enterochromaffin-like ECL), as células G, as células enterocromafins (enterochromaffin - EC), as células D, as células D1/P e as células X.4 As células neuroendócrinas correspondem, no seu total, a uma minoria da massa celular gástrica, representando apenas 2% das células da mucosa.3,8 As células ECL correspondem a cerca de 35% das células neuroendócrinas gástricas e são produtoras de histamina, localizando-se profundamente na mucosa oxíntica do fundo/corpo gástrico, próximo das células parietais e principais.8 As células G, presentes no antro (na zona média da mucosa) do estômago, são produtoras de gastrina.4 As células D e as células EC, produtoras de somatostatina e serotonina, respectivamente, estão representadas em toda a mucosa gástrica.4 As células P /D1 são mais frequentes na mucosa ácido-péptica (oxíntica), correspondendo a uma pequena minoria no antro gástrico.9 Todas estas células neuroendócrinas podem ser encontradas em lesões tumorais. No entanto, os NETs do estômago têm, na sua maioria, origem nas células ECL e, raramente, nas células G ou EC.4,5 Em situações normais, a secreção ácida é complexa, envolvendo vários tipos celulares nomeadamente as células ECL, as células G e D que estão implicadas no controlo fisiológico das células parietais responsáveis pela produção e secreção de ácido clorídrico (HCl). (Figura 1)9 Numa fase inicial, a gastrina é produzida e secretada pelas células G do antro e do duodeno, como resposta à distensão gástrica e ao aumento do pH intraluminal resultante da ingestão alimentar e, via circulação sistémica, actua nos receptores colecistocina (CCK2) das faces basolateral e luminal das células ECL.9 Os receptores CCK2 estão associados a uma proteína Gq intracelular.8 A estimulação da proteína Gq activa a fosfolípase C da membrana celular que catalisa a formação de trifosfato de inositol e diacilglicerol a partir da hidrólise dos fos- FIGURA 1: Representação esquemática da secreção ácida no estômago (adaptado de Rindi et al 20049). Nervo Vago Gastrina + Célula G - + Célula ECL Gastrina + Célula parietal Histamina Célula D HCI Somatostatina © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 115 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 fatidilinositóis.10 O trifosfato de inositol fixase a receptores específicos na membrana do retículo endoplasmático que contém depósitos intracelulares de cálcio, promovendo o movimento deste ião do interior do retículo endoplasmático para o citosol, o que estimula a exocitose da histamina. A gastrina exerce ainda estimulação da activação da descarboxilase da histidina (Histidine Decarboxylase - HDC), que catalisa a descarboxilação da histidina em histamina, estimulando, desta forma, a produção da histamina. A histamina é depois armazenada em vesículas secretoras, através de um transportador vesicular de monoaminas tipo 2 (Vesicular Monoamine Transporter subtype 2 - VMAT 2). Para além da activação, a gastrina exerce um papel importante na expressão genética da HDC. A estimulação da transcrição da HDC é regulada pela Proteína Cinase C (Protein Kinase C - PKC), activação indirecta das proteínas c-fos e c-jun e estimulação da MAP kinase. As proteínas c-fos e c-jun formam um heterodímero, designado proteína activadora 1 (Activator Protein 1- AP-1) que é um factor de transcrição. O passo final da estimulação da transcrição da HDC depende da activação da proteína Raf, não sendo, contudo, necessária a activação da Ras. Paralelamente à estimulação da actividade da HDC, a gastrina aumenta a transcrição do gene da proteína cromogranina.10 A histamina actua nos receptores H2, presentes na membrana das células parietais, e estimula a secreção de HCl (efeito parácrino). A diminuição do pH gástrico inibe a secreção de gastrina, ou seja, condiciona uma regulação de inibição retroactiva da secreção gástrica, mediada pela secreção de somatostatina que é produzida nas células D.9 A somatostatina exerce um efeito directo nas células parietais, através da ligação a receptores da somatostatina subtipo 2 (SSR2) das células parietais, e indirecto nas células ECL, inibindo a secreção de histamina.8,9 O nervo vago estimula a secreção 116 de HCl, através da secreção de acetilcolina que actua em receptores M3, presentes na membrana das células parietais.8 Os tumores neuroendócrinos do estômago ocorrem na maioria dos casos associados a hipergastrinemia, em dois contextos patológicos distintos: a gastrite crónica atrófica do tipo A e a síndroma de Zollinger-Ellison (Zollinger-Ellison syndrome - ZES). Clinicamente, os NETs gástricos que se desenvolvem no contexto da gastrite crónica atrófica são classificados de NETs gástricos do tipo I e os NETs que se desenvolvem no contexto da ZES são classificados de NETs gástricos do tipo II.5,6,8,11 A gastrite crónica atrófica do tipo A resulta da destruição das células parietais do fundo gástrico, por um processo autoimune.12,13 Como resultado da destruição das células parietais ocorre diminuição da produção de HCl no estômago (acloridia) que tem como consequência a hiperplasia das células G no antro gástrico, a diminuição das células D e hipergastrinemia.12 A gastrina exerce um efeito proliferativo nas células ECL resultando em hiperplasia difusa linear e micronodular adenomatóide, da qual podem resultar NETs gástricos, após um período de latência de muitos anos.14 No entanto, os NETs gástricos do tipo I ocorrem apenas em alguns doentes com gastrite crónica atrófica. Esta evidência sugere que outros factores, além da gastrina, sejam necessários para o desenvolvimento tumoral.6,8,14 Os NETs gástricos do tipo I ocorrem maioritariamente em mulheres (70-80% dos casos), com média de idades de 50-60 anos.15 É o tipo mais comum, correspondendo a cerca de 68-83% do total de NETs gástricos.6,8,15,16 Os NETs gástricos do tipo II ocorrem em doentes com ZES, na maior parte dos casos no contexto da síndroma de Neoplasia Endócrina Múltipla tipo I (Multiple Endocrine Neoplasia type I - MEN-1).6 A MEN-1 é uma síndroma autossómica domi- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 nante causada por mutações no gene MEN1, localizado no cromossoma 11q13, que codifica uma proteína (menin) supressora tumoral.17 Esta síndroma é caracterizada pelo desenvolvimento de hiperplasia das paratiróides, tumores neuroendócrinos, adenomas da hipófise anterior e adenomas da suprarrenal. Outras manifestações, menos comuns, incluem: lipomas, colagenomas, angiofibromas e NETs gástricos e brônquicos. A ZES ocorre em 21-70% dos casos de MEN-1 e é causada pela secreção aumentada de HCl no estômago secundária a hipergastrinemia produzida por um gastrinoma.17 A secreção aumentada de ácido clorídrico causa doença ulcerosa péptica, esofagite erosiva e diarreia. A maioria dos gastrinomas localiza-se no duodeno (50-70%), pâncreas (20-40%) e outras localizações intra-abdominais: estômago, fígado e gânglios linfáticos.18 A ZES, no contexto da MEN-1, está associado a risco de 13-37% de desenvolvimento de NETs gástricos do tipo II, comparativamente ao risco de 0-2% nos doentes com ZES esporádico que desenvolvem este tipo de NET.8 Um estudo de ZES esporádicos (sem MEN 1) descreveu que a maioria (52% de 106 doentes com hipergastrinemia de 13-42 anos) apresentava alterações nas células ECL: hiperplasia linear e/ou alterações mais avançadas.19 Neste estudo, nenhum doente desenvolveu NET gástrico do tipo II. Alguns estudos descrevem alterações mais avançadas na proliferação das células ECL em 46-53 % dos doentes com ZES/MEN 1, que é uma percentagem superior à observada (10-13%) em doentes com ZES esporádico.19 A mutação heterozigótica no gene MEN1 e a presença da hipergastrinemia, causada por gastrinomas, estão provavelmente implicados no desenvolvimento de NETs gástricos do tipo II.14 Os NETs gástricos do tipo II são menos comuns, correspondendo <5-8% do total de NETs gástricos.5,8 Ocorrem com frequên- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO cia semelhante em homens e mulheres, com média de idades ao diagnóstico de 4550 anos.15 A relação da hipergastrinemia com o desenvolvimento de NETs em doentes com gastrite crónica atrófica e em doentes com ZES tem sugerido que níveis elevados de gastrina podem estar implicados no desenvolvimento de NETs gástricos.6,8 A hipergastrinemia tem sido implicada no desenvolvimento de NETs gástricos em modelos animais. Vários estudos realizados em animais, utilizando diversos métodos para a indução da hipergastrinemia (ex: drogas, cirurgia) demonstraram que a hipergastrinemia pode promover o desenvolvimento de NETs gástricos.8 Em humanos, contudo, estudos referentes à utilização de inibidores de bomba de protões (IBP) descrevem aumento de densidade das células ECL após tratamento com omeprazole e aumento significativo (p< 0,005) nas glândulas fúndicas após tratamento com lanzoprazole.20 No entanto, nenhum estudo demonstrou a ocorrência de NETs gástricos nestes contextos.21 A hipergastrinemia associada à vagotomia também não foi associada ao desenvolvimento de NETs gástricos em humanos.8 Este facto pode reflectir uma interacção importante, ainda não determinada, de neuropeptídeos e alterações genéticas. Os NETs gástricos do tipo III não cursam com níveis aumentados de gastrina (são habitualmente normais) nem se associam a qualquer das patologias gástricas dos outros subtipos.5,6 São, por isso, designados NETs gástricos esporádicos. A etiologia deste tipo de NET gástrico é desconhecida.8 Os NETs gástricos do tipo III correspondem a cerca de 15-23% dos NETs gástricos e são mais comuns em homens, com idade superior a 50 anos.5 No contexto de transformação neoplásica neuroendócrina no estômago descrevemse casos anedóticos de carcinomas neuroendócrinos de células pequenas (38 casos publicados desde 1976).22 Os carcinomas 117 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 neuroendócrinos de células pequenas podem ocorrer em qualquer localização, têm origem em células multipotenciais e apresentam grande variedade de características histológicas. São clinicamente agressivos e têm mau prognóstico, com sobrevida média de 6,5-14,9 meses.23,24 do confinados à mucosa são classificados como micro-NETs.25 FIGURA 2: Aspecto microscópico de NET gástrico que ultrapassa a muscular da mucosa. 3. PATOLOGIA E GENÉTICA 3.1 CARACTERÍSTICAS ANÁTOMOPATOLÓGICAS A maioria dos NETs gástricos tem origem nas células ECL e localiza-se frequentemente no fundo/corpo gástrico.6 As lesões precursoras dos NETs gástricos do tipo I e II são a hiperplasia e a displasia das células ECL.14 A hiperplasia das células ECL caracteriza-se por aumento do número de células ECL, com padrões linear, difuso ou micronodular, e menos de 150 μm de dimensão.5 A forma mais exuberante de hiperplasia das células ECL é a hiperplasia adenomatóide que está associada a hiperplasia micronodular acentuada.5,6 As lesões displásicas, com dimensões entre 150-500 μm, são constituídas por células moderadamente atípicas, núcleo aumentado hipercrómático, citoplasma moderadamente abundante e menor expressão de marcadores granulares como a cromogranina A (Chromogranin A- Cg A). Localizam-se profundamente na mucosa oxíntica e não ultrapassam a muscular da mucosa.5 As lesões displásicas correspondem à transição entre hiperplasia benigna e tumores neuroendócrinos e podem assumir quatro padrões morfológicos: 1) padrão expansivo constituído por nódulos> 150 μm; 2) micronódulos confluentes; 3) microinfiltração da lâmina própria; 4) nódulos envolvidos por estroma neoformado. Lesões> 500 μm designam-se tumores neuroendócrinos (figura 2); quan- 118 Os NETs gástricos do tipo I são bem diferenciados e localizados geralmente na mucosa e submucosa da parede gástrica.26 Os NETs gástricos do tipo I são constituídos por células ECL pequenas, homogéneas, com citoplasma eosinofílico finamente granular e núcleo redondo ou oval. As mitoses são infrequentes. A mucosa gástrica adjacente apresenta sinais de gastrite crónica, com infiltrado linfoplasmocitário denso na lâmina própria do corpo/fundo, poupando o antro, depleção marcada das células parietais, e lesões hiperplásicas e displásicas (cerca de 6% dos casos) de células ECL.25 Localizam-se habitualmente no corpo ou fundo do estômago e são geralmente multifocais. São frequentemente lesões pequenas (<1-2 cm) com baixo potencial de metastização (<5%)11, 27, 28 (Quadro I). Os NETs gástricos do tipo II são habitualmente múltiplos, pequenos (<1-2 cm) e compostos predominantemente por células ECL, embora alguns possam conter outros tipos de células neuroendócrinas.8 A morfologia dos NETs gástricos do tipo II e a hiperplasia das células ECL é idêntica à observada nos NETs do tipo I, mas a mucosa adjacente tem hipertrofia das glândulas oxínticas.25 © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 À semelhança dos NETs do tipo I, os NETs gástricos do tipo II localizam-se maioritariamente na mucosa oxíntica. Os NETs gástricos do tipo II apresentam geralmente invasão limitada à mucosa e submucosa gástrica, cerca de 30% invasão ganglionar e 10% metástases à distância.8 Os NETs gástricos do tipo III são geralmente tumores únicos e grandes (>2cm). Ocorrem com níveis de gastrina normais e sem alterações na mucosa gástrica adjacente.5 Embora sejam constituídos na sua maioria por células ECL, podem conter outras células neuroendócrinas, produtoras de serotonina, somatostatina ou gastrina.8 Embora muitos NETs do tipo III sejam bem diferenciados, outros são menos diferenciados com características atípicas, pleomorfismo nuclear, nucléolos proeminentes, áreas de necrose e expressão da p53.25 Quando diagnosticados, cerca de 15% dos tumores são localizados e >50 % dos doentes com NETs gástricos do tipo III têm metastização hepática.8 O diagnóstico e a caracterização das lesões precursoras e dos NETs gástricos devem basear-se em métodos complementares, para além do exame histológico com hematoxilina e eosina.25 As células ECL não têm características específicas que permitam a sua identificação com microscopia óptica mas podem ser identificadas por métodos de coloração argêntica, microscopia electrónica e imuno- histoquímica com anticorpos que identificam histamina, sinaptofisina (marcador de pequenas vesículas não-densas) e CgA (marcador de pequenas vesículas densas), que são marcadores característicos, mas não específicos, destas células neuroendócrinas.26,29 A identificação imunohistoquímica do trans-receptor vesicular monoamina (VMAT2) pode também ser usada para identificar células neuroendócrinas.5 Este receptor tem sido utilizado como marcador mais específico dos grânulos das células neuroendócrinas.6 Existem dois tipos de trans-receptores vesiculares de monoaminas: VMAT 1 e VMAT2. O VMAT 1 é detectado em células gastrointestinais produtoras de serotonina (EC) e o VMAT 2 em células produtoras de histamina (ECL).26 A Ki-67 é um antigénio nuclear estruturalmente associado à cromatina que é usado para avaliar a actividade proliferativa de células e tumores.30 A maioria dos NETs diferenciados tem índice proliferativo baixo (<2% de células tumorais Ki-67 positivas) associado a comportamento biológico mais benigno. Índices proliferativos mais elevados determinados com Ki-67 têm sido associados a comportamento maligno e pior prognóstico dos doentes com NETs gastrointestinais.30 A avaliação imunohistoquímica com Ki-67 e p53 permitiu, num estudo com 21 NETs gástricos, diferenciar o prognóstico dos doentes, sendo a maior expres- QUADRO I: Características dos NETs gástricos (adaptado de Delle Fave et al 20055, Ruszniewski et al 2006 63 e Burkitt et al 20066). Tipo I Tipo II Patologia associada Gastrite crónica atrófica ZES/MEN 1 – Frequência 68-83% 5-8% 15-23% Macroscopia Lesões polipóides únicas/múltiplas (<1-2 cm) Lesões polipóides, múltiplas (<1- 2 cm) Lesões polipóides únicas Geralmente ulceradas (>2 cm) Histopatologia Sem atipia celular Ki-67 < 2% Atipia celular ocasional Possibilidade de invasão e perda de diferenciação Ki-67 <2% Invasão frequente Atipia celular frequente Ki-67 >2% Gastrina sérica ↑↑ ↑↑ Normal Metastização Excepcional 10-30% 50-100% 78-100% Semelhante ao tipo I; uma minoria pode ter comportamento mais agressivo < 50% Sobrevida aos 5 anos © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Tipo III 119 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 são destes marcadores associada a pior sobrevida dos doentes.31 Vários factores investigados numa série com 102 NETs gástricos tornaram possível o desenvolvimento de um sistema de classificação histopatológica para os NETs gástricos.32 Foram propostos três graus histológicos (G1-G3): grau 1 (G1), caracterizado por estrutura monomorfa, microlobular-trabecular, discreta atipia celular e raras mitoses típicas (1-3/10 campos de grande ampliação (High Power Field-HPF); grau 2 (G2), caracterizado por agregados sólidos e elevado índice mitótico (>7/10 HFP); grau 3 (G3), carcinomas neuroendócrinos pouco diferenciados, com áreas sólidas, necrose extensa e elevado índice mitótico, com mitoses atípicas. 3.2 CARACTERÍSTICAS GENÉTICAS (CITOGENÉTICAS E MOLECULARES) – CARCINOGÉNESE E PROGRESSÃO DOS TUMORES NEUROENDÓCRINOS DO ESTÔMAGO A gastrina parece estar envolvida na proliferação das células parietais e das células ECL.10,33 As células progenitoras das células ECL não expressam receptor CCK2 e a resposta proliferativa parece estar relacionada com a libertação de factores de crescimento, como o factor de crescimento epidérmico ligando da heparina (heparin binding epidermal growth factor) e o factor transformador de crescimento alfa (Transforming Growth Factor-αTGF-α).6,8 A gastrina parece ter um efeito próproliferativo directo nas células ECL no desenvolvimento de NETs gástricos.6 Embora a hipergastrinemia seja essencial para o desenvolvimento de NETs do tipo I e II, não é suficiente para causar desenvolvimento tumoral.6 Outros co-factores como mutações genéticas, factores de crescimento e alterações nas proteínas do mesênquima têm vindo a ser propostos.5,6 A base molecular da patogénese dos NETs gástricos é ainda largamente desconhecida.5 O modelo genético mais estudado 120 nos NETs gástricos é a alteração do gene MEN-1 associado à síndroma de neoplasia endócrina múltipla (MEN-1).34 A MEN 1 é uma síndroma com transmissão autossómica dominante de alta penetrância, causada por mutação germinativa inactivante do gene MEN 1, localizado no cromossoma 11q13, que codifica uma proteína (menin) supressora tumoral. A mutação germinativa afecta o gene MEN-1, sendo o portador da mutação genética um heterozigótico com predisposição para o desenvolvimento tumoral.35 A inactivação somática do alelo não mutado (perda de heterozogotia) resulta no desenvolvimento das lesões associadas à síndroma MEN-1. Os NETs esporádicos do estômago ou que ocorrem num contexto hereditário apresentam frequentemente perda de heterozigotia para o locus da MEN-1. A perda de heterozigotia foi demonstrada em 75% de 23 casos de NETs gástricos hereditários e em 41% de 46 NETs gástricos esporádicos.36 O papel dos factores de crescimento envolvidos no desenvolvimento de NETs gástricos foi recentemente centrado na proteína Reg. A proteína Reg (Regenerating protein) foi identificada como factor de crescimento necessário à regeneração pancreática, tendo sido identificada em localizações extra-pancreáticas de animais e humanos, nomeadamente na mucosa gástrica onde é secretada pelas células ECL e células principais.37,38 No estômago, a proteína Reg estimula a proliferação das células parietais, a sua produção é estimulada pela gastrina e a sua expressão aumenta nas células ECL que rodeiam as úlceras da mucosa gástrica. Admite-se que a Reg é um possível regulador da regeneração da mucosa gástrica. No entanto, tendo em conta a acção endócrina da gastrina, o aumento da expressão da Reg exclusivamente nas células que rodeiam as lesões gástricas não pode ser explicado considerando apenas a gastrina, o que pressupõe o envolvimento de outros factores reguladores da expressão da Reg.37 Em ratos com mucosa gástrica lesa- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 da descreveu-se a libertação de uma citocina pró-inflamatória [CINC-β2‚-correspondente à interleucina 8 (IL 8) humana] que estimula a produção de Reg nas células ECL. Outras citocinas pró-inflamatórias não estimulam a secreção da proteína Reg nas células ECL.38 Um estudo recente descreveu o aumento da proteína Reg em NETs gástricos associados a hipergastrinemia e a mutação do gene Reg foi implicada no desenvolvimento de NETs gástricos de células ECL.37 Demonstrou-se que outros genes expressos na mucosa gástrica são regulados pela gastrina, nomeadamente o inibidor do activador do plasminogénio (Plasminogen Activator Inhibitor 2 - PAI-2) e a metaloproteinase 9 da matriz (Matrix Metalloproteinase 9- MMP-9), sugerindo um sistema no qual a gastrina exerce efeitos a longo prazo na remodelação da mucosa gástrica.39 O PAI-2 é um membro do sistema activador do plasminogénio uroquinase. A activação deste sistema é importante para a invasão celular através da regulação da migração celular e da degradação selectiva da matriz extracelular. Existe em quantidades baixas na mucosa gástrica normal, mas aumenta em condições com hipergastrinemia: gastrite crónica atrófica e ZES.40 A gastrina aumenta a expressão da metaloproteinase 7 da matriz (Matrix Metalloproteinase 7 - MMP-7) que estimula a proliferação de miofibroblastos, aumentando a matriz extracelular envolvente das células ECL. Esta expressão de MMP-7 foi descrita em adenocarcinomas gástricos e associada a mau prognóstico. Os mecanismos são desconhecidos, podendo resultar de alterações da matriz extracelular que promovem a fibrose, aumento da invasão celular, ou supressão da apoptose.41 Comparativamente às lesões do tipo I e II, que têm sido mais estudadas, pouco se sabe sobre a patogenia dos NETs gástricos do tipo III. Demonstrou-se a presença de mutações da p53, particularmente nos tumores pouco diferenciados.42,43 © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 4. APRESENTAÇÂO CLÍNICA A apresentação clínica da maioria dos NETs gástricos é variável e inespecífica. Geralmente são achados incidentais em doentes que realizam endoscopia digestiva alta por dispepsia.44 Os NETs gástricos podem manifestar-se com sintomas semelhantes aos das úlceras pépticas, pólipos gástricos hemorrágicos e adenocarcinomas gástricos.8 Há casos descritos com queixas de dor abdominal, hemorragia digestiva e anemia.45 Uma minoria (0,5-11%) de doentes com NETs gástricos pode apresentar características da síndroma carcinóide. A síndroma carcinóide resulta geralmente da libertação de histamina, bradicinina e outras substâncias, ainda não identificadas, produzidas pelo tumor.46 A apresentação clínica da síndrome carcinóide inclui rubor, edema facial, broncospasmo, diarreia, taquicardia e disfunção cardíaca direita.8 5. DIAGNÓSTICOS DIFERENCIAIS Tendo em conta a apresentação clínica dos NETs gástricos podem ser considerados os seguintes diagnósticos diferenciais: gastrite, úlcera péptica, adenocarcinoma gástrico, refluxo gastro-esofágico, hemorragia digestiva alta (úlcera péptica, varizes esofágicas, laceração de Mallory-Weiss).18 Devem ainda ser considerados: asma, anafilaxia, edema pulmonar, doença cardíaca isquémica, cardiomiopatia dilatada, síndromas de má absorção, diarreia crónica (osmótica, secretora, inflamatória, factícia ou esteatorreia) dor abdominal por disfunção neurológica, endócrina, de causa farmacológica ou mecânica, espasmo ou distensão visceral (obstrução intestinal, de canais pancreáticos, ureteral) e síndroma do intestino irritável. 121 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 6. DIAGNÓSTICO E ESTADIAMENTO 6.1 DIAGNÓSTICO Os NETs gástricos são geralmente identificados de forma incidental na endoscopia digestiva alta. A endoscopia digestiva alta permite a identificação e biopsia do NET gástrico, fornecendo informação acerca do número e tamanho dos tumores. Para além da identificação tumoral, a endoscopia permite a visualização e biopsia da mucosa gástrica adjacente, importante na caracterização do subtipo de NET gástrico.47 Os NETs gástricos ocorrem mais frequentemente como pólipos múltiplos e pequenos, de tonalidade amarelada.48 A mucosa adjacente pode ser macroscopicamente normal, especialmente nos NETs gástricos do tipo III, pode ter evidência de gastrite atrófica (tipo I) ou de úlcera péptica (tipo II).49 A maioria dos tumores localiza-se no corpo/fundo gástrico. No entanto, há casos descritos de NETs gástricos do tipo II no antro gástrico, sendo que os NETs do tipo III podem ocorrer em qualquer localização.49 Adicionalmente, a endoscopia é importante no tratamento dos NETs gástricos, permitindo a exérese.50 Os estudos de contraste de bário podem ser úteis na detecção de irregularidades da mucosa, nomeadamente na detecção de lesões polipóides, mas têm baixa sensibilidade para a detecção de lesões da submucosa.51 A determinação da localização e da extensão dos NETs gástricos são essenciais para o tratamento adequado. Vários métodos complementares de diagnóstico podem ser usados, nomeadamente a ecoendoscopia, a Tomografia Computorizada (TC), a Ressonância Magnética Nuclear (RMN), a PET (Positron Emission Tomography) e a cintigrafia com análogos de somatostatina (Quadro II). 52 122 QUADRO II. Diagnóstico da localização e da extensão de NETs gástricos e de gastrinomas (adaptado de Caplin et al 1998 47, Modlin et al 2008 52, Burkitt et al 2006 6 Jensen RT 2008 18). Meio Complementar de Diagnóstico NET primário Endoscopia digestiva com biopsia Ecoendoscopia Extensão ganglionar Ecoendoscopia Extensão metastática Cintigrafia com análogos da somatostatina TAC e/ou RMN PET Gastrinomas Ecoendoscopia Cintigrafia com análogos da somatostatina TAC e/ou RMN Nenhuma destas técnicas é 100% sensível e múltiplas modalidades podem ser necessárias para a detecção de lesões pequenas.52 A ecoendoscopia é uma técnica particularmente útil para a localização do NET, fornecendo informações acerca da extensão na parede e da invasão ganglionar.50 A grande maioria dos NETs gástricos está limitada à primeira e segunda camada, são pequenos, superficiais e não metastizam. A ecoendoscopia é também importante na identificação de gastrinomas que ocorrem em associação com NETs gástricos do tipo II.52 A TC e a RMN são os métodos habitualmente usados na identificação de metástases locais e à distância.11 A maioria dos NETs gástricos expressa receptores da somatostatina tornando a cintigrafia com análogos da somatostatina útil para a identificação do tumor primário e das metástases à distância.6 A cintigrafia com análogos da somatostatina é o método mais sensível na detecção de metástases hepáticas (81-96% comparativamente à angiografia -50-90% ou à RMN -55-70%), pelo que é a modalidade de imagem inicial de escolha para caracterizar os NETs primários e metastáticos.52 A cintigrafia com análogos da somatostatina deve ser realizada com TC e/ou RMN para determinação do tamanho e localização exacta das metástases.18 A PET é uma técnica que permite relacionar a localização anatómica das lesões com o funcionamento dos NETs. A PET com 11C-5-hidroxitriptofano é útil nos NETs gástricos, apresentando maior sensibilidade do © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 que os meios convencionais e cintigrafia com análogos da somatostatina.18 A definição do tipo de NET gástrico tem impacto importante no tratamento e no prognóstico.6 Para além do estudo anátomopatológico do NET gástrico, é importante a determinação dos níveis séricos de gastrina. Os níveis de gastrina estão elevados nos NETs gástricos do tipo I e II.6,8 O teste de estimulação da gastrina pela secretina pode ajudar a diferenciar os NETs gástricos do tipo I dos NETs gástricos do tipo II.18 O estudo da secretina é o teste de estimulação de gastrina mais sensível e específico para o diagnóstico da ZES. Um aumento de gastrina> 200 pg 15 minutos após a injecção de secretina, tem sensibilidade e especificidade de 90% na ZES.18 O teste da estimulação da gastrina com secretina é negativo nos doentes com gastrite crónica atrófica. No caso de NETs gástricos do tipo II é importante a identificação do gastrinoma associado. (Quadro II) A ecoendoscopia apresenta sensibilidade elevada para a detecção de gastrinomas pancreáticos mas não é muito útil para a detecção de gastrinomas duodenais (sensibilidade de 90-100 % e 45-60%, respectivamente).52 Os gastrinomas expressam receptor da somatostatina, pelo que a cintigrafia com análogos da somatostatina pode ser usada, demonstrando taxas de sensibilidade e de especificidade> 75%.53 À semelhança do que acontece com os NETs gástricos, os doentes com gastrinomas deverão realizar TC e/ou RMN para despiste das metástases dos gastrinomas.18 Os NETs gástricos são geralmente não funcionantes, pelo que não está indicada a avaliação da secreção de neuropeptídeos. Em alternativa, surgiram marcadores serológicos.54 Actualmente, estão disponíveis métodos para avaliar a Cg A intacta e os seus produtos. Os níveis séricos estão aumentados nos tumores neuroendócrinos gastro-enteropancreáticos (GEP-NETs) e são particularmente úteis para o diagnóstico de tumores © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO não funcionantes.55,56 A CgA sérica aumenta na gastrite crónica atrófica, na hiperplasia/displasia das células ECL e nos NETs gástricos. Níveis aumentados de CgA são também observados na insuficiência renal. 55,56 Foi descrita uma diferença estatisticamente significativa (p<0,001) entre os níveis séricos de CgA de doentes com gastrite crónica atrófica e a população geral, apresentando os doentes com gastrite crónica atrófica níveis mais elevados.57 No entanto, esta diferença não era significativa quando se compararam doentes com NETs gástricos e doentes com lesões precursoras. Noutro estudo de 15 doentes com NETs gástricos descreveram-se níveis séricos de CgA aumentados em todos os subtipos tumorais, mais elevados (p<0,001) nos doentes com NETs gástricos do tipo III do que nos doentes com NETs gástricos do tipo I.58 A determinação dos níveis séricos de Cg A tem-se revelado mais útil para avaliar a extensão da doença em doentes com NETs metastizados.6 6.2 ESTADIAMENTO Recentemente foi proposta uma classificação TNM (Tumor-Node-Metastasis) para o estadiamento dos GEP-NETs.59 Nesta classificação, T representa a extensão da invasão tumoral, N o envolvimento ganglionar e M a presença de metástases à distância. Nos NETs gástricos, as lesões tumorais superficiais (< 0,5 mm) são designadas por in situ (Tis). T1 indica a invasão tumoral da lâmina própria ou da submucosa, para lesões tumorais < 1 cm. Lesões maiores (> 1cm), com invasão da muscular própria ou subserosa são classificados T2, sendo as lesões com invasão da serosa classificadas T3. A classificação T4 indica as lesões com invasão de estruturas adjacentes. N1 designa metástases ganglionares. A presença de uma ou mais metástases à distância em qualquer local anatómico, incluindo gânglios linfáticos não locais, é clas- 123 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 sificada como M1. Recomenda-se a indicação do local anatómico das metástases à distância (PUL - Pulmão; HEP- Fígado; OSS- Osso). QUADRO III: Proposta ENETS (European Neuroendocrine Tumor Society) de Estadiamento dos NETs gástricos (adaptado de Rindi et al 2006 59). Estadiamento Estádio 0 Tis N0 M0 Estádio I T1 N0 M0 Estádio IIa T2 N0 M0 Estádio IIb T3 N0 M0 Estádio IIIa T4 N0 M0 Estádio IIIb Qualquer T N1 M0 Estádio IV Qualquer T Qualquer N M1 No estadiamento (Quadro III), as lesões superficiais <1cm com invasão da lâmina própria ou da submucosa, sem metástases ganglionares ou à distância, são designadas estádio I (T1N0M0); lesões de maiores dimensões, com invasão da muscular própria (T2) ou serosa (T3), sem metástases ganglionares nem metástases à distância, são designadas estádio II (T2 ou T3 N0M0); tumores com invasão de estruturas adjacentes ou com metástases ganglionares, sem metástases à distância, são designadas estádio III (T4N0M0 ou qualquer T, N1M0). A presença de metástases à distância define o estádio IV. Um estudo de 202 doentes, 48 dos quais com NETs gástricos, revelou que a proposta de classificação TNM é útil, permitindo uma estratificação prognóstica dos NETs gastrointestinais.60 7. PROGNÓSTICO O prognóstico dos NETs gástricos depende do tipo e do estadiamento do tumor.11 Vários parâmetros têm sido usados na avaliação prognóstica de NETs gástricos, incluindo: estudo anátomo-patológico, grau histológico (G1-G3), dimensão, índice mitótico, índice Ki67 (indicador da actividade proliferativa), expressão da p53, invasão vascular e da parede. Todos estes parâmetros demonstraram valor preditivo de malignidade e da sobrevi- 124 vência dos doentes.32 NETs gástricos G2 ou G3, com índice mitótico ≥ 9 / 10 HPF e > 300 células Ki-67 positivas/10 HFP, têm comportamento mais maligno.32 A sobrevida cumulativa global dos NETs gástricos aos 5 anos é de 63%.44 A presença de metástases ganglionares ou à distância agrava o prognóstico (7,1-21,2% comparativamente aos 64,5-69,1% sem doença mestastizada).44 As lesões do tipo I têm habitualmente bom prognóstico, com sobrevida aos 5 anos de 78-100%.44 A sobrevida dos doentes com NETs do tipo II é semelhante à dos com tipo I.8 O prognóstico está relacionado com o gastrinoma associado, que tem taxa de sobrevida aos 5 anos de 60-75 %.8 Os doentes com NETs gástricos do tipo III têm pior prognóstico, com sobrevida aos 5 anos < 50%.6 Este facto relaciona-se com 60% de metastização ganglionar e >50% de metastização hepática observadas nos NETs gástricos do tipo III.61 8. TRATAMENTO O tratamento dos NETs gástricos deve ser decidido após a confirmação do diagnóstico do tipo de tumor e do estadiamento da doença.6 É importante a determinação dos níveis séricos de gastrina, porque os tumores associados a hipergastrinemia devem ser tratados com procedimentos de redução/eliminação dos níveis de gastrina.6 8.1 TRATAMENTO DO TUMOR PRIMÁRIO Os NETs gástricos não metastizados podem ser removidos endoscopicamente ou cirurgicamente6 (Quadro IV). © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 QUADRO IV: Tratamento de NETs gástricos primários (adaptado de Akerstrom G et al 2007 62, Ruszniewski et al 2006 63, Jensen RT 2008 18). Tipo e dimensão de NET gástrico Tratamento Tumor do tipo I e II < 1 cm Ressecção endoscópica/ Vigilância Tumor do tipo I e II 1-2 cm Ressecção endoscópica Ressecção cirúrgica Tumor do tipo I e II > 2 cm Ressecção cirúrgica Antrectomia nos NETs do tipo I Tumor do tipo III Gastrectomia e linfadenectomia Os NETs gástricos do tipo I e II <1 cm de diâmetro são indolentes e com risco mínimo de invasão, podendo ser tratados com ressecção limitada via endoscópica.62 No entanto, de acordo com as recomendações da ENETS, os NETs gástricos do tipo I e II <1 cm de diâmetro podem ser vigiados, estando a ressecção endoscópica indicada em tumores> 1cm de diâmetro que não ultrapassem a muscular própria e com <6 lesões tumorais.63 Num trabalho recentemente publicado sobre o seguimento (média de 54 meses) de 11 doentes com NETs gástricos do tipo I demonstrou-se que em 9 doentes não foram detectadas lesões> 1 cm de diâmetro, nem metástases locais ou à distância, levantando a possibilidade de seguir estes doentes apenas com vigilância 64 clínica/endoscópica. Nos NETs gástricos do tipo I e II > 2 cm de diâmetro, ou com metastização ganglionar, alguns autores recomendam gastrectomia enquanto outros recomendam antrectomia no tratamento de NETs gástricos do tipo I para reduzir a hipergastrinemia.18 A antrectomia tem-se revelado eficaz em mais de 80% dos doentes com NETs gástricos do tipo I.63 Para os NETs gástricos do tipo I e II entre 1 e 2 cm de diâmetro ainda há não consenso, existindo autores que recomendam a ressecção endoscópica e outros tratamento cirúrgico, especialmente nos casos de NETs gástricos do tipo I e II múltiplos e com recidiva tumoral detectada durante o seguimento.5,18 Outra opção terapêutica para a prevenção da recidiva tumoral consiste no uso de análogos da somatostatina.5 As duas for- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO mulações mais eficazes disponíveis actualmente são o lanreótido e o octreótido, considerados eficazes no controlo dos sintomas e na redução dos níveis dos marcadores séricos tumorais.52 A terapêutica com análogos da somatostatina não está recomendada nos NETs gástricos do tipo I e II, excepto nos casos de tumores funcionantes e no caso dos NETs gástricos do tipo II, quando associados a outros tumores neuroendócrinos.63 Nos NETs do tipo II deve ser dada atenção à causa de hipergastrinemia, geralmente um gastrinoma duodenal.65 No caso de gastrinomas co-existentes há autores que aconselham a exérese cirúrgica apenas quando não há metástases, enquanto outros sugerem abordagens mais agressivas, mesmo na presença de metástases hepáticas, com remoção de todos os gastrinomas. O valor destas abordagens alternativas não está esclarecido.18 As lesões do tipo III não metastizadas devem ser removidos com gastrectomia e linfadenectomia.62 8.2 TRATAMENTO DA DOENÇA METASTÁTICA As abordagens terapêuticas da doença metastática incluem terapêutica médica, quimioterapia, radioterapia e radiologia de intervenção.6 Nos casos raros de NETs gástricos sintomáticos, podem ser utilizados análogos da somatostatina ou antagonistas dos receptores de serotonina, como o ondansetron, para o alívio da sintomatologia.66,67 O tratamento sistémico dos NETs gástricos inclui o uso de agentes biológicos [análogos da somatostatina e interferão-alfa (Interferon - INF-α)] e quimioterapia.56 Os análogos da somatostatina de acção prolongada e o INF-α reduzem raramente o tamanho do tumor mas exercem efeitos citostáticos em 26-95% dos tumores neuroendócrinos. Ainda não foi estabelecida a duração de tratamento para estabilização tumoral nem o efeito na sobrevida com estes tratamentos.18 125 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 Os citotóxicos são usados em tumores pouco diferenciados ou com progressão rápida.52 Vários fármacos estão actualmente disponíveis: etoposida, cistaplatina, estreptozocina, 5-fluorouracilo e doxorrubicina. No entanto, os estudos disponíveis são retrospectivos, não padronizados e incluem tumores heterogéneos, não permitindo conclusões seguras sobre a utilidade destes tratamentos.52 A radioterapia com isótopos do octreótido tem-se revelado segura e eficaz, podendo ser usada no tratamento dos NETs que expressam densidade adequada de receptores da somatostatina.68,69 Inicialmente, o tratamento foi realizado com altas doses de [111In]octreótido e mais tarde com análogos com maior afinidade, como o 90YtriumDOTA-Try-3-octreótido e o 177-LutetiumDOTA-Tyr3-octreotate.69 Este último é um agonista selectivo dos receptores 2 da somatostatina. Ensaios clínicos em NETs tratados com 177-Lutetium-DOTA-Tyr3-octreotate descrevem estabilização (23-40%) e regressão (38%) tumoral.18 A dose máxima tolerada está relacionada com os efeitos tóxicos para o rim e medula óssea.69 Num estudo de 50 doentes com GEP-NETs metastizados (seguidos durante 3 meses) e tratados com 177Lutetium-DOTA-Tyr3-octreotate, verificou-se melhoria da qualidade de vida, especialmente nos casos com regressão tumoral.70 A presença de metástases hepáticas associa-se a pior prognóstico e agravamento da qualidade de vida. O tratamento da metastização hepática pode ser cirúrgico ou médico. Pode ser realizada a exérese segmentar ou ablação hepática. O tratamento médico inclui a quimioembolização da artéria hepática.56 Embora a embolização da artéria hepática ou a exérese cirúrgica das metástases hepáticas permitam redução dos sintomas, persistem dúvidas sobre a eficácia destes tratamentos.71 126 BIBLIOGRAFIA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Kloppel G, Perren A, Heitz PU. The gastroenteropancreatic neuroendocrine cell system and its tumors: the WHO classification. Ann N Y Acad Sci 2004; 1014: 13-27. Modlin IM, Lye KD, Kidd M. A 50-year analysis of 562 gastric carcinoids: small tumor or larger problem? Am J Gastroenterol 2004; 99(1): 23-32. Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003; 97 (4): 934-59. Solcia E, Rindi G, Buffa R, Fiocca R, Capella C. Gastric endocrine cells: types, function and growth. Regul Pept 2000; 93 (1-3): 31-5. Delle Fave G, Capurso G, Milione M, Pantuto F. Endocrine tumours of the stomach. Best Pract Res Clin Gastroenterol 2005; 19(5): 659-73. Burkitt MD, Pritchard DM. Review article: Pathogenesis and management of gastric carcinoid tumours. Aliment Pharmacol Ther 2006; 24 (9): 1305-20. Hemminki K, Li X. Incidence trends and risk factors of carcinoid tumors: a nationwide epidemiologic study from Sweden. Cancer 2001; 92 (8): 2204-10. Modlin IM, Lye KD, Kidd M. Carcinoid tumors of the stomach. Surg Oncol 2003; 12(2): 153-72. Rindi G, Leiter AB, Kopin AS, Bordi C, Solcia E. The “normal” endocrine cell of the gut: changing concepts and new evidences. Ann N Y Acad Sci 2004; 1014: 1-12. Dockray GJ, Varro A, Dimaline R, Wang T. The gastrins: their production and biological activities. Annu Rev Physiol 2001; 63: 119-39. Mulkeen A, Cha C. Gastric carcinoid. Curr Opin Oncol 2005; 17 (1): 1-6. Arnold R. Diagnosis and differential diagnosis of hypergastrinaemia. Wien Klin Wochenschr 2007; 119 (19-20): 564-9. Annibale B, Azzoni C, Corleto VD, di Giulio E, Caruana P, D’Ambra G et al. Atrophic body gastritis in patients with enterochromaffin-like cell dysplasia are at increased risk for the development of type I gastric carcinoid. Eur J Gastroenterol Hepatol 2001; 13(12): 1449-56. Kloppel G, Anlauf M, Perren A. Endocrine precursor lesions of gastroenteropancreatic neuroendocrine tumors. Endocr Pathol 2007; 18(3): 150-5. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 15. Kloppel G, Anlauf M. Epidemiology, tumour biology and histopathological classification of neuroendocrine tumours of the gastrointestinal tract. Best Pract Res Clin Gastroenterol 2005; 19(4); 507-17. 16. Bordi C, D’Adda T, Azzoni C, Ferrano G. Pathogenesis of ECL cell tumors in humans. Yale J Biol Med 1998; 71(3-4): 273-84. 17. Gibril F, Schumann M, Pave A, Jensen RT. Multiple neuroendocrine neoplasia type 1 and Zollinger-Ellison syndrome: a prospective study of 107 cases and comparison with 1009 cases from the literature. Medicine (Baltimore) 2004; 83(1): 43-83. 18. Jensen RT. Gastro-Entero-Pancreatic neuroendocrine tumors. In: Fauci A, Kasper D, Braunwald E, Hausser L, Longo D et al. Harrison’s Principles of Internal Medicine. 17th edition. New York: The McGraw-Hill Companies; 2008 p.2347-58. 19. Peghini PL, Annibale B, Azzoni C, Milione M, Corleto VD, Gibril F et al. Effect of chronic hypergastrinemia on human enterochromaffin-like cells: insights from patients with sporadic gastrinomas. Gastroenterology 2002; 123 (1): 68-85. 20. Masaoka T, Suzuki H, Hibi T. Gastric epithelial cell modality and proton pump inhibitor. J Clin Biochem Nutr 2008; 42(3): 191-6. 21. Jensen RT. Consequences of long-term proton pump blockade: insights from studies of patients with gastrinomas. Basic Clin Pharmacol Toxicol 2006; 98 (1): 4-19. 22. Shpaner A, Yusuf TE. Primary gastric small-cell neuroendocrine carcinoma. Endoscopy 2007; 39 Suppl 1: 310-11. 23. Namikawa T, Kobayashi M, Okabayashi T, Ozaki S, Nakamura S, Yamashita K et al. Primary gastric small-cell carcinoma: report of a case and review of the literature. Med Mol Morphol 2005; 38(4): 256-61. 24. Kusayanagi S, Konishi K, Miyasaka N, Sasaki K, Kurahashi T, Kaneko K et al. Primary small cell carcinoma of the stomach. J Gastroenterol Hepatol 2003; 18(6): 743-7. 25. Williams GT. Endocrine tumours of the gastrointestinal tract- select topics. Histopathology 2007; 50(1): 30-41. 26. Rindi G, Paolotti D, Fiocca R, Wiedenman B, Henry JP, Solcia E. Vesicular monoamine transporter 2 as a marker of gastric enterochromaf- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. fin-like cell tumors. Virchows Arch 2000; 436(3): 217-23. Schindl M, Kaserer K, Niederle B. Treatment of gastric neuroendocrine tumors: the necessity of a type- adapted treatment. Arch Surg 2001; 136(1): 49-54. Rindi G, D’Adda T, Azzoni C, Ferrano G. Gastric carcinoids and neuroendocrine carcinomas: pathogenesis, pathology, and behavior. World J Surg 1996; 20(2): 168-72. Bordi C, D’Adda T, Azzoni C, Ferrano G. Classification of gastric endocrine cells at the light and electron microscopical levels. Micros Res Tech 2000; 48(5):258-71. Boo YJ, Park SS, Kim JH, Mok YJ, Kim CS. Gastric neuroendocrine carcinoma: clinicopathologic review and immunohistochemical study of E-cadherin and Ki-67 as prognostic markers. J Surg Oncol 2007; 95(2): 110-7. Safatle-Ribeiro AV, Ribeiro U Jr, Corbett CE, Iriya K, Kobata CH, Sakai P et al. Prognostic value of immunohistochemistry in gastric neuroendocrine (carcinoid) tumors. Eur J Gastroenterol Hepatol 2007; 19 (1):21-8. Rindi G, Azzoni C, La Rosa S, Klersy C, Paolotti D, Rappel S e tal. ECL cell tumor and poorly differentiated endocrine carcinoma of the stomach: prognostic evaluation by pathological analysis. Gastroenterology 1999; 116(3): 532-42. Dockray GJ. Clinical endocrinology and metabolism. Gastrin. Best Pract Res Clin Endocrinol Metab 2004; 18(4): 555-68. Duerr EM, Chung DC. Molecular genetics of neuroendocrine tumors. Best Pract Res Clin Endocrinol Metab 2007; 21 (1): 1-14. Toumpanakis CG, Caplin ME. Molecular genetics of gastroenteropancreatic neuroendocrine tumors. Am J Gastroenterol 2008; 103(3): 72932. Oberg K. Genetics and molecular pathology of neuroendocrine gastrointestinal and pancreatic tumors (gastroenteropancreatic neuroendocrine tumors). Curr Opin Endocrinol Diabetes Obes 2009; 16(1): 72-8. Kazumori H, Ishihara S, Hoshino E, Kawashima K, Moriyama N, Suetsugu H et al. Neutrophil chemoattractant 2 beta regulates expression of the Reg gene in injured gastric mucosa in rats. Gastroenterology 2000; 119(6): 1610-22. Miyaoka Y, Kadowaki Y, Ishihara S, Ose T, Fukuhara H, Kasumori et al. Transgenic overex- 127 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 39. 40. 41. 42. 43. 44. 45. 46. 47. 48. 49. 128 pression of Reg protein caused gastric cell proliferation and differentiation along parietal cell and chief lineages. Oncogene 2004; 23 (20): 3572-9. Ashcroft FJ, Varro A, Dimaline R, Dockray GJ. Control of the expression of the lectin-like protein Reg-1 by gastrin: role of the Rho family GTPase RhoA and a C-rich promoter element. Biochem J 2004; 381: 397-403. Varro A, Hemers E, Archer D, Pagliocca, Haigh C, Ahmed S et al. Identification of plasminogen activator inhibitor-2 as a gastrin – regulated gene: Role of Rho GTPase and menin. Gastroenterology 2002; 123(1): 271-80. Varro A, Kenny S, Hemers E, McCaig C, Przemeck S, Wang TC et al. Increased gastric expression of MMP-7 in hypergastrinemia and significance for ephitelial-mesenchymal signaling. Am J Physiol Gastrointes Liver Physiol 2007; 292(4): 1133- 40. Nishikura K, Watanabe H, Iwafuchi M, Fujiwara T, Kijima K, Ajioka Y. Carcinogenesis of gastric endocrine cell carcinoma: analysis of histopathology and p53 gene alteration. Gastric Cancer 2003; 6(4): 203-9. Pizzi S, Azzoni C, Bassi D, Bottarelli L, Milione M, Bordi C. Genetic alteration in poorly differentiated endocrine carcinomas of the gastrointestinal tract. Cancer 2003; 98(6): 1273-82. Borch K, Ahrén B, Ahlman H, Falkmer S, Granérus G, Grimelius N. Gastric carcinoids: biologic behavior and prognosis after differentiated treatment in relation to type. Ann Surg 2005; 242(1):64-73. Onaits MW, Kirshbom PM, Hayward TZ, Quayle FJ, Feldman JM, Seigler HF et al. Gastrointestinal carcinoids: characterization by site of origin and hormone production. Ann Surg 2000; 232(4): 549-56. Pinchot SN, Holen K, Sippel RS, Chen H. Carcinoid tumors. Oncologist 2008; 13(12): 1255-69. Caplin ME, Buscombe JR, Hilson AJ, Jones AL, Watkinson A, Burroughs AK. Carcinoid tumour. Lancet 1998; 352(9130): 799-805. Bordi C, Corleto VD, Azzoni C, Pizzi S, Ferrano G, Delle Fave G et al. Sampling strategies for analysis of enterochromaffin-like cell changes in Zollinger-Ellinson syndrome. Am J Clin Pathol 2000; 114(3): 419-25. Bordi C, Corleto VD, Azzoni C, Pizzi S, Ferrano 50. 51. 52. 53. 54. 55. 56. 57. 58. 59. 60. G, Gibril F et al. The antral mucosa as a new site for endocrine tumors in multiple endocrine neoplasia type 1 and Zollinger-Ellison syndromes. J Clin Endocrinol Metab 2001; 86(5): 2236-42. Vander Noot MR, Eloubeidi MA, Chen VK, Eltoum I, Jhala N et al. Diagnosis of gastrointestinal tract lesions by endoscopic ultrasoundguined fine-needle aspiration biopsy. Cancer 2004; 102(3): 157-63. Wallace S, Ajani JA, Charnsangavej C, DuBrow R, Yang DJ, Chuang VP et al. Carcinoid tumors: imaging procedures and interventional radiology. World J Surg 1996; 20(2): 147-56. Modlin IM, Oberg K, Chung DC, Jensen RT, de Herder WW, Thakker RV et al. Gastroenteropancreatic neuroendocrine tumours. Lancet Oncol 2008; 9(1): 61-72. Banasch M, Schmitz F. Diagnosis and treatment of gastrinoma in the era of proton pump inhibitors. Wien Klin Wochenschr 2007; 119(19-20): 573-8. de Herder WW. Biochemistry of neuroendocrine tumours. Best Pract Res Clin Endocrinol Metab 2007; 21(1): 33-41. Erikson B, Oberg K, Stridsberg M. Tumor markers in neuroendocrine tumors. Digestion 2000; 62: 33-8. Kaltsas GA, Besser GM and Grossman AB. The diagnosis and medical management of advanced neuroendocrine tumors. Endocr Rev 2004; 25(3): 458-511. Peracchi M, Gebbia C, Basilisco G, Quatrini M, Tarantino C, Vescarelli C e tal. Plasma chromogranin A in patients with autoimmune chronic atrophic gastritis, enterochromaffin-like cell lesions and gastric carcinoids. Eur J Endocrinol 2005; 152(3): 443-8. Granberg D, Wilander E, Stridsberg M, Granerus G, Skogseid B, Oberg K. Clinical symptoms, hormone profiles, treatment, and prognosis in patients with gastric carcinoids. Gut 1998; 43(2): 223-8. Rindi G, Kloppel, Alhman H, Caplin M, Couvelard A, de Herder WW et al. TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch 2006; 449(4): 395-401. Pape UF, Jann H, Muller-Nordhom J, Bockelbrink A, Berndt U, Willich SN et al. Prognostic relevance of a novel TNM classifica- © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 61. 62. 63. 64. 65. 66. 67. 68. 69. 70. 71. tion system for upper gastroenteropancreatic neuroendocrine tumors. Cancer 2008; 113(2): 256-65. de la Fuente SG, McMahon RL, Pickett LC, Pappas TN. Sporadic gastric carcinoid tumor laparoscopically resected: a case report. JSLS 2004; 8(1): 85-7. Akerstrom g, Hellman P. Surgery on neuroendocrine tumours. Best Pract Res Clin Endocrinol Metab 2007; 21(1): 87-109. Ruszniewski P, Delle Fave G, Cadiot J, Komminoth P, Chung D Kos, Kudla B et al. Well-differentiated gastric tumors /carcinomas. Neuroendocrinology 2006; 84(3): 158- 64. Ravizza D, Fiori G, Trovato C, Fazio N, Bonomo G, Luca F et al. Long-term endoscopic and clinical follow-up of untreated type 1 gastric neuroendocrine tumours. Dig Liver Dis 2007; 39(6): 537-43. Richards ML, Gauger P, Thompson NW, Giordano TJ. Regression of type II gastric carcinoids in multiple endocrine neoplasia type 1 patients with Zollinger-Ellison syndrome after surgical excision of all gastrinomas. World J Surg 2004; 28(7): 652-8. Garland J, Buscombe JR, Bouvier C, Bouloux P, Champaman MH, Chow AC et al. Sandostatin LAR (long-acting octreotide acetate) for malignant carcinoid syndrome: a 3-year experience. Aliment Pharmacol Ther 2003; 17 (3): 437-44. Platt AJ, Heddle RM, Rake MO, Smedley H. Ondansetron in carcinoid syndrome. Lancet 1992; 339: 1416. Oberg K and Eriksson B. Nuclear medicine in the detection, staging and treatment of gastrointestinal carcinoid tumours. Best Pract Res Clin Endocrinol Metab 2005; 19(2): 265-76. Forrer F, Valkema R, Kwekkebom DJ, de Jong M, Kreening EP. Neuroendocrine tumors. Peptide receptor radionuclide therapy. Best Pract Res Clin Endocrinol Metab 2007; 21(1): 111-29. Teunissen JJ, Kwekkeboom DJ, Krenning EP. Quality of life in patients with gastroenteropancreatic tumors treated with [177LuDOTA0,Tyr3]octreotate. J Clin Oncol 2004; 22(13): 2724-9. Chamberlain RS, Canes D, Brown KT, Saltz L, Jamagin W, Fong Y et al. Hepatic neuroendocrine metastases: does intervention alter outcomes? J Am Coll Surg 2000; 190(4). 432- 45. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 129 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 131 ... 137 Síndrome de Insensibilidade aos Androgénios. Manifestações clínicas, defeitos moleculares, alterações hormonais e abordagem terapêutica. Selma B. Souto1,4, Daniel Carvalho-Braga2,4, José Luís Medina3,4 1 2 3 4 Interna de Formação Específica de Endocrinologia do Serviço de Endocrinologia do Hospital de São João, E.P.E. Assistente Hospitalar Graduado do Serviço de Endocrinologia do Hospital de São João, E.P.E. Director do Serviço de Endocrinologia do Hospital de São João, E.P.E. Faculdade de Medicina da Universidade do Porto RESUMO A resistência aos androgénios designada por síndrome de insensibilidade aos androgénios, é um distúrbio genético ligado ao cromossoma X, causado por mutações no gene do receptor dos androgénios. Os defeitos neste gene causam uma variedade de fenótipos em indivíduos com cariótipo 46, XY, que vão desde a infertilidade masculina a indivíduos com genitais externos femininos normais. O seu diagnóstico baseia-se na clínica e na investigação hormonal e molecular. A apresentação fenotípica complexa deste síndrome dificulta o seu diagnóstico e o aconselhamento genético das famílias afectadas. Foram identificadas mais de 400 mutações no gene do receptor dos androgénios. Esta revisão foca os aspectos clínicos, as alterações hormonais, os defeitos moleculares e a abordagem terapêutica do síndrome de insensibilidade aos androgénios. PALAVRAS-CHAVE Síndrome de insensibilidade aos androgénios; SIA; Ambiguidade genital; Gene do receptor dos androgénios. SUMMARY The end-organ resistance to androgens has been designated as androgen insensitivity syndrome (AIS), an X-linked disorder caused by mutations in the androgen receptor (AR) gene. The defects in the AR gene causes a variety of phenotypes in 46,XY individuals, ranging from male infertility to completely normal female external genitalia. Precise diagnosis requires clinical, hormonal and molecular investigation. The complexity of phenotypic presentation of AIS complicates both the diagnostic procedure and genetic counselling of the affected families. More than 400 different AR gene mutations have thus far been reported. This review focuses on the clinical features, molecular pathophysiology and management of AIS. KEY-WORDS Androgen insensitivity syndrome; AIS; Ambiguous genitalia; Androgen Receptor Gene. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 131 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 INTRODUÇÃO O síndrome de insensibilidade aos androgénios (SIA) é um distúrbio genético ligado ao cromossoma X, caracterizado por defeitos na virilização de indivíduos com cariótipo 46,XY1,2. Resulta de mutações com perda de função no gene do receptor dos androgénios (RA), causando resistência periférica aos androgénios1,2. Foi descrito pela primeira vez em 1953 por John Morris e nessa altura designado por “síndrome do testículo feminizante”3. Desde 1953 que os mecanismos responsáveis pelo seu desenvolvimento têm sido estudados. Em 1989, foi descoberta a localização exacta do gene humano do RA em Xq11-124. Os fenótipos clínicos do SIA são divididos em três categorias que reflectem a gravidade da resistência aos androgénios, nomeadamente a insensibilidade completa (SICA), parcial (SIPA) e ligeira (SILA) aos androgénios. PAPEL DOS ANDROGÉNIOS NO DESENVOLVIMENTO SEXUAL MASCULINO Até à 6ª semana de gestação, independentemente do sexo cromossómico, os embriões apresentam gónadas primordiais bipotenciais, com genitais externos indiferenciados e dois ductos genitais internos, os ductos de Wölff e de Müller5,6. Por volta da 6ª ou 7ª semana de gestação, inicia-se a diferenciação da gónada embrionária em testículo, por acção do factor determinante testicular, o gene SRY, localizado no braço curto do cromossoma Y, em conjunto com outros factores codificados por genes localizados nos autossomas ou no cromossoma X5. Entre a 9ª e 13ª semanas de gestação, ocorre a diferenciação dos ductos de Wölff em epidídimo, canal deferente e vesículas seminais por acção local da testosterona produ- 132 zida pelas células de Leydig fetais, sob a estimulação da gonadotrofina coriônica humana (hCG). Com a diferenciação dos ductos de Wölff, ocorre a regressão dos ductos de Müller por acção local da hormona anti-Mülleriana (AMH), produzida pelas células de Sertoli5. A diferenciação masculina dos genitais externos em pénis, bolsa escrotal e uretra peniana ocorre entre a 9ª e 13ª semanas de gestação e exige concentração adequada de testosterona e a sua conversão em di-hidrotestosterona (DHT), um andrógenio mais potente, por acção da 5∝-redutase a nível dos tecidos-alvo5. Na ausência de concentrações adequadas de testosterona e DHT, ocorre uma falha na masculinização dos genitais, com desenvolvimento de um fenótipo feminino (com clitóris, grandes e pequenos lábios e porção inferior da vagina) ou graus variáveis de ambiguidade genital5. A hormona insulin-like factor 3 (INSL3) é uma hormona produzida pelas células de Leydig, igualmente importante na diferenciação sexual masculina. Este peptídeo está envolvido na primeira fase de descida testicular trans-abdominal. A segunda fase, que ocorre antes do nascimento, é a descida inguino-escrotal, e é androgénio-dependente7. A acção dos androgénios nos tecidosalvo, requer a presença de receptores de androgénios funcionais, que após a ligação, activam a transcrição de genes específicos nos tecidos-alvo. Desta forma, qualquer anomalia na produção ou acção dos andrógenios, entre a 9ª e a 13ª semanas de gestação, num feto com cariótipo 46,XY leva à masculinização incompleta, resultando em pseudo-hermafroditismo masculino5. GENE DO RECEPTOR DOS ANDROGÉNIOS O RA pertence a uma família de factores de transcrição nuclear que inclui entre © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 outros, os receptores de estrogénios, das hormonas tiroideias, da vitamina D, do ácido retinóico, de glicocorticóides, de mineralocorticóides, e da progesterona8. Os receptores dos andrógenios, dos glicocorticóides, dos mineralocorticóides e da progesterona fazem parte, por sua vez, de uma sub-família dos factores de transcrição nuclear, que estão agrupados pela sequência homóloga e pela capacidade de activarem a transcrição de genes-alvo através do mesmo elemento de resposta hormonal8. Após a formação do complexo hormona-receptor, o RA, interage directamente com os genesalvo para regular a sua transcrição. Quando ocorre falha do receptor em activar estes genes resulta em resistência hormonal. O RA possui diferentes domínios funcionais: o domínio de regulação transcricional (amino-terminal), o domínio de ligação ao DNA que contém zinc fingers, a região hinge e o domínio de ligação ao esteróide (carboxi-terminal) (Figura 1)1,8. FIGURA 1: Gene humano do receptor de androgénios. Adaptado de Galani e colaboradores1. O gene do RA localiza-se no cromossoma X, entre os fragmentos Xq11-12 e possui cerca de 90 kilobases (kb), contendo 8 exons separados por introns cujos tamanhos varia de 0,7 a mais de 26 kb (Figura 1)1,8. O DNA complementar (DNAc) do RA apresenta aproximadamente 2760pb. O exon 1 codifica o domínio activador da transcrição ou aminoterminal, constituído por 555 aminoácidos e possui extensão correspondente a mais de 50% da proteína do RA. Uma característica deste domínio é apresentar repetições de glutaminas (11-31 resíduos) e © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO glicinas (16-27 resíduos)9, cuja importância exacta não está completamente esclarecida, porém repetições semelhantes são encontradas em vários factores de transcrição. A expansão da repetição de poliglutaminas para 40-65 resíduos está associada à atrofia muscular espinhal/bulbar ou doença de Kennedy. Esta expansão parece não afectar a afinidade de ligação aos andrógenios, mas pode causar diminuição na actividade transcricional do receptor, talvez como resultado da redução nos níveis do RNA mensageiro (RNAm) e da proteína do RA, identificada em pacientes com este tipo de expansão10. Foi proposto que a actividade transcricional do RA é inversamente proporcional à extensão de repetição de glutaminas. Alguns estudos epidemiológicos demonstraram que indivíduos com menor extensão da repetição de glutaminas têm maior risco de desenvolvimento de cancro de próstata e geralmente apresentam doença mais avançada ao diagnóstico11. Os exons 2 e 3 codificam o domínio de ligação ao DNA, que possui cerca de 70 aminoácidos. O domínio de ligação ao DNA contém dois iões zinco, cada um ligado ao enxofre de 4 cisteínas, produzindo uma estrutura de hélice-alça-hélice que interage com sequências específicas de DNA, denominadas elementos de resposta hormonal. O primeiro e o segundo zinc fingers são codificados pelo exon 2 e 3, respectivamente. O domínio de ligação ao DNA determina a especificidade da interacção do RA com o DNA. Três aminoácidos na base do primeiro zinc finger são conservados entre os receptores de andrógenos, glicocorticóides, mineralocorticóides e progesterona e ligam-se às sequências de nucleotídeos amplificadoras da transcrição, os elementos de resposta hormonal, localizadas em regiões próximas ou na sequência de genes-alvo. O segundo zinc finger possui aminoácidos que estabilizam a ligação do DNA ao receptor, participam na dimerização do RA, e juntamente com a região hinge, no transporte do citoplasma para o 133 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 núcleo celular10. A região 5’ do exon 4 codifica a região hinge, que contém um sinal de localização nuclear necessário para a translocação do complexo andrógenio/ receptor do citoplasma para o seu local de acção nuclear8,9. A porção 3’ do exon 4 e os exons 5, 6, 7 e 8 codificam o domínio de ligação aos andrógenios, que contém cerca de 290 aminoácidos e representa 30% da proteína do RA. Este domínio é responsável pela ligação aos andrógenios, e participa na activação transcricional, na dimerização do receptor e interage com proteínas inibitórias (HSP)10. O RNAm do RA foi identificado pela técnica de Northern Blot em inúmeros tecidos humanos, incluindo testículo, próstata, fibroblastos de tecido genital, fígado e linhagens celulares de cancro de próstata e de mama8. MANIFESTAÇÕES CLíNICAS O SIA representa provavelmente a causa mais frequente de pseudo-hermafroditismo masculino12,13. Os indivíduos afectados apresentam cariótipo 46,XY, com testículos não completamente descidos e genitais externos femininos ou parcialmente masculinizados. Como referido anteriormente, está tradicionalmente dividido em três categorias de acordo com o fenótipo dos genitais: síndrome de insensibilidade completa (SICA), parcial (SIPA) e ligeira (SILA) aos androgénios. SÍNDROME DE INSENSIBILIDADE COMPLETA AOS ANDROGÉNIOS A forma completa do SIA é relativamente rara, tendo uma prevalência estimada de 1 em cada 20 400 recém nascidos do sexo masculino6. O seu fenótipo é o de um indivíduo do sexo feminino, apesar do cariótipo 46,XY e da formação de testículos normais, que produzem concentrações adequadas de testosterona para a idade e normalmente metabolizada em DHT2. 134 A apresentação típica é a de uma adolescente fenotipicamente do sexo feminino, sem ambiguidade sexual ao nascimento, com desenvolvimento mamário normal, escassez ou ausência de pêlos púbicos e axilares e com amenorreia primária1,2,8. O diagnóstico diferencial nesta idade é efectuado com disgenesia gonadal completa, ou síndrome de Swey, no qual ocorre menor desenvolvimento mamário e baixa estatura2. A idade do desenvolvimento mamário nestes doentes não foi objecto de estudo de muitos investigadores, porém, alguns autores, reportam algum atraso, sendo coincidente com a idade da puberdade nos rapazes 8,14. Por outro lado, um estudo retrospectivo de 9 indivíduos pos-pubertários com SICA sugere que a puberdade ocorre em idade semelhante às raparigas normais15. Os indivíduos com a forma completa do SAI, têm uma excelente feminização na puberdade, com mamas normais ou aumentadas, contornos corporais femininos e ausência de acne, devido à produção de estrogénios pelos testículos e pela aromatização periférica da testosterona5,6. Em alguns casos, a suspeita de SICA ocorre na infância, na presença de edemas ou hérnias inguinais bilaterais1. As hérnias inguinais bilaterais são raras nas meninas, e em 1 a 2 % dos casos representam SICA2. Alguns indivíduos têm suspeita de SICA antes do nascimento, quando a amniocentese revela um cariótipo 46,XY e a ecografia prénatal mostra genitais externos femininos2. Os doentes com SICA, podem apresentar uma vagina em fundo cego, estando habitualmente ausentes as estruturas derivadas dos ductos de Wolff, tais como epidídimo, vasos deferentes e vesículas seminais e ausência de próstata2,16. As estruturas derivadas dos ductos de Müller ocorrem igualmente com pouca frequência em doentes com SICA17-19. Porém, num estudo de Rutgers e Scully, os derivados dos ductos de Müller, tais como pequenas trompas de falópio, foram detectadas em um terço dos 43 casos © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 estudados20. Num outro estudo que incluiu 11 doentes com SICA, apenas um doente com 14 anos e meio, que apresentava a mutação p.L881P exibia uma trompa de Falópio unilateral21. Em alguns doentes existe história familiar de um familiar do sexo feminino com hérnia inguinal corrigida na infância, com cariótipo 46,XY. Porém, um terço dos doentes não tem história familiar e apresentamse com mutações de novo. SÍNDROME DE INSENSIBILIDADE PARCIAL AOS ANDROGÉNIOS Devido à grande variabilidade de manifestações clínicas e à existência de formas subtis ou atípicas de resistência aos androgénios, tais como a infertilidade masculina, a prevalência da forma parcial de SIA é desconhecida22. Os diferentes fenótipos reflectem a gravidade da subvirilização. Os indivíduos com SIPA com um fenótipo feminino, apresentam clitoriomegalia discreta, com fusão parcial dos pequenos lábios e pêlos púbicos na puberdade. Na apresentação com fenótipo masculino os indivíduos apresentam micropénis, hipospadia perineal e criptorquidia (esta forma é igualmente designada de síndrome de Reifenstein)1,8,23. Nos doentes com SIPA, as estruturas derivadas dos ductos de Wolff podem estar parcialmente ou completamente desenvolvidas, dependendo do fenótipo bioquímico do RA e os testículos estão frequentemente não descidos, localizando-se na região inguinal ou no escroto/grandes lábios24. Os indivíduos com SIPA têm habitualmente ginecomastia e testículos com um número reduzido de células germinativas, com consequente azoospermia e podem mais tarde, na puberdade, desenvolver carcinoma in situ24. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO SÍNDROME DE INSENSIBILIDADE LIGEIRA AOS ANDROGÉNIOS As formas ligeiras de SIA foram detectadas em estudos de infertilidade masculina, que sugeriam defeitos na acção dos androgénios2,25. Verificou-se que em alguns homens com oligospermia, com testosterona normal e LH elevada existia uma mutação no gene do RA que conferia resistência aos androgénios. O SILA pode manifestar-se igualmente por ginecomastia isolada no jovem adulto provavelmente com história prévia de hipospadias minor corrigidas na infância. DIAGNÓSTICO O diagnóstico de SIA deve ser suspeito em qualquer criança com cariótipo 46,XY que apresenta ambiguidade genital ou fenótipo feminino, na qual a resposta da testosterona e DHT ao teste de estimulação com hCG é normal para o sexo masculino. Em alguns casos existe história familiar que sugere hereditariedade ligada ao cromossoma X. A ecografia pélvica confirma a presença de testículos. A confirmação do diagnóstico pode ser efectuada pela demonstração da ligação anormal dos androgénios ao RA em cultura de fibroblastos da pele dos genitais ou pela identificação da mutação inactivadora no gene do RA6,9. Classicamente, os indivíduos em idade pós-pubertária portadores de SIA apresentam níveis séricos elevados de LH e concentrações normais ou elevadas de FSH, estrógenios e testosterona, comparativamente aos homens normais. Os estudos efectuados em recém-nascidos e crianças com a forma completa de SIA revelaram que os níveis séricos de LH e testosterona não estão acima do normal nesta faixa etária8. A produção de estrógenios pelo testículo e pela aromatização periférica da testosterona está elevada em cerca de duas vezes quando compa- 135 Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 rada à de homens normais. A relação entre os níveis sanguíneos de testosterona e DHT está significativamente elevada, porém não compatível com os níveis encontrados na deficiência de 5∝-reductase tipo 28. ABORDAGEM TERAPÊUTICA Existem vários aspectos a considerar na abordagem terapêutica, nomeadamente o grau de resistência, o risco de desenvolvimento de tumores gonadais, a necessidade de cirurgia e o aconselhamento genético. SÍNDROME DE INSENSIBILIDADE COMPLETA AOS ANDROGÉNIOS Nos indivíduos com a forma completa, com genitais externos femininos normais e que cresceram como mulheres não há qualquer dúvida quanto à atribuição do sexo feminino1. Uma vez que a feminização destes indivíduos ocorre em parte pela acção dos androgénios testiculares e em parte pela conversão periférica de androgénios em estrogénios, opta-se frequentemente, pela remoção testicular após a puberdade quando a feminização está completa. A razão para a gonadectomia póspubertária é o risco de malignização testicular, que é rara antes da puberdade. Goulis e colaboradores descreveram um caso de hamartoma testicular bilateral num indivíduo de 18 anos com SICA, portador da mutação R831X do gene do RA26. A gonadectomia pré-pubertária está indicada se testículos inguinais forem fisicamente ou esteticamente desconfortáveis e se a herniorrafia inguinal for necessária. Neste caso, está indicada a terapêutica de substituição com estrogénios para iniciar a puberdade e manter a feminização. Em alguns casos, é necessária a realização de dilatações vaginais para evitar a dispareunia. 136 SÍNDROME DE INSENSIBILIDADE PARCIAL AOS ANDROGÉNIOS Nas formas de SIPA com fenótipo feminino, a abordagem é semelhante ao SICA, com excepção de que se preconiza a gonadectomia pré-pubertária para evitar o desconforto do crescimento da clitoromegalia na puberdade1. Nos casos de ambiguidade genital ou fenótipo masculino, a escolha do sexo é um processo complexo que requer a abordagem de uma equipa multidisciplinar, devendo ser solucionado o mais rapidamente possível. Para além das considerações anatómicas e cirúrgicas, a escolha do sexo masculino envolve terapêutica com testosterona. SÍNDROME DE INSENSIBILIDADE LIGEIRA AOS ANDROGÉNIOS Nos indivíduos com infertilidade, o objectivo terapêutico principal é a promoção da espermatogénese1. ACONSELHAMENTO GENÉTICO Cerca de 70% das mutações no gene RA são hereditárias e de transmissão ligada ao cromossoma X1. As mutações de novo representam 30% dos casos de mutações RA, sendo o risco de transmissão muito baixo, com excepção das mutações germline de novo da mãe. Nesta circunstância, a presença de mosaicismo germinativo celular pode ser assumida e o risco de transmissão é elevado27. Porém, a possibilidade de mosaicismo germline não pode ser excluída em nenhum caso de mutação de novo do gene RA, de modo que é necessária precaução no aconselhamento genético destas famílias. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO Artigos de Revisão REVISTA PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO | 2009 | 01 BIBLIOGRAFIA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Galani, A., et al., Androgen insensitivity syndrome: clinical features and molecular defects. Hormones (Athens), 2008. 7(3): p. 217-29. Hughes, I.A. and A. Deeb, Androgen resistance. Best Pract Res Clin Endocrinol Metab, 2006. 20(4): p. 577-98. Morris, J.M., The syndrome of testicular feminization in male pseudohermaphrodites. Am J Obstet Gynecol, 1953. 65(6): p. 1192-1211. Brown, C.J., et al., Androgen receptor locus on the human X chromosome: regional localization to Xq11-12 and description of a DNA polymorphism. Am J Hum Genet, 1989. 44(2): p. 264-9. Kupfer, S.R., C.A. Quigley, and F.S. French, Male pseudohermaphroditism. Semin Perinatol, 1992. 16(5): p. 319-31. Melo, K.F., et al., [Androgen insensitivity syndrome: clinical, hormonal and molecular analysis of 33 cases]. Arq Bras Endocrinol Metabol, 2005. 49(1): p. 87-97. Hutson, J.M. and S. Hasthorpe, Testicular descent and cryptorchidism: the state of the art in 2004. J Pediatr Surg, 2005. 40(2): p. 297-302. Quigley, C.A., et al., Androgen receptor defects: historical, clinical, and molecular perspectives. Endocr Rev, 1995. 16(3): p. 271-321. Kronenberg HM, M.S., Polonsky K, Larsen PR, editor, Williams Textbook of Endocrinology. 11th ed: Saunders. Hiipakka, R.A. and S. Liao, Molecular mechanism of androgen action. Trends Endocrinol Metab, 1998. 9(8): p. 317-24. Chamberlain, N.L., E.D. Driver, and R.L. Miesfeld, The length and location of CAG trinucleotide repeats in the androgen receptor N-terminal domain affect transactivation function. Nucleic Acids Res, 1994. 22(15): p. 3181-6. Ahmed, S.F. and I.A. Hughes, The genetics of male undermasculinization. Clin Endocrinol (Oxf), 2002. 56(1): p. 1-18. Savage, M.O., et al., Endocrine studies in male pseudohermaphroditism in childhood and adolescence. Clin Endocrinol (Oxf), 1978. 8(3): p. 219-31. Morris, J.M. and V.B. Mahesh, Further Observations on the Syndrome, "Testicular Feminization". Am J Obstet Gynecol, 1963. 87: p. 731-48. © 2009 – SOCIEDADE PORTUGUESA DE ENDOCRINOLOGIA, DIABETES E METABOLISMO 15. Papadimitriou, D.T., et al., Puberty in subjects with complete androgen insensitivity syndrome. Horm Res, 2006. 65(3): p. 126-31. 16. Bale, P.M., N.J. Howard, and J.E. Wright, Male pseudohermaphroditism in XY children with female phenotype. Pediatr Pathol, 1992. 12(1): p. 29-49. 17. Swanson, M.L. and E.H. Coronel, Complete androgen insensitivity with persistent mullerian structures. A case report. J Reprod Med, 1993. 38(7): p. 565-8. 18. Dodge, S.T., M.S. Finkelston, and K. Miyazawa, Testicular feminization with incomplete Mullerian regression. Fertil Steril, 1985. 43(6): p. 937-8. 19. Ulloa-Aguirre, A., et al., Incomplete regression of mullerian ducts in the androgen insensitivity syndrome. Fertil Steril, 1990. 53(6): p. 1024-8. 20. Rutgers, J.L. and R.E. Scully, The androgen insensitivity syndrome (testicular feminization): a clinicopathologic study of 43 cases. Int J Gynecol Pathol, 1991. 10(2): p. 126-44. 21. Galani, A., et al., Sex-reversed phenotype in association with two novel mutations c.2494delA and c.T3004C in the ligand-binding domain of the androgen receptor gene. Fertil Steril, 2008. 90(5): p. 2008 e1-4. 22. Aiman, J. and J.E. Griffin, The frequency of androgen receptor deficiency in infertile men. J Clin Endocrinol Metab, 1982. 54(4): p. 725-32. 23. Ferlin, A., et al., Male infertility and androgen receptor gene mutations: clinical features and identification of seven novel mutations. Clin Endocrinol (Oxf), 2006. 65(5): p. 606-10. 24. Melo, K.F., et al., Clinical, hormonal, behavioral, and genetic characteristics of androgen insensitivity syndrome in a Brazilian cohort: five novel mutations in the androgen receptor gene. J Clin Endocrinol Metab, 2003. 88(7): p. 3241-50. 25. Gottlieb, B., et al., Molecular pathology of the androgen receptor in male (in)fertility. Reprod Biomed Online, 2005. 10(1): p. 42-8. 26. Goulis, D.G., et al., R831X mutation of the androgen receptor gene in an adolescent with complete androgen insensitivity syndrome and bilateral testicular hamartomata. Hormones (Athens), 2006. 5(3): p. 200-4. 27. Kohler, B., et al., Androgen insensitivity syndrome: somatic mosaicism of the androgen receptor in seven families and consequences for sex assignment and genetic counseling. J Clin Endocrinol Metab, 2005. 90(1): p. 106-11. 137