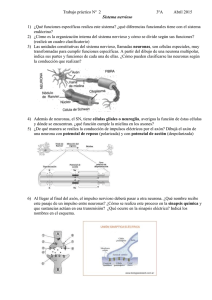
Parte I
Anuncio

Parte I Los componentes del sistema nervioso y su comunicación 1 Biología de las células nerviosas 2 Generación y conducción de potenciales en el sistema nervioso 3 Transmisión sináptica 1 Biología de las células nerviosas En las neuronas existen regiones funcionalmente diferenciadas En una neurona típica pueden identificarse morfológicamente cuatro regiones: a) el cuerpo celular, llamado también soma o pericarion, b) las dendritas, c) el axón y d) las terminales axónicas o sinápticas (fig. 1-1). La función principal de las neuronas es la generación de señales eléctricas, y en esta actividad cada una de las partes señaladas tiene un papel específico. El cuerpo celular (o pericarion) constituye el centro funcional y metabólico de la neurona y contiene tres organelas fundamentales: • El núcleo celular, que en las neuronas, a diferencia de otras células, es de gran tamaño. • El retículo endoplasmático, donde se sintetizan las proteínas de membrana y secretorias. • El aparato de Golgi, donde se realiza el procesado de los componentes de membrana y secretorios. Las dendritas son arborizaciones del cuerpo celular que desempeñan el papel de zona receptora principal para la neurona. El axón, proceso tubular que puede alcanzar distancias considerables, actúa como la unidad conductiva de la neurona. Los tamaños relativos del cuerpo neuronal, de las dendritas y del axón son variables de neurona a neurona. En muchos casos, el axón puede superar en varios órdenes de magnitud el diámetro del cuerpo celular. Como caso extremo puede mencionarse el de una motoneurona lumbar que inerve algún músculo del pie. Si se ampliara el cuerpo celular de esta motoneurona al Fig. 1-1. Neurona típica con las sinapsis que recibe. De izquierda a derecha, axodendrítica, axosomática, axoaxónica proximal y axoaxónica distal. Esta última en general inhibitoria, con participación en la inhibición presináptica. tamaño de una pelota de tenis, el axón tendría unos 2 km de longitud y el árbol dendrítico ocuparía el volumen de una habitación de unos 4 × 4 metros. Esto destaca la arbitrariedad de esquemas neuronales como los de la figura 1-1: el árbol dendrítico es de una extraordinaria importancia para la neurona, no reflejado en los esquemas habituales. Cuando los axones son gruesos están rodeados de una vaina aislante, la mielina, provista por las células de Schwann en la periferia y por la oligodendroglia en el SNC. La vaina de mielina es esencial para la conducción de alta velocidad y se halla interrumpida en los nervios periféricos, a intervalos regulares, por los nodos de Ranvier. Las terminales axónicas o sinápticas constituyen los elementos de transmisión de la neurona. A través de ellas, una neurona contacta y transmite información a la zona receptiva de otra neurona, o de una célula efectora (p. ej., muscular). 4 Parte I - Los componentes del sistema nervioso y su comunicación La zona de contacto se llama sinapsis. Cuando se trata de una neurona, la zona postsináptica se ubica en las dendritas y, con menos frecuencia, en el cuerpo neuronal o en las porciones iniciales o finales del axón. En promedio, existen unos 1015 contactos sinápticos en el cerebro humano adulto (es decir, unas 10.000 terminaciones sinápticas por neurona, aunque el número de estas terminaciones varía notablemente de un tipo neuronal a otro). Sobre la base del número de procesos originados en el cuerpo neuronal, las neuronas se clasifican en tres grupos: • Unipolares. • Bipolares. • Multipolares. Las neuronas unipolares se encuentran en invertebrados y presentan un único proceso que da origen a varias ramas. Estas ramas desempeñan la función de axón o de dendritas. En los mamíferos, la neurona sensorial primaria de los ganglios de las raíces dorsales es una variante de la neurona unipolar, llamada seudounipolar (fig. 1-2), porque da origen a dos ramas funcionales, una periférica o dendrítica, y otra central que constituye las raíces dorsales de los nervios espinales. Las neuronas bipolares son de soma ovoide con dos procesos: periférico (de función dendrítica) y central (o axonal). Las neuronas bipolares de la retina son un ejemplo de esta clase de neuronas (véase fig. 1-2). Las neuronas multipolares son el tipo predominante en el SNC de los mamíferos. Presentan arborizaciones dendríticas y, en general, un solo axón; las arborizaciones dendríticas pueden emerger en todas las direcciones del cuerpo axonal. Son ejemplos de neuronas multipolares las células piramidales de la corteza cerebral, las motoneuronas espinales y las células de Purkinje del cerebelo (figs. 1-2 y 1-3). De acuerdo con la longitud del axón, indicativa de la función que desempeñan, se distinguen dos tipos de neuronas: • Neuronas de axón largo, o de tipo Golgi I, que participan en la transferencia de información entre regiones cerebrales (p. ej., neuronas piramidales de proyección de la corteza cerebral), o que proveen un tono basal de excitación a amplias áreas cerebrales (p. ej., neuronas monoaminérgicas “en telaraña” del tronco encefálico). La diferencia entre estos dos subgrupos de neuronas Golgi I es el grado de ramificación del axón. En las neuronas de proyección, las ramificaciones se limitan a una o unas pocas zo- nas cerebrales, mientras que en las neuronas monoaminérgicas presentan una profusa arborización “en telaraña”, que conecta con numerosas áreas cerebrales muchas veces alejadas entre sí. • Neuronas de axón corto, o de tipo Golgi II, que cumplen la función de interneuronas en circuitos locales. Podemos así enunciar una regla elemental de formación de los circuitos neuronales en el SNC: “dos neuronas × tres circuitos”. Es decir, dos tipos neuronales (Golgi I y Golgi II) generan los tres circuitos básicos: • Circuitos locales, formado por interneuronas. • Circuitos de proyección o “punto a punto”, que conectan circuitos locales lejanos entre sí. • Circuitos “en telaraña”, que dan la base para que modificaciones locales y aisladas se transformen en estados globales del SNC, por ejemplo, la vigilia, el sueño lento y el sueño REM (de rapid eye movements, movimientos oculares rápidos). Las células de la glía son el componente celular más abundante del SNC El tipo celular más abundante en el SNC es el de las células de la glía, cuyo número excede unas 10-50 veces el de las neuronas. En general, las células gliales carecen de la propiedad de generar activamente señales eléctricas. Las células gliales tienen: • Una función de soporte para las neuronas, semejante al papel del tejido conectivo en otros órganos. • La función de eliminación de productos de desecho del metabolismo neuronal, o de restos celulares luego de la lesión o muerte celular. • La provisión de vaina de mielina (figs. 1-3 y 1-5). • Una función de buffer espacial de K+ (fig. 1-4). • Una función de guía para la migración neuronal durante el desarrollo. • Una función de nutrición neuronal, con la provisión entre otros de lactato y glucosa (fig. 1-6). • Función de captación de neurotransmisores (p. ej., glutamato; fig. 1-6). • Una función activa de generación de señales de tipo paracrino, como distintas citocinas. Este aspecto es de vital importancia para entender los cuadros emo- Biología de las células nerviosas 5 Fig. 1-2. Tipos de neuronas en distintas áreas del sistema nervioso central. cionales que acompañan a las infecciones o al desarrollo de tumores. La manera en que la reacción inmune periférica afecta al SNC es por acción de las citocinas circulantes sobre células gliales a través de los órganos circunventriculares. • Una muy reciente función identificada para las células gliales es la de su capacidad de regeneración neuronal. Este aspecto está siendo muy estudiado y se inserta en la verificación de la capacidad del SNC para reestablecer el stock neuronal de áreas afectadas. Las células gliales se dividen en los siguientes grupos: a) macroglia, que comprende a los astrocitos, los oligodendrocitos, las células de Schwann y los ependimocitos. Es de origen ectodérmico, b) microglia, que comprende fagocitos, que son parte del sistema inmune. Es de origen mesodérmico. Los astrocitos median las funciones gliales mencionadas, salvo la de producir mielina, que es función de la oligodendroglia en el SNC y de la célula de Fig. 1-3. Pasos en la mielinización de un axón por la célula de Schwann. 6 Parte I - Los componentes del sistema nervioso y su comunicación Fig. 1-4. Función de buffer espacial de K+ de las células gliales. El catión que se acumula por la actividad neural se difunde por la extremada permeabilidad de la membrana del astrocito. Schwann en la periferia (figs. 1-3 y 1-5). La síntesis de mielina por los oligodendrocitos está, sin embargo, bajo la regulación indirecta de los astrocitos, a través de una interacción de tipo paracrino. Aunque los oligodendrocitos y las células de Schwann están específicamente encargados de la producción de la vaina de mielina, difieren entre sí en varios aspectos funcionales. Existen unas 400-500 células de Schwann para envolver el axón periférico de una neurona sensorial primaria del nervio femoral (de unos 0,5 metros de longitud, con distancia internodo de Ranvier de alrededor de 1 mm). En cambio, la prolongación central de esa misma neurona sensorial está contenida, junto con otras semejantes, en un único oligodendrocito (fig. 1-5). Otra diferencia es que los genes que participan en la síntesis de mielina en la célula de Schwann son activados por la presencia de axones, mientras que los de los oligodendrocitos lo son por la presencia de astrocitos. Debe destacarse que no hay reacción fisiológica ante antígenos en neuronas que no implique participación de las células de la glía. Durante el proceso temprano de mielinización, las células de Schwann expresan una glucoproteína (MAG, myelin-associated glycoprotein) (sólo una parte minoritaria en la mielina madura), que se encuentra concentrada en la adyacencia inmediata de la membrana axonal. El MAG pertenece a una superfamilia de inmunoglobulinas implicadas en el reconocimiento celular; otros miembros son el antígeno mayor de histocompatibilidad, la Po, los antígenos de superficie de los linfocitos T y las moléculas de adhesión de células neurales. Una enfermedad neurológica, la esclerosis en placa, se caracteriza por el desarrollo de autoanticuerpos contra proteínas de la mielina. La principal proteína en la mielina periférica madura es llamada “Po” y atraviesa la membrana celular de la célula de Schwann. Esta proteína pertenece también a la superfamilia de proteínas de reconocimiento celular. Biología de las células nerviosas 7 Su función es la de interaccionar con moléculas semejantes en el proceso de compactación de la mielina. En la parte central de la mielina (que carece de Po) predomina un proteolípido (50% de la proteína presente). El resto de las proteínas mielínicas, tanto en la parte central como en la periférica de la mielina, son las conocidas como “proteína mielínica básica”, y derivan de un mismo gen. Se puede desarrollar una encefalomielitis alérgica experimental en ratas con la inyección de antígenos de mielina y cuya evolución tiene las características de la enfermedad crónica humana. La actividad neuronal, con la consiguiente acumulación de K+ en el espacio extracelular, produce la despolarización de las células gliales. Al ser la membrana celular de los astrocitos permeable en forma casi exclusiva al K+, este catión es captado con facilidad por los astrocitos, con lo que se impide una acumulación que resultaría peligrosa para la función neuronal (función de “buffer espacial de K+”) (véase fig. 1-4). Se ha verificado que la conductancia al K+ difiere entre las distintas regiones del astrocito y es muy elevada en el pie vascular. En forma proporcional a la actividad neuronal, la concentración extracelular de K+ puede variar entre 4 y 10 mM (lo normal es 2,5 mM), que produce vasodilatación importante (50% de aumento del diámetro vascular cuando se alcanzan 10 mM de K+). Al servir los pies vasculares (podocitos) de los astrocitos como “buffer espacial” para el K+, proveen un mecanismo efectivo de autorregulación del flujo sanguíneo cerebral. Como los astrocitos están conectados entre sí a través de uniones estrechas, se forma entre ellos un amplio sincitio funcional, con posibilidad de perder en otra región el K+ ganado en una región celular (véase fig. 1-4). En los últimos 15 años se ha identificado toda la gama de canales dependientes del voltaje presentes en las neuronas (cap. 2), también en células de la glía. Tanto los oligodendrocitos como los astrocitos expresan canales de K+ dependientes del voltaje; sólo los astrocitos poseen canales de Na+ dependientes del voltaje. Se han identificado también distintos tipos de canales del calcio y aniónicos. Se ha propuesto que estos canales son transferidos al axón, aunque esta hipótesis no ha sido probada. La hipótesis más probable es que los canales sean operativos para los distintos procesos de “asistencia de la función neuronal” regulados por la glía, ya enumerados. Fig. 1-5. La célula de Schwann envuelve el axón periférico de una neurona sensorial primaria. La prolongación central de esa misma neurona sensorial está envuelta por un oligodendrocito. El líquido cefalorraquídeo constituye la aproximación más cercana al líquido intersticial cerebral y está separado de la circulación sistémica por dos barreras Además de la masa cerebral (unos 1.400 gramos), la cavidad craneana contiene aproximadamente 75 mL de sangre y 75 mL de líquido cefalorraquídeo (LCR). La función hidrostática del LCR es trascendente: su presencia permite la flotación del cerebro, y así reduce el peso efectivo de 1.400 a unos 50 gramos y sirve de amortiguación ante traumatismos craneanos. La mayor parte del LCR se encuentra en los ventrículos cerebrales, donde se forma tanto por secreción desde el plexo coroideo (70%) como a partir de los capilares cerebrales (30%); en este último caso, el LCR 8 Parte I - Los componentes del sistema nervioso y su comunicación Fig. 1-6. El aporte energético a la neurona está dado por la glucosa captada a través de transportadores específicos (Glut 3) y el lactato que proviene del astrocito. El astrocito también participa en el metabolismo de transmisores (p. ej., glutamato). Hay transportadores específicos de glucosa en la pared capilar y astrocito (Glut 1) y en la microglia (Glut 5, no mostrado). Fig. 1-7. El LCR se forma y se secreta en el plexo coroideo en los ventrículos laterales, tercero y cuarto. En el adulto, el peso del plexo coroideo es de 2-3 g. En el espacio subaracnoideo no existe plexo coroideo. Biología de las células nerviosas 9 Fig. 1-8. Relaciones entre los componentes del espacio subaracnoideo. Espacio de Virchow-Robin. Fig. 1-9. Meninges y espacios meníngeos. Sección coronal a través de la región paramediana de los hemisferios cerebrales. arriba a las cavidades ventriculares desde el espacio intersticial cerebral. Como se muestra en la figura 17, el LCR fluye desde los ventrículos laterales y a través del agujero de Monro hacia el III ventrículo, y por el acueducto de Silvio, hacia el IV ventrículo. Desde el IV ventrículo, el LCR alcanza el espacio subaracnoideo por el foramen de Magendie. Dentro del espacio subaracnoideo, el LCR se distribuye tanto hacia abajo por el canal vertebral, como hacia arriba por la convexidad cerebral (véase fig. 1-7). Debido a que el espacio subaracnoideo acompaña a los vasos cerebrales en trayectos prolongados dentro del parénquima cerebral (constituyendo los espacios de Virchow-Robin), existe un pasaje fácil de solutos desde el tejido cerebral hasta el espacio subaracnoideo y desde aquí, a los ventrículos cerebrales (fig. 1-8). La reabsorción del LCR tiene lugar en las vellosidades subaracnoideas, que funcionan como “válvulas” unidireccionales del flujo (fig. 1-9). La velocidad de formación y de reabsorción del LCR es de unos 500 mL/día. El LCR y el intersticio cerebral están aislados de la circulación general por dos barreras funcionales: El término “barrera hematoencefálica” fue introducido por Ehrlich hacia fines del siglo XIX para denominar al fenómeno por el que una amplia gama de compuestos circulantes son excluidos del SNC y no penetran en él. Existen dos razones fundamentales para esta exclusión: a) las características morfológicas y funcionales de los capilares cerebrales y b) las características fisicoquímicas de la sustancia que se va a transferirse. En los capilares cerebrales pueden distinguirse tres aspectos diferenciales que le dan identidad en relación con otros capilares del organismo (fig. 1-10): • La barrera hematoencefálica, que impide el libre pasaje de sustancias desde los capilares cerebrales al espacio extracelular del tejido nervioso. • La barrera hematocefalorraquídea, que afecta el libre pasaje de sustancias desde los capilares coroideos al LCR. • El endotelio presenta uniones estrechas (tightjunctions), que no existen en los capilares sistémicos, y tiene muy pocas vesículas pinocitóticas. Carece de los procesos endocitóticos (endocitosis en fase fluida, endocitosis mediada por receptor) típicos de los capilares sistémicos. • Las células endoteliales de los capilares cerebrales presentan numerosas mitocondrias, lo cual indica la existencia de procesos de transporte activos. En efecto, bioquímicamente pueden demostrarse varios mecanismos de transporte mediados por transportadores (carriers) específicos, los que en muchos casos están asociados con la bomba Na+-K+-ATPasa. Los capilares cerebrales están así provistos de una verdadera “barrera enzimática” (fig. 1-11). • Las células endoteliales de los capilares cerebrales están rodeadas (aunque no en forma total) por células gliales, que contribuyen significativamente en dicha barrera. 10 Parte I - Los componentes del sistema nervioso y su comunicación Fig. 1- 10. Capilares no fenestrados en el SNC. Las células endoteliales presentan “uniones estrechas” entre sí y están rodeadas por una membrana basal y los pies de los astrocitos. • Puede así afirmarse que los capilares cerebrales se comportan más como órganos secretorios que como barreras de filtración. De ellos resulta la diferente composición del plasma y del LCR (cuadro 1-1). Es en este nivel donde se producen los fenómenos que conducen a la isquemia cerebral ante un daño vascular. Ellos incluyen diversas manifestaciones hemodinámicas, electrofisiológicas y bioquímicas, con numerosos círculos viciosos de retroalimentación positiva que amplifican el daño. La disminución del flujo sanguíneo por debajo de cierto límite da por resultado la disminución del aporte de O2 y una homeostasis iónica alterada (salida de K+ hacia el espacio extracelular y entrada de Na+ y Ca2+ en la neurona), con despolarización de la membrana y edema citotóxico. Se produce entonces una liberación masiva de neurotransmisores excitatorios (glutamato, aspartato), que es de importancia central en el establecimiento de la lesión (véase más adelante). En el SNC hay ciertas zonas (órganos circunventriculares) donde la barrera hematoencefálica es inexistente, debido a que los capilares carecen de las propiedades morfológicas y bioquímicas enumeradas. Los órganos circunventriculares son verdaderas “ventanas” del SNC, que cumplen funciones quimiorreceptoras y de recepción hormonal, y que en su mayoría Fig. 1-11. Procesos de transporte en el epitelio coroideo. Para la secreción de LCR, tiene lugar la actividad coordinada de transportadores de iones (círculos rojos) y canales (flechas gruesas) en la cara basolateral (que mira al plasma) y apical (que mira hacia el LCR). La fuerza primaria para el transporte es la bomba Na+-K+-ATPasa; ésta mantiene la concentración de Na+ en las células coroideas mucho más baja que en el líquido extracelular. En consecuencia, en la membrana basolateral hay una captación de Na+ hacia la célula en intercambio con H+ (antiporte), o en el mismo sentido que el Cl- extracelular (cotransporte). El Cl- se transporta activamente desde el plasma hacia la célula a través de un antiporte y un cotransporte. En la cara apical (hacia el LCR), el Na+ es bombeado activamente en dirección de los ventrículos. A través de esta cara apical, el K+ y el Cl–, y también el HCO3- (generado por la anhidrasa carbónica, c.a.), abandonan la célula a través de canales. El movimiento de agua se asocia con la secreción de Cl- y K+ en el LCR. están especializadas en la neurosecreción. Los órganos circunventriculares son siete: • Eminencia media del hipotálamo. • Glándula pineal. • Órgano vasculoso de la lámina terminal. • Área postrema. • Órgano subcomisural. • Órgano subfornical. • Neurohipófisis. La naturaleza del compuesto que atraviesa la barrera hematoencefálica también es de importancia para su transferencia a través de ella. Entre las características Biología de las células nerviosas 11 fisicoquímicas requeridas para el pasaje de compuestos en forma pasiva a través de la barrera hematoencefálica son importantes: a) un bajo peso molecular y b) su afinidad por el agua, lípidos de membrana y proteínas plasmáticas y de membrana (fig. 1-12). Las proteínas prácticamente no atraviesan en forma pasiva la barrera hematoencefálica, mientras que entre los compuestos de bajo peso molecular, los que son hidrosolubles la atraviesan mucho más lentamente que los liposolubles. Hay entrada de proteínas en el SNC (p. ej., citocinas) por procesos de transporte específico. Se denomina barrera hematocefalorraquídea a la que afecta el pasaje de sustancias desde los capilares coroideos al LCR. La barrera hematocefalorraquídea se ubica principalmente en el sello circunferencial establecido entre las células del epitelio coroideo. A diferencia de los capilares cerebrales, los capilares del plexo coroideo presentan numerosas fenestraciones y, por lo tanto, su endotelio no impide la difusión de sustancias desde la sangre al LCR. En la figura 1-10 se resumen las relaciones estructurales y funcionales de ambas barreras, hematoencefálica y hematocefalorraquídea. ¿Cuál es el sitio exacto, entre los distintos componentes de estas barreras, en el que se ejerce la función reguladora de la transferencia de sustancias? Si bien, como ya hemos mencionado, hay zonas identificables como barreras predominantes (el endotelio vascular para la barrera hematoencefálica; el epitelio coroideo para la barrera hematocefalorraquídea), es más exacto considerar a las barreras como la expresión de la función conjunta de sus distintos componentes, que se detallan en la figura 1-13. Por ejemplo, en el caso de la barrera hematoencefálica, los astrocitos no forman una barrera tan continua como el endotelio vascular, pero, sin embargo, sería un error considerar que los astrocitos no participan en forma activa en el control de las sustancias que arriban a las neuronas desde la circulación general. Las relaciones anatómicas entre estos componentes se esquematizan en las figuras 1-13 y 1-14. Las barreras hematoencefálica y hematocefalorraquídea no están plenamente establecidas en el momento del nacimiento. Ésta es la razón por la cual cier- Cuadro 1-1. Diferencias en concentración de diversos componentes del plasma y del LCR Componente LCR Plasma Componente LCR Plasma Peso específico 1,0075 1,025 Fosfato (mmol P/L) 0,48 1,3 Sólidos totales (g/100 mL) 1,0 8,7 Lactato (mEq/L) 1,7 1,7 Contenido de agua 99,0 91,3 N2 no prot (mg N/100 mL) 19 27 Sustancias reductoras (como glucosa) 65,0 98,0 Urea 14 14 Glucosa (mg/100 mL) 61,0 92,0 Ácido úrico 0,6 1,6 No glucosa 4,0 6,0 Aminoácidos 1,6 5 Sodio (mEq/L) 141 137 Creatinina 4 6 Potasio (mEq/L) 3,3 4,9 Colesterol (mg/100/mL) 0,14 160 Calcio (mEq/L) 2,5 5,0 Proteínas (mg/100 mL) 28 7.000 Magnesio (mEq/L) 2,4 64 Albúmina 23 4.430 Base total (mEq/L) 155 163 Globulina 5 2.270 Cloro (mEq/L) 124 101 Fibrinógeno 0 300 Bicarbonato (mEq/L) 21 23 12 Parte I - Los componentes del sistema nervioso y su comunicación Fig. 1-12. Fuerzas fisicoquímicas participantes en el pasaje de sustancias a través de la barrera hematoencefálica (BHE). AA, aminoácidos. tos metabolitos circulantes, que no son nocivos durante la vida adulta para la función neuronal, lo son en la edad perinatal. Un ejemplo es el de la bilirrubina indirecta, que cuando aumenta en el recién nacido por hemólisis excesiva (p. ej., incompatibilidad Rh) produce un cuadro de daño irreversible de los ganglios basales llamado “kernicterus”. En cambio, en los adultos, ictericias aún más pronunciadas por bilirrubina directa no causan daño cerebral debido a la existencia de las barreras ya mencionadas y a la menor toxicidad del compuesto en forma conjugada. elementos funcionales de protección de las células nerviosas. Su alteración, presente en diversas patologías cerebrales, conlleva graves daños para la función neuronal. En conclusión, las barreras hematoencefálica y hematocefalorraquídea deben considerarse como El flujo sanguíneo cerebral en un adulto normal es de 750 mL/min (50 mL/100 g/min); a la sustancia gris le En el cuadro 1-2 se enumeran algunas propiedades de la barrera hematocefalorraquídea. El cerebro está protegido por una estructura indeformable de hueso craneano Biología de las células nerviosas 13 Cuadro 1-2. Propiedades de la barrera hematocefalorraquídea Generador de agua Sitio principal de pasaje de agua de sangre a SNC. LCR como amortiguador para traumatismos encefálicos Transporte activo desde SNC Aniones orgánicos (p. ej., ácido homovanílico) y iones inorgánicos (p. ej., yoduro) son eliminados activamente manteniendo bajos los niveles de LCR Metabolismo de fármacos Proveedor de micronutrientes Extracción y transporte de nucleósidos, microelementos, vita- El plexo coroideo metaboliza, como el hígado, xenobióticos minas hidrosolubles, etc. Desde la sangre al LCR para entrar que poseen enzimas como P-450 o epóxido hidrolasa en neuronas o en la glía Fábrica de factores tróficos Producción y secreción al LCR de IGF-I, TF-β, etc. Vigilancia inmunológica Debido a la falta de linfáticos del tejido nervioso, las células presentadoras de antígenos interaccionan en el plexo coroideo con los linfocitos Transporte de fármacos Se puede evitar la BHE usando los sistemas de transportadores del plexo coroideo (p. ej., AZT) Fuente o blanco de neuropéptidos Receptores y/o síntesis de vasopresina, insulina, angiotensina II, leptina. Estos péptidos actúan localmente o se distribuyen en el tejido cerebral Homeostasis iónica del LCR Sensado de cambio en iones K+, Ca2+ y Mg2+ en el LCR y ajuste de la velocidad de transporte a ellos. Regulación del transporte de Cl- y HCO3- para mantener el pH del LCR Entrada de agentes patógenos Debido a la permeabilidad del plexo coroideo, los complejos inmunes o gérmenes pueden atravesarlo (p. ej., HIV) Fig. 1-13. Relaciones funcionales entre los distintos elementos que componen las barreras hematoencefálica y hematocefalorraquídea. Las flechas indican la dirección del flujo del LCR. (Modificado de Kandel y col, 2000.) 14 Parte I - Los componentes del sistema nervioso y su comunicación Fig. 1-14. Células participantes en el intercambio entre compartimientos cerebrales. (Modificado de Kandel y col, 2000.) corresponden 75 mL/100 g/min y a la sustancia blanca, 25 mL/100 g/min. Como hemos dicho, la presencia de LCR reduce el peso efectivo del cerebro. Esto, junto con la rigidez de la estructura ósea craneana, aumenta la protección del SNC ante el trauma, pero lo hace susceptible, ante un desequilibrio del contenido del cráneo, a un aumento de la presión intracraneana. El componente principal que ocupa la cavidad craneana es el agua, distribuida en cuatro compartimientos: sangre, LCR y los espacios extracelular e intracelular (neuronal y glial). En forma esquemática, puede decirse que el 80% del contenido intracraneano está constituido por la masa encefálica, el 10% por la sangre de los vasos sanguíneos y un 10% por el LCR. Para su integridad estructural y funcional, el cerebro depende del aporte constante de glucosa y oxígeno y de la eliminación de sus desechos metabólicos. Esto implica una íntima relación entre el flujo sanguíneo cerebral, la disponibilidad de los sustratos necesarios y los requerimientos metabólicos cerebrales (fig. 1-15). La mayor parte de la energía cerebral es consumida para el mantenimiento del gradiente iónico Entre el 50% y el 80% del metabolismo energético cerebral se invierte en el trabajo de la bomba Na+-K+-ATPasa, mientras que la biosíntesis de neurotransmisores sólo insume un 1% del total. El resto de la energía se utiliza en tareas de biosíntesis neuronal (renovación de membranas celulares y la síntesis de proteínas estructurales y enzimas). Debe notarse que existe un estrecho acoplamiento funcional entre el metabolismo cerebral, la actividad neuronal y el flujo sanguíneo cerebral. Ante incrementos de la actividad neuronal y de la demanda metabólica cerebral, se produce, por acción de quimiorreceptores vasculares, un incremento del flujo sanguíneo cerebral. Este acoplamiento tiene una latencia de unos 2 segundos y es estrictamente regional. Depende principalmente de la acción de señales que se acumulan en el líquido extracelular durante la acti- Biología de las células nerviosas 15 Fig. 1-15. Factores que afectan el flujo sanguíneo cerebral. (Modificado de Ganong y col, 2003.) vación neuronal, como lactato, H+, adenosina, K+, prostaglandinas, óxido nítrico (NO) y, en forma secundaria, de la acción de neurotransmisores sobre receptores en la microcirculación cerebral, como la noradrenalina, la acetilcolina, el péptido vasoactivo intestinal (VIP) o la sustancia P. En condiciones basales, la utilización celular de glucosa, el consumo de oxígeno y el flujo sanguíneo cerebral están en estrecha relación. Cuando aumenta la actividad sináptica (liberación de neurotransmisor), aumentan los requerimientos metabólicos (a través de la glucólisis) para el metabolismo de neurotransmisores (en especial en los astrocitos, que recaptan al neurotransmisor glutamato para procesarlo a glutamina) (véase fig. 1-6). No es de extrañar entonces que el CO2 sea el agente fisiológico y farmacológico más potente para modificar el flujo sanguíneo cerebral. Los vasos cerebrales reaccionan casi instantáneamente ante cambios en la presión local de CO2. Su aumento genera vasodilatación y su descenso tiene el efecto contrario. Un cambio de 1 mm Hg en la presión parcial arterial de CO2 produce un aumento del 2% en el flujo sanguí- neo cerebral. Así, los incrementos de la actividad funcional cerebral están asociados con aumentos del flujo sanguíneo cerebral, lo cual da la base para la mayoría de los métodos de neuroimagen funcional en uso en la actualidad. El efecto del O2 es de menor cuantía. Sólo cuando la presión parcial de O2 cae por debajo de 50 mm Hg se produce vasodilatación. Otros mecanismos que mantienen la perfusión cerebral normal son la vasodilatación refleja (mantenimiento de un flujo normal mediante la reducción de la resistencia vascular), la circulación por arterias colaterales y el incremento en la cantidad de extracción cerebral de glucosa y O2. Debe notarse que el control neurogénico de la circulación cerebral no tiene un papel tan importante en la regulación del flujo sanguíneo cerebral como los factores metabólicos antes mencionados. El sistema nervioso autónomo simpático cervical (proveniente del ganglio cervical superior) provee vasoconstricción noradrenérgica a las grandes arterias cerebrales, mientras que el parasimpático cerebral es vasodilatador por acción de la acetilcolina en ese mismo nivel. El tono va- 16 Parte I - Los componentes del sistema nervioso y su comunicación soconstrictor de la microcirculación depende de la actividad de neuronas noradrenérgicas del locus coeruleus y serotoninérgicas del rafe. Hay también interneuronas corticales peptidérgicas que usan neuropéptido Y para promover la vasoconstricción o VIP para la vasodilatación. La autorregulación vascular cerebral previene que ocurran modificaciones importantes en el flujo sanguíneo cerebral ante cambios sistémicos En condiciones normales, el flujo sanguíneo cerebral se mantiene constante a través de un amplio rango de variación de la presión de perfusión cerebral (dada por la diferencia entre la presión arterial media y la presión intracraneana y cuyo valor normal varía entre 5 y 20 cm de agua). Por este mecanismo de autorregulación vascular cerebral se previene que cambios sistémicos generen modificaciones importantes del flujo sanguíneo cerebral. La autorregulación resulta de un mecanismo miogénico controlado por la presión intraluminal (su aumento produce vasoconstricción y su disminución, vasodilatación) y que opera en forma independiente y simultánea con los otros factores neurogénicos, químicos y metabólicos. La autorregulación cerebral mantiene el flujo constante ante modificaciones en la presión de perfusión entre 60 y 150 mm Hg. Esto protege al SNC, por ejemplo, de los cambios posturales, de las eventuales oclusiones arteriales o del aumento de la presión intracraneana. Es de notar que existe un acoplamiento efectivo entre la presión intracraneana y la presión arterial sistémica. Ante el aumento de la presión intracraneana, aumenta la presión venosa intracerebral y disminuye el flujo sanguíneo cerebral. Esto genera en forma refleja un aumento de la presión arterial sistémica (reflejo de Cushing). En síntesis, puede decirse que la irrigación del cerebro depende de la presión de perfusión, o sea, de la diferencia entre la presión arterial sistémica media y la presión intracraneana. La presión de perfusión puede caer por: • Disminución del volumen sistólico. • Incremento de la presión intracraneana. • Vasoconstricción local. La resistencia local se controla por factores metabólicos locales (autorregulación), que mantienen el flujo cerebral constante ante cambios de la presión arterial sistémica, y así se mantiene la provisión constante de O2 y glucosa para las células cerebrales. El aumento de CO2 , y la caída del pH y de la PO2, inducen la formación de NO en la pared vascular, lo cual causa relajación vascular. La caída de CO2, y el aumento del pH y de la PO2 producen vasoconstricción y aumento de la resistencia vascular. En la isquemia cerebral se compromete el flujo sanguíneo y disminuyen el aporte de O2 y glucosa y la eliminación de productos del catabolismo cerebral El cerebro tiene depósitos mínimos de energía, por lo que la lesión por isquemia es mayor que en otros tejidos (figs. 1-16 a 1-18, recuadro 1-1.). La isquemia global se produce por caída de la presión arterial sistémica o por aumento de la presión intracraneana. Una isquemia global de 5 a 10 minutos produce daño permanente e irreversible de las células nerviosas. ¿Cómo cambia la microcirculación en la isquemia? La disminución de nutrientes y el aumento de productos de desecho son señales de aumento del flujo sanguíneo local para mantener la presión de perfusión. Los vasos se dilatan para reducir la resistencia, la presión arterial aumenta para mantener la perfusión, y existen factores locales de resorción del coágulo (véase fig. 1-17). La isquemia depleciona las reservas energéticas. No hay energía para mantener los gradientes de concentración de Na+ y K+, las neuronas se despolarizan y se liberan neurotransmisores. Se dañan las mitocondrias y se afecta la cadena respiratoria, con producción de radicales libres. La glucosa se convierte en lactato con reducción de la producción de ATP. En la isquemia central se produce un área periférica de “penumbra” (véase fig. 1-16). El destino de esta zona indefinida (muerte o recuperación) dependerá de la rapidez y eficacia de las medidas médicas adoptadas en la fase aguda de la isquemia. En la isquemia se abren canales iónicos en la membrana celular de las neuronas, el Na+ y el H2O entran en la célula y causan edema celular. Hay liberación de glutamato y reducción de su captación neuronal y glial por menor disponibilidad de ATP. El glutamato se une a receptores NMDA y no NMDA (véase cap. 3) con entrada de Ca2+ en las células. El aumento de Ca2+ produce lesión neuronal, liberación de fosfolipasas y alteración de fosfolípidos de membrana, con formación de eicosanoides, prostaglandinas, tromboxanos y leucotrienos. Esto lleva a mayor vasoconstricción, edema y coagulación intravascular. El aumento de Biología de las células nerviosas 17 Fig. 1-16. Evolución de la zona de penumbra luego de la isquemia cerebral. Fig. 1-17. Fenómenos celulares en la isquemia cerebral. 18 Parte I - Los componentes del sistema nervioso y su comunicación RECUADRO 1-1 Accidentes cerebrovasculares (I) Los accidentes cerebrovasculares son una de las tres causas más frecuentes de coma cerebral y muerte. Consisten en la disfunción neurológica producida por la reducción del flujo sanguíneo cerebral. El cuadro neurológico puede ser transitorio o definitivo. La isquemia cerebral es una alteración potencialmente reversible de la función cerebral, resultante de la provisión inadecuada de oxígeno o glucosa. Si la isquemia es grave como para producir muerte celular, se llega al infarto cerebral, situación en que las posibilidades de reversión disminuyen considerablemente. La muerte neuronal sobreviene a los 5-10 minutos de isquemia. La falla en la disponibilidad de energía por las células cerebrales es la base de los síntomas neurológicos del accidente cerebrovascular. La muerte neuronal se produce cuando las neuronas son incapaces de sintetizar ATP. Al no contar con nutrientes, la supervivencia celular se compromete. Hemos visto en este capítulo que como resultado de la acidosis intracelular por la glucólisis anaeróbica se deprime la respiración mitocondrial, se producen radicales libres y tiene lugar una intensa peroxidación de lípidos. También se altera la homeostasis iónica neuronal con entrada de Na+, Cl-, H2O y, sobre todo, de Ca2*. La entrada de agua conduce al edema celular, con compresión de los vasos sanguíneos y mayor reducción de la circulación. Las estructuras celulares se degeneran porque no existe la energía necesaria para la síntesis de macromoléculas. Otro factor agravante es la pérdida de los mecanismos de autorregulación del flujo cerebral, discutidos en este capítulo. Como vimos, este proceso mantiene relativamente constante el flujo cerebral a pesar de las variaciones de la presión arterial media. El sistema es eficaz hasta un nivel inferior de presión arterial media de 60 mm Hg, con límite superior en los 150 mm Hg. En el área de infarto cerebral, la autorregulación desaparece y el flujo sanguíneo sigue entonces en forma pasiva a los cambios en la presión arterial sistémica. El flujo sanguíneo cerebral disminuye ante cualquier proceso que estreche u ocluya un vaso cerebral nutriente. Se llama estenosis a la oclusión parcial. En el caso de la carótida, se requiere una reducción del 50% al 75% del diámetro antes de que haya modificación severa del flujo. Aun en estas circunstancias, el flujo cerebral puede permanecer normal si la circulación cola- Ca2+ activa la producción de radicales libres que se difunden a otras neuronas alterándolas con destrucción celular (véase fig. 1-18). Otros factores agravantes son el edema de astrocitos perineuronales y perivasculares y el daño endotelial teral alcanza a compensar la reducción. El estrechamiento arterial es producido en general por depósitos de lípidos en la pared (ateromas). Una caída de la presión sistémica severa puede conducir a una disminución del flujo cerebral, aun en presencia de vasos normales. Esta situación origina infartos en las zonas de borde, es decir, en las áreas localizadas entre la distribución de dos arterias mayores. Como estas zonas están al final de ambos árboles arteriales, están sujetas a una perfusión sanguínea baja, que en condiciones normales es sólo marginalmente suficiente. Son, por lo tanto, las primeras zonas en comprometerse ante caídas de la presión arterial sistémica. Si esta caída es prolongada y de importancia, sobreviene una isquemia cerebral global. La hemorragia cerebral es una de las formas más graves de accidente cerebrovascular y resulta de la ruptura espontánea de la pared de un vaso sanguíneo debilitado por una hipertensión arterial de larga evolución, o por la presencia de un ensanchamiento congénito de la pared o un aneurisma. En el primer caso, la hemorragia ocurre hacia el parénquima cerebral (hemorragia intracerebral). En el segundo caso, se acompaña además de hemorragia hacia el LCR, dado que los aneurismas se ubican en general en la superficie de los hemisferios. Ambos tipos de hemorragias (intracerebral, subaracnoidea) son de pronóstico serio, debido al efecto de masa y compresión de estructuras cerebrales vecinas y al severo espasmo de los vasos cerebrales debido a la presencia de sangre en el LCR. Los accidentes cerebrovasculares están en general precedidos por ataques isquémicos transitorios, que ceden en forma espontánea (en un lapso de 15 minutos a 24 horas). Una causa común de estos ataques transitorios es el breve episodio de isquemia producido por el pasaje de un émbolo, que produce obstrucción hasta que el émbolo se destruye y fluye por el árbol circulatorio. Estos émbolos pueden originarse en el corazón o en una lesión arteriosclerótica de un vaso grande, como la carótida. Un sitio común es la bifurcación de ésta en su rama interna y externa. Los émbolos producidos pueden causar disfunción sensorial, motora o del lenguaje, o ceguera unilateral transitoria. Los ataques isquémicos transitorios deben evaluarse y diagnosticarse cuidadosamente a fin de prevenir episodios de mayor gravedad. con aumento de la permeabilidad de la barrera hematoencefálica. Así, proteínas del plasma entran en el espacio intersticial cerebral y se produce edema vasogénico con aumento de la presión intracraneana y mayor compromiso del flujo sanguíneo. El cuadro clínico Biología de las células nerviosas 19 Fig. 1-18. Progresión de fenómenos en la isquemia cerebral. que se produce es altamente dependiente del territorio vascular involucrado (recuadro 1-2). Las neuronas presentan un potencial de reposo y cuatro tipos de señales eléctricas Las señales neurales dependen de las propiedades eléctricas de la membrana celular, y en las neuronas se observan distintos tipos de potenciales. En forma general, y con dependencia de la región neuronal examinada, las neuronas presentan un potencial de reposo y las siguientes señales eléctricas: • Señal de entrada. • Señal de integración. • Señal de conducción. • Señal de salida o de secreción (fig. 1-19). El potencial de reposo resulta, como en toda célula del organismo, de la separación de cargas eléctricas a través de una membrana celular que es semipermeable. Si el valor del potencial extracelular se fija en forma arbitraria en 0 mV, el interior de las neuronas será negativo (unos -60 a -70 mV). Este fenómeno no es privativo de las neuronas. Los valores del potencial de reposo en distintas células del organismo varían entre -40 y -75 mV, con excepción del músculo esquelético, donde alcanza unos -90 mV. Cuando el potencial de reposo de la membrana se hace más negativo que en la situación de reposo, es decir, cuando aumenta, se habla de hiperpolarización. Por el contrario, una reducción en el potencial de membrana, por ejemplo, de –70 a –40 mV, se llama despolarización. La hiperpolarización hace a la neurona menos excitable, mientras que la despolarización la transforma en más excitable. La señal de entrada comprende dos variantes, según se trate de la superficie receptora de las neuronas sensoriales o de las superficies dendrítica o somática de las neuronas centrales. En las neuronas sensoriales, el cambio de potencial se denomina potencial receptor o generador; en las dendritas o el soma neuronal se llama potencial sináptico. Ambos potenciales son de naturaleza local, graduados y de propagación pasiva o electrotónica; disminu- 20 Parte I - Los componentes del sistema nervioso y su comunicación RECUADRO 1-2 Accidentes cerebrovasculares (II) El déficit neurológico producido por los accidentes cerebrovasculares depende del vaso sanguíneo involucrado. El cerebro está perfundido por las arterias carótidas y las basilares (figs. 1-20 y 1-21). Uno de los cuadros más comunes involucra al territorio de la arteria cerebral media. Esta arteria tiene dos ramas: una profunda (la lenticuloestriada) y otra superficial (pial). La rama profunda irriga la cápsula interna, parte del globo pálido y del caudado, y la corona radiata. La rama pial irriga la superficie lateral de los lóbulos frontal, temporal y occipital. El cuadro clínico que resulta de la estenosis u oclusión de la arteria cerebral media depende de cuál de las ramas es la más afectada. Entre los síntomas más comunes se encuentran la hemiparálisis y la pérdida de sensibilidad contralateral, ambas más pronunciadas en el miembro superior. Esto se debe a que la representación del miembro inferior en la corteza sensorial y motora primaria está en la superficie medial de los lóbulos frontal y parietal (“hombrecillo invertido con los miembros inferiores colgando el espacio interhemisférico”; cap. 4). Estas áreas están fuera del territorio de la cerebral media. La afasia es común en las lesiones vasculares del hemisferio dominante (cap. 16). Cuando la lesión ocurre en el hemisferio no dominante, en especial en el lóbulo parietal, se produce una alteración grave de la representación espacial (abandono del hemicuerpo contralateral o neglect syndrome), en el cual el paciente no atiende a objetos o estímulos localizados contralateralmente a la lesión (cap. 16). En forma independiente de este cuadro, puede presentarse hemianopsia contralateral cuando están involucradas las radiaciones ópticas, es decir, las vías talamocorticales que conectan el cuerpo geniculado lateral con la corteza visual (cap. 5). La arteria cerebral anterior irriga al lóbulo frontal anterior y a partes de la corteza frontal y parietal en la región interna de los hemisferios. Por las razones ya citadas, la alteración del flujo en esta arteria se acompaña de parálisis y de pérdida de la sensibilidad en el miembro inferior contralateral. Este cuadro no se acompaña de hemianopsia ni de afasia. Los ojos pueden estar desviados hacia el sitio de la lesión debido al compromiso del área frontal de la mirada, responsable de dirigir los movimientos oculares rápidos de persecución de objetos en el plano horizontal (véase cap. 5). Cuando esta zona está dañada, predomina la del hemisferio opuesto, razón por la que el enfermo tiene los ojos desviados hacia la lesión (véase fig. 10-24). La oclusión de la arteria carótida interna da por resultado el infarto de los dos tercios anteriores del hemisferio correspondiente, en el área de distribución de las dos arterias mencionadas, cerebral media y anterior. Como la arteria cerebral anterior recibe flujo colateral de la homónima del hemisferio opuesto, el cuadro con frecuencia se limita al compromiso del territorio de la cerebral media (véase fig. 1-21) La oclusión de una arteria vertebral puede pasar inadvertida si la vertebral opuesta está normal y aporta circulación colateral a través de la arteria basilar. En otros casos, la oclusión de la arteria vertebral puede derivar en infarto del territorio de unas de sus ramas, la arteria cerebelosa posteroinferior. Esto desencadena un cuadro de compromiso de la porción lateral del bulbo, conocido como “síndrome de Wallenberg”. Las estructuras afectadas son la rama espinal del trigémino, el tracto espinotalámico, el núcleo ambiguo del vago, el pedúnculo cerebeloso inferior y las fibras simpáticas descendentes (cap. 12). Como consecuencia, el síndrome de Wallenberg comprende, desde el punto de vista sensorial, pérdida de la sensibilidad dolorosa y térmica (pero no táctil) de la porción homolateral de la cara (vía no cruzada del tracto espinal del V par) y pérdida de la sensibilidad al dolor y temperatura de la mitad opuesta del cuerpo (por lesión de la vía espinotalámica, que es cruzada) (cap. 4). Hay incoordinación homolateral de los miembros (por lesión del pedúnculo cerebeloso inferior) y disfonía (por parálisis homolateral de las cuerdas vocales (lesión del núcleo ambiguo del X par). En el ojo homolateral se observan ptosis (caída del párpado) y miosis (constricción de la pupila) por lesión del simpático. Se alteran también de manera significativa los mecanismos del sueño y del soñar (cap. 15). El síndrome de Wallenberg es un buen ejemplo de correlación anatómica, fisiológica y clínica. También ilustra un hecho de interés: cuando existen cuadros sensoriales o motores cruzados (un lado de la cara y el lado opuesto corporal), ello implica lesiones del tronco encefálico. La obstrucción de la arteria basilar lleva al infarto de la porción superior del tronco encefálico y de ambos lóbulos occipitales. Este cuadro con frecuencia es fatal. El par de arterias cerebrales posteriores se origina de la bifurcación de la porción terminal de la arterial basilar. Cada arteria cerebral posterior tiene una rama hemisférica que irriga al lóbulo occipital y ramas perforantes que irrigan al tronco encefálico, junto con otras ramas de la basilar (véase fig. 1-20). La oclusión de las ramas hemisféricas de una arteria cerebral posterior produce hemianopsia (pérdida de la mitad del campo visual) contralateral homónima en ambos ojos (cap. 5). Por ejemplo, una oclusión de la arteria cerebral posterior derecha produce un infarto occipital derecho con pérdida de la mitad izquierda del campo visual de ambos ojos. Cuando se ocluyen ambas ramas hemisféricas de las cerebrales posteriores, la pérdida total de la visión que se produce se denomina “ceguera cortical” (cap. 5). Los Biología de las células nerviosas 21 RECUADRO 1-2 (Cont.) Accidentes cerebrovasculares (II) Fig. 1-20. Irrigación del cerebro, vista basal. La vía sanguínea principal es a través de la arteria carótida interna y el sistema vertebrobasilar, los que se comunican entre sí a través del polígono de Willis. Fig. 1-21. Superficies lateral y medial del cerebro, que muestran la distribución de las principales arterias cerebrales. Las arterias cerebral anterior y media son ramas de la carótida interna; la arteria cerebral posterior es rama de la arteria basilar. 22 Parte I - Los componentes del sistema nervioso y su comunicación RECUADRO 1-2 (Cont.) Accidentes cerebrovasculares (II) pacientes con este cuadro muchas veces niegan la existencia de la ceguera. Cada arteria cerebral posterior también perfunde al esplenio, denominación que recibe la porción posterior del cuerpo calloso. Cuando esta estructura se infarta, en conjunto con la corteza visual primaria del hemisferio dominante, se origina un cuadro de alexia (imposibilidad de comprender la palabra escrita) sin agrafia (imposibilidad de escribir) (véase cap. 16). El cuadro de hemiacromatopsia (pérdida de la visión cromática de un hemicampo visual) se origina cuando se lesionan las áreas secundarias visuales en el infarto de la porción inferior y medial del lóbulo occipital. Esto se debe a que en estas áreas se encuentran zonas que discriminan el color (cap. 5). Como en el caso de la hemianop- sia, se afecta la visión de color del hemicampo visual opuesto a la lesión en ambos ojos. Además de las lesiones citadas, que corresponden a las grandes ramas de las arterias cerebrales, se producen también infartos lacunares, o pequeñas lesiones de menos de 15 mm de diámetro, debidas a la oclusión de arterias penetrantes pequeñas que se han alterado por la hipertensión crónica. Aunque de poca extensión, estas lesiones suelen ser devastadoras. Por ejemplo, un infarto lacunar que implica a la cápsula interna o al tracto piramidal en la protuberancia puede producir una hemiparesia grave, o un infarto lacunar del núcleo ventral posterior del tálamo puede producir una pérdida sensorial severa contralateral con síndrome talámico (cap. 4). Fig. 1-19. Las distintas señales de recepción, integración, conducción y secreción en neuronas sensoriales, motoras e interneuronas. A la derecha, los distintos potenciales encontrados en cada segmento. (Modificado de Kandel y col. 2000) Biología de las células nerviosas 23 yen en forma progresiva en intensidad, y no se detectan más allá de 1 o 2 mm del sitio de origen. Su amplitud es de 0,1 a 5 mV, excepto en casos particulares como la placa motora (véase cap. 3) o en las sinapsis de la fibras trepadoras con células de Purkinje del cerebelo (véase cap. 11). Los potenciales receptores o generadores se detectan en los receptores sensoriales y son, en sus distintas variantes, una representación analógica del estímulo. Pueden ser hiperpolarizantes (inhibitorios) o despolarizantes (excitatorios). Los potenciales sinápticos son el medio por el cual una neurona puede modificar el potencial de membrana de las células con las cuales se conecta. Para ello, la neurona presináptica libera un transmisor químico o, con menor frecuencia, la transmisión se realiza por un mecanismo eléctrico. En la transmisión química, el neurotransmisor interactúa con receptores ubicados en la superficie de la membrana postsináptica, lo cual da lugar a la generación del potencial sináptico, que puede ser de tipo inhibitorio: potencial inhibitorio postsináptico (PIPS) (que es hiperpolarizante) o excitatorio: potencial excitatorio postsináptico (PEPS) (de naturaleza despolarizante). La duración de los potenciales sinápticos es variada (desde milisegundos a, en ciertos casos, segundos o minutos). La señal de integración se observa en la “zona gatillo” de la membrana neuronal, donde los distintos potenciales locales, propagados electrotónicamente, se suman y dan origen al potencial de acción. En general, aunque no siempre, la “zona gatillo” se ubica en el cono axonal. Esta zona se caracteriza por poseer una concentración elevada de canales de Na+ y K+ dependientes del voltaje, particularidad que la transforma en la porción de menor umbral de toda la membrana celular. Si la suma de los potenciales sinápticos alcanza el umbral, se genera un potencial de acción; de allí que se llame “integradora” a la señal producida. Veremos en el siguiente capítulo que dicha suma puede ser de tipo espacial o temporal. La señal de conducción es el potencial de acción. Mientras que los potenciales sináptico o receptor se propagan en forma pasiva y disminuyen en amplitud con la distancia, el potencial de acción (o “potencial espiga”) tiene las siguientes propiedades: • Se propaga activamente a lo largo del axón (o en ciertos casos, como las neuronas piramidales de la corteza cerebral, también por las dendritas). • No disminuye su intensidad en función de la distancia. • Es de naturaleza “todo o nada”. • Es semejante en todas las neuronas, sea cual fuere la función que tenga la neurona (sensorial, motora o de interneurona). La amplitud del potencial de acción es de unos 100 mV y dura 0,5-2 mseg. La señal de salida se observa en las terminales sinápticas del axón, donde la despolarización produce la liberación de neurotransmisor (sinapsis de tipo químico) o perturba, debido a la aposición de membranas, el potencial de reposo de la neurona postsináptica (sinapsis de tipo eléctrico). En el caso de las sinapsis químicas, la liberación de transmisor depende de la entrada de Ca2+ e implica la generación de un potencial local, llamado potencial secretor, desencadenado por el potencial de acción. La entrada de Ca2+ es proporcional a la intensidad del potencial secretor y es esencial para la liberación exocitótica del transmisor. La distribución de canales dependientes del voltaje señalada (de Na+ y K+ en el axón; de Ca2+ en la terminal neural) no debe tomarse como absoluta. En las dendritas coexisten los tres tipos de canales dependientes del voltaje en regiones intersinápticas de la membrana celular; también están presentes los canales regulados por transmisor, característicos de la región sináptica. Esta coexistencia de canales de distintos tipos define el perfil de descarga típico de cada neurona (véase cap. 3). Cada neurona comprende un conjunto de macromoléculas específicas y no específicas Hemos mencionado que las formas neuronales son en extremo variadas (unas 10.000). Esta diversidad citológica es el resultado del proceso embriológico conocido con el nombre de diferenciación. Cada célula diferenciada sintetiza sólo ciertas macromoléculas (enzimas, proteínas estructurales, componentes de membrana, productos de secreción), es decir, utiliza sólo una porción del material genético que contiene. Muchos componentes de las neuronas son comunes a otras células y, por lo tanto, no son específicos. Otros componentes se encuentran sólo en las neuronas, o únicamente en ciertos grupos neuronales, y son entonces específicos. Es decir, cada neurona comprende un conjunto de macromoléculas específicas y no específicas. Como ejemplo de lo antedicho, mencionamos aquí algunas diferencias y semejanzas entre los dos componentes neuronales del reflejo miotático, cuya función 24 Parte I - Los componentes del sistema nervioso y su comunicación Fig. 1-22. Estructura histológica de una motoneurona del asta anterior de la médula espinal. A. Un único axón mielinizado se extiende desde el asta anterior medular a las fibras musculares. B. Sección transversal a través de las porciones internodales que comprenden las capas de mielina formadas por la célula de Schwann. C. Sección longitudinal del nodo de Ranvier, con en axón central desprovisto de la capa de mielina. se analiza en detalle en el capítulo 9 (véase fig. 9-14). El reflejo miotático está mediado por una neurona sensorial primaria aferente (Ia), con su soma ubicado en los ganglios de las raíces dorsales, y dos prolongaciones, una periférica que termina en el huso muscular del músculo esquelético, y una central hacia la médula espinal. El segundo componente neuronal de este reflejo es la motoneurona alfa ubicada en el asta anterior de la médula espinal, y sobre la cual hace sinapsis la prolongación central de la aferente primaria Ia. La neurona sensorial primaria y la motoneurona alfa difieren entre sí en: • Su forma (seudounipolar en las aferentes primarias, multipolar en el caso de las motoneuronas alfa). • En el tipo de conexiones que recibe (la información de entrada llega a la motoneurona a nivel de las dendritas en un 95% y sólo el 5% en el cuerpo neuronal; en el caso de las neuronas sensoriales, ello ocurre en uno de los extremos seudounipolares). • En el tipo de receptor presente en sus membranas celulares (sensible a la deformación celular producida por el estiramiento del músculo en las aferentes primarias; específico para neurotransmisores como el glutamato, el GABA y la glicina en las motoneuronas alfa). • En el transmisor que emplean (glutamato para las aferentes primarias, acetilcolina para las motoneuronas alfa). Como semejanzas entre ambas neuronas pueden mencionarse, entre otras propiedades: • Canales similares de Na+, K+ y Ca2+ dependientes del voltaje en la membrana neuronal. • Tienen un idéntico mecanismo de intercambio Na+ -K+ (la bomba Na+-K+-ATPasa). • Ambos tipos de neuronas presentan axones envueltos por una vaina de mielina (fig. 1-22). Es decir, las similitudes y las diferencias dependen de la síntesis y la distribución de las proteínas neuronales. La fracción de material genético expresada por las células nerviosas es la mayor del organismo. Se calcula que unas 200.000 secuencias distintas de RNA mensajero son expresadas en el cerebro, lo cual constituye unas 10-20 veces más que lo observado en el hígado o el riñón. La velocidad de expresión de estos genes es variada. Los estudios sobre genes de expresión temprana (p. ej., oncogén c-fos) han incorporado un elemento dinámico en la descripción de las conexiones cerebrales, ya que se consideran marcadores de la actividad neuronal. En este sentido, los resultados obtenidos coinciden con los de la autorradiografía con glucosa radiactiva (véase cap. 10). Un Biología de las células nerviosas 25 adelanto de interés es el análisis mediante el desarrollo de formas atenuadas de virus (herpes simple, adenovirus) que infectan a las neuronas y permiten la transferencia de genes a las neuronas maduras adultas. Así se puede inducir la síntesis de proteínas que desempeñan un papel crítico en la fisiología neuronal. Esta manipulación genética es específica bioquímica y anatómicamente, y puede realizarse en regiones individualizadas del encéfalo adulto. Abre también la posibilidad de la terapia génica. Con excepción de algunas pocas proteínas codificadas por el genoma mitocondrial, todas las especies de RNA mensajero en las neuronas tienen origen nuclear. Las neuronas, como otros tipos de células, sintetizan tres clases de proteínas: • Proteínas que se sintetizan en el citoplasma y permanecen en él. • Proteínas de síntesis citosólica, pero con destino final mitocondrial, nuclear o peroxisómico. • Proteínas que se sintetizan en asociación con membranas y se distribuyen por medio de vesículas en distintas organelas. Las proteínas citoplasmáticas o citosólicas constituyen la fracción más importante y comprenden: a) elementos fibrilares del citoesqueleto (neurofilamentos, tubulina y actina y proteínas asociadas que, en conjunto, representan el 20% de las proteínas neuronales), b) enzimas del metabolismo intermedio. Son proteínas sintetizadas en los polisomas libres y producidas en su forma final, con muy poco procesado posterior y c) proteínas con destino mitocondrial, nuclear o peroxisómico que también se sintetizan en polisomas libres, con inserción posterior en el sitio de destino (transferencia postraduccional). Las proteínas de membrana y secretorias resultan de la acción RNA mensajeros que forman polisomas asociados con el retículo endoplasmático rugoso. La sustancia de Nissl basófila, típica de las neuronas, es el resultado de la tinción de este RNA mensajero. La cadena peptídica comienza a sintetizarse por el N-terminal, y existe una secuencia llamada péptido señal, relativamente hidrófoba, que no permanece en la proteína madura. El péptido señal tiene varias funciones. Por un lado, le permite al polisoma unirse a la superficie citoplasmática de la membrana del retículo endoplasmático. Asimismo, detiene la traducción del RNA mensajero. Por último, se libera péptido señal y la traducción recomienza. Según el destino final de la proteína, el péptido naciente: • Se incorpora a porciones de la membrana del retícu- lo endoplasmático, que luego se transferirán, previo pasaje por el aparato de Golgi, a la membrana celular (proteínas de membrana) o a distintas organelas, como la membrana nuclear, el aparato de Golgi, las vesículas secretorias, los endosomas, o el mismo retículo endoplasmático. Existen varias configuraciones de inserción de proteínas a membranas, según la atraviesen por un único sitio de inserción o varios (ejemplo de este último caso son las proteínas constitutivas de los canales iónicos). • Se trasloca a la luz de las cisternas del retículo (proteínas secretorias). En el caso de las proteínas secretorias, durante este período se produce un procesado activo del péptido original, que incluye ruptura de la proteína en fragmentos de menor peso molecular, glucosilación, sulfatación, etc. Estas modificaciones tienen lugar dentro de vesículas, las que por transporte axoplasmático son transferidas hacia la membrana celular. Puede así concluirse que las proteínas de membrana y las destinadas a la secreción son modificadas de manera significativa luego de su síntesis, a diferencia de lo que ocurre con las proteínas citosólicas. Los productos secretorios son sintetizados como parte de largas cadenas polipeptídicas, que sufren luego sucesivos procesos de hidrólisis proteolítica. Los mecanismos de transferencia de las vesículas desde el retículo endoplasmático al Golgi, y de allí a los sitios de inserción en la membrana o de secreción, son complejos. En las neuronas, las proteínas de membrana y de secreción son vehiculizadas a sus sitios finales por una de dos vías diferentes: a) en la vía constitutiva, las vesículas se mueven continuamente para renovar el plasmalema, llevando nuevos constituyentes y reciclando los viejos a través de los endosomas. Luego de ser recuperados del plasmalema, los endosomas entran en los lisosomas para ser degradados, o son reciclados para reaparecer en la membrana plasmática y b) en la vía regulada, las vesículas secretorias o sinápticas se fusionan con la membrana celular sólo en el momento de la secreción que, como veremos, es dependiente del Ca2+ (fig. 1-23). Cada sinapsis tiene un conjunto de receptores, canales y moléculas apropiadas para los neurotransmisores participantes Una cuestión clave en la biología de las neuronas es comprender cómo los componentes celulares son dirigidos a distancia desde el núcleo celular a muy distin- 26 Parte I - Los componentes del sistema nervioso y su comunicación te a la proteína citoesquelética MAP-2 (microtubuleassociated protein; véase más adelante), y el que codifica la síntesis de la subunidad alfa de la proteincinasa dependiente de calmodulina. En menor proporción, en las espinas dendríticas se encuentran ARNm correspondientes a otros componentes del citoesqueleto. Los ARNm mencionados se transportan asociados con los componentes del citoesqueleto, por transporte axoplasmático lento. En forma semejante a lo que ocurre en las neuronas, se produce la síntesis de proteínas en regiones alejadas del núcleo en células gliales. Por ejemplo, en los oligodendrocitos y en las células de Schwann, la proteína básica de la mielina es sintetizada en los procesos celulares (donde se encuentran los ARNm correspondientes), mientras que los proteolípidos se sintetizan perinuclearmente. La función apropiada del sistema nervioso depende del rápido y eficiente flujo de información entre las neuronas y sus efectores, producido a través de las sinapsis. Fig. 1-23. Ciclo de vida de las vesículas sinápticas. Se sintetizan, se ensamblan y se exportan desde el aparato de Golgi, transportándose por transporte axonal rápido hacia la sinapsis. Luego de la exocitosis y el reciclado retornan al cuerpo celular por transporte retrógrado, donde se digieren en los lisosomas. (Modificado de Kandel y col, 2000.) tos sitios del árbol dendrítico o del axón. Veremos más adelante (cap. 3) que la función sináptica es el resultado de una particular combinación de proteínas (receptores, canales iónicos, moléculas de adhesión y sistemas de segundos mensajeros), que determinan la respuesta postsináptica al transmisor liberado en dicha sinapsis. Por lo tanto, una neurona central, que recibe en promedio 104 sinapsis, debe construir 104 microambientes sinápticos que sean adecuados para las variadas señales recibidas. Hasta hace poco se pensaba que estos microambientes se obtenían mediante los procesos de exportación de proteínas desde el pericarion. Sin embargo, se ha identificado un segundo mecanismo dado por ARN mensajeros que se transfieren desde el núcleo neuronal a sitios sinápticos específicos para facilitar la síntesis local de proteínas. Ésta es la razón de que se encuentren polirribosomas en dendritas, inmediatamente por debajo de los sitios postsinápticos. Dos tipos de ARNm predominan en las dendritas, el correspondien- Si bien la morfología de la sinapsis se ha estudiado durante mucho tiempo, sólo recientemente se ha obtenido información sobre las señales moleculares responsables de la organización de estas estructuras. La concentración selectiva de receptores es una de las propiedades típicas de la sinapsis. Los estudios más detallados se han efectuado sobre el receptor nicotínico de la placa muscular (véase cap. 2). En la sinapsis, la densidad de receptores es de unas 10.000 moléculas/mm2, mientras que fuera de la placa motora la densidad es unas 1.000 veces menor. La principal molécula responsable de esta concentración es una proteína de 200 kDa producida por las motoneuronas y que se asocia con la membrana postsináptica, llamada agrina. Esta proteína tiene homologías con otros factores de crecimiento, como el factor de crecimiento epidérmico. El transporte axoplasmático es una adaptación funcional a la polaridad extrema de las neuronas Las neuronas son células secretorias. Como las células endocrinas, en las cuales los gránulos de secreción se ensamblan en el aparato de Golgi, las neuronas presentan vesículas de almacenamiento del transmisor (vesículas sinápticas), también formadas en el sistema neuronal de membranas internas. A diferencia de las células glandulares, la extrema polarización de la neurona hace que en muchos casos la distancia entre el Biología de las células nerviosas 27 cuerpo celular y las terminales sinápticas sea considerable. Líneas arriba hemos mencionado el ejemplo de una motoneurona lumbar, con un axón varios órdenes de magnitud más largo que el diámetro del pericarion. Cobra así extrema importancia el tráfico de sustancias entre el soma y las terminales o dendritas, denominado transporte axoplasmático. Existen dos tipos de transporte axoplasmático: • Anterógrado. • Retrógrado. Dentro del transporte axoplasmático anterógrado se distinguen los siguientes subgrupos: a) rápido y b) lento. En esencia, todas las organelas celulares que contienen membranas se exportan desde el cuerpo celular por un proceso de transporte axoplasmático anterógrado rápido, de velocidad promedio de 400 mm/día. Los principales componentes transportados por este proceso son las vesículas sinápticas y las mitocondrias. Durante la exocitosis en las terminales neurales, las vesículas sinápticas se reciclan varias veces y la membrana celular es renovada constantemente por nuevos componentes que arriban desde el soma neuronal. A fin de mantener un equilibrio entre los nuevos componentes de membrana que llegan y los que se reciclan en la terminal, estos últimos retornan al cuerpo celular para su degradación o posterior reutilización. La velocidad de tal transporte axoplasmático retrógrado es de unos 200 mm/día. Además de la función de reciclado de vesículas y de la membrana celular, el transporte axoplasmático retrógrado es utilizado para transferir al soma señales producidas en elementos celulares postsinápticos, como por ejemplo, el factor de crecimiento neural. Este factor estimula el crecimiento de grupos neuronales durante el desarrollo embriológico del SNC y tiene una posible aplicación en la recuperación del tejido neural adulto ante degeneraciones seniles o luego de la lesión. Pertenece a una familia más amplia de moléculas tróficas neurales, llamadas neurotrofinas, que actúan sobre receptores vinculados a tirosincinasa y constituyen señales de recuperación celular que impiden la entrada de la célula en el proceso de apoptosis. Las neurotrofinas de mayor importancia son el factor de crecimiento neural, la neurotrofina 3, la neurotrofina 4/5 y el factor neurotrófico cerebral (brain-derived neurotrophic factor, BDNF). Todos pueden producirse en la postsinapsis como consecuencia de la actividad neural y son transportados por transporte axoplasmático retrógrado a las neu- ronas presinápticas. Es de interés que tanto la actividad eléctrica normal como las crisis convulsivas repetidas modifican la anatomía y la excitabilidad de las redes neurales y la expresión de los genes que codifican la síntesis de neurotrofinas. Es probable que estos mecanismos sean de importancia en procesos normales (p. ej., sueño, cap. 15; aprendizaje, cap. 16) y patológicos (epilepsia, cap. 15). Por transporte axoplasmático retrógrado, penetran el SNC virus neurotrópicos como los agentes del herpes, de la rabia y de la poliomielitis, así como toxinas (toxina tetánica). El transporte axoplasmático anterógrado lento presenta dos componentes: a) velocidad de 0,5-3 mm/día y b) velocidad de 4-6 mm/día. A través del transporte axoplasmático anterógrado lento viajan componentes citosólicos (elementos del citoesqueleto y proteínas solubles). El subtipo más lento comprende las proteínas que forman los neurofilamentos y las que constituyen los microtúbulos (tubulina alfa y beta y proteínas asociadas, como las MAP). El subtipo más rápido de transporte axoplasmático anterógrado lento involucra a la actina (la cual al polimerizarse da origen a los microfilamentos) y a la clatrina (proteína que recubre vesículas en reciclado en el extremo secretorio); la calmodulina también se desplaza en este componente. Como puede apreciarse, los tres componentes principales del citoesqueleto, microtúbulos, neurofilamentos y microfilamentos, son transportados a través del axón y las dendritas por transporte axoplasmático anterógrado lento. La forma de estudio de los distintos tipos de transporte axoplasmático consiste en la inyección de precursores radiactivos (p. ej., aminoácidos) o de micropartículas radiactivas en las cercanías del soma neuronal y el seguimiento de las moléculas marcadas a lo largo del axón. Mediante este procedimiento se ha establecido que el transporte axoplasmático anterógrado rápido es: a) dependiente de la fosforilación oxidativa, b) no es modificado por inhibidores de la síntesis de proteínas, c) se observa aun en axones desconectados del soma. Este transporte rápido está basado en los microtúbulos, que proveen una “vía” estacionaria sobre las cuales se mueven las organelas en forma saltatoria. El transporte axoplasmático anterógrado rápido depende de varios de los filamentos que constituyen el citoesqueleto, es decir, la actina, la miosina y los microtúbulos. Los microtúbulos proveen un “riel” sobre el cual se mueven las partículas, y la traslocación, que es dependiente de la energía, sería por deslizamiento de filamentos de actina y miosina, en forma semejante al proceso de contracción muscular (véase cap. 7). 28 Parte I - Los componentes del sistema nervioso y su comunicación Fig. 1-24. Una MAP (proteína asociada con los microtúbulos), la cinesina, de actividad ATPasa, está directamente vinculada con el transporte axoplasmático anterógrado rápido. En presencia de ATP, produce la fuerza necesaria para el desplazamiento de las organelas. Como hemos mencionado, los microtúbulos se componen de tubulina y proteínas asociadas (MAP). Una de estas proteínas, la cinesina, de actividad ATPasa, está directamente vinculada con el transporte axoplasmático anterógrado rápido, y produce, en presencia de ATP, la fuerza necesaria para el desplazamiento de las organelas (fig. 1-24). Otra proteína de características semejantes, la dineína, es la responsable del transporte axoplasmático retrógrado. Los elementos fibrilares del citoesqueleto neuronal se mueven por transporte axoplasmático lento. Estas proteínas determinan la forma neuronal; presentan cambios de importancia en el envejecimiento normal y patológico (enfermedad de Alzheimer; cap. 16). Las familias de proteínas fibrilares del citoesqueleto neuronal son tres Los principales elementos fibrilares del citoesqueleto axonal son: • Microtúbulos. • Neurofilamentos. • Microfilamentos (fig. 1-25). En cada caso se presentan también proteínas asociadas. Los microtúbulos, compuestos por 13 protofilamentos de tubulina alfa y beta, tienen un diámetro de unos 25 nm, y están orientados longitudinalmente. Son de importancia para definir la direccionalidad del transporte axoplasmático anterógrado rápido y del retrógrado. Su longitud máxima en las dendritas o en el axón es de unos 0,1 mm, no recorren toda la extensión intracelular y no se continúan con microtúbulos del cuerpo celular. Diversas proteínas asociadas (MAP-1, MAP-2, tau) regulan la estabilidad de los microtúbulos y promueven su polimerización. Los neurofilamentos, de 10 nm de diámetro, son los elementos fibrilares más abundantes en los axones (10:1 en relación con los microtúbulos) y constituyen la base del citoesqueleto. Se denominan neurofibrillas a los haces de neurofilamentos visibles al microscopio óptico. Pertenecen, junto a los llamados “filamentos intermedios” de otros tipos celulares, a la familia de proteínas de las citoqueratinas, que además comprende a la proteína fibrilar glial, a la desmina y a la queratina. Están totalmente polimerizados en condiciones fisiológicas. En la enfermedad de Alzheimer se degeneran en forma característica (los llamados tangles u ovillos de neurofilamentos). Una MAP (tau), fosforilada anormalmente, es responsable de este fenómeno. Los microfilamentos, de 3-5 nm de diámetro, son polímeros de actina en doble hélice. Su constitución es semejante a la de la actina de otros grupos celulares. En muchos casos, los microfilamentos se fijan a la membrana celular a través de proteínas asociadas, como la espectrina neuronal (o fodrina), la anquirina, la vinculina y la talina. La mayoría de la actina neuronal está asociada con la membrana celular; en las dendritas corticales se encuentra principalmente en las espinas dendríticas, sitio de máxima abundancia de sinapsis. Los microfilamentos también pueden interaccionar con proteínas de la matriz extracelular, como la laminina o la fibronectina, asociándose con proteínas que atraviesan la membrana, las integrinas. Estas proteínas de superficie facilitan la adhesión y el reconocimiento celular y se unen a diversos componentes de la matriz extracelular, como la fibronectina, el colágeno o la laminina. Las integrinas se consideran receptores para señales de la matriz extracelular que afectan a la función celular. Su vía de segundo mensajero es la activación de la tirosincinasa (véase cap. 3). Los distintos componentes fibrilares del citoesqueleto, en su conjunto, se hallan en estado dinámico, alargándose o acortándose en forma continua. Por ejemplo, el 50% de la actina presente está en forma despolimerizada; su polimerización se regula momento a momento por complejos mecanismos intracelulares, aún no totalmente elucidados. Biología de las células nerviosas 29 Fig. 1-25. Componentes del citoesqueleto neuronal. BIBLIOGRAFÍA RECOMENDADA Abbott NJ, Ronnback L, Hansson E. Astrocyte-endothelial interactions at the blood-brain barrier. Nat Rev Neurosci 2006;7:41-53. Ackley BD, Jin Y. Genetic analysis of synaptic target recognition and assembly. Trends Neurosci 2004;27:540-7. Aidley DJ. The Physiology of Excitable Cells. London: Cambridge University Press; 1983. Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. Biología Molecular de la Célula. 4ª ed. Madrid: Omega; 2002. Altenberg GA. The engine of ABC proteins. News Physiol Sci 2003;18:191-5. Amiry-Moghaddam M, Ottersen OP. The molecular basis of water transport in the brain. Nat Rev Neurosci 2003;4:9911001. Anderson CM, Nedergaard M. Astrocyte-mediated control of cerebral microcirculation. Trends Neurosci 2003;26:340-4. Andrews ZB, Diano S, Horvath TL. Mitochondrial uncoupling proteins in the CNS: In support of function and survival. Nat Rev Neurosci 2005;6:829-40. Araujo SJ, Tear G. Axon guidance mechanisms and molecules: Lessons from invertebrates. Nat Rev Neurosci 2003;4:910-22. Bareyre FM, Schwab ME. Inflammation, degeneration and regeneration in the injured spinal cord: insights from DNA microarrays. Trends Neurosci 2003;26:555-63. Barros LF, Porras OH, Bittner CX. Why glucose transport in the brain matters for PET. Trends Neurosci 2005;28:117-9. Ben Ari Y, Spitzer NC. Nature and nurture in brain development. Trends Neurosci 2004;27:361. Benn SC, Woolf CJ. Adult neuron survival strategies– slamming on the brakes. Nat Rev Neurosci 2004;5:686-700. Bennett MV, Contreras JE, Bukauskas FF, Saez JC. New roles for astrocytes: Gap junction hemichannels have something to communicate. Trends Neurosci 2003;26:610-7. Chao MV. Neurotrophins and their receptors: A convergence point for many signalling pathways. Nat Rev Neurosci 2003;4:299-309. Chotard C, Salecker I. Neurons and glia: Team players in axon guidance. Trends Neurosci 2004;27:655-61. Chuckowree JA, Dickson TC, Vickers JC. Intrinsic regenerative ability of mature CNS neurons. Neuroscientist 2004;10:280-5. Conti L, Cattaneo E. Controlling neural stem cell division within the adult subventricular zone: An Appealing job. Trends Neurosci 2005;28:57-9. Crespo-Santiago D. La matriz extracelular del sistema nervioso central: Proteoglicanos del tipo condroitín sulfato y reparación neural. Rev Neurol 2004;38:843-51. de Castro F. Chemotropic molecules: Guides for axonal pathfinding and cell migration during CNS development. News Physiol Sci 2003;18:130-6. Dean C, Dresbach T. Neuroligins and neurexins: Linking cell adhesion, synapse formation and cognitive function. Trends Neurosci 2006;29:21-9. 30 Parte I - Los componentes del sistema nervioso y su comunicación Dent EW, Tang F, Kalil K. Axon guidance by growth cones and branches: Common cytoskeletal and signaling mechanisms. Neuroscientist 2003;9:343-53. Dillon C, Goda Y. The actin cytoskeleton: Integrating form and function at the synapse. Annu Rev Neurosci 2005;28:25-55. Dityatev A, Schachner M. Extracellular matrix molecules and synaptic plasticity. Nat Rev Neurosci 2003;4:456-68. Dorta-Contreras AJ, Reiber H. Teoría de la difusión molecular /flujo de líquido cefalorraquídeo. Rev Neurol 2004;39:564-9. Ebihara L. New roles for connexons. News Physiol Sci 2003;18:100-3. Ehlers MD. Ubiquitin and synaptic dysfunction: Ataxic mice highlight new common themes in neurological disease. Trends Neurosci 2003;26:4-7. Emsley JG, Arlotta P, Macklis JD. Star-cross’d neurons: Astroglial effects on neural repair in the adult mammalian CNS. Trends Neurosci 2004;27:238-40. Esteban FJ, Horcajadas A, El Rubaidi O, Luque-Barona R, Ibañez G, Garcáa-Carriazo A, Segovia M, Moral-Leal ML. Óxido nítrico en astrocitos malignizados. Rev Neurol 2005;40:437-40. Farber K, Kettenmann H. Physiology of microglial cells. Brain Res Brain Res Rev 2005;48:133-43. Ferguson KL, Slack RS. Growth factors: can they promote neurogenesis? Trends Neurosci 2003;26:283-5. Ferrus A. El por qué de tantas sinapsis. Rev Neurol 2002;35:661-7. Freeman MR, Doherty J. Glial cell biology in Drosophila and vertebrates. Trends Neurosci 2006;29:82-90. Ganong WF. Review of Medical Physiology 21a ed. New York: McGraw-Hill. 2003 Gandhi CS, Isacoff EY. Shedding light on membrane proteins. Trends Neurosci 2005;28:472-9. Garcia-Ovejero D, Azcoitia I, Doncarlos LL, Melcangi RC, García-Segura LM. Glia-neuron crosstalk in the neuroprotective mechanisms of sex steroid hormones. Brain Res Brain Res Rev 2005;48:273-86. Gidday JM. Cerebral preconditioning and ischaemic tolerance. Nat Rev Neurosci 2006;7:437-48. Goldman S. Glia as neural progenitor cells. Trends Neurosci 2003;26:590-6. Gomez TM, Zheng JQ. The molecular basis for calcium-dependent axon pathfinding. Nat Rev Neurosci 2006;7:115-25. González-Amaro R, Sánchez-Madrid F. Moléculas de adhesión intercelular y factores quimiotácticos en la patogenia de la esclerosis múltiple. Rev Neurol 2002;35:985-93. Gotz M. Glial cells generate neurons– master control within CNS regions: Developmental perspectives on neural stem cells. Neuroscientist 2003;9:379-97. Guan KL, Rao Y. Signalling mechanisms mediating neuronal responses to guidance cues. Nat Rev Neurosci 2003;4:941-56. Hagg T. Molecular regulation of adult CNS neurogenesis: An integrated view. Trends Neurosci 2005;28:589-95. Hanani M. Satellite glial cells in sensory ganglia: From form to function. Brain Res Brain Res Rev 2005;48:457-76. Hanz S, Fainzilber M. Integration of retrograde axonal and nuclear transport mechanisms in neurons: implications for therapeutics. Neuroscientist 2004;10:404-8. Hatten ME, Heintz N. Large-scale genomic approaches to brain development and circuitry. Annu Rev Neurosci 2005;28:89108. Haydon PG. Glia: Listening and talking to the synapse. Nat Rev Neurosci 2001;2:185-93. Hertz L, Zielke HR. Astrocytic control of glutamatergic activity: Astrocytes as stars of the show. Trends Neurosci 2004;27:735-43. Hippenmeyer S, Kramer I, Arber S. Control of neuronal phe- notype: What targets tell the cell bodies. Trends Neurosci 2004;27:482-8. Hirokawa N, Takemura R. Molecular motors and mechanisms of directional transport in neurons. Nat Rev Neurosci 2005;6:201-14. Horner PJ, Palmer TD. New roles for astrocytes: The nightlife of an “astrocyte”. La vida loca! Trends Neurosci 2003;26: 597-603. Howard A, Tamas G, Soltesz I. Lighting the chandelier: New vistas for axo-axonic cells. Trends Neurosci 2005;28:310-6. Iadecola C. Neurovascular regulation in the normal brain and in Alzheimer’s disease. Nat Rev Neurosci 2004;5:347-60. Innocenti GM, Price DJ. Exuberance in the development of cortical networks. Nat Rev Neurosci 2005;6:955-65. Jarjour AA, Kennedy TE. Oligodendrocyte precursors on the move: Mechanisms directing migration. Neuroscientist 2004;10:99-105. Jessen KR, Mirsky R. The origin and development of glial cells in peripheral nerves. Nat Rev Neurosci 2005;6:671-82. Jockusch BM, Huttelmaier S, Illenberger S. From the nucleus toward the cell periphery: A guided tour for mRNAs. News Physiol Sci 2003;18:7-11. John GR, Lee SC, Brosnan CF. Cytokines: Powerful regulators of glial cell activation. Neuroscientist 2003;9:10-22. Johnson MH. Functional brain development in humans. Nat Rev Neurosci 2001;2:475-83. Kalb R. The protean actions of neurotrophins and their receptors on the life and death of neurons. Trends Neurosci 2005;28:5-11. Kandel ER, Schwartz JH, Jessel TM. Principles of Neural Science. 4th ed. New York: McGraw Hill; 2000. Kettenmann H, Ransom BR. Neuroglia. 2nd ed. Oxford: Oxford University Press; 2004. Kim S, Chiba A. Dendritic guidance. Trends Neurosci 2004;27: 194-202. Kirik D, Bjorklund A. Modeling CNS neurodegeneration by overexpression of disease-causing proteins using viral vectors. Trends Neurosci 2003;26:386-92. Klann E, Dever TE. Biochemical mechanisms for translational regulation in synaptic plasticity. Nat Rev Neurosci 2004;5: 931-42. Kleene R, Schachner M. Glycans and neural cell interactions. Nat Rev Neurosci 2004;5:195-208. Lai CH, Kuo KH, Leo JM. Critical role of actin in modulating BBB permeability. Brain Res Brain Res Rev 2005;50:7-13. Lauritzen M. Reading vascular changes in brain imaging: Is dendritic calcium the key? Nat Rev Neurosci 2005;6:77-85. Lledo PM, Alonso M, Grubb MS. Adult neurogenesis and functional plasticity in neuronal circuits. Nat Rev Neurosci 2006;7:179-93. Lo EH, Dalkara T, Moskowitz MA. Mechanisms, challenges and opportunities in stroke. Nat Rev Neurosci 2003;4:399-415. Loturco JJ, Bai J. The multipolar stage and disruptions in neuronal migration. Trends Neurosci 2006. Lu B, Pang PT, Woo NH. The yin and yang of neurotrophin action. Nat Rev Neurosci 2005;6:603-14. Luo L, O’Leary DD. Axon retraction and degeneration in development and disease. Annu Rev Neurosci 2005;28:127-56. Ming GL, Song H. Adult neurogenesis in the mammalian central nervous system. Annu Rev Neurosci 2005;28:223-50. Missler M. Synaptic cell adhesion goes functional. Trends Neurosci 2003;26:176-8. Nedergaard M, Ransom B, Goldman SA. New roles for astrocytes: Redefining the functional architecture of the brain. Trends Neurosci 2003;26:523-30. Newman EA. New roles for astrocytes: Regulation of synaptic transmission. Trends Neurosci 2003;26:536-42. Biología de las células nerviosas 31 Notterpek L. Neurotrophins in myelination: A new role for a puzzling receptor. Trends Neurosci 2003;26:232-4. Overstreet LS. Quantal transmission: not just for neurons. Trends Neurosci 2005;28:59-62. Pan W, Kastin AJ. Why study transport of peptides and proteins at the neurovascular interface. Brain Res Brain Res Rev 2004;46:32-43. Pascual Garvi JM, González LF, Prieto AR, Cerdan S, Roda JM. La barrera hematoencefálica. Desarrollo de una estructura que sostiene la heterogeneidad funcional del sistema nervioso central. Rev Neurol 2004;38:565-81. Paxinos G, Mai JK. The Human Nervous System. 2nd ed. New York: Elsevier-Academic Press; 2004. Pellerin L, Magistretti PJ. Neuroenergetics: Calling upon astrocytes to satisfy hungry neurons. Neuroscientist 2004;10:53-62. Peters A, Palay SL, Webster H. The Fine Structure of the Nervous System. The Neurons and Supporting Cells. New York: Oxford University Press; 1991. Purves D. Invitación a la Neurociencia. Buenos Aires: Editorial Médica Panamericana; 2001. Rakic P. Neurogenesis in adult primate neocortex: An evaluation of the evidence. Nat Rev Neurosci 2002;3:65-71. Ramón y Cajal S. Textura del Sistema Nervioso del Hombre y de los Vertebrados. Alicante: Gráficas Vidal Leuka; 1992. Rao SD, Weiss JH. Excitotoxic and oxidative cross-talk between motor neurons and glia in ALS pathogenesis. Trends Neurosci 2004;27:17-23. Richardson WD, Kessaris N, Pringle N. Oligodendrocyte wars. Nat Rev Neurosci 2006;7:11-8. Sawa A, Pletnikov MV, Kamiya A. Neuron-glia interactions clarify genetic-environmental links in mental illness. Trends Neurosci 2004;27:294-7. Schaller B. Physiology of cerebral venous blood flow: From experimental data in animals to normal function in humans. Brain Res Brain Res Rev 2004;46:243-60. Seifert G, Schilling K, Steinhauser C. Astrocyte dysfunction in neurological disorders: A molecular perspective. Nat Rev Neurosci 2006;7:194-206. Shea TB, Jung C, Pant HC. Does neurofilament phosphorylation regulate axonal transport? Trends Neurosci 2003;26: 397-400. Shepherd GM. The Synaptic Organization of the Brain. Oxford: Oxford University Press; 2004. Silver J, Miller JH. Regeneration beyond the glial scar. Nat Rev Neurosci 2004;5:146-56. Smith R. Moving molecules: mRNA trafficking in mammalian oligodendrocytes and neurons. Neuroscientist 2004;10:495500. Squire L, Bloom FE, McConnell SK, Roberts JL, Spitzer NC, Zigmond MJ. Fundamental Neuroscience. 2nd ed. New York: Academic Press; 2003. Theis M, Sohl G, Eiberger J, Willecke K. Emerging complexities in identity and function of glial connexins. Trends Neurosci 2005;28:188-95. Tresguerres JAF, Ariznavarreta Ruiz C, Cachofeiro Ramos V, Cardinali D P, Escrich Escriche E, Gil Loyzaga P, Lahera Juliá V, Mora Teruel F, Romano Pardo M, Tamargo Menéndez J. Fisiología Humana. 3ª ed. Madrid: McGraw Hill-Interamericana; 2005. Volterra A, Meldolesi J. Astrocytes, from brain glue to communication elements: The revolution continues. Nat Rev Neurosci 2005;6:626-40. Waagepetersen HS, Sonnewald U, Schousboe A. Compartmentation of glutamine, glutamate, and GABA metabolism in neurons and astrocytes: Functional implications. Neuroscientist 2003;9:398-403. Waites CL, Craig AM, Garner CC. Mechanisms of vertebrate synaptogenesis. Annu Rev Neurosci 2005;28:251-74. Yuste R, Bonhoeffer T. Genesis of dendritic spines: Insights from ultrastructural and imaging studies. Nat Rev Neurosci 2004;5:24-34.