Activos Cosméticos - Croda Personal Care
Anuncio
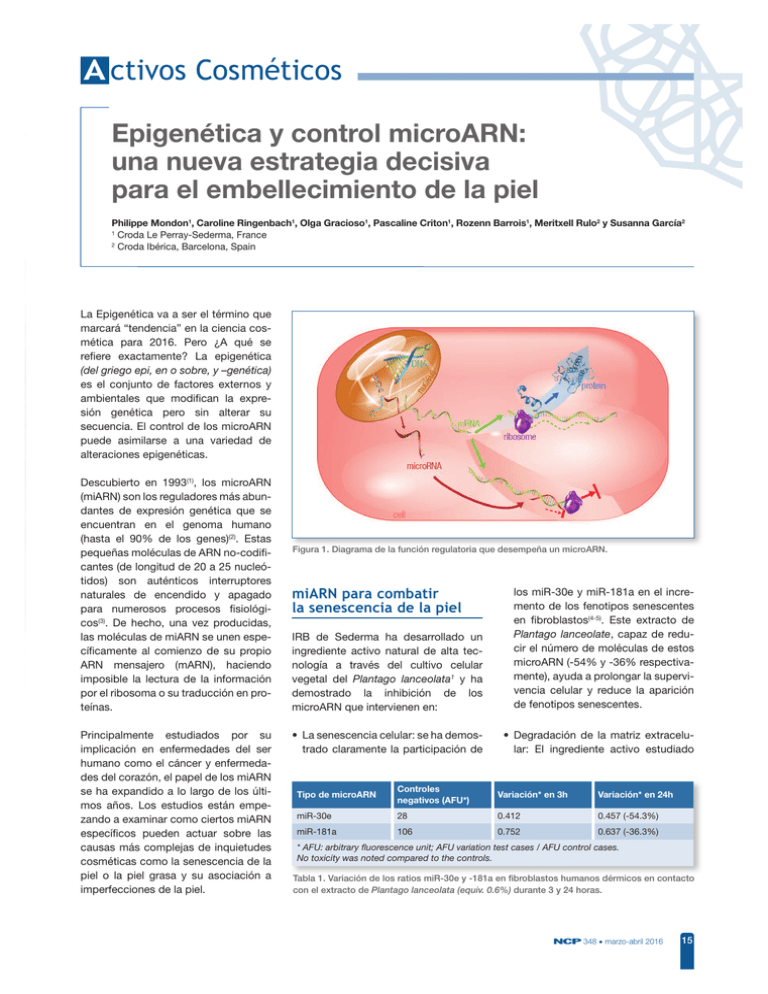
A ctivos Cosméticos Epigenética y control microARN: una nueva estrategia decisiva para el embellecimiento de la piel Philippe Mondon1, Caroline Ringenbach1, Olga Gracioso1, Pascaline Criton1, Rozenn Barrois1, Meritxell Rulo2 y Susanna García2 1 Croda Le Perray-Sederma, France 2 Croda Ibérica, Barcelona, Spain La Epigenética va a ser el término que marcará “tendencia” en la ciencia cosmética para 2016. Pero ¿A qué se reiere exactamente? La epigenética (del griego epi, en o sobre, y –genética) es el conjunto de factores externos y ambientales que modiican la expresión genética pero sin alterar su secuencia. El control de los microARN puede asimilarse a una variedad de alteraciones epigenéticas. Descubierto en 1993(1), los microARN (miARN) son los reguladores más abundantes de expresión genética que se encuentran en el genoma humano (hasta el 90% de los genes)(2). Estas pequeñas moléculas de ARN no-codiicantes (de longitud de 20 a 25 nucleótidos) son auténticos interruptores naturales de encendido y apagado para numerosos procesos isiológicos(3). De hecho, una vez producidas, las moléculas de miARN se unen especíicamente al comienzo de su propio ARN mensajero (mARN), haciendo imposible la lectura de la información por el ribosoma o su traducción en proteínas. Principalmente estudiados por su implicación en enfermedades del ser humano como el cáncer y enfermedades del corazón, el papel de los miARN se ha expandido a lo largo de los últimos años. Los estudios están empezando a examinar como ciertos miARN especíicos pueden actuar sobre las causas más complejas de inquietudes cosméticas como la senescencia de la piel o la piel grasa y su asociación a imperfecciones de la piel. Figura 1. Diagrama de la función regulatoria que desempeña un microARN. miARN para combatir la senescencia de la piel IRB de Sederma ha desarrollado un ingrediente activo natural de alta tecnología a través del cultivo celular vegetal del Plantago lanceolata1 y ha demostrado la inhibición de los microARN que intervienen en: los miR-30e y miR-181a en el incremento de los fenotipos senescentes en ibroblastos(4-5). Este extracto de Plantago lanceolate, capaz de reducir el número de moléculas de estos microARN (-54% y -36% respectivamente), ayuda a prolongar la supervivencia celular y reduce la aparición de fenotipos senescentes. • La senescencia celular: se ha demostrado claramente la participación de • Degradación de la matriz extracelular: El ingrediente activo estudiado Tipo de microARN Controles negativos (AFU*) Variación* en 3h Variación* en 24h miR-30e 28 0.412 0.457 (-54.3%) miR-181a 106 0.752 0.637 (-36.3%) * AFU: arbitrary fluorescence unit; AFU variation test cases / AFU control cases. No toxicity was noted compared to the controls. Tabla 1. Variación de los ratios miR-30e y -181a en fibroblastos humanos dérmicos en contacto con el extracto de Plantago lanceolata (equiv. 0.6%) durante 3 y 24 horas. NCP 348 • marzo-abril 2016 15 A ctivos Cosméticos Piel sin estrés Piel “envejecida”, placebo Piel “envejecida”, extracto de Plantago lanceolata al 2% Figura 2. Demostración de la estimulación de la síntesis de elastina en explantes de piel en contacto con el extracto de Plantago lanceolata. Detección por immunofluorescencia (n=3). limita la expresión del miR-29 (-35%) y miR-196a (-34%) que han sido descubiertos por el control del colágeno-I, colágeno-IV y la síntesis de elastina(6-12). De esta manera, ayuda a estimular la síntesis de las macromoléculas de la matriz extracelular y a su vez mejorar la calidad de la dermis. Para completar esta acción, este extracto de Plantago lanceolata también modula la actividad de las metaloproteinasas de la Matriz (MMP) responsables de la degradación de las macro proteínas que dan estructura a la matriz extracelular, tales como el colágeno y la elastina. Las MMP están controladas por el miR-21(13-14) y el extracto estudiado reduce el miR-21 en un 34%, y en consecuencia disminuye la actividad de las MMP y mejora tanto la calidad, densidad como el grosor de la dermis, tal como se ilustra a continuación (Figura 3). miARN para desvanecer las imperfecciones de la piel grasa Otro ingrediente activo natural extraído a través del cultivo de las células vegetales del Syringa vulgaris2 y desarrollado por IRB, de Sederma, ha sido diseñado para matiicar e igualar el tono de la piel grasa así como la piel 16 NCP 348 • marzo-abril 2016 T0 T1 mes Figura 3. Observación de una mejora en la firmeza y elasticidad de la piel, tras la aplicación del extracto de Plantago lanceolata durante un mes en la mano. propensa a sufrir acné. Gracias a un mecanismo cosmetogenómico exclusivo, se ha demostrado su control en la proliferación bacteriana de la P. acnes (Propionibacterium acnes) y la inlamación inducida mediante la regulación del miR-105. La proliferación de P. acnes es la característica principal de la piel pro-acneica. Cuando esta bacteria se une a las células de la piel a través de los receptores de supericie que reciben el nombre de Toll-Like Receptors 2 (TLR-2)(15), se desencadena una cascada de reacciones que derivan en la producción de moléculas pro-inlamatorias(16). La síntesis del TLR-2 se modula en el queratinocito mediante un micro-ARN llamado miR-105(17). El extracto de Syringa vulgaris, incrementa la expresión del miR-105 en un 65% y reduce la expresión de los TLR-2, y de este modo reduce el número de puntos de unión bacteriana y en consecuencia, los efectos bacterianos. El resultado general es una reducción de las imperfecciones de la inlamación tal como se ilustra a continuación (Figura 4). Estos dos ejemplos demuestran la importancia de la epigenética y especialmente la regulación de los mecanismos de los microARN y su interés para T0 T1 mes Figura 4. Variación de la cantidad de imperfecciones de inflamación después de aplicar 0,5% del extracto de Syringa vulgaris. la industria cosmética. Los estudios son sólo un punto de partida y los descubrimientos en microRNA y más particularmente de las moléculas que pueden actuar sobre ellos, darán lugar a una nueva generación de productos para el cuidado de la piel. Bibliografía 1. LEE R.C., FEINBAUM R.L., AMBROS V., “The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14.” Cell, 1993, 75, p. 843-854. 2. PROVOST P., “Interpretation and applicability of microRNA data to the context of Alzheimer's and age-related diseases”. Aging (Albany NY). 2010 Mar 31; 2(3), p. 166-9. 3. BANERJEE J., SEN C.K., “MicroRNAs in skin and wound healing.” Methods Mol. Biol., 2013, 936, p. 343-356. 4. KHANNA A., MUTHUSAMY S., LIANG R., SAROJINI H., WANG E., “Gain of survival signaling by downregulation of three key miRNAs in brain of calorie-restricted mice.” Aging, 3, 2011, p. 223236. 5. MANCINI M., SAINTIGNY G., MAHE C., ANNICHIARICO-PETRUZZELLI M., MELINO G, CANDI E., “MicroRNA-152 and -181a participate in human dermal fibroblasts senescence acting on cell adhesion and remodeling of the extracellular matrix.” Aging, 2012, 4, p. 843853. 6. MAURER B., STANCZYK J., JUNGEL A., AKHMETSHINA A., TRENKMANN M., BROCK 1 2 M., KOWAL-BIELECKA O., GAY R.E., MICHEL B.A., DISTLER J.H., GAY S., DISTLER O., “MicroRNA-29, a key regulator of collagen expression in systemic sclerosis.” Arthritis & Rheum., 2010, 62, p. 1733-1743. 7. KWIECINSKI M., NOETEL A., ELFIMOVA N., TREBICKA J., SCHIEVENBUSCH S., STRACK I., MOLNAR L., VON BRANDENSTEIN M., TOX U., NISCHT R., COUTELLE O., DIENES H.P., ODENTHAL M., “Hepatocyte growth factor (HGF) inhibits collagen-I and IV synthesis in hepatic stellate cells by miRNA-29 induction.” PLOS One, 2011, 6, e24568. 8. LI J., GHAZWANI M., ZHANG Y., LU J., FAN J., GANDHI C.R., LI S., “miR-122 regulates collagen production via targeting hepatic stellate cells and suppressing P4HA1 expression.” J. Hepatol., 2013, 58, p. 522-528. 9. KASHIYAMA K., MITSUTAKE N., MATSUSE M., OGI T., SAENKO V.A., UJIFUKU K., UTANI A., HIRANO A., YAMASHITA S., “miR-196a downregulation increases the expression of type I and III collagens in keloid fibroblasts.” J. Invest. Dermatol., 2011, 132, p. 1597-1604. 10. HONDA N., JINNIN M., KAJIHARA I., MAKINO T., MAKINO K., MASUGUCHI S., FUKUSHIMA S., OKAMOTO Y., HASEGAWA M., FUJIMOTO M., IHN H, “TGF-β-mediated downregulation of microRNA-196a contributes to the constitutive upregulated type I collagen expression in scleroderma dermal fibroblasts.” J. Immunol., 2012, 188, p. 3323-3331. 11. DONG X.R., MAJESKY M.W., “Restoring elastin with microRNA-29.” Arterioscler. Thromb. Vasc. Biol., 2012, 32, p. 548-551. enhances elastin levels in cells haploinsufficient for elastin and in bioengineered vessels.” Arterioscler. Thromb. Vasc. Biol., 2012, 32, p. 756759. 13. GABRIELY G., WURDINGER T., KESARI S., ESAU C.C., BURCHARD J., LINSLEY P.S., KRICHEVSKY A.M., “MicroRNA 21 promotes glioma invasion by targeting matrix metalloproteinase regulators.” Molec. Cell., Biol., 2008, 28, p. 5369-5380. 14. REN J., SUN Y., ZHAO X., WANG X., FENG J., LIU M., ZHU D. “Downregulation of miR-21 regulates MMP-2 expression and suppress migration of Laryngeal squamous cell carcinoma.” Head Neck Oncol., 2012, 9, p. 65. 15. KORECK A., KIS K., SZEGEDI K., PAUNESCU V., CIOACA R., OLARIU R., NEGRU S., BATA-CSORGOZ., KEMENY L., DOBOZY A., SZELL M., “TLR2 and TLR4 polymorphisms are not associated with acne vulgaris.”, Dermatology, 2006; 213, p. 267-9. 16. KUROKAWA I., DANBY F.W., JU Q., WANG X., XIANG L.F., XIA L., CHEN W., NAGY I., PICARDO M., SUH D.H., GANCEVICIENE R., SCHAGEN S., TSATSOU F., ZOUBOULIS C.C., “New developments in our understanding of acne pathogenesis and treatment”. Exp. Dermatol., 2009, 18, p. 821-832. 17. BENAKANAKERE M.R., LI Q., ESKAN M.A., SINGH A.V., ZHAO J., GALICIA J.C.,STATHOPOULOU P., KNUDSEN T.B., KINANE D.F., “Modulation of TLR2 protein expression by miR-105 in human oral keratinocytes”. J. Biol Chem., 2009, 284, p. 2310723115. 12. ZHANG P., HUANG A., FERRUZZI J., MECHAM R.P., STARCHER B.C., TELLIDES G., HUMPHREY J.D., GIORDANO F.J., NIKLASON L.E., SESSA W.C , “Inhibition of microRNA-29 Nombre comercial Senestem™ Nombre comercial Sebuless™ NCP 348 • marzo-abril 2016 17



