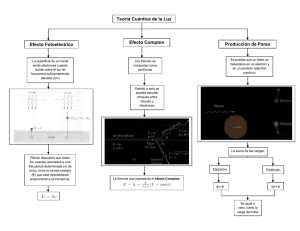
Fisica moderna
Anuncio

TEMA 5: INTRODUCCIÓN A LA FÍSICA MODERNA PARTE 1: El efecto fotoeléctrico y los espectros discontinuos: insuficiencia de la Física clásica para explicarlos. Hipótesis de De Broglie. Relaciones de indeterminación. Valoración del desarrollo científico y tecnológico que supuso la Física moderna. • Descripción fenomenológica y análisis de la insuficiencia de la física clásica para explicar el efecto fotoeléctrico y los espectros atómicos. • Hipótesis de Planck: cuantización de la energía. • Teoría de Einstein del efecto fotoeléctrico : concepto de fotón (aspecto corpuscular de la radiación). • Espectros discontinuos: niveles de energía en los átomos. • Hipótesis de De Broglie (aspecto ondulatorio de la materia) • Dualidad onda - corpúsculo (superación de la dicotomía partícula-onda característica de la física clásica). • Principio de incertidumbre de Heisenberg. • Determinismo y probabilidad • Dominio de validez de la física clásica. PARTE 2: Física nuclear. La energía de enlace. Radioactividad: tipos, repercusiones y aplicaciones. Reacciones nucleares de fisión y fusión, aplicaciones y riesgos. • Breve referencia al modelo atómico: núcleo y electrones. • Interacciones dominantes en los ámbitos atómico molecular y nuclear y órdenes de magnitud de las energías características en los fenómenos atómicos y nucleares. • Energía de enlace y defecto de masa. • Principio de equivalencia masa energía. • Estabilidad nuclear. • Radiactividad; descripción de los procesos alfa, beta y gamma y justificación de las leyes del desplazamiento. • Ley de desintegración radiactiva; magnitudes. • Balance energético (masa energía) en las reacciones nucleares. • Descripción de las reacciones de fusión y fisión nucleares; justificación cualitativa a partir de la curva de estabilidad nuclear. INSUFICIENCIA DE LA FÍSICA CLÁSICA La física clásica trata a las partículas y las ondas como cosas diferentes. El comportamiento de las partículas puede explicarse mediante las leyes de Newton y el de las ondas mediante la teoría de Huygens y las leyes de Maxwell para el electromagnetismo. Sin embargo, a final del siglo XIX y comienzos del XX aparecieron nuevos fenómenos que pusieron en duda la validez de las leyes clásicas: • • • • Radiación del cuerpo negro Efecto fotoeléctrico Efecto Compton Interpretación de los espectros atómicos INTERPRETACIÓN DE LA RADIACIÓN TÉRMICA. HIPÓTESIS DE PLANCK. Exposición del fenómeno: Sabemos que los cuerpos absorben y emiten energía. Un cuerpo frío absorbe más de la que emite, mientras que un cuerpo caliente emite más energía que absorbe. Supongamos que empezamos a calentar un trozo de hierro. Todos sabemos que al ir aumentando su temperatura comienza a tomar un tono rojizo, después rojo intenso hasta ponerse amarillo brillante. Sencillamente lo que ocurre es que los restos positivos del metal vibran cada vez con más rapidez en sus posiciones en la red, es decir, que se comportan como si fueran osciladores armónicos: Es evidente que al tratarse de cargas aceleradas radiarán energía en forma de ondas electromagnéticas. A medida que se calienta más, aumentan las frecuencias de vibración y por tanto la frecuencia de las OEM que radia y por eso va pasando a rojo y luego al amarillo. Si para una temperatura determinada, analizamos la energía que radia por unidad de área y tiempo (es decir, la potencia por unidad de área, un concepto similar a la intensidad) para cada frecuencia (o longitud de onda) se obtiene una curva como la de la figura: observaremos que : • • Radia más energía cuanto mayor es la temperatura del hierro. Si la temperatura del hierro es mayor, aumenta la frecuencia para la cual radia el máximo de energía, es decir se va desplazando desde el IR (donde solo notamos el calor) hacia al visible y por ese motivo lo empezamos a ver rojo De esta forma, si variamos la temperatura y medimos la energía radiada para cada frecuencia podemos obtener una familia de curvas. Cada material tiene una familia a de curvas distintas, por eso, y para facilitar su estudio, se ha pensado en un cuerpo ideal que absorba todas las radiaciones (sean de la frecuencia que sean) y que por tanto sea capaz de emitir todas las radiaciones. A este cuerpo ideal se le llama cuerpo negro. Un cuerpo negro puede ser una caja negra impregnada de negro de humo en la que se ha practicado un pequeño orificio. Así al entrar la luz en ella, a fuerza de reflejarse se absorberá completamente antes de salir: Si se calienta el cuerpo negro a gran temperatura, sus paredes comenzarán a emitir radiaciones, que en parte él mismo absorberá, pero el resto saldrán por el orificio. A esta se la llama radiación del cuerpo negro. Representando la energía radiada por unidad de tiempo y área en función de la frecuencia, a varias temperaturas, se obtienen una familia de curvas similares a las anteriores: Se observa que: • Al aumentar la temperatura del cuerpo negro, éste radia más energía. Experimentalmente se ha demostrado que la energía total radiada por unidad tiempo y de área (potencia por unidad de área) es proporcional a la cuarta potencia de la temperatura, lo que se conoce como ley de Stefan–Boltzman Eν = σT4 σ = cte. de Stefan–Boltzman = 5,67 ⋅ 10 −8 Wat/m2ºK4 Para los cuerpos no negros la ley de Stefan–Boltzman se escribe igual, pero introduciendo una coeficiente de absorción característico de cada material: Eν = α σT4 • La frecuencia para la cual la radiación es máxima sufre un corrimiento hacia el visible. Wien encontró la relación que existe entre la temperatura a la que está el cuerpo y la frecuencia para la cual emite la radiación máxima: T ν max = cte = 9,65 ⋅ 10 −12 º K ⋅ s Basándose en esto y estudiado la ν max o la λmax de la luz emitida por las estrellas podemos calcular la temperatura a la que se encuentran. (Teniendo en cuenta que c = λ ν , la ley de Wien también puede escribirse como T ⋅ λ max = 2,89 ⋅ 10 −3 º K ⋅ m ) Interpretaciones: A) Interpretación clásica de Rayleigh–Jeans: Estos dos físicos ingleses,basándose en la teoría electromagnética y en que los átomos al vibrar se comportan como pequeños osciladores armónicos que emiten continuamente OEM, llegaron a una expresión matemática, que más o menos concordaba con la curva experimental para bajas frecuencias (en el IR), pero que para altas frecuencias crecía exponencialmente, desviándose de la curva experimental, por lo que los físicos la llamaron “catástrofe ultravioleta”, porque de acuerdo con esto, la teoría electromagnética clásica no era capaz de explicar este fenómeno. B) Interpretación cuántica de Max Planck: Este físico alemán, en una conferencia el 14 de diciembre de 1900, que es una fecha histórica para la física, dijo que para poder explicar la radiación del cuerpo negro había que desechar la idea de que los cuerpos pueden absorber y emitir energía de forma continua. Hay que admitir que la energía se absorbe y emite en forma de pequeños paquetes de energía, que llamó “cuantos” (posteriormente Einstein los llamó fotones) y su energía es proporcional a su frecuencia: E = hν h = cte. de Planck = 6,62 ⋅ 10 −34 J ⋅ s Según esto, un cuerpo puede absorber o emitir un fotón, o dos, o tres, es decir n ⋅ hν donde n es un número entero, lo que quiere decir que “la energía está cuantizada”. • Planck supuso que la radiación electromagnética era emitida por pequeños osciladores submicroscópicos que solo podían vibrar con múltiplos enteros de cierta frecuencia ν, y no con cualquiera, así que radiaban energía en múltiplos de hν. • Como el número de osciladores es enorme y cada uno de ellos oscila con una frecuencia distinta, el cuerpo puede emitir todas las frecuencias y el espectro es continuo. • Planck partiendo de esta idea, absolutamente nueva, consiguió una fórmula empírica que reproducía exactamente la curva experimental de la radiación el cuerpo negro. Planck puso los cimientos de la física moderna, pero no recibió el premio Nóbel por su descubrimiento del cuanto hasta varios años después, cuando Einstein hizo uso de éste concepto para explicar el efecto fotoeléctrico, quedando la revolucionaria idea fuera de dudas. Ejemplo: Calcular la temperatura de la superficie del sol y la energía radiada por unidad de área y tiempo, sabiendo que la longitud de onda para la cual la energía radiada es máxima es λ max = 5,1 ⋅ 10 −7 m . Datos: Cte de Wien = 2,89.10–3 mºK; Cte de Stefan–Boltzman = 5,67.10–8 W/m2ºK4 De acuerdo a las unidades en que nos dan la constante de Wien, escribiremos la ley de Wien como: T ⋅ λ max = 2,89 ⋅ 10 −3 º K ⋅ m de donde: 2,89 ⋅ 10 −3 m⋅º K T= = 5666,67º K 5,1 ⋅ 10 −7 m De acuerdo con la ley de Stefan–Boltzman, la energía por unidad de área y tiempo radiada por el sol (potencia por unidad de área) Eν = σT4 sustituyendo: E ν = 5,67 ⋅ 10 −8 ⋅ 5666,67 4 = 5,85 ⋅ 10 7 W / m 2 EFECTO FOTOELÉCTRICO Exposición del fenómeno: El efecto fotoeléctrico consiste en la emisión de electrones por parte de los metales al ser iluminados. Un sencillo experimento puede ponerlo de manifiesto: Si adosamos una lámina de zinc al conductor de un electroscopio descargado, veremos que al iluminar la placa de zinc con luz UV se separan las láminas del electroscopio porque se carga positivamente como consecuencia de que emite electrones: Se puede estudiar el fenómeno introduciendo el zinc en una ampolla de vidrio como cátodo (al dispositivo se le llama célula fotoeléctrica) 1. En primer lugar se puede observar que para cada metal hay una frecuencia mínima (frecuencia umbral νo) por debajo de la cual no hay ninguna emisión de electrones. Lógicamente los metales más electropositivos, al tener los electrones de valencia menos ligados, tienen frecuencias umbrales más pequeñas que los otros: ν o ,Sodio = 4,5 ⋅ 1014 Hz (rojo) ν o , Zinc = 8,5 ⋅ 1014 Hz (UV) 2. Si se aumenta la intensidad de la luz, aumenta el número de electrones que abandonan el metal, es decir, aumenta la intensidad de la corriente, como era de esperar de acuerdo con la teoría electromagnética clásica. Lo curioso del caso, y que ya no se puede explicar con la teoría electromagnética clásica, es que por muy intensa que sea la luz, si no tiene una frecuencia igual o mayor que la umbral no sale ni un solo electrón. (Según la física clásica la energía de una onda es proporcional al cuadrado de la amplitud, de manera que se puede tener ondas de gran energía aunque su frecuencia sea pequeña, como por ejemplo ocurre con las olas) 3. Si se ilumina con una luz de frecuencia mayor a la umbral, los electrones salen disparados con una energía cinética que no depende de la intensidad de la luz, sino solamente de su frecuencia. La energía cinética de los fotoelectrones puede medirse conectando a la célula fotoeléctrica una pila variable al revés: Al potencial que anula la corriente fotoeléctrica se le llama potencial de detención, Vo. Por tanto, teniendo en cuenta que el trabajo eléctrico es W=qV, podemos poner que : eVo = 1 mv 2 2 donde e es la carga del electrón y m es su masa. 4. Cuando la luz incide sobre el metal, los electrones son emitidos instantáneamente. Esto tampoco puede explicarse con la teoría electromagnética clásica, ya que si el electrón extrae energía de la onda, debería transcurrir un tiempo hasta que acumule la energía necesaria para escapar del metal. Explicación de Einstein al efecto fotoeléctrico: Planck creía que solo estaba cuantificado el intercambio de energía (absorción y emisión), pero que después la luz se comportaba como una onda. Einstein fue más atrevido, supuso que la energía electromagnética es sí misma era la que estaba cuantificada en pequeños paquetes de energía que llamó fotones. La energía de un fotón es: E = hν Vamos a ver como con la suposición de Einstein pueden explicarse todas las observaciones anteriores: Si llamamos trabajo de extracción o función trabajo (Eo) a la energía mínima que debe tener el fotón para arrancar un electrón del metal. Es evidente que el fotón debe tener una frecuencia mínima νo (la umbral) para arrancar al electrón: Eo = h νo Si la frecuencia de la luz es menor que la umbral no hay emisión: Si h ν < E o ⇒ No sale Si la frecuencia de la luz es justamente la umbral, entonces arranca al electrón, pero éste queda sin energía porque toda ella se ha invertido en arrancarlo: Si h ν = E o ⇒ Sale el electrón, pero queda sin energía Si la frecuencia de la luz es mayor que la umbral: Si h ν > E o ⇒ Sale el electrón y la energía que sobra de arrancarlo se invierte en energía cinética De esta forma Einstein escribió que: h ν = Eo + 1 mv 2 2 h ν = h νo + 1 mv 2 2 o lo que es igual: despejando la velocidad con que sale el electrón: v= 2 h (ν − ν o ) m Como puede verse la velocidad de los fotoelectrones, y por tanto su energía cinética, no depende de la intensidad de la luz. Solamente depende de la frecuencia y lo demás son constantes. Al aumentar la intensidad de la luz, lo que aumenta es el número de fotones y por tanto es mayor el número de electrones que salen del metal. Ello explica que aumente la intensidad de la corriente: Al aumentar la intensidad de la luz (el nº de fotones) aumenta es el número de electrones que salen del metal, y por tanto la intensidad de la corriente. Por último queda explicar la instantaneidad con que son emitidos los fotoelectrones, pero es fácil, ya que como se dice en la hipótesis, los fotones son paquetes de energía concentrada y no ondas que tienen su energía distribuida por todo el frente de onda. Einstein recibió el premio Nóbel, no por su teoría de la relatividad como cree mucha gente, sino por la interpretación del efecto fotoeléctrico que acabamos de ver. Ejemplo E4A.S2005 Al iluminar una superficie metálica con luz de frecuencia creciente empieza a emitir fotoelectrones cuando la frecuencia corresponde al color amarillo. a) Explique razonadamente qué se puede esperar cuando el mismo material se irradie con luz roja. ¿Y si se irradia con luz azul? b) Razone si cabría esperar un cambio en la intensidad de la corriente de fotoelectrones al variar la frecuencia de la luz, si se mantiene constante el número de fotones incidentes por unidad de tiempo y de superficie. a) Para que se produzca efecto fotoeléctrico los fotones de luz deben tener una frecuencia igual a la umbral o superior. Según se deduce del enunciado, para este material la frecuencia umbral corresponde al amarillo, por lo que al iluminar con luz roja, que tiene una frecuencia menor, no se producirá efecto fotoeléctrico, independientemente de la intensidad de la luz roja. Por el contrario, al iluminar con luz azul el metal emitirá electrones que saldrán con una energía cinética igual a la diferencia entre la energía del fotón de luz azul y la del fotón de luz amarilla (trabajo de extracción). b) Cada fotón arranca un electrón (siempre que tenga una frecuencia igual a la umbral o superior) por lo que si se mantiene el número de fotones la intensidad de la corriente será la misma. No obstante, si variamos la frecuencia lo que sí variará será la energía cinética de los electrones emitidos (siempre que la frecuencia sea igual a la umbral o superior). Ejemplo E5B.S2007: Un fotón incide sobre un metal cuyo trabajo de extracción es 2 eV. La energía cinética máxima de los electrones emitidos por ese metal es 0,47 eV. a) Explique las transformaciones energéticas que tienen lugar en el proceso de fotoemisión y calcule la energía del fotón incidente y la frecuencia umbral de efecto fotoeléctrico del metal. b) Razone cuál sería la velocidad de los electrones emitidos si la energía del fotón incidente fuera 2 eV. h = 6,6 ·10–34 J s ; e = 1,6 ·10–19 C a) La energía del fotón incidente (hν) se invierte en extraer el electrón del metal y la restante en comunicarle energía cinética, por tanto: h ν = Eo + 1 mv 2 = 2 + 0,47 = 2,47eV 2 en julios: h ν = 2,47 ⋅ 1,6 ⋅ 10 −19 = 3,95 ⋅ 10 −19 J La frecuencia del fotón incidente, despejando será: ν= 3,95 ⋅ 10 −19 J = 5,98 ⋅ 1014 Hz 6,6 ⋅ 10 −34 J.s La frecuencia umbral es la que corresponde a un fotón de energía igual al trabajo de extracción: 2 *1,6 ⋅ 10 −19 J νo = = 4,86 ⋅ 1014 Hz −34 6,6 ⋅ 10 J.s b) Es evidente, según hemos dicho antes, que si la energía del fotón incidente es igual al trabajo de extracción la energía cinética sería cero, y por tanto la velocidad de los electrones nula. Ejemplo E3A.S2007: Sobre una superficie de sodio metálico inciden simultáneamente dos radiaciones monocromáticas de longitudes de onda λ1 = 500 nm y λ2 = 560 nm. El trabajo de extracción del sodio es 2,3 eV. a) Determine la frecuencia umbral de efecto fotoeléctrico y razone si habría emisión fotoeléctrica para las dos radiaciones indicadas. b) Explique las transformaciones energéticas en el proceso de fotoemisión y calcule la velocidad máxima de los electrones emitidos. c = 3 ·108 m s–1 ; h = 6,6 ·10–34 J s ; e = 1,6 ·10–19 C ; me = 9,1·10–31 kg a) En primer lugar debemos calcular la energía de los dos fotones. Si su energía es mayor o igual al trabajo de extracción habrá emisión, y en caso contrario no porque no llegarían al umbral. (recuerda que 1nm=10–9m) E 1 = hν 1 = h c 3 ⋅ 10 8 = 6,6 ⋅ 10 −34 = 3,96 ⋅ 10 −19 J −9 λ1 500 ⋅ 10 E 2 = hν 2 = h c 3 ⋅ 10 8 = 6,6 ⋅ 10 −34 = 3,54 ⋅ 10 −19 J λ2 560 ⋅ 10 −9 El trabajo de extracción en julios es E o = 2,3eV = 2,3 ⋅ 1,61019 = 3,68 ⋅ 10 −19 J Como podemos ver, solamente el primer fotón tiene energía suficiente para arrancar un electrón del metal, el segundo no producirá efecto fotoeléctrico independientemente de la intensidad que tenga la luz. La frecuencia umbral es la frecuencia mínima que debe tener un fotón para arrancar un electrón y por tanto es la energía de un fotón que coincide con el trabajo de extracción: Eo = h νo ⇒ E o 3,68 ⋅ 10 −19 νo = = = 5,58 ⋅ 1014 Hz − 34 h 6,6 ⋅ 10 A la misma conclusión habríamos llegado si calculamos la frecuencia de cada fotón ( ν = v / λ ) y la comparamos con el valor de la umbral. b) La energía del fotón (3,96.10–19J) se transmite al electrón. Parte de ella se emplea en arrancarlo del metal (3,68.10–19J) y la restante se emplea en comunicarle energía cinética. 1 h ν = E o + mv 2 2 1 3,96 ⋅ 10 −19 = 3,68 ⋅ 10 −19 + 9,1 ⋅ 10 −31 v 2 2 v = 2,48 ⋅ 10 5 m / s EFECTO COMPTON Explicación del fenómeno: Compton hizo incidir un haz de rayos X duros, de frecuencia ν, sobre un bloque de grafito y observó que: • • Los rayos X dispersados tenían una frecuencia ν´ menor (o lo que es igual que tenían una longitud de onda mayor que los rayos incidentes) El incremento que sufre la longitud de onda del fotón es función del ángulo de rechazo: ∆λ = f ( φ ) Este fenómeno es inexplicable mediante la física clásica, porque según ella, al incidir los rayos X de frecuencia ν sobre el grafito, sus átomos se verían obligados a vibrar con esa frecuencia y por tanto radiarían OEM también de la misma frecuencia ν. Explicación de Compton: Compton explicó este fenómeno haciendo uso de las ideas de Einstein sobre el fotón. Pensó que el fotón incidente chocaba con un electrón libre del grafito, de la misma manera que lo hacen dos bolas de billar, pero en este caso que no cede toda su energía al electrón (como sucede en el efecto fotoeléctrico) solamente cede una parte y por eso se convierte en otro fotón de menor frecuencia ν´<ν (o de mayor longitud de onda). El efecto Compton es el apoyo más evidente al comportamiento corpuscular de la luz. El tratamiento al problema es el mismo que el de un choque elástico entre dos bolas de billar, es decir que antes y después del choque se conserva la energía y, por supuesto, el momento lineal. A partir de estas consideraciones puede demostrarse que el incremento de la longitud de onda del fotón dispersado es: ∆λ = h (1 − cos φ) mec a la constante h/mec se le llama longitud de onda Compton = 2,4.10–12 m pudiéndose escribir también como: ∆λ = λ c (1 − cos φ) Como puede verse, el corrimiento Compton ( ∆λ = λ´−λ ) solo es función del ángulo de rechazo del fotón. Si φ=0 entonces ∆λ = 0 , es decir que λ´= λ y no hay efecto Compton. Es muy importante recalcar que mientras en el efecto fotoeléctrico desaparece el fotón, porque cede toda su energía al electrón, en el efecto Compton el fotón solo cede una parte de su energía al electrón, con lo que no desaparece, sino que se convierte en otro fotón de menor energía. Compton recibió el Nóbel por sus estudios e interpretación de éste fenómeno. Ejemplo: Cuando un fotón de rayos X duros, de longitud de onda 3.10–11 m incide sobre un electrón en reposo sale disparado formando un ángulo de 60º. Calcular: a) La longitud de onda del fotón dispersado b) La energía cinética del electrón sobre el que chocó el fotón. Datos: Long.de onda Compton = 2,4.10–12 m ; h = 6,62.10–34J.s ; e = 1,6–10–19 C ∆λ = λ´−λ = h (1 − cos φ) mec sustituyendo: ∆λ = 2,4 ⋅ 10 −12 (1 − cos 60) = 1,2 ⋅ 10 −12 m de donde: λ´= ∆λ − λ = 1,2 ⋅ 10 −12 − 3 ⋅ 10 −11 = 3,12 ⋅ 10 −11 m b) Puesto que se trata de un choque elástico y en consecuencia se conserva la energía, la energía del fotón incidente debe ser igual a la del fotón dispersado más la energía cinética que adquiere el electrón, por tanto: hν = hν´+ Ec electr por tanto: h c c = h + Ec electr λ λ´ 1 1 1 1 Ec electr = hc − = 6,62 ⋅ 10 −34 3 ⋅ 10 8 − = 2,55 ⋅ 10 −16 J = 1591eV 11 −11 λ λ ´ 3 ⋅ 10 3 , 12 ⋅ 10 ESPECTROS DISCONTINUOS. NIVELES DE ENERGÍA EN LOS ÁTOMOS Ya sabemos que cuando la luz blanca se hace pasar a través de un prisma se descompone dando lugar a un espectro que contiene la totalidad de los colores desde el rojo al violeta, por lo que se llama espectro continuo, mientras que si solo hay unos pocos se llama espectro discontinuo. Un espectro de emisión es el espectro de la luz que emite un cuerpo, mientras que si hacemos pasar la luz blanca a través del cuerpo y analizamos la luz que deja pasar, el espectro se llama de absorción. Ambos son complementarios, quiere decir que los colores que le faltan a uno son justamente los que tiene el otro. En un espectro atómico: • • • El conjunto de líneas espectrales que se obtiene para un elemento concreto es siempre el mismo, incluso si el elemento forma parte de un compuesto complejo, es decir que cada elemento produce su propio espectro diferente al de cualquier otro elemento, y por lo tanto el espectro de un elemento es como si fuera su huella digital, por eso inicialmente los químicos alemanes Kirchoff y Bunsen comenzaron a emplearlos como medio de análisis. Los espectros contienen rayas agrupadas en series espectrales que van desde el IR hasta el UV Cada serie está formada por infinitas rayas cada vez mas juntas hasta llegar al límite de la serie. Si se descompone al luz emitida por un tubo de descarga lleno de hidrógeno, se obtiene su correspondiente espectro, en el que se pueden distinguir sus series espectrales. Una de ellas, la serie Balmer, cae dentro del visible, otra en el UV y el resto están en el IR. El sueco Rydberg encontró empíricamente la relación que existía entre la longitud de onda de cada raya en cada una de las series: 1 1 1 = R H 2 − 2 λ ni nf • • • • RH es la constante de Rydberg = 1,09.107 m–1 ni y nf son números enteros. n1 determina la serie. Haciendo n1=1 se obtiene la serie Lyman, haciendo n1=2 se obtiene la serie Balmer, con n1=3 la serie Paschen, etc Limitando el valor de n1 para una serie concreta, el conjunto de rayas espectrales se obtiene dándole a n2 valores enteros consecutivos al valor de n1, es decir n2 = n1+1, n1+2, n1+3, .... Serie Lyman Balmer Paschen Bracket Pfund ni 1 2 3 4 5 nj 2, 3, 4, ... 3, 4, 5, ... 4, 5, 6, … 5, 6, 7, … 6, 7, 8, … Región del esp. UV Visible IR IR IR El modelo atómico de Rutherford era incapaz de explicar los espectros discontinuos de los átomos porque según éste el electrón puede girar en cualquier órbita (cualquier valor del radio es bueno) y por tanto el espectro debería ser continuo, y además porque al tratarse de una carga acelerada debería radiar OEM de la misma frecuencia que la frecuencia de revolución con lo que terminaría cayendo sobre el núcleo. La deducción teórica de la ecuación de Rydberg vino de mano de Bhor, que propuso un modelo atómico basado en el de Rutherford, pero en el que el electrón solo puede girar en unas órbitas estacionarias, donde no emite energía, y que son aquellas en las que el momento angular del electrón es un múltiplo entero de h/2π. l = r mv = n h 2π donde n es un número entero que toma valores 1, 2, 3 ... e indica la órbita y se llama número cuántico principal. Las transiciones electrónicas se producen absorbiendo y luego emitiendo un fotón de energía igual a la diferencia de energía entre los niveles y dan lugar a los espectros discontinuos. En la figura se muestra como un fotón excita al electrón, que inicialmente se encuentra en el nivel mas bajo de energía, y lo manda hasta el nivel 4. Posteriormente vuelve a su estado fundamental emitiendo un fotón correspondiente a la serie Balmer y otro a la serie Lyman. La energía de los fotones es igual a la diferencia de energía entre los niveles entre los que salta: 1 c 1 ∆E = E 2 − E1 = hν = h = hcR H 2 − 2 λ ni nf R´= h c R H = 2,16 ⋅ 10 −18 J Por ejemplo, el salto que se muestra en la figura, correspondiente a la segunda raya de la serie Balmer, corresponde a un fotón de: 1 1 ∆E = E 4 − E 2 = 2,16 ⋅ 10 −18 2 − 2 = 4,06 ⋅ 10 −19 J = 2,54eV 4 2 E = hν ⇒ ν= E 4,06 ⋅ 10 −19 = = 6,13 ⋅ 1014 Hz (azul) − 34 h 6,62 ⋅ 10 Ejemplo práctico: Si observamos la luz emitida por un tubo de descarga de hidrógeno con la ayuda de un espectroscopio podremos ver varias rayas de colores (la serie Balmer). Leyendo sobre la escala del espectroscopio puedes ver que la raya de color rojo corresponde a una luz con una longitud de onda de aproximadamente 660 nm y que la raya de color azul corresponde a una luz de longitud de onda aproximadamente 490 nm. Para cada una de esas dos rayas vamos a calcular la energía del fotón correspondiente, o lo que es igual, la diferencia de energía entre los dos niveles atómicos entre los que ha saltado el electrón. Los datos que vamos a necesitar son la constante de Planck, la carga del electrón (para pasar de Julios a eV) y la velocidad de la luz (para poder calcular la frecuencia, ya que c = λ ⋅ ν ) E Rojo = h ⋅ ν Rojo = h E Azul = h ⋅ ν Azul = h c λ Rojo c λ Azulo = 6,62 ⋅ 10 −34 3 ⋅ 10 8 = 3,01 ⋅ 10 −19 J = 1,88 eV −9 660 ⋅ 10 = 6,62 ⋅ 10 −34 3 ⋅ 10 8 = 4,05 ⋅ 10 −19 J = 2,53 eV −9 490 ⋅ 10 Lógicamente la raya azul al tener menor longitud de onda (o mayor frecuencia) corresponde a un fotón de mayor energía, o lo que es igual, a un salto más grande, es decir, desde un nivel más exterior. Como verás, los valores que hemos calculado experimentalmente coinciden bastante bien con los que pueden obtenerse a partir de la gráfica de energía del átomo de hidrógeno. Corresponden a los saltos desde el nivel 3 al nivel 2 (raya roja): ∆E = E 3 − E 2 = −1,5 − −3,4 = 1,9 eV y desde el nivel 4 al nivel 2 (raya azul) ∆E = E 4 − E 2 = −0,9 − −3,4 = 2,5 eV DEDUCCIÓN DE LA ECUACIÓN DE RYDBERG De acuerdo con la idea de Rutherford, el átomo de hidrógeno está formado por un protón en el núcleo y un electrón girando a su alrededor a una distancia r, de tal manera que la fuerza de atracción eléctrica se compense con la fuerza centrífuga (SR Inercial) Felectr = Fcentrif ⇒ K e2 v2 = m r r2 de donde se puede despejar el radio de la órbita o bien la velocidad con la que debe girar para mantenerse: v= r= Ke 2 mr Ke 2 mv 2 Como vemos, en el modelo de Rutherford cualquier radio es aceptable con tal que de gire con la velocidad adecuada (el resto de las magnitudes son constantes), con lo que los espectros atómicos deberían ser continuos. La energía del electrón en la órbita, que será la suma de la cinética más la potencial (la Ep es negativa porque las cargas del electrón y del protón tienen distinto signo: q=e y q´=–e) 1 e2 2 E = Ec + Ep = mv − K 2 r sustituyendo v: 2 1 Ke 2 e 2 Ke 2 Ke 2 Ke 2 E = m −K = − =− 2 mr r 2r r 2r La energía del electrón es función del radio de la órbita y aumenta con la distancia hasta hacerse cero en el infinito (ten en cuanta que es negativa). Hasta aquí el razonamiento de Rutherford. Ahora Bhor en su modelo para explicar los saltos electrónicos introduce la idea de que cualquier órbita no es buena, solo aquellas en las que el momento angular del electrón es múltiplo entero de h/2π. l = rmv = n h 2π Por tanto las órbitas buenas son: r=n h 2π mv si elevamos al cuadrado y sustituimos la expresión encontrada para la velocidad: r2 = n2 h2 h 2 ⋅ mr 2 = n 4π 2 m 2 ⋅ v 2 4π 2 m 2 ⋅ Ke 2 simplificando: h2 r=n 4π 2 mKe 2 2 Por tanto la energía del electrón en cualquiera de esas órbitas será: E=− Ke 2 Ke 2 ⋅ 4π 2 mKe 2 K 2 e 4 ⋅ 2π 2 m =− = − 2r 2 ⋅ n 2h 2 n 2h 2 Como vemos, salvo n el resto todo son constantes: K=9.109Nm2/C2 ; e=1,6.10–19C ; m=9,1.10–31Kg y h=6,62.10–34 J.s de manera que si operamos nos quedaría que: E = −2,16 ⋅ 10 −18 1 1 = −R´ 2 2 n n Teniendo en cuenta que la energía del fotón corresponde a la diferencia de energía entre dos niveles dados: 1 1 1 1 ∆E = E f − E i = − R´ 2 − − R´ 2 = R´ 2 − 2 nf ni ni nf Si tenemos en cuenta que esa energía es la que se emite en forma de OEM y es la energía del fotón de frecuencia ν y de longitud de onda λ ∆E = E f − E i = hν = h c λ ⇒ 1 1 ∆E R´ 1 1 1 = = 2 − 2 = R H 2 − 2 λ hc hc n i n f ni nf que es la ecuación que Rydberg encontró de forma empírica. Como vemos la constante de Rydberg se obtiene como: K 2 e 4 ⋅ 2π 2 m RH = h 3c HIPÓTESIS DE De BROGLIE Durante el primer cuarto del siglo XX la física tenía un dilema sobre la naturaleza de la luz entre ondulatoria y corpuscular. Por una lado la radiación del cuerpo negro, el efecto fotoeléctrico, el efecto Compton y la interpretación de los espectros atómicos apuntaban hacia la naturaleza “cuántica” de la luz, mientras que los fenómenos de interferencias, difracción y polarización evidenciaban su naturaleza ondulatoria. En 1924, Luis De Broglie en su tesis doctoral hizo el siguiente razonamiento: • Si la luz está formada por corpúsculos, éstos se podrán caracterizar por su momento lineal como cualquier partícula: p=mc con lo que la ecuación de Einstein se podrá escribir como: E = mc 2 = pc • Si la luz es una onda se podrá caracterizar por su longitud de onda: E = hν = h • c λ Igualando ambas expresiones se deduce la relación entre la longitud de onda y el momento lineal de los fotones asociados a ella: λ= h p o bien que λ= h mv De Broglie hizo extensiva su hipótesis a todas las partículas en general, y en particular a los electrones diciendo: “A todo corpúsculo en movimiento se le puede asociar una onda, cuya longitud de onda es inversamente proporcional a su momento lineal” La hipótesis de De Broglie no tenía ningún apoyo experimental y por tanto debía confirmarse, es decir habría que conseguir fenómenos de difracción con electrones, lo que probaría que las partículas llevan asociada una onda. Davisson y Germer, y poco después Thonson (hijo), consiguieron realizar experimentos de difracción con electrones haciendo incidir un haz de electrones sobre una superficie muy fina de níquel, obteniendo una figura de difracción similar a la que se obtiene por difracción de rayos X y a partir de la que podía calcularse la longitud de onda asociada a los electrones y que coincidía con la prevista por De Broglie. Si dejamos caer un puñado de harina a través de una criba veremos como la mayoría de las partículas siguen una trayectoria recta y solo las que choquen con los alambres se desvían. El resultado sería un montón: sin embargo cuando hacemos lo mismo con una onda el resultado como sabemos es diferente, porque se obtiene una figura de difracción. Y eso mismo ocurre cuando se lanza un haz de electrones contra una criba apropiada como es un cristal (la distancia entre átomos es comparable a la longitud de onda), que hay lugares donde la intensidad es máxima y otros donde es nula, dependiendo de que las ondas interfieran constructivamente o no, es decir de que la diferencia de camino sea múltiplo entero de λ o de λ/2. Como es natural, en la curva de distribución de intensidad no hay electrones amontonados y la curva debe interpretarse como la probabilidad de la presencia de ellos. La difracción a través de un cristal, como hemos visto, es la difracción de Laue, pero también se puede obtener difracción por planos (difracción de Bragg) ya que los planos del cristal reflejan los electrones como un espejo refleja la luz: De Broglie, mediante su hipótesis pudo demostrar lo que hasta entonces nadie había podido: El porqué las órbitas del modelo atómico de Bhor estaban cuantificadas, es decir que solo eran posibles aquellas en las que el momento angular del electrón es un múltiplo entero de h / 2π h l = rmv = n n=1, 2, 3, .... 2π De Broglie dijo que si el electrón lleva asociada una onda, solo podrá girar en aquellas órbitas para las cuales la onda sea estacionaria, lo que solamente puede ocurrir cuando la longitud de la circunferencia sea un múltiplo entero de λ, porque en caso contrario la onda se autodestruiría por sucesivas interferencias: 2 π r = nλ Sustituyendo λ por el valor de De Broglie 2π r = n h mv ⇒ rmv = n h 2π Una aplicación práctica de la dualidad onda–corpúculo es el microscopio electrónico ideado por Müller. La limitación de un microscopio está en que no pueden resolverse imágenes mas pequeñas que la longitud de onda de la luz que emplea. Cuando empleamos luz del visible puede resolver hasta los 300 o 350 nm, así que no es posible ver algo que mida menos de eso. Los rayos X en principio podrían ser una solución, porque tienen longitudes de onda entre 10 y 0,01nm, pero no valen porque son muy difíciles de enfocar y dan lugar a imágenes muy borrosas. Los electrones sin embargo cuando se aceleran mediante un campo eléctrico pueden llegar a tener longitud de onda muy pequeñas, de hasta 0,001nm, (recuerda que de acuerdo con la expresión de De Broglie la longitud de onda es inversamente proporcional a la velocidad de los electrones λ = h / mv ) y los electrones son fáciles de enfocar utilizando campos eléctricos y magnéticos, como se hace en los tubos de TV. Ejemplo E4B.S2007 / E4B.S2008: Razone si la longitud de onda de De Broglie de los protones es mayor o menor que la de los electrones en los siguientes casos: a) ambos tienen la misma velocidad. b) ambos tienen el mismo momento lineal? c) ambos tienen la misma energía cinética. a) Como sabemos la masa del protón es mucho mayor que la masa del electrón (algo más de 1800 veces mayor), por tanto si el protón y el electrón tienen la misma velocidad la longitud de onda del protón será menor: λp = h mp v λp λe λe = = h / mpv h / mev ⇒ λp = λe me mp ⇒ λp < λe h mev b) Si el protón y el electrón tienen el mismo momento lineal, ambos tendrán también la misma longitud de onda asociada, ya que λ = h / p . Evidentemente, en este caso, como p = m p v p = m e v e para que ambas partículas tengan el mismo momento lineal deben tener distinta velocidad, porque tienen distinta masa. c) Este ejercicio es básicamente como los anteriores Ec = 12 mv 2 ⇒ 2mEc = (mv) 2 ⇒ mv = 2mEc λp = h mpvp λp λe λe = = h / 2m p Ec h / 2m e Ec = me mp ⇒ λp = λe me mp ⇒ λp < λe h me vp Ejemplo E2B.S2007: Un haz de electrones se acelera con una diferencia de potencial de 30 kV. a) Determine la longitud de onda asociada a los electrones. b) Se utiliza la misma diferencia de potencial para acelerar electrones y protones. Razone si la longitud de onda asociada a los electrones es mayor, menor o igual a la de los protones. ¿Y si los electrones y los protones tuvieran la misma velocidad? h = 6,6 ·10–34 J s ; e = 1,6 ·10–19 C ; me = 9,1·10–31 kg a) El trabajo eléctrico que hace la fuente sobre el electrón es igual a la carga del electrón por la d.d.p. y teniendo en cuenta el teorema de las fuerzas vivas, será igual a la variación de energía cinética: Welectrico = q ⋅ V = ∆Ec 1,6 ⋅ 10 −19 30000 = 1 9,1 ⋅ 10 −31 v 2 2 ⇒ v = 1,03 ⋅ 10 8 m / s y de acuerdo con De Broglie: λ= h 6,6 ⋅ 10 −34 = = 2,07 ⋅ 10 −11 m −31 8 mv 9,1 ⋅10 ⋅ 1,03 ⋅ 10 b) Puesto que los electrones y los protones tienen la misma carga en valor absoluto, ambas partículas tendrán la misma energía cinética cuando se aceleren mediante la misma ddp (aunque no la misma velocidad porque tienen distinta masa), y en tal caso, como hemos razonado en el ejercicio anterior la longitud de onda de los protones será menor. También hemos razonado que si ambas partículas tienen la misma velocidad los protones tendrán también menor longitud de onda. Un microscopio electrónico utiliza un haz de electrones acelerados por un campo eléctrico entre dos puntos entre los que existe con una diferencia de potencial de 10.000 V. a) Calcular la longitud de onda asociada a dichos electrones. b) Si el poder de resolución de un microscopio (capacidad para distinguir dos puntos separados por una determinada distancia) es inversamente proporcional a la longitud de onda empleada, calcular cuantas veces aumenta aumentará la resolución de un microscopio electrónico frente al ordinario, que utiliza luz de 555 nm. Datos: h = 6,67.10−34 J.s ; me = 9,1.10−31 Kg; e = 1,6.10−19 C. a) Teniendo en cuenta que el campo eléctrico es un campo conservativo, y que por tanto se conserva la energía mecánica, podemos poner que ∆Ep + ∆Ec = 0 Por otro lado, teniendo en cuenta que por definición, el trabajo que hace el campo para llevar un cuerpo (en este caso una carga) de un punto a otro es igual a menos la variación de energía potencial entre esos puntos: WA →B,campo = − ∆Ep = −q´∆V , finalmente nos queda que: q´∆V + ∆Ec = 0 1 sustituyendo: − 1,6 ⋅ 10 −19 * 10 4 + 9,1 ⋅ 10 −31 v 2B − 0 = 0 2 de donde tenemos que la velocidad final de los electrones es vB = 5,93.107 m/s La longitud de onda de De Broglie asociada a una partícula viene dada por: λe = h 6,67 ⋅ 10 −34 = = 1,24 ⋅ 10 −11 m − 31 7 m e v 9,1 ⋅ 10 * 5,93 ⋅ 10 b) Si el poder de resolución (PR) es inversamente proporcional a la longitud de onda empleada podemos poner que PR=k/λ, donde k sería la constante de proporcionalidad, por tanto aplicando la ecuación al microscopio electrónico y el óptico y dividiendo miembro a miembro tenemos que: λ m.optico PR m.electronico 555 ⋅ 10 −9 = = = 44758 PR m.optico λ m.electronico 1,24 ⋅ 10 −11 Quiere decir que el microscopio electrónico tiene un poder de resolución casi de 45.000 veces superior que el microscopio óptico ordinario. PRINCIPIO DE INCERTIDUMBRE DE HEISENBERG Como es de suponer, es imposible realizar una medida sin interaccionar de alguna manera con el sistema a medir, por ejemplo si para medir la temperatura de un líquido introducimos un termómetro en él, éste intercambiará calor con el líquido que manera que cuando alcance el equilibrio no nos dará la temperatura a la que realmente estaba el líquido. Pero claro el termómetro es muy pequeño y el error que introduce en la medida es insignificante. En el mundo microscópico, sin embargo, los errores son más importantes. Supongamos que existiera un supermicroscopio con el que fuera posible ver el átomo de hidrógeno. Como el poder de resolución del microscopio depende de la longitud de onda empleada y es mas o menos igual a ella, resulta que tendríamos que iluminar al átomo con una luz de o o aproximadamente λ = 1 A = 10 −10 m . Pero claro, un fotón de 1 A tiene una energía: E = hν = h c 3 ⋅ 10 8 = 6,6 ⋅ 10 −34 −10 = 1,98 ⋅ 10 −15 J = 12375 eV λ 10 Si tenemos en cuenta que el potencial de ionización (energía necesaria para arrancarle un electrón a un átomo) del átomo de hidrógeno es solo de 13,6 eV comprenderemos que la interacción con el átomo sería tan grande que de ninguna manera podríamos verlo como es en estado normal. El principio de incertidumbre formulado por Wrener Heisenberg dice que “es imposible conocer con exactitud y a la vez la posición y el momento lineal de una partícula. Cuanto mayor sea la sea la precisión con que conocemos su posición, mayor será el error con que podemos conocer su momento lineal y viceversa, de forma que el producto de las incertidumbres siempre será mayor o igual que h/2π.” ∆x ⋅ ∆p ≥ h 2π Esta incertidumbre nada tiene que ver con los instrumentos de medida, sino que es intrínseca del hecho de medir. Einstein extendió el principio de incertidumbre de Heisenberg a todas las parejas de magnitudes conjugadas, es decir que tuvieran las mismas dimensiones que la posición por el momento, es decir: ML2T–1, como ocurre con la energía y el tiempo, así que también puede escribirse como: h ∆E ⋅ ∆t ≥ 2π Ejemplo: a) Calcular la longitud de onda asociada a un electrón que se mueve de una placa a otra de un condensador entre las que existe una ddp de 100 V b) Calcular la longitud de onda asociada a una pelota de tenis de 100 g que se mueve con una velocidad de 100 m/s. Compara los resultados obtenidos. c) Si la velocidad del electrón y de la pelota estuvieran medidas con un error del 1% ¿Cuál es el error con que podría determinarse la posición del electrón y de la pelota?. Compara los resultados. a) La velocidad del electrón se calcula teniendo en cuenta que: Welectrico = q ⋅ V = ∆Ec 1 1,6 ⋅10 −19100 = 9,1 ⋅10 −31 v 2 2 y la longitud de onda asociada: λ= ⇒ v = 6 ⋅10 6 m / s o h 6,62 ⋅ 10 −34 = = 1,22 ⋅ 10 −10 m = 1,22 A − 31 6 mv 9,1 ⋅ 10 ⋅ 6 ⋅ 10 b) En el caso de la pelota, la longitud de onda asociada sería: o h 6,62 ⋅ 10 −34 λ= = = 6,62 ⋅ 10 −35 m = 6,62 ⋅ 10 − 25 A mv 0,1 ⋅ 100 Como puede verse, la longitud de onda del electrón es comparable a la de los rayos X y es del orden de las distancias interatómicas de los átomos en un cristal y por tanto es apropiada para producir fenómenos de difracción y poner de manifiesto las propiedades ondulatorias de la onda asociada al electrón. Sin embargo, la longitud de onda asociada a la pelota de tenis es tan extremadamente pequeña que en la naturaleza no existe nada comparable y por tanto, en la práctica, resulta imposible poner de manifiesto la onda asociada a la pelota. c) Supongamos ahora que las velocidades anteriores se han obtenido con un error del 1%. En el caso del electrón el error cometido habría sido de: ∆v = 6 ⋅ 10 6 ⋅ 0,01 = 6 ⋅ 10 4 m / s Así que el error con que habríamos medido el momento lineal sería: ∆p = m∆v = 9,1 ⋅ 10 −31 ⋅ 6 ⋅ 10 4 = 5,46 ⋅ 10 −26 Kg ⋅ m / s así que: h h 6,62 ⋅ 10 −34 ⇒ ∆x ≥ = = 1,9 ⋅ 10 −9 m − 26 2π ⋅ ∆p 2π ⋅ 5,46 ⋅ 10 2π En el caso de la pelota: ∆v = 100 ⋅ 0,01 = 1m / s ∆x ⋅ ∆p ≥ ∆p = m∆v = 0,1 ⋅ 1 = 0,1Kg ⋅ m / s h ∆x ⋅ ∆p ≥ 2π ⇒ h 6,62 ⋅ 10 −34 ∆x ≥ = = 10 −33 m 2π ⋅ ∆p 2π ⋅ 0,1 Como vemos, en el caso del electrón la incertidumbre es del orden de las distancias interatómicas, y por lo tanto es importante, pero en el caso de la pelota es absolutamente despreciable porque no es ni siquiera del tamaño de un núcleo, es decir que a efectos prácticos podríamos decir que sí podríamos determinar con precisión la posición de la pelota. En otras palabras, podemos decir que dada la pequeñez de la constante de Planck, la incertidumbre en nuestro mundo macroscópico es despreciable, pero no ocurre así en el mundo microscópico. DETERMINISMO Y PROBABILIDAD Como consecuencia del principio de incertidumbre de Heisenberg no podemos situar al electrón en órbitas sencillas y bien definidas y además conocer su velocidad como puede hacerse en el modelo de Bhor, que nos permite calcular el radio (posición) y la velocidad (momento). Schrodinger elaboró su mecánica cuántica ondulatoria partiendo de las ideas de De Broglie y suponiendo que los estados estacionarios de los átomos corresponden a ondas de materia estacionarias, a las que llamó función de onda ψ, que es una función de la posición y del tiempo. El significado de la función de onda ψ es probabilístico y nos da la probabilidad de encontrar al electrón en un elemento de volumen dV: P = ∫ Ψ 2 dV V Los valores de probabilidad oscilan entre 0 y 1. Es importante recalcar que ψ2 nos da una medida de la probabilidad de encontrar al electrón en un volumen dado, es decir, no donde está, sino donde es probable que esté, y por tanto no contradice el principio de incertidumbre. Supongamos el caso sencillo de una cuerda que está vibrando entre dos puntos. Como es natural, esos dos puntos entre los que vibra serán nodos y además solo podrá vibrar con unos determinados valores de λ, es decir que la longitud de onda está cuantizada ya que solo puede tomar valores para los que la longitud de la cuerda sea siempre un múltiplo entero de λ/2 λ L=n 2 Por ejemplo, dos modos posibles de vibración de la cuerda serían: En el caso de una partícula encerrada entre esas paredes, la ecuación de esas ondas es la que se representa por ψ, y la probabilidad de encontrar a la partícula entre esas paredes viene dada por ψ2: Como puedes ver, para n=1 es más probable que la partícula se encuentre en el centro, sin embargo una interpretación clásica daría la misma probabilidad en cualquier lugar. Aplicando estos mismo conceptos al átomo se obtienen unas regiones de máxima probabilidad de encontrar al electrón que se llaman orbitales. EL NÚCLEO ATÓMICO. CONCEPTOS PREVIOS 1. El núcleo atómico está formado por protones y neutrones. A ambos se les llama indistintamente con el nombre de nucleones y tienen las siguientes características: protón 1,007597 Masa referida al e− 1836 neutrón 1,008982 1838 Masa (uma) +1,6.10−19 Carga referida a e− +1 0 0 Carga (C) Símbolo 1 1 1 0 p n Hoy día sabemos que de las tres partículas elementales que inicialmente se pensaba que formaban los átomos, solamente lo es el electrón. Los protones y neutrones a su vez están formados de otras partículas elementales llamadas quarks. La Unidad de Masa Atómica (uma) se define como la doceava parte de la masa del isótopo 12 del carbono: Para hallar el equivalente de la uma y el Kg recordemos que 1 mol de carbono 12 tiene una masa de 12 gramos y contienen un número de Avogadro de átomos, es decir que: 1 mol de át.de C12 −−− tiene una masa de 12 gr −−−− contiene 6,023.1023 át.de C12 por tanto, la masa de 1 solo átomo de carbono será: C12 = 0,012 = 1,99 ⋅ 10 − 26 Kg 6,023 ⋅ 10 23 y la uma, que es la doceava parte del C12 sería: 1 uma = C12 = 1,66 ⋅ 10 −27 Kg 12 Número atómico (Z): Es el número de protones de un núcleo y es el que nos define al elemento químico. (Un átomo en estado normal tiene igual número de protones y electrones. Si pierde o gana electrones se convierte en un ión positivo o negativo del mismo elemento, pero si perdiera o ganada un protón se transformaría en otro elemento distinto, el anterior o posterior en la tabla periódica.) Número másico (A): Es el número de protones y neutrones, es decir el número de nucleones. De acuerdo con esto, es evidente que el número de neutrones de un núcleo será: N = Z−A Lo núcleos se representan con el símbolo del elemento y un número en la parte inferior que indica el número atómico (que es informativo, porque realmente es redundante) y otro número en la parte superior que indica su masa: A Z A X X AZ ZX Isótopos: Son aquellos núcleos que tienen el mismo número de protones, y por tanto definen al mismo elemento, pero difieren en el número de neutrones y por tanto tienen distinta masa. Tienen igual Z y distinto A. El hidrógeno tiene tres isótopos: Es importante recordar que las propiedades químicas de los elementos vienen determinadas por la disposición de los electrones de la última capa, así pues todos los isótopos de un elemento se comportan químicamente igual y en este aspecto son indistinguibles. Sin embargo tienen distintas propiedades físicas, empezando porque tienen distinta masa y porque no todos tienen la misma estabilidad. 2. Carga. En el núcleo se encuentra concentrada toda la carga positiva del átomo, debida a los protones. 3. Masa. Es evidente que en el núcleo está concentrada casi la totalidad de la masa del átomo, puesto que la masa de los electrones es muy pequeña. El 99,9% de la masa del átomo corresponde al núcleo. 4. Dimensiones. Se puede considerar al núcleo como una espera de radio del orden de 10−15 metros. 10−15 m = 1 Fermi (fm) Experimentalmente se ha deducido que el radio del núcleo de un átomo es proporcional a su masa A, de acuerdo con la siguiente expresión: R = Ro3 A donde Ro es una constante cuyo valor es 1,2.10−15 m. No confundas el volumen del núcleo (que crece proporcionalmente al número de masa), con el volumen del átomo, que no sigue esa proporción, porque influyen los electrones. 5. Densidad. La densidad nuclear es muy elevada y es independiente del número másico. Si suponemos el núcleo como una esfera y teniendo en cuenta que: • La masa de un átomo cualquiera es m=A umas, en Kg sería: m = A ⋅ 1,66 ⋅ 10 −27 Kg • El volumen: V= • 4 4 πR 3 = π ⋅ R 3o A = 7,24 ⋅ 10 − 45 A m3 3 3 La densidad sería: m A ⋅ 1,66 ⋅ 10 −27 ρ= = = 2,29 ⋅ 1017 Kg / m 3 − 45 V 7,24 ⋅ 10 A Hay que fijarse en lo grande que es la densidad nuclear. Para que te hagas una idea, imagina que la cabeza de un alfiler de 1mm de diámetro estuviera formada de material nuclear, entonces: 4 m = Vρ = π(0,5 ⋅ 10 −3 ) 3 ⋅ 2,29 ⋅ 1017 = 1,2 ⋅ 10 8 Kg 3 Lo que quiere decir que la cabeza del alfiler tendría una masa de 120 millones de Kg. Una densidad tan elevada nos indica además que los nucleones se encuentran muy compactos y que, por el contrario, la materia macroscópica está prácticamente vacía. FUERZAS NUCLEARES Los protones del núcleo ejercen mutuamente entre sí fuerzas de repulsión electrostática, sin embargo, los núcleos atómicos son entidades muy estables. De ello se deduce que en la escala nuclear deben existir otro tipo de fuerzas que mantengan la cohesión del núcleo y que son de naturaleza diferente a las gravitatorias y a las electromagnéticas conocidas en el mundo macroscópico. Estas fuerzas, responsables de que se mantengan unidos los nucleones, se denominaron fuerzas nucleares fuertes o de corto alcance. Tienen las siguientes características: 1. Son de muy corto alcance. Quiere decir que solo se manifiestan a distancias muy pequeñas, del orden de 1 fm (1Fermi=10−15m) • • Al aumentar la distancia disminuyen muy rápidamente. A una distancia de 2fm ya se hacen 10 veces más pequeñas. A distancias menores de 1fm de repente se vuelven repulsivas 2. Son muy intensas. Las fuerzas nucleares en su radio de acción son 1000 veces mayores que las eléctricas y millones y millones de veces mayores que las gravitatorias. 3. Las fuerzas nucleares son independientes de la carga, esto quiere decir que tienen lugar indistintamente entre p−p, n−n y p−n Explicación teórica: Se debe al físico japonés Hideki Yukawa, quién supuso que de la misma manera que dos jugadores de ping−pong se lanzan la pelota y es ella la que los mantiene unidos, las fuerzas que mantienen unidos a los nucleones son debidas al intercambio de una partícula que llamó mesón, porque según sus cálculos teóricos su masa estaría entre la del electrón y la del protón. Frank Powell en 1950 recibió el Nóbel por el descubrimiento de unas partículas de masa 300 veces la del electrón. Eran los mesones π o piones predichos por Yukawa, quien también recibió el Nóbel por dicha predicción. Según el modelo de Yukawa un protón expulsa un pión+ y se transforma en neutrón y viceversa. p ⇔ π+ + n También puede ocurrir que un neutrón expulse un pión– y se transforme en protón y viceversa: n ⇔ π− + p Esquemáticamente se podría ilustrar de la siguiente forma: La actual teoría del Modelo Estándar, mediante la que se trata de unificar todas las leyes físicas, explica las fuerzas como el resultado del intercambio de partículas por parte de las partículas de materia, conocidas como partículas mediadoras de la fuerza. En el caso de las fuerzas electromagnéticas las partículas mediadoras serían los fotones y en el caso de la interacción fuerte los gluones. MODELOS NUCLEARES Existen varios modelos, aunque ninguno es definitivo, son complementarios: Modelo de la gota líquida: Este modelo fue propuesto por Bohr y considera el núcleo formado por protones y neutrones mezclados al azar como las moléculas en una gota de agua, de manera que cada partícula interacciona solo con las que tiene alrededor, y las de la superficie al no compensar todas las fuerza crearían una especie de tensión superficial que las mantendría unidas en forma de esfera: Su fundamento se basa en que: • • La densidad casi uniforme de todos los núcleos de los elementos, que es el del orden de 1017 Kg/m3. De la misma manera que la densidad en cualquier punto de una gota es la misma. La energía total de enlace es proporcional a su masa, de la misma manera que el calor de vaporización de un líquido es proporcional a su masa ∆E ≈ Cte. A El modelo explica: • • • Que la densidad nuclear sea casi igual para todos los núcleos La emisión de partículas α de una manera parecida a la evaporación, es decir, cuando los nucleones, mediante choques, adquieren energía suficiente para vencer la barrera nuclear. Las reacciones de fisión, suponiendo que al entrar una partícula nueva en el núcleo, puede romper la armonía y dividirse en dos fragmentos. Modelos de capas concéntricas: Fue ideado en 1950 por Mayer y supone que los nucleones están situados en capas o niveles de energía dentro del núcleo, de forma parecida a como los electrones están colocados en la corteza en el modelo de Bohr. Se basa en el hecho de que los núcleos con un número de protones o neutrones igual a 2, 8, 20, 28, 50, 82 o 126, presentan una gran estabilidad. Correspondería con capas que están completas de protones y/o neutrones, como pasa con los niveles de electrones de un átomo. A esos números se les llama números mágicos. Ambas teorías, actualmente se combinan en el modelo colectivo ENERGÍA DE ENLACE Y DEFECTO DE MASA. La masa de un núcleo puede determinarse experimentalmente con gran precisión mediante el espectrógrafo de masas y resulta que siempre es inferior a la masa teórica que resulta de sumar los protones y neutrones que lo constituyen. A la diferencia entre la masa teórica y la masa experimental se le llama defecto de masa: ∆m = m teórica − m exp erimental [ ] ∆m = Z ⋅ m p + (A − Z)m n − m exp erimental A la energía que corresponde a esta pérdida de masa, de acuerdo con la relación de Einstein E = mc 2 , se le llama energía de enlace o de cohesión y representa la energía que se desprendería al formarse el núcleo a partir de sus componentes y por tanto sería la energía mínima que tendríamos que aportar para romperlo. Como consecuencia, la energía de enlace nos puede dar una idea de la estabilidad del núcleo. Sin embargo lo que pasa es que la energía de enlace es tanto mayor cuanto mayor es el número de nucleones de un núcleo y por lo tanto no se puede emplear a título comparativo, y es por eso que se define energía de enlace por nucleón, como la energía de enlace de un núcleo dividida por el número de nucleones que tiene: ∆E A La energía de enlace por nucleón sí sirve para comparar relativamente la estabilidad de los diferentes núcleos. Si representamos la energía de enlace por nucleón en función del número de nucleones de los diferentes núcleos obtendremos una gráfica como la de la figura: En la gráfica puede observarse lo siguiente: • • • Cuanto mayor es la energía de enlace por nucleón mayor es la estabilidad del núcleo Los núcleos más estables son los que tienen un número de masa (A) entre 40 y 80, y entre ellos el Fe56 es de los más estables. Se explica que se libere energía cuando se unen dos núcleos ligeros para formar otro más pasado (Fusión) o cuando un núcleo pesado se divida en dos más ligeros (Fisión). De ambas reacciones trataremos más adelante. Ejemplo: La masa atómica del isótopo 147 N es 14,000109 u. a) Indique los nucleones de este isótopo y calcule su defecto de masa. b) Calcule su energía de enlace y la energía de enlace por nucleón. c = 3,0·108 m s−1 ; 1 u = 1,67·10−27 kg ; mp = 1,007276 u ; mn = 1,008665 u a) Como el número atómico es 7, quiere decir que tiene 7 protones, y si el número de masa (p+n) es 14, quiere decir que tiene 7 neutrones, por tanto su masa teórica será: m teórica = 7 m p + 7 m n = 7 ⋅ 1,007276 + 7 ⋅ 1,008665 = 14,111587 umas ∆m = m teórica − m exp erimental = 14,111587 − 14,000109 = 0,111478umas en Kg sería: ∆m = 0,11478 ⋅ 1,67 ⋅ 10 −27 = 1,86168 ⋅ 10 −28 Kg b) La energía de enlace, de acuerdo con la expresión de Einstein será ∆E = ∆m ⋅ c 2 = 1,86168 ⋅ 10 −28 (3,0 ⋅ 10 8 ) 2 = 1,67551 ⋅ 10 −11 J dividiendo por la carga del electrón, la podemos expresar en unidades de eV ∆E = 1,67551 ⋅ 10 −11 = 1,04719 ⋅ 10 8 eV = 104,719MeV −19 1,6 ⋅ 10 La energía de enlace por nucleón, que es el valor que sirve para comparar la estabilidad de ∆E 104,719 unos núcleos con otros, sería: = = 7,48MeV que como vemos corresponde al A 14 valor que se representa en el gráfico. ESTABILIDAD NUCLEAR La estabilidad nuclear es el equilibrio entre las fuerzas de repulsión eléctrica de los protones y la fuerza atractiva nuclear de corto alcance que experimentan los protones y neutrones del núcleo. La relación entre el número de protones (Z) y neutrones (N) es por lo tanto clave para la estabilidad del núcleo. Supongamos, por ejemplo, el caso del circonio (número atómico Z=40) que tiene isótopos desde A=78 hasta A=110. Vamos a pintar en negro todos isótopos más o menos estables que tiene: 90 Zr , 91 Zr , 92 Zr , 93 Zr , 94 Zr y 96 Zr . El resto de isótopos son inestables y los que tienen mayor número de masa (desde el A=97 hasta el A=110) los vamos a pintar en azul, mientras que los que tienen menos neutrones (desde A=78 hasta el A=89) los pintaremos en rojo. Si hacemos lo mismo con todos los elementos podremos obtener una gráfica de todos los átomos donde representamos el número de neutrones en función del número de protones: • • • • Los núcleos más estables son los que aparecen dibujados como puntos negros Para los núcleos ligeros la estabilidad nuclear se consigue con un número de protones y neutrones similar. Como puede verse la curva se confunde con la recta N=Z A medida que aumenta el número atómico hay una tendencia a aumentar el número de neutrones, precisamente para atenuar las fuerzas repulsivas entre protones, pudiendo llegar en los núcleos más pesados a que N/Z=1,5, es decir a que tengan 3 neutrones por cada dos protones. Llega un momento en que la acumulación de cargas positivas en un volumen tan pequeño hace que no pueda contrarrestarse por una simple adición de neutrones y así los elementos superiores al 209 83 Bi son inestables y ello se traduce en la emisión espontánea de partículas con objeto de acercarse a configuraciones más estables. A este proceso se le llama radioactividad. RADIACTIVIDAD NATURAL Como hemos dicho, los núcleos correspondientes a átomos con número atómico superior a 83 son inestables y pueden fragmentarse de manera espontánea en otros núcleos más ligeros. Este proceso natural, que se llama radiactividad, no es más que una reacción nuclear en la que el núcleo padre trata de estabilizarse emitiendo partículas y emitiendo energía. La emisión de energía se debe a que la suma de las masas de los núcleos resultantes de la reacción (hijos) es menor que la de los núcleos originales (padres), de manera que la diferencia de masa detectada se convierte en energía, y esa energía se manifiesta en energía cinética de los núcleos hijos y en radiación electromagnética (fotones γ). Las radiaciones emitidas por un núcleo inestable natural son de tres tipos: • • Partículas α, que son núcleos de helio (formados por 2 p y 2 n) Partículas β, que son electrones. En el núcleo no hay electrones, pero se forman por transformación de un neutrón en un protón + electrón y más otra partícula llamada antineutrino, de la que ya hablaremos. n → p+ + e− + ν • o bien 1 o n → 11 p + −10 e + ν Radiación γ que son fotones de energía E = hν La carga de las tres clases de partículas puede ponerse de manifiesto con un campo eléctrico: Las transformaciones que tienen lugar en un núcleo inestable se recogen en las leyes de Soddy y Fajans: 1. Cuando un núcleo emite partículas α se transforma en otro núcleo en el que suma es 4 unidades más pequeña y su número atómico 2 unidades menor (dos lugares antes en la tabla periódica). Ejemplo: 238 92 U → 23490Th + 42 α + Energía La desintegración α es propia de los núcleos pesados y con ella tienen a convertirse en núcleos que se acerquen más a la curva de estabilidad. 2. Cuando un núcleo emite una partícula β se transforma en otro que aunque tiene la misma masa (son isóbaros) tiene un número atómico 1 unidad mayor (es el siguiente en la tabla periódica). Ejemplo: 0 Th → 234 91 Pa + −1 β + Energía 234 90 Este tipo de emisiones tiene lugar en los núcleos con demasiados neutrones. Son los que están por encima de la curva de estabilidad, los dibujados en azul en la gráfica de estabilidad. Fíjate que en realidad lo que hace es cambiar un neutrón por un protón ( n → p+ + e− + ν ) 3. La emisión de un rayo γ no altera ni la carga ni la masa del núcleo. Ocurre cuando un núcleo se encuentra en estado excitado y se estabiliza emitiendo un fotón de energía hν. El proceso es similar al que tiene lugar con los electrones de la corteza, solo que aquí los fotones emitidos son de mucha mayor energía, ya que como sabes los rayos γ son los de mayor frecuencia del espectro electromagnético. Generalmente la radiación γ acompaña a las emisiones de partículas α y β. Además de las anteriores emisiones radiactivas se han observado otras dos más: la emisión de positrones y la captura de electrones. La emisión β+ es propia de los núcleos con un exceso de protones en relación con el número de neutrones. En este caso lo que ocurre es que un protón del núcleo se transforma en un neutrón, un positrón y un neutrino: p+ → n + e+ + ν o bien 1 1 p →10 n + +10 e + ν las partículas β+ por tanto son positrones, es decir, partículas en todo igual a los electrones pero que tienen carga positiva. En este caso el nuevo núcleo tiene la misma masa y su número atómico disminuye en una unidad (se ha cambiado un protón por un neutrón) y es el tipo de emisión que tienen lugar en los núcleos dibujados en rojo en la gráfica de estabilidad nuclear. Captura electrónica, llamada también captura K, es la que tiene lugar en algunos núcleos en los que, como en el caso de la emisión β+, tienen un exceso de protones y pueden capturar uno de sus electrones de la capa más interna y en tal caso reemplazan un protón por un neutrón, según: p+ + e− → n + ν En este caso, aunque el resultado sea el de un átomo con un protón menos, lo mismo que en la emisión β+, el proceso es diferente y además en este caso la energía que se emite es menor y corresponde solo a un rayo X en lugar de a un rayo γ. Esta energía es debida al salto de un electrón de la capa de valencia hasta la primera capa para ocupar el hueco que dejó el electrón capturado por el núcleo. Todos los procesos de desintegración anteriores, al igual que cualquier reacción nuclear, tienen lugar cumpliendo ciertas reglas: • • • • • El número de nucleones (A) se debe conservar La carga eléctrica se debe conservar La energía se debe conservar El momento lineal se debe conservar El movimiento angular (incluyendo el movimiento angular Spín) se debe conservar. Ejemplo: a) Describa la estructura de un núcleo atómico y explique en qué se diferencian los isótopos de un elemento. b) Razone cómo se transforman los núcleos al emitir radiación alfa, beta o gamma. c) Razone qué desviación sufren los distintos tipos de radiación al ser sometidos a un campo magnético. a) Teoría. Respecto a la estructura del núcleo debes explicar como las fuerzas de corto alcance son capaces de mantener unidos los nucleones. Hacer una breve referencia a los modelos nucleares y a la estabilidad nuclear en función de la relación de protones y neutrones. Al referirte a los isótopos debes justificar el tipo de emisión previsible según sea la relación de protones y neutrones. b) Explica las leyes de Soddy y Fajans c) Si en lugar de establecer un campo eléctrico sometemos los tipos de radiación que se producen en un proceso de desintegración a un campo magnético también podremos separarlos puesto que las partículas α y β tienen carga distinta: Como puede verse en la figura, aplicado la regla de la mano izquierda, la fuerza magnética que actuaría sobre las partículas α y las partículas β tiene sentido contrario porque, r r aunque se mueven en el seno del mismo campo B y con la misma velocidad v , tienen distinta carga. Sin embargo el radio de sus trayectorias no es el mismo, ya que desde el punto de vista de un SRNI, teniendo en cuenta que la fuerza normal o centrípeta, en este caso es la fuerza magnética de Lorentz, el radio de la trayectoria será: F=m v2 = qvB R ⇒ R= mv qB Suponiendo que las partículas α y β salgan disparadas con la misma velocidad, tienen masa y carga distinta. Así que: • • • La carga de las partículas α (núcleos de helio) es positiva y doble que la de las partículas β (electrones) La masa de las partículas α, al estar formada por 2 protones y dos neutrones, es aproximadamente 4*1800=7200 veces mayor que la de las partículas β Por tanto, como puede entenderse el radio de la trayectoria de las partículas α será aproximadamente 3600 veces mayor, lo que quiere decir que aun en el caso de que ambas partículas tuviesen la misma carga, también podríamos separarlas mediante un campo magnético. Precisamente ese es el fundamento del espectrógrafo de masas. LEY DE LA DESINTEGRACIÓN RADIACTIVA Las leyes de la desintegración nuclear son de naturaleza estadística exponencial, eso quiere decir que no es posible saber cuando se va a desintegrar un núcleo, solamente la probabilidad de que ese proceso tenga lugar. Supongamos que inicialmente, en el instante t, tenemos un número N de átomos radiactivos, y supongamos que en el intervalo de tiempo dt se desintegran un número de núcleos dN. La velocidad de desintegración será –dN/dt donde el signo negativo indica que la desintegraciones dan lugar a una disminución del número de núcleos iniciales. Como cuanto mayor sea la muestra mayor será la probabilidad de que ocurra una desintegración, es decir, que como la velocidad de desintegración es proporcional al número de átomos existentes, se puede poner: − dN = λN dt donde λ es una constante característica de cada elemento radiactivo llamada constante de desintegración, y puede interpretarse como una medida de la rapidez con que se desintegran los núcleos o más exactamente como una medida de la probabilidad de que un núcleo se desintegre en la unidad de tiempo. Escribiendo la expresión anterior de otra forma: dN = −λ dt N si integramos y tenemos en cuenta que en el instante t=0 había No núcleos: N t dN ∫N N = t =∫0− λ dt o ln N N No = −λ t t 0 ln N − ln N o = −λ t ln N = −λ t No N = e −λ t No N = N o e −λ t • La ley de desintegración radiactiva de de decaimiento exponencial por el signo negativo del exponente. • Como puede verse los elementos que tengan una λ elevada se desintegrarán rápidamente y su vida media será pequeña ya que ambas magnitudes son recíprocas. • Nos da el número de núcleos (N) que “probablemente” quedan después de un tiempo (t) y viceversa. El resto de las magnitudes que aparecen (No y λ) son constantes. Si representamos gráficamente el número de núcleos que quedan en función del tiempo: Se llama periodo de semidesintegración T1 / 2 al tiempo necesario para que el número de núcleos iniciales se reduzca a la mitad. Es decir que: t = T1 / 2 ⇒ N= No 2 sustituyendo en la ecuación de la ley de desintegración radiactiva tenemos que: No = N o e − λ T1 / 2 2 ⇒ 1 = e −λ T1 / 2 2 1 = −λ T1 / 2 2 ⇒ ln T1 / 2 = ln 2 λ ⇒ ln 1 − ln 2 = −λ T1 / 2 Se llama vida media (τ) al promedio de vida o tiempo de un núcleo, es decir, el promedio del tiempo que un núcleo tarda en desintegrarse . Es la inversa de la constante de desintegración: τ= 1 λ Al valor absoluto de la velocidad de desintegración se le llama Actividad de la sustancia (A). Como puede verse, la actividad de una muestra radiactiva es proporcional al número de núcleos que haya en ese momento, ya que λ es una constante. A= N = N o e −λ t ⇒ dN ln 2 = λN = N dt T1 / 2 λ N = λ N o e −λ t ⇒ A = A o e −λ t Unidades de actividad: • • La actividad en el SI se mide en Rutherford (Rt), que es la actividad de una sustancia en la que se desintegran 106 núcleos por segundo La actividad también suele medirse en Curios (Ci). El curio es la actividad de una sustancia en la que se desintegran 3,7.1010 núcleos por segundo. 1 Rt = 106 núcleos/s 1 Ci = 3,7.1010 núcleos/s • En medicina se utiliza la magnitud Exposición y se define como la carga eléctrica producida por ionización del aire de 1 Kg de muestra radiactiva. Su unidad, obviamente, será el Culombio/Kg, aunque suele medirse en Roentgen. 1 R=2,57.10−9 C/Kg Ejemplo: En una muestra radiactiva hay 1020 átomos radiactivos. Si su periodo de semidesintegración es de 3 años. a) ¿cuántos átomos quedarán en la muestra después de 3 años? b) ¿cuántos átomos quedarán en la muestra después de 1,5 años? a) Obviamente, al cabo de un tiempo igual al periodo de semidesintegración, por definición deben quedar la mitad de los átomos iniciales, así que: t = T1 / 2 ⇒ N o 10 20 N= = = 5 ⋅ 1019 átomos 2 2 Lo que es fácil de comprobar aplicando la ley de la desintegración: N = N o e −λ t = N o e − ln 2 t T = 10 20 e − ln 2 3 3 = 5 ⋅ 1019 átomos b) Para cualquier otro valor de tiempo que no sea T1/2 debemos calcular el número de átomos siempre aplicando la ley de la desintegración radiactiva, ya que como ves el número de átomos y el tiempo no guardan una relación lineal, sino exponencial, así que nada de reglas de tres. N = N o e −λ t = N o e − ln 2 t T = 10 20 e − ln 2 1, 5 3 = 7,07 ⋅ 1019 átomos Ejemplo: Una muestra radiactiva de 20gr tiene un periodo de semidesintegración de 170 días. ¿Qué cantidad quedará después de una semana? Como el número de átomos es proporcional a la masa (*), podríamos escribir la ley de desintegración radiactiva como: N = No e −λ t m = mo e ⇒ −λ t = mo e − ln 2 t T sustituyendo: m = 20 e − ln 2 7 170 = 19,437gr fíjate que no es necesario poner el tiempo en segundos, obviamente lo que sí debe estar es en las mismas unidades en que se mida el periodo de semidesintegración. (*) El número de átomos (N) es proporcional a la masa (m), siendo N = m ⋅ N Av Pat 1 mol de átomos −−− tiene una masa Pat gr −−−− contiene NAv át. m gr −−−−−−−−−−− N át. Ejemplo: Una muestra de radio de 27,156 gr tiene una actividad de 1012 desintegraciones por segundo. Calcular el número de Avogadro, sabiendo que el tiempo de semidesintegración del radio es 1590 años y que el peso atómico del mismo es 226,1. De acuerdo con la definición de velocidad de desintegración o actividad: A= dN ln 2 = λN = N dt T1 / 2 Para calcular el número de átomos de radio que hay en la muestra de 27,15 gr. Tendremos en cuenta que en 1 mol de cualquier sustancia, en este caso de Ra, hay un número de Avogrado de átomos, por tanto: 1 mol de át.de Ra −−− tiene una masa de 226,1 gr −−−− contiene NAv át.de Ra 27,15 gr −−−−−−−−−−−−−−−−−−− N át.de Ra N= n º gramos N Av P.Atómico A= ln 2 n º gr ⋅ N Av T1 / 2 P.At sustituyendo: 1012 = ln 2 27,156 ⋅ N Av 1590 ⋅ 365 ⋅ 24 ⋅ 3600 226,1 de donde: N Av = 6,023 ⋅ 10 23 át/mol (Fíjate que esta vez el tiempo lo hemos puesto en segundos, porque es la unidad en la que nos han expresado la actividad de la muestra) E4B.S2005 4. El núcleo radiactivo 232 92 U se desintegra, emitiendo partículas alfa, con un período de semidesintegración de 72 años. a) Escriba la ecuación del proceso de desintegración y determine razonadamente el número másico y el número atómico del núcleo resultante. b) Calcule el tiempo que debe transcurrir para que su actividad se reduzca al 75 % de la inicial. a) De acuerdo con las leyes de Soddy y Fajans, cuando un núcleo radiactivo emite una partícula alfa (núcleo de helio) se transforma en otro de número atómico dos unidades menor y de número de masa 4 unidades menos, por tanto el elemento sería el 22890Th 232 92 U → 22890Th + 42 α Como en todas las reacciones nucleares se conserva el número de nucleones (232=228+4) y la carga (92=90+2). Además debe conservarse la energía relativista, el momento lineal, angular y el spin. b) La ley de desintegración nuclear es N = N o e − λ t . Teniendo en cuenta que la actividad es en un momento determinado es proporcional al número de núcleos que quedan (A=λN) podemos escribir que A = A o e − λ t . Sustituyendo, y teniendo en cuenta que: • si la actividad inicial es Ao, cuando se reduzca un 75% la actividad final será un 25% de la actividad inicial, por tanto 0,25Ao • la relación entre el periodo de semidesintegración y la constante de desintegración: λ=ln2/T N = N o e −λ t ⇒ A = A o e −λ t ⇒ 0,25A o = A o e − ln 2 t 72 ⇒ ln 0,25 = − ln 2 t ⇒ t=150 años 72 FAMILIAS RADIACTIVAS NATURALES La radiactividad no es nada nuevo, en la naturaleza existen núcleos naturales que son inestables, es decir radiactivos, y que por tanto se descomponen dando lugar a su vez a otros, y estos a su vez a otros y así sucesivamente hasta que llegan finalmente a uno que es estable, el resultado es toda una cadena llamada serie o familia radiactiva. Existen 3 familias radiactivas naturales que se nombran con el nombre del elemento que las inicia o padre. Estas son; la del Uranio 238, la del Torio 232 y la del Actino 227. Como ejemplo, en la familia radiactiva del 238U que se representa mas abajo, podemos ver que el Uranio 238 emite una partícula α y se transforma en Torio. Este a su vez emite una partícula β y se transforma en Protactinio, y así sucesivamente se va desintegrando hasta finalmente llegar al Plomo 206 que es estable. U → 23490Th + α 238 92 Th → 234 91 Pa + β 234 90 APLICACIONES DE LOS ISÓTOPOS RADIACTIVOS Aplicaciones en geología y arqueología: En este caso se utilizan para fechar muestras, ya que la ley de desintegración radiactiva permite relacionar la cantidad de núcleos radiactivos que tiene en la actualidad una muestra geológica o arqueológica con los que había inicialmente: N = N o e −λ t Podemos despejar el tiempo: Tomando logaritmos neperianos: ln N = −λ t No ⇒ 1 N 1 N t = − ln = ln o λ No λ N y teniendo en cuenta la relación entre la constante de desintegración y el periodo de semidesintegración (T1/2=1/λ) nos quedaría que: t= N N T ⋅ ln o = 1,44 T ln o ln 2 N N Como vemos, conociendo el periodo de semidesintegración de la sustancia radiactiva, si medimos el número de átomo iniciales de la muestra y conocemos los en la actualidad tiene una muestra igual, podemos saber el tiempo transcurrido. En arqueología se utiliza como reloj el Carbono 14, porque su tiempo de vida es comparable al tiempo a medir. El Carbono 14, que es radiactivo, se forma por la acción de los rayos cósmicos a partir del Nitrógeno 14 existente en la naturaleza en la siguiente reacción: 14 1 14 1 7 N + 0 n → 6 C +1 p • • Cualquier ser vivo, al respirar, toma átomos de carbono 12 y de carbono 14, que incorpora a su estructura (recuerda que los isótopos son indistinguibles químicamente) Naturalmente el 14C se va desintegrando por ser radiactivo, pero la proporción de 14 C y 12C se mantiene constante mientras está vivo debido al aporte ordinario de CO2, donde existen ambos isótopos en proporción estable. El C14 se descompone dando de nuevo nitrógeno, una partícula β y un neutrino, según la reacción: 14 6 • C→147 N + β + ν Cuando el organismo se muere, el carbono 14 continúa desintegrándose como siempre, pero ahora no hay aporte que reemplace los átomos perdidos, así que la proporción de 14C y 12C se hace cada vez menor a medida que pasa el tiempo. En geología, donde los tiempos que se miden son mucho más grandes se utiliza como reloj el 235U ya que tiene una vida mucho mayor que el carbono 14. Ejemplo: Una muestra de madera recogida en la tumba de Ramsés II tiene una actividad de 470 partículas/hora, mientras que la madera actual tiene una actividad de 700 partículas/hora. Sabiendo que el periodo de semidesintegración del C14 es de 5700 años ¿cuál es la época en la que vivió este faraón? Habría que empezar por despejar el tiempo a partir de la ley de desintegración hasta llegar a la expresión: N t = 1,44 T ln o N Teniendo en cuenta que el número de átomos en la muestra es directamente proporcional a la actividad de la muestra, recuerda que A=λN, podemos poner que: t = 1,44 T ln Ao 700 = 1,44 ⋅ 5700 ⋅ ln = 3.269 años A 470 Ejemplo: Una roca de uranio contiene un 2,2% de 235U y el resto 238U. Si se estima que inicialmente los dos isótopos existían en la misma proporción, calcula la edad de la roca sabiendo que el periodo de semidesintegración del 235U es de 109 años. t = 1,44 T ln No 50 = 1,44 ⋅ 10 9 ⋅ ln = 4,5 ⋅ 10 9 años N 2,2 4500 millones de años, que resulta un valor en consonancia con la edad de la tierra estimada por otros procedimientos. Aplicaciones en Biología y Química: Los isótopos radiactivos se utilizan como trazadores con el objeto de dilucidar los mecanismos de las reacciones y ello puede hacerse gracias al idéntico comportamiento químico de todos los isótopos de un elemento, ya que las propiedades químicas no residen en el núcleo del elemento sino en la disposición de los electrones de la última capa. Por ejemplo, en la reacción global del proceso de fotosíntesis que tiene lugar en las plantas tenemos que: 6 CO2 + 6 H2O → C6H12O6 + 6 O2 La pregunta es ¿de donde proviene el oxígeno que se desprende? ¿del CO2 o del agua?. Para contestar a esta pregunta no hay más que marcar el oxígeno de una de las dos sustancias, por ejemplo se utiliza agua sintetizada con oxígeno 15 que es radiactivo. Tras la reacción se puede comprobar que el oxígeno que desprende la planta es radiactivo, lo que nos permite deducir, sin ninguna duda, que el oxígeno proviene del agua. Aplicaciones en Medicina: Los radioisótopos se utilizan en medicina para diagnosticar enfermedades y también para curarlas: • • • Para ver el funcionamiento de órganos de difícil acceso. Así en cardiopatía se inyecta al paciente con 137Ba y del seguimiento de las señales que produce se puede ver el estado del corazón. Para descubrir hemorragias internas, ya que allí donde las haya la actividad radiactiva será mayor. Con el mismo fundamento se utilizan para detectar escapes o roturas en los oleoductos. El primero en utilizarlos como trazadores fue George de−Hevesy, quien recibió en Nóbel de medicina por sus aportaciones. En radioterapia para la destrucción de células cancerosas Aplicaciones en Genética: Debido a que la radiación puede producir mutaciones en el material genético de un organismo, se utiliza en semillas para inducir cambios genéticos que resulten benéficos para el cultivo como una mayor resistencia a alguna enfermedad específica, mejor adaptación a ciertas condiciones ambientales, o un mayor rendimiento en las cosechas. El problema es que no es posible controlar una irradiación para que sólo produzca mutaciones beneficiosas, ni mucho menos escoger la característica que deseamos modificar, por eso este tipo de experimentos son muy largos hasta conseguir mutaciones que podrían ser beneficiosas. Actualmente, las mejores variedades de cebada, trigo, arroz, etc. provienen de mutaciones inducidas. También es muy importante los trabajos realizados para crear especies de insectos incapaces de reproducirse. De esa forma se sueltan en lugares donde se quieren exterminar y al aparearse con sus congéneres evitan que las plagas se sigan extendiendo. Otras aplicaciones: Debido al alto poder ionizante de la radiación γ, también se utilizan los radioisótopos para la destrucción de gérmenes en materiales de uso médico y en la preservación de alimentos. DETECTORES El fundamento de todos los medios de detección de partículas se basan en los efectos ionizantes de las mismas. Contador Geiger−Müller: Consiste en un filamento rodeado de un cilindro en el que hay un gas como argón: Entre el filamento y el cilindro se establece una ddp elevada, pero insuficiente como para producir una descarga del gas, de manera que por el circuito no circulará corriente. Cuando incida la radiación sobre las moléculas de gas, éstas se ionizan y de esta forma se establece una corriente a través de la resistencia que es proporcional a la cantidad de radiación. Como puede comprenderse, dado su funcionamiento, los contadores Geiger pueden utilizarse para medir cualquier tipo de radiación ionizante, como por ejemplo las partículas α, β y la rayos X y γ. Detector de centelleo: Se basa en que cuando una partícula α choca contra una pantalla de sulfuro de zinc se produce un pequeño destello luminoso. Contando el número de destellos podemos saber el número de partículas emitidas por la muestra radiactiva. Utilizando otras sustancias, en lugar del ZnS, se puede producir este mismo destello con electrones, rayos X y radiación gamma. En lugar de contar los destellos lo que se hace es convertirlos en una corriente eléctrica utilizando una célula fotoeléctrica, y así la intensidad de la corriente que se produce nos mide la cantidad de radiación recibida. Cámara de niebla de Wilson: Este dispositivo es mas bien para ver las trayectorias de las partículas que para medir la cantidad de radiación. Se basa en que los iones actúan como núcleos de condensación del vapor de agua saturado. Una cámara de niebla es simplemente una caja cerrada que contiene vapor de agua superenfriado y supersaturado, lo que se consigue expandiéndolo con la ayuda de un pistón una vez que se ha saturado de vapor. Cuando una partícula cargada, de suficiente energía, interacciona con el vapor lo ioniza y da lugar a pequeñas gotas de agua que dan lugar a una niebla, con lo que se produce un rastro a lo largo de su trayectoria similar al de los aviones reactores, de esta forma puede verse y fotografiarse. Cámara de burbujas de Glaser: Su funcionamiento es parecido al de la cámara de niebla de Wilson, solo que aquí se utiliza un líquido a una temperatura justo por debajo de su punto de ebullición. Como sabemos, la temperatura de ebullición de un líquido depende de la presión, así que si se disminuye la presión con la ayuda de un émbolo podemos conseguir que quede justo a punto de hervir. En estas condiciones, al entrar la radiación, los iones hacen de núcleos de ebullición, de forma que puede verse y fotografiarse su trayectoria debido al rastro de burbujas que van dejando. La ventaja de la cámara de burbujas sobre la de niebla está en que en el líquido hay muchísimas más moléculas que en el gas y por tanto la resolución de la trayectoria de las partículas es muchísimo mayor. BALANCE ENERGÉTICO MASA−ENERGÍA EN LAS REACCIONES NUCLEARES Las reacciones nucleares se producen normalmente bombardeando un núcleo A, que sirve de blanco, con un proyectil a, como por ejemplo un neutrón, protón o núcleo de helio, etc. El resultado es otro núcleo B, en su estado normal o excitado, y una partícula b. A+a → B+b también se escribe abreviadamente: A (a , b) B En una reacción nuclear, por tanto, hay una redistribución de los nucleones de los núcleos por lo que dan lugar a átomos diferentes. Esta es una diferencia muy importante con las reacciones químicas, en las que solo hay una redistribución de los átomos, con lo que solo se obtienen moléculas diferentes, pero con los mismos átomos) La primera reacción nuclear la consiguió Rutherford bombardeando nitrógeno con partículas α y dando lugar a oxígeno y un protón: 14 7 N + 42 α→178 O +11 p En las reacciones nucleares la perdida de energía que experimenta la partícula que colisiona con el núcleo se invierte en formar un núcleo excitado que inmediatamente se transforma en otro, o se divide, emitiendo partículas y radiación, dependiendo de la energía de excitación. Así, la reacción anterior sería: 14 7 N + 42 α→189* F→178 O +11 p Muchas veces en las reacciones nucleares se suelen obtener isótopos que no existen en la naturaleza, como por ejemplo: 238 92 U + 01 n → 239 92 U Las reacciones nucleares pueden considerarse como procesos de choques elásticos entre partículas, en los que deben conservarse las siguientes magnitudes: • • • • • El número de nucleones (A) se debe conservar La carga eléctrica se debe conservar La energía se debe conservar (*) El momento lineal se debe conservar El movimiento angular (incluyendo el movimiento angular Spín) se debe conservar. (*) La conservación de la energía debe escribirse en términos de conservación relativista. Por ejemplo, suponiendo la reacción A(a,b)B y que inicialmente el núcleo A se encuentra en reposo se escribiría como: (Ec A + m A c 2 ) + (Ec a + m a c 2 ) = (Ec B + m B c 2 ) + (Ec b + m b c 2 ) es decir: Ec A + Ec a + (m A + m a − m B − m b )c 2 = Ec B + Ec b Factor de reacción Q El factor de reacción (Q) corresponde a la energía desprendida en la reacción como consecuencia de la transformación en energía, debida a pérdida de masa. Puede ser positivo o negativo. Q = (∑ m reactivos − ∑ m productos ) ⋅ c 2 • • En el caso de que Q sea positivo la reacción ocurrirá para cualquier energía cinética del proyectil. En el caso de que Q sea negativo el proyectil deberá tener una energía cinética umbral para producir la reacción. Ejemplo: Al bombardear el isótopo 10 del boro con un deuterón de una energía de 8,10 MeV se produce un neutrón y un núcleo residual de carbono 11, que sale formando un ángulo de 45,1º. a) Escribir la reacción que tiene lugar b) El factor de la reacción. c) Si el neutrón producido tienen una energía de 13,0 MeV ¿Cuál será su dirección? DATOS: Masas atómicas: B10=10,0161, H2=2,0147, n=1,0090, C11=11,0149 1 uma=1,66.10−27Kg, Carga e− =1,6.10−19C a) 10 5 B+ 21 H→116 C+ 01 n b) Para calcular el factor de reacción primero vamos a calcular la pérdida de masa que tiene lugar en la reacción y lo luego vemos a qué energía equivale de acuerdo a la ecuación de Einstein: ∆m = ∑ m reactivos − ∑ m productos = 10,0161 + 2,0147 − 11,0149 − 1,0090 = 0,0069 umas Antes de calcular su equivalencia en energía debemos pasar la masa de umas a Kg, de esa manera la energía la obtendremos en Julios. ∆m = 0,0069 ⋅ 1,66 ⋅ 10 −27 = 1,1454 ⋅ 10 −29 Kg Así la el factor de reacción, o energía debida a la pérdida de masa de la reacción es: Q = ∆m ⋅ c 2 = 1,1454 ⋅ 10 −29 (3 ⋅ 10 8 ) 2 = 1,0309 ⋅ 10 −12 Julios en MeV: 1,0309 ⋅ 10 −12 = 6,43 ⋅ 10 6 eV = 6,43MeV 1,6 ⋅ 10 −19 c) Para calcular la trayectoria de rechazo del neutrón, teniendo en cuenta que la reacción nuclear puede considerarse como un choque elástico entre partículas, no hay mas que aplicar las ecuaciones de conservación del momento lineal y de la energía: Q= r r r r pB + pH = pC + pn Ec B + Ec H + Q = Ec C + Ec n De la segunda ecuación se puede calcular la EcC sustituyendo el resto de los valores en MeV tenemos: 8,10+6,43=13,0+EcC ⇒ EcC=1,53 MeV A partir de la conservación del momento lineal podemos escribir una ecuación para cada eje: Eje X ⇒ Eje Y ⇒ m H v H = m n v n cos α + m C v C cos β 0 = m n v n senα − m C v C senβ Con una de las ecuaciones es suficiente para resolver el problema, aunque antes de sustituir debemos calcular el módulo de la velocidad de cada partícula a partir del valor de su energía cinética, aunque dado lo engorrosos de los números hay un camino más corto: 1 Ec = mv 2 ⇒ mv = 2m Ec 2 por tanto: 0 = 2m n Ec n senα − 2m C Ec C senβ 0 = 2 ⋅ 1,0090 ⋅ 13,0 senα − 2 ⋅ 11,0149 ⋅ 1,53 sen 45,1 ⇒ α = 53,4º En la reacción puede verse como, además, se conserva la carga (5+1=6+0) y también se conserva el número de nucleones (10+2=11+1) Ejemplo: Para producir la reacción nuclear Mg24(α,p)Al27 se aceleran las partículas α mediante un ciclotrón que tienen unas D de 1m de radio y están sometidas a un potencial de 10000senωt voltios, estando sometido a un campo magnético de 1 tesla. a) Calcular la velocidad y la energía que adquieren las partículas α b) Factor de reacción. ¿la reacción es posible? c) Cuantas vueltas da la partícula α en el ciclotrón antes de salir? d) Que tiempo tarda en dar esas vueltas? DATOS: Masas: mMg=23,9924, mα=4,0026, mAl=26,9899, mp=1,0076 1uma=1,66.10−27Kg, e=1,6.10−19C a) La velocidad de salida, que depende del radio del ciclotrón es, teniendo en cuenta que desde el punto de vista de un SRNI, la fuerza centrífuga del electrón la compensa la fuerza magnética: F=m v2 = qvB R ⇒ v= qBR m 2 ⋅ 1.6 ⋅ 10 −19 ⋅ 1 ⋅ 1 v= = 4,816 ⋅ 10 7 n / s − 27 4,0026 ⋅ 1,66 ⋅ 10 Se ha tenido en cuenta que la carga de la partícula α es dos veces la del electrón, positiva. La energía que adquiere la partícula α, que será cinética es: Ec = 1 1 mv 2 = 4,0026 ⋅ 1,66 ⋅ 10 − 27 (4,816 ⋅ 10 7 ) 2 = 7,7 ⋅ 10 −12 Julios = 48,1MeV 2 2 (la masa hay que expresarla en Kg para que la energía salga en julios. Luego dividiendo por la carga del electrón la podemos pasar a eV y si dividios por 106 serían MeV) b) El factor de reacción es: Q = ∆m ⋅ c 2 = (m Mg + m α − m Al − m p ) ⋅ c 2 Q = (23,9924 + 4,0026 − 26,9899 − 1,0076) ⋅ 1,66 ⋅ 10 −27 ⋅ (3 ⋅ 10 8 ) 2 Q = −3,735 ⋅ 10 −13 Julios = −2,33MeV Como vemos, el factor de reacción es negativo, lo que indica que la reacción no es espontánea y se requiere de un proyectil, en este caso la partícula α, que tenga una energía como mínimo superior a 2,33 MeV. Como la partícula α acelerada en el ciclotrón ha alcanzado una energía igual a 48,1 MeV la reacción ocurrirá sin problemas. c) La partícula α cada vez que pasa de una D a otra es acelerada por el campo eléctrico creado por la ddp que hay entre las D, de acuerdo con: 1 mv 2 = qV 2 por tanto, para obtener la energía cinética máxima debe atravesar x veces ese potencial, de manera que: 1 mv 2max = qV ⋅ x 2 de donde: mv 2 4,0026 ⋅ 1,66 ⋅ 10 −27 (4,816 ⋅ 10 7 ) 2 x= = = 2408 2qV 2 ⋅ 2 ⋅ 1,6 ⋅ 10 −19 ⋅ 10000 como cada vuelta que da la partícula atraviesa dos veces el potencial acelerador, el número de vueltas que tienen que dar es la mitad: n º vueltas = x = 1204 vueltas 2 Observa que la energía que adquiere la partícula proviene del potencial eléctrico. El campo magnético simplemente provoca una fuerza normal a la velocidad y por tanto solamente es responsable de que gire. d) Precisamente el funcionamiento del ciclotrón se basa en que el periodo de rotación de una partícula cargada en el interior de un campo magnético uniforme es independiente del radio y de la velocidad: T= 2πR 2π ⋅ 1 = = 1,305 ⋅ 10 −7 seg 7 v 4,816 ⋅ 10 como da 1204 vueltas, el tiempo que estará dentro del ciclotrón será t = 1,57 ⋅ 10 −4 seg REACCIONES DE FISIÓN Y FUSIÓN NUCLEAR. JUSTIFICACIÓN A PARTIR DE LA CURVA DE ESTABILIDAD NUCLEAR Fisión nuclear: Consiste en la división de un núcleo pesado, de aproximadamente A=200, como el uranio o el torio, en dos fragmentos mas pequeños de tamaño comparable. El método normal para provocar una reacción de fisión es bombardear el núcleo pesado con neutrones previamente acelerados, por ejemplo: 235 92 92 1 U + 01 n →141 56 Ba + 36 Kr + 3 0 n En una reacción de fisión hay dos hechos importantes: • Se libera energía. En la gráfica de estabilidad nuclear en la que se representa la energía de enlace por nucleón ( ∆E / A ) en función del número de masa (A) puede observarse que la energía por nucleón de los núcleos de A=200 es del orden de 7,5 MeV/nucleón, mientras que las de los fragmentos de A=100 es del orden de 8,5 MeV/nucleón, que por tanto son más estables (se necesita más energía para romperlos). Quiere decir que, en términos generales hay un aumento de estabilidad de 1 MeV/nucleón y si el núcleo pesado tuviera A=200, es decir 200 nucleones, pues ganaría una estabilidad de 200 MeV Esta energía aparece en forma de calor y de energía cinética de los productos finales. • En la fisión se absorbe un solo neutrón, pero se producen un promedio de 2 o 3 neutrones. Esto sugiere la posibilidad de una reacción en cadena, si no se controla, ya que cada nueva etapa se producirán mas fisiones, creciendo exponencialmente y dando lugar a lo que sería una bomba atómica de fisión. Si la reacción de fisión se controla, de manera que solo uno de los neutrones emitidos produzca una nueva fisión y así sucesivamente, tendríamos una reacción autosostenida que es lo que ocurre en las centrales de energía nuclear. En el núcleo de un reactor nuclear se coloca el combustible nuclear, que puede ser Uranio−235 o Plutonio−239, y entre este se sitúan unas barras de control de grafito (moderador), que tiene la propiedad de absorber neutrones. Introduciendo más o menos las barras se consigue acelerar o frenar la reacción. Como puede verse en el esquema, la energía producida en el reactor, como consecuencia de la fisión, calienta un líquido y éste en un cambiador de calor se utiliza para generar vapor a presión que al chocar contra la turbina la hace girar. La turbina hace girar una bobina en el seno de un campo magnético y como consecuencia entre sus extremos se produce una corriente alterna. Fusión Nuclear: Es un proceso inverso al de fisión. En este caso se forma un núcleo más pesado a partir de dos núcleos más ligeros que chocan. Como ejemplo vamos a ver las reacciones del ciclo protón−protón que tienen lugar en las estrellas: H 1 + H1 → H 2 + e + + ν H 2 + H 1 → He 3 He 3 + He 3 → He 4 + H 1 + H 1 Las dos primeras reacciones ocurren 2 veces, así que el ciclo en su conjunto produce un átomo de helio a partir de cuatro protones. La energía que se desprende en el ciclo (despreciando la masa del positón y la de su neutrino) sería: E = ∆m ⋅ c 2 = (4 ⋅ 1,007597 − 4,002603) ⋅ 1,6610 −27 (3 ⋅ 10 8 ) 2 = 4,15 ⋅ 10 −12 J = 25,94MeV Como podemos ver en la gráfica de estabilidad nuclear, la energía de enlace de los elementos muy ligeros, como el hidrógeno, es menor que la de los más pesados que se obtienen por fusión, en este caso el helio, que por tanto es mucho más estable en más de 6 MeV según se ve en la gráfica. (En este caso al intervenir 4 átomos de hidrógeno la energía que se desprende es algo más de 24 MeV, exactamente 25,94 MeV.) El problema de la fisión está en que para que choquen los dos núcleos deben vencer la repulsión culombiana (barrera de Coulomb), y por tanto deben tener una cierta energía cinética que les permita acercarse tanto como para que puedan actuar las fuerzas nucleares de corto alcance (alrededor de 10−15 m). (Este problema no existía en la fisión, ya que los átomos pesados se bombardean con neutrones que al no tener carga no son rechazados por los núcleos que hacen de blanco. Es más, en el caso de los neutrones el problema casi es el inverso, ya que si tuvieran una energía cinética demasiado grande permanecerían muy poco tiempo cerca de los núcleos disminuyendo así la probabilidad penetrar en ellos, por eso para la fisión se utilizan neutrones lentos, llamados neutrones térmicos.) La barrera de Coulomb puede entenderse si se compara con una cuesta. Para que una bola suba la pendiente necesita una cierta energía cinética, pero una vez que se consigue caería a un pozo con mayor estabilidad que la posición inicial. Aquí es lo mismo, a grandes distancias los núcleos se repelen, pero si tienen una cierta energía cinética pueden vencer esa barrera a una distancia ro y entonces ya se atraerían fuertemente. La energía potencial correspondiente a dos cargas, en este caso dos núcleos de números atómicos Z1 y Z2, separados una distancia de 10−14 m que es la distancia a la que empiezan a actuar las fuerza nucleares de corto alcance sería: Ep = K Z Z (1,6 ⋅ 10 −19 ) 2 q ⋅ q´ = 9 ⋅ 10 9 1 2 −14 = 2,3 ⋅ 10 −14 Z1 Z 2 = 13855 ⋅ Z1 Z 2 MeV r 10 Como vemos es enorme y, en todo caso, solo es razonable para núcleos muy ligeros, es decir, de bajo número atómico Z. Si la energía necesaria para poner en contacto los núcleos se le suministrara en forma de energía cinética, teniendo en cuenta que la energía media de una partícula debido a su temperatura es Ec = 3 2 kT donde k es la constante de Boltzman = 1,38.10−23 J/ºK, resulta que para tener la energía calculada anteriormente debería tener una temperatura: Ep = Ec 3 2,3 ⋅ 10 −14 Z1 Z 2 = 1,38 ⋅ 10 − 23 T 2 ⇒ T = 1,1 ⋅ 10 9 Z1 Z 2 ºK como puedes imaginar una temperatura del orden de 109 ºK (mil millones de ºK) es muy elevada y por tanto la construcción de reactores de fusión presenta muchísimos problemas de tipo práctico. En la actualidad se está construyendo en Francia un prototipo que encierra el “plasma” mediante un confinamiento magnético con forma toroidal, ya que es imposible construir un confinamiento físico capaz de soportar esas temperaturas. No obstante, en las estrellas, y por supuesto en el sol, ocurren reacciones de este tipo. (El plasma, llamado también el cuarto estado de la materia, además de los tres conocidos sólido, líquido y gas, es una especie de gas formado por electrones e iones positivos debido a que por su elevada temperatura los átomos se han roto.) A pesar del inconveniente de la gran energía que se requiere para iniciar las reacciones de fusión y del inconveniente para conseguir un confinamiento adecuado, estas reacciones presentan muchas ventajas sobre las de fisión y por lo tanto son un reto importante a alcanzar • • • Son unas reacciones muy limpias, ya que prácticamente no producen residuos radiactivos, al contrario que las de fisión donde los residuos son uno de sus mayores problemas. Tienen mayor rendimiento energético. En el ejemplo del ciclo protón−.protón hemos visto que se producen 25,94 MeV para un desgaste de 4 umas de combustible, mientras que en la de fisión teníamos 200 MeV para un desgaste de 200 umas. Otra ventaja es la gran cantidad de materia prima, ya que hidrógeno y deuterio hay en el agua del mar todo lo que se quiera, mientras que el uranio es limitado y difícil de enriquecer a 235. Al igual que ocurría en las reacciones de fisión, también aquí puede originarse una reacción en cadena. En el caso de la fusión era porque para el inicio de cada reacción se necesitaba un neutrón y en ella se producían dos o tres de manera que evolucionaría exponencialmente. En la fusión ocurre parecido, solo que en este caso es la propia energía producida en la reacción la que activaría nuevos núcleos para que la reacción continúe. (Como ignición de una bomba de fusión se utiliza una bomba de fisión para proporcionar la temperatura necesaria para iniciar los procesos de fusión.) Ejemplo: Las siguientes reacciones, llamadas ciclo del carbono, ocurren en el sol y son la causa de la energía que radia: C12 + H1 → N13 N13 → C13 + e+ C13 + H1 → N14 N14 + H1 → O15 O15 → N15 + e+ 15 N + H1 → C12 + He4 Suponiendo que pudiésemos realizarlas de forma controlada en la tierra ¿Qué cantidad de hidrógeno se necesitaría para abastecer de energía a nuestro país, suponiendo que el consumo sea de 109 Kwh anuales? DATOS: Masas: mH1=1,673.10−27Kg, mHe4=6,644.10−27Kg, me+=9,110.10−31Kg Como puedes ver si sumas todas las reacciones, el C12 actúa simplemente de catalizador ya que al final del ciclo se recupera, y el proceso se puede resumir en: 4 H1 → He4 + 2 e+ De acuerdo con la equivalencia masa−energía de Einstein la energía desprendida en la reacción debido a la pérdida de masa es: E = ∆m ⋅ c 2 = (4 ⋅ 1,673 ⋅ 10 −27 − 6,644 ⋅ 10 −27 − 2 ⋅ 9,110 ⋅ 10 −31 ) ⋅ (3 ⋅ 10 8 ) 2 = 4,222 ⋅ 10 −12 Jul h E = 4,222 ⋅ 10 −12 wat ⋅ seg = 4,222 ⋅ 10 −12 ⋅ 10 −3 Kw ⋅ = 1,173 ⋅ 10 −18 Kw ⋅ h 3600 Los 4 núcleos de H1 producen 1,173.10−18 Kwh, así que para obtener los 109 Kwh necesarios necesitaríamos: 4 ⋅ 10 9 N= = 3,41 ⋅ 10 27 átomosH1 −18 1,173 ⋅ 10 Teniendo en cuanta ahora que 1 mol de átomos de hidrógeno tiene una masa de 1 gr y contiene un número de Avogadro de átomos (6,023.1023) podemos poner: 1 mol de át.de H −−− tiene una masa de 1 gr −−−− contiene 6,023.1023 át.de H m −−−−−−−−−−−−−−−−−−− 3,41.1027 át.de H 3,41 ⋅ 10 27 m= = 5661gr = 5,661 Kg de H 6,023 ⋅ 10 23 PARTÍCULAS ELEMENTALES. MODELO DE LOS QUARKS Hasta el primer tercio del siglo XX se pensó que la materia era una combinación de protones, neutrones y electrones en proporciones establecidas. Hacia 1940 Yukawa, para poder explicar el origen de las fuerzas nucleares de corto alcance, predijo la existencia en el núcleo de otras partículas que llamó mesones π. En el estudio de las desintegraciones β vimos que se emitía una nueva partícula llamada antineutrino 1 1 0 0 n →1 p + −1 e + ν El estudio de la radiación cósmica ha sido un campo importante donde se han descubierto muchas partículas elementales, sobre todo en los tiempos en los que no se disponía de grandes aceleradores de partículas. En 1932 Anderson descubrió el positrón estudiando la radiación cósmica con una cámara de niebla. El positrón e+ es una partícula idéntica en todo al electrón, con la excepción de que tiene carga positiva. Se le llama antipartícula del electrón. Un proceso de producción de antipartículas es conocido como producción de un par y puede ocurrir cuando un fotón de alta energía la pierde al chocar contra un núcleo: γ → e− + e+ Al proceso inverso se le llama aniquilación del par y consiste en que la partícula al chocar con su antipartícula se aniquilan convirtiéndose sus masas en radiación: e − + e + → 2γ Estos dos procesos son la prueba definitiva de la equivalencia masa−energía de Einstein. Todas las partículas tienen su correspondiente antipartícula, así para el protón existe el antiprotón y para el neutrón existe el antineutrón aunque en este caso la diferencia no radica en su distinta carga puesto que no tienen, sino en su spín, es decir en el sentido de giro de las partículas sobre sí mismas: Ejemplo: Un positrón y un electrón se aniquilan al ponerse en contacto produciendo dos rayos γ a) Cual es la energía de los fotones b) Cual es su longitud de onda DATOS: me=9,1.10−31Kg, h=6,626.10−34 J/s a) Suponiendo que es despreciable la energía cinética inicial de las partículas, la energía de los fotones provendrá exclusivamente de la masa de las partículas. Como las partículas tienen la misma masa, la energía de cada fotón es: E = mc 2 = 9,1 ⋅ 10 −31 (3 ⋅ 10 8 ) 2 = 8,19 ⋅ 10 −14 J b) La longitud de onda de los fotones es: E = hν = h c λ ⇒ λ= hc 6,626 ⋅ 10 −34 ⋅ 3 ⋅ 10 8 = = 2,42 ⋅ 10 −12 m −14 E 8,19 ⋅ 10 Ejemplo: Un fotón de 1,1 MeV se materializa produciendo un par electrón−positrón ¿Con qué velocidad salen disparadas las partículas, supuesta igual para ambas? Datos: me=9,1.10−31Kg, e=1,6.10−19C γ → e− + e+ La energía del fotón es igual a energía que se invierte en materializarlas + la energía cinética que adquieren, es decir: E γ = 2mc 2 + Ec − + Ec + sustituyendo, aunque teniendo en cuenta que hay que pasar los MeV a julios, y que la energía cinética del electrón y del positrón son iguales por tener la misma velocidad: 1 1,1 ⋅ 10 6 ⋅ 1,6 ⋅ 10 −19 = 2 ⋅ 9,1 ⋅ 10 −31 (3 ⋅ 10 8 ) 2 + 2 9,1 ⋅ 10 −31 v 2 2 de donde: v = 1,14 ⋅ 10 8 m / s Con los modernos aceleradores de partículas, que es donde se producen y detectan se han llegado a conocer muchas otras, que se clasifican según su spín o según su estructura: Fermiones Según su spín Bosones Leptones Según su estructura Hadrones (formados por quarks) • Partículas con spín semientero (s=1/2, 3/2) • Cumplen el principio de exclusión de Pauli (no puede haber 2 partículas en el mismo estado cuántico con los 4 números cuánticos iguales) • Son partículas con masa (En el Modelo Estándar todas las partículas de materia son fermiones) • Son fermiones: e−, p+, n • Partículas con spín entero (s=0, 1, 2) • No cumplen el principio de exclusión de Pauli (muchos fotones pueden estar en el mismo estado cuántico como pasa en el láser) • Son partículas sin masa, salvo los W y Z • Son bosones: el fotón y el gravitón, los bosones W y Z de la interacción débil, los gluones de la interacción fuerte y el bosón de Higgs • Son fermiones de masa ligera (de ahí su nombre) • No poseen interacción fuerte • Son leptones: e−, muón µ− , tauón τ− y los neutrinos y sus correspondientes antipartículas Mesones • Tienen masa intermedia y su spin es cero • Interacción fuerte • Son mesones: los piones π+ π− π0 , los kaones y sus antipartículas Bariones • Son fermiones de mayor masa • Interacción fuerte • Son bariones: p+, n, lambda Λ0 y sus antipartículas En los 60 había tal número de partículas elementales que Wolfgang Pauli llegó a decir “si lo hubiera sabido me habría hecho biólogo” . En el año 1963 Gell−Mann e independientemente el físico suizo Zweig propusieron una hipótesis, según la cual todos los hadrones están constituidos por tres partículas más elementales denominadas quarks, hoy día son 6 los quarks. Los quarks tienen números cuánticos fraccionarios, en particular una carga eléctrica igual a +2/3, −1/3, +1/3 representan por las letras de la palabra que les da nombre: Símb Nombre Carga Masa (GeV) u up (arriba) +⅔ 0,3 d down (abajo) −⅓ 0,3 c charm (encanto) −⅓ 0,5 s strange (extraño) +⅔ 1,5 t top (cima) −⅓ 4,5 b bottom (fondo) +⅔ 175 Toda partícula se hace con la unión de estos quarks, y la interacción se realiza con el intercambio de los bosones portadores de las fuerzas llamados gluones (pegamento). Por ejemplo: • • El neutrón está formado por la unión de los quark udd (uno up y dos down) y estos se mantienen unidos gracias a un intercambio mutuo de gluones. Viendo las propiedades de los quarks que lo componen tendremos las características del neutrón, (carga eléctrica nula, y masa aproximada de 930 MeV). El Protón está formado por los quark uud Por tanto, las partículas elementales realmente serían los leptones y los quarks FUERZAS FUNDAMENTALES De acuerdo con el tipo de interacción en el que participan las partículas elementales, las fuerzas de la naturaleza se clasifican en cuatro tipos, que en orden de intensidad son: 1. Interacción nuclear fuerte: Se llama también interacción hadrónica, porque en ella intervienen los mesones y bariones. Es una fuerza de muy corto alcance, del orden de 1fermi=10−15m, decreciendo muy rápidamente para distancias mayores. Es la responsable de mantener unidos a los protones y neutrones y por tanto de la estabilidad nuclear. 2. Interacción electromagnética: Es debida a las partículas con la carga eléctrica. Es mucho menos fuerte que la nuclear fuerte, pero tiene mayor alcance. 3. Interacción nuclear débil: Es debida a todas las partículas. Tiene una distancia de interacción algo mayor que las fuerzas de corto alcance, alrededor de 10−16m y es la que explica la desintegración β y la de muchas otras partículas inestables. 4. Interacción gravitatoria: Es debida a las partículas con masa. Tiene un alcance infinito, como la electromagnética. Es la más débil de todas y solo tiene importancia en cuerpos con gran masa, pero es insignificante para las partículas elementales. La moderna Teoría Estándar considera las interacciones entre dos partículas como consecuencia del intercambio de unas partículas especiales llamadas partículas mediadoras o portadores de fuerza. Estas partículas mediadoras de fuerza son siempre bosones. • • • • La interacción electromagnética se explicaría mediante el intercambio de fotones. La fuerza nuclear débil se explicaría por el intercambio de dos tipos de bosones muy masivos llamados W y Z. La fuerza nuclear fuerte se explica mediante la existencia de unos portadores de fuerza que actúan a un nivel más profundo, llamados gluones, que son bosones sin masa. La interacción gravitatoria que sería la más difícil de explicar se debería a la existencia de unas partículas medidoras llamadas gravitones, pero que hasta ahora nadie ha podido encontrar. Distancia de interacción Nuclear fuerte 10−15 m Electromagnética infinita Nuclear débil 10−16 m Gravitatoria infinita Interacción Partículas que interaccionan Hadrones Con carga Todas Con masa Partícula mediadora Gluones Fotones Bosones W y Z Gravitones Fuerza relativa 1 10−3 10−8 10−45