La nueva química de los gases nobles
Anuncio

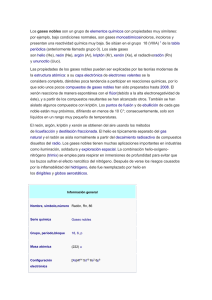
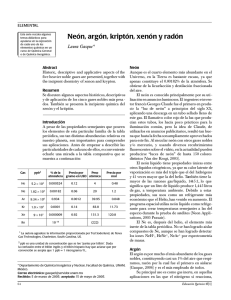
La nueva química de los gases nobles Yuri Hueda Tanabe Están en el aire que respiramos, pero por su escasa reactividad nadie sospechó de la existencia de los gases que ahora llamamos nobles, hasta finales del siglo XIX, cuando William Ramsay los descubrió a partir de experimentos con nitrógeno atmosférico. Aunque representan apenas alrededor del 1% de la atmósfera terrestre, se les han encontrado muchas aplicaciones, algunas tan familiares como los globos llenos de helio y los anuncios de neón, y otras muy sofisticadas en los espectrómetros de masas y escáneres de tomografía axial computarizada que emplean xenón. Los átomos de los seis elementos de este grupo tienen completa su capa electrónica más externa, con 2 electrones el helio y 8 el resto. La gran estabilidad de esta configuración electrónica explica su reticencia a reaccionar con otros átomos, por lo que durante mucho tiempo se creyó que eran completamente inertes. Sin embargo, Linus Pauling sugirió en 1933 que los gases nobles más pesados sí podían reaccionar y formar enlaces químicos ya que en ellos la distancia entre la capa externa y el núcleo es mayor que en los ligeros por lo que la estabilidad de esta capa electrónica externa en los pesados, no es tan alta. Esta hipótesis no se comprobó experimentalmente hasta 1962, cuando N. Bartlett preparó el primer compuesto con un gas noble: el hexafluoroplatinato de xenón, Xe+[PtF6] -. Después de éste se obtuvieron varios compuestos más con xenón y algunos cuantos con kriptón y radón, lo cual llevó a abandonar el adjetivo de inertes y preferir el de nobles. En los últimos años, la química de estos gases se ha desarrollado rápidamente en varias direcciones. En Finlandia, M. Räsanen y sus colaboradores obtuvieron en años recientes moléculas del tipo HGnY, donde Gn es un gas noble y Y un grupo electronegativo como OH- o F-. La importancia de su trabajo es que descubrieron varios enlaces químicos nuevos con gases nobles, como Xe-H, Xe-I, Xe-Br, Xe-S, Kr-H, Ar-H y Ar-F. Un logro particularmente importante fue la obtención, en 1998, de HArF, el primer compuesto químico con argón, uno de los gases nobles ligeros. Entre los retos actuales se cuenta la preparación de compuestos estables con los otros dos gases nobles ligeros, helio y neón. Por otro lado, en 2002, químicos de las universidades de Ohio y Virginia obtuvieron accidentalmente un compuesto de uranio y argón al estar trabajando con la molécula de CUO en argón sólido. Estaban interesados en la interacción entre el uranio y el monóxido de carbono (el argón era simplemente para formar una ?jaula? protectora alrededor de las moléculas de CUO a baja temperatura) pero, para su sorpresa, los resultados indicaron que los átomos de uranio formaban enlaces químicos con los del argón. Desviados de su objetivo original, siguieron esta inesperada línea de investigación y obtuvieron también compuestos de uranio con xenón y kriptón. Ahora investigan la posibilidad de formar enlaces entre gases nobles y otros metales a bajas temperaturas. Uno de los resultados más recientes es la obtención de compuestos orgánicos de gases nobles dada a conocer en marzo de este año. A partir de cálculos teóricos, R.B. Gerber, de la Universidad Hebrea de Jerusalén, predijo la existencia de una nueva familia de compuestos del tipo HGnY, donde Y es un hidrocarburo y, sobre esa base, Räsanen, en Helsinki y V. Feldman, en Moscú, se abocaron a su obtención en el laboratorio hasta que lo consiguieron. La visión que tenemos ahora de los gases nobles es muy distinta de la de principios del siglo pasado; de ser considerados inertes, estos gases se han convertido en elementos cuya química ha despertado un gran interés, tanto desde el punto de vista teórico ?estudio de la naturaleza de los enlaces, elucidación de los mecanismos de formación de los compuestos, predicción de sus propiedades? como de sus aplicaciones en diversos campos, como la industria, la medicina o la agricultura, en los que se espera la creación de compuestos con bajos efectos fisiológicos negativos o contaminantes. Bibliografía: Li, J., B.E. Bursten, et al, 2002, ?Noble gas-actinide compounds: Complexation of the CUO molecule by Ar, Kr, and Xe atoms in noble gas matrices?, Science 295, 22 de marzo, pp. 2242-2245. Ligas: http://www.sciencedaily.com/releases/2005/03/050323115810.htmhttp ://www.weizmann.ac.il/ICS/booklet/18/pdf/gerber.pdf