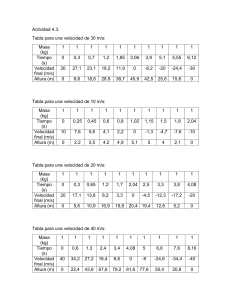
contenidos mínimos para la prueba de septiembre
Anuncio

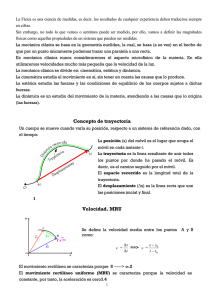
IES Valsequillo Departamento: Física y Química FÍSICA Y QUÍMICA, 3º ESO CURSO: 2015/2016 ORIENTACIONES PARA LA PRUEBA DE SEPTIEMBRE CONTENIDOS IMPARTIDOS OBJETO DE EXAMEN El método científico. Etapas. Magnitudes físicas. Unidades de medida. Sistema Internacional de unidades. Cambio de unidades (longitud, superficie, volumen, masa, tiempo, temperatura, velocidad). Múltiplos y submúltiplos de las unidades de medida. Notación científica. Modelos atómicos: Dalton, Thomson y Rutherford. Estructura del átomo. Partículas subatómicas. Número atómico. Número másico. Concepto de isótopo. Concepto de ion. Determinar el número de cada uno de los tipos de partículas que constituyen un átomo (neutro) o un ion. Radioactividad: tipos y aplicaciones. Período de semidesintegración. Características del Sistema Periódico. Símbolos químicos de los elementos principales. Formulación y nomenclatura de compuestos binarios: óxidos, hidruros, haluros de oxígeno, haluros de hidrógeno y sales binarias. Movimiento. Tipos de trayectoria. Ecuación del movimiento rectilíneo uniforme. Conceptos de velocidad y aceleración. Resolución de problemas. IES Valsequillo FÍSICA Y QUÍMICA, 4º ESO Departamento: Física y Química CURSO: 2015/2016 ORIENTACIONES PARA LA PRUEBA DE SEPTIEMBRE CONTENIDOS IMPARTIDOS OBJETO DE EXAMEN Conceptos básicos sobre el átomo: partículas subatómicas (electrón, protón y neutrón). Número atómico y número másico de un elemento. Isótopos. Iones. Características del Sistema Periódico. Símbolos químicos de los elementos principales. Configuración electrónica de un átomo, determinar el grupo y el período (en los que se encontraría ese elemento dentro de la tabla periódica) a partir de esa estructura. Enlace químico: iónico, covalente y metálico. Propiedades. Determinar el tipo de enlace de un compuesto atendiendo a los elementos que lo conforman y su estructura electrónica. Formulación y nomenclatura de compuestos inorgánicos sencillos: óxidos, peróxidos, hidruros, ácidos hidrácidos, sales binarias, hidróxidos y oxoácidos (ácidos ternarios). Formulación y nomenclatura de compuestos de carbono (hidrocarburos: alcanos, alquenos y alquinos; hidrocarburos de cadena cerrada). Masa atómica de un elemento y masa molecular de un compuesto. Reacciones químicas. Ajuste de ecuaciones sencillas. Cálculos estequiométricos sencillos con mol y gramos. Disoluciones: concentración de una disolución (g/L; tanto por ciento en masa; tanto por ciento en volumen; mol/L o molaridad). Movimiento rectilíneo uniforme (MRU). Resolución de problemas. Gráficas s-t y v-t Movimiento rectilíneo uniformemente acelerado (MRUA). Resolución de problemas. Gráficas s-t y v-t Ejemplos de MRUA: Caída libre y tiros verticales. Aplicación en problemas. Las tres leyes de Newton. Aplicación en problemas. Diferencia entre peso y masa. Fuerza de rozamiento. Fuerza normal IES Valsequillo Departamento: Física y Química FÍSICA Y QUÍMICA, 1º BACHILLERATO CURSO: 2015/2016 ORIENTACIONES PARA LA PRUEBA DE SEPTIEMBRE CONTENIDOS IMPARTIDOS OBJETO DE EXAMEN Concepto de mol. Número de Avogadro. Masa atómica y masa molecular relativas. Masa molar. Composición centesimal de un compuesto. Determinación de fórmulas empíricas y moleculares de compuestos. Concepto de disolución. Componentes. Formas de expresar la composición de una disolución (porcentaje en masa; porcentaje en volumen; fracción molar; molaridad). Concepto de solubilidad. Propiedades de las disoluciones. Presión osmótica. Ascenso ebulloscópico. Descenso crioscópico. Leyes fundamentales de la química: Ley de conservación de la masa; Ley de las proporciones definidas; Ley de las proporciones múltiples; Ley de los volúmenes de combinación; Teoría atómica de Dalton; Principio de Avogadro; Leyes de los gases ideales; Ley de las presiones parciales; Teoría cinético-molecular de los gases. Ecuación de estado de los gases ideales. Cambios químicos. Reacción química. Ajuste de ecuaciones químicas. Estequiometría de las reacciones químicas. Cálculos con relación masamasa, volumen-volumen, masa-volumen, con reactivo limitante, con reactivos en disolución. Rendimiento de una reacción química. Reactivos impuros (pureza de una muestra). Teoría cinético-molecular de la materia. Concepto de energía interna. Relación entre temperatura y energía interna. Energía transferida mediante calor. Trabajo de expansión y compresión de un gas. Primer principio de la termodinámica. Concepto de entropía: segundo principio de la termodinámica. Intercambio de energía en las reacciones químicas. Calor de reacción. Entalpía estándar de reacción (entalpía de formación, entalpía de combustión…). Entalpía de enlace. Ley de Hess. Entropía estándar de reacción. Energía libre de Gibb: criterios de espontaneidad de un proceso químico. Formulación y nomenclatura inorgánica: compuestos binarios (óxidos, peróxidos, hidruros, ácidos hidrácidos, sales binarias) y ternarios (oxoácidos y sales ternarias). Formulación y nomenclatura orgánica: hidrocarburos, hidrocarburos halogenados, alcoholes, éteres, aldehídos, cetonas, ácidos carboxílicos, ésteres, aminas, amidas y nitrilos. Isomería. Tipos de isomería estructural. IES Valsequillo Departamento: Física y Química Movimiento. Sistema de referencia inercial y no inercial. Trayectoria, posición y desplazamiento. Conceptos de velocidad media e instantánea. Conceptos de aceleración media y aceleración instantánea. Componentes intrínsecas de la aceleración (aceleración normal y aceleración tangencial). Vector de posición, vector velocidad y vector aceleración. MRU. Ecuación. Gráficas s-t y v-t MRUA. Ecuaciones. Gráficas s-t, v-t y a-t. Movimiento vertical de los cuerpos. Composición de movimientos en la misma dirección y en direcciones perpendiculares (MRU en ambos casos) MCU y MCUA. Características Características de las fuerzas. Vectores fuerza. Composición y descomposición de fuerzas. Leyes de la dinámica o leyes de Newton. Momento lineal de un cuerpo. Principio de conservación del momento lineal. Impulso mecánico. Fuerza normal. Fuerza de rozamiento. Ley de la gravitación universal de Newton. Peso de un cuerpo. OBSERVACIONES: Se deberá demostrar, principalmente, que se sabe aplicar los contenidos mencionados en problemas tipo como los trabajados a lo largo del curso.