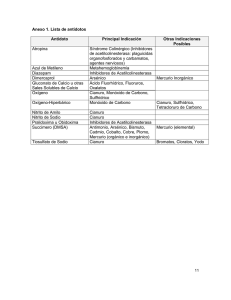
eliminación de efluentes industriales cianurados
Anuncio

I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. ELIMINACIÓN DE EFLUENTES INDUSTRIALES CIANURADOS Amat, A. M.; Arques, A.; Santos-Juanes, L*.; Silvestre, M.; Vicente, R. Departamento de Ingeniería Textil y Papelera. Universidad Politécnica de Valencia. Plaza Ferrándiz y Carbonel s/n, E-03801 Alcoy, Spain. Resumen Unos de los residuos más problemáticos generados en la industria son los cianurados. Además de ser el cianuro uno de los compuestos más tóxicos existentes éstos suelen ir acompañados por la presencia de metales de transición que también son altamente tóxicos. Por este motivo, se plantea el estudio de la aplicabilidad de la fotocatálisis solar como técnica alternativa para la depuración de estos efluentes industriales. Se han planteado dos posibles métodos de tratamiento que pueden utilizar la energía solar como única fuente de energía: la fotocatálisis con dióxido de titanio y un proceso tipo foto-Fenton (metal y H2O2). En primer lugar se ha realizado pruebas a escala laboratorio tratando agua sintética y real de una empresa de la zona. En ambos casos se consiguen mejores resultados con el tratamiento tipo foto-Fenton. Con este método se logra la total eliminación de los cianuros (tanto libres como complejados) y la precipitación de los metales presentes en las aguas reales, principalmente el cobre. Como consecuencia se produce un importante descenso de la toxicidad pudiendo alcanzar la detoxificación total del efluente. Finalmanete se escala este proceso a una planta piloto de detoxificación solar situada en la misma empresa generadora del efluente. Palabras clave: cianuro, compuestos cianurados, fotocatálisis solar 1. Introducción La fotocatálisis es un proceso fotoquímico que se engloba dentro de las Técnicas de Oxidación Avanzada. La IUPAC la define como: Reacciones catalíticas que implican la absorción de luz por un catalizador o por un sustrato [1]. En general, estas técnicas son muy útiles para el tratamiento de contaminantes refractarios a otros métodos ya que son capaces de producir su transformación química, pudiendo llegar a mineralizar fracciones importantes del contaminante. Una ventaja de estas técnicas es que apenas se forma subproductos de reacción y pueden servir como pretratamiento a los métodos biológicos convencionales [2]. 2. Procesos fotocatalíticos Seguidamente se explican los dos procesos fotocatalíticos empleados. 2.1 Fotocatálisis con dióxido de titanio El dióxido de titanio (TiO2) es actualmente el fotocatalizador más estudiado y sobre el que más se ha publicado [3]. Ha sido utilizado satisfactoriamente en la eliminación de contaminantes como plaguicidas, disolventes clorados, compuestos farmacéuticos, colorantes textiles etc [4]. Su mecanismo de reacción es ampliamente conocido. El TiO2 es un semiconductor de banda ancha que puede pasar electrones de la banda de valencia a la banda de conducción tras ser excitado con radiación UV. Se forman así pares electrón-hueco (e-/h+) que bien pueden recombinarse o bien pueden iniciar reacciones de oxidación y reducción, generando especies transitorias altamente oxidantes [5]. I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. * Correspondencia: Lusanju1@txp.upv.es El dióxido de titanio ha sido objeto de varios trabajos como fotocatalizador en disoluciones cianuradas siendo capaz de eliminar eficazmente el cianuro libre. La presencia de metales en la disolución puede dificultar este proceso, especialmente el cobre, que además de inhibir la acción del catalizador tiene gran facilidad para formar un complejo altamente estable [7]. La aplicación del dióxido de titanio para la eliminación de cianuros se ha estudiado anteriormente en aguas sintéticas pero no en aguas reales de empresa que contienen además del cianuro metales pesados. Además no se ha determinado la toxicidad del efluente después del proceso fotocatalítico. Este punto es muy importante porque nos permite saber si dicho efluente puede ser vertido a la red de alcantarillado sin peligro. 2.1 El proceso foto-Fenton El proceso de Fenton se basa en la combinación de sales de hierro y peróxido de hidrógeno que al reaccionar proporcionan radicales hidroxilo (especie altamente oxidante) según la ecuación química [8]. Fe2+ + H2O2 → Fe3+ + OH- + HO· (1) En la oscuridad, este proceso es más lento por el tiempo que tarda el Fe(II) en pasar a Fe(III). La irradiación con luz UV de la muestra (foto-Fenton) aumenta el poder oxidante del proceso y su velocidad. Esto se debe a la foto-reducción del Fe(III) en Fe(II), que a su vez produce nuevos radicales hidroxilo. Asímismo se produce la descomposición fotolítica de peróxido de hidrógeno según las ecuaciones: Fe3+ + H2O → Fe2+ + HO· + H+ (2) H2O2 → 2 HO· (λ<400nm) (3) Para operar en condiciones óptimas, el proceso foto-Fenton se debe realizar a un pH aproximado de 2.8 [9]. Empleando este proceso se ha conseguido oxidar gran cantidad de compuestos tóxicos como colorantes textiles, halometanos, compuestos orgánicos clorados etc [10]. Existe la posibilidad de cambiar las sales de hierro por sales de algún otro metal de transición. Se produce entonces lo que se conoce por un proceso tipo foto-Fenton (no necesariamente pH 2.8). Alguno de estos metales pueden ser el cobre y el cromo [11]. En muchos de los casos, se ha observado que la adición de sales de cobre e irradiación de la muestra mejora mucho la eficiencia del proceso [12]. También en este caso, el tratamiento de efluentes reales y la medida de la detoxificación conseguida son dos aspectos que merecen ser investigados. 3. Experimental A continuación se detallan los equipos empleados así como el procedimiento empleado en cada experimento. 3.1 Instrumentación Electrodo selectivo de cianuros Es un electrodo modelo CN 500 de la marca WTW que se completa con un electrodo de referencia R 503/D de la misma marca. Permite medir la concentración de cianuro libre en una muestra, pero no el complejado. I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. Analizador de carbono orgánico (TOC) Los análisis se han realizado en un equipo Shimadzu modelo TOC-VCSH que permite cuantificar la materia orgánica presente en una muestra. Viene equipado con automuestreador y módulo para la detección de nitrógeno. Este equipo mide el carbono total (TC), el carbono inorgánico (IC) y el carbono orgánico (TOC). Asumiendo que el cianuro (CN-) es la única fuente de carbono podemos medir la variación de carbono que experimenta la muestra. Simulador de luz solar Para realizar los experimentos se utilizó un simulador solar de la marca comercial Oriel Instruments, modelo 81160 equipado con una lámpara de xenón. Dicha lámpara puede trabajar desde 200 a 500 W, produciendo un espectro uniforme que simula la luz solar real. Respirómetro de fangos activos Modelo BM3-LAB de la marca Neurtek. Este equipo permite calcular la toxicidad de una muestra analizando la variación en la tasa de respiración de los fangos activos. En todos los casos se trabaja con fangos reales de la EDAR no preadaptados municipal de Alcoy lo que nos permite aproximarnos bastante a lo que pasaría si estas muestras llegaran a la depuradora. Luminómetro El equipo utilizado para la medida de la intensidad de la bioluminiscencia emitida por Vibrio fischeri es un fotomultiplicador, BioFix® Lumi-10 Macherey-Nagel GMBH & Co. KG con un detector de fotones de alta sensibilidad que trabaja a una longitud de onda entre 380-630 nm. El equipo, que presenta un display gráfico y puede ser conectado a un ordenador a través de un cable RS232, puede efectuar una serie de ensayos de toxicidad, mutageneidad e incluso ensayos de biología molecular y bioquímicos, gracias al software integrado. Planta piloto de detoxificación solar de 50L de capacidad La planta solar de 50 L es una Solardetox® Acadus-2006 (Figura 1) fabricada por Ecosystem. Está formada por una serie de tubos de vidrio paralelos por donde circula el agua a tratar. Detrás de cada tubo hay un concentrador cilidro-parabólico de aluminio que concentra toda la radiación dispersa hacia el centro del tubo. Posee un radiómetro que acumula la radiación solar que le llega. Esta planta posibilita pasar las experiencias del laboratorio con simulador al sol real y tratando más cantidad de muestra. Está situada en la misma empresa generadora de los efluentes, lo que permite realizar los ensayos in situ. Figura 1. Planta piloto de fotocatálisis solar de 50 L I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. 3.2 Procedimientos Para los experimentos con aguas sintéticas se han preparado de 100 ppm de CN- todas ajustadas a un pH de 12. Las reacciones se han realizado en reactores cilíndricos destapados de 250 mL de capacidad irradiados en el simulador de luz solar. El dióxido de titanio usado ha sido el P-25 de la marca Degussa en proporciones de 0.2, 0.5 y 1g/L. Se ha añadido peróxido de hidrógeno a las disoluciones para conseguir concentraciones de 10 mM, 20 mM y 30 mM para aguas sintéticas y de 1M para aguas reales. Como catalizadores se ha añadido, según los casos, hierro(II) y cobre(II) en concentraciones de 50 ppm del catión. En los casos en que se ha trabajado sin adición de metal se ha seguido la evolución del cianuro con el electrodo selectivo. Cuando ha habido metal, bien como catalizador externo o bien por tratarse de aguas reales, se ha seguido la evolución por el TOC; midiendo el carbono de cada muestra tras precipitar y filtrar el posible CO2 formado como producto de la oxidación. La toxicidad frente a fangos activos e ha medido en el respirómetro. Primero se carga el reactor con 500mL de fangos activos. Se añade una sustancia muy biodegradable (1g de acetato sódico) para alcanzar un estado de máxima actividad microbiológica. Cuando los fangos llegan a este valor máximo (máximo consumo de oxígeno) se añade la muestra problema. Generalmente se añaden 250 mL de muestra y se tiene en cuenta la dilución producida. En los casos en los que el contaminante es altamente tóxico, como ocurre con el cianuro, la toxicidad causada es tan elevada que se deben añadir cantidades menores de muestra (10, 20 ó 30 mL). La adición de la muestra produce un descenso en la tasa de respiración que relacionándolo con el valor máximo alcanzado nos permite calcular el porcentaje de inhibición o toxicidad causada. Para los cálculos de toxicidad con Vibrio fischeri, se cuantifica la inhibición de la luminiscencia producida por cultivos de esta bacteria tras un tiempo de contacto con la muestra (15 min) mezclando en una cubeta volúmenes iguales de la muestra a analizar, o de sucesivas diluciones, con una suspensión de bacterias luminiscentes. La medida de la intensidad de la luminiscencia se realiza en el Luminómetro BioFix®. Para calcular la Dosis Letal 50 (cantidad de contaminante que causa un 50% de inhibición), se realizaron respirometrías añadiendo diferentes concentraciones de los contaminantes estudiados. El dato final de DL50 se da como concentración del contaminante en el reactor tras añadir la muestra; es decir, teniendo en cuenta el volumen final. Finalmente se adjuntan las características más importantes del agua real de una empresa de recubrimientos metálicos que se ha empleado. -Cianuro Libre: entre 120 ppm -Cianuro Complejado: 850 ppm -Cobre: 360 ppm -Otros metales: (Cd, Zn...) ≤ 20ppm -pH: de 10.9 -Conductividad: 2.2 mS/cm 4. Resultados y discusión En primer lugar se ha calculado la toxicidad de las especies más relevantes que se encuentran en el agua real: el cianuro y el cobre. Se ha calculado la DL50 de cada una frente a fangos activos de depuradora. El cianuro es casi 7 veces más tóxico que el cobre con una dosis letal 50 calculada de 3 ppm mientras que la cobre (II) es algo menor de 0.5 ppm. I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. Mientras el cianuro y el cobre son dos especies altamente tóxicas; el cianato que se produce al oxidar el cianuro no presenta toxicidad alguna incluso con concentraciones finales en el reactor de 35 ppm. 4.1 Tratamiento con dióxido de titanio Se han realizado reacciones de degradación del cianuro libre con distintas proporciones de TiO2 (Degussa P-25) irradiando durante 3h disoluciones de cianuro de 100 ppm. - Figura 2. Evolución de la concentración de CN y de la toxicidad de disoluciones de 100 ppm de CN libre tras ser irradiadas 3 horas con distintas cantidades de TiO2 en simulador solar. En la figura 2 se muestra la concentración de cianuro y la toxicidad inicial y final, de 10 mL, obtenida por respirometría de fangos activos. Destacar el efecto de la adsorción del CNsobre el catalizador, que se observa y cuantifica en la muestra no irradiada. Tras tres horas de irradiación y a pesar de conseguir porcentajes de eliminación bastante importantes, las aguas siguen presentando toxicidades elevadas (pequeñas cantidades de cianuro libre provocan inhibiciones considerables). Las reacciones que tienen lugar en la oxidación del cianuro por el dióxido de titanio al irradiar la muestra son las siguientes [13]: CN- + 2h+ + 2OH- → CNO- + 2H2O CNO- + 4O2 + 2OH- + 3H2O → CO2-3 + NO-3 + 4H2O2 - (4) (5) Figura 3. Descenso del TC (%) en muestras de CN de 100 ppm tras ser tratadas 3 horas con distintas cantidades de TiO2 en el simulador de luz solar. I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. Al irradiar con distintas cantidades de dióxido de titanio se observa que el descenso de carbono total se debe principalmente a su adsorción sobre el catalizador (como demuestra la disolución no irradiada). (Ver figura 3). Al pasar al tratar aguas reales se ha observado la importante toxicidad tras el tratamiento. Esto se debe probablemente a que el dióxido de titanio no es capaz de destruir los complejos de cianuro eficientemente y mucho menos de producir la reducción del metal. La figura 4 muestra la toxicidad que generan 10mL de muestra de agua de empresa tratada con distintas cantidades de dióxido de titanio durante 3 horas de irradiación. La toxicidad es persistente en todos los casos, incluso tras el tratamiento. Figura 4. Toxicidad (%) provocada por la adición de 10 mL de aguas reales tratadas 3h por irradiación en el simulador con distintas cantidades de TiO2 . 4.2 Tratamiento con H2O2 Manteniendo la concentración de cianuro libre de 100ppm, se han realizado experimentos con una concentración 10mM de peróxido de hidrógeno. Tras 3 horas de irradiación, las pruebas de toxicidad debida a la adición de 10mL de la muestra tratada al reactor biológico del respirómetro, indican una inhibición de los fangos de un 50%. Se ha aumenta la concentración de peróxido de hidrógeno 20mM. Esta vez no se apreció toxicidad residual cuando añadimos 10, 20, 30mL de la muestra tratada. Parece que con esta concentración de H2O2 consigue la total oxidación del cianuro (como se verá más adelante) siguiendo las reacciones [12]: CN- + H2O2 → OCN- + H2O - OCN + 3H2O2 → NO2- NO2- + H2O2 → + CO32- NO3- (6) + + 2H2O + 2H + H2O (7) (8) No obstante, la variación de carbono total que se observa es despreciable. Se deduce de este hecho que con esta concentración de H2O2, se produce la oxidación de cianuro a cianato, pero no la de cianato a carbonato; algo que está en consonancia con la bibliografía que determina que se necesita añadir unas 4 veces la cantidad estequiométrica de agua oxigenada para la total oxidación del cianuro a cianato [14]. 4.3 Efecto catalizador de las sales de hierro (proceso foto-Fenton), y las sales de cobre (tipo foto-Fenton) I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. El efecto catalítico de sales de hierro o de cobre puede mejorar los resultados de la fotodegradación. Con el cobre se obtienen mejores resultados, lo que es esperable ya que estamos a un pH muy alejado del óptimo para el empleo de sales de hierro (2.8). Para la misma cantidad de sales de hierro que de cobre (50 ppm), con la misma concentración de H2O2 (20 mM) y con 1 hora de irradiación el descenso del TC producido por el cobre es el doble que el que se consigue con hierro. Figura 5. Descenso del TC (%) obtenido tras una hora de irradiación en simulador solar de disoluciones de 100ppm de cianuro libre al añadirle H2O2 20mM y 50 ppm de Fe o Cu respectivamente. Este efecto fotocatalítico del cobre va a ser uno de los puntos más importantes del estudio ya que es el metal mayoritario presente en las aguas reales generadas por la empresa de recubrimientos metálicos y por lo tanto se evita la necesidad de añadir otros catalizadores externos. En base a estos resultados las aguas reales de empresa se irradiaron únicamente con peróxido de hidrógeno. Esta reacción fotocatalítica además de eliminar el cianuro consigue precipitar el cobre que precipita como hidróxido al romperse el complejo [15]. De esta forma, tras el filtrado o decantación de la muestra conseguimos una detoxificación total. 4.4 Tratamiento en planta piloto Todo proceso de fotocatálisis debe estar encaminado a la utilización de la luz solar como fuente de energía eliminando así gran parte de los costes energéticos y confiriendo al proceso su gran valor medioambiental. Por ello una vez se ha demostrado la viabilidad del tratamiento en el laboratorio se ha pasado al tratamiento con planta piloto irradiada con luz solar directa. Se pasa entonces a utilizar la radiación acumulada como referencia y no el tiempo de tratamiento ya que la radiación puede variar entre épocas del año, días e incluso horas de un mismo día. Por ello se han escalado las reacciones a la planta piloto de 50L ubicada en la misma empresa generadora de los efluentes. Se han tomado muestras a diversas radiaciones para estudiar toxicidad, evolución de carbono total, cianuro libre y cobre en disolución. La figura 6 muestra la evolución del cianuro libre, del cobre y del carbono total con la radiación recibida por la planta. I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. Figura 6. Evolución del cabono total, el cianuro libre y el cobre con la radiación acumulada. Se consigue la total eliminación del cianuro libre y la casi eliminación del cobre (separado como hidróxido). El carbono total sigue un descenso más lento, lo que indica que tras la oxidación de cianuro a cianato se produce la oxidación a carbonato. La eliminación de los compuestos tóxicos produce la consiguiente bajada de la toxicidad que es completa para fangos activos y muy importante para las más sensibles Vibrio fischeri (figura 7) [16]. Como consecuencia la muestra tratada y filtrada puede ser vertida sin problemas a la red de alcantarillado ya que no causará problemas ni en la depuradora ni posteriormente en el medio receptor. Figura 7: Evolución de la toxicidad de la muestra con la radiación acumulada 5. Conclusiones El estudio de dos técnicas de fotocatalisis solar como posible alternativa a los métodos tradicionales de depuración de efluentes cianurados nos lleva a las siguientes conclusiones: -La fotocatálisis con dióxido de titanio es capaz de oxidar el cianuro libre con relativa facilidad, pero difícilmente oxida el cianuro complejado con cobre y mucho menos consigue la reducción de los metales presentes. I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. -Tras el tratamiento con dióxido de titanio las muestras siguen presentando elevada toxicidad frente a los fangos de depuradora. -El peróxido de hidrógeno oxida fácilmente tanto a los cianuros libres y como a los complejados. -Al tratar aguas reales de empresa, el cobre presente cataliza la reacción para piosteriormente precipitar al romperse el complejo (pH de trabajo alrededor de 10). -Con el uso de H2O2 como único reactivo, se pueden oxidar los cianuros libres, los complejados y precipitar los metales teniendo una muestra filtrada final ausente de toxicidad, e incluso reutilizable. -No se forman intermedios peligrosos, no se añade conductividad a la muestra, ni materia orgánica extra y el exceso de H2O2 se descompone con el tiempo. -La única fuente de energía utilizada durante el proceso es la luz solar. 6. Referencias [1] S. E. Braslavsky, K. N. Houk, J. W. Verhoeben. Glossary of Terms Used in Photochemistry. IUPAC October (2005). [2] Rein Munter. Advanced oxidation processes. Current status and prospects. Proceedings of the Estonian Academy of Sciencies. Chemistry 50 (2001) 59-80 [3] Akira Fujishima, Xintong Zhang. Titanium dioxide photocatalysis: present situation and future approaches. C. R. Chimie 9 (2006) 750-760 [4] Chantal Guillard, Jean Disdier, Christine Monnet, Joseph Dussand, Sixto Malato, Julián Blanco, Manuel I. Maldonado, Jean-Marie Hermann. Solar efficiency of anew deposited titania photocatalyst: chlorofenol, pesticide and dye removal applications. Applied Catalysis B: Environmental 46 (2003) 319-332 [5] Alexander G. Agrios and Pierre Pichat. State of the art and perspectives on materials and applications of photocatalysis over TiO2. Journal of Applied Electrochemistry 35 (2005) 655663 [6] A. Bozzi, I. Guasaquillo, J. Kiwi. Accelerated removal of cyanides from industrial effluents by supported TiO2 photocatalyst. Applied Catálisis B: Enviromental 51 (2004) 203-211 [7] Miguel Rodríguez, Sixto Malato, César Pulgarín, Sandra Contreras, David Curcó, Jaime Giménez, Santiago Esplugas. Optimizing the solar photo-Fenton process in the treatment of contaminated water. Determination of intrinsic kinetic constants for scale-up. Solar Energy 79 (2005) 360-368 [8] Joseph J. Pignatello, Esther Oliveros, Allison McKay. Advanced Oxidation Processesfor Organic Contaminant Destruction Based on the Fenton Reaction and Related Chemistry. Critical Reviews in Environmental Science and Technology 36 (2006)1-84. [9] Parag R. Gogate, Aniruddha B. Pandit. A review of imperative technologies for wastewater treatment I: Oxidation technologies at ambient conditions. Advances in Enviromental Research 8 (2004) 501-55. [10] Pawel Ciesla, Przemyslaw Kocot, Piotr Mytych, Zofia Stasicka. Homogeneous photocatalysis by transition metal complexes in the environment. Journal of Molecular Catalysis A: Chemical 224 (2004) 17-33. [11] Mehmet Kivis, Emine Karakaya, Nevzat O. Yigit, Gokhan Civelekoglu, Ata Akcil. Heterogeneous catalytic degradation of cyanide using copper-impregnated pumice and hydrogen peroxide. Water Research 39 (2005) 1652-1662. I Simposio Iberoamericano de Ingeniería de Residuos Castellón, 23-24 de julio de 2008. [12] V. Augugliaro, J Blanco Gálvez, J. Cáceres Vázquez, E. García López, V. Loddo, M. J. Lopez Muñoz, S. Malato Rodríguez, G. Marci, L. Palmesano, M. Schiavello, J. Soria Ruiz. Photocatalytic oxidation of cyanide in aqueous TiO2 suspensions irradiated by sunlight in mild and strong oxidant conditions. Catalysis Today 54 (1999) 245-253. [13] M. Kitis, A. Akcil, E. Karakaya, N.O. Yigit. Destruction of cyanide by hydrogen peroxide in tailing slurries from low bearing sulphidic gold ores. Minerals Engineering 18 [2005] 353362. [14] L. Santos-Juanes, A. M. Amat, A. Arques, A. Bernabeu, M. Silvestre, R. Vicente, E. Añó. Activated sludge respirometry to asses solar detoxification of a metal finishing effluent. Journal of Hazardous Materials 153 (2008) 905-910. Agradecimientos Los autores desean agradecer la financiación obtenida al Ministerio de Educación y Ciencia (PTR1995-0934-OP).