Exámen Microscópico
Anuncio

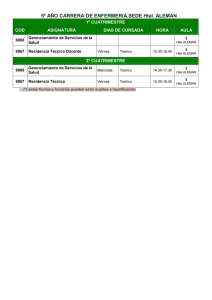
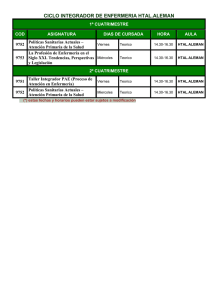
Piensa Ud. en “Micosis” dentro del diagnóstico diferencial ? Que se le puede pedir al laboratorio de Micología ? Que se debe esperar del laboratorio de Micología? Diagnóstico Diferencial Las manifestaciones clínicas muchas veces son poco orientadoras y se confunden fácilmente por otras enfermedades: • distintas infecciones bacterianas • procesos neoplásicos • transplantes de órganos • afecciones alérgicas • psoriasis • etc. • Solicitud de pedido clara y completa • Muestra representativa con transporte y mantenimiento correcto Adecuado procesamiento Informe preliminar rápido Preparación de Medios de Cultivo y reactivos Indicaciones claras para el paciente y el médico Toma de muestra y transporte Exámen microscópico Cultivo Identificación Sensibilidad antifúngica Serología (Ag /Ac) Biología molecular Espectrometría de masas MANUALES DE GESTION DE CALIDAD DE CADA LABORATORIO Medios de Cultivo para Microbiología Control de Calidad Para que los microorganismo puedan crecer adecuadamente, los Medios de Cultivo deben cumplir con diversos “requisitos”. Diagnóstico Micológico Hongos patógenos y oportunistas mas frecuentes M.CUTÁNEASSUBCUTÁNEAS MICOSIS ENDÉMICAS M.HONGOS OPORTUNISTAS Dermatofitos Histoplasma capsulatum Levaduras Paracoccidioides brasiliensis Cryptococcus neoformans Hongos de Micetomas Coccidiodes immitis/posadasii Aspergillus spp Sporotrix shenckii Blastomyces dermatitidis Zygomycetes Penicillium marneffei P. jirovecii Otros Candida spp Trichosporon spp 1- Piel y Faneras 2- Secreciones mucosas (vaginal, bucofaríngeas) y semimucosas (glande, vulva) 3- Punción de nódulos subcutáneos 4- Biopsias y piezas quirúrgicas 5- Escarificación cutánea 6- Hemocultivos - Médula ósea 7- Orina 8- Esputo y secreciones bronquiales 9- LCR y liq. punción 10- Suero Htal Fernández Sección Microbiología 2013 Examen directo y Cultivo (tradicional) Multiplex PCR (Biol. Molecular) J.Clin.Microbiol 2007, 45:1200-1204. (diagnóstico en 5 hs de T.rubrun en uñas ) Htal Fernández Sección Microbiología 2013 Suspender tratamiento antifúngico 1 semana para tratamiento local o sistémico continuo 3- 4 semanas para tratamiento por pulsos No colocarse cremas, ni polvos Uñas: realizar baños de agua y jabón blanco los 3 días previos a la toma de muestra Concurrir con zapatos cerrados y medias de algodón No: cremas, polvos, esmaltes, ni cortarse las uñas Htal Fernández Sección Microbiología 2013 Diagnóstico Micológico TOMA DE MUESTRA DE UÑAS proximal subungueal distal subungueal Diagnóstico Micológico TOMA DE MUESTRA PIEL LAMPIÑA tomar escamas de los bordes Htal Fernández Sección Microbiología 2013 Diagnóstico Micológico TOMA DE MUESTRA Pitiriasis versicolor tomar escamas de toda la lesión Diagnóstico Micológico TOMA DE MUESTRA Cuero cabelludo Desprender con pinza y raspar la superficie del cuero cabelludo. Inflamatoria Hidróxido de potasio de 10 a 40% c/tinta Parker indeleble y glicerina 10% o Calcofluor Flamear a la llama hasta desprendimientos de burbujas. Microscópio c/10 y 40 X de aumento Coloración de Azul de Metileno o Kinyoun (Malassezia/Nocardia) Htal Fernández Sección Microbiología, 2013 OHK 40% c/tinta Parker Examen directo de uñas-piel Filamentos hialinos, artrosporados, ramificados Calcofluor Htal Fernández Sección Microbiología 2013 Examen directo de cuero cabelludo Pelo con OHK 40% c/tinta Parker Pelo microspórico (40x) Examen directo de cuero cabelludo Pelo con OHK 40% c/tinta Parker Pelo tricofítico (40x) Cultivo 1- PIEL Y FANERAS:- Medios de Cultivo Agar Sabouraud Miel Agar Lactrimell de Borelli Agar Banana/Avena/Leche Agar DTM Agar Sabouraud actidione (inhibe hongos ambientales) Agar Dixon, etc.(Malassezia) Otros Sembrar en 2 tubos, 28 ºC Incubar por 3 semanas PIEL Y FANERAS:- Medios de Cultivo Lact Sab/actid Lact Contaminantes Contaminantes dermatofitos PIEL Y FANERAS:- Medios de Cultivo Agar DTM Dermatofitos DTM levaduras Agar Sabouraud Examen con c/Azul de lactofenol (a 40x) Trichophyton mentagrophytes Macroconidias Hifas espiraladas Microconidias redondas Htal Fernández Microbiología -2013 Examen con c/Azul de lactofenol (a 40x) Trichophyton tonsurans Microconidias de tamaño variado Htal Fernández Microbiologia-2013 Examen con c/Azul de lactofenol (a 40x) Microsporum canis Macroconidias Htal Fernández Microbiología -2013 Examen con c/Azul de lactofenol Microsporum gypseum (a 40X) Macroconidias Htal Fernández Microbiología-2013 Examen con c/Azul de lactofenol Del medio Sab/actidone (a 40X) Hifas estériles de un dermatofito (sin fructificación) Htal Fernández Microbiologia -2013 Examen con c/Azul de lactofenol del medio Sabouraud con aceite de oliva: Malassezia spp (40X) Levaduras dentro de las gotas de aceite Htal Fernández Microbiologia -2013 Examen con c/Azul de lactofenol del medio Sabouraud con aceite de oliva: Malassezia spp (100X) Htal Fernández Microbiologia -2013 Diagnóstico Microbiológico Secreciones Mucosas Muestras: -Bucofarigea ó Vaginal: con hisopo en SF/Stuart -Labio,vulva ó glande: hisopo o raspado en SF. Exámen Microscópico: -Fresco -Coloración de Giemsa. Cultivo e Identificación: -Medios cromogénicos (Candida ID,Chromagar, Oxoid) -2 tubos de Sabouraud a 35-37ºC, ~ 7 días. Candida ID C. albicans C. krusei C. glabrata C. tropicalis (seca) Htal J.A.Fernández Microbiología-2013 CRHOMagar C. albicans C. tropicalis Otras Htal J.A.Fernández Microbiología-2013 Agar Cromogénico Oxoid C. dubliniensis C. albicans Agar Cromogénico Oxoid 2 especies C. krusei C. parapsilosis Aspecto y color de la colonia • Aspecto microscópico (clamidosporos, tubo • germinativo, etc) • Agar cromogénico • Fermentación y asimilación de azúcares • Pruebas bioquímicas (urea, agar opacidad, etc.) Htal J.A.Fernandez Microbiología-2013 Identificación de Levaduras Candida albicans Y C. dubliniensis Tubo germinativo: 0.3ml suero, 2-3hs Aspecto Microscópico en Agar Harina de Maíz con Tween 80 (40X) Clamidosporos Blastoconidias Blastoconidias C.albicans Aspecto Microscópico en Agar Harina de Maíz con Tween 80 (40X) Blastoconidias Clamidosporos pseudohifas C.albicans Aspecto Microscópico en Agar Harina de Maíz con Tween 80 (40X) Blastoconidias C.glabrata SIN pseudohifas Candida parapsilosis Blastoconidias Aspecto Microscópico en Agar Harina de Maíz con Tween 80 (40X) pseudohifas TOMA DE MUESTRA Asepsia- Descostrar-Bisturí- Raspar fondo 2 portaojetos y material en SF estéril (1 ml) EX. MICROSCÓPICO Fresco o Tinta china. Giemsa (hongos y citológico:Herpes - Mollusco) Ziehl Neelsen o Kinyoun (BAAR, Nocardia) CULTIVO e IDENTIFICACION 2 SAB y 2 BHI- (28 y 35ºC) 1 L.Jensen (30ºC Micobacterium marinum) Htal J.A.Fernandez Microbiología-2013 Escarificación Cutánea Microscopia: por coloración de Giemsa (100X) Histoplasma capsulatum levaduras intramacrófagos, teñidas en casquete Escarificación cutánea Histoplasma capsulatum levaduras intramacrofagos, teñidas en casquete (100x) Escarificación cutánea celulas hiperpigmentadas halo claro Mollusco contagiosum Escarificación cutánea Herpes spp (100x): células gigantes multinucleadas, compatibles con proceso viral MUESTRAS: Sacar en SF (Micología) y en formol 10%(A.Patológ) - B.micetomas: “granos” - B.nódulos (feohifomicosis y cromomicosis) - Biopsias de posibles Zigomicetes EX.MICROSCÓPICO: Si se piensa en Zigomicetes, NO MACERAR preparar improntas para: Fresco- Giemsa - ZN - Gram- KY. CULTIVO: Si se vieron en el directo: - Hifas ramificadas, gruesas y no tabicadas. NO MACERAR. Sembrar 2 BHI y 2 SAB (28 y 35ºC). - Bacilos ácido alcohol resistente, ramificados o no: T. Martin, SAB sin ATB, Agar sangre. - Actinomices: BHI en anaerobiosis (35ºC) Agar blando glucosado(35ºC) Htal Fernández Microbiología, 2013 Mucormicosis Paciente pediátrico transplantado Médula Osea Rhizomucor spp Filamento grueso sin tabiques (Gram-Neisser- 40X) Hospital Fernandez 2013 Rhizomucor spp TOMA DE MUESTRA: -Métodos automatizados, bifásicos o clásico (< tiempo, > sensibilidad con frascos específicos para algunas levaduras) -Lisis centrifugación c/saponina 5%(cc.final 0.5%)/Isolator Htal FernandezMicrobiologia 2013 En tubo estéril: Saponina 5% (concentración final 0.5%) + Polianetol sulfonato de sodio al 0.4 % ó EDTA. Adulto: 9 ml de sangre Pediátrico: 1,5-3 ml de sangre Los tubos de LC se centrifugan a 3000 r.p.m. durante 30 minutos, se descarta el sobrenadante Sembrar el sedimento: en 2 Sabouraud miel c/ATB y 2 agar BHI Incubar a 28 y 35 °C por 3 semanas. S Centrifugar 30 minutos Saponina + sangre B + S B sembrar sedimento 28°C 37°C S: Sabouraud miel c/antibioticos B: BHI agar c/ antiboticos Htal Fernández Microbiología -2013 HEMOCULTIVOS- MEDULA OSEA Técnica de elección: “Lisis Centrifugación” Es la técnica de elección para Hemocultivo cuando se sospecha hongos filamentosos (H.capsulatum, Fusarium spp) pues significativamente la recuperación y el tiempo de aislamiento (de 3 semanas a 1-2 semanas). - Wilson,J.Clin.Microbiol. 31:865/71, 1993. - Bianchi. Medical Mycology, 38: 77, 2000) - Cumitech 1C Blood Cultures IV ASM Press, 2005. (N ◦ 683) Nª aislamientos Tiempo de deteccion de Histoplasmosis por lisis centrifugacion 18 16 14 12 10 8 6 4 2 0 Histoplamosis 1 3 5 7 9 11 13 15 17 19 21 23 25 Tiempo de deteccion en dias Tiempo de detección de Criptococos según técnica de hemocultivo (n=209) 30 25 20 15 10 5 Nº de0 episodios 1 Au LC 2 3 4 5 6 7 8 9 Tiempo de detección en días EXAMEN MICROSCOPICO: Sólo en Medula ósea,del sedimento de L-centrifugación CULTIVO: LC: Sembrar el sedimento en 4-6 tubos en SAB y BHI. Incubar a 28 y 35ºC por 3-4 semanas. En pacientes con “Alimentación parenteral lipídica” agregar medios especiales para fungemias por Malassezia sp Htal FernandezMicrobiologia 2013 Toma de muestra: Igual Urocultivo Para C.neof. y P.brasil.: en hombre post-masaje prostático Examen microscópico: Fresco (Tinta china) Del Sobrenadante: - Látex para C.neoformans Cultivo e Identificación: SAB (en placa) y/o Agar Cromogénico. Recuento de colonias: ???? Diagnóstico Micológico ORINA Candiduria significativa : - En pacientes sondados, con recuento de colonias ≥ 102 ufc/ml de un patógeno predominante - Síntomas clínicos - Sedimento urinario: no siempre presenta leucocituria - Realizar el cultivo con recambio de sonda (30 % mejora) Consenso Intersociedades Manejo Inf. Tracto Urinario Septiembre 2006 Diagnóstico Micológico ORINA En pacientes sondado de UTI o UTIN: se solicita una 2da muestra con recambio de sonda, el mismo día. En pacientes de Neonatologia: se trabaja e informa la 1er muestra Punción suprapubica: se trabaja la muestra En pacientes sondados se siembra 10 y 100ul Htal J.A.Fernández Microbiología-2013 MUESTRA: Esputo seriado (3 muestras) Secreciones broqueales, LB, miniBAL,BAL EXAMEN MICROSCOPICO: Importante porque define si la muestra es representativa. Fresco y coloraciones. CULTIVOS: 2-3 tubos SAB c/ATB pero SIN actidione, 2-3 BHI, Agar Sangre y Tayer Martin INTERPRETACION e IDENTIFICACION Htal Fernández-Microbiología 2013 EXAMEN MICROSCOPICO: Fresco (40x) Filamento hialino, ramificado, dicotómico COLORACIONES: Gram-Neisser, 40x Calcofluor white Giemsa (H.capsulatum, P.marnefei, Pcp,) Kinyoun (Nocardia). Gram Wiegert, Azul Toluidina O, IFI (Pcp), Grocott Examen en fresco de biopsia pulmón con Gram- Neisser Examen en fresco (10x) de un BAL Acúmulos de P.jiroveci Examen en fresco (40x) de un BAL Acúmulos de P.jiroveci Coloración de Gram -Weigert Acúmulos de P.jiroveci Coloración de metenamina plata C.neoformans Examen en fresco con Gram - Neisser (40x) de un BAL Cryptococcus neoformans Examen en fresco Coloración de Giemsa (100X)- BAL Histoplama capsulatum Acúmulos de P.jiroveci Examen en fresco Levaduras catenuladas (40x) Levaduras en rueda de timon Aumento (40x) CULTIVO E IDENTIFICACION Aspergillus fumigatus Anverso Reverso Aspecto macroscópico de la colonia IDENTIFICACION Conidioforo: corto, pared lisa Vesicula: subglobulosa, en forma de cúpula Fialides : uniceriadas, 2/3 superior Aspergillus fumigatus MUESTRA: LCR >3ml. Centrifugar EX.MICROSCÓPICO: Tinta China del Sedimento CULTIVO: SAB-BHI a 28 y 37 ºC del Sedimento SEROLOGIA: del Sobrenadante - Latex, Elisa para C.neoformans (Ag) - Elisa y radioinmunoensayo para H.capsulatum (Ag) - CIE y Fijación de Complemento (Ac) para H.capsulatum, P.brasiliensis y C.posadasii Htal Fernandez-Microbiologia 2013 Tinta China Cryptococcus neoforman MUESTRA: Suero (LCR, orina) ANTÍGENO: - Látex, Elisa para C.neoformans, - Elisa (Galactomananos) y/o Colorimétrico (13)-- D-glucanos para Aspergillus spp - Elisa y radioinmunoensayo para H.capsulatum Anticuerpo: Inmunodifusión, CIE y Fijación de Complemento (H.capsulatum, P.brasiliensis, C.immitis/posadasii, Aspergillus fumigatus, A.niger, A.flavus) DETECCIÓN DE METABOLITOS: Mananos y Enolasa TÉCNICAS MOLECULARES: PCR, PCR Real-Time, etc. Espectrometría de masa (Malditof)