Cinética y Control de Sistemas Multienzimáticos
Anuncio

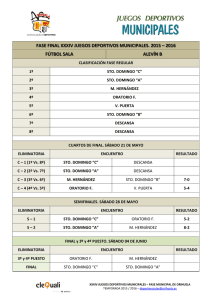
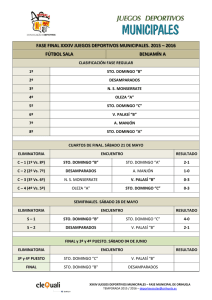
Cinética y Control de Sistemas Multienzimáticos Luis Acerenza Laboratorio de Biología de Sistemas Facultad de Ciencias Universidad de la República Montevideo, Uruguay aceren@fcien.edu.uy Cinética de las enzimas aisladas Descripción cinética tradicional • Leyes de velocidad ........ (v) Modelo de Michaelis-Menten irreversible Reacción: Mecanismo: Ley de velocidad: S E → P S+E← → C → P + E v = Vmax S KM + S Caso I: v = velocidad inicial, S = Stotal (in vitro) Caso II: v = velocidad instantánea, S = Slibre (in situ) Modelo de Hill irreversible Reacción: Ley de velocidad: S E → P v = Vmax Sn n n K 0.5 + S Relevante como ecuación empírica de ajuste de datos sobre cinéticas cooperativos Modelo de Michaelis-Menten reversible Reacción: Mecanismo: Ley de velocidad: S E ←→ P S+E← → C ← → P + E v= (VS K S ) (S − P K eq ) 1 + S KS + P KP Modelo mínimo para describir cinéticas in situ (v = velocidad instantánea, S = Slibre , P=Plibre) Cinética de sistemas bienzimáticos Sistema bienzimático X E1 → S Sustrato Producto • Parámetros (p): X, S, E1. • Variable: v1. X E2 → Y S Sustrato Producto • Parámetros (p): S, Y, E2. • Variable: v2. E1 → S E2 → Y • Parámetros (p): X, Y, E1, E2. • Variables: S, J. Cursos temporales (análisis numérico) v1 = (VS1 K S 1 ) (X − S K eq1 ) 1 + X K S 1 + S K P1 v2 = Software: COPASI (VS 2 K S 2 ) (S − Y K eq 2 ) 1 + S K S 2 + Y K P2 Cursos temporales (análisis simbólico) v1 = v1 ( X , S , E1 ) v1 = (VS1 K S1 ) (X − S K eq1 ) 1 + X K S 1 + S K P1 v 2 = v 2 (S ,Y , E 2 ) v2 = (VS 2 K S 2 ) (S − Y K eq 2 ) 1 + S K S 2 + Y K P2 v1 = (VS 1 K S 1 ) (X − S K eq1 ) v2 = (VS 2 K S 2 ) (S − Y K eq 2 ) v1 = V1 (X − S K eq1 ) v 2 = V2 (S − Y K eq 2 ) Ecuación diferencial dS = v1 ( X , S , E1 ) − v 2 (S ,Y , E 2 ) dt v1 = V1 (X − S K eq1 ) v 2 = V2 (S − Y K eq 2 ) dS = −α S + β dt V1 + V2 α= K eq1 V2 Y β = V1 X + K eq 2 Estado Estacionario dS =0 dt ⇒ β S ee = α Curso temporal S (t ) = (S 0 − S ee ) e −α t + S ee S (0 ) = S 0 Flujos J 1 (t ) = V1 (X − S (t ) K eq1 ) J ee1 = V1 (X − S ee K eq1 ) J ee1 = J ee 2 ≡ J ee J 2 (t ) = V2 (S (t ) − Y K eq 2 ) J ee 2 = V2 (S ee − Y K eq 2 ) J ee X − Y K e1 K e 2 = 1 1 + V1 V2 K e1 Ejemplo numérico Valores de los parámetros: V1 = 1, V2 = 1 α = 4/3 X = 3, Y = 1 β=4 ⇒ Ke1 = 3, Ke2 = 1 See = 3 S0 = 0, 1, 2, 3, 4, 5, 6 Jee = 2 S vs. t 6 5 4 S 3 2 1 0 1 2 3 tiempo X E1 → S E2 → Y J1 vs. t 6 5 4 3 J1 2 1 0 -1 1 2 3 tiempo X E1 → S E2 → Y J2 vs. t 5 4 3 J2 2 1 0 -1 1 2 3 tiempo X E1 → S E2 → Y Control del flujo: Jee vs. Ei (análisis numérico) v1 = (VS1 K S1 ) (X − S K eq1 ) 1 + X K S 1 + S K P1 v2 = (VS 2 Software: COPASI K S 2 ) (S − Y K eq 2 ) 1 + S K S 2 + Y K P2 Control del flujo: Jee vs. Ei (análisis simbólico) J ee X − Y K eq1 K eq 2 = 1 1 + V1 V2 K eq1 k cat1 V1 = E1 K S1 k cat 2 V2 = E2 KS2 Control por concentración de enzimas: (I) V1 >> V2 Keq1 (II) V1 << V2 Keq1 (III) V1 ≈VK 2 eq1 ⇒ ∝ E2 ⇒ Jee ∝ E1 ⇒ Jee y Jee es independiente de E1 y Jee es independiente de E2 E1 y E2 afectan a Jee (menos que ¿Cuál es la enzima limitante? ∝) Enzima limitante Enzima que, al cambiar su concentración, produce un cambio proporcional en el flujo Análisis del Control Metabólico Descripción cinética alternativa • Coeficientes de elasticidad ..... (ε) Coeficientes de elasticidad ε ε v V max v S S ∂v = v ∂S V max ∂ v = v ∂ V max ε ε v P P ∂v = v ∂P ET ∂ v = v ∂E T v ET Cinéticas normales: ε Sv ≥ 0 ε Pv ≤ 0 ε Av ≥ 0 ε Iv ≤ 0 ε Ev = 1 T Coeficientes de elasticidad (sensibilidad de las velocidades aisladas) ε Sv = lim δ S →0 δv v ≈ pequeño cambio relativo en v δ S pequeño cambio relativo en S S Modelo de Michaelis-Menten irreversible KM ε = KM + S v S v P ε =0 ∈ (0,1) Modelo de Michaelis-Menten reversible S KS 1 ε = − 1 − P S K eq 1 + S K S + P K P v S v P ε = v S − P S K eq 1 − P S K eq v P ε +ε = P KP − 1+ S KS + P KP 1 1+ S KS + P KP ∈ ∈ (0,+∞ ) ∈ (− ∞ ,0) (0,1) Recordar X Sistema bienzimático (v) E1 → S Sustrato Producto • Parámetros (p): X, S, E1. • Variable: v1. X E2 → Y S Sustrato Producto • Parámetros (p): S, Y, E2. • Variable: v2. E1 → S E2 → Y • Parámetros (p): X, Y, E1, E2. • Variables: S, J. Sistema bienzimático (εε) X E1 → S Sustrato Producto v1 = v1 ( X , S , E1 ) E2 → Y S Sustrato Producto v 2 = v 2 (S ,Y , E 2 ) (v1 ∝ E1 ) ε Ev = 1 (v2 ∝ E 2 ) ε Ev = 0 (v1 independiente E 2 ) ε Ev = 0 (v2 independiente E1 ) ε Sv < 0 ε Sv > 0 ε Ev = 1 1 1 2 2 1 2 1 2 1 2 X E1 → S S ee = S ee ( X ,Y , E1 , E 2 ) E2 → Y J ee = J ee ( X ,Y , E1 , E 2 ) Coeficientes de Control (sensibilidad de las variables del sistema) Y=JoS E = [enzima] δY Y ≈ pequeño cambio relativo en Y δ E pequeño cambio relativo en E E C EY = lim δ E →0 E ∂S C = S ∂E S E E ∂J C = J ∂E J E Coeficientes de control C S Ek Ek ∂ S = S ∂E k C C J E1 = = ε Ek ∂ J = J ∂E k ε Ev = δ i k i Como: S E1 C J Ek k v2 S 1 − ε Sv1 ε Sv −1 = v2 ε S − ε Sv1 C EJ2 − ε Sv1 = v2 ε S − ε Sv1 C 2 ε Sv − ε Sv 2 S E2 1 Relaciones de sumación • Sumación de concentración: C ES1 + C ES2 = 0 • Sumación de flujo: J E1 C +C J E2 =1 Definición de etapa limitante de velocidad (en el marco del ACM) Ek es limitante si su cambio produce un cambio proporcional en el flujo C J Ek ≡1 Enzima limitante en sistema bienzimático ε Cinéticas “normales”: C ES1 > 0 C ES2 < 0 v1 S < 0 0 < C EJ1 < 1 J E1 J E2 1.0 0.7 0.0 0. 3 0.5 0.0 0.5 1.0 C +C ε y v2 S >0 0 < C EJ2 < 1 =1 E1 es limitante E2 es limitante Control del flujo: MCA (análisis numérico) v1 = (VS1 K S1 ) (X − S K eq1 ) 1 + X K S 1 + S K P1 v2 = (VS 2 Software: COPASI K S 2 ) (S − Y K eq 2 ) 1 + S K S 2 + Y K P2 Efecto amortiguador del metabolismo C EJ11 < ε Ev11 = 1 → S i C EJ22 < ε Ev22 = 1 Ei → S i +1 → Al aumentar Ei : 1) aumenta inmediatemente Ji (t=0) 2) decrece paulatinamente Si lo que hace decrecer Ji 3) aumenta paulatinamente Si+1 lo que hace decrecer Ji Conclusión: La mayor parte del aumento inicial, al llegar al estado estacionario, es amortiguado Teoremas de Sumación (N pasos) • Sumación de concentración: N ∑C S Ek k =1 • Sumación de flujo: N ∑C k =1 J Ek =1 =0 Sumación de flujo (consequencia) N ∑C k =1 C J Ek J Ek =1 ⇒ C J Ek 1 = N es el valor promedio de los coeficientes Representación modular de sistemas enzimáticos estacionarios E S P C S P E Análisis Modular del Control Metabólico para Grandes Cambios MMCA Proceso de interés vmódulo 1 s vmódulo 2 Coefficients for large changes Infinitesimal changes var = lim C par δ par →0 ε Sv = lim δ S →0 δ var var δ par par δv v δS S Large changes var C par = δ var var δ par par δv v ε Sv = δS S System properties as a function of module properties vmodule 1 1 C = v2 ε S − r1 ε Sv1 S v1 J v1 C = ε Sv 2 v2 S ε − r1 ε v1 S 1 ε Sv 2 (rS − 1) + 1 r1 = = v1 r2 ε S (rS − 1) + 1 vmodule 2 s C S v2 − r1 = v2 ε S − r1 ε Sv1 C J v2 − r1 ε Sv1 = v2 ε S − r1 ε Sv1 rS = S x S o o = reference state x = final state Summation and response relationships S v1 J v1 C J v2 C +C =1 • Flux summation: • Response: S v2 C + C = 1 − rS • Concentration summation: S par S v =C ε v par C J par J v =C ε v par Experimental case Control of glycolytic flux and biomass production in Lactococcus lactis vmodule 1 S o = 9.7 s vmodule 2 S S o ∈ (0.49, 1) [ ATP ] S= [ ADP] v1 (S ) v2 (S ) ε Sv1 ε Sv 2 Infinitesimal Control Coefficients (at the reference state): CvJ1 = 0.80 CvJ2 = 0.20 r ∈ (0.72, 1.38) Koebmann et al. (2002) Appl. Environ. Microbiol. 68, 4274-4282 r Estimation (I) of flux increase (constant control coefficients): CvJ1 = 0.80 CvJ2 = 0.20 r ∈ (0.72, 1.38) 0.8 (1.38-1) x 100 = 30% Estimation (II) of flux increase (non-saturable kinetics): CvJ1 = 0.80 CvJ2 = 0.20 (1/(1-0.8 (1-1/1.38))-1) x 100 = 28% r ∈ (0.72, 1.38) Infinitesimal analysis predicts 28-30% increase in flux by increasing the activity of module 1 Large changes flux control coefficients Flux control drops when activity increases Acerenza & Ortega (2007) FEBS J. 274, 188-201 Conclusions with MCA for large changes 1) For each module, the control decreases rather abruptly when increasing its own activity 2) Increasing the activity of module 1 (having the highest control), we only obtain 4% increase in flux, while estimations with infinitesimal analysis predict 28-30% increase. 3) The flux can not be increased by a high factor changing the activity of a single module. Answer given by Modular MCA for large responses To obtain a large increase in flux it may be necessary to change the activity of more than one module Difficulty: What enzyme activities do we have to change and by how much? El Método Universal Kacser H & Acerenza L (1993) A universal method for achieving increases in metabolite production. Eur. J. Biochem. 216, 361-367 Acerenza L (2000) On the universality of the universal method in Technological and Medical Implications of Metabolic Control Analysis (eds. A. Cornish-Bowden y M. L. Cárdenas), pp. 33-37, Kluwer Academic Publishers, Dordrecht. G J2 J1 N S J3 ∆J ∆ J3 = ∆ J ∆J2 = 0 r3 = E3y /E3x = 1+ ∆ J/J3x ∆ J1 = ∆ J P ∆S = 0 & r1 = E1y /E1x = 1+ ∆ J/J1x Extension: modular MCA for large responses in branched systems vmodule 1 s vmodule 2 vmodule 3 Ortega & Acerenza (2011) FEBS J 278, 2565-2578 ( ) C vS1 = 1 + ε Sv1 (rS − 1) den ( ) CvS2 = − α 1 + ε Sv2 (rS − 1) den ( r1 = ) C vS3 = − ( 1 − α ) 1 + ε Sv3 (rS − 1) den ( ) (1 + ε − 1)) den CvJ11 = α ε Sv2 + ( 1 − α ) ε Sv3 ( C vJ21 = − α ε Sv1 1 + ε Sv2 (rS C J1 v3 = − (1 − α ) ε (1 + ε v1 S ( (rS v1 S v3 S (rS ( 2 ) r2 = 1 1 3 3 1 ( α 1 + ε Sv (rS 2 2 1 2 1 r3 2 3 3 3 1 2 S (1 − α ) + (ε Sv − α ε Sv ) (rS − 1) = (1 − α ) (1 + ε Sv (rS − 1)) 2 3 ) (r − 1) − 1)) 3 3 2 3 ( α + ε Sv − (1 − α ) ε Sv den 3 3 − 1) ) (rS − 1 )) CvJ = − ( 1 − α ) ε Sv (1 + ε Sv (rS − 1 )) den C vJ = ε Sv (1 + ε Sv (rS − 1 )) den C vJ = − α ε Sv (1 + ε Sv (rS − 1)) den C vJ = (− ε Sv + α ε Sv ) (1 + ε Sv (rS − 1)) den den = − ε Sv + α ε Sv + (1 − α )ε Sv v2 S S 1 + ε Sv1 (rS − 1) C vJ12 = ε Sv2 1 + ε Sv1 (rS − 1) den CvJ22 = − ε Sv1 + ( 1 − α ) ε Sv3 ) (r − 1) den − 1 ) den ) ) (1 + ε ( 1 + α ε Sv2 + ( 1 − α )ε Sv3 3 α = J 2o J 1o