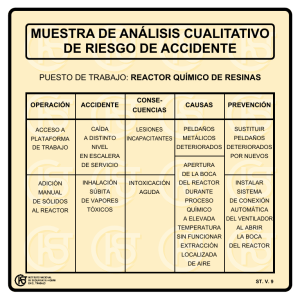
Procesos biológicos unitarios
Anuncio

Procesos bioló gicos unitarios Metcalf & Eddy En la mayoría de los casos, con un análisis y control adecuados del entorno, es posible tratar por vía biológica la práctica totalidad de las aguas residuales. Por lo tanto, es necesario que el ingeniero sanitario conozca perfectamente el funcionamiento y las características de cada uno de los procesos de tratamiento biológico, a fin de que pueda asegurar el control y adecuación del medio ambiente al proceso de tratamiento escogido. Teniendo en cuenta la importancia del tratamiento biológico, en este capítulo se pretende: (1) presentar una panorámica general del tratamiento biológico de las aguas residuales; (2) hacer una introducción de los aspectos importantes relacionados con el metabolismo microbiano; (3) hacer una introducción de los principales organismos responsables del tratamiento de las aguas residuales; (4) repasar y discutir los factores clave que intervienen en el crecimiento biológico y en la cinética del tratamiento de aguas residuales, y (5) ilustrar la aplicación de los principios básicos y de la cinética al análisis de los procesos biológicos más comúnmente empleados en el tratamiento del agua residual. La eliminación biológica de nutrientes y las técnicas de lagunaje se analizan en secciones diferentes. La información contenida en este capítulo proporciona las bases para el proyecto de los procesos de tratamiento biológicos discutidos en los Capítulos 10 a 12. 8.1 PANORÁMICA GENERAL DEL TRATAMIENTO BIOLÓGICO DEL AGUA RESIDUAL Para proporcionar el material necesario para abordar el resto de los temas que se van a tratar en este capítulo, en primer lugar se analizan los objetivos del tratamiento biológico del agua residual y el papel de los microorganismos en el mismo. Objetivos del tratamiento biológico Los objetivos del tratamiento biológico del agua residual son la coagulación y eliminación de los sólidos coloidales no sedimentables y la estabilización de la materia orgánica. En el caso del agua residual doméstica, el principal objetivo es la reducción de la materia orgánica presente y, en muchos casos, la eliminación de nutrientes como el nitrógeno y el fósforo. A menudo, la eliminación de compuestos a nivel de traza que puedan resultar tóxicos, también constituye un objetivo de tratamiento importante. En el caso de las aguas de retorno de usos agrícolas, el principal objetivo es la eliminación de los nutrientes que puedan favorecer el crecimiento de plantas acuáticas, como el nitrógeno y el fósforo. En el caso de aguas residuales industriales, el principal objetivo es la reducción de la concentración de compuestos tanto orgánicos como inorgánicos. A menudo, puede ser necesario llevar a cabo un pretratamiento previo, debido a la potencial toxicidad de estos compuestos para los microorganismos. Papel de los microorganismos La eliminación de la DBO carbonosa, la coagulación de los sólidos coloidales no sedimentables, y la estabilización de la materia orgánica se consiguen, biológicamente, gracias a la acción de una variedad de microorganismos, principalmente bacterias. Los microorganismos se utilizan para convertir la materia orgánica carbonosa coloidal y disuelta en diferentes gases y tejido celular. Dado que el tejido celular tiene un peso específico ligeramente superior al del agua, se puede eliminar por decantación. Es importante señalar que, salvo que se separe de la solución el tejido celular que se produce a partir de la materia orgánica, no se alcanzará un tratamiento completo. Ello es debido a que el tejido celular, que es de naturaleza orgánica, aparecerá como parte de la medida de la DBO del efluente. Si no se separa el tejido celular, el único tratamiento que se habrá llevado a cabo es el asociado con la conversión bacteriana de una fracción de la materia orgánica presente originalmente en diversos productos gaseosos finales. 8.2 INTRODUCCIÓN AL METABOLISMO MICROBIANO La comprensión de las actividades bioquímicas de los microorganismos importantes es básica en el proyecto del tratamiento biológico y en la elección de los procesos que forman parte de él. Los dos temas principales que se estudian en este apartado son: (1) las necesidades nutritivas generales de los microorganismos habitualmente presentes en el tratamiento del agua residual, y (2) la naturaleza del metabolismo microbiano, en función de la necesidad de oxígeno molecular. Necesidades nutritivas para el crecimiento microbiano Para poder reproducirse y funcionar de manera correcta, un organismo necesita: (1) una fuente de energía; (2) carbono para la síntesis de materia celular nueva, y (3) elementos inorgánicos (nutrientes) tales como nitrógeno, fósforo, azufre, potasio, calcio y magnesio. Los nutrientes orgánicos (factores de crecimiento) también pueden ser necesarios para la síntesis celular. En el siguiente apartado se trata de las necesidades de fuentes de carbono y de energía, normalmente conocidas como substratos, de nutrientes y de factores de crecimiento para los diferentes tipos de organismos. Fuentes de energía y de carbono. La materia orgánica y el dióxido de carbono son dos de las principales fuentes de carbono celular para los microorganismos. Los organismos que utilizan el carbono orgánico para la formación de tejido celular se denominan heterótrofos. Los organismos que obtienen carbono celular a partir del dióxido de carbono reciben el nombre de organismos autótrofos. El proceso de conversión del dióxido de carbono a tejido celular orgánico es un proceso reductivo que precisa un suministro neto de energía. Por lo tanto, los organismos autótrofos deben emplear una parte mayor de su energía para la síntesis de tejido celular que los organismos heterótrofos, lo cual comporta unas tasas de crecimiento menores que las de éstos. La energía necesaria para la síntesis celular se obtiene de la luz o bien de las reacciones químicas de oxidación. Los organismos capaces de utilizar la luz como fuente de energía reciben el nombre de organismos fotótrofos. Estos organismos pueden ser heterótrofos (algunas bacterias sulfurosas) o autótrofos (algas y bacterias fotosintéticas). Los organismos que obtienen la energía a partir de reacciones químicas se conocen como organismos quimiótrofos. Al igual que en el caso de los fotótrofos, los organismos quimiótrofos también pueden ser heterótrofos (protozoos, hongos y la mayoría de las bacterias) o autótrofos (bacterias nitrificantes). Los organismos quimioautótrofos consiguen la energía a partir de la oxidación de compuestos inorgánicos reducidos tales como el amoniaco, el nitrito y el sulfuro. Los organismos quimioheterótrofos suelen obtener la energía mediante la oxidación de compuestos orgánicos. En la Tabla 8-1 se resume la clasificación de los microorganismos en base a las fuentes de energía y carbono celular. En las Figuras 8-1 a 8-3 se esquematizan los mecanismos típicos de metabolismo bacteriano. Necesidades de nutrientes y de factores de crecimiento. En ocasiones, los nutrientes pueden condicionar y limitar, en mayor medida que el carbono y la energía, la síntesis celular y el crecimiento bacteriano. Los principales nutrientes inorgánicos necesarios para los microorganismos son: N, S, P, K, Mg, Ca, Fe, Na, y Cl, mientras que entre los nutrientes de menor importancia se hallan el Zn, Mn, Mo, Se, Co, Cu, Ni, V y W [34]. TABLA 8-1 Clasificación general de los microorganismos atendiendo a sus fuentes de energía y de carbonoa a Adaptado de la bibliografía [34] FIGURA 8-1 Esquema del metabolismo bacteriano quimioheterótrofo. Al margen de los nutrientes inorgánicos que se acaban de citar, algunos microorganismos pueden necesitar también algunos nutrientes orgánicos. Los nutrientes orgánicos, conocidos como «factores de crecimiento», son compuestos que necesitan los organismos como precursores o constituyentes para la síntesis de materia celular orgánica que no se puede obtener a partir de otras fuentes de carbono. A pesar de que los factores de crecimiento varían de un organismo a otro, los principales factores de crecimiento se pueden dividir en las siguientes tres clases: (1) aminoácidos; (2) purinas y pirimidinas, y (3) vitaminas [34]. La nutrición bacteriana y los procesos de tratamiento biológicos. El principal objetivo de la mayoría de los procesos de tratamiento biológico es la reducción del contenido de materia orgánica (DBO carbonosa) del agua residual. Para conseguir este objetivo, son de gran importancia los organismos quimioheterótrofos, pues además de energía y carbono, también necesitan compuestos orgánicos. Cuando los objetivos del tratamiento incluyan la conversión de amoníaco en nitrato, son de gran importancia las bacterias nitrificantes quimioheterótrofas. Las aguas residuales municipales suelen contener cantidades de nutrientes (tanto orgánicos como inorgánicos) adecuadas para permitir el tratamiento biológico para la eliminación de la DBO carbonosa. No obstante, en aguas residuales de origen industrial, puede ocurrir que no exista suficiente presencia de nutrientes. En tales casos, es necesario añadir nutrientes para permitir el adecuado crecimiento bacteriano y la consiguiente degradación de los residuos orgánicos. FIGURA 8-2 Esquema del metabolismo bacteriano quimioautótrofo. FIGURA 8-3 Esquema del metabolismo bacteriano fotoautótrofo. Tipos de metabolismos microbianos Dentro de las organismos quimioheterótrofos, se puede realizar una nueva clasificación atendiendo a las características de su metabolismo y a sus necesidades de oxígeno molecular. Los organismos que generan energía por transporte de electrones mediante enzimas desde un donante de electrones hasta un aceptor de electrones exterior tienen un metabolismo respiratorio. En cambio, el metabolismo fermentativo no incluye la participación de un aceptor exterior. La fermentación es un proceso de producción de energía menos eficiente que la respiración; como consecuencia de ello, los organismos heterótrofos estrictamente fermentativos se caracterizan por tasas de crecimiento y de producción celular menores que las de los organismos heterótrofos respiratorios. Cuando el oxigeno molecular actúa como aceptor de electrones en los metabolismos respiratorios, el proceso recibe el nombre de respiración aerobia. Los organismos que se basan en la respiración aerobia para satisfacer sus necesidades energéticas sólo pueden sobrevivir si existe una aportación suficiente de oxígeno molecular. Estos organismos reciben el nombre de organismos aerobios obligados. Algunos compuestos inorgánicos oxidados tales como el nitrato o el nitrito, pueden hacer las funciones de aceptores de electrones para ciertos organismos respiratorios en ausencia de oxígeno molecular (véase Tabla 8-2). En la ingeniería ambiental, los procesos en que intervienen estos organismos reciben el nombre de procesos anóxicos. TABLA 8-2 Aceptores presentes de electrones en en las reacciones el bacterianas agua normalmente residual a También conocida corno desnitriricación anóxica Los organismos que generan energía por fermentación y sólo pueden existir en un medio en ausencia de oxigeno, se denominan anaerobios obligados. Los organismos que generan energía por fermentación y que tienen la capacidad de crecer, tanto en presencia como en ausencia de oxigeno molecular, reciben el nombre de organismos anaerobios facultativos, y se pueden clasificar en dos grupos, atendiendo a sus posibilidades metabólicas. Los organismos anaerobios facultativos puros pueden cambiar de metabolismo fermentativo a respiratorio, dependiendo de la presencia o ausencia de oxigeno molecular. Los organismos anaerobios aerotolerantes tienen un metabolismo estrictamente fermentativo, pero son relativamente insensibles a la presencia de oxigeno molecular. 8.3 MICROORGANISMOS IMPORTANTES BIOLÓGICO DEL AGUA RESIDUAL EN EL TRATAMIENTO Los microorganismos se suelen clasificar, según su estructura y funcionamiento celular, en eucariotas, eubacterias y arqueobacterias, tal y como se muestra en la Tabla 3-11. Los grupos procariotas (eubacterias y arqueobacterias) suelen denominarse simplemente bacterias, y son primordiales en el tratamiento biológico. El grupo de las eucariotas incluye las plantas, animales y las protistas. Los organismos eucariotas importantes en el tratamiento biológico de las aguas residuales incluyen (1) los hongos, (2) los protozoos y los rotíferos, y (3) las algas. Bacterias Las bacterias son organismos procariotas unicelulares. Su modo habitual de reproducción es por escisión binaria, aunque algunas especies se reproducen sexualmente o por gemación. Si bien existen miles de especies diferentes de bacterias, su forma general encaja dentro de alguna de las tres siguientes categorías: esféricas, cilíndricas y helicoidales. El tamaño de las bacterias es muy variable. Los tamaños representativos son de 0,5 a 1 micra de diámetro para las bacterias esféricas, entre 0,5 y 1 micra de anchura por 1,5 a 3 micras de longitud para las cilíndricas (bastoncillos), y entre 0,5 y 5 micras de anchura por 6 a 15 micras de longitud en el caso de bacterias helicoidales (espirales). Estructura celular. En general, la mayoría de las células bacterianas son bastante parecidas (véase Fig. 8-4). Como se puede apreciar en la Figura 8-4, el interior de la célula, que recibe el nombre de citoplasma, contiene una suspensión coloidal de proteínas, carbohidratos, y otros compuestos orgánicos complejos. La región citoplasmática contiene ácido ribonucleico (ARN), cuya principal misión es la síntesis de proteínas. Asimismo, en el citoplasma, se halla la región del núcleo, rica en ácido desoxirribonucleico (ADN). El ADN contiene toda la información necesaria para la reproducción de la totalidad de los componentes de la célula y se puede considerar como la base de la célula. FIGURA Esquema general de una célula bacteriana [31]. 8-4 Composición celular. Diferentes ensayos realizados sobre una variedad de bacterias indican que su composición básica es del 80 por 100 de agua y el 20 por 100 de materia seca, de la que el 90 por 100 es materia orgánica y el 10 por 100 inorgánica. En la Tabla 8-3 se facilitan los datos típicos de la composición de las células bacterianas. Una fórmula que permite describir, de manera aproximada, su fracción orgánica es C5H7O2N [16]. Como la propia fórmula indica, el 53 por 100 en peso de la fracción orgánica es carbono. Cuando también se considera la presencia de fósforo, se puede emplear la formulación C60H87O23N12P. Los compuestos que forman parte de la fracción inorgánica incluyen: P2O5 (50%), SO3 (15 %), Na2O (11 %), CaO (9%). MgO (8%), K2O (6 %) y Fe2O3 (1 %). Puesto que todos estos elementos y compuestos deben proceder del medio ambiente en el que se desarrolla la célula, la falta de cualquiera de ellos limitará el crecimiento celular y, en algunos casos, será responsable de sus alteraciones. TABLA 8- Composición a típica de las células bacterianasa Adaptado de la bibliografía [12, 34 y 35]. Necesidades medioambientales. Las condiciones ambientales de temperatura y de pH tienen un papel importante en la supervivencia y crecimiento de las bacterias. A pesar de que las bacterias pueden sobrevivir en un intervalo bastante amplio de valores de la temperatura y del pH, el crecimiento óptimo se suele producir en un intervalo muy restringido de valores de estos dos parámetros. Las temperaturas por debajo de la óptima tienen efectos más importantes sobre el crecimiento bacteriano que las superiores a aquélla; se ha podido comprobar que las tasas de crecimiento se doblan por cada aumento de 10ºC de la temperatura hasta alcanzar el valor óptimo. Según el intervalo de temperatura en el que el desarrollo bacteriano es óptimo, las bacterias se pueden clasificar en psicrófilas, mesólilas y termófilas. Los intervalos de temperatura óptima típicos para las bacterias de estas tres categorías señaladas están indicados en la Tabla 8-4. Para información más detallada de los organismos en los diferentes intervalos de temperatura consúltese la bibliografía incluida al final del capitulo L13-15, 34]. El pH del medio ambiente también constituye un factor clave en el creci-miento de los organismos. La mayoría de las bacterias no toleran niveles de pH por debajo de 4,0 ni superiores a 9,5. En general, el pH óptimo para el crecimiento bacteriano se sitúa entre 6,5 y 7,5. TABLA Intervalos a de temperatura También llamadas criófilas. típicos para algunas 8-4 bacterias Hongos Se considera que los hongos importantes en ingeniería sanitaria son protistas heterótrofas, no fotosintéticas y multicelulares. Los hongos se suelen clasificar en función de su modo de reproducción. Se pueden reproducir sexual o asexualmente, por escisión, gemación, o por formación de esporas. Los mohos u «hongos verdaderos» producen unidades microscópicas (hifas), que colectivamente forman una masa filamentosa llamada micelio. Las levaduras son hongos que no tienen la capacidad de formar micelio, razón por la cual son unicelulares. La mayoría de los hongos son aerobios estrictos. Pueden crecer con muy poca humedad y toleran ambientes con pH relativamente bajos. El pH óptimo para la mayoría de las especies es 5,6, mientras que el intervalo de tolerancia se sitúa entre 2 y 9. Los hongos tienen una baja demanda de nitrógeno, sólo necesitan, aproximadamente, la mitad que las bacterias. La capacidad de los hongos para sobrevivir en condiciones pH bajos y escasa disponibilidad de nitrógeno los convierte en organismos de gran importancia en el tratamiento de aguas residuales de origen industrial y en la formación de compuestos a partir de residuos sólidos orgánicos. Protozoos y rotíferos Los protozoos son protistas móviles microscópicas y, por lo general, unicelulares. La mayoría de los protozoos son heterótrofos aerobios, aunque algunos son anaerobios. Los protozoos suelen ser mayores que las bacterias, y se suelen alimentar de ellas para la obtención de energía. De hecho, al consumir bacterias y materia orgánica, los protozoos actúan como purificadores de los efluentes de procesos biológicos de tratamiento de aguas residuales. El rotífero es un animal aerobio, heterótrofo y multicelular. Su nombre procede del hecho de que disponen de dos juegos de pestañas giratorias sobre la cabeza, que emplean para la captura de alimentos y para moverse. Los rotíferos son muy eficaces en la eliminación de bacterias dispersas y floculadas, así como de pequeñas partículas de materia orgánica. Su presencia en un efluente indica un proceso aerobio de purificación biológica muy eficiente. Algas Las algas son protistas unicelulares o multicelulares, autótrofas y fotosintéticas. Su importancia en los procesos de tratamiento biológico estriba en dos hechos. En lagunas de estabilización, la capacidad de las algas para generar oxígeno por fotosíntesis es vital para la ecología del medio ambiente acuático. Para que una laguna de oxidación aerobia o facultativa funcione adecuadamente, la presencia de algas es necesaria para suministrar el oxígeno a las bacterias heterótrofas aerobias. Esta relación simbiótica entre las bacterias y las algas se analizará con mayor detalle en la Sección 8.12, que trata de las lagunas de oxidación aerobias y facultativas. Las algas también son, asimismo, importantes en los procesos de tratamiento biológico porque el problema de la prevención del crecimiento excesivo de algas en los cuerpos de agua receptores se ha centrado, hasta la fecha, en la eliminación de nutrientes en los procesos de tratamiento. Algunos científicos abogan por la eliminación del nitrógeno en los efluentes de las plantas de tratamiento; otros recomiendan la eliminación del fósforo; y un tercer grupo recomienda la eliminación de ambos constituyentes. Los objetivos del tratamiento condicionan el tipo de proceso biológico que hay que seleccionar. 8.4 CRECIMIENTO BACTERIANO El control efectivo del medio ambiente en que se desarrolla el tratamiento biológico del agua residual se basa en la comprensión de los principios fundamentales que rigen el crecimiento de los microorganismos. El siguiente apartado trata del crecimiento de las bacterias, los organismos de mayor importancia en el tratamiento biológico. Características principales del crecimiento en cultivos puros Como se ha indicado anteriormente, las bacterias se pueden reproducir por fisión binaria, sexualmente o por gemación. Por lo general, se reproducen por fisión binaria, es decir, por división; la célula original se transforma en dos nuevos organismos. El tiempo necesario para cada fisión, que recibe el nombre de tiempo de generación, puede variar entre días y menos de 20 minutos. Por ejemplo, si el tiempo de generación es de 30 minutos, una bacteria producirá 16.777.216 bacterias después de un periodo de 12 h. Esta es una cifra hipotética, puesto que las bacterias no continúan dividiéndose indefinidamente a causa de diversas limitaciones ambientales, tales como la concentración del substrato, la concentración de nutrientes, e incluso el tamaño del sistema. Crecimiento en términos de número de bacterias. La forma general en que se produce el crecimiento de las bacterias en un cultivo discontinuo se ilustra en la Figura 8-5. Inicialmente, se inocula un pequeño número de organismos en un volumen determinado de un medio de cultivo y se registra el número de organismos viables en función del tiempo. El modelo de crecimiento basado en el número de células consta, más o menos, de cuatro fases diferenciadas: FIGURA Curva de crecimiento bacteriano típica, en términos de número de bacterias. 8-5 1. Fase de retardo. Tras la adición de un inóculo a un medio de cultivo, la fase de retardo representa el tiempo necesario para que los organismos se aclimaten a las nuevas condiciones ambientales y comiencen a dividirse. 2. Fase de crecimiento exponencial. Durante esta fase, la célula se divide a una velocidad determinada por su tiempo de generación y su capacidad de procesar alimento (tasa constante de crecimiento porcentual). 3. Fase estacionaria. En esta fase, la población permanece constante. Las razones que se apuntan para la explicación de este fenómeno son las siguientes: (a) las células han agotado el substrato o los nutrientes necesarios para el crecimiento, y (b) la generación de células nuevas se compensa con la muerte de células viejas. 4. Fase de muerte exponencial. Durante esta fase, la tasa de mortalidad de bacterias excede la de generación de células nuevas. La tasa de mortalidad suele ser función de la población viable y de las características ambientales. En algunos casos, la fase de muerte exponencial se corresponde con la inversa de la fase de crecimiento exponencial. Crecimiento en términos de masa de bacterias. El modelo de crecimiento también se puede abordar estudiando la variación con el tiempo de la masa de microorganismos. En este modelo de crecimiento también se pueden diferenciar cuatro fases. 1. Fase de retardo. De nuevo, las bacterias precisan de cierto tiempo para aclimatarse al nuevo medio. Cuando se aborda el estudio en términos de masa de bacterias, la fase de retardo no es tan larga como en el enfoque en función del número de bacterias, debido a que la masa de bacterias empieza a aumentar antes de que se produzca la división celular. 2. Fase de crecimiento exponencial. Siempre existe una cantidad en exceso de alimento alrededor de los microorganismos; la tasa de metabolismo y crecimiento sólo es función de la capacidad de los organismos para procesar el substrato. 3. Fase de crecimiento decreciente. La tasa de crecimiento, y en consecuencia la masa de bacterias, disminuyen como consecuencia de la limitada disponibilidad de alimento. 4. Fase endógena. Los microorganismos se ven forzados a metabolizar su propio protoplasma sin reposición del mismo, ya que la concentración de alimento disponible se encuentra al mínimo. Durante esta fase, se puede presentar el fenómeno conocido con el nombre de lisis, según el cual los nutrientes que quedan en las células muertas se difunden en el medio proporcionando alimento a las células vivas existentes («crecimiento críptico»). Crecimiento en cultivos mixtos Es importante observar que la anterior discusión se refiere a una única población de microorganismos. En general, los procesos de tratamiento biológico están compuestos por complejas poblaciones biológicas mezcladas e interrelacionadas, en las que cada microorganismo del sistema tiene su propia curva de crecimiento. La posición y forma de la curva particular de crecimiento dentro del sistema, en función del tiempo, depende del alimento y de los nutrientes disponibles, así como de factores ambientales tales como la temperatura y el pH y del carácter aerobio o anaerobio del sistema. La variación con el tiempo del predominio de microorganismos en la estabilización aerobia de un agua residual orgánica se presenta en la Figura 8-6. Si bien las bacterias son de importancia capital, existen muchos otros organismos que participan en la estabilización del residuo orgánico. Al proyectar o analizar un proceso de tratamiento biológico, el ingeniero deberá pensar en términos de un ecosistema, o comunidad, tal como el que se muestra en la Figura 8-6, y no en una «caja negra» que sólo contenga microorganismos misteriosos. FIGURA 8-6 Crecimiento relativo de los microorganismos en el curso de la estabilización de un residuo orgánico en un medio líquido [24]. 8.5 CINÉTICA DEL CRECIMIENTO BIOLÓGICO En este capitulo se pone especial énfasis en señalar que el proyecto de un sistema de tratamiento biológico de aguas residuales, precisa de una comunidad biológica y un medio ambiente bien controlados. Anteriormente, se han estudiado los microorganismos de importancia en el tratamiento de las aguas residuales junto con sus características metabólicas y sus formas de crecimiento. Aunque ya se han descrito las características del medio ambiente necesarias para el crecimiento, aún no se ha comentado nada acerca de cómo controlarlo. Las condiciones ambientales se pueden controlar mediante la regulación del pH, de la temperatura, la adición de nutrientes o elementos de traza, la adición o exclusión de oxigeno o, también, mediante una mezcla adecuada del medio. El control de las condiciones ambientales asegurará que los microorganismos dispongan del medio adecuado para su desarrollo. Para asegurar el crecimiento de los microorganismos, se les debe permitir un tiempo de permanencia en el sistema suficiente para que se reproduzcan. Este periodo depende de la tasa de crecimiento, la cual está directamente relacionada con la velocidad a la que metabolizan o utilizan el residuo. Suponiendo que las condiciones ambientales estén debidamente controladas, se puede asegurar una estabilización eficaz mediante el control de la tasa de crecimiento de los microorganismos. El propósito de esta sección es presentar la cinética del crecimiento biológico. Crecimiento celular Tanto en los sistemas de cultivo de alimentación continua como en los de alimentación discontinua, la tasa de crecimiento de las células bacterianas se puede definir mediante la siguiente expresión: rg = µX (8.1) donde: rg = tasa de crecimiento bacteriano, masa/volumen unitario tiempo. µ = tasa de crecimiento específico, tiempo-1. X = concentración de microorganismos, masa/volumen unitario. Dado que en los cultivos de alimentación discontinua dX/dt = rg (véase Apéndice G), la siguiente relación también es válida para este tipo de cultivos: dX/dt = µX (8.2) Crecimiento con limitación de substrato En los cultivos de alimentación discontinua, si uno de los requisitos esenciales para el crecimiento (substrato o nutrientes) está presente en cantidades limitadas, será el primero en agotarse y se detendrá el crecimiento (véase Fig. 8-5). En un cultivo continuo, este hecho tendrá el efecto de limitar el crecimiento. Experimentalmente, se ha podido determinar que el efecto de disponer de cantidades limitadas de substrato o de nutrientes, a menudo, se puede definir adecuadamente mediante la siguiente expresión desarrollada por Monod [25, 26]: µ = µm S/(Ks + S) (8.3) donde: µ = tasa de crecimiento específico, tiempo-1. µm = máxima tasa de crecimiento específico, tiempo-1. S = concentración del substrato que limita el crecimiento, masa/unidad de volumen. Ks= constante de velocidad mitad, concentración de substrato a la mitad de la máxima tasa de crecimiento, masa/unidad de volumen. El efecto de la concentración de substrato sobre la tasa de crecimiento específico se ilustra en la Figura 8-7. FIGURA 8-7 Gráfico representativo de los efectos de un nutriente limitante sobre la velocidad específica de crecimiento. Si se sustituye en la Ecuación 8.1 el valor de de la Ecuación 8.3, la expresión de la tasa de crecimiento que resulta es: rg = µmXS/(Ks + S) (8.4) Crecimiento celular y utilización del substrato Tanto en los sistemas de cultivo de alimentación continua como en los de alimentación discontinua, una parte del substrato se transforma en células nuevas, y otra parte se oxida y da origen a productos finales orgánicos e inorgánicos. Dado que se ha observado que la cantidad de células nuevas producidas es la misma para un substrato dado, se ha desarrollado la siguiente relación entre el grado de utilización del substrato y la tasa de crecimiento: rg = -Yrsu (8.5) donde: rg = tasa de crecimiento bacteriano, masa/unidad de volumen. Y = coeficiente de producción máxima medido durante cualquier período finito de la fase de crecimiento exponencial, definido como la relación entre la masa de células formadas y la masa de substrato consumido, masa/masa. rsu = tasa de utilización de substrato, masa/volumen tiempo. Basándose en ensayos de laboratorio, se ha podido comprobar que la producción depende de: (1) el estado de oxidación de la fuente de carbono y de los elementos nutrientes; (2) del grado de polimerización del substrato; (3) de las vías de metabolismo; (4) de la tasa de crecimiento, y (5) de diversos parámetros físicos de cultivo. Si se sustituye el valor de rg de la Ecuación 8.4 en la Ecuación 8.5, el grado de utilización de substrato se puede definir como: rsu = - µmXS/Y(Ks + S) (8.6) En la Ecuación 8.6, el término µm/Y se sustituye por el término k, definido como la tasa máxima de utilización del substrato por unidad de masa de microorganismos: k = µm/Y (8.7) Si se sustituye el término k por el término µm/Y en la Ecuación 8.6, la expresión que resulta es: rsu = - kXS/(Ks + S) (8.8) Efectos del metabolismo endógeno En los sistemas bacterianos que se emplean en el tratamiento biológico del agua residual, la distribución de edades de las células es tal que no todas las células del sistema están en la fase de crecimiento exponencial. Consecuentemente, la expresión de la tasa de crecimiento se debe corregir para tener en cuenta la energía necesaria para el mantenimiento celular. Otros factores, tales como la muerte y la depredación, también deben ser objeto de consideración. Generalmente, estos factores se engloban en uno único, y se supone que la disminución de la masa celular causada por ellos es proporcional a la concentración de organismos presentes. En la literatura técnica, esta disminución se identifica como descomposición endógena. El término de la descomposición endógena se puede formular de la siguiente manera: rd (descomposición endógena) = - kdX (8.9) donde: kd = coeficiente de descomposición endógena, tiempo-1. X = concentración de células, masa/unidad de volumen. Cuando la Ecuación 8.9 se combina con las Ecuaciones 8.4 y 8.5, las expresiones que se obtienen para la tasa neta de crecimiento son: r'g = (µmXS/(Ks + S)) - kdX (8.10) r'g = -Yrsu - kdX (8.11) donde r'g = tasa neta de crecimiento bacteriano, masa unidad de volumen. La expresión correspondiente para la tasa neta de crecimiento específico viene dada por la Ecuación 8.12, que es la misma que la expresión propuesta por Van Uden [39]: µ' = (µm S/(Ks+S)) - kd (8.12) donde µ' = tasa neta de crecimiento específico, tiempo-1. Los efectos de la respiración endógena sobre la producción neta de bacterias se tienen en cuenta al definir una producción observada de la siguiente manera [29,39]: Yobs = - r'g /rsu (8.13) Efectos de la temperatura La dependencia de la temperatura de las constantes de la velocidad de la reacción biológica es muy importante a fin de asegurar la eficacia conjunta de un proceso de tratamiento biológico. La temperatura no sólo influye en las actividades metabólicas de la población microbiana, sino que también tiene un profundo efecto sobre factores tales como la velocidad de transferencia de gases y sobre las características de sedimentación de los sólidos biológicos. El efecto de la temperatura sobre la velocidad de reacción de un proceso biológico se suele expresar de la siguiente manera: rT = r20 THETA (T-20) (8.14) donde: rT = velocidad de reacción a T ºC. r20 = velocidad de reacción a 20 ºC. THETA = coeficiente de actividad-temperatura. T = temperatura, en ºC. En la Tabla 8-5 se presentan valores de típicos para los procesos biológicos más utilizados. Esos valores no se deben confundir con los propuestos en el Capítulo 3 para la determinación de la DBO. Otras expresiones cinéticas Al revisar las expresiones cinéticas desarrolladas para describir el crecimiento de los microorganismos y la eliminación de substrato, es importante recordar que estas expresiones son empíricas y que se usan para explicar e ilustrar los fenómenos que se producen, pero que no son las únicas expresiones existentes. Las expresiones que se incluyen a continuación, también se han venido utilizando para describir la tasa de utilización del substrato: rsu = -k (8.15) rsu = - kS (8.16) rsu = -kXS (8.17) rsu = -kX S/So (8.18) También se han propuesto diversas expresiones para la tasa de crecimiento específico (véase Ec. 8.3), entre las que cabe destacar las propuestas por Monod, Teissier, Contois, y Moser [26, 34]. El factor fundamental en la aplicación de cualquier expresión cinética es el análisis de un balance de masas. De este modo, mientras la expresión utilizada describa el fenómeno observado, no importa que no tenga relación alguna con las expresiones que aparecen con más frecuencia en la literatura. También es importante destacar que no es recomendable generalizar expresiones específicas, deducidas a partir de datos o experiencias limitados, para cubrir una gran variedad de situaciones. TABLA 8-5 Coeficientes de temperatura-actividad para diversos procesos biológicos de tratamiento Aplicación de la cinética del crecimiento y de la eliminación de substrato al tratamiento biológico Antes de proceder a la descripción individual de los diferentes procesos biológicos, es necesario explicar la aplicación general de los principios cinéticos de crecimiento biológico y de eliminación de substrato. El propósito de este apartado es ilustrar: (1) el desarrollo de balances de substrato y de microorganismos, y (2) la predicción de las concentraciones de microorganismos y de substrato en el efluente. Para ello se considerará un proceso de tratamiento aerobio llevado a cabo en un reactor de mezcla completa sin recirculación (véase Fig. 8-8). El esquema es el mismo que se empleará para el proceso de fangos activados sin recirculación que se analizará en la Sección 8.7. Es interesante observar que el reactor de mezcla completa es básicamente igual que un quimiostato de los que se utilizan en los ensayos de laboratorio (véase Fig. 8-9). FIGURA Representación esquemática de un reactor de mezcla completa sin recirculación. 8-8 FIGURA Esquema de un quimioestato de laboratorio típico [34]. 8-9 Balances de masa de microorganismos y de substrato. Un balance de masa para la masa de microorganismos del reactor de mezcla completa de la Figura 8-8 se puede escribir de la siguiente manera: 1. Planteamiento general: Velocidad de acumulación de microorganismos dentro de los límites del sistema = = cantidad de microorganismos que entran en el sistema - cantidad de microorganismos que salen del sistema + + crecimiento neto de microorganismos dentro de los límites del sistema (8.19) 2. Planteamiento simplificado: Acumulación = Entrada - Salida + Crecimiento neto (8.20) 3. Representación simbólica: (dX/dt) Vr = QXo - QX + Vrr'g (8.21) donde: dX/dt = tasa de crecimiento de microorganismos medida en términos de masa (sólidos en suspensión volátiles), masa de SSV/unidad de volumen tiempo. Vr = volumen del reactor. Q = caudal, volumen/tiempo. Xo = concentración de microorganismos a la entrada del reactor, masa de SSV/unidad de volumen. X = concentración de microorganismos en el efluente, masa de SSV/unidad de volumen. r'g = tasa neta de crecimiento de microorganismos, masa de SSV/ unidad de volumen · tiempo. En la Ecuación 8.21 y expresiones subsiguientes derivadas de ella, la fracción volátil del total de sólidos biológicos en suspensión se usa como una aproximación de la masa biológica activa. Este supuesto se basa en que la fracción volátil se considera proporcional a la actividad de la masa microbiana en cuestión. A pesar de que se han empleado otras diversas medidas, tales como el contenido de nitrógeno, proteínas, ADN y ATP, se suele utilizar el contenido de sólidos en suspensión volátiles debido, fundamentalmente, a lo sencillo que resulta medirlos. Si se sustituye el valor de r'g de la Ecuación 8.10 en la Ecuación 8.21, resulta: (dX/dt) Vr = QXo - QX + Vr ((µmXS/(Ks + S)) - kdX) (8.22) donde S = concentración de substrato en el efluente del reactor, mg/l. Si se supone que se puede despreciar la concentración de microorganismos en el efluente, y que prevalecen las condiciones estacionarias (dX/dt = 0), la Ecuación 8.22 se puede simplificar, y se obtiene: Q/Vr = 1/THETA = (µmS/(Ks + S)) - kd (8.23) donde THETA = tiempo de detención hidráulica, V/Q. En la Ecuación 8.23, el término 1/THETA corresponde a la tasa neta de crecimiento específico (véase Ec. 8-12), y también se corresponde con el término l/THETAc donde es el tiempo de medio de retención celular. En el campo del tratamiento de las aguas residuales, THETAc se puede definir como la masa de organismos presentes en el reactor dividida por la masa diaria de organismos eliminados del sistema. (En la Sección 8.7 se da una segunda definición comúnmente empleada.) Para el reactor de la Figura 8-8, el valor de THETAc viene dado por la siguiente expresión: THETAc = VrX/QX = Vr/Q (8.24) Si se lleva a cabo un balance de substrato correspondiente al balance de masa de microorganismos de la Ecuación 8.22, se obtiene la siguiente expresión: (dS/dt)Vr = QSo - QS + Vr (kXS/(Ks + S)) (8.25) En condiciones estacionarias (dS/dt = 0), la ecuación que resulta es: (So - S) - THETA (kXS/(Ks + S)) = 0 (8.26) donde THETA = Vr/Q. Concentraciones de microorganismos y de substrato en el efluente. Las concentraciones de microorganismos y de substrato en el efluente se pueden obtener de la siguiente manera: si se resuelve la Ecuación 8.23 para el término S/(K+S), se sustituye la expresión resultante en la Ecuación 8.26 y se simplifica empleando la Ecuación 8.7, la concentración de microorganismos en el efluente, en condiciones estacionarias, viene dada por: X = µm(So - S) / k(1+ kdTHETA) = Y(So - S)/(1- kdTHETA) (8.27) Operando de manera análoga, la concentración de substrato en el efluente es: S = Ks(1 + THETA kd) / (THETA(Yk - kd) - 1) (8.28) Por lo tanto, se pueden emplear las Ecuaciones 8.27 y 8.28 para la predicción de las concentraciones de microoganismos y de substrato en el efluente si se conocen los valores de los coeficientes cinéticos (véase Fig. 8-10). Es importante tener en cuenta que las concentraciones en el efluente que se obtienen al FIGURA 8-10 Concentración de residuo en el efluente y eficacia de eliminación respecto al tiempo medio de retención celular para un reactor de mezcla completa sin recirculación (THETA= THETAc). aplicar las ecuaciones aquí expuestas, se basan en un residuo soluble, y no tienen en cuenta la posible presencia de sólidos en suspensión en el interior del reactor. Las concentraciones de substrato y de microorganismos presentes en los efluentes en la práctica, dependen del funcionamiento y rendimiento de los tanques de sedimentación. La producción observada, Yobs viene dada por la siguiente expresión: Yobs = Y / (1 + kd THETA) (8.29) La Ecuación 8.29 se obtiene sustituyendo el valor de X que proporciona la Ecuación 8.27 por el valor de r'g de la Ecuación 8.13 y dividiendo por el término (So - S), lo cual corresponde al valor de rsu expresado en unidades de concentración. 8.6 PROCESOS BIOLÓGICOS DE TRATAMIENTO El objetivo de esta sección es introducir al lector los principales tipos de procesos de tratamiento biológicos que se han desarrollado para el tratamiento de las aguas residuales e identificar sus aplicaciones. En lo que resta del capítulo, se analizan los procesos de tratamiento biológico más comúnmente empleados para el tratamiento de las aguas residuales. Definiciones útiles Los términos que se definen a continuación son de gran utilidad para comprender los conceptos en los que se basa el tratamiento biológico: Procesos aerobios. Son los procesos de tratamiento biológico que se dan en presencia de oxígeno. Procesos anaerobios. Procesos de tratamiento biológico que se dan en ausencia de oxigeno. Desnitrificación anóxica. Es el proceso por el cual el nitrógeno de los nitratos se transforma, biológicamente, en nitrógeno gas en ausencia de oxígeno. Este proceso también se conoce con el nombre de desnitrificación anaerobia. Eliminación biológica de nutrientes. Término que se aplica a la eliminación de nitrógeno y fósforo mediante procesos de tratamiento biológico. Procesos facultativos. Son los procesos de tratamiento biológico en los que los organismos responsables pueden funcionar en presencia o ausencia de oxígeno molecular. Estos organismos se conocen con el nombre de organismos facultativos. Eliminación de la DBO carbonosa. Es la conversión biológica de la materia carbonosa del agua residual en tejido celular y en diversos productos gaseosos. En la conversión, se supone que el nitrógeno presente en los diferentes compuestos se convierte en amoniaco. Nitrificación. Es el proceso biológico mediante el cual el amoniaco se transforma, primero en nitrito y posteriormente en nitrato. Desnitrificación. Proceso biológico mediante el cual el nitrato se convierte en nitrógeno gas y en otros productos gaseosos. Substrato. Es el término empleado para representar la materia orgánica o los nutrientes que sufren una conversión o que pueden constituir un factor limitante en el tratamiento biológico. Por ejemplo, la materia orgánica carbonosa presente en el agua residual es el substrato objeto de conversión en el tratamiento biológico. Procesos de cultivo en suspensión. Son los procesos de tratamiento biológico en los que los microorganismos responsables de la conversión de la materia orgánica u otros constituyentes del agua residual en gases y tejido celular, se mantienen en suspensión dentro del liquido. Procesos de cultivo fijo. Son los procesos de tratamiento biológico en los que los microorganismos responsables de la conversión de la materia orgánica u otros constituyentes del agua residual en gases y tejido celular están fijados a un medio inerte, tal como piedras, escorias, o materiales cerámicos y plásticos especialmente diseñados para cumplir con esta función. Los procesos de cultivo fijo también se conocen con el nombre de procesos de película fija. Procesos de tratamiento biológico Los principales procesos biológicos aplicados al tratamiento de las aguas residuales se recogen en la Tabla 8-6. Existen cinco grupos principales: procesos aerobios, procesos anaerobios, procesos anóxicos, procesos aerobios, anaerobios y anóxicos combinados, y los procesos de lagunaje. Los procesos individuales se pueden dividir, a su vez, dependiendo de si el tratamiento se lleva a cabo en sistemas de cultivo en suspensión, en sistemas de cultivo fijo, o en sistemas resultantes de la combinación de ambos. Se debe hacer constar que todos los procesos biológicos que se emplean en el tratamiento del agua residual, como se muestra en la Tabla 8-6, tienen su origen en fenómenos y procesos que se producen en la naturaleza. Los ciclos aerobios y anaerobios, mostrados en las Figuras 8-11 y 8-12 respectivamente, son ejemplos típicos. La descomposición de los residuos se puede acelerar mediante el control del medio ambiente y el entorno de los microorganismos. El proceso de tratamiento biológico consiste en el control del medio ambiente de los microorganismos, de modo que se consigan condiciones de crecimiento óptimas. Aplicación de los procesos de tratamiento biológico Las principales aplicaciones de estos procesos, también indicadas en la Tabla 8-6, son: (1) la eliminación de la materia orgánica carbonosa del agua residual, normalmente medida como DBO, carbono orgánico total (COT), o demanda química de oxigeno (DQO); (2) nitrificación; (3) desnitrificación; (4) eliminación de fósforo, y (5) estabilización de fangos. En lo que resta de este capítulo se pondrá especial énfasis en la eliminación de la materia carbonosa, ya sea mediante procesos aerobios o anaerobios. La nitrificación, la desnitrificación y la eliminación del fósforo son objeto de un estudio más profundo en el Capitulo 11, mientras que la estabilización de fangos se aborda en el Capitulo 12. TABLA 8-6 Principales procesos biológicos utilizados en el tratamiento del agua residual La principal aplicación se presenta en primer lugar, entre paréntesis se expones otros usos. a FIGURA El ciclo aerobio en la naturaleza 8-11 FIGURA El ciclo anaerobio en la naturaleza 8.7 PROCESOS SUSPENSIÓN DE TRATAMIENTO 8-12 AEROBIO DE CULTIVO EN Los principales procesos de tratamiento biológico de cultivo en suspensión empleados para la eliminación de la materia orgánica carbonosa son: (1) el proceso de fangos activados; (2) las lagunas aireadas; (3) el reactor de flujo discontinuo secuencial, y (4) el proceso de digestión aerobia. De todos ellos, el proceso de fangos activados es, con mucho, el más ampliamente empleado en el tratamiento secundario de las aguas residuales domésticas, razón por la cual en esta sección se prestará especial atención a su estudio. En la Sección 8.11, que trata la eliminación biológica de nutrientes, se estudiará la nitrificación con cultivo en suspensión. Proceso de fangos activados Este proceso fue desarrollado en Inglaterra en 1914 por Ardern y Lockett [3], y su nombre proviene de la producción de una masa activada de microorganismos capaz de estabilizar un residuo por vía aerobia. En la actualidad, existen muchas versiones del proceso original, pero son todas fundamentalmente iguales. El sistema que se ilustra en la Figura 8-13 es el sistema de fangos activados con reactor de mezcla completa. En la Tabla 8-10 se citan otros sistemas de fangos activados cuyo estudio se aborda en el Capitulo 10. Descripción del proceso. Desde el punto de vista del funcionamiento, el tratamiento biológico de aguas residuales mediante el proceso de fangos activados se suele llevar a cabo utilizando un diagrama de flujo como el de la Figura 8-13. El residuo orgánico se introduce en un reactor, donde se mantiene un cultivo bacteriano aerobio en suspensión. El contenido del reactor se conoce con el nombre de «liquido mezcla». En el reactor, el cultivo bacteriano lleva a cabo la conversión en concordancia general con la estequiometria de las Ecuaciones 8.30 y 8.31. Oxidación y síntesis: bacterias COHNS + O2 + nutrientes ------> CO2 + NH3 + C5H7NO2 + otros productos finales (8.30) (materia organica) (nuevas celulas bacterias) Respiración endógena: bacterias C5H7NO2 + 5 O2 -----> 5 CO2 + 2 H2O + NH3 + energía (8.31) (celulas) 113 1 160 1,42 En estas ecuaciones, COHNS representa la materia orgánica del agua residual. A pesar de que la reacción de la respiración endógena conduce a la formación de productos finales relativamente sencillos y al desprendimiento de energía, también se forman algunos productos orgánicos estables. A partir de la Ecuación 8.31 se puede observar que si todas las células se oxidan por completo, la DBO última de las células equivale a 1,42 veces el valor de la concentración de células. FIGURA 8-13 Esquema de un reactor de mezcla completa con recirculación celular y purga: (a) desde el reactor, y (b) desde la línea de recirculación. El ambiente aerobio en el reactor se consigue mediante el uso de difusores o de aireadores mecánicos, que también sirven para mantener el liquido mezcla en estado de mezcla completa. Al cabo de un periodo determinado de tiempo, la mezcla de las nuevas células con las viejas se conduce hasta un tanque de sedimentación para su separación del agua residual tratada. Una parte de las células sedimentadas se recircula para mantener en el reactor la concentración de células deseada, mientras que la otra parte se purga del sistema (véase Fig. 8-13b). La fracción purgada corresponde al crecimiento de tejido celular r'g (véase Ec. 8.11), asociado a un agua residual determinada. El nivel al que se debe mantener la masa biológica depende de la eficacia deseada en el tratamiento y de otras consideraciones relacionadas con la cinética del crecimiento. En la Tabla 10-5 del Capitulo 10 se citan las concentraciones de microorganismos mantenidas en varios sistemas de tratamiento de fangos activados. Microbiología del proceso. Para proyectar un sistema de fangos activados correctamente y con las debidas garantías de buen funcionamiento. es necesario comprender la importancia de los microorganismos dentro del sistema. En la naturaleza, el papel clave de las bacterias es descomponer la materia orgánica producida por otros organismos vivos. En el proceso de fangos activados, las bacterias son los microorganismos más importantes, ya que son los causantes de la descomposición de la materia orgánica del afluente. En el reactor, o tanque de aireación, las bacterias aerobias o facultativas utilizan parte de la materia orgánica del agua residual con el fin de obtener energía para la síntesis del resto de la materia orgánica en forma de células nuevas, como se muestra en la Figura 8-1. En realidad, sólo una parte del residuo original se oxida a compuestos de bajo contenido energético tales como el NO3-, el SO4-2 O el CO2; el resto se sintetiza en forma de materia celular. Los productos intermedios que se forman antes de producirse los productos finales de oxidación son muy diversos, algunos de los cuales se muestran en el término de la derecha de la Ecuación 8.30. En general, las bacterias que intervienen en el proceso de fangos activados incluyen los géneros Pseudomonas, Zoogloea, Achromobacter, Flavobacterium, Nocardia, Bdellovibrio, Mycobacterium, y las dos bacterias nitrificantes más comunes, los Nitrosomas y las Nitrobacter [13,14]. Adicionalmente, se pueden presentar diversas formas filamentosas tales como la Sphaerotilus, Begiatoa, Thiothrix, Lecicothrix,y Geotrichum [13, 14]. En tanto que las bacterias son los microorganismos que realmente degradan el residuo orgánico del afluente, las actividades metabólicas de otros microorganismos son, igualmente, importantes en el sistema de fangos activados. Por ejemplo, los protozoos y rotíferos ejercen una acción de refino de los efluentes. Los protozoos consumen las bacterias dispersas que no han floculado y los rotíferos consumen cualquier partícula biológica pequeña que no haya sedimentado. Por otro lado, del mismo modo que es importante que las bacterias descompongan el residuo orgánico tan pronto como sea posible, también lo es el que formen un flóculo adecuado, puesto que este punto constituye un requisito previo para la separación de los sólidos biológicos en la instalación de sedimentación. Se ha observado que cuando se aumenta el tiempo medio de retención celular mejoran las características de sedimentación del flóculo biológico. En el caso de aguas residuales domésticas, los tiempos medios de retención celular necesarios para conseguir una buena sedimentación oscilan entre 3 y 4 días. En la Tabla 10-5 se indican unos valores típicos de los tiempos medios de retención celular empleados en el proyecto y funcionamiento de diversos procesos de fangos activados. Aunque se obtenga una excelente formación de flóculos, el efluente del sistema podría tener un alto contenido de sólidos biológicos, como consecuencia de un mal diseño de la unidad de sedimentación secundaria, mal funcionamiento de los dispositivos de aireación, o por la presencia de organismos filamentosos como el Spbaerotilus, los E. coli u hongos [14, 17, 42]. Estos temas se tratarán más adelante en este capitulo, y se analizan con mayor profundidad en el Capitulo 10. Análisis del proceso: Reactor de mezcla completa con recirculación. En el sistema de mezcla completa, que se ilustra de forma esquemática en la Figura 8-13 y en la fotografía de la Figura 8-14, el liquido del reactor se mezcla completamente, y se supone que el contenido de microorganismos en el agua que entra al reactor es nulo. Como se muestra en la Figura 8-13, la unidad de separación de sólidos (tanque de sedimentación) en la que se separan las células del reactor para su posterior recirculación, es una parte integral del proceso de fangos activados. Debido a la presencia de esta unidad de separación de sólidos, la elaboración de un modelo cinético para describir este sistema precisa de dos hipótesis adicionales: 1. La estabilización de los residuos por parte de los microorganismos se produce únicamente en el reactor. Esta hipótesis conduce a un modelo conservativo (en algunos sistemas se puede producir cierto grado de estabilización de los residuos en la unidad de sedimentación). 2. El volumen utilizado al calcular el tiempo medio de retención celular del sistema sólo incluye el volumen del reactor. FIGURA Reactor típico de mezcla completa con aireador de superficie. 8-14 En efecto, se supone que el tanque de sedimentación sirve como depósito desde el que se recirculan los sólidos para mantener un nivel determinado de éstos en el tanque de aireación. Si el sistema es tal que no se cumplen estas hipótesis, es necesario introducir modificaciones en el modelo propuesto. Por ejemplo, en sistemas de fangos activados con oxígeno puro, se ha demostrado que más del 50 por 100 de los sólidos totales del sistema pueden estar presentes en el tanque de sedimentación secundaria. Este tema se considera con mayor profundidad y detalle, tanto en la discusión que sigue como en el Capítulo 10. El tiempo medio de retención hidráulica del sistema, THETAs se define como: THETAs = VT/Q = (Vr + Vs) / Q (8.32) donde: VT = volumen del reactor + volumen del tanque de sedimentación. Q = caudal afluente. Vr = volumen del reactor. Vs = volumen del tanque de sedimentación. El tiempo medio de retención hidráulica del reactor, THETA, se define como: THETA = Vr / Q (8.33) donde Vt = es el volumen del reactor. Para el sistema de la Figura 8-13u, el tiempo medio de retención celular Q, definido como la masa de microorganismos del reactor dividida por la masa diaria de microorganismos purgada del sistema, viene dado por la siguiente expresión: THETAc = VrX/(QwX + QeXe) (8.34) donde: Qw = caudal del líquido que contiene las células biológicas que hay que purgar del sistema (en este caso, del reactor). Qe = caudal de líquido efluente de la unidad de separación. Xe = concentración de microorganismos en el efluente de la unidad de separación de sólidos. Para el sistema de la Figura 8-13b, el tiempo medio de retención celular viene dado por la siguiente expresión: THETAc = VrX/(Q'wX + QeXe) (8.35) donde: Xr = concentración de microorganismos en la línea de recirculación de fangos. Q'w = tasa de purga de células desde el caudal de recirculación. Es conveniente hacer mención del hecho de que, a menudo, en la literatura referente a este tema, el valor de THETAc se suele calcular considerando la masa total de microorganismos contenidos, tanto en el reactor como en el tanque de sedimentación. Ambos métodos son aceptables, mientras se especifique con elaridad las bases de cálculo empleadas. Comparando la Ecuación 8.34 o la 8.35 con las Ecuaciones 8.32 y 8.33, se puede apreciar que para un volumen dado del reactor, el valor de THETAc es independiente tanto de THETA como de THETAs. Sin embargo, en la práctica, THETAc no puede ser totalmente independiente de los valores de THETA y THETAs. Los factores que relacionan THETAc con THETA y THETAs se tratarán más adelante. En relación con la Figura 8-13a, se puede escribir un balance de masas para los microorganismos del sistema global de la siguiente manera: 1. Planteamiento general: Velocidad de acumulación de microorganismos dentro de los límites del sistema = = Cantidad de microorganismos que entran en el sistema Cantidad de microorganimos que salen del sistema + + Crecimiento neto de microorganismos dentro de los limites del sitema (8.36) 2. Planteamiento simplificado: Acumulación = Entrada - Salida + Crecimiento neto (8.37) 3. Representación simbólica: (dX/dt) Vr = QXo - [QwX + QeXe] + Vr(r'g) (8.38) Sustituyendo la Ecuación 8.11 por la tasa de crecimiento y suponiendo que la concentración de células en el afluente es nula y que prevalecen condiciones estacionarias (dX/dt = 0), se obtiene: (QwX + QeXe)/VrX = -Y rsu/X - kd (8.39) El término de la izquierda de la Ecuación 8.39 representa el inverso del tiempo medio de retención celular definido anteriormente (véase Ec. 8.34). Empleando la Ecuación 8.35, la Ecuación 8.39 se puede simplificar y reordenar para obtener: 1/THETAc= -Y rsu/X - kd (8.40) El término rsu se determina por medio de la siguiente expresión: rsu = -Q/Vr (So - S) = - (So - S)/THETA (8.41) donde: (So - S) = cantidad de substrato utilizada, mg/l. So = concentración de substrato en el afluente, mg/l. S = concentración de substrato en el efluente, mg/l. THETA = tiempo de detención hidráulica, d. La concentración de microorganismos en el reactor, X, se puede obtener sustituyendo la Ecuación 8.41 en la 8.40 y despejando el valor de X: X = (THETAc/THETA) · Y(So -S)/(1+kd THETAc) (8.42) Haciendo un balance del substrato, se obtiene que la concentración de substrato en el efluente es: S = Ks(1+THETAc kd)/(THETAc(Yk -kd) - 1) (8.43) Es conveniente resaltar la igualdad existente entre la Ecuación 8.43 y la Ecuación 8.28, que se desarrolló para un reactor de mezela completa sin recirculación. La ecuación correspondiente para la producción observada en un sistema con recirculación es la misma que la Ecuación 8.29, sustituyendo THETA por THETAc o THETAct como se muestra a continuación: Yobs = Y/(1+kd THETAc o THETAct) (8.44) Relaciones para el diseño y control del proceso. A pesar de que las Ecuaciones 8.42 y 8.43 pueden ser útiles para predecir los efectos de los diferentes cambios que puedan producirse en el sistema, presentan cierta dificultad para su aplicación para el diseño debido a la cantidad de constantes incluidas en las mismas. Por esta razón se han desarrollado relaciones más prácticas para el diseño del proceso. Las relaciones que hay que considerar en esta discusión incluyen la tasa de utilización específica, el tiempo medio de retención celular, y la relación alimento-microorganismos. La relación entre la tasa de utilización específica y el tiempo medio de retención celular es, asimismo, analizada. En la Ecuación 8.40, el término (- rsu/X) se conoce como la tasa de utilización específica del substrato, U. Empleando la definición de rsu dada en la Ecuación 8.41, la tasa de utilización específica se puede calcular de la siguiente manera: U = -rsu / X = (So - S)/THETA · X = (Q/Vr) ((So - S) / X) (8.45) Si se sustituye el término U por (rsu/X) en la Ecuación 8.35, la ecuación que resulta es: 1/THETAc = YU - kd (8.46) De la Ecuación 8.46 se puede observar que 1/THETAc, la tasa neta de crecimiento específico, y U, la tasa de utilización específica, están directamente relacionadas. Para determinar la tasa de utilización específica, U, es necesario conocer el substrato utilizado y la masa de microorganismos que interviene en esta utilización. El substrato utilizado se puede obtener como la diferencia entre la DQO o la DBO5 a la entrada y a la salida del sistema. La dificultad de la evaluación de la masa activa de microorganismos es el principal problema, y es la razón que suele hacer poco práctico el uso del parámetro U como parámetro de control. Si se emplea el valor de THETAc como parámetro de control del tratamiento, no es necesario determinar la cantidad sólidos biológicos activos contenidos en el sistema, ni evaluar la cantidad de alimento utilizado. El uso de THETAc se basa, simplemente, en el hecho de que, para controlar la tasa de crecimiento y por lo tanto el grado de estabilización del residuo, es necesario purgar cada día un porcentaje determinado de la masa celular del sistema. Por lo tanto, si para alcanzar un determinado nivel de tratamiento se necesita un valor de 10 días, ello implica que cada día es necesario purgar el 10 por 100 de la masa celular de todo el sistema. En el sistema de mezela completa con recirculación, la purga de las células se puede realizar en el conducto de recirculación al reactor o, directamente, del líquido mezela. Si se hace directamente en el reactor y se considera que la concentración de sólidos en el efluente es despreciable, sólo es necesario conocer los valores de Qw y Vr para determinar el valor de THETAc mediante la Ecuación 8.34. Por lo tanto, la purga de células, mediante este procedimiento, proporciona un método directo para la medida y el control de THETAc. En la práctica, para obtener un fango más concentrado, lo que se hace es purgar fango desde el conducto de recirculación. Suponiendo que el valor de Xc sea muy pequeño, la Ecuación 8.35 se puede reescribir en la forma: THETAc = VrX / Q'wXr (8.47) Por lo tanto, la purga desde el conducto de recirculación precisa el conocimiento de la concentración de microorganismos, tanto en el líquido mezcla como en el fango de recirculación. Un término que está íntimamente ligado a la tasa de utilización específica, U, y que se usa habitualmente en la práctica como parámetro de diseño y de control es la relación alimento-microorganismos (F/M), que se define como: F/M = So /(THETA X) (8.48) Los términos U y (F/M) están relacionados por el rendimiento del proceso en la forma: U = (F/M) E/100 (8.49) donde E es el rendimiento del proceso, cuya definición es la siguiente: E = ((So - S)/So) · 100 (8.50) donde: E = rendimiento del proceso, porcentaje. So = concentración de substrato en el afluente. S = concentración de substrato en el efluente. La aplicación de estas relaciones al diseño de los procesos se ilustra en el Ejemplo 8-1. Ejemplo 8-1. Análisis del proceso de fangos activados. Se desea tratar un residuo orgánico con una DBO5 soluble de 250 mg/l mediante un proceso de fangos activados de mezcla completa. La DBO5 del efluente debe ser inferior a 20 mg/l. Supóngase que la temperatura es de 20ºC, el caudal es de 0,25 m3/s, y que son de aplicación las siguientes condiciones: 1. Los sólidos suspendidos volátiles del afluente al reactor son despreciables. 2. Concentración del fango de retorno = 10.000 mg/l de sólidos en suspensión = 8.000 mg/l de sólidos suspendidos volátiles. 3. Sólidos suspendidos volátiles en el líquido mezcla (SSVLM) = 3.500 mg/l = 0,8 · SSLM totales. 4. Tiempo medio de retención celular: THETAc = 10 días. 5. Régimen hidráulico del reactor = mezela completa. 6. Coeficientes cinéticos, Y = 0,65, (kilos de célula)/(kilos DBO5 utilizada) = 0,06 d-1. 7. Se estima que el efluente contendrá alrededor de 20 mg/l de sólidos biológicos, de los que un 80 por 100 son volátiles y un 65 por 100 son biodegradables. Supóngase que la DBO5 de los sólidos biológicos biodegradables se puede obtener multiplicando la DBO última por el factor 0,68 [e.d. el valor de K en la ecuación de la DBO es K = 0,1 d-1 (base 10)]. 8. El agua residual contiene nitrógeno, fósforo y otros nutrientes a nivel de trazas en cantidades suficientes para el crecimiento biológico. Solución 1. Estimar la DBO5 soluble del efluente: DBO5 del efluente = DBO5 soluble del afluente que escapa al tratamiento + DBO5 de los sólidos en suspensión del afluente 20 = S + 20(0,65)(1,42)(0,68) S = 7,4 mg/l de DBO5 soluble La eficacia del tratamiento biológico, analizada en términos de DBO5, es: Es = ((250 - 7,4)/250) · (100) = 97 % La eficacia conjunta de la planta es Econjunta = ((250 - 20)/250) · (100) = 92 % 2. Calcular el volumen del reactor. El volumen del reactor se puede determinar empleando la Ecuación 8.42 sustituyendo V/Q por THETA y reordenando la ecuación de la siguiente manera: XV = YQTHETAc(So - S) / (1+kd · THETAc) 3.500 mg/l (V m3/d)= 0,65(21.600 m3/d) (10 d)(250 mg/l - 7,4 mg/l) / (1+(0,06/d)(10d)) V = 6.082,3 m3 3. Calcular la masa de fango producido a) La producción observada es: Yobs = Y / (1 + kd THETAc) = 0,65 / (1+0,06(10)) = 0,406 h) La producción de biomasa es: Producción de biomasa, kg SSV/dia = Y mg/mg [(So - S) mg/l] [Q m3/s] [86400 s/d] [1/1000 kg/g] = (0,406) (250 - 7,4) (0,25) (86.400) (l/l.000) = 2.127 kg SS/d 4. Cálculo de la biomasa purgada, tanto si se purga del reactor (Fig. 8-13a) como si se purga de la conducción de recirculación (Fig. 8-13b). Es necesario tener en cuenta los sólidos que se pierden en el efluente de la planta (véase el comentario que figura al final del problema). Supóngase también que Qe = Q y que los SSV en el efluente son 16 mg/l (0,80 · 20 mg/l). a) Determinar el caudal purgado desde el reactor empleando la Ecuación 8.34: THETAc = VrX/(QwX + QeXe) 10 = (6.082,3 m3)(3.500 mg/l)/((Qw m3/d)(3.500 mg/l) + (21.600 m3 d)(16 mg/l)) Qw= 509 m3 b) Caudal purgado desde la conducción de retorno: THETAc = VrX / (Q'wXr + QeXe) 10 = (6.082,3)(3.500mg/l) / ((Qw m3/d)(8.000mg/l) + (21,60 m3/d)(16 mg/l)) Qw = 222,9 m3/d Nótese que en ambos casos, el peso del fango purgado es el mismo (2.127 kg de SSV/d), y que ambos métodos de purga proporcionan un valor de 10 días. 5. Calcular la relación de recirculación haciendo un balance de masa respecto al reactor despreciando los sólidos suspendidos del afluente: Concentración de SSV en el aireador = 3.500 mg/l Concentración de SSV en el retorno = 8.000 mg/l 3.500(Q + Qr) = 8.000(Qr) Qr/Q = R = 0,78 6. Calcular el tiempo de detención hidráulica del reactor: TRH = V / Q = 6.082,3 m3 / 21.600 m3/d = 0,28 d = 6,7 hr 7. Comprobar la tasa de utilización específica de substrato y el factor de carga volumétrica: a) La tasa de utilización específica es: U = (So - S)/(THETA X) = (250 - 7,4 mg/l)/0,28 d(3.500 mg/l) = 0,25 (mg DBO5 utilizados) / (mg SSVLM · d) b) La relación F/M es: F/M = So/(THETA X) = 250/0,28 d(3.500 mg/l) = 0,255 (mg DBO5 aplicada) / (mg SSVLM · d) c) La carga volumétrica, expresada como kg DBO5/m3 es: CV = (So mg/l)(Q m3/d)(1/106 kg/mg)(1.000 1/m3) / (Vm3) =250(21.600)(1/l.000)/6.082,3 = 0,887 kg DBO5 aplicada/m3 Comentario. Si no se tiene en cuenta los sólidos del efluente en el momento de calcular el caudal purgado, el valor real del tiempo medio de retención será inferior al valor de proyecto. En este ejemplo, si se despreciaran los sólidos volátiles del efluente, el tiempo medio de retención celular rondaría los 8,5 días. Eficacia y estabilidad del proceso. En este apartado se estudiarán en mayor profundidad los efectos de la cinética, comentados anteriormente, sobre la eficacia y estabilidad del sistema ilustrado en la Figura 8-13. Como se vio en la Ecuación 8.46, la tasa de crecimiento neta de microorganismos, 1/THETAc , estaba directamente relacionada con U, la tasa de utilización específica. Combinando las Ecuaciones 8.45 y 8.26, se puede ver que: U = kS/(Ks + S) (8.51) relación a partir de la cual se puede obtener la siguiente ecuación: S = UKs / (k - U) (8.52) Para un efluente y comunidad biológica dados, y para un conjunto determinado de condiciones ambientales, quedan fijados los valores de los coeficientes Y, k, Ks y kd. (Es importante hacer mención del hecho de que la gran variabilidad que presenta la composición de las aguas residuales domésticas puede invalidar su tratamiento como un único tipo de residuo a la hora de evaluar los coeficientes cinéticos). Para valores determinados de estos coeficientes, la concentración de residuo en el efluente del reactor es función directa de THETAc o de U, como muestra la Ecuación 8.51. Fijando el valor de uno de estos tres parámetros, no sólo se fija el valor de los otros dos, sino que también se determina la eficacia y el rendimiento del proceso biológico de estabilización de los residuos. La Figura 8-15 ilustra las representaciones gráficas de las Ecuaciones 8.42 y 8.43 para un sistema de mezcla completa con recirculación con un crecimiento específico determinado. Como se puede ver, la concentración del efluente y el rendimiento del proceso están directamente relacionados con el valor de THETAc. A partir de la Figura 8-15, también se puede apreciar que existe un cierto valor de THETAc por debajo del cual no se produce estabilización alguna del residuo. Este valor crítico de THETAc se conoce con el nombre de tiempo medio de retención celular mínimo THETAcm. Físicamente, THETAcm es el tiempo de retención para el cual las células se extraen o son eliminadas del sistema por arrastre antes de que se puedan reproducir. El tiempo medio de retención mínimo se puede calcular mediante la Ecuación 8.53, obtenida a partir de las Ecuaciones 8.39, 8.6 y 8.7. FIGURA 8-15 Concentración de residuo en el efluente y eficacia de eliminación respecto al tiempo medio de retención celular para reactores de mezcla completa y de flujo en pistón con recirculación. Es conveniente mencionar el hecho de que cuando se produce una eliminación por arrastre de las células, coinciden las concentraciones del afluente, So, y del efluente, S. 1/THETAcm = Y (kSo / (Ks + So)) - kd (8.53) En el tratamiento de aguas residuales, los casos en los que So es mucho mayor que Ks son muy abundantes, de modo que se puede reescribir la Ecuación 8.46 para obtener: 1/THETAcm = Yk - kd (8.54) Las Ecuaciones 8.53 y 8.54 se pueden emplear para determinar el tiempo medio de retención celular mínimo, THETAcm. Los valores típicos de los coeficientes cinéticos que se pueden emplear para determinar el valor de THETAcm se muestran en la Tabla 87. Evidentemente, los sistemas de tratamiento biológico no se deben proyectar con valores de iguales a THETAcm. Para asegurar un tratamiento adecuado, los sistemas de tratamiento biológico se suelen proyectar y hacer funcionar con valores de 2 a 20 veces THETAcm. En efecto, la relación entre THETAc y THETAcm se puede considerar como un factor de seguridad del proceso FS [19]. FS = THETAc/THETAcm (8.55) Flujo en pistón con recirculación. El sistema de flujo en pistón con recirculación celular, mostrado de forma esquemática en la Figura 8-16 y en la fotografía de la Figura 8-17, se puede emplear para modelar ciertas formas del proceso de fangos activados. La característica que distingue este sistema con recirculación es que el régimen hidráulico del reactor es del tipo de flujo en pistón. En un modelo de flujo en pistón verdadero, todas las partículas que entran en el reactor permanecen en el interior del mismo durante idéntico periodo de tiempo. Debido a la recirculación, algunas partículas pueden pasar por el reactor en más de una ocasión, pero mientras están en el interior del tanque, todas permanecen el mismo tiempo. FIGURA Reactor de flujo en pistón con recirculación celular. 8-16 FIGURA 8-17 Reactores de flujo continuo típicos: (a) con difusores de burbuja fina, y (b) con difusores de burbuja gruesa. Un modelo cinético del sistema de flujo en pistón es matemáticamente difícil de obtener, pero Lawrence y McCarty [18] hicieron dos hipótesis simplificativas que conducen a un modelo cinético útil para describir el funcionamiento de un reactor de flujo en pistón: 1. La concentración de microorganismos en el afluente al reactor es aproximadamente la misma que la del efluente del mismo. Esta hipótesis se aplica sólo en los casos en los que THETAc/THETA > 5. La concentración media de microorganismos en el reactor que resulta se simboliza con X. 2. La tasa de utilización del substrato, al pasar el residuo a través del reactor, viene dada por la siguiente expresión: rsu = -(kSX/(Ks + S)) (8.56) Integrando la Ecuación 8.56 sobre el tiempo de retención del residuo en el tanque, y simplificando, la expresión que resulta es la siguiente: 1/THETAc = (Yk(So - S) / ((So - S) + (1 + alfa)Ks ln (Si/S))) - kd (8.57) donde: So = concentración del afluente. S = concentración del efluente. Si = concentración del afluente al reactor tras la mezcla con el caudal de recirculación =(So + alfa ·S) / (1 + alfa) alfa = relación de recirculación. Los demás términos ya se han definido anteriormente. La Ecuación 8.57 es muy parecida a la Ecuación 8.40, que se aplica a sistemas de mezcla completa, con o sin recirculación. La principal diferencia entre ambas ecuaciones es que en la Ecuación 8.57, THETAc también es función de la concentración de residuo en el efluente. El sistema de flujo en pistón con recirculación puro, es teóricamente más eficaz en la estabilización de la mayoría de los residuos solubles que el sistema de mezcla completa con recirculación, tal como se puede apreciar en la Figura 8-15. En la práctica, es difícil conseguir un régimen de flujo en pistón puro debido a la dispersión longitudinal. Esta dificultad, junto con el hecho de que el sistema de flujo en pistón no puede soportar elevadas cargas instantáneas de la misma manera que el sistema de mezcla completa, tiende a reducir las diferencias entre los rendimientos de ambos modelos. Se ha podido comprobar que, al dividir el tanque de aireación en una serie de reactores en serie, se puede mejorar la eficacia del tratamiento sin que ello suponga una disminución de la capacidad del sistema para soportar elevadas cargas instantáneas. La elección de los diferentes tipos de reactores se analiza con mayor detalle en el Capítulo 10. Instalaciones de sedimentación para el proceso de fangos activados. Es importante volver a destacar y recordar que el tanque de sedimentación es un elemento integral del proceso de tratamiento de fangos activados. No se puede considerar el diseño de un reactor independientemente del de las instalaciones de sedimentación asociadas. Para cumplir con las normativas de vertido en cuanto a sólidos en suspensión y DBO asociados a los sólidos en suspensión volátiles del efluente, y para mantener THETAc independiente de THETA, es necesario tener la posibilidad de separar los sólidos del líquido mezcla y recircular parte de ellos al reactor. Dado que la microbiología del proceso es variable, se ha comprobado que las características de sedimentación de los sólidos biológicos del liquido mezcla son diferentes para cada planta, en función de las características del agua residual y de las numerosas variables asociadas al diseño y operación del proceso. Por ello, cuando se proyectan instalaciones de sedimentación para una planta de tratamiento, tanto nueva como ya existente, se deben realizar ensayos de sedimentación en columna, y el proyecto deberá basarse en los resultados de los mismos. Si no es posible realizar ensayos de sedimentación, el proyecto deberá realizarse en función de las cargas hidráulica y de sólidos. Ambos procedimientos se consideran con mayor profundidad en el Capitulo 10. El abultamiento del fango en el proceso de fangos activados (Bulking). El término «bulking» se aplica a la condición en la que se da una superabundancia de organismos filamentosos en el liquido mezcla de un proceso de fangos activados (véase Fig. 8-18). La presencia de organismos filamentosos provoca que los flóculos biológicos del reactor sean voluminosos y poco consistentes. Los flóculos así formados no sedimentan bien, y suelen ser arrastrados, en grandes cantidades, en el efluente de los tanques de sedimentación. Los organismos filamentosos que se presentan en el proceso de fangos activados incluyen una variedad de bacterias filamentosas, actinomicetos y hongos [17,42]. Las condiciones que favorecen el crecimiento de los organismos filamentosos son muy diversas, y varían para cada planta. El control de los organismos filamentosos se ha conseguido de diferentes maneras, ya sea por adición de cloro o de peróxido de hidrógeno al fango activado de retorno, por alteración de la concentración de oxigeno disuelto en el tanque de aireación, por alteración de los puntos de alimentación del agua a tratar para incrementar el valor de la relación F/M, mediante la adición de nutrientes básicos (p.e. nitrógeno y fósforo), adición de nutrientes y factores de crecimiento de traza o, más recientemente, mediante el uso de selectores [2, 17, 42, 44]. El control del crecimiento de los organismos filamentosos en procesos de mezcla completa se ha conseguido mezclando el fango de retorno con el agua residual entrante en un pequeño tanque de contacto anóxico conocido con el nombre de «selector» [2,17]. A partir de la experiencia práctica, se ha podido comprobar que el liquido mezcla de los procesos de fangos activados con flujo en pistón sedimenta mejor que el procedente de los procesos de mezcla completa, y que tiende a tener menos organismos filamentosos. Asimismo, se ha podido apreciar que también sedimenta mejor el liquido procedente de reactores discontinuos secuenciales y fondo oscuro, y (f) filamentos de Thiothrix, 400 aumento y fondo oscuro. A partir de la experiencia práctica, se ha podido comprobar que el líquido mezcla de los procesos de fangos activados con flujo en pistón sedimenta mejor que el procedente de los procesos de mezcla completa, y que tiende a tener menos organismos filamentosos. Asimismo, she podido apreciar que también sedimenta mejor el líquido procedente de reactores discontinuos secuenciales (véase el siguiente apartado). Experimentalmente, como muestra la Figura 8-19, se ha podido comprobar que la abundancia relativa de organismos filamentosos y no filamentosos está relacionada con sus tasas de crecimiento cuando se exponen a diferentes concentraciones de substratos (e.d. concentraciones elevadas en el proceso con flujo en pistón, y bajas en el proceso de mezcla completa). En relación con la Figura 8-19, se puede concluir que los organismos no filamentosos que forman flóculos presentan un valor de µmáx elevado pero una baja afinidad al substrato (Ks alta), mientras que los filamentosos tienen un valor µmáx de bajo y una alta afinidad por el substrato (Ks baja). Por lo tanto, las bajas concentraciones de substrato que se presentan en los reactores de mezcla completa favorecen el crecimiento de los organismos filamentosos. Para mayores detalles sobre el uso de selectores en el proceso de fangos activados, consúltese la referencia bibliográfica [17] Por otra parte, el diseño de selectores se aborda en el Capítulo 10. FIGURA 8-18 Organismos filamentosos típicos presentes en el fango abultado: (a y b) 100 aumentos; (c) 400 aumentos; (d y e) filamentos de Sphaerotilus, 400 aumentos FIGURA Curvas de crecimiento típico para organismos filamentosos y no filamentosos. Lagunas 8-19 aireadas Las lagunas aireadas (a veces denominadas «estanques aireados»), se desarrollaron a partir de estanques de estabilización facultativos en los que se instalaron aireadores de superficie para eliminar los olores que se producían al estar sometidas a sobrecargas orgánicas (véase Fig. 8-20). Aunque en la literatura se pueden encontrar diversas definiciones de los procesos de lagunas aireadas, en este texto se utilizará la siguiente descripción de estos procesos. FIGURA Laguna aireada típica. 8-20 Descripción del proceso. El proceso del lagunaje aireado es esencialmente el mismo que el de fangos activados de aireación prolongada convencional (THETAc = 20 días), excepto que se usa como reactor un depósito excavado en el terreno. El oxígeno necesario en el proceso se suministra mediante difusores o aireadores superficiales. En una laguna aerobia, la totalidad de los sólidos se mantienen en suspensión. En el pasado, las lagunas aireadas se operaban como los sistemas de fangos activados sin recirculación, y solían ir seguidas de grandes estanques de sedimentación. Para conseguir los niveles de tratamiento secundario que especifica la U.S. Environmental Protection Agency (véase Tabla 4-1), en la actualidad, se utilizan muchas lagunas aireadas complementadas con instalaciones de sedimentación e incorporando recirculación de sólidos biológicos. Microbiología del proceso. Dado que el proceso de lagunaje aireado es, esencialmente, el mismo que el de fangos activados, la microbiología es también similar. Existen algunas diferencias, puesto que la gran superficie asociada a las lagunas aireadas puede dar lugar a efectos térmicos más señalados de lo que es normal en el proceso convencional de fangos activados. En los sistemas de lagunas aireadas es posible llevar a cabo el proceso de nitrificación, tanto de forma estacional como en continuo. El grado de nitrificación depende del diseño y de las condiciones de funcionamiento del sistema, así como de la temperatura del agua residual. Generalmente, cuanto más alta sea la temperatura de ésta y cuanto menores las cargas (aumento del tiempo de retención del fango), mayor será el grado de nitrificación alcanzable. Análisis del proceso. El análisis de una laguna aireada se puede llevar a cabo utilizando la técnica descrita en la Sección 8.5 para un sistema aerobio de mezcla completa sin recirculación, o bien el procedimiento descrito anteriormente en esta sección para un proceso de fangos activados con recirculación, dependiendo del método de funcionamiento utilizado. Otro enfoque diferente consiste en suponer que la eliminación de la DBO5, tanto la total asociada a la fracción soluble y a los sólidos en suspensión como solamente la soluble, se pueden describir en términos de una función de primer orden (rsu = - k · S) o de cuasi segundo orden (rsu = - k · S · X). El análisis de un reactor de mezcla completa sin recirculación ya se ha realizado anteriormente en este capítulo (véase Sección 8.5) y se detalla, adicionalmente, en el apéndice G. Las ecuaciones correspondientes para una laguna aireada única son las siguientes: Para una cinética de primer orden: S/So = 1 / (1 + k1 (V/Q)) (8.58) Para cinética de cuasi segundo orden: S/So = 1 / (1 + k2X (V/Q)) (8.59) donde: S = concentración de DBO5 del efluente, mg/l. So = concentración de DBO5 del afluente, mg/l. k1, k2 = constante de eliminación global de la DBO5, L/mg · d. V = volumen, m3. Q = caudal, m3/día. X = sólidos en suspensión del liquido mezcla, mg/l. La ecuación correspondiente, deducida de la consideración de la cinética de eliminación del substrato soluble dada por la Ecuación 8.8 es: S/So = 1 / (1 + [kX/(Ks + S)] (V/Q)) (8.60) Los términos de la Ecuación 8.60 ya se han definido anteriormente. La aplicación de las Ecuación 8.58, 8.59 y 8.60 se trata en el Problema 8.17 y en el Ejemplo 10-5 del Capitulo 10. Reactor discontinuo secuencial Un reactor discontinuo secuencial (SBR) es un sistema de tratamiento de fangos activados cuyo funcionamiento se basa en la secuencia de ciclos de llenado y vaciado. Los procesos unitarios que intervienen son idénticos a los de un proceso convencional de fangos activados. En ambos sistemas intervienen la aireación y la sedimentaciónclarificación. No obstante, existe entre ambos una importante diferencia. En las plantas convencionales, los procesos se llevan a cabo simultáneamente en tanques separados, mientras que en los SBR, los procesos tienen lugar secuencialmente en el mismo tanque. Descripción del proceso. Tal como se emplean hoy en día, todos los sistemas de SBR tienen en común cinco etapas, que tienen lugar de forma secuencial: (1) llenado; (2) reacción (aireación); (3) sedimentación (clarificación); (4) extracción (vaciado por decantación), y (5) fase inactiva. Cada uno de estos pasos se ilustra en la Figura 8-21 y se describe en la Tabla 8-8. Para alcanzar objetivos de tratamiento específicos, se han introducido numerosas modificaciones del proceso variando los tiempos asociados a cada uno de los diferentes pasos [37]. FIGURA 8-21 Secuencia de funcionamiento típica para un reactor discontinuo secuencial [37]. TABLA 8-8 Descripción de las diferentes fases de funcionamiento de un reactor discontinuo secuenciala Adaptado de la bibliografía [37]. La purga de los fangos suele tener lugar durante la fase de sedimentación o la fase inactiva, aunque puede llevarse a cabo durante cualquier fase, dependiendo del modo dc operación. a b La purga del fango es otro paso importante en el funcionamiento de los SBR que afecta, de manera importante, a su rendimiento. No se incluye como una de las cinco etapas básicas del proceso, puesto que no existe un momento determinado dedicado a la eliminación del fango dentro del ciclo de funcionamiento. La cantidad de fango que hay que purgar y la frecuencia con que se debe efectuar la purga se determinan según las necesidades dictadas por los rendimientos, como ocurre con el sistema de flujo continuo convencional. En el funcionamiento de los SBR, la purga del fango suele realizarse en la fase de sedimentación o en la de inactividad. Una característica única de los SBR es que no es necesario disponer de un retorno de fangos activados (RFA). Debido a que tanto la aireación como la decantación tienen lugar en el mismo tanque, no se pierde cantidad de fango alguna en la fase de reacción, y no es necesario recircular parte del fango de la sedimentación para mantener constante el nivel de fangos en la cuba de aireación [37]. Algunas modificaciones incorporadas al proceso de SBR contemplan la posibilidad de modos de operación a caudal continuo. Aplicación del proceso. A primeros de los años sesenta, con el desarrollo de nuevos equipos y nuevas tecnologías, renació el interés por los sistemas de llenado-vaciado. Las mejoras en los dispositivos de aireación y de control han permitido el desarrollo de este tipo sistemas hasta alcanzar el nivel de eficacia actual, que permite que la tecnología de los SBR compita con éxito con los sistemas convencionales. Todos los residuos que habitualmente se tratan con procesos de fangos activados se pueden tratar con reactores discontinuos secuenciales. Digestión aerobia La digestión aerobia es un método alternativo de tratar los fangos orgánicos producidos en el curso de las diversas operaciones de tratamiento. Los digestores aerobios se pueden emplear para el tratamiento de: (1) únicamente fangos activados o de filtros percoladores; (2) mezclas de fangos activados o de filtros percoladores con fangos primarios, o (3) fango biológico en exceso de plantas de tratamiento de fangos activados sin sedimentación primaria. Actualmente suelen emplearse dos variantes del proceso de digestión aerobia: el sistema convencional y el sistema con oxigeno puro, aunque también se ha empleado la digestión aerobia termófila. En el Capítulo 12 se proporcionan detalles adicionales de todos estos procesos. Descripción del proceso. En la digestión aerobia convencional, el fango se airea durante un largo periodo de tiempo en un tanque abierto, sin calefacción, empleando difusores convencionales o aireadores superficiales. El proceso se puede llevar a cabo de manera continua o discontinua. En plantas de pequeño tamaño se emplea el sistema discontinuo, en el que el fango se airea y se mezcla completamente durante un largo periodo de tiempo, dejándose sedimentar a continuación en el interior de la misma cuba [37]. En los sistemas continuos, la decantación y concentración del fango se realiza en un tanque independiente. La digestión con oxigeno de gran pureza es una modificación del proceso de digestión aerobia en el que se sustituye el aire por oxígeno de gran pureza. El fango que resulta es parecido al fango que se obtiene en los procesos de digestión aerobia convencionales. La digestión aerobia termófila representa un refinamiento adicional del proceso de, digestión aerobia. Este proceso puede permitir conseguir altos rendimientos de eliminación de la fracción biodegradable (superiores al 80 por 100) en tiempos de detención cortos (3 a 4 días) mediante la acción de bacterias termófilas a temperaturas entre 25 y 50 ºC superiores a la temperatura ambiente. Microbiología del proceso. La digestión aerobia, como se ha comentado, es similar al proceso de fangos activados. Al agotarse el suministro de substrato disponible, los microorganismos empiezan a consumir su propio protoplasma para obtener energía para las reacciones de mantenimiento celular. Cuando ocurre esto, se dice que los organismos se hallan en fase endógena. Como se puede apreciar en la Ecuación 8.31, el tejido celular se oxida a dióxido de carbono, amoníaco y agua por vía aerobia. En la práctica, sólo se puede oxidar entre el 75 y el 80 por 100 del tejido celular, puesto que el resto está formado por componentes inertes y compuestos orgánicos no biodegradables. El amoniaco producido en esta oxidación se oxida a nitrato a medida que progresa la digestión. Si se mezcla fango activado, o fango procedente de filtros percoladores, con fango primario para su digestión aerobia conjunta, se producirá tanto la oxidación directa de la materia orgánica del fango primario como la oxidación endógena del tejido celular. Desde el punto de vista de su funcionamiento, se puede concluir que la mayoría de los digestores aerobios son reactores de flujo arbitrario sin recirculación. Análisis del proceso. Los factores a tener en cuenta en el análisis de los digestores aerobios incluyen el tiempo de detención hidráulica, los criterios de carga del proceso, las necesidades de oxigeno, las necesidades energéticas para el mezclado, las condiciones ambientales y el funcionamiento y explotación del proceso. El proyecto de digestores aerobios se trata en el Capitulo 12. 8.8 PROCESOS AEROBIOS DE TRATAMIENTO DE CULTIVO FIJO Los procesos de tratamiento aerobios de cultivo fijo se emplean, normalmente, para eliminar la materia orgánica que se encuentra en el agua residual. También se pueden emplear para llevar a cabo el proceso de nitrificación (conversión del nitrógeno amoniacal en nitrato). Los procesos de cultivo fijo incluyen los filtros percoladores, los filtros de pretratamiento o desbaste, los reactores biológicos rotativos de contacto (biodiscos) y los reactores de nitrificación de lecho fijo. Dado que el proceso de filtros percoladores es el más comúnmente empleado, será tratado con mayor detalle que el resto de los procesos. La nitrificación con procesos de película fija se analiza en la Sección 8.11, en la que se estudia la eliminación biológica de nutrientes. Filtros percoladores El primer filtro percolador se puso en funcionamiento en Inglaterra en 1893. El concepto de filtro percolador nació del uso de los filtros de contacto, que eran estanques impermeables rellenados con piedra machacada. En su funcionamiento, el lecho de contacto se llenaba con el agua residual por la parte superior y se permitía el contacto del agua con el medio durante un corto espacio de tiempo. A continuación, se dejaba drenar el lecho y se permitía un cierto tiempo de reposo antes de repetir el ciclo. Un ciclo típico exigía un total de 12 horas, de las cuales 6 se destinaban al reposo del filtro. Las limitaciones del filtro de contacto incluían una posibilidad relativamente alta de obturaciones, la duración del periodo de reposo, y la carga que podía emplearse, que era relativamente baja. Descripción del proceso. El filtro percolador moderno (véase Fig. 8-22) consiste en un lecho formado por un medio sumamente permeable al que se adhieren los microorganismos y a través del cual percola el agua residual, fenómeno del que recibe el nombre el proceso. El medio filtrante suele estar formado por piedras (en ocasiones también se emplean escorias), o diferentes materiales plásticos de relleno. En el caso de filtros percoladores con medio filtrante de piedra, el diámetro de las piedras oscila entre 2,5 y 10 cm. La profundidad del lecho varía en cada diseño particular, pero suele situarse entre 0,9 y 2,5 metros, con una profundidad media de 1,8 metros. Los filtros de piedra suelen ser circulares, y el agua residual se distribuye por la parte superior del filtro mediante un distribuidor rotatorio. Los filtros percoladores que emplean lechos de material plástico pueden tener diversas formas, habiéndose construido filtros circulares, cuadrados y de otras formas diversas, con profundidades entre 4 y 12 metros. Se suelen emplear tres tipos de medios filtrantes plásticos: (1) relleno de flujo vertical (véase Fig 8-23); (2) relleno de flujo transversal (véase Fig. 10-33), y (3) otras distribuciones de rellenos a granel (véase Fig. 10-33). Los filtros incluyen un sistema de drenaje inferior para recoger el liquido tratado y los sólidos biológicos que se hayan separado del medio. Este sistema de drenaje inferior es importante, tanto como instalación de recogida como por su estructura discontinua a través de la cual puede circular el aire (véase Fig. 8-22). El líquido recogido pasa a un tanque de sedimentación en el que se separan los sólidos del agua residual. En la práctica, se recicla una parte del liquido recogido en el sistema de drenaje inferior o del efluente del tanque de sedimentación, para diluir la concentración del agua residual que entra en el sistema y para mantener la humedad de la película biológica. La materia orgánica presente en el agua residual se degrada por la acción de la población de microorganismos adherida al medio (véase Fig. 8-24). La materia orgánica del liquido es adsorbida en la película biológica, en cuyas capas externas (0,1 a 0,2 mm) se degrada bajo la acción de los microorganismos aerobios. Cuando los microorganismos crecen, aumenta el espesor de la película, y el oxígeno se consume antes de que pueda penetrar en todo el espesor de la película. Por lo tanto en la proximidad de la superficie del medio, se crea un ambiente anaerobio. Conforme la película aumenta de espesor, la materia orgánica adsorbida se metaboliza antes de que pueda alcanzar los microorganismos situados cerca de la superficie del medio filtrante. La consecuencia de no disponer de una fuente orgánica externa de carbono celular es que los microorganismos situados cerca de la superficie del medio filtrante se hallan en la fase de crecimiento endógena, en la que pierden la capacidad de adherirse a la superficie del medio. En estas condiciones, el líquido arrastra la película a su paso por el medio, y se inicia el crecimiento de una nueva capa biológica. Este fenómeno de pérdida de la película biológica, conocido como arrastre, es básicamente función de la carga hidráulica y orgánica del filtro. La carga hidráulica origina las velocidades de arrastre, y la carga orgánica influye en la velocidad de metabolismo en la capa biológica. En los filtros percoladores modernos, la carga hidráulica del sistema se regula para asegurar un espesor uniforme de la película biológica. FIGURA 8-22 Filtros percoladores típicos: (a) corte de un filtro percolador (de Dorr-Oliver); (b) filtro de medio pétreo convencional, y (c) filtros percoladores de alta carga. FIGURA 8-23 Módulo de plástico de flujo vertical típico empleado en filtros percoladores de alta carga. FIGURA 8-24 Representación esquemática de la sección transversal de una película biológica en un filtro percolador. Microbiología del proceso. La comunidad biológica presente en un filtro está compuesta principalmente por protistas, incluyendo bacterias facultativas, aerobias y anaerobias, hongos, algas y protozoos. También se suelen encontrar algunos animales superiores como gusanos, larvas de insectos y caracoles. En el filtro percolador, los organismos predominantes son las bacterias. Su misión, junto con las bacterias aerobias y anaerobias, es la de descomponer la materia orgánica del agua residual. Entre las especies bacterianas habitualmente presentes están las Achromohbacter, Flavobacterium, Pseudomonas y Alcaligenes. Dentro de la capa viscosa, en la que prevalecen condiciones adversas para el crecimiento, se presentan las formas filamentosas Sphaerotilus natans y Beggiatoa. En las zonas más bajas del filtro se encuentran las bacterias nitrificantes, Nitrosomonas y Nitrobacter [13, 14]. Los hongos presentes, también contribuyen a la estabilización del agua residual, pero su contribución sólo es importante a pH bajos o en el caso de algunas aguas residuales de origen industrial. En ocasiones, su crecimiento puede ser tan rápido que produce la obstrucción del filtro y limitan la ventilación del mismo. Entre las especies que suelen presentarse en los filtros percoladores se han identificado las siguientes: Fusazium, Mucor, Pencillium, Geotrichum, Sporatichum y diversas levaduras [13, 14]. Las algas sólo pueden crecer en las capas superiores del filtro, en las zonas hasta las que puede llegar la luz solar. Entre las especies de algas que se suelen encontrar en los filtros percoladores se pueden citar la Phormidium, Chlorella y Ulothrix [13, 14]. Por lo general, las algas no toman parte directa en la degradación de los residuos, pero añaden oxigeno al agua residual que se está filtrando durante las horas del día. Desde un punto de vista operacional, las algas son un estorbo, ya que pueden originar la obstrucción de la superficie del filtro, lo que conduce a la producción de olores. Los protozoos que se pueden encontrar en los filtros percoladores son predominantemente del grupo ciliata, e incluyen la Vorricella, la Opercularia y la Epistylis [13, 14]. Al igual que en el proceso de fangos activados, su función no es estabilizar el agua residual sino controlar la población bacteriana. Los animales superiores tales como caracoles, gusanos e insectos, se alimentan de las capas biológicas del filtro, con lo que ayudan a mantener la población bacteriana en estado de gran crecimiento o de rápida utilización del alimento. Las formas de vida superiores no son tan comunes en los filtros percoladores de alta carga. Los presencia de caracoles es especialmente problemática en los filtros nitrificantes, en los que se sabe que consumen la mayor parte del crecimiento de las bacterias nitrificantes. Las poblaciones individuales de la comunidad biológica descritas anteriormente sufren variaciones a lo largo de la profundidad del filtro, en función de los cambios que se produzcan en la carga orgánica, la carga hidráulica, la composición del agua residual afluente, el pH, la temperatura, la disponibilidad de aire y otros factores que se analizarán en lo que sigue. Análisis del proceso. Los principales factores que hay que tener en cuenta a la hora de predecir el funcionamiento de los filtros percoladores son las cargas orgánica e hidráulica, y el grado de tratamiento necesario. A lo largo de los años, diversos investigadores han propuesto ecuaciones para describir las eliminaciones observadas, como por ejemplo Atkinson [4], Bruce y Merckens [6], Eckenfelder [7], Fairall [9], Galler y Gotass [10], Germain [11], Logen et. al. [20,21], el National Research Council [27], Schultz [32] y Velz [40]. En la discusión que sigue se presentan y analizan, tanto el enfoque teórico basado en el balance de masa empleado en la elaboración de un modelo del proceso de los filtros percoladores, como el enfoque práctico del desarrollo de modelos a partir del análisis de datos experimentales. Balance de masas. Atkinson y sus colaboradores [4] han propuesto el siguiente modelo para describir la tasa de flujo de materia orgánica hacia la película biológica, suponiendo que la difusión en la misma es el factor que controla la velocidad de reacción, y suponiendo, también, que no existe gradiente de concentración alguno a lo largo de la película líquida (véase Fig. 8-25): FIGURA Esquema de definición para el análisis del proceso del filtro percolador [31]. rs = - EhkoS / (Km + S) (8.61) donde: rs = tasa de flujo de materia orgánica hacia el interior de la capa biológica, m/dia. 8-25 E = factor de efectividad (0 < E < 1). h = espesor de la capa biológica, m. ko = tasa máxima reacción, d-1. S = concentración media de substrato (p.e. DBO) en un volumen elemental dentro de la masa líquida, mg/l. Km = constante de velocidad mitad, mg/l. Debido a que el factor de efectividad E es aproximadamente proporcional a la concentración de DBO del agua, la Ecuación 8.6l se puede reescribir como: rs = - fhkoS2 / (Km + S) (8.62) donde: f = factor de proporcionalidad. Este modelo se puede aplicar al análisis de un filtro percolador efectuando un análisis del balance de masas correspondiente a la materia orgánica contenida en el volumen del líquido (véase Fig. 8-25): 1. Planteamiento general: Velocidad de acumulación de substrato dentro de los límites del sistema = = Cantidad de substrato que entra en el elemento de volumen - Cantidad de substrato que sale del elemento de volumen + + Flujo de substrato desde el volumen elemental de la película biológica (8.63) 2. Planteamiento simplificado: Acumulación = Entrada - Salida + Utilización (8.64) 3. Representación simbólica: (dS/dt)dV = QS - Q (S + (dS/dD)dD) + dDw (- fhkoS2/(Km + S)) (8.65) donde: Q = caudal volumétrico, m3/día. w = anchura de la sección considerada, m. Z = profundidad del filtro, m. Si se suponen condiciones estacionarias (dS/dt = 0), la Ecuación 8.65 se puede simplificar hasta llegar a: QdS/dD = -fkohw S2/(Km + S) (8.66) Si se supone que el valor del coeficiente de saturación es pequeño en relación con el de la DBO, la Ecuación 8.66 se puede escribir como: dS/dZ = - fhkowS/Q (8.67) La Ecuación 8.67 se puede integrar entre los límites Se y Si y entre 0 y D, con lo que se obtiene: Se/Si = exp [-(fhko)wD/Q] (8.68) donde: Se = concentración en el efluente, mg/l. Si = concentración en el afluente después de la mezcla del agua residual a tratar con el efluente recirculado, mg/l. El uso de la Ecuación 8.68 conlleva la determinación de los coeficientes f, h y ko para un conjunto determinado de condiciones de funcionamiento. El análisis que se acaba de llevar a cabo sirve para ilustrar el procedimiento que se sigue para realizar el balance de masa de un proceso biológico de cultivo fijo. No obstante, hay que hacer mención del hecho de que muchos de los modelos obtenidos a partir de bases teóricas no han funcionado demasiado bien a la hora de modelar el rendimiento real de los filtros percoladores. A continuación, se presentan algunos de los modelos basados en la experiencia práctica, que se han empleado para la descripción del funcionamiento y rendimiento de los filtros percoladores. Ecuaciones del NCR. Debido a la irregular naturaleza de las piedras, cantos rodados y escorias empleadas en los filtros construidos con materiales pétreos, es difícil obtener expresiones teóricas que se ajusten a la realidad del funcionamiento de esta clase de filtros. Las ecuaciones del NCR para la descripción de los rendimientos de los filtros percoladores son expresiones empíricas desarrolladas a partir de los registros de datos de explotación de las plantas dotadas de filtros percoladores que trataban los residuos de las instalaciones militares durante la II Guerra Mundial [27]. La aplicación de estas fórmulas está especialmente indicada para filtros de materiales pétreos de una o varias fases con relaciones de recirculación diversas (véase Fig. 8-26). Para un filtro de material pétreo de un proceso de filtración que conste de un sólo filtro, o para el primer filtro de un proceso de doble etapa, la ecuación es la siguiente: E1 = 100 / (1 + 0,4425 · SQRT(W/VF)) (8,69) donde: E1 = rendimiento de eliminación de la DBO a la temperatura de 20 ºC, incluyendo los efectos de la recirculación y la sedimentación, porcentaje W = carga de DBO aplicada al filtro, kg/día. V = volumen del medio filtrante. F = factor de recirculación. El factor de recirculación se calcula empleando la Ecuación 8.70: F = (1 + R)/(1 + R/10)2 (8.70) donde: R = tasa de recirculación, Qr/Q. Qr = caudal de recirculación. Q = caudal de agua residual. FIGURA 8-26 Diagramas de flujo típicos de los procesos de filtros percoladores con diferentes esquemas de recirculación: (a) filtros de una etapa, (b) filtros de dos etapas (véase también Fig. 10-31). El factor de recirculación representa el número medio de veces que circula a través del filtro la materia orgánica del afluente. El término R/10 pretende tener en cuenta el hecho, observado experimentalmente de que la eliminación de la materia orgánica disminuye conforme aumenta el número de pasos de aquélla a través del filtro [27]. En la Tabla 10-13 se proporcionan las relaciones de recirculación típicas para diferentes tipos de filtros. Para el filtro secundario (véase Fig. 8-26), la ecuación que resulta es: E2 = 100 / (1 + (0,4425/(1 - E1)) · SQRT(W'/VF)) (8.71) donde: E2 = rendimiento de eliminación de la DBO a 20 ºC para el filtro secundario, incluyendo el efecto de la sedimentación y de la recirculación, porcentaje. E1 = fraccion de DBO eliminada en el filtro de la primera etapa. W' = carga de DBO aplicada al filtro de la segunda etapa. El efecto de la temperatura del agua residual sobre la eficacia del proceso se puede aproximar empleando la Ecuación 8.14 sustituyendo ET por rT y E20 por r20. Para el valor de THETA, el coeficiente de temperatura-actividad, se suele adoptar 1,035. En el Ejemplo 8-2 se ilustra la aplicación de las ecuaciones del NRC. Ejemplo 8-2. Dimensionamiento de un filtro percolador empleando las ecuaciones del NCR. Se desea tratar un agua residual con una DBO5 de 200 mg/l mediante un filtro percolador de dos etapas. Se desea que la calidad del efluente sea de 25 mg/l de DBO5. Si la profundidad de ambos filtros debe ser de 1,8 m, y la relación de recirculación es 2:1, calcular los diámetros de filtro necesarios. Suponer Q = 8.000 m3, temperatura del agua residual = 20 ºC, y que E1 = E2. Solución 1. Cálculo de E1 y E2: Eficacia conjunta = (200 - 25/200)(100) = 87,5 % E1 + E2(1 - E1) = 0,875 E1 = E2 = 0,646 2. Cálculo del factor de recirculación: F = (1 +R)/(1 + R/10)2 = (1 + 2)/(1,2)2 = 2,08 3. Cálculo de la carga de DBO del primer filtro: W= (C mg/l)(Q m3/d)·(1/1.000 kg/g) W = 200(8.000)·(1/1.000) = 1.600kg DBO5/d 4. Cálculo del volumen para la primera etapa: E1 = 100 / (1 + 0,4425 · SQRT(1.600 kg/VF)) 64,6 = 100 / (1 + 0,4425 · SQRT(1.600 kg/V(2,08))) V = 501 m3 5. Cálculo del diámetro del primer filtro: A = V / d = 501 m3 /1,5 m = 334 m2 d = 20,62 m 6. Cálculo de la carga de DBO5 del segundo filtro: W'= (1 - E1)W= 0,354(l.600) = 535,25kg DBO5/d 7. Cálculo del volumen del filtro de la segunda etapa: E2 = 100 / (1 + (0,4425/(1-E1)) · SQRT(W/VF)) 64,6 = 100 / (1 + (0,4425/(1-0,646)) · SQRT(523,25/V(2,08)) V = 1.309 m3 8. Cálculo del diámetro del segundo filtro: A = V/D = 1.309 m3/1,5 m = 1.309 m3 d = 16,67 m 9. Cálculo de la carga de DBO5 de cada filtro: a) Filtro de la primera etapa Carga de DBO5 = (1.600 kg/d)/(501 m3) = 3,19 kg/m3 b) Filtro de la segunda etapa Carga de DBO5 =(1.512 kg/d)/(1.309 m3) = 0,40 kg/m3 10. Cálculo de la carga hidráulica de cada filtro: a) Filtro de la primera etapa Carga hidráulica = ((1 + 2)(8000 m3/d)/24 h/d) / (334 m2) = 2,99 m3/m2·h b) Filtro de la segunda etapa Carga hidráulica = ((1 + 2)(8000 m3/d)/24 h/d) / (872,67) = 1.146 m3/m2·h Comentario. Con el fin de facilitar la instalación de los mecanismos y equipos giratorios habituales, los diámetros calculados se deben redondear de 1,5 m en 1,5 m. Para reducir los costes de construcción, ambos filtros se suelen tomar de las mismas dimensiones. En los casos en los que se empleen dos filtros percoladores de iguales dimensiones, los rendimientos de ambos serán diferentes. En muchos casos, la carga hidráulica viene limitada por normativa. Formulaciones para medio filtrantes de material plástico. Debido a que las propiedades de los medios de plástico son más predictibles y conocidas a priori, se han desarrollado numerosas relaciones empíricas para predecir el funcionamiento y rendimiento de los filtros percoladores con rellenos de materiales plásticos. Dos de las expresiones más frecuentemente empleadas para describir el funcionamiento observado en este tipo de filtros son las propuestas por Eckenfelder [7] y por Germain [11] y Schultz [32]. La expresión propuesta por Eckenfelder es la siguiente: Se/Si = exp [-KSamD(Qv)-n] (8.72) donde: K = constante de la velocidad de la reacción observada (valor normalmente obtenido a partir de estudios en planta piloto), m/día. D = profundidad del filtro, m. Sa = superficie específica del filtro = Superficie del filtro Ax, (m2)/Unidad de volumen V, (m3) Qv= caudal volumétrico aplicado al filtro por unidad de área del filtro = Q/A, m/d. Q = caudal aplicado al filtro sin recirculación, m3/d. A = área transversal del filtro, m2. m, n = constantes empíricas. La forma general de la ecuación propuesta por Germain [11] y Schultz [32] es la siguiente: Se/Si = exp[-k20D(Qv)-n] (8.73) donde: Se = DBO5 total del efluente del filtro sedimentado, mg 1. Si = DBO5 total del agua residual aplicada al filtro, mg/l. k20 = constante de tratabilidad correspondiente a la profundidad media del filtro (D) a la temperatura de 20ºC, las unidades varian en función del valor del exponente n. D = profundidad del filtro, m. Qv = caudal volumétrico aplicado por unidad de área del filtro = Q/A, m3/min · m2. Q = caudal aplicado al filtro sin recirculación, m3/min. A = área transversal del filtro, m2. n = constante experimental, normalmente, n = 0,5. La constante de tratabilidad de la Ecuación 8.73, k20, engloba tanto la constante KT como la superficie específica As del medio filtrante como se indica en la Ecuación 8.72. El efecto de la temperatura del agua residual sobre la eficacia de la filtración se puede tener en cuenta ajustando el valor de k20 empleando para ello un valor de THETA = 1,035. El intervalo de valores de THETA que se ha podido establecer según estudios de campo se indica en la Tabla 8-5. En base al análisis de los datos correspondientes a diversos filtros existentes, Albertson [1] demostró que hay que introducir correcciones en el valor de la constante de tratabilidad para un agua residual determinada cuando se pretende aplicar el valor de k20 observado para una profundidad determinada para el diseño de un filtro de diferente profundidad. La relación propuesta por Albertson es la siguiente: k2 = k1 (D1/D2)X (8.74) donde: k1 = constante de tratabilidad para la profundidad de filtro D1. k2 = constante de tratabilidad para la profundidad de filtro D2. D1 = profundidad del primer filtro, m. D2 = profundidad del segundo filtro, m. x = 0,5 para filtros verticales y de material pétreo 0,3 para filtros de materiales plásticos. En la aplicación de las Ecuaciones 8.68, 8.72 o 8.73 para el diseño de filtros percoladores, es necesario recordar que el valor del término f · h · ko, K, o k20 varía con multitud de condiciones y circunstancias locales, por lo que el empleo de los valores propuestos en la literatura debe llevarse a cabo con extremo cuidado. Es más, dado que la mayoría de los valores de k que se dan en los diferentes textos no están normalizados en relación con la profundidad, es difícil, si no imposible, intentar comparar directamente los diferentes valores de k. En el Ejemplo 8-3 se ilustra la aplicación de la Ecuación 8.73 para el diseño de filtros percoladores. Ejemplo 8-3. Dimensionamiento de un filtro percolador empleando una ecuación de primer orden. Determinar la superficie necesaria para el tratamiento de un agua residual con una DBO5 de 300 mg/l mediante filtros sintéticos de 6 m y 9 m de profundidad, después de la sedimentación primaria. La DBO5 final del efluente debe ser de 25 mg 1 o inferior. Suponer que la constante de tratabilidad determinada realizando ensayos con un filtro de 6 m de profundidad es de 0,058 (m3/min)0,5 · m a 20 ºC. Solución 1.Determinar la superficie necesaria para un filtro de 6 m empleando la Ecuación 8.73: Se/Si = exp [-k20D(Qv)-n] a) Sustituyendo Q/A por Qv, y despejando, resulta: A = Q ((-ln Se/Si)/k20D)1/n b) Sustituyendo los valores conocidos se determina A: Se = 25 mg/l Si = 300 mg/l n = 0,5 k20 = 0,058 (m3/min)0,5 m para n = 0,5 D=6m Q = (8.000 m3/d)/(1.440 min/d) = 5,55 m3/min A = 5,55 ((-ln 25/300)/0,058 (6))2 = 283 m2 2. Determinación de la superficie necesaria para un filtro de 9 m empleando la Ecuación 8.73: a) Determinación del valor de k20 para una profundidad de filtro de 9 empleando la Ecuación 8.74: k30 = k20 (D20/D30)x k30 = 0,058 (20/30)0,5 = 0,0473 b) Sustituyendo los valores conocidos, se obtiene A: Se = 25 mg/l Si = 300 mg/l n = 0,5 k30 = 0,0473 (m3/min)0,5 m para n = 0,5 D=9m Q = (8.000 m3/d)/(1.440 min/d) = 5,55 m3/min A = 5,55 ((-ln 25/300)/0,0473 (30))2 = 189,1 m2 Recirculación. Otro factor, sobre cuya influencia sobre el comportamiento del filtro existe una considerable falta de entendimiento, es el efecto de la recirculación. En el pasado, se pudo constatar que la recirculación mejoraba la eficacia y rendimiento de los filtros de materiales pétreos. No obstante, en base a estudios más recientes, parece que las ventajas de la recirculación se deben, principalmente, al mejor lavado por arrastre y al riego del filtro. Mediante el adecuado control de la carga hidráulica, se ha conseguido mantener, de forma uniforme, una capa de biomasa más fina, lo cual ha comportado una mejora en el rendimiento, y también ha sido posible evitar el fenómeno de arrastre que, a menudo, ocurría en la mayoría de los filtros percoladores de medio pétreo. La aplicación de la recirculación en filtros de medios sintéticos tiene una concepción diferente a la de los filtros de piedra. Los medios sintéticos típicos necesitan un caudal específico de riego (caudal por unidad de área) más alto para favorecer el desarrollo de la capa biológica a lo largo de la profundidad del filtro. Por lo tanto, es necesario recircular para mantener el grado de mojado necesario para cada medio determinado. Los caudales adecuados, tanto para filtros de material pétreo como sintéticos, se tratan en el Capitulo 10. El efecto de la recirculación sobre el funcionamiento de un filtro de relleno sintético se analiza en el Ejemplo 8-4. Ejemplo 8-4. Estudio del efecto de la recirculación sobre el proceso de filtros percoladores. Estudiar el efecto de las relaciones de recirculación (entre 0 y 4) para un proceso de filtros percoladores. Utilizar los datos e información del Ejemplo 8-3 para el filtro percolador de 9 m. Solución 1. Determinar la fracción de la carga orgánica aplicada que se elimina, empleando la Ecuación 8.73, cuando la relación de recirculación vale 0. Se/Si = exp [-k20D(A/Q)n] a) Los datos pertinentes, obtenidos del Ejemplo 8-3, son: Se = 25 mg/l Si = 300 mg/l n = 0,5 k20 = 0,0583 (m3/min)0,5 m para n = 0,5 D=9m Q = (8.000 m3/d)/(1.440 min/d) = 5,55 m3/min A = 189,1 m2 b) La fracción de la carga orgánica aplicada eliminada es: Se/Si = 25/300 = 0,083 Fracción eliminada = 1 - Se/Si = 1 - 0,083 = 0,917 (Nótese que cuando la relación de recirculación es cero, la fracción eliminada tal como se acaba de calcular, también corresponde a la fracción de la DBO entrante eliminada.) 2. Determinar la fracción de la carga eliminada para varios valores de la relación de recirculación: a) Utilizar la Ecuación 8.73 en la siguiente forma, donde Si es el afluente al filtro, incluida la recirculación. Se/Si = exp [-0,0473 (9) (189,1/(1+ alfa) 5,55)0,5] b) Elaborar una tabla de cálculo: 3. Determinar la fracción de la carga orgánica entrante eliminada a partir de los datos del paso 2. Ello se puede lograr haciendo un balance de materia a la entrada del filtro, teniendo en cuenta tanto el flujo afluente como el de recirculación: QSo + alfa Q Se = (1 + alfa) Q Si donde: So = DBO en el agua residual afluente antes de la recirculación. Se = DBO en el caudal de recirculación. alfa = relación de recirculación. Si = DBO aplicada al filtro. Suponer que Q = 1 y escribir la anterior relación de forma que permita calcular el valor de (So/Se) a partir de los datos del paso 2: So/Se = [ (1+alfa)Si/Se - alfa] Calcular la fracción del afluente eliminada a partir de los datos del paso 2. Comentario. A partir de los cálculos realizados, se puede comprobar que esta modelación predice que, conforme aumenta la relación de recirculación, se reduce el grado de tratamiento, tanto si se mide en términos de la carga aplicada al filtro (1-Se/Si) como si se mide en función de la carga entrante (1-Se/So). El empleo de la recirculación para reducir la carga aplicada, para mantener el grado de mojado óptimo del filtro, o para el control hidráulico, es un aspecto crítico aun cuando no se mejore la efectividad del proceso. Limitaciones de la transferencia de masa. Uno de los problemas que se encuentran en el proyecto de los filtros percoladores es la determinación de la máxima cantidad de materia orgánica que se puede aplicar al filtro antes de que el oxigeno pase a ser una variable limitante. Reconociendo las limitaciones de todo planteamiento analítico, debidas a las numerosas variables que intervienen, el problema se puede plantear, sin embargo, igualando la transferencia de materia orgánica procedente de la capa líquida, definida en la Ecuación 8.62, a la tasa de transferencia de oxígeno dictada por la Ecuación 6.54. Asimismo, se debe incluir un factor que tenga en cuenta el rendimiento. Ello se puede hacer multiplicando el término de la transferencia de substrato por un factor del tipo (1 - y), donde y es el rendimiento esperado expresado en tanto por uno. A partir de los datos que se presentan en la literatura, parece que cuando las concentraciones en la masa del liquido se hallan en el intervalo entre 400 y 500 mg/l, la transferencia de oxigeno se puede convertir en un factor limitante [31]. El flujo de aire a través de los filtros se considera en el Capítulo 10. Instalaciones de separación de sólidos para los filtros percoladores. Al igual que en el proceso de fangos activados, las instalaciones de separación de sólidos desempeñan un papel muy importante en el proceso del filtro percolador, ya que es imprescindible para la eliminación de los sólidos en suspensión arrastrados periódicamente en los filtros de baja carga, así como de las menores cantidades de sólidos desprendidos, de forma continua, en los filtros de alta carga. Si se adopta un sistema con recirculación, se podría reciclar una fracción de los sólidos sedimentados y purgar el resto, pero la recirculación de los sólidos biológicos sedimentados no es tan importante como en el proceso de fangos activados. En el proceso del filtro percolador, la mayoría de los microorganismos activos se adhiere al medio filtrante y no sale del reactor, como ocurre en el proceso de fangos activados. A pesar de que la recirculación podría colaborar a la inoculación del filtro, los objetivos fundamentales de la recirculación son diluir la concentración del agua afluente y hacer que el efluente del filtro se ponga de nuevo en contacto con la población biológica para su tratamiento adicional. La recirculación, casi siempre, forma parte del proceso de filtros percoladores de alta carga. Filtros de desbaste Los filtros de desbaste son filtros percoladores especialmente diseñados para trabajar con cargas hidráulicas elevadas. Los filtros de desbaste se usan, principalmente, para reducir la carga orgánica aplicada a los procesos posteriores y para obtener una nitrificación estacional, caso en el que se emplean para reducir la carga orgánica aplicada al proceso biológico situado a continuación en el proceso, con el objetivo de que se pueda conseguir la nitrificación en los meses de verano. Descripción del proceso. Aunque los primeros filtros de desbaste consistían en instalaciones poco profundas, con medios filtrantes formados por piedras, la tendencia actual apunta hacia el uso de medios sintéticos con profundidades entre 3,7 y 12 m. Al igual que los demás procesos biológicos, el funcionamiento de este tipo de filtros depende de la temperatura. Cuando los filtros de desbaste se usan para la eliminación de una parte de la materia orgánica presente, o como medio de mejora del proceso de nitrificación posterior, la disminución de su rendimiento no es un factor crítico. Los filtros de desbaste se suelen emplear con cargas hidráulicas elevadas, por lo que necesitan altas tasas de recirculación. El hecho de que las cargas hidráulicas sean tan elevadas, hace que el fenómeno de arrastre de la capa biológica se produzca, casi, de forma de continua. Si se emplea un efluente no sedimentado para la recirculación, los sólidos biológicos presentes en el caudal de recirculación pueden contribuir a la eliminación de materia orgánica como si se tratara de un sistema de cultivo en suspensión. Cuando se produce este mecanismo, se pueden alcanzar rendimientos superiores a los previstos mediante un modelo de cultivo fijo. Microbiología del proceso. La actividad biológica en un filtro de desbaste es, esencialmente, la misma que la descrita para un filtro percolador. No obstante, existirán ciertas diferencias en los organismos presentes, debido a un efecto de arrastre más pronunciado causado por la aplicación de mayores cargas hidráulicas. El crecimiento biológico es sensible a los mismos metales pesados y sustancias orgánicas que los descritos en los sistemas de cultivo en suspensión convencionales, pero el proceso ha demostrado tener mayor resistencia frente a las cargas de choque. Dado que el tiempo de retención hidráulica en los filtros de desbaste es relativamente corto, la materia orgánica que no se puede biodegradar rápidamente no se ve prácticamente afectada en el proceso. Análisis y diseño del proceso. Los filtros de desbaste se suelen proyectar basándose en factores de carga desarrollados en estudios en planta piloto, y a partir de datos deducidos de instalaciones a escala industrial, aunque se puede aplicar el análisis anteriormente presentado para el caso de filtros percoladores. En el Capítulo 10 se pueden encontrar algunos valores apropiados para el proyecto de este tipo de instalaciones. Sistemas biológicos rotativos de contacto (biodiscos) Un reactor biológico rotativo de contacto consiste en una serie de discos circulares de poliestireno, o cloruro de polivinilo, situados sobre un eje, a corta distancia unos de otros. Los discos están parcialmente sumergidos en el agua residual y giran lentamente en el seno de la misma (véase Fig. 8-27). FIGURA Reactor biológico rotativo de contacto de captación de aire (de Envirex, Inc.) (RBC) equipado con 8-27 cubículos Descripción del proceso. En el funcionamiento de un sistema de este tipo, los crecimientos biológicos se adhieren a las superficies de los discos, hasta formar una película biológica sobre la superficie mojada de los mismos. La rotación de los discos pone la biomasa en contacto, de forma alternativa, con la materia orgánica presente en el agua residual y con la atmósfera, para la adsorción de oxigeno. La rotación del disco induce la transferencia de oxígeno y mantiene la biomasa en condiciones aerobias. La rotación también es el mecanismo de eliminación del exceso de sólidos en los discos por medio de los esfuerzos cortantes que origina y sirve para mantener en suspensión los sólidos arrastrados, de modo que puedan ser transportados desde el reactor hasta el clarificador. Los biodiscos se pueden utilizar como tratamiento secundario, y, también, se pueden emplear para la nitrificación y desnitrificación estacionales o permanentes. Análisis del proceso. Los biodiscos de suelen proyectar basándose en factores de carga desarrollados en estudios en planta piloto, y a partir de datos deducidos de instalaciones a escala industrial, aunque se puede aplicar el análisis anteriormente presentado para el caso de filtros percoladores. Tanto los criterios de carga hidráulica como orgánica son aplicables al dimensionamiento de las unidades para el tratamiento secundario. Las cargas para tiempo caluroso y para nitrificación continua son considerablemente inferiores a las correspondientes al tratamiento secundario. En el Capítulo 10 se presentan algunos valores típicos para el proyecto de esta clase de elementos. Los biodiscos correctamente dimensionados constituyen sistemas muy fiables debido a la gran cantidad de biomasa presente (relación de funcionamiento F/M baja). Este hecho también les permite resistir mejor las sobrecargas hidráulicas y orgánicas. La disposición por etapas en serie de este sistema de flujo en pistón elimina los cortocircuitos y amortigua las sobrecargas. Reactores de lecho compacto Existe otro proceso de cultivo fijo, que es el reactor de lecho compacto, utilizado tanto para la eliminación de la DBO carbonosa como para la nitrificación. Típicamente, un reactor de lecho compacto consiste en un tanque (reactor) en el que existe un medio al que se adhieren los microorganismos. El agua residual se introduce en el tanque por su parte inferior mediante un sistema de distribución adecuado o mediante una cámara de alimentación. El aire u oxigeno puro necesario para el proceso se introduce conjuntamente con el agua residual a tratar. 8.9 PROCESOS DE TRATAMIENTO ANAEROBIOS DE CULTIVOS EN SUSPENSIÓN En los últimos diez años se han desarrollado numerosos procesos para el tratamiento de fangos y residuos de alto contenido en materia orgánica. En la Figura 8-28 se ilustran los procesos más utilizados en la actualidad. De todos ellos, el más común de los procesos anaerobios de cultivo en suspensión es el proceso de digestión anerobia de mezcla completa. Debido a que la importancia del proceso de digestión anaerobia de mezcla completa es fundamental en la estabilización de la materia orgánica y de los sólidos biológicos, será el principal centro de atención de este apartado, aunque también se describirán el proceso de contacto anaerobio y el proceso anaerobio de manto de fango de flujo ascendente. FIGURA Configuraciones de reactores tratamiento anaerobio del agua residual [33]. típicos empleadas en 8-28 el Digestión anaerobia La digestión anaerobia es uno de los procesos más antiguos empleados en la estabilización de fangos. En este proceso se produce la descomposición de la materia orgánica e inorgánica en ausencia de oxígeno molecular. Sus principales aplicaciones han sido, y siguen siendo hoy en día, la estabilización de fangos concentrados producidos en el tratamiento del agua residual y de determinados residuos industriales. Sin embargo, recientemente se ha demostrado que los residuos orgánicos diluidos también se pueden tratar anaeróbicamente. Descripción del proceso. En el proceso de digestión anaerobia, la materia orgánica contenida en la mezcla de fangos primarios y biológicos se convierte biológicamente, bajo condiciones anaerobias, en metano (CH4) y dióxido de carbono (CO2). El proceso se lleva a cabo en un reactor completamente cerrado. Los fangos se introducen en el reactor de forma continua o intermitente, y permanecen en su interior durante periodos de tiempo variables. El fango estabilizado, que se extrae del proceso continua o intermitentemente, tiene un bajo contenido en materia orgánica y patógenos, y no es putrescible. Los dos tipos de digestores anaerobios más empleados son los de alta y baja carga. En el proceso de digestión de baja carga (véase Fig. 8-29a), no se suele calentar ni mezclar el contenido del digestor, y los tiempos de detención oscilan entre 30 y 60 días. En los procesos de digestión de alta carga (véase Fig. 8-29b), el contenido del digestor se calienta y mezcla completamente. El tiempo de detención necesario suele ser de 15 días o menos. La combinación de estos dos procesos se suele conocer con el nombre de proceso de doble etapa (véase Fig. 8-29c). La función básica de la segunda etapa consiste en separar los sólidos digeridos del liquido sobrenadante, aunque puede tener lugar una digestión adicional y una cierta producción de gases. Microbiología del proceso. La conversión biológica de la materia orgánica de los fangos parece que se produce en tres etapas (véase Fig. 8-30). En relación con esta figura, el primer paso del proceso comporta la transformación por vía enzimática (hidrólisis) de los compuestos de alto peso molecular en compuestos que puedan servir como fuentes de energía y de carbono celular. El segundo paso (acidogénesis), implica la conversión bacteriana de los compuestos producidos en la primera etapa en compuestos intermedios identificables de menor peso molecular. El tercer paso (metanogénesis), supone la conversión bacteriana de los compuestos intermedios en productos finales más simples, principalmente metano y dióxido de carbono [15, 22, 23]. En un digestor, la conversión de los fangos orgánicos y de los residuos se lleva a cabo mediante la acción conjunta de diferentes organismos anaerobios. Un grupo de microorganismos se ocupa de la hidrolización de los polímeros orgánicos y de los lípidos para formar elementos estructurales básicos como los monosacáridos, los aminoácidos y los compuestos relacionados con éstos (véase Fig. 8-30). Un segundo grupo de bacterias anaerobias fermenta los productos de la descomposición para producir ácidos orgánicos simples, de los que el que se presenta con mayor frecuencia en los digestores orgánicos es el ácido acético. Este grupo de microorganismos, que reciben el nombre de no metanogénicos, está formado por bacterias facultativas y anaerobias estrictas, aunque de forma colectiva se conocen como bacterias «formadoras de ácidos». Entre las bacterias no metanogénicas que se ha podido aislar en los digestores se encuentran: Clostridium spp, Peptococcus anaerobus, Bifidobacterhim spp, Desulphovibrio spp, Corynebacterium spp, Lactobacillus, Actinomyces, Staphilococcus, y Escherichia coli. Otros grupos fisiológicos presentes incluyen los que producen enzimas proteolíticas, lipolíticas, ureolíticas o celulíticas [14, 15]. FIGURA 8-29 Digestores anaerobios típicos: (a) proceso convencional de fase única y de baja carga; (b) proceso de fase única, tanque de mezcla completa y alta carga, y (c) proceso de doble fase. FIGURA Representación esquemática del el proceso de digestión anaerobia [15]. flujo del carbono 8-30 en Un tercer grupo de microorganismos convierte el hidrógeno y el ácido acético, originado por las bacterias formadoras de ácidos, en gas metano y en dióxido de carbono. Las bacterias responsables de este proceso son anaerobias estrictas y se las conoce como «metanogénicas» o «formadoras de metano». Muchos de los organismos metanogénicos identificados en los digestores anaerobios son similares a los encontrados en los estómagos de los animales rumiantes y en sedimentos orgánicos tomados de lagos y ríos. Los principales géneros de microorganismos que se han identificado incluyen los bastoncillos (Methanobacteriurn, Methanobacillus) y las esferas (Methanacaccus, Methanosarcina) [14, 15]. Las bacterias más importantes de este grupo, que son las que degradan el ácido acético y el ácido propiónico, tienen tasas de crecimiento muy lentas, razón por la cual se considera que su metabolismo es un factor limitante del tratamiento anaerobio de los residuos orgánicos. En la digestión anaerobia, la estabilización se alcanza cuando se produce metano y dióxido de carbono. El gas metano así producido es altamente insoluble, y su desprendimiento de la solución representa la estabilización real del residuo. Es importante notar que las bacterias generadoras de metano sólo pueden emplear determinados substratos para llevar a cabo su función. Hoy en día, se sabe que las sustancias que sirven como substrato a los organismos metanogénicos son: CO2 + H2, formiato, acetato, metanol, metilaminas y monóxido de carbono. Las reacciones típicas de producción de energía ligadas a estos compuestos son las siguientes: 4 H2 + CO2 -> CH4 + 2 CH2O (8.75) 4 HCOOH -> CH4 + 3 CO2 + 2 H2O (8.76) CH3COOH -> CH4 + CO2 (8.77) 4 CH3OH -> 3 CH4 + CO2 + 2 H2O (8.78) 4 (CH3)3N + H2O -> 9 CH4 + 3 CO2 + 6 H2O + 4 NH3 (8.79) En un digestor anaerobio, las dos vías principales de producción de metano (véase Fig. 8-31) son: (1) la conversión de hidrógeno y dióxido de carbono en metano y agua (Ecuación 8.75), y (2) la conversión de acetato en metano y dióxido de carbono (Ecuación 8.77). Los organismos metanogénicos y los acidogénicos comparten una relación «sintrópica» (mutuamente beneficiosa) en la que los metanógenos convierten en metano y dióxido de carbono los productos finales de la fermentación, tales como el hidrógeno, el formiato o el acetato. Los metanógenos son capaces de utilizar el hidrógeno producido por los organismos acidogénicos debido a su eficacia en la hidrogénesis. Como quiera que los organismos metanogénicos son capaces de mantener la presión parcial del H2 a valores extremadamente bajos, el equilibrio de las reacciones de fermentación se desplaza en el sentido de la formación de productos finales más oxidados (p.e. formiato y acetato). La utilización del hidrógeno producido por los acidogénicos y otras bacterias anaerobias, por parte de los organismos metanogénicos, se conoce con el nombre de transferencia de hidrógeno entre especies. De hecho, las bacterias metanogénicas eliminan compuestos que pueden inhibir el crecimiento de los microorganismos acidogénicos Con objeto de mantener un sistema de tratamiento anaerobio que estabilice correctamente el residuo orgánico, los microorganismos formadores de ácidos y de metano se deben encontrar en un estado de equilibrio dinámico. Para mantener dicho estado, el contenido del reactor deberá carecer de oxígeno disuelto y estar libre de concentraciones inhibitorias de constituyentes tales como los metales pesados y los sulfuros. Además, el medio acuoso deberá presentar valores del pH situados entre 6,6 y 7,6. También deberá existir una alcalinidad suficiente para que el pH del sistema no descienda por debajo de 6,2, puesto que este punto marca el límite de actividad de las bacterias formadoras de metano. Mientras la digestión prosiga con normalidad, la alcalinidad oscilará entre 1.000 y 5.000 mg/l, y la concentración de ácidos volátiles será inferior a 250 mg/l. Es necesario disponer de suficiente cantidad de nutrientes tales como nitrógeno o fósforo, para asegurar el crecimiento adecuado de la comunidad biológica. La temperatura también es un parámetro ambiental importante. Los intervalos de temperatura óptimos son el mesofilico (30 a 38 ºC) y el termofilico (49 a 57 ºC). FIGURA Etapas de la digestión anaerobia con flujo de energía [33]. 8-31 Análisis del proceso. Las ventajas e inconvenientes del tratamiento anaerobio de un residuo orgánico, en comparación con el tratamiento aerobio, vienen condicionadas por el lento crecimiento de las bacterias formadoras de metano. El lento crecimiento de estas bacterias obliga a tiempos de detención más dilatados para conseguir una adecuada estabilización de los residuos. No obstante, este bajo crecimiento implica que sólo una pequeña parte del residuo orgánico biodegradable está siendo sintetizado en forma de nuevas células. En la Tabla 8-9 se indican algunos coeficientes cinéticos típicos de la digestión anaerobia. Mediante la acción de las bacterias metanogénicas, la mayor parte del residuo orgánico se transforma en metano, que es un gas combustible y, por ello, un producto final útil. Si se producen cantidades suficientes de metano, como ocurre en el tratamiento de los fangos de aguas residuales municipales, el gas se puede emplear para la generación de energía o para proporcionar calefacción a los edificios. La cantidad de gas que se produce en un proceso anaerobio de conversión de la materia orgánica se puede estimar tal como se muestra en el Ejemplo 8-5. TABLA 8-9 Coeficientes cinéticos típicos para la digestión anaerobia de algunos substratosa a Adaptado parcialmente de la bibliografia [12, Los valores que se proporcionan son los correspondientes a 20 ºC. 15 y 43]. b Ejemplo 8-5. Conversión de la DBOL en gas metano. Determinar la cantidad de gas metano producido por kg de DBOL estabilizada. Supóngase que el compuesto inicial es glucosa (C6H12O6). Solución 1. Escribir una ecuación igualada para la conversión de la glucosa en CO2 y CH4 bajo condiciones anaerobias: C6H12O6 -> 3 CO2+3CH4 180 132 48 Nótese que a pesar de la conversión de la glucosa, el gas metano presenta una demanda de oxígeno para su conversión total en CO2 y H2O. 2. Escribir una ecuación igualada para la oxidación del metano a CO2 y H2O, y determinar los kilogramos de metano generados por cada kilogramo de DBOL. 3 CH4 + 6 O2 -> 3 CO2 + 6 H2O 48 192 Empleando esta ecuación y la anterior, la DBOL por kg de glucosa es (192/180) kg, y 1 kg de glucosa produce (48/180) kg de metano, de manera que la cantidad de metano producida por cada kg de DBOL convertido será: kg CH4 / kg DBOL = (48/180) / (192/180) = 0,25 Por lo tanto, por cada kg de DBOL convertida se producirán 0,25 kg de metano. 3. Determinar el volumen equivalente de los 0,25 kg de metano producidos en la estabilización de 1 kg de DBO. VCH4 = (0,25 kg) (1.000 g/kg)(1 mol/16 g)(22,4 l/mol) = 350 l de CH4 en condiciones normales (20 ºC, 1 atm) Por lo tanto, por cada kilogramo de DBOL convertida se producen 350 l de metano. A causa de la baja lasa de crecimiento celular y de la conversión de la materia orgánica en gas metano y dióxido de carbono, la materia sólida resultante suele estar bastante bien estabilizada. Esto la convierte, tras el proceso de deshidratación o de secado, en un material apto para su evacuación en vertederos, para el compostaje, o para su aplicación al terreno. Debido a la gran proporción de materia celular orgánica, los sólidos del fango resultante de los procesos aerobios se suelen digerir de forma anaerobia. A las altas temperaturas necesarias para lograr un tratamiento adecuado se les suele achacar los principales inconvenientes con los que tropieza el proceso de digestión anaerobia. Sin embargo, dichas temperaturas sólo son necesarias cuando no se pueden conseguir tiempos medios de retención celular suficientemente largos a las temperaturas nominales. En los sistemas de digestión anaerobia de la Fig. 8-29, el tiempo medio de retención celular coincide con el tiempo de detención hidráulica del líquido dentro del digestor. Conforme aumenta la temperatura, se producen reducciones importantes en el tiempo mínimo de retención celular. Por lo tanto, un aumento de la temperatura, no sólo reduce el tiempo de retención celular necesario para alcanzar un nivel de tratamiento adecuado, sino que también reduce el tiempo de detención hidráulica asociado, lo cual permite disponer de reactores de menor volumen. Proceso anaerobio de contacto Algunos residuos industriales con alto contenido en DBO se pueden estabilizar por medio del tratamiento anaerobio de forma muy efectiva. En el proceso anaerobio de contacto (véase Fig. 8-28), los residuos que se quiere tratar se mezclan con los sólidos del fango recirculado y se digieren a continuación en un reactor cerrado para evitar la entrada de aire [33]. El contenido del reactor se mezcla completamente y, tras la digestión, la mezcla se separa en un clarificador o una unidad de flotación al vacío. El sobrenadante del proceso, normalmente, es sometido a un tratamiento posterior. El fango anaerobio sedimentado se recircula para servir de siembra al agua residual entrante. Debido a la baja tasa de síntesis de los microorganismos anaerobios, el exceso de fango a evacuar es mínimo. Este proceso se ha empleado de forma satisfactoria para la estabilización de efluentes de industrias cárnicas y otras de alto contenido orgánico en estado soluble. En la Tabla 8-10 se proporcionan datos típicos de las cargas del proceso y de los rendimientos del proceso anaerobio de contacto. TABLA Datos típicos de rendimiento de procesos anaerobios 8-10 empleados en Proceso el anaerobio tratamiento de manto de de fango vertidos de flujo industriales ascendente (UASB) En este proceso (véase Fig. 8-28), el residuo que se quiere tratar se introduce por la parte inferior del reactor. El agua residual fluye en sentido ascendente a través de un manto de fango constituido por gránulos o partículas formadas biológicamente. El tratamiento se produce al entrar en contacto el agua residual y las partículas. Los gases producidos en condiciones anaerobias (principalmente metano y dióxido de carbono) provocan una circulación interior, que colabora en la formación y mantenimiento de los gránulos. Parte del gas generado dentro del manto de fango se adhiere a las partículas biológicas. Tanto el gas libre como las partículas a las que se ha adherido gas, ascienden hacia la parte superior del reactor. Allí, se produce la liberación del gas adherido a las partículas, al entrar éstas en contacto con unos deflectores desgasificadores. Las partículas desgasificadas suelen volver a caer hasta la superficie del manto de fango. El gas libre y el gas liberado de las partículas se captura en una bóveda de recogida de gases instalada en la parte superior del reactor. El líquido, que contiene algunos sólidos residuales y algunos de los gránulos biológicos, se conduce a una cámara de sedimentación, donde se separan los sólidos residuales. Los sólidos separados se reconducen a la superficie del manto de fango a través del sistema de deflectores. Para mantener el manto de fango en suspensión, es necesario que la velocidad de flujo ascendente tenga un valor entre 0,6 y 0,9 m/h. En la Tabla 8-10 se proporcionan los datos de cargas y de rendimientos del proceso anaerobio de manto de fango de flujo ascendente (UASB). 8.10 PROCESOS ANAEROBIOS DE TRATAMIENTO DE CULTIVO FIJO Los dos procesos anaerobios de tratamiento más comúnmente empleados para el tratamiento de residuos orgánicos carbonosos son el filtro anaerobio y el proceso de lecho expandido. En la Sección 8-11 y en el Capítulo II se aborda el estudio de los procesos de tratamiento de cultivo fijo empleados para la desnitrificación. En la Tabla 8-10 se proporcionan datos típicos de las cargas y rendimientos del proceso del filtro anaerobio y del proceso de lecho expandido. Proceso del filtro anaerobio El filtro anaerobio es una columna rellena de diversos tipos de medios sólidos que se utiliza para el tratamiento de la materia orgánica carbonosa contenida en el agua residual. El agua a tratar fluye en sentido ascendente, entrando en contacto con el medio sobre el que se desarrollan y fijan las bacterias anaerobias. Dado que las bacterias están adheridas al medio y no son arrastradas por el efluente, se pueden obtener tiempos medios de retención celular del orden de los cien días. En consecuencia, es posible conseguir grandes valores de THETAc con bajos tiempos de detención hidráulica. De este modo, el filtro anaerobio se puede emplear para el tratamiento de residuos de baja concentración a temperatura ambiente. Proceso de lecho expandido En el proceso de lecho expandido (véase Fig. 8-28), el agua residual a tratar se bombea a través de un lecho de material adecuado (p.c. arena, carbón, conglomerado expandido) en el que se ha desarrollado un cultivo biológico. El efluente se recircula para diluir el agua entrante y para mantener un caudal adecuado que asegure que el medio se halle expandido. Se han llegado a emplear concentraciones de biomasa superiores a 15.00040.000 mg/l. Debido a las altas concentraciones de biomasa que se pueden conseguir, el proceso de lecho expandido también se puede emplear para el tratamiento de aguas residuales municipales, con tiempos de detención hidráulica muy pequeños. En el tratamiento de este tipo de residuos, la presencia de sulfatos puede producir la generación de sulfuro de hidrógeno, para cuya captura en la fase de solución se han desarrollado diferentes métodos. Se supone que el uso de este y otros procesos anaerobios de cultivo fijo aumentará con el tiempo, especialmente debido a que la cantidad de fango producido es considerablemente inferior a la que se produce en los procesos aerobios. La recuperación del metano, un gas útil, es otra de las ventajas importantes de los procesos anaerobios. 8.11 ELIMINACIÓN BIOLÓGICA DE NUTRIENTES La eliminación de los nutrientes del agua residual se hace necesaria cada vez con mayor frecuencia, ya que puede ser necesario controlar el vertido de nitrógeno o de fósforo debido a su potencial impacto sobre la calidad de las aguas receptoras [41]. Las opciones de eliminación de nutrientes que cabe considerar son las siguientes: 1. Eliminación de nitrógeno sin eliminar el fósforo. 2. Eliminación conjunta del nitrógeno y del fósforo. 3. Eliminación del fósforo con o sin eliminación de nitrógeno. 4. Eliminación del fósforo todo el año con eliminación estacional del nitrógeno. La información que contiene esta sección pretende ser una breve introducción al tema de la eliminación de nutrientes. En el Capítulo 11 se puede encontrar un examen más extenso de los procesos biológicos de eliminación de nutrientes. Procesos de eliminación de nutrientes La eliminación biológica de los nutrientes es un método de coste relativamente bajo de eliminar el nitrógeno y el fósforo presentes en el agua residual. La experiencia reciente ha podido demostrar que los procesos biológicos constituyen un medio fiable y efectivo de eliminar el nitrógeno y el fósforo. Eliminación del nitrógeno. En el agua residual, el nitrógeno puede estar presente en múltiples formas, y son numerosas las transformaciones que puede sufrir en los diferentes procesos de tratamiento (véase Fig. 8-32). Estas transformaciones permiten convertir el nitrógeno amoniacal en otros productos fácilmente separables del agua residual. Los dos mecanismos principales que intervienen en este proceso son la asimilación y la nitrificación-desnitrificación. Debido a que el nitrógeno es un nutriente, los microbios presentes en los procesos de tratamiento tenderán a asimilar el nitrógeno amoniacal y a incorporarlo a su masa celular. Una parte de este nitrógeno amoniacal retornará al agua residual con la lisis y muerte de las células. En el proceso de nitrificación-desnitrificación, la eliminación del nitrógeno se consigue en dos etapas de conversión. En la primera, la nitrificación, se reduce la demanda de oxígeno del amoniaco mediante su conversión a nitrato. No obstante, en este paso, el nitrógeno apenas ha cambiado de forma y no se ha eliminado. En el segundo paso, la desnitrificación, el nitrato se convierte en un producto gaseoso que es eliminado. Estos dos procesos se estudiarán por separado en esta sección. FIGURA Transformaciones del nitrógeno en los procesos de tratamiento biológico [28]. 8-32 Eliminación del fósforo. El consumo de fósforo por parte de los microorganismos tiene lugar en reactores dispuestos en etapas en serie. Mediante el adecuado control de las condiciones ambientales, es posible hacer que los microorganismos consuman un exceso sobre sus necesidades normales. La eliminación del fósforo se consigue por purga o arrastre de los microbios [8, 28]. Ambos métodos se analizan más adelante en esta sección, y con mayor detalle en el Capitulo 11. Nitrificación biológica La nitrificación es el primer paso en la eliminación del nitrógeno por el proceso de nitrificación-desnitrificación. A continuación se describe el proceso de nitrificación y su aplicación. Descripción del proceso. Son dos los géneros de bacterias responsables de la nitrificación, Nitrosomas y Nitrobacter. Los Nitrosornas oxidan el amoniaco en nitrito, producto intermedio, mientras que los Nitrobacter transforman el nitrito en nitrato. La no acumulación de nitrito en el sistema evidencia que la conversión de amoníaco a nitrito tiene lugar por medio de una serie de complejas reacciones que gobiernan el proceso de conversión global. De forma aproximada, las reacciones que tienen lugar se pueden expresar de la siguiente manera: Para los Nitrosomas, la ecuación es la siguiente: 55NH4- +76 O2 + 109 HCO3- --> C5H7O2N + 54 NO2- + 57 H2O + 104 H2CO3 (8.80) Para los Nitrobacter, la ecuación es: 400 NO2- +NH4+ + 4 H2CO3 + HCO3- + 195 O2 --> C5H7O2N + 3 H2O + 400 NO3(8.81) Estas ecuaciones permiten calcular las cantidades necesarias para los procesos de las diferentes especies químicas. Aproximadamente, se necesitan 4,3 mg de O2 por cada mg de nitrógeno amoniacal oxidado a nitrógeno en forma de nitrato. En el proceso de conversión, se consume gran cantidad de alcalinidad: 8,64 mg de HCO3- por cada mg de nitrógeno amoniacal oxidado. Es necesario tener presente que la transformación de nitrógeno amoniacal en nitrógeno en forma de nitrato no supone la eliminación del nitrógeno, aunque sí permite eliminar su demanda de oxigeno. Las bacterias nitrificantes son organismos extremadamente sensibles a gran cantidad de sustancias inhibidoras, agentes tanto orgánicos como inorgánicos, que pueden impedir el crecimiento y la actividad de estos organismos. Las altas concentraciones de amoníaco y de ácido nitroso pueden resultar inhibidoras, siendo también importante el efecto del pH. El intervalo óptimo de valores del pH es estrecho, entre 7,5 y 8,6, pero algunos sistemas aclimatados a condiciones de pH más bajos también han conseguido la nitrificación de forma satisfactoria. La temperatura también ejerce una gran influencia sobre el crecimiento de las bacterias nitrificantes. Aún así, la cuantificación de esta influencia es difícil de establecer. Para que se produzca la nitrificación, es fundamental que existan concentraciones de oxígeno disuelto por encima de 1 mg/l. Si el nivel de OD es inferior a este valor, el oxigeno se convierte en el nutriente limitante del proceso, y puede producirse el cese o la ralentización de la nitrificación. Aplicación del proceso. Los principales procesos de nitrificación se pueden clasificar en procesos de cultivo en suspensión y procesos de cultivo fijo. En el proceso de cultivo en suspensión, la nitrificación se puede conseguir en el mismo reactor empleado para el tratamiento de la materia orgánica carbonosa, o en un reactor de cultivo en suspensión independiente, situado a continuación del proceso de fangos activados convencional. En aquellos casos en los que la nitrificación y el tratamiento de la materia orgánica carbonosa se realizan en un único reactor, el proceso recibe el nombre de nitrificación de una fase. Cuando se emplea una instalación independiente, suele constar de un reactor y de un tanque de sedimentación del mismo tipo que se emplea en el proceso de fangos activados. La oxidación del amoniaco a nitrato se puede llevar a cabo con aire o con oxígeno puro. Los detalles del proceso de nitrificación se analizan en el Capitulo 11. Al igual que en el caso de los reactores de cultivos en suspensión, la nitrificación se puede conseguir en el reactor de cultivo fijo empleado para la eliminación de la materia orgánica carbonosa, o en un reactor independiente. Los filtros percoladores, los biodiscos y los filtros de alta carga se pueden emplear para los sistemas de nitrificación. Estos sistemas resisten bien las cargas de choque, pero son susceptibles de dejar pasar el amoníaco sin oxidar en condiciones de caudal punta. En sistemas combinados de oxidación carbonosa-nitrificación, las capas biológicas son de mayor espesor que en los reactores de nitrificación. Esta diferencia de espesor en la capa biológica se compensa con las bajas cargas de DBO carbonosa soluble necesarias para el adecuado crecimiento de los cultivos nitrificantes. En los sistemas combinados, el aumento de las cargas puede producir un espesor excesivo de la capa biológica y generar problemas de arrastre de sólidos. Desnitrificación biológica La desnitrificación es la segunda etapa de la eliminación del nitrógeno mediante el proceso de nitrificación-desnitrificación. En la siguiente discusión se aborda el estudio del proceso de desnitrificación y sus aplicaciones. Descripción del proceso. La eliminación del nitrógeno en forma de nitrato por conversión en nitrógeno gas se puede conseguir biológicamente bajo condiciones «anóxicas» (sin oxígeno). El proceso se conoce con el nombre de desnitrificación. En el pasado, el proceso de conversión se solía identificar como la desnitrificación anaerobia. Sin embargo, las principales vías bioquímicas no son anaerobias, sino modificaciones de las vías aerobias; es por esta razón por la que se ha creído conveniente emplear el término anóxico en lugar de anaerobio [36]. La conversión del nitrógeno, en forma de nitratos, a formas más rápidamente eliminables se puede llevar a cabo gracias a la acción de diversos géneros de bacterias. De entre todas ellas, se pueden destacar: Achromobacter, Acrobacter, Alcaligenes, Bacillus, Brevibavterium, Flavobacterium, Lactobacillus, Micrococcus, Proteus, Pseudomonas y Spirillum. Estas bacterias son heterótrofas capaces de la reducción disimilatoria del nitrato, que es un proceso de dos etapas. El primer paso consiste en la conversión de nitrato en nitrito, y a continuación se producen óxido nítrico, óxido nitroso y nitrógeno gas. Las reacciones de reducción del nitrógeno son las siguientes: NO3- -> NO2- -> NO -> N2O -> N2 (8.82) Los tres últimos compuestos son gaseosos, y se pueden liberar a la atmósfera. En los sitemas de desnitrificación, el parámetro crítico es la concentración de oxigeno disuelto. La presencia de OD suprime el sistema enzimático necesario para el desarrollo del proceso de desnitrificación. La alcalinidad se produce durante la conversión de nitrato en nitrógeno gas, lo cual provoca un aumento del pH. El pH óptimo se sitúa entre 7 y 8, con diferentes valores óptimos que dependen de las diferentes poblaciones bacterianas posibles. La temperatura afecta a la tasa de eliminación del nitrato y a la de crecimiento microbiano. Los organismos son sensibles a los cambios de temperatura. Aplicación del proceso. Al igual que sucedía con la nitrificación, los procesos de desnitrificación se pueden clasificar teniendo en cuenta si los cultivos son fijos o en suspensión. La desnitrificación con cultivos en suspensión se suele llevar a cabo en sistemas de fangos activados de flujo en pistón (p.e. a continuación de cualquier proceso que convierta el amoníaco y el nitrógeno orgánico en nitratos [nitrificación]). Las bacterias anaerobias obtienen la energía para el crecimiento a partir de la conversión de nitrato en nitrógeno gas, pero necesitan una fuente de carbono para la síntesis celular. Debido a que los efluentes nitrificados suelen presentar concentraciones bajas de materia carbonosa, es necesario disponer de una fuente externa de carbono. Para conseguirla, en algunos sistemas de desnitrifiación biológica se emplea el agua residual cruda o tejido celular. En el tratamiento de aguas de retorno de usos agrícolas, deficitarias en carbono orgánico, se ha empleado el metanol como fuente de carbono, aunque también se han empleado residuos industriales pobres en nutrientes pero ricos en materia carbonosa. Debido a que el nitrógeno gas producido en la desnitrificación dificulta la sedimentación del líquido mezcla, antes del clarificador de la desnitrificación se debe instalar un reactor para la eliminación del nitrógeno gas. La desnitrificación con cultivo fijo (película fija) se lleva a cabo en un reactor en columna que contiene piedras o alguno de los diversos materiales sintéticos sobre los que crecen las bacterias. La necesidad o no de disponer de un clarificador dependerá del tamaño del medio. El arrastre de sólidos con el efluente produce un efecto de purga de aquellos. Para evitar la obstrucción del medio debida a la presencia de sólidos y las pérdidas de carga que ello provoca, es necesario prever un lavado a contracorriente y/o un lavado con aire periódicos. Al igual que sucedía con la desnitrificación con cultivos en suspensión, también suele ser necesaria alguna fuente externa de carbono. La mayoría de las aplicaciones de este proceso adoptan el sistema de flujo descendente (por gravedad o a presión), aunque también se emplean técnicas de lecho expandido. En el Capitulo 11 se tratan más modificaciones del proceso, desde el punto de visto de la configuración física de los elementos. Eliminación de fósforo El fósforo está presente en el agua residual en forma de ortofosfato (PO4-3), polifosfato (P2O7) y formas orgánicas del fósforo. Los dos últimos términos engloban hasta el 70 por 100 del fósforo contenido en el agua residual. Los microbios utilizan el fósforo para la síntesis celular y en el transporte de energía. Como consecuencia de ello, entre el 10 y el 30 por 100 del fósforo presente se elimina durante el tratamiento biológico secundario. Para conseguir niveles de fósforo bajos en el efluente, es necesario eliminar más cantidad de la estrictamente necesaria para el mantenimiento y síntesis celular. Bajo ciertas condiciones aerobias, los microorganismos pueden consumir más fósforo del necesario. Las células pueden liberar fósforo en condiciones anóxicas. La eliminación biológica del fósforo se consigue generando en los reactores las condiciones ambientales adecuadas de manera secuencial. Descripción del proceso. Uno de los principales organismos responsables de la eliminación del fósforo son los Acinetobacter. Estos organismos liberan el fósforo almacenado como respuesta, en condiciones anaerobias, a la presencia en el agua residual de ácidos grasos volátiles (AGV). En su competencia por la supervivencia con los organismos heterótrofos, los AGV son un substrato importante para los Acinetobacter. Cuando una zona aeróbica (óxica) sigue a una zona anaerobia, los organismos consumen mayores cantidades de fósforo de lo habitual. Los microorganismos no sólo utilizan el fósforo para el mantenimiento celular, síntesis celular y transporte de energía, sino que también lo almacenan para su uso posterior. El fango que contiene el exceso de fósforo se purga o se evacúa a una línea de fango auxiliar para eliminar el exceso de fósforo. La liberación del fósforo de produce bajo condiciones anóxicas. Por lo tanto, el proceso biológico de eliminación del fósforo hace necesario poder disponer de reactores o zonas anaerobias y aerobias dentro del mismo reactor. Como se acaba de comentar, existen dos mecanismos de eliminación del fósforo: la purga de fango, y el tratamiento en línea auxiliar. Actualmente existen una serie de procesos que se basan en alguno de estos mecanismos. Dos de estos procesos son el PhoStrip y el Bardenpho (véase Fig. 8-33). Ambos procesos, como se puede apreciar en la Figura 8-33, realizan la secuencia entre los contactos anaerobios y aerobios con pequeñas modificaciones. En el proceso PhoStrip, se usa la liberación biológica del fósforo en condiciones anóxicas para concentrar el nutriente en una línea auxiliar para su tratamiento químico. Normalmente se suele añadir cal para la precipitación del fósforo. En el proceso Bardenpho, para conseguir la eliminación, tanto del nitrógeno como del fósforo, se sigue una secuencia de condiciones anaerobias, anóxicas y aerobias. El fósforo se elimina mediante la purga del fango. Eliminación conjunta del nitrógeno y del fósforo En los casos en los que se debe eliminar tanto el nitrógeno como el fósforo se emplean métodos combinados como el Bardenpho (véase Fig. 8-33b). Los procesos de eliminación combinados se analizan en el Capítulo 11. 8.12 PROCESOS DE TRATAMIENTO POR LAGUNAJE (ESTANQUES) Los sistemas de lagunaje se pueden clasificar, en relación con la presencia de oxigeno, en (1) aerobios, (2) de maduración, (3) facultativos, y (4) anaerobios. FIGURA 8-33 Procesos de tratamiento típicos empleados para la eliminación biológica del fósforo: (a) proceso PhoStrip, y (b) proceso Bardenpho de cinco fases (adaptado de la bibliografía [28]). Estanque de estabilización aerobia En su forma más simple, los estanques de estabilización aerobia son grandes depósitos excavados en el terreno, de poca profundidad, que se emplean para el tratamiento del agua residual por medio de procesos naturales que incluyen la utilización de algas y de bacterias. Aunque es normal agrupar todos los sistemas de estanques en un solo tipo, en este capitulo se van a analizar de acuerdo con la clasificación de la Tabla 8-6. En el Capitulo 10, el diseño se aborda de forma colectiva. Descripción del proceso. Un estanque de estabilización aerobia contiene bacterias y algas en suspensión, existiendo condiciones aerobias en toda su profundidad. Existen dos tipos básicos de estanques aerobios. En el primer tipo, el objetivo es maximizar la producción de algas. La profundidad de este tipo de estanques se suele limitar a entre 15 y 50 cm. En el segundo tipo de estanques, el objetivo es maximizar la cantidad de oxigeno producido, y se emplean profundidades de hasta 1,5 m. En ambos tipos, el oxigeno, además del producido por las algas, penetra en el líquido por la difusión atmosférica. Para optimizar los resultados, es conveniente mezclar periódicamente el contenido de los estanques por medio de bombas o de aireadores de superficie. Microbiología del proceso. En los estanques aerobios fotosintéticos, el oxigeno se suministra por aireación natural a través de la superficie y por fotosíntesis de las algas. Con excepción de la población de algas, la comunidad biológica presente en los estanques de estabilización es similar a la existente en los sistemas de fangos activados. El oxigeno liberado por las algas en el proceso de fotosíntesis es utilizado por las bacterias en la degradación aerobia de la materia orgánica. Los nutrientes y el dióxido de carbono liberados en este proceso de degradación los emplean, a su vez, las algas. Esta relación ciclo-simbiótica se ilustra en la Figura 8-34. También se presentan animales superiores tales como los rotíferos y protozoos, cuya principal función consiste en la mejora del efluente. El grupo especifico de algas, animales o especies bacterianas presentes en cualquier zona de un estanque aerobio depende de factores tales como la carga orgánica, el grado de mezclado del estanque, el pH, los nutrientes, la luz solar, y la temperatura. Este último factor ejerce un efecto muy importante sobre los estanques aerobios, particularmente en regiones que tienen inviernos fríos. FIGURA Representación esquemática de la relación simbiótica bacterias en un estanque de estabilización de alta carga. entre 8-34 algas y Análisis del proceso. En los estanques aerobios, la eficacia de la eliminación de la DBO5 es alta, situándose por encima del 95 por 100. Sin embargo, es necesario recordar que, aun cuando se haya conseguido eliminar la DBO soluble del agua residual a tratar, el alto contenido en algas y bacterias del efluente del estanque puede ejercer valores de la DBO5 superiores a los del agua afluente. En el Capítulo 10 se presentan diversos procedimientos que permiten eliminar las algas del agua residual tratada. Se han propuesto diversos sistemas teóricos para el análisis de los estanques de estabilización aerobios. Sin embargo, a causa de las numerosas variables incontrolables que influyen en el proceso, los estanques todavía se suelen diseñar utilizando factores de carga deducidos de ensayos en planta piloto y observaciones de sistemas en funcionamiento. La carga del estanque se ajusta para adecuarse a la cantidad de oxigeno disponible por fotosíntesis y reaireación atmosférica. Estanques facultativos Los estanques en los que la estabilización de las aguas residuales se lleva a cabo mediante una combinación de bacterias facultativas, anaerobias y aerobias, se conocen con el nombre de estanques de estabilización facultativos (aerobios-anaerobios). Descripción del proceso. Como se puede apreciar en la Figura 8-35, en un estanque facultativo existen tres zonas: (1) una zona superficial en la que existen bacterias aerobias y algas en una relación simbiótica, como se ha descrito anteriormente; (2) una zona inferior anaerobia en la que se descomponen activamente los sólidos acumulados por acción de las bacterias anaerobias, y (3) una zona intermedia, que es parcialmente aerobia y anaerobia, en la que la descomposición de los residuos orgánicos la llevan a cabo las bacterias facultativas. Los estanques de estabilización facultativos son tanques excavados en el terreno que se alimentan con agua residual procedente de un proceso previo de desbaste o con el efluente de un tratamiento primario. Los sólidos de gran tamaño sedimentan para formar una capa de fango anaerobio. Los materiales orgánicos sólidos y coloidales se oxidan por la acción de las bacterias aerobias y facultativas empleando el oxígeno generado por las abundantes algas presentes cerca de la superficie. El dióxido de carbono, que se produce en el proceso de oxidación orgánica, sirve como fuente de carbono para las algas. La descomposición anaerobia de los sólidos de la capa de fango comporta la producción de compuestos orgánicos disueltos y de gases tales como el CO2, el H2S y el CH4, que o bien se oxidan por las bacterias aerobias, o se liberan a la atmósfera. En la práctica, la presencia de oxígeno en la capa superior del estanque se consigue por las algas o mediante aireadores de superficie (véase Cap. 10). Si se emplean aireadores de superficie, la presencia de algas no es necesaria. La ventaja de utilizar aireadores de superficie reside en que ello posibilita aplicar cargas orgánicas más elevadas. Sin embargo, la carga orgánica aplicada no debe exceder de la cantidad de oxigeno que pueda ser suministrada por los aireadores sin que se produzca un mezclado completo del contenido del estanque, ya que en este caso se pierden las ventajas derivadas de la descomposición anaerobia. Microbiología del proceso. La comunidad biológica de la capa superior o aerobia es similar a la de un estanque aerobio. Los microorganismos de la zona inferior del estanque son bacterias facultativas y anaerobias. La respiración también se produce en presencia de luz solar; sin embargo, la reacción neta es la producción de oxígeno. Las Ecuaciones 8.83 y 8.84 representan reacciones bioquímicas simplificadas de la fotosíntesis y de la respiración: FIGURA Representación esquemática de un tanque de estabilización [35]. 8-35 Fotosíntesis: CO2 + 2H2O --> (CH2O) + O2 + H2O (8.83) Células nuevas Respiración: CH2O + O2 ---> CO2 + H2O (8.84) Debido a que las algas usan dióxido de carbono en su actividad fotosintética, ello puede dar lugar a condiciones de pH altos, especialmente en aguas residuales con alcalinidades bajas. En muchos casos, las algas presentes en los estanques facultativos obtienen el carbono necesario para la síntesis celular del ion bicarbonato. Cuando se emplea como fuente de carbono el ion bicarbonato, se pueden producir altas variaciones diurnas del pH. Además, con el aumento del pH cambian los componentes de la alcalinidad, y tiende a predominar la alcalinidad debida a la presencia de carbonato y de hidróxido. Si el agua residual presenta altas concentraciones de calcio, se producirá el precipitado de carbonato de calcio cuando las concentraciones de carbonato y de ion calcio sean la suficientemente elevadas para alcanzar el valor del producto de solubilidad. Esta eliminación del ion carbonato evitará que el pH siga subiendo. Análisis del proceso. La magnitud del esfuerzo aplicado al estudio de los estanques facultativos es enorme, y se ha dedicado, aproximadamente, la misma atención al desarrollo de ecuaciones de diseño adecuadas. A pesar de que se han publicado numerosas ecuaciones de diseño, no existe una ecuación universalmente aceptada. La explicación de este hecho reside, en parte, en que el proceso está poco determinado debido a las variaciones que presenta la naturaleza. Por ejemplo, todas las ecuaciones desarrolladas para la predicción de la calidad del efluente pierden su validez en cuanto aparece el viento. Bajo estas condiciones, la calidad del efluente dependerá del grado de mezcla provocado por el viento, y de la cantidad de sólidos sedimentados que pasan a estar en suspensión. Esta es la principal razón por la cual los estanques facultativos se suelen proyectar a partir de datos obtenidos de instalaciones en funcionamiento. Estanques de maduración terciarios Los estanques de estabilización de baja carga terciarios o de maduración se diseñan para mejorar la calidad de los efluentes secundarios y para la nitrificación estacional. Los mecanismos biológicos involucrados son similares a los de otros procesos aerobios de cultivo en suspensión. Su funcionamiento implica la respiración endógena de los sólidos biológicos residuales y la conversión del amoniaco en nitrato mediante el oxígeno suministrado por reaireación superficial y por la presencia de algas. Se han propuesto tiempos de detención de 18 a 20 días como el mínimo periodo necesario para conseguir la respiración endógena completa de los sólidos residuales. Para mantener las condiciones aerobias, las cargas aplicadas deben ser bastante bajas. Estanques anaerobios Los estanques anaerobios se usan para el tratamiento de agua residual de alto contenido orgánico que también contenga una alta concentración de sólidos. Generalmente, un estanque anaerobio es un estanque profundo excavado en el terreno, dotado de un sistema de conducciones de entrada y de salida adecuados. Para conservar la energía calorífica y mantener las condiciones anaerobias, se han construido estanques de profundidades de hasta 9,1 metros. Los residuos a tratar en el estanque sedimentan en el fondo del mismo, y el efluente parcialmente clarificado se vierte, normalmente, a otro proceso posterior. Generalmente, estos estanques son anaerobios en toda su profundidad, excepto en una estrecha franja cercana a la superficie. La estabilización se consigue por medio de una combinación de precipitación y de conversión anaerobia de los residuos orgánicos en CO2, CH4, otros productos gaseosos finales, ácidos orgánicos y tejido celular. Normalmente, es fácil conseguir, de forma continua, rendimientos de eliminación de la DBO5 superiores al 70 por 100. En condiciones óptimas de funcionamiento, es posible conseguir eficacias de eliminación de hasta el 85 por 100. 8.13 TEMAS DE DEBATE Y PROBLEMAS 8.1. Una muestra de 1 1 contiene 250 gr de caseína (C8H12O3N2). Si se sintetizan 0,5 g de tejido celular bacteriano por cada mg de caseína consumido, determinar la cantidad de oxígeno necesario para completar la oxidación de la caseína en productos finales y tejido celular. Los productos finales de la oxidación son el dióxido de carbono (CO2), el amoníaco (NH3), y agua. Suponer que el nitrógeno no incorporado en la producción de tejido celular se convierte en amoníaco. 8.2. Suponiendo que el coeficiente endógeno kd pueda despreciarse. desarrollar unas expresiones que se puedan emplear para determinar la concentración de substrato y de células en función del tiempo, para un reactor de alimentación discontinua. Si la concentración inicial de substrato y de células es de 100 y 200 mg/l respectivamente, determinar la cantidad de substrato que queda al cabo de 1 hora. Si el coeficiente endógeno vale 0,04d-1, estimar el error cometido al despreciar este factor. Suponer que se aplican las siguientes constantes: k = 2,0h-1; Ks = 80 mg/l; Y = 0,4 mg/mg. 8.3. Si el grado de dilución D se define como Q/V y se desprecia el coeficiente endógeno, desarrollar unas expresiones que permitan estimar la concentración de substrato y de células en el efluente de un reactor de mezcla completa sin recirculación en función del grado de dilución. Si Y = 0,5 mg/mg, µm = 1,0 h-1, Ks = = 200 mg/l, y So = 10.000 mg/l, elaborar una gráfica de las concentraciones de substrato y de células respecto al grado de dilución. Utilizar un papel milimetrado y representar el grado de dilución desde 0 hasta 1,0 h-1. Utilizar divisiones de 2 cm por cada 1.000 mg/l de células y de 1 cm por cada 1.000 mg/l de substrato. 8.4. Deducir la Ecuación 8.29, que es la que se emplea para la estimación de la producción celular observada. 8.5. Se ha de tratar un agua residual mediante un proceso aerobio en un reactor de mezcla completa sin recirculación. Determinar el valor de THETAcM empleando los siguientes valores de las constantes: Ks = 50 mg/l; k = 5,0 d-1; kd = 0,06 d-1; Y = 0,60 mg/mg. La concentración inicial de substrato en el agua residual es de 200 mg/l. 8.6. Utilizando un valor de THETAc = 2 d de proyecto de 2 días, junto con las constantes del problema anterior, determinar la concentración de substrato en el efluente, la tasa de utilización específica (-rsu/X), la relación alimento-microorganismos (So/X THETA), y la concentración de microorganismos en el reactor. 8.7. Los siguientes datos se han obtenido estudiando cuatro reactores de fango activado de flujo continuo a escala de laboratorio para el tratamiento de los residuos de una industria alimentaria. Determinar los valores de Y y de kd a partir de estos datos. 8.8. Deducir la Ecuación 8.57 para un reactor de flujo en pistón. 8.9. Se propone utilizar un reactor de mezcla completa con recirculación para el tratamiento de un agua residual de concentración media (véase Tabla 3-16). Determinar la cantidad de oxígeno necesaria para la oxidación carbonosa del agua residual (suponer que no se produce nitrificación) para un tiempo medio de retención celular de 6 días. Utilizar los coeficientes cinéticos de la Tabla 8-7, y suponer que los compuestos orgánicos presentes en el agua residual se pueden representar como C6H12O6, el nitrógeno como NH4+, y el fósforo como H2PO4+. Representar el tejido celular obtenido en el proceso como C60H87O23N12P. ¿Qué porcentaje del nitrógeno y del fósforo presente en el afluente aparecerá en el efluente? 8.10. Suponiendo que el residuo especificado en el Problema 8.9 se puede nitrificar completamente con un tiempo de retención celular de 15 días, estimar la cantidad total de oxígeno necesaria. ¿Qué comparación puede hacerse con la cantidad de oxigeno necesaria para la oxidación carbonosa? 8.11. Si el 75 por 100 del tejido celular producido durante el tratamiento biológico es biodegradable, estimar la producción carbonosa última del tejido celular empleando la Ecuación 8.31. Si el valor de K (base 10) es igual a 0,1, determinar la DBO5 de los tejidos celulares. Expresar la respuesta en términos de mg de DBO5/mg de tejido celular. 8.12. Determinar los coeficientes cinéticos k, KS, µm, Y y kd a partir de los siguientes datos deducidos empleando un reactor de mezcla completa con recirculación de sólidos a escala de laboratorio (véase Fig. 8-13b). Consultar el Apéndice H en relación con la determinación de los coeficientes cinéticos a partir de datos experimentales. 8.13. Haga un resumen de una página del contenido de la referencia bibliográfica [19]. 8.14. Se va a utilizar un proceso de fangos activados de corto tiempo de aireación a continuación de un filtro percolador para el tratamiento de un agua residual doméstica. Utilizando la información y los datos que se adjuntan, determinar la concentración celular SSVLM que se debe mantener en el tanque de aireación si, tanto la DBO del efluente como los sólidos en suspensión, deben presentar concentraciones inferiores a los 25 mg/l. ¿Qué grado de recirculación será necesario bajo las características de funcionamiento típicas y óptimas para el tanque de sedimentación secundario? Suponer que la DBO5 de los sólidos del efluente corresponde al 65 por 100 del valor de la concentración de los sólidos. 1) Caudal medio, 4.000 m3/d; 2) Caudal punta 8.000 m3/d; 3) Tiempo de detención en el tanque de aireación para el caudal punta = 0,05 h; 4) Efluente del filtro percolador: DBO5 = 60 mg/l, SS = 60 mg SSVLM/d (véase Tabla adjunta); 5) Datos de sedimentación para los SSVLM obtenidos en una localidad próxima con una planta de similares características; 6) Los sólidos biológicos sedimentados van a recircularse introduciéndolos en cabeza del reactor; 7) Coeficientes cinéticos para el proceso de aireación: k = 5,0 d-1, Ks = 60 mg/l, Y = 0,5 mg/mg, kd = 0,06 d-1; 8) Tipo de tanque de aireación = reactor de mezcla completa. 8.15. Preparar un resumen de una página del siguiente artículo: Garret, M. T., Jr.: «Hydraulic Control of Activated Sludge Growth Rate», Sewage and Industrial Wastes, vol. 39, núm. 3,1958. 8.16. Un proceso de tratamiento de fangos activados de mezcla completa convencional va a ser utilizado para tratar 400 m3/d de un agua residual cuya DBO5 es de 250 mg/l después de la sedimentación primaria. La carga del proceso debe ser de 0,30 kg DBO5/kg SSVLM · d. Si el tiempo de detención es de 6 h y la tasa de recirculación es 0.33, determinar el valor de los SSVLM. 8.17. Se va a proyectar una laguna aireada de mezcla completa con un tiempo de detención de 5 días. Utilizando la Ecuación 8.60 y los datos que se dan a continuación, determinar la DBO5 soluble del efluente. Estimar la DBO5 total considerando la aportación de la DBO5 de los sólidos. ¿Cuáles deberían ser los valores de k1 en la Ecuación 8.58 y de k2 en la Ecuación 8.59 para que se obtuvieran los mismos resultados que con la Ecuación 8.60? Cite un mínimo de tres referencias recientes (posteriores a 1980). 1. Características del afluente: Caudal = 400 m3 d DBO5 total = 200 mg/l DBO5 filtrada = 150 mg/l Sólidos en suspensión 200 mg/l 2. Coeficientes cinéticos: k = 4,0 d-1 Ks = 80 mg/l Y = 0,45 mg/mg kd =0,05d-1 3. DBO5 de los sólidos del efluente = 0,65 (sólidos en suspensión). 4. Suponer que la DBO5 asociada a los sólidos en suspensión es convertida, en su totalidad, durante el proceso. 8.18. Preparar un resumen de una página del siguiente articulo: Thirumurthi, D.: «Design Principles of Waste Stabilization Ponds», Joarnal of the Sanitary Division, ASCE, vol. 95, núm. SA2, 1969. 8.19. Hallar los diámetros teóricos de los dos filtros percoladores de un proceso de filtros percoladores de dos etapas (como el de la Fig. 8-26b) para una instalación con las siguientes características y necesidades de tratamiento: 1. Caudal de 2.400 m3/d con una DBO5 de 300 mg/l. 2. Para garantizar el mantenimiento de la calidad del curso receptor, la DBO del efluente debe ser igual a menor que 21 mg/l. 3. Los filtros deben tener el mismo diámetro y una profundidad de 1,5 m. 4. La tasa de recirculación escogida debe procurar una carga hidráulica de 28 m3/m2 · d. 5. El tanque de sedimentación primario consigue eliminar el 30 por 100 de la DBO5. 6. Emplear los criterios de carga del NCR para filtros percoladores de dos etapas. 8.20. Los datos siguientes han sido obtenidos en un estudio de planta piloto que incluía el tratamiento de agua residual combinada doméstica e industrial mediante un filtro percolador relleno con un material sintético. La DBO5 aplicada al filtro tras la sedimentación primaria, era de 350 mg/l. La superficie del filtro piloto era de 1,0 m2. La temperatura del agua residual era de 16ºC en el momento de hacerse los ensayos. Utilizando estos datos, determinar el valor de los término k20 y n de la Ecuación 8.73. 8.21. Empleando el valor del coeficiente cinético obtenido en el Problema 8.20, determinar el máximo caudal que se puede aplicar a un filtro de 6,0 m de altura diseñado para eliminar el 50 por 100 de la DBO5 aplicada en condiciones invernales. La DBO5 aplicada es de 350 mg 1, y la temperatura crítica sostenida durante el invierno es de 8 ºC. Si la temperatura media del agua residual en los meses de verano es de 22 ºC , ¿Qué grado de eliminación se puede esperar en los meses de verano? 8.22. Estimar la cantidad de metano que se puede producir en la fermentación del ácido tricarboxílico, con fórmula empírica C3H8O6. Despreciar el efecto del crecimiento celular. 8.23. ¿Cuál es el peso molecular y el peso específico aproximado, en condiciones normales, de un gas procedente de un digestor que está compuesto por metano, en un 70 por 100, y dióxido de carbono en un 28 por 100? 8.24. Se diseña un digestor anaerobio para eliminar el 85 por 100 de la DBO5 de un residuo industrial orgánico que tiene una DBO última de 2.000 mg/l. Si el tiempo medio de retención celular es de 12 días, estimar la cantidad de fango a evacuar cada día y la cantidad diaria de gas producido. Suponer que el caudal es de 40 m3/d, Y = 0,1, kd = 0,01 d-1. ¿Cuál seria el incremento en las producciones de gas y de fango si se incrementara el tiempo de retención hasta los 20 días? ¿Es rentable aumentar el tamaño del digestor? 8.14 REFERENCIAS BIBLIOGRAFICAS 1. ALBERTSON, O. E., y DAVIS, G.: «Analysis of Process Factors Controlling Performance of Plastic Bio-Media», Presented at tbe 57th Annual Meeting of the Water Pollution Control Federation, New Orleans, LA, octubre de 1984. 2. ALBERTSON, O. E.: «Tbe Control of Bulking Sludges: From the Early Innovators to Current Practice», Journal WPCF, vol. 69. pág. 172, abril de 1987. 3. ARDERN, E., y LOCKETT, W. T.: «Expenments on the Oxidation of Sewage without the Aid of Filters», J. Soc, Chem, ind., vol. 33. págs. 523,1122, 1914. 4. ATKINSON, B.; DAVIES, I. J., y How, S. Y.: «The Overall Rate of Substrate Uptake by Microbial Films, partes I y II», Trans. Inst. Chem. Eng., 1974. 5. BENEFIFLD, L. D., y RANDALL, C. W.: Biological Process Design for Wastewarer Treatment, Prentice-Hall, Englewood Cliffs, NJ, 1980. 6. BRUCE, A. M., y MERKENS, J. C.: «Eurtber Studies of Partial Treatment of Sewage by high-Rate Biological Filtration», J. Inst. Water Pollut. Contr., vol. 72, núm. 5. Londres, 1973. 7. ECKENFELDER, W. W., Jr.: «Trickling Filtration Design and Performance», Traus. ASCE, vol. 128, t963. 8. ECKENFELDER, W. W., Jr: «Biological Phosphorus Removal: State of the Art Review», Pollution Engineering, pág. 88, septiembre de 1987. 9. FAIRALL, J. M.: «Correlation of Trickling Filter Data». Sewagee aud ind. Wasted, vol. 28, núm.9. t956. 10. GALLER, W. S.. y GOTASS, H. B.: «Optimization Analysis for Biological Filter Desigo», J. Sanit. Eng. Div., ASCE. vol. 92, nùm. SAl, 1966. 11. GERMAIN, J. E.: «Economic Treatment of Domestie Waste By Plastic-Medium Tricking Filter», Journal WPCF, vol. 38. núm. 2, 1966. 12. GRADY, C. P. L., Jr., y LIM, H. C.: Biological Wastewater Treatment: Theory aud Application, Marcel Dekker, Nueva York, 1980. 13. HAWKES, H. A.: The Ecology of Waste Water Treatment, Macmillan, Nueva York, NY, 1963. 14. HIGGINS, I. J., y BURNS, R. G.: The Chemistry and Microbiology of Pollution, Academie, Londres, 1975. 15. HOLLAND, K. T., KNAPP, J. S., y SHOESMITH, J. G.: Anaerobic Bacteria, Chapman and Hall, Nueva York, 1987. 16. HOOVER, S. R., y PORGES, N.: «Assimilation of Dairy Wastes by Activated Sludge, II: The Equation of Synthesis and Oxygen Utilization», Sewagee ad ind. Wastes, vol. 24, 1952.