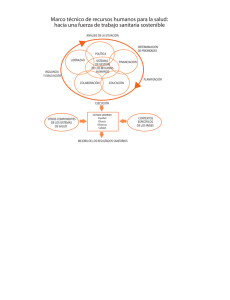
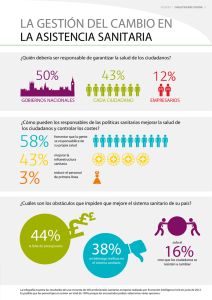
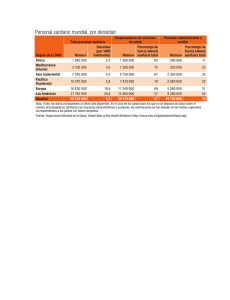
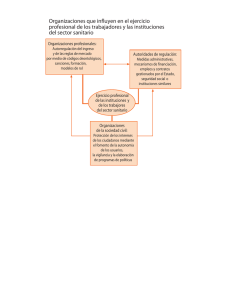
Decreto 1395- Reglamento a la Ley Orgánica de Salud.
Anuncio

Fiel Web 12.0 (www.fielweb.com) :: Ediciones Legales, 2012 REGLAMENTO A LA LEY ORGÁNICA DE SALUD (Decreto No. 1395) Rafael Correa Delgado PRESIDENTE CONSTITUCIONAL DE LA REPÚBLICA Considerando: Que la Constitución Política de la República en su artículo 23 numeral 20 dispone que el Estado reconoce y garantiza a las personas el derecho a una calidad de vida que asegure la salud, alimentación y nutrición, agua potable, saneamiento ambiental; Que la disposición general segunda de la Ley Orgánica de Salud, establece que el Presidente de la República, deberá expedir el reglamento que norme su contenido; y, En ejercicio de las facultades previstas en el numeral 5 del artículo 171 de la Constitución Política de la República, Decreta: Expedir el REGLAMENTO A LA LEY ORGÁNICA DE SALUD. Capítulo I DE LAS ACCIONES DE SALUD Art. 1.- Las áreas de salud en coordinación con los gobiernos seccionales autónomos impulsarán acciones de promoción de la salud en el ámbito de su territorio, orientadas a la creación de espacios saludables, tales como escuelas, comunidades, municipios y entornos saludables. Todas estas acciones requieren de la participación interinstitucional, intersectorial y de la población en general y están dirigidas a alcanzar una cultura por la salud y la vida que implica obligatoriedad de acciones individuales y colectivas con mecanismos eficaces como la veeduría ciudadana y rendición de cuentas, entre otros. Capítulo II DE LA SANGRE, SUS COMPONENTES Y DERIVADOS Art. 2.- El Ministerio de Salud Pública organizará el Sistema nacional de aprovisionamiento y utilización de sangre y la red de servicios de sangre constituida por los hemocentros, bancos de sangre tipos 1 y 2, depósitos de sangre y servicios de medicina transfusional. Art. 3.- Para el funcionamiento del Sistema nacional de aprovisionamiento de sangre y la red de servicios de sangre, el Ministerio de Salud Pública dictará las políticas y establecerá el Plan Nacional de Sangre (PNS), a partir de los cuales se formularán las normas y procedimientos que permitan lograr el aprovisionamiento, procesamiento, disponibilidad y utilización de sangre, hemocomponentes y derivados seguros y de calidad, de manera oportuna y en cantidad suficiente para atender las necesidades de la población. Art. 4.- El Ministerio de Salud Pública establecerá los requisitos técnicos para el licenciamiento y acreditación de la red nacional de sangre y de las plantas industriales de fraccionamiento, y ejecutará el proceso de licenciamiento de estos establecimientos. Art. 5.- El Ministerio de Salud Pública establecerá normas y procedimientos para la donación, fraccionamiento, estudios serológicos (tamizaje), pruebas pretransfusionales, uso clínico y vigilancia de las reacciones transfusionales e implementará programas de educación continua en inmunohematología y alternativas transfusionales. Art. 6.- El Ministerio de Salud Pública regulará y controlará lo correspondiente a costos de operación involucrados en los procesos de obtención, donación, procesamiento, distribución y utilización de sangre, sus derivados y componentes, con el objeto de estandarizarlos y posibilitar su acceso equitativo. Capítulo III DEL REGISTRO SANITARIO Art. 7.- El tiempo máximo para la expedición del Registro Sanitario será en el término de quince días, una vez que se ha cumplido con todos los requisitos establecidos por la ley, este reglamento y las normas que dicte la autoridad sanitaria nacional. Art. ... .- (Agregado por el Art. 1 del D.E. 996, R.O. 618­S, 13­I­2012).­ El plazo de vigencia del Registro Sanitario se contará a partir de la época de su concesión. Dicho registro podrá re inscribirse por períodos iguales y con el mismo número asignado originalmente, en los términos establecidos en el presente Reglamento. Durante la vigencia del Registro Sanitario, el titular está en la obligación de actualizar la información cuando se produzcan cambios en la información inicialmente presentada, para lo cual el Instituto Nacional de Higiene establecerá un formulario único de actualización de la información del Registro Sanitario. En caso de que el Instituto Nacional de Higiene identifique previo control post registro, cambios o modificaciones que no hubieren sido oportunamente notificadas por el titular del Registro, podrá iniciar el procedimiento administrativo correspondiente para la suspensión o cancelación del registro respectivo, con la observancia de las normas del debido proceso. Art. 8.- (Reformado por el Art. 2 del D.E. 996, R.O. 618-S, 13-I-2012).- No se requiere nuevo Registro Sanitario en los siguientes casos: a) Cambio de nombre del producto; b) Cambio de nombre del solicitante del registro; c) Cambio de razón social del fabricante; d) Cambio, aumento o disminución de las mismas formas de presentación ya registradas; y, e) Otros establecidos en reglamentos específicos. Los cambios mencionados en las letras precedentes están sujetos a la presentación de los requisitos técnicos y/o legales de respaldo respectivos, y deberán ser aprobados o rechazados dentro del término de siete días, contados a partir de la fecha de ingreso de la solicitud. De no existir observación o pronunciamiento Página 1 de 3 Fiel Web 12.0 (www.fielweb.com) :: Ediciones Legales, 2012 expreso por parte del Instituto Nacional de Higiene, se entenderá aceptada la solicitud. Art ... .- (Agregado por el Art. 3 del D.E. 996, R.O. 618­S, 13­I­2012).­ El Registro Sanitario concedido podrá ser reinscrito previa solicitud suscrita por el titular del mismo, que deberá ser presentada con al menos noventa (90) días de anticipación a la fecha de su vencimiento. Para el caso de Registros Sanitarios de productos que durante su período de vigencia no hubieren sufrido cambios o modificaciones en su inocuidad o uso previsto, y que no hubieren sido objeto de suspensión por parte de la autoridad sanitaria, la reinscripción se realizará automáticamente, sin más requisitos que la presentación de la solicitud respectiva por parte de su titular, en la cual se deberá dejar expresa constancia de que no se encuentra incurso en ninguna de las dos situaciones antes señaladas. Nota: En este artículo se aplicó la Fe de Erratas publicada en el Suplemento del Registro Oficial 624, 23­I­2012. Art. 9.- El importe o valor de la inscripción, reinscripción de Registro Sanitario y análisis de control de calidad posregistro al que se refiere el artículo 138 de la Ley Orgánica de Salud, así como el pago por servicios que preste la Autoridad Sanitaria Nacional a través de sus dependencias competentes, será fijado por el Ministerio de Salud Pública basándose en criterios técnico­legales. Art. 10.- La participación de los laboratorios acreditados se sujetará a las normas y disposiciones que dicte el Ministerio de Salud Pública. Art. 11.- El control de calidad postregistro está orientado a verificar el cumplimiento y mantenimiento de los parámetros que fueron declarados y aceptados para la emisión del Registro Sanitario del producto, y que les permite seguir siendo aptos para el uso y consumo humano. Art. 12.- Cuando se suspenda o cancele el Registro Sanitario conforme al artículo 141 de la ley, el Instituto Nacional de Higiene informará inmediatamente a la Dirección General de Salud la suspensión o cancelación, adjuntando los justificativos técnicos y legales que ocasionaron tal decisión. Art. 13.- Si como consecuencia del control posregistro realizado por las dependencias técnicas involucradas a nivel nacional o provincial, se comprueba que los fabricantes o importadores no cumplen con los requisitos y condiciones establecidas en las normativas técnicas y sanitarias correspondientes, dichas dependencias deberán presentar un informe a la Dirección General de Salud, quien de ser procedente solicitará al Instituto Nacional de Higiene la suspensión o cancelación del Registro Sanitario de los productos en cualquier tiempo. Art. 14.- La cantidad de muestras médicas a autorizarse para la importación se determinará de conformidad con el número de visitadores médicos de que disponga el importador y en base al instructivo que dicte para el efecto la autoridad sanitaria nacional. Art. 15.- La promoción de los medicamentos debe ser realizada a través de los visitadores médicos, en su condición de personal vinculado a la industria farmacéutica, quienes deberán tener formación profesional en carreras afines a las ciencias de la salud y farmacéuticas. Se prohíbe la visita médica en los servicios de salud públicos. Art. 16.- La promoción de los medicamentos debe sustentarse tanto en la información terapéutica aprobada en el Registro Sanitario del producto como en las evidencias científicas. La empresa responsable de la comercialización debe estar en condiciones de facilitar dichas evidencias científicas a petición de los profesionales de la salud. Art. 17.- La promoción de otros productos de uso y consumo humano sujetos a registro sanitario, comprende la organización o patrocinio de toda actividad relacionada con la entrega de esos productos por parte de las empresas, para promover el uso o consumo de los mismos. Art. 18.- Los ensayos clínicos patrocinados por la industria farmacéutica o investigadores particulares requieren de la autorización previa de la Autoridad Sanitaria Nacional, previo el cumplimiento de los requisitos que dicha autoridad establezca. Art. 19.- La Autoridad Sanitaria Nacional emitirá las directrices y normas administrativas necesarias respecto a los procedimientos para el otorgamiento, suspensión, cancelación o reinscripción del Registro Sanitario. Capítulo IV DE LOS MEDICAMENTOS Art. 20.- Para fines de aplicación de la ley se entenderá como medicamentos esenciales aquellos que satisfacen las necesidades de la mayor parte de la población y que por lo tanto deben estar disponibles en todo momento, en cantidades adecuadas, en formas de dosificación apropiadas y a un precio que esté al alcance de todas las personas. Art. 21.- En las instituciones públicas del sistema nacional de salud, la prescripción de medicamentos se hará obligatoriamente de acuerdo a los protocolos y esquemas de tratamiento legalmente establecidos y utilizando el nombre genérico o la denominación común internacional del principio activo. Art. 22.- Se entiende por farmacovigilancia de medicamentos de uso y consumo humano, a la actividad de salud pública destinada a la identificación, cuantificación, evaluación y prevención de los riesgos asociados a los medicamentos una vez comercializados. La farmacovigilancia sirve para orientar la toma de decisiones que permitan mantener la relación beneficio ­ riesgo de los medicamentos en una situación favorable o bien suspender su uso cuando esta relación sea desfavorable, y contribuye con elementos para ampliar las contraindicaciones en caso de que se presenten. Art. 23.- Los estudios de utilización de medicamentos se realizarán en las etapas de comercialización, distribución, dispensación y uso de fármacos en el país, con énfasis especial en los efectos terapéuticos, consecuencias sociales y económicas derivadas de su uso o consumo. Art. 24.- La autoridad sanitaria nacional emitirá las directrices y normas administrativas necesarias respecto a los procedimientos para la obtención del requisito sanitario de medicamentos en general. Capítulo V ESTABLECIMIENTOS FARMACÉUTICOS Art. 25.- La venta y/o dispensación de medicamentos puede hacerse bajo las siguientes modalidades: a) Receta médica; b) Receta especial para aquellos que contienen psicotrópicos o estupefacientes; y, c) De venta libre. Art. 26.- El Ministerio de Salud Pública emitirá las normas respecto a la receta médica que serán de observancia obligatoria para todos los integrantes del Sistema Nacional de Salud. Art. 27.- La preparación de fórmulas magistrales en farmacias deberá ser previamente autorizada por el Ministerio de Salud Pública. En el caso de que un comisariato o supermercado solicite autorización para vender medicamentos, se definirá un área específica para el funcionamiento de la farmacia, la misma que cumplirá con los requisitos determinados por la Autoridad Sanitaria Nacional. Art. 28.- Los establecimientos farmacéuticos deben contar con la responsabilidad técnica de un profesional químico farmacéutico o bioquímico farmacéutico. Un profesional bioquímico farmacéutico o químico farmacéutico podrá ser responsable técnico de hasta dos establecimientos farmacéuticos públicos o privados, sean estos laboratorios farmacéuticos, casas de representación de medicamentos, distribuidoras farmacéuticas o farmacias; a excepción de los profesionales que laboren en las provincias del Oriente, Santo Domingo de los Tsáchilas y en aquellas en que se compruebe que no existen suficientes profesionales farmacéuticos, en donde se podrá responsabilizar de hasta tres establecimientos farmacéuticos a cada profesional, siempre que la dedicación o carga horaria exigida lo permita. Página 2 de 3 Fiel Web 12.0 (www.fielweb.com) :: Ediciones Legales, 2012 Los profesionales químicos farmacéuticos o bioquímicos farmacéuticos que sean propietarios de establecimientos farmacéuticos, sólo podrán responsabilizarse además del propio establecimiento farmacéutico de uno adicional. Art. 29.- La Autoridad Sanitaria Nacional emitirá las directrices y normas administrativas necesarias sobre el control, requisitos y funcionamiento de los establecimientos farmacéuticos. Art. 30.- Deróguense los decretos ejecutivos No. 248, publicado en el Registro Oficial 55 de 4 de abril del 2003, No. 1583, publicado en el Registro Oficial 349 de 18 de junio del 2001 y No. 4142, publicado en el Registro Oficial 1008 de 10 de agosto de 1996. Art. Final.- El presente reglamento entrará en vigencia a partir de su publicación en el Registro Oficial. Dado en el Palacio Nacional, en Quito, a 16 de octubre del 2008. DISPOSICIONES EN DECRETOS REFORMATORIOS DECRETO No. 996 (R.O. 618-S, 13-I-2012) Disposición Transitoria Única.­ Por esta única ocasión, los registros sanitarios de aquellos productos que se encontraban por vencer entre el mes de enero del año 2011 y el 30 de junio del año 2012, respecto de los cuales se haya presentado la correspondiente solicitud de reinscripción o renovación, al menos 15 días antes de su vencimiento, se entenderán renovados hasta el 31 de diciembre del 2012, salvo que, antes de la llegada de esta última fecha, el Instituto Nacional de Higiene, Leopoldo Izquieta Pérez, haya aprobado o negado la petición del titular del registro, en cuyo caso el registro sanitario tendrá la vigencia prevista al momento de la concesión o, en el caso contrario, dejará de tener vigencia a partir de la resolución que niegue la solicitud. FUENTES DE LA PRESENTE EDICIÓN DEL REGLAMENTO A LA LEY ORGÁNICA DE SALUD 1.- Decreto 1395 (Registro Oficial 457, 30-X-2008) 2.- Decreto 996 (Suplemento del Registro Oficial 618, 13-I-2012) 3.- Fe de Erratas (Suplemento del Registro Oficial 624, 23-I-2012). Página 3 de 3