El ciclo celular, sus alteraciones en el cáncer y como es - UAM-I
Anuncio

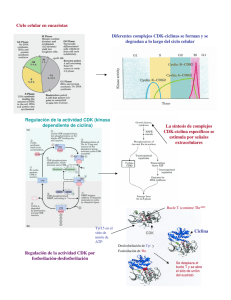
El ciclo celular, sus alteraciones en el cáncer y como es regulado en células troncales embrionarias Marco Antonio Quezada Ramı́rez Licenciatura en Biologı́a Experimental, UAM-I. e-mail mqr 170882yahoo.com.mx Recibido:01 de febrero de 2007 Aceptado: 22 de mayo de 2007. te to get their objectives have taked us to understanding today many others cell process as deregulations of cell cycle which origins cancers and lately the basic biology of the hoper and polemics embryonic stem cells. This review describes the molecular mechanism of cell cycle, how it is altered in cancer and finally how it is modified in embryonic stem cells. Resumen El ciclo celular es el proceso a través del cual las células se multiplican o proliferan. Su correcta ejecución en un organismo pluricelular como el hombre contribuye a establecer en él una integración estructural y funcional adecuada para hacer frente a las condiciones impuestas por el ambiente. Corresponde a las cinasas dependientes de ciclinas (CDKs, cyclin-dependent kinases) y sus subunidades activadoras, las ciclinas, dirigir el recorrido de las células por las fases del ciclo celular (G1, S, G2 y M). La elucidación a través de décadas de investigación del mecanismo molecular con el que operan estas moléculas para lograr sus objetivos nos ha llevado a comprender actualmente muchos otros procesos celulares como las desregulaciones del ciclo celular que desembocan en cánceres y en los últimos años la biologı́a básica de las polémicas y esperanzadoras células madre embrionarias. El objetivo de esta revisión es describir el mecanismo molecular del ciclo celular, sus alteraciones en los procesos de cáncer y finalmente su estructuración en células madre embrionarias. Key words: cell cycle, cell proliferation, cyclindependent kinases (CDKs), cyclins, cancer, self-renewal. Introducción El ciclo celular (CC) es el conjunto de eventos que van desde el nacimiento y el crecimiento hasta la división de una célula cualquiera; es decir, la proliferación celular propiamente dicha. La importancia de este proceso la vemos, por ejemplo, en el cuerpo humano, donde se regeneran constantemente los epitelios (como los de cavidades intestinales), ası́ como células sanguı́neas (eritrocitos y leucocitos); e incluso, algunas células pueden accionar su CC como mecanismo de defensa (los hepatocitos en la regeneración del hı́gado); todo ello para mantener no sólo la integridad sino también las funciones biológicas adecuadas del organismo frente a las condiciones que le impone el ambiente (López-Casillas, 2002). Palabras clave: ciclo celular, proliferación celular, cinasas dependientes de ciclinas (CDKs), ciclinas, cáncer, autorrenovación. El CC se encuentra dividido en cuatro fases morfológicamente no muy bien diferenciadas pero molecularmente bien delimitadas y en el siguiente orden secuencial: fases G1, S, G2 y M. Las fases G1 y G2 (gap o intervalo) implican una actividad metabólica para el crecimiento en masa de la célula. Por su parte la fase S (sı́ntesis) consiste en la replicación del DNA para heredar a cada célula hija la misma carga genética. Y la fase M (mitosis) o de división celular como su nombre lo indica es la división de todo el material celular para originar dos células hijas (figura 1, pág. 6) (Alberts et al, 1998). La duración completa de este ciclo varia con el tipo de Abstract The cell cycle is the process for which cells multiplicate or proliferate. Its correct execution in a pluricellular organism as the human, contribute to establish in him an adequate functional and structural integration to face the environmental conditions. Correspond to the cyclin-dependent kinases (CDKs) and their subunities the cyclins, to direct the path of cells for the phases of cell cycle (G1, S, G2 and M). The elucidation trough decades of research of the molecular mechanism for which this molecules opera5 6 ContactoS 65, 5–12 (2007) célula de que se trate y de las condiciones del medio en el que se encuentre (tabla I). Cuando la célula no está en actividad proliferante se dice que ha salido del CC y se encuentra en estado de quiescencia ó G0, un ejemplo clásico de estas células son las neuronas (López-Casillas, 2002). damente galardonados con el premio Nobel de Fisiologı́a y Medicina en el 2001 (López-Casillas, 2002). Es por ello que en esta revisión se hace una descripción en las primeras secciones del mecanismo molecular que gobierna el tránsito de las células por las fases del CC. Enseguida se abordan ejemplos de alteraciones del CC que desembocan en cáncer y finalmente se analiza su estructuración en células troncales embrionarias. Estı́mulo y transducción de señales para el encendido molecular del ciclo celular Como ocurre en muchos otros procesos celulares para que el CC de una célula se ponga en marcha es necesaria la presencia de un estı́mulo que la célula sea capaz de interpretar a través de sus receptores para ası́ poder encender la maquinaria molecular del ciclo. A este proceso se le conoce como transducción de señales y es mediado por complejos proteicos de funciones especı́ficas denominados transducisomas (Zentella-Dehesa y Alcántara-Hernández, 2003). Figura 1. Fases y duración de un ciclo celular estándar considerado en 24 horas. Tabla I. Duración de algunos Ciclos Celulares Células Escherichia coli Levadura Embrionarias de rana Epitelio intestinal Fibroblastos de mamı́fero en cultivo Hepatocitos humanos Tiempo 20 minutos 1.5-3 horas 30 minutos 12 horas 20 horas 1 año El tránsito por estas cuatro fases del CC está dirigido por una red de interacción de proteı́nas altamente compleja y finamente regulada. De entre estas proteı́nas se destacan las enzimas de acción fosforilante denominadas cinasas dependientes de ciclinas (CDKs, cyclin-dependent kinases 1, 2, 4 y 6) y sus subunidades activadoras las ciclinas (A, B, D y E) (Kim y Zhao, 2005). La elucidación de estas redes de interacción nos ha llevado a entender actualmente muchos otros fenómenos celulares como el cáncer y más recientemente la biologı́a de las células troncales embrionarias. Parte importante de este conocimiento que ahora tenemos sobre el CC vino de las aportaciones cientı́ficas de Leland H. Hartwell, Paul N. Nurse y R. Timothy Hunt, quienes fueron mereci- Aquellas proteı́nas que constituyen el estı́mulo o señal extracelular que le indica a una célula entre en proliferación, son conocidas como factores de crecimiento. Estos factores (llamados por algunos autores citocinas) son producidos naturalmente por el organismo y en ocasiones su actividad no solo se limita a inducir la proliferación sino también la diferenciación celular. Actualmente se conoce una gran variedad de factores de crecimiento y muchos de ellos han sido purificados para ser utilizados con fines de investigación. Para ejercer sus efectos requieren que la célula blanco exprese los receptores de membrana especı́ficos para cada uno de ellos. Una vez que el ligando (factor de crecimiento) se une a su receptor de membrana le produce a éste un cambio conformacional que se traduce comúnmente en una actividad enzimática sobre otras proteı́nas que forman parte de la vı́a de señalización en la célula (acopladores, amplificadores, etc.). En las vı́as de señalización para factores de crecimiento se ha encontrado que las reacciones predominantes son las fosforilaciones (Zentella-Dehesa y Alcántara Hernández, 2003). Las células embrionarias de ratón (mESC, mouse embryonic stem cells), por ejemplo, proliferan in vitro gracias a la presencia en cultivo del factor inhibitorio de la leucemia (LIF, leukemia inhibitor factor), una citocina que produce una señal de trans- El ciclo celular. . . Marco Antonio Quezada Ramı́rez. ducción especı́fica y conocida al unirse a su receptor de membrana, el heterodı́mero conocido como pg130/LIFR. Al unirse a su ligando, en la región citoplásmica de este receptor se activa la tirosincinasa asociada a Janus (JAK, Janus-associated kinase) que fosforila a STAT3, proteı́na que una vez fosforilada se dimeriza y cumple la función de factor de transcripción cuando es translocada al núcleo de la célula (figura 2, pág. 8) (Burdon et al, 2002; Eckfeldt et al, 2005). Es sabido que STAT3 activa la expresión de genes clave para el encendido del CC como ha sido demostrado en la lı́nea celular linfoide BAF-03 (Burdon et al, 2002). De entre estos genes de respuesta temprana a STAT3 —como han sido llamados— sobresale c-myc, que codifica a una proteı́na que funge como factor de transcripción para ciclina D2, CDK4, ciclina E, ciclina A y la fosfatasa cdc25A, los actores principales de las primeras etapas del ciclo (Nathans et al, 1988; Gartel y Shchors, 2003). Transición G1/S La producción de ciclina D promueve el inicio del recorrido por las fases del CC. Al formar un complejo con la CDK adecuada (4 ó 6) se activa la acción cinasa de esta última, cuyo sustrato principal es la proteı́na Rb (Verschuren et al, 2004; Kim y Zhao, 2005). La proteı́na Rb (denominada ası́ por la contracción de la palabra retinoblastoma, lugar donde fue descubierta) juega un importante papel en el control de la proliferación celular. Se trata de una proteı́na supresora de tumor que en su forma hipofosforilada bloquea a los factores de transcripción E2F1, E2F2 y E2F3a, que son esenciales para la expresión de genes que le darán continuidad al ciclo (E2Fs activantes) (Kim y Zhao, 2005, Attwooll et al, 2004). La fosforilación parcial de Rb por el complejo ciclina D/CDK deja en libertad a los E2Fs activantes, los cuales tienen la capacidad de reemplazar al complejo represor p107/E2F4 de sus promotores blanco en etapa G1 temprana (figura 2). Esta acción desemboca en la activación transcripcional de la ciclina E y la fosfatasa cdc25A, la cual, como señalamos lı́neas atrás ya habı́a sido mediada por c-myc (Attwooll et al, 2004; Burdon et al, 2002). Es importante aquı́ destacar que si la ciclina D estuviera ausente, la ciclina E tendrı́a la capacidad suficiente para promover el inicio del CC ya que su producción no requiere forzosamente la intervención del complejo ciclina D/CDK y además, como marcaremos en- 7 seguida, posee otras proteı́nas blanco de gran importancia. La fosfatasa cdc25A remueve grupos fosfatos inhibidores de CDK2 y permite ası́ la formación del complejo ciclina E/CDK2, que culmina la inactivación de la proteı́na Rb (Burdon et al, 2002). Se sabe hoy que Rb cuenta con 16 sitios potenciales de fosforilación (Verschuren et al, 2004). Se ha visto también que el complejo ciclina E/CDK2 ejerce una acción cinasa sobre p107 y p130 (los otros dos miembros de la familia Rb) además de fosforilar parte de la maquinaria de replicación como la proteı́na cdc6 (figura 2) (Kim y Zhao, 2005). Los E2Fs activantes promueven también la expresión de ciclina A (que igualmente fue mediada por c-myc), ciclina B y proteı́nas de la maquinaria de replicación (como cdc6 y orc1) en la misma transición G1/S. La formación del complejo ciclina A/CDK2 permite activar parte de la maquinaria para iniciar la replicación (por fosforilación de cdc6) y el bloqueo de los E2Fs activantes, de este modo se inhibe la producción de proteı́nas que intervienen en la progresión de la etapa S, asegurando que se sinteticen solo las necesarias (figura 2, pág 8, tabla II, pág, 9) (Verschuren et al, 2004; Golias et al, 2004). Transición G2/M La fase G2 del CC es el lapso entre el fin de la replicación (fase S) y el inicio de la fase M (figura 1). Al igual que en G1 la célula aumenta en tamaño y duplica sus organelos citosólicos. Por su parte la fase M o de división celular comprende la división nuclear (mitosis) y la división citoplásmica (citocinesis), siendo esta ultima la etapa final del CC (Alberts et al, 1998). El actor principal de esta transición es el complejo ciclina B/CDK1, antiguamente conocido como factor promotor de la meiosis, pero dado que también fue encontrado en los procesos de mitosis de las células animales hoy es más correctamente llamado factor promotor de la fase M o MPF por sus siglas en inglés (M-promoting factor) (Stephano-Hornedo, 1993). El MPF es activado por la cinasa Polo y translocado al núcleo en prometafase coincidiendo con la desintegración de la membrana nuclear, por lo cual se ha sugerido que uno de sus trabajos es fosforilar a las proteı́nas de la lamina nuclear, un paso fundamental para que el núcleo se disocie en vesı́culas y deje libres a los cromosomas que también son formados 8 ContactoS 65, 5–12 (2007) Figura 2. Eventos moleculares en la transición G1/S del ciclo celular. Se muestra una hipotética vı́a de transducción de señales para esquematizar la activación del complejo cilcina D/CDK que promueve el inicio del ciclo (arriba izquierda). Son los complejos ciclina E/CDK2 y ciclina A/CDK2 quienes fosforilan a cdc6 y logran el desensamble del complejo pre-replicativo (pre-RC) y el reclutamiento de factores de replicación (como DNA polimerasa) para dar paso a la fase S (abajo derecha). El complejo pre-RC no se ensambla hasta una nueva fase G1 donde baja la actividad cinasa. (Ver información complementaria en el texto). por intervención del MPF, pues observaciones in vitro revelan por parte de este una acción cinasa sobre la histona H1. No obstante, reportes recientes indican que pueden existir otros mecanismos de condensación mediados por las proteı́nas survivina y la cinasa Aurora B, importantes también para la segregación cromosómica (Stephano-Hornedo, 1993; Verschuren et al, 2004; Pardo, 2005). El MPF ha sido objeto de intensa investigación y se han propuesto otras acciones para este complejo durante el CC y que por brevedad no discutiremos aquı́ (tabla II) (Stephano-Hornedo, 1993). Sólo por dejar señalado mencionaré que incluso la presencia de este factor en los ovocitos maduros es importante para el éxito de algunos experimentos de clonación basados en la técnica de la transferencia nuclear. cial y molecularmente de una manera altamente precisa y no menos compleja. Un punto de control entre ambos procesos esta a nivel de la ciclina B. Se ha observado que la introducción de la una ciclina B que no puede ser degradada por carecer de la secuencia de reconocimiento por el complejo APC (ver adelante), arresta a las células en anafase y no se procede a la citocinesis (Stephano-Hornedo, 1993; Pardo, 2005). Ası́, el final de la citocinesis (la formación de dos células hijas) marca el final de un CC. Ciclina A, que puede formar un complejo con CDK1, también fosforila a proteı́nas de la membrana nuclear además de estabilizar a ciclina B (figura 3, tabla II) (Golias et al, 2004). Regulación de las proteı́nas del ciclo celular Las CDKs son proteı́nas constitutivas cuya actividad esta regulada por un gran número de moléculas no menos importantes y que también requieren su regulación para llevar al CC a buen puerto. Entre las moléculas que están vinculadas a la actividad de las CDKs se encuentran otras cinasas (CDK7, Wee1, Myt1), fosfatasas (cdc25A, B y C), proteı́nas inhibidoras (CKIs) y sus coenzimas las ciclinas. Por brevedad solo nos enfocaremos a las más sobresalientes. La citocinesis para la separación de las células hijas ocurre solo después de que se hubo terminado la mitosis, pues ambos procesos están vinculados espa- Las ciclinas están sujetas a una regulación por retroalimentación negativa (negative feedback), excepto la ciclina D, quien es expresada mientras se man- El ciclo celular. . . Marco Antonio Quezada Ramı́rez. 9 Tabla II. Expresión, efectos y regulación de complejos CDKs/ciclinas durante el Ciclo Celular. Etapas G0/G1e Estimulo Ciclina CDK Blancos FC Ciclina D CDK4/6 Rb G1l/Se FC y E2Fs Ciclina E CDK2 G1/SPrometa FC y E2Fs Ciclina A CDK2 CDK1 G1/SE2Fs Meta/Ana Ciclina B CDK1 (MPF) Efectos Degradacion Regulación Activación de ciclina Dependiente E y cdc25A del FC e INK4 Rb, cdc6, p27, Activación de ciclinas ciclina E A y B y maquinaria de replicación. SCF Inactivación de ciclina E y p27 cdc6, E2Fs, Activa la replicación APC, ciclina B y a APC. Bloquea Regulación E2Fs.Estabiliza a Negativa ciclina B y a través APC, láminas, Activa APC y proteı́nas de CIPs histona H1, de formación del huso. APC ARNpol II, Desaparición de la pp60c-src, membrana nuclear. NO38 Condensación de y nucleolina cromosomas. Inhibición de la transcripción. Reorganización de cito esqueleto. Desensamble de nucleolo FC, factor de crecimiento; e, temprana; l, tardı́a; Prometa, prometafase; Meta, metafase; Ana, anafase; MPF, factor promotor de la fase M; INK4, familia de inhibidores de la cinasa 4; CIP, familia de proteı́nas inhibidoras de CDKs hase kinase) al ser exportada del núcleo de la célula (tabla II) (Verschuren et al, 2004). La degradación de las ciclinas A y B es mediada por el complejo promotor de la anafase (APC, anaphasepromoting complex) que ellas mismas activan junto con cinasa Polo (negative feedback) (Tabla II). El complejo ubiquitin ligasa APC media la degradación por el proteosoma y sus blancos incluyen ciclinas A y B, securina (esencial para la segregación cromosómica), cinasa Polo y Aurora B, estas dos ultimas imprescindibles para la correcta ejecución de la citocinesis (figura 3) (Pardo, 2005). Figura 3. Algunos eventos moleculares en la fase M en orden cronológico. tenga el estı́mulo mitógeno, aunque esto no implica que no tenga que ser degradada. Las ciclinas D y E requieren ser fosforiladas para su degradación por el proteosoma mediada por el complejo ubiquitin ligasa SCF (Skp/Cullin/F-box). La ciclina E es fosforilada por ciclina E/CDK2 (negative feedback), mientras que ciclina D es fosforilada por la cinasa glicógeno sintasa 3β (GSK-3β, glycogen sint- Existen además otros actores importantes para el control del CC y que requieren también ser regulados. Los inhibidores de CDKs (CKIs, cyclindependent kinase inhibitors), son proteı́nas supresoras de tumor que bloquean la actividad de los complejos CDKs/ciclinas y causan arrestos en fases especı́ficas del CC dependiendo donde se encuentre el complejo cinasa inhibido. Algunos CKIs son estimulados por senescencia celular, inhibición por contacto o diferenciación terminal (Burdon et al, 2002). Dos familias de CKIs han sido descritas. La familia INK4 (inhibitors of kinase 4) se compone de las proteı́nas p15, p16, p18 y p19 (nombradas de acuerdo a su masa molecular), todas ellas interactúan con 10 las CDKs 4 y 6 ocasionándoles un cambio conformacional que impide su unión con la ciclina D. La familia CIP (CDKs-inhibitor proteins) incluye a las proteı́nas p21, p27 y p57, que bloquean a las ciclinas A, B y E y a las CDKs 1 y 2 o a los complejos ya formados por estas (Kim y Zhao, 2005). Es sabido que c-myc es un represor transcripcional de CKIs identificados durante el avance del CC. La proteı́na c-myc bloquea la transcripción de p15 al unirse a su promotor y de p21 al bloquear a los factores de trascripción sp1/sp3 (Figura 2) (Gartel y Shchors, 2003). Además p21 es una proteı́na cuya expresión esta mediada por otra importante proteı́na supresora de tumores, p53. La proteı́na p53 es un factor de transcripción cuya actividad está involucrada en múltiples procesos celulares (arresto del CC, apoptosis, diferenciación celular, etc.). Se dice que esta proteı́na está ubicada en el centro de las vı́as de respuesta al estrés, activándose (por modificaciones post-traduccionales) cuando existe daño al DNA, hipoxia, activación de oncogenes, entre otras señales. Por ello se la ha llegado a nombrar “el guardián del genoma”. Dentro del CC esta proteı́na constituye un punto de control en las transiciones G1/S y G2/M. Cuando es activada por un daño al DNA que requiera ser reparado antes de entrar a la replicación (fase S), p53 activa la transcripción de p21 y a través de este inhibidor inhibe la actividad del complejo ciclina E/CDK2. También se ha encontrado que puede unirse al RNAm de CDK4 para impedir su traducción. A través de estos mecanismos arresta el CC en fase G1 (Ryan et al, 2001; Golias et al, 2004) Si el daño es producido luego de la replicación del DNA, p53 arresta a la célula en G2/M uniéndose al promotor del gen de ciclina B bloqueando su transcripción (Kim y Zhao, 2005). Cuando el daño al DNA es irreparable (masivo), p53 puede llevar a la muerte celular por apoptosis activando los genes requeridos para ambas vı́as de muerte: mitocondrial y receptor de muerte (Ryan et al, 2001). Es importante tener presente que las células se encuentran sujetas a diversas señales extracelulares provenientes de su microambiente (pueden expresar receptores para mas de cien tipos distintos de moléculas), las cuales determinan las funciones que han de seguir. Y el CC no es la excepción. Otras proteı́nas involucradas en la regulación del ciclo son las proteı́nas morfogenéticas del hueso (BMPs, pone morphogenetic proteins) pertenecientes a la su- ContactoS 65, 5–12 (2007) perfamilia del factor de crecimiento transformante β (TGFβ, transforming growth factor β) (Lodish et al, 2005). Se ha visto que las BMP2 y 4 pueden inducir la expresión de la proteı́na inhibidora de la diferenciación tipo 1 (Id1, inhibitor of differentiation) durante la transición G1/S, donde Id1 bloquea los efectos del CKI p16 sin llevar a las células a la inmortalización (figura 2) (Ruzinova y Benezra, 2003). Alteraciones del ciclo celular y cáncer El cáncer es una proliferación celular descontrolada causada por factores fı́sicos, quı́micos, genéticos ó biológicos. Existen decenas de formas en que se presenta la enfermedad pero su fisiopatologı́a básica comprende aberraciones en cualquier punto de la maquinaria molecular que gobierna el CC y que por tanto causan las desregulaciones de éste (Golias et al, 2004). Resulta entonces poco menos que imposible nombrar aquı́ todos los tipos de alteraciones que existen en cada forma de cáncer conocida pero ejemplificaremos algunos casos. Ciclina D se ha visto incrementada en múltiples tipos de cáncer, como el de estómago o el de esófago, y el riesgo de desarrollar estos males aumenta cuando existe un decremento de zinc, pues se ha demostrado que la deficiencia nutricional es un factor de riesgo importante para desarrollar estos tipos de cánceres gastroesofágicos. La sola sobreexpresión de ciclina D ha mostrado ser insuficiente para dar una respuesta carcinogénica en modelos animales tratados con agentes cancerı́genos como la Nnitrosometilbenzilamina. Las ciclinas A y E, por su parte, se sobreexpresan en carcinomas hepatocelulares y su nivel de sobreexpresión se relaciona con la agresividad de la enfermedad (Golias et al, 2004). Ciclina B se incrementa en casos positivos a los virus del papiloma humano (HPVs, human papillomaviruses) 16 o 18, los cuales son la principal causa de cáncer de cervix en mujeres. Además estos HPVs de alto riesgo codifican en su genoma oncoproteı́nas que también juegan un rol en la carcinogénesis, como es el caso de la oncoproteı́na E7, que al igual que el complejo ciclina D/CDK puede bloquear la función de Rb y ası́ promover el CC (Kim y Zhao, 2005) o la oncoproteı́na E6 que bloquea las funciones de p53 al unirse a este factor de transcripción (Gariglio, 1995). Las células que sobreexpresan c-myc son resistentes a los efectos de arresto del crecimiento promovidos por el TGFß que induce la expresión de p15, p21 El ciclo celular. . . Marco Antonio Quezada Ramı́rez. y p27 (los mismos CKIs reprimidos por c-myc). Esta situación también se encuentra en aproximadamente 80 % de los tumores cervicales (Gariglio, 1995; Gartel y Shchors, 2003). El gen p53 se encuentra mutado en la mitad de los cánceres humanos conocidos (de hı́gado, piel, pulmón, etc.). Las leucemias mieloides son parte del otro cincuenta por ciento donde no hay mutaciones en este gen (Ryan et al, 2001). La pérdida de la función de p53 deja a las células sin un mecanismo para inhibir el desarrollo de tumores y, por lo tanto, frente a un daño al DNA que active un oncogen no podrı́an detener su ciclo proliferativo y corregir el daño o morir por apoptosis. Cuando solo un alelo de p53 se encuentra mutado (proveniente del padre o la madre) su portador es susceptible a desarrollar algún tipo de cáncer (de mama, osteosarcoma, etc.), esta condición se conoce como sı́ndrome de Li-Fraumeni y el desarrollo del tumor dependerá del tejido en el que se produzca la segunda mutación que anule al alelo funcional. Las mutaciones del gen p53 se reflejan en una proteı́na que no se degrada rápidamente y además inactiva a la proteı́na p53 silvestre al formar complejos multimericos con ella (Gariglio, 1995). Pero un caso de particular interés lo constituye el herpesvirus asociado al sarcoma de Kaposi (un tumor de origen endotelial frecuente en pacientes inmunosuprimidos, como los pacientes con SIDA). Dicho virus (KSHV, Kaposi’s sarcoma-associated herpesvirus) codifica en su genoma a una oncoproteı́na con función de ciclina que activa preferentemente a las CDKs 4 ó 6 pero les confiere acción sobre una variedad de proteı́nas mucho más amplia (no solo Rb), actuando sobre blancos de ciclina E/CDK2 (cdc6, p27) y de ciclina A/CDK2 (cdc6), de este modo una sola oncoproteı́na causa desregulaciones en múltiples puntos del ciclo a la vez. Además es una ciclina vı́rica que no esta sujeta al bloqueo por CKIs y tampoco puede ser degradada por el proteosoma (Verschuren et al, 2004). El Ciclo celular en células troncales embrionarias Se conocen desde hace tiempo, pero en los últimos años ha venido creciendo la esperanza de los pacientes aquejados con enfermedades degenerativas y el asombro de los investigadores biomédicos por las células madre. Las células madre embrionarias (ESCs, embryonic stem cells), más correctamente llamadas células troncales, son células no diferen- 11 ciadas que tienen el potencial de dar origen a todos los tejidos de un organismo durante su desarrollo embrionario. Además levantan lı́neas celulares pluripotenciales con la capacidad de diferenciarse a tejidos especializados mediante su inducción especı́fica en cultivo, lo que naturalmente las hace atractivas en el desarrollo de terapias celulares para tratar enfermedades degenerativas que hasta ahora han sido incurables (enfermedad de Parkinson, Alzheimer, cirrosis hepática, etc.) (Eckfeldt et al, 2005). Los estudios in vitro de estas células derivadas del embrión de ratón (mESCs) como modelo de estudio, han demostrado ciertas particularidades en lo que respecta a su proliferación celular, caracterı́stica llamada en su caso autorrenovación. A diferencia de lo que ocurre en células somáticas, las mESCs muestran una fase G1 no controlada por el complejo ciclina D/CDK ni la proteı́na Rb. De hecho estas células solo expresan bajos niveles de ciclinas D1 y D3, pero no expresan el tipo D2 (entre las cuales no hay diferencias funcionales). La proteı́na Rb por su parte esta inactiva (hiperfosforilada) en esta parte del ciclo. Es por tanto el complejo ciclina E/CDK2 quien dirige el CC en esta primera fase pero aun esta a discusión si actúa constitutivamente o está bajo la dirección de la vı́a de transducción de señales LIF-LIFR/gp130-STAT3 planteada al inicio de este artı́culo (Burdon et al, 2002). Además se ha observado que al momento de diferenciarse en cultivo (por el retiro de LIF) las mESCs comienzan a expresar las ciclinas D adoptando el control G1/S. Este evento se acompaña también de la activación de Rb (hipofosforilado), que es capaz de unirse a factores de trascripción especı́ficos de diferenciación como Myo-D, miogenina y C/EBP. Pero aún no se conoce de qué manera están vinculados estos procesos y si estos resultados pueden extrapolarse a las células troncales embrionarias de humanos, las cuales obviamente son de especial interés para desarrollar realmente terapias de reemplazo celular (hESCs) (Burdon et al, 2002). Conclusión El descubrimiento de los controles que gobiernan el CC nos ha llevado a comprender muchos de los fenómenos que se presentan en la vida celular tanto en la salud como en la enfermedad, siendo este último punto de particular interés para el estudio de posibles blancos terapéuticos donde se puedan combatir las anormalidades del CC que desembocan en tumores. Pero el camino a seguir aún es lar- 12 go pues todavı́a quedan cabos sueltos que hay que enlazar. Se ha llegado a cuestionar por ejemplo la capacidad de transactivación de los E2Fs activantes y el papel que realmente juega Rb dentro del ciclo, sobre todo al observar que esta proteı́na se puede asociar a factores de trascripción durante los eventos de diferenciación de las mESCs. Sin duda el desarrollo de terapias antitumorales requiere de un cabal entendimiento de la estructura del CC, asimismo para el estudio de esas entidades tan sorprendentes como son las células troncales, que pueden ser la base para el desarrollo a futuro de terapias celulares contra el cruel flagelo que representan las enfermedades degenerativas hoy en dı́a. Bibliografı́a 1. Alberts, B. (et al). (1998). Essential Cell Biology, Garland Publishing, Inc. New York and London, USA, pp. 547-562 y 582-584. 2. Attwooll, C; Denchi, E. L. and Helin, K. (2004). The E2F family: specific functions and overlapping interests. The EMBO Journal, vol 23, num 24, pp. 4709-4714. 3. Burdon, T. Smith, A. and Savatier, P. (2002). Signalling, cell cycle and pluripotency in embryonic stem cells. Trends in Cell Biology, vol 12, num 9, pp. 432-438. 4. Calzada A, Bueno A. y Sánchez M. (2000). El inicio de la replicación del ADN. Ciencia al Dia Internacional, núm. 1 vol 3. Disponible en el URL http://www.ciencia.cl/CienciaAlDia/ volumen3/numero1/articulos/v3n1a3v1.PDF 5. Eckfeldt CE, Mendenhall EM y Verfaillie CM (2005). The Molecular Repertoire of the “almighty” stem cell. Nature Rev Molec Cell Biol 6:726-737. 6. Gariglio P. (1995). Genética molecular del cáncer humano: virus y cáncer, Ciencia y Desarrollo, Vol. XX, num. 120, pp. 65-74. 7. Gartel, A. I. and Shchors, K. (2003). Mechanism of c-myc-mediated transcriptional repression of growth arrest genes. Experimental Cell Research, 283: 17-21. ContactoS 65, 5–12 (2007) 8. Golias, C. H; Charalabopoulos, A. and Charalabopoulos, K (2004). Cell Proliferation and Cell Cycle Control: a mini review. Int J Clin Pract, 58, 12:1134-1141. 9. Kim, Y. T. and Zhao, M. (2005). Aberrant Cell Cycle Regulation in Cervical Carcinoma. Yonsei Medical Journal, vol 46, num 5, pp. 597-613. 10. Lodish H, Berk A, Matzudaira P, Kiser CA, Kinger M, Scott MP, Zipursky SC and Darnell J. (2005). Biologı́a Celular y Molecular, 5a edición, Editorial Médica Panamericana, pp. 571578. 11. López-Casillas F. (2002). El ciclo celular bien vale un galardón. Ciencia enero-marzo: 74-77. 12. Nathans D, Christy B, Hartzell S, Nakabeppu Y y Ryder K (1988).The Genomic Response to Growth Factors. En: Cell cycle Control in Eukaryotes. Editor: Beach D, Basilico C y Newport J pp. 22-25. 13. Pardo, M. (2005). Citoquinesis en células eucariotas. Investigación y Ciencia, julio, pp. 40-49. 14. Ruzinova, M. B. and Benezra, R. (2003). Id proteins in development, cell cycle and cancer. Trends in Cell Biology, vol 13, num 8, pp. 410416. 15. Ryan K. M, Phillips AC y Vousden KH (2001) Regulation and Function of the p53 tumor suppressor protein. Current Opinion in Cell Biology 13:332-337 16. Stephano-Hornedo J. L. (1993). El factor promotor de la fase M y el control de la división celular. Ciencia 44:305-322. 17. Verschuren, E. W.; Jones, N. and Evan, G. (2004). The cell cycle and how it is steered by Kaposi´s sarcoma-associated herpesvirus cyclin. Journal of General Virology, 85: 1347-1361. 18. Zentella-Dehesa A. y Alcántara-Hernandez R. (2003). Importancia de los dominios de interaccion proteica en la formación de complejos en los sistemas de transducción. REB 22:117-129. cs