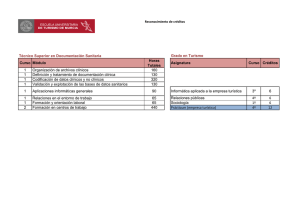
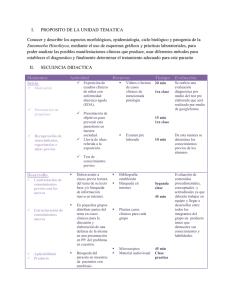
8. Desarrollo-clinico-Dolores Ochoa
Anuncio

V EDICIÓN LA BUENA PRÁCTICA CLÍNICA EN LOS ENSAYOS CLÍNICOS 7 - 8 de ABRIL de 2015 DESARROLLO CLÍNICO DE LOS MEDICAMENTOS Dra. Dolores Ochoa Mazarro Servicio de Farmacología Clínica Hospital Universitario de la Princesa ETAPAS EN EL DESARROLLO DE LOS NUEVOS FÁRMACOS • Investigación (descubrimiento): investigación básica para el avance del conocimiento científico, que puede o no estar encaminada a objetivos comerciales específicos • Desarrollo: actividades técnicas utilizadas en la traducción de los hallazgos de la fase de descubrimiento en productos o procesos. DESCUBRIMIENTO DE FÁRMACOS Dianas terapéuticas Origen de los compuestos Librerías químicas Colecciones de compuestos históricos Librerías de productos naturales Librerías combinatorias Remedios tradicionales Conocimiento empírico de la fisiopatología. Síntesis racional Identificación estructural de receptores y mediadores. Hebra complementaria de oligonucleótidos Genómica Estudios de cribado farmacológico Selección de candidatos Desarrollo del fármaco SELECCIÓN DE FÁRMACOS A DESARROLLAR Patologías con tratamientos pero con posibilidades de mejora: Insuficiencia cardíaca Hipertensión Asma Patologías sin tratamiento (o de baja eficacia) Enfermedades neurológicas crónicas Enfermedad de Alzheimer Enfermedad neurona motora Posibilidad de individualizar (determinar la población beneficiaria) Potencial comercial Demanda pública/pacientes Patologías y poblaciones huérfanas DESARROLLO DE FÁRMACOS LA VIDA DE UN MEDICAMENTO Publicación de la utilidad terapéutica de una molécula 1987 Atorvastatina 20-25 años Período de exclusividad por PATENTE Desarrollo preclínico y clínico Autorización 1997 Venta exclusiva DESARROLLO DE FÁRMACOS • Desarrollo preclínico: • • • • • • Químico/Biológico Farmacológico Toxicológico Farmacéutico Desarrollo clínico Comercialización ESQUEMA DEL DESARROLLO DE FÁRMACOS EL DESARROLLO CLÍNICO CLASIFICACIÓN SEGÚN LOS OBJETIVOS ESTUDIOS FASE I: FARMACOLOGÍA Objetivos Estimación inicial de seguridad y tolerabilidad. Farmacocinética: Dosis máxima tolerada. Naturaleza de las RAs observadas. Absorción Excreción Distribución Metabolismo Aspectos farmacéuticos. Farmacodinamia. PK-PD. Interacciones. En casos concretos estimación inicial de actividad terapéutica. ESTUDIOS FASE I: FARMACOLOGÍA Población estudiada Generalmente voluntarios sanos. Ocasionalmente pacientes. Número total: pocas decenas. Diseño de los estudios No controlados o controlados con la situación basal. Controlados con placebo y enmascarados. Dosis única - Dosis escalonadas - Dosis múltiple. Parámetros utilizados: – – – Parámetros cinéticos Parámetros dinámicos. Reacciones adversas Alteraciones analíticas. Ocasionalmente parámetros clínicos ESTUDIOS FASE II: TERAPÉUTICOS EXPLORATORIOS Objetivos Determinación preliminar de eficacia en la indicación propuesta. Determinación de la dosis y el régimen de tratamiento más adecuado para la Fase III. Evaluación de parámetros potenciales de evaluación. Evaluación preliminar de seguridad en pacientes. Ocasionalmente evaluación de farmacocinética/farmacodinamia en pacientes. Población estudiada Pacientes con criterios de selección estrictos (muestra homogénea). Grado de severidad de la enfermedad bien definida. Número total: pocos cientos. ESTUDIOS FASE II: TERAPÉUTICOS EXPLORATORIOS Diseño y análisis de los estudios Ocasionalmente no controlados (fase IIa). Diseños de búsqueda de dosis: – Dosis escalonadas. – Diseños de dosis-respuesta paralelos. Controlados con placebo y enmascarados (fase IIb). Duración corta. Variables utilizadas: – Intermedias. – Parámetros farmacológicos de interés. – Parámetros clínicos. Análisis exploratorios. Múltiples parámetros de evaluación. ESTUDIOS FASE III: TERAPÉUTICOS CONFIRMATORIOS Objetivos Demostrar/confirmar eficacia en la indicación propuesta. Determinación final de la dosis y el régimen de tratamiento más adecuado: Dosis más adecuada. – Dosis-respuesta. – Intervalo de administración – Establecer el perfil de seguridad del fármaco. Proporcionar una base adecuada para la evaluación de la relación beneficio-riesgo que permita la comercialización. Proporcionar una base comparativa de eficacia con alternativas terapéuticas relevantes. ESTUDIOS FASE III: TERAPÉUTICOS EXPLORATORIOS Población estudiada Pacientes con criterios de selección representativos de la población que padece la enfermedad (muestra heterogénea). Pacientes con diferentes grados de severidad de la enfermedad. Pacientes con enfermedades concomitantes. Uso en poblaciones especiales: ancianos, niños, etc. Pacientes con fármacos generalmente utilizados en ese tipo de población. Número total: pocos miles. ESTUDIOS FASE III: TERAPÉUTICOS EXPLORATORIOS Diseño y análisis de los estudios Ensayos clínicos bien controlados que permitan establecer la eficacia: Placebo o control activo Estudios de dosis-respuesta paralelos. Duración prolongada, determinada por el tipo de patología y la duración de uso previsible. Estudios de seguridad. Variables utilizadas: Parámetros clínicos: Morbi-mortalidad Calidad de vida Análisis de confirmación: basados en un parámetro relevante de evaluación REQUISITOS A CUMPLIR • Requisito legal: protegido por patente • Exigencia de Calidad: Evaluación química/galénica • Cumplimiento de GMP, GLP, farmacopeas • Drug Master File • Demostración de seguridad y eficacia: • Ensayos clínicos fase I-III ASPECTOS A DEMOSTRAR PARA AUTORIZACIÓN DE UN FÁRMACO Eficacia del fármaco en la enfermedad de interés: Estudios frente a placebo. Clara relación dosis respuesta. Equivalencia terapéutica. Seguridad: Riesgos aceptables para el beneficio terapéutico obtenido tras una exposición adecuada para el uso previsto en el uso clínico. Perfil global de reacciones adversas por sistemas. Reacciones adversas más frecuentes. Reacciones adversas por gravedad. ESTUDIOS FASE IV: USO TERAPÉUTICO Objetivos Completar el conocimiento de la relación beneficio-riesgo en la población general (efectividad). Determinar la eficiencia del tratamiento. Completar el conocimiento de la relación beneficio-riesgo en la poblaciones especiales: ancianos, niños, embarazadas, poblaciones de riesgo. Identificar reacciones adversas de baja frecuencia. Población estudiada Poblaciones amplias de pacientes. Número: miles ESTUDIOS FASE IV: USO TERAPÉUTICO Diseño y análisis de los estudios Estudios comparativos de eficiencia/efectividad. Estudios metodológicamente sencillos (pragmáticos). Estudios de morbi-mortalidad. Estudios a largo plazo. Diseño controlado, generalmente aleatorizado. Estudios de parámetros de evaluación adicionales. Estudios de utilización de medicamentos. Estudios farmacoeconómicos. Estudios epidemiológicos. Ensayos clínicos aleatorizados. TIPOS DE ENSAYOS CLÍNICOS SEGÚN EL OBJETIVO DEL ESTUDIO Explicativos – – – – – – – – generar conocimiento de un determinado tto. fase I, II y III precoz criterios restrictivos muestra pequeña muestra homogénea condiciones distintas de práctica habitual variable de significado biológico análisis por protocolo Pragmáticos – – – – – – – – decidir la aplicación clínica de un tto. fase III tardía y IV criterios laxos muestra grande muestra heterogénea condiciones parecidas a la práctica habitual variable de significado clínico por intención de tratar CONTROL DE CALIDAD DE LOS ENSAYOS CLÍNICOS • Aprobación por el CEIC y la AEMPS • Cumplimiento de las normas de BPC • Procedimientos Normalizados de Trabajo • Monitorización durante la realización • Auditorias del promotor del estudio • Inspecciones de la AEMPS UNIDADES FASE I Instalaciones y medidas de seguridad (Ass. British Pharmaceutical Industry, 1989) ubicación: hospitales, universidad, laboratorios farmacéuticos, centros privados fácil acceso a servicios de emergencia, cercanía a hospital personal sanitario cualificado farmacólogo clínico, médico experto en reanimación, enfermera procedimientos de emergencia y equipamiento PNTs desfibrilador, respirador, medicación de urgencias servicios de apoyo: CEIC, laboratorio archivo de documentación UNIDAD DE ENSAYOS CLÍNICOS Hospital Universitario La Princesa INSTALACIONES 2 salas unidas con 12 sillones control médico y control de enfermería 2 consultas con 1 sillón cada una 1 despacho-consulta con una camilla 2 baños 1 laboratorio de procesamiento de muestras RECEPCIÓN Zona de hospitalización Medidas de seguridad Procesamiento de muestras Equipo de trabajo V EDICIÓN LA BUENA PRÁCTICA CLÍNICA EN LOS ENSAYOS CLÍNICOS 7 - 8 de ABRIL de 2015 MUCHAS GRACIAS Dra. Dolores Ochoa Mazarro Servicio de Farmacología Clínica Hospital Universitario La Princesa mdochoa.hlpr@salud.madrid.org