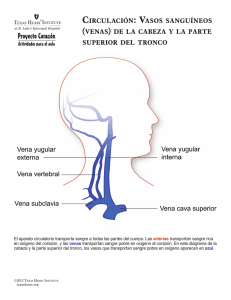
Venas en los Miembros Inferiores
Anuncio

CAPÍTULO DOS Venas en los Miembros Inferiores Dr. Hilario Robledo INTRODUCCIÓN Las venulectasias en las pierna ocurren del 29-41% de las mujeres y del 6-15% de los hombres en los países desarrollados (en la Figuras 1.1 y 1.2, se detallan también, la incidencia por edades e incluso en la infancia y adolescencia). Los láseres se han utilizado para tratar venas de las piernas desde 1970, aunque los cirujanos láser no lograron resultados aceptables hasta el advenimiento de los láseres de colorante pulsado (PDL) en la década de 1980. En la década de los noventa, el desarrollo de láseres con mayor longitud de onda y anchuras de pulso más largas garantizaron un resultado consistente y sentaron un precedente del láser en el tratamiento de las ledsiones vasculares en los miembros inferiores. Como con otras indicaciones, el láser se basa en el principio de la fototermolisis. El láser ideal debe tener las siguientes características: 1. Una longitud de onda que sea mejor absorbida por la oxihemoglobina que por los cromóforos competentes; 2. Penetración en profundidad para alcanzar el vaso diana; 3. Una energía suficiente para dañar el vaso sanguíneo sin lesionar la epidermis; y 4. Una duración de pulso que coagule lentamente el vaso sin dañar al tejido adyacente. Figura 2.1 Incidencia de varices en mujeres y hombres 48 Figura 2.2 Incidencia de varices la infancia Evaluación del paciente Cuando están presentes venas varicosas troncales - patología de venas colaterales, las telangiectasias asociadas no pueden tratarse de forma satisfactoria sin aliviar la presión hisrostática subyacente. En los casos de incompetencia valvular de la vena safena interna y/o vena safena externa (15% incidencia combinada, 5% insuficiencia aislada de la vena safena externa), se debe recurrir a las técnicas quirúrgicas como la safenectomía tradicional (Müller - fleboextracción), técnica de Oesch, cura CHIVA o técnicas ablativas endovenosas mediante radiofrecuencia o láseres a través de fibras ópticas que pueden tener diferentes longitudes de onda y que estudiaremos más adelante. La flebectomía ambulatoria permite virtualmente el tratamiento de todas las venas varicosas, mientras que la escleroterapia-compresión puede utilizarse para tratar venas troncales varicosas y venas reticulares insuficientes. Sólo entonces deberían tratarse las telangiectasias con escleroterapia o con sistemas basados en la luz o láser. Sin embargo, en pacientes que tienen solamente telangiectasias aisladas sin problemas de aumento de presión en venas nutricias de mayor calibre, puede utilizarse primariamente la escleroterapia o el láser/IPL. Los médicos deben diagnosticar el origen del flujo retrógrado. El examen físico es necesario para determinar si als telangiectasias superficiales tienen su origen de una incompetencia venosa más profunda. Se debe tener el adecuado conocimiento de la anatomía básica del sistema venoso superficial y las herramientas para efectuar un diagnóstico. Los sistemas venosos superficiales incluyen la vena safena interna (magna), vena safena externa (parva), y el plexo venoso lateral subdérmico (PVLS). Los pacientes jóvenes presentan usualmente telangiectasias que se originan en el sistema venoso lateral-PVLS. Cuando en la historia clínica se constatan antecedentes familiares de priemr grado con varices, se debe considerar el reflujo de la vena safena interna y/o externa. Expectativas del paciente 49 Además de un asesoramiento adecuado respecto a la posible aparición de efectos adversos como la despigmentación, matting (neotelangiectasias) e incluso la ulceración y cicatriz residual, los pacientes deben entender que la perfección no es posible, que siempre habrá venas y que quizás las venas de muy pequeño calibre pueden no resolverse. Una vez que el paciente entienda la naturaleza y el riesgo del tratamiento, deben tomarse en todos los casos fotografías digitales, esas imágenes son una herramienta indispensable para evaluar el progreso del tratamiento y de forma más importante para documentar la mejora al paciente. Con demasiada frecuencia, los pacientes pueden no reconocer la resolución parcial del cuadro. La comparación de las imágenes del antes y del después, aumentará el grado de satisfacción del pacente. Los pacientes deberían entender también que el tratamiento de las venas de las piernas no produce una satisfacción inmediata. Cuando se utilizan sistemas de luz pulsada o láser, los periodos óptimos entre cada uno de los tratamientos pueden ser de 8-12 semanas. Con frecuencia las telangiectasias finalemente mejorarán a pesar de que no existan signos de cambio en las primeras dos semanas. Herramientas diagnósticas (Datos Complementarios) Al igual que el resto de los médicos tienen conocimiento de los métodos utilizados para el diagnóstico de las enfermedades cardíacas, los médicos dedicados a este tipo de patología venosa (flebólogos) deben tener el conocimiento de las herramientas diagnósticas para detectar patología venosa de los miembros inferiores. El examen de un paciente con patología venosa de los miemrbos inferiores, como es lógico, debería comenzar con la realización de una historia clínica completa junto a la exploración física y detectar la presencia o no de dilatación varicosa dependiente del territorio de safnea interna y/o externa, lagos venosos, insuficiencia de venas reticulares, patología de venas colaterales, edema, alteraciones tróficas de la piel (lipodermatoesclerosis), varículas, venulectasias (venas mayores de 2 mm de díametros y o telangiectasias siguiendo su clasificación que se expondrá más adelante, siguiendo la clasificación de Duffy (lienales, arborizadas, racimo), conservación de los pulsos periféricos distales (pedio, tibial posterior). Como parte de esta exploración física se practica el test de Brodie-Trendelemburg que se expone en las siguientes figuras (2.3, 2.4, 2.5, 2.6 y 2.7): Figura 2.3 Test de Brodie-Trendelemburg 50 51 El doppler manual es la herramienta más común y menos costosa para el diagnóstico del reflujo venoso que está directamente relacionado con la insuficiencia valvular del sistema venoso superficial. Las frecuencias óptimas para examinar los vasos superficiales (a menos de 2 cm de la supeficie de la piel) son de 8-10 MHz, mientras que los vasos más profundos requieren frecuencias de 4-5 MHz. La compresión manual en la panto-rrilla genera una señal audible de flujo. Cuando se libera la comopresión se sigue de un flujo retrógrado que cesa en un periodo de tiempo de 0.5-1 segundo cuando las válvulas son competentes. Sin embargo, si las válvulas son incompetentes el flujo continua. (figura 1.8). La pletismografía mide la presión o los cambios de volumen. La foropletismografía es la variante más común que toma la venataja de la absorción de la luz por la hemoglobina para calcular el cambio en el volumen de sangre. Primero se le pide al paciente que realice dorsiflexión varias veces para permitir que los músculos de la pantorrilla vacíen el sistema venoso. El aparato mide entonces el cambio en el volumen en el tiempo según se rellena el sistema venoso. Cuando existe reflujo venoso, el relleno es rápido. Un tiempo de relleno inferior a 25 s indica una insuficiencia venosa significante. La ecotomografía en modo B con doppler color (duplex scan) muestra gráficamente la anatomía del 52 Figura 2.8 Doppler manual Figura 2.9 Pletismografía Figura 2.10 - Duplex scan - ecotomografía en modo B con doppler color sistema venoso en dos dimensiones superponiendo la señal doppler como un marcador en color. Se puede identificar el origen del reflujo, descartar la presencia de trombosis venosa tanto en el sistema venoso superficial como profundo, que contraindicaría una intervención sobre el sistema venoso superficial, con la alta resolución de las imágenes que hoy día se tiene, ver la morfología y funcionalidad del sistema valvular, alojar la fibra óptica en el/los cayados insuficientes en el caso de láser envodenoso - LEV, medición de flujos y tiempo de reflujo, que por mencionar lo más simplemente posible, el transductor se coloca sobre el vaso en cuestión mientras se aplica compresiñon distal en la extremidad, al igual se puede utilizar la maniobra de Valsalva para aumentar la presión hidrostática, incrementando el flujo cefálico. Cuando se libera la compresión, las válvulas funcionales deberían cerrarse y parar el flujo retrógrado. El reflujo venoso retrógrado mayor de 0.5 segundos revela un reflujo patológico en relación con incompetencia valvular. Creemos que este método diagnóstico es una herramienta fundamental en el estudio tanto preoperatorio de la patología venosa superficial de los miembros inferiores como en el seguimiento postoperatorio, quedando fuera del ámbito de este capítulo abundar sobre toda la metodología utilizada en esta prueba diagnóstica que ha relegado a otras más invasivas y con la posibilidad de efectos adversos, algunos de ellos severos, como la introducción de contrastes en el sistema venoso o mediante la utilización de radiaciones ionizantes. 53 Figura 2.11 Anatomía de venas tributarias del cayado de la safena interna Figura 2.13 Anatomía de la vena safena interna (magna) y unión safeno-femoral Figura 2.12 Venas comunicantes conectas la venas en el mismo plano fascial. Las venas perforantes conectan una vena superficial con una profunda, cruzando el plano fascial Figura 2.14 Anatomía de la vena safena externa (parva) y unión safeno-poplítea 54 Estrategia Terapeútica Selección del objetivo Figura 2.15 - Sistema venoso lateral subdérmico, es un sistema de pequeño calibre que se extiende por encima y por debajo de la rodilla en la cara lateral de la pierna. El flujo venoso es paradójicamente descendente a las venas perforantes de la rodilla Figura 2.16 - Algoritmo de tratamiento El éxito en el tratamiento de las varicosidades depende de una progresión lógica de las intervenciones. Las venas varicosas dependientes de la insuficiencia de los cayados safenos interno y externo, troncales - colaterales, perforantes y reticulares se deben eliminar, bien quirúrgicamente o a través de ablación endovenosa, seguida mediante la esclero-terapia en forma líquida o microespuma de las venas insuficientes remanentes, desde las más grandes a las más pequeñas. En los casos en que los vasos que no responden a la escleroterapia, que son demasiado pequeños para ser inyectados o que permanecen después de la escleroterapia, debe considerarse el tratamiento mediante láser o luz pulsada. Otra indicación clara para las fuentes de luz es el matting telangiectásico. Matting (neotelangiectasias - angioplasia distal) se refiere a venas múltiples diminutas de nueva formación que aparecen en los pacientes, con frecuencia después de la escleroterapia. Se presentan como un parche compuesto de venas numerosas con un diámetro menor de 0.2 mm localizado en el sitio del tratamiento. Aunque pueden resolverse en la mayoría de los casos espontáneamente (80-90%) a los 3-12 meses, producen insatisfacción de los pacientes especialmente si no han sido advertidos previamente. 55 Selección de los parámetros El gran desafío en el tratamiento láser de las venas en los miembros inferiores es que las venas varían ampliamente en tamaño y profundidad en la piel. Una vena que tiene un segmento superficial tratable puede cambiar repentinamente su curso a una profundidad fuera del rango de acción de los láseres. No tratar la longitud completa de la vena significa que las células endoteliales del segmento más profundo no tratado migrarán al segmento tratado para reparar el daño y de esta forma se produce la recanalización. Además, los vasos superficiales están conectados a las venas reticulares más profundas que con frecuencia requieren tratamiento adyuvante mediante escleroterapia. La elección de la longitud de onda y la duración del pulso deben relacionarse con los vasos tratados. En general, las longitudes de onda mayores permiten una mayor profundidad y las longitudes de onda más cortas tienen una menor penetrabilidad, al igual que la elección de la anchura de pulso, más largo en vasos de mayor diámetro y más cortos en vasos de menor calibre (ej.: telangiectasias superfiales de color rojo). Los spots - diámetros focales de mayor tamaño tienen una mayor penetración (concepto del volumen de tejido irradiado, menor dispersión) y optimizan la entrega de fluencia al objetivo. Otra ventaja de las longitudes de onda de la luz láser más largas es la naturaleza dinámica de los picos de absorción en función del tamaño del vaso y de la profundidad. Mientras que los picos de absorción de la hemoglobina en el rango de la luz verde (541 nm) que los infrarrojos (800-1000 nm) para los vasos superficiales, cuando el tamaño del vaso se aproxima a 0.5 mm de diámetro y 0.5 mm en profundidad, la absorción de la hemoglobina en el espectro infrarrojo es más importante. Selección del láser Láser KTP (fosfato de titanio y potasio) El primer tratamiento con éxito en el tratamiento de las venas de las piernas se produjo en forma de láseres y fuentes de lus pulsadas. Inicialmente se eligió el láser KTP a 532 nm debido a la absorción favorable por la hemoglobina. Los cristales de KTP son seguros, convenientes y fácilmente disponibles para los fabricantes. Aunque estos dispositivos pulsado en milisegundos han demostrado su eficacia en el tratamiento de las telangiectasias faciales, las experiencias iniciales con spots pequeños y duraciones de pulso de 10 ms o menores fueron decepcionantes. Los resultados eran mucho mejores con spots más grandes de 3-5 mm y anchuras de pulso de 10-50 ms con fluencias de 12-20 julios/cm2. Figura 2.17 - Insuficiencia del sistema venoso lateral subdérmico antes y después del tratamiento - combinado - esclerosis y láser. Las principales desventajas del láser de KTP son la penetración inadecuada y también su absorción por la melanina, ambas propiedades de la longitud de onda de 532 nm. Los pacientes con fototipos de piel altos o bronceados experimentan un alto riego de despigmentación. El enfria-miento de la piel es especialmente importante en estos casos para proteger la epidermis. Dadas estas limitaciones, el láser KTP pulsado está mejor indicado 56 para el tratamiento de telangiectasias faciales en fototipos de piel I-III. La técnica de tratamiento es dependiente. Se necesitan con frecuencia múltiples pases con el tiempo adecuado y enfriamiento entre los pases para lograr el punto final que es el espasmo del vaso o la coagulación intravascular, que están asociados con mejores resultados. Sin embargo, debe evitarse la superposición de los pulsos (ej.: dar un pulso seguido inmediatamente de otro en el mismo lugar), ya que puede dar lugar a la formación de surcos o alteraciones cicatriciales. Láser de colorante pulsado - PDL Figura 2.19 - Insuficiencia del sistema venoso lateral subdérmico antes y después del tratamiento - combinado - esclerosis y láser. El láser de colorante pulsado original a 585 nm y con una anchura de pulso de de 450 µs era correcto para el tratamiento de las manchas de vino Oporto que están compuestos de de vasos muy superficiales y diminutos de 100 µm, con una profundidad media de 0.46 mm, sin embargo los resultados no eran satisfactorios para el tratamiento de las telangiectasias de las ex- tremidades inferiores. La anchura de pulso corta es eficaz sólo para el tratamiento de vasos superficiales muy finos de diámetro, menores de 0.1 mm de diámetro. Basados en la teoría de la fototermólisis selectiva, la duración de pulso ideal para la destrucción de venas de 0.1 mm a varios milímetros de diámetro está en el rango de 1-50 ms. La alta energía que se entrega en pulsos muy cortos produce la rotura de los vasos con púrpura y depósito de hemosiderina, que se denomina clínicamente como hiperpigmenatción a largo plazo. Polla y cols. utilizaron este láser para lograr solamente un aclaramiento del 75% en el 15% de las telangiectasias tratadas y hallaron poca o ninguna mejora en el 73% de los vasos. Como se esperaba, los vasos que respondieron fueron telangiectasias muy finas y superficiales. Además, el 50% de los pacientes experimentaron discromías. Sin embargo, cuado se utilizaba apropiadamente, los resultados podían ser favorables. En otro estudio, las telangiectasias superficiales de 0.2 mm o menores y el matting telangiectásico inducido por la escleroterapia fueron tratadas mediante PDL con anchura de pulso de 450 µm, spot de 5 mm y con una fluencia de 6.5-8 J/cm2, seguidas por compresión durante 72 horas. El 66% de las telangiectasias lineales de aclararon completamente dentro de los 4 primeros meses después de un solo tratamiento. Hubo hiperpigmentación transitoria en el 10% de los casos. El adevenimiento de los láseres de colorante pulsado con anchuras de pulso largas hicieron posible el tratamiento de telangiectasias finas y superficiales. Existen en la actualidad varios dispostivos que utilizan colorante de rodamina capaces de emitir pulsos con una duración entre 0.45/0.50 a 40 ms. Las longitudes de onda abarcan desde los 585 a los 600 nm, que tienen una mejor penetración para tratar vasos más profundos. Sin embargo, a estas longitudes de onda, la absorción por la melanina es aún significativa. El riesgo de discromías puede ser alto sin el enfriamiento epidérmico adecuado. Varios estudios con el PDL con anchura de pulso de 1.5 ms revelaron resultados variables. Un solo tratamiento con el PDL en vasos de hasta 1 mm de diámetro, utilizando el spot elípticos de 3x7 mm y con una fluencia de hasta 18 J/cm2 obtuvieron un 67% de aclaramiento. En otro estudio utilizando un PDL a 595 nm, mostró unos resulatdos ligeramente mejores. Ambos estudios reportaron efectos secundarios incluyendo la formación de costras y despigmentaciín. Reicher mostró una mejor tasa de éxito cuando en el área tratada 57 Figura 2.20, 2.21, 2.22 - Telangiectasias (≤ 1 mm) - venulectasias (1-2 mm) en los miembros inferiores en los que se ha descartado o ya tratado las insuficiencias venosas troncales, colaterales, reticulares que han sido tratadas mediante láser de neodimio:YAG de pulso largo. 58 se eliminaba el reflujo venoso retrógrado de las venas reticulares. En este estudio las telangiectasias con un calibre de 0.1-1 mm eran tratadas con un PDL de 1.5 ms y anchuras de pulso de 585-600 nm. Se observó un aclaramiento total en los vasos de 0.5-1 mm de diámetdo después de 4 tratamientos. Se produjo una despigmentación transitoria en el 50% de los pacientes Bernstein examinó la nueva generación de PDL a 595 nm y con anchura de pulso de hasta 40 ms. En los fototipos de piel I-II, tres sesiones con un interavalo de 6 semnas usando el spot de 3x10 mm y con uan fluencia media de 20.4 J/cm2 produjo un 60% resultados moderados o mejores objetivamente, sin embargo la despigmentación permaneció siendo un efecto secundario significante, especialmente con fluencias altas. Láser Alejandrita de pulso largo Otros láseres pulsados han aprovechado con éxito el pequeño pico de absorción de la hemoglobina en el rango de 700-900 nm. Estos incluyen al láser de alejandrita pulsados, diodos y los láseres de neodimio:YAG de pulso largo. Las longitudes de onda más largas permiten una profundidad mayor para tratar venas de mayor calibre y con una relativa baja absorción por la melanina. Con la longitud de onda de 755 nm, los láseres de alejandrita son capaces de penetrar 2-3 mm desde la superficie epidérmica. Combinados con una duración de pulso de 20 ms, estos láseres han tratado telangiectasias con algún éxito. McDaniel y cols. reportaron un aclaramiento total del 63% después de tres tratamientos. Los vasos de tamaño medio (0.4-1 mm) responden mejor, seguidos por vasos mayores (1-3 mm). Los vasos más pequeños de 0.3 mm tuvieron una pobre respuesta, poniendo de manifiesto la necesidad de anchuras de pulso más cortas para alcanzar esos vasos de fino calibre. El parámetro óptimo en el estudio era una duarción de pulso de 5 ms y una fluencia de 20 J/cm2. Otro estudio mostró el aclaramiento del 75% de dos tercios de todas las venas (0.3-2 mm) con un solo tratamiento utilizando un spot de 8 mm, anchura de pulso de 3 ms y con una fluencia d e60-80 J/cm2. Se prudujo una hiperpigmentación transitoria en un tercio de las áreas tratadas. Láseres Diodo A 800-930 nm (también desarrollados y comercialmente disponibles con una longitud de onda de 940 y 980 nm), los láseres de diodo son similares a los de alejandrita en su capacidad de profundizar, seleccionar venas reticulares mayores y emparejarse con el tercer pico de absorción de la hemoglobina de aproximadamente 900 nm con una interferencia relativamente menor con la melanina. Dierickx utilizando un láser basado en placas semiconductoras de 800 nm, observó un aclaramiento en dos tercios de las venas después de tres tratamientos con una anchura de pulso entre 5-30 ms y una fluencia de 15-40 J/cm2. La longitud de onda de 940 nm penetra 3 mm por debajo de la superficie de la piel y es capaz de alcanzar la mayoría de las venas con calibres de hasta 1 mm de diámetro cuando se utilizan fluencias de 250-400 J/cm2. Teóricamente, las venas rojas contienen proporcionalmente una mayor cantidad de oxihemoglobina y por tanto deberían responder más favorablemente. Kaudewitz y cols. reportaron resultados a corto plazo de más de un 50% de aclaramiento de vasos menores de 1 mm en el 76% de los pacientes y un 75-100% de aclaramiento en el 46% de los pacientes después de un solo pase con este láser. El mecanismo de este proceso no se ha determinado todavía. Basados en esta observación, a los pacientes se les podría asegurar que los resultados pueden mejorar con el tiempo y que tratamientos adicionales podrían ser innecesarios. Se observó hiperpigmentación transitoria y matting telangiectásico en algún paciente, pero se aclaró en menos de un año. Más recientemente, el equipo español del Dr. Mario Trelles utilizando un dispositivo de 800 nm produjo una tasa de aclaramiento del 70%. Utilizando parámetros agresivos con fluencias de hasta 336 J/cm2, 50 ms de duración, 3 mm de spot (Nota: la nomenclatura de estos prámetros para un mayor entendimiento debería expresarse en las historias clínicas de la siguiente forma: Fluencia/Anchura de pulso/Spot, en el caso anterior sería: 336/50/3) y una superposición de pulsos de 5-8, los investigadores vieron aclaramiento incluso en venas de hasta 3-4 mm de diámetro. Láser Neodimio:YAG de pulso largo El desarrollo de los láseres de nd:YAG de pulso largo fue un hito emocionante en el tratamiento de las venas de las piernas. Su longitud de onda permite una mayor penetración y alcanzar venas de calibres relativa59 mente grandes, haciéndolo ideal para la destrucción de vasos grandes en la dermis media, se dice que tienen un alcance 3 mm, pero con estos láseres tenemos una buena y larga experiencia habiedo utilizado a lo largo de 14 años prácticamnte todos los existentes en el mercado (CoolTouch - Varia, Altus Medial - CoolGlide que posteriormente fue Cutera - CoolGlide Excel, CoolGlide Vantage y recientemente el CoolGlide Excel V con sus dos longitudes de onda 532-1064 nm; Candela - GentleYAG, GentleMax, GentleMax Pro; Cynosure - Apogee Elite, Cynergy; Laserscope - Lyra y recientemente hemos probado dos de construcción europea fabricados por Quanta y Fotona - XP Max), hemos podido obervar un alcance en profundidada y con efectividad de hasta 5-6 mm (tejido celular subcutáneo) para dañar vasos incluyendo venas reticulares en los miembros inferiores de 3 y 4 mm de diámetro con aclaramientos en este tipo de vasos mayor del 90% de los pacientes tratados con un solo tratamiento. El aclaramiento que hemos llegado a producir ha sido una media del 70-80% de los vasos de las piernas de 1-4 mm de diámetro en los paciente tratados, se facilitarán los protocolos de tratamiento en el apéndice de este capítulo junto a las instrucciones post-tratamiento y modelo de consentimiento informado que utilizamos en nuestras clínicas. Nosotros consideramos este láser el de mayor importancia y primera elección en el tratamiento de los vasos en los miembros inferiores, al igual que en el capítulo anterior se considera al láser de colorante pulsado el de elección en tumoraciones vasculares cutáneas. Comparando los láseres de Nd:YAG con el diodo de 810 nm y alejandrita de 755 nm, Eremia y cols. encontraron, al igual que nosotros, unos resultados mucho mejores con el neodimio:YAG de pulso largo. Aunque el láser de Nd:YAG parece muy prometedor en el tratamiento de las venas en piernas, un estudio comparativo que igualmente compartimos en los pacientes que hemos tratado a lo largo de todos estos años, mostró todavía unos resultados superiores cuando se combina con escleroterapia dependiendo del diámetro de los vasos y/o anulando el reflujo de las venas feeding de mayor calibre junto a las técnicas ya mencionadas previamente para anular el reflujo venoso retrógrado de las venas troncales, en nuestro caso mediante láser endovenoso 940 o 1470 nm, escleroterapia mediante microespuma para las venas colaterales troncales o introducción de fibra óptica de 400 micras y tratamiento del resto de las venas mediante láser de neodimio:YAG de pulso largo. Un estudio realizado por Levy y cols. mostró resultados prometedores con la combinación la escleroterapia con tratamiento mediante Nd:YAG. Sin embargo, este doble abordaje, que personalmente comparto y realizado de forma habitual, puede ser difícil para la mayoría de los practicantes o de los que se inician en estas técnicas. Evidencias recientes han mostrado que la formación de metahemoglobina aumenta la absorción de la longitud de onda de 1064 nm. El calentamiento de la hemoglobina produce reacciones oxidativas que forman metahemoglobina. La metahemoglobina tiene tres veces la absorbancia de la oxihemoglobina y trece veces mayor que la deoxihemoglobina. Esta información sugiere que en teoría podría ser beneficioso entregar la energía en trenes de pulso, mejor que disparar toda la energía en un solo pulso con el riego de sobrecalenta-miento del objetivo y daño del tejido adyacente. Cada micropulso que componen el pulso, podría generar metahemoglobina que actuaría como objetivo para el pulso subsiguiente. El modo multipulso de esta forma aumentará la eficacia mientras que preserva el tejido adyacente y reduciendo la sensación de dolor del tratamiento. Lo mencionado anteriormente tiene en nuestra opinión una base solamente teórica, ya que utilizando las dos formas de entrega, pulso único y pulso compuesto en varios micropulsos, produce la misma sensación de incomodidad al paciente e igualmente en nuestra experiencia el modo de entrega de pulso en meseta único con una buena distribución de la energía, necesita una menor fluencia para la obliteración del vaso, no queriendo dar la el nombre de la casa fabricante para que no pueda parecer que nos vinculamos a una de ellas. Lo que si hemos detectado, es que la incorporación de un cristal de zafiro refrigerado mediante una solución acuosa enfriada a 4-5º C produce una importante protección epidérmica disminuyendo la sensación de dolor en la entrega de los pulsos del sistema láser. También creemos que posiblemente el diámetro focal mínimo de un láser de neodimio:YAG en los miembros inferiores debería ser de 3 mm. Las venas rojas superficiales y finas (menores de 0.2 mm) pueden responder mejor a los láseres de longitud de onda menor como el KTP o el láser de colorante pulsado. La alta fluencia que se necesita en los spots de 1.5 mm, en le caso del láser de Nd:YAG, tiene más probabilidad de ocasionar efectos indeseables. Láser Combinado Nd:YAG/PDL Teniendo en cuenta la formación de metahemoglobina, un dispositivo relativamente nuevo combina las dos longitudes de onda secuencialmente para tratar lesiones vasculares incluyendo las de los miembros 60 Figura 2.23 y 2.24- Venas reticulares en cara posterior de piernas. Se muestra fotografía antes e inmediatamente después del tratamiento mediante láser Nd:YAG, 1064 nm, en la que se observa el aclaramiento que ha ocurrido en las venas tratadas. Se deja como post-tratamiento cura oclusiva mediante pomada o lubricante oleoso (parafina), gasa vaselinada y medias de compresión clase II. inferiores (Cynergy, Cynosure Inc., Westford, MA, USA). El primer pulso de PDL, 595 nm, convierte la hemoglobina a metahemoglobina que absorbe más energía por por el pulso secuencial de Nd:YAG, 1064 nm. Esto permite la utilización de de fluencias más bajas en el láser de neodimio:YAG, reduciendo el rigo de efectos adversos. Pequeños estudios e informes de casos han mostrado resultados prometedores, pero son necesarios estudios pros-pectivos randomizados a largo plazo que comparen los resultados obtenidos mediante esta secuencialidad de pulsos con otros láseres y con la escleroterapia. En nuestra experiencia, que llevamos utilizando este sistema desde su comercialización, hemos podido observar su eficacia en las manchas de vino oporto nodulares del adulto con este sistema dual (MPX - multiplex), sin embargo, los resultados obtenidos en el tratamiento de las lesiones vasculares en los miembros inferiores no han sido mejorados comparados con los sistemas tradicionales. Es posible que en telangiectasias, venas de menos de 1 mm de diáme- tro a menos de 1 mm de la superficie epidérmica puedan responder en un menor número de sesiones, pero los resultados en venulectasias (> 2 mm) y la venas reticulares (3-4 mm), venas de mayor calibre y más profundas, han sido desalentadores. Por otro lado es lógico, ya que el alcance del PDL en profundidad es limitado y de nuevo en nuestra opinión, no llegaría a convertir la hemoglobina en metahemoglobina en las venas de mayor profundidad en el caso de las lesiones en los miembros inferiores. Utilizamos este sistema, en los casos anteriores, de forma aislada y no combinada, es decir, láser de Nd:YAG para el tratamiento de venulectasias y venas reticulares, y el láser de colorante pulsado para el tratamiento de las telangiectasLias,venas menores de 1 mm de diámetro y matting telangiectásico, en estas aplicaciones se podría utilizar de forma combinada, es decir, en su modo patentado MPX, multiplex. Figura 2.25 y 2.26- Venas reticulares en hueco poplíteo en paciente con fototipo de piel IV según la clasificación de Firzpatrick, tratadas mediante láser Nd:YAG a los 5 días del tratamiento. Se observa equímosis posterior y formación de alguna costra superficial (epidérmica) que se desprenderá sin cicatriz residual y sin alteración de la pigmentación a los 5-6 días (duración total 10-12 días). Con láseres de longitud de onda de 1064 nm se pueden tratar con ésxito venas de 3 mm. de diámetro en pacientes con fototipos de piel oscura. 61 Figura 2.27, 2-28 y 2-29- Venas reticulares, venulectasias y telangiectasias en cara interna de pierna derecha tratadas mediante láser Nd:YAG de pulso largo. Se muestran las tres fotografías ya que esta paciente presentaba insuficiencia de los cayados de las safena internas. Previamente al tratamiento descrito mediante láser percutáneo se practicó láser endovenoso de ambos miembros inferirores para oclusión y tratamiento del reflujo venoso retrógrado, de lo contrario, como ya ha sido descrito en este capítulo, el tratamiento realizado hubiera sido ineficaz. Los tratamiento venosos en los miembros inferiores deben relizarse diagnosticando y tratando primero la hipertensión venosa en el sistema venoso superficial de los cayados, venas troncales, perforantes, para tratar por último secuencialmente como en este caso, las venas reticulares, venulectasias y telangiectasias. 62 Luz pulsada intensa - IPL Los aparatos de luz pulsada intensa - IPL son dispositivos que emiten una fuente de luz no coherente, con una anchura de banda entre los 515-1200 nm. Están bombeados mediante una fuente de luz, una lámpara de flash que es capaz de entregar fluencias de hasta 90 J/cm2 con anchuras de pulso que oscilan entre 2 y 100 ms, dependiendo del modelo. Una característica única de los IPL es su capacidad de utilizar filtros capaces de eliminar longitudes de onda inferirores para aumentar su selectividad, también disminuyen el total de la energía emitida. Están disponibles una variedad de filtros que generalmente van de los 560 a los 755 nm. Los filtros más útiles para las lesiones vasculares son los de 550 y 570 nm, filtros que entregan fundamentalmente luz amarilla, luz roja e infrarroja. El espectro de luz de banda ancha que emiten los IPL tiene la ventaja de las propiedades ópticas dinámicas de la hemoglobina así como en la variación del tamaño y la profundidad de los vasos. Como el tamaño aumenta de 0.1 a 1 mm y la profundidad de 0.3 a 1 mm, el pico de absorción d ela hemoglobina varía desde aproximadamente 600 a 900 nm. Por tanto, teniendo una amplia banda de luz de 515-1200 nm permite al clínico seleccionar los vasos superficiales y los profundos de forma simultánea, también hay que decir con la consiguiente dsimunución energética en ese reparto. Otra ventaja práctica de los IPL son los relativamente grandes tamaños de spots que facilitan el tratamiento. En cualquier caso, no es igual la densidad conseguida mediante un spot circular que por la de uno de forma rectangular, índice de reflexión y coeficiente de dispersión que se discutieron físicamente en el volumen anterior, además de la configuración de entrada de luz mediante el sistema de fibra óptica en el rectángulo de cristal de cuarzo o zafito, unifocal o bifocal. Los estudios iniciales han mostrado una tasa de éxito de hasta un 90% de aclaramiento en vasos menores de 0.2 mm y de un 80% en vasos de 0.2-0.5 mm de diámetro. Los últimos estudios también han mostrado buenos resultados pero no han duplicado estos impresionantes resultados. Todos han reportado el bajo índice de efectos secundarios, con una despigmentación transitoria de hasta el 3% de los pacientes. Para los vasos menores de 0.2 mm, los parámetros útilies incluyen un pase simple con una duración de pulso de 3 ms y 22 J/ cm2, o un pase doble de 35-40 J/cm2 entregado en 2.4 y 4.0 ms con un intervalo de 10 ms. Los vasos mayores, de 0.2-0.5 mm pueden ser tratados mediante con fluencias de 35-45 J/cm2 con anchuras de pulso de 3-6 ms y con un intervalo entre los pulsos de 20 ms. Otro protocolo utiliza la versatilidad de los IPL mediante la combinación pulsos cortos y largos en un tratamiento simple. Utilizando fluencias de hasta 70 J/cm2, el primer pulso se entrega con 2.4 a 3 ms y el segundo pulso con una duración de 7 ms y un intervalo entre ellos de 10-20 ms. Basados en la teoría de la fototermólisis selectiva, los pulsos más cortos seleccionarán los vasos de menor calibre mientras que los pulsos más largos lo hacen en vasos de mayor calibre. Este protocolo ha permitido un aclaramiento del 74% en dos tratamientos con una tasa de despigmentación del 8%. TEMAS AVANZADOS: CONSEJOS DE TRATAMIENTO PARA CLÍNICOS EXPERTOS Escleroterapia versus láseres Mientras que las varicosidades se tratan mejor mediante técnicas quirúrgicas o procedimientos endovenosos, la escleroterapia permanece como el tratamiento de elección para las venas pequeñas de las piernas. Estudios comparativos recientes muestran todavía qu la mayoría de las telangiectasias de las piernas responden mejor a la escleroterapia necesitando un menor número de sesiones. Sin embargo los avances recientes en la tecnología láser han expandido la utilidad de los lásres y las fuentes de luz pulsada de tal forma que tanto el clínico como el paciente pueden seleccionar ahora el láser como el tratamiento de elección en ciertos casos. En la toma de esta decisión, la primera consideración es la contraindicación a la escleroterapia, como la predisposición del paciente a trombosis venosas, historia de alteraciones de la coagulación, hipersenbilidad a los esclerosantes y la gestación. También se debe tener en cuenta la predisposición del paciente. Muchos pacientes tienen fobia a las agujas y pueden preferir la incomodidad del tratamiento láser a la ansiedad de sufrir múltiples pinchazos transcutáneos. Otros prefieren los tratamientos mediante la útima tecnología sin tener en cuenta la clara ventaja de la escleroterapia en ciertos casos. Es la responsabilidad del médico acon63 sejar apropiadamente al paciente sopesando los riesgos y las ventajas de los dos abordajes. Se debe reconocer que como en todo tratamiento estético, el tratamiento para la eliminación de las venas no deseadas puede ser un proceso subjetivo y emocional. Como tal, la percepción de los pacientes de la calidad del tratamiento es de gran importancia para su satisfacción. Otra consideración es la propia preferancia del clínico. El éxito de la escleroterapia es una técnica muy dependiente, los principiantes tienen una curva de aprendizaje para llegar a ser expertos en la escleroterapia. También se puede elegir en lugar de enfocar el tratamiento solamente al láser referir al paciente a otros médicos expertos en escleroterapia. La decisión de ofrecer el tratamiento láser puede ser tambiín financiera al igual que una decisión técnica. Cuando se considera que la adquisición de un láser requiere una inversión inicial de miles de euros además de los costes de mantenimiento, comparado con la pequeña inversión en la compra del agente esclerosante, jeringas y agujas, el clínico puede estar limitado únicamente a la escleroterapia. El tamaño del vaso puede ser un un determinante importante. Los vasos muy pequeños, menores de 0.3 mm, como el matting telangiectásico, son muy difíciles de canalizar. Estos pueden ser excelentes candidatos para la terapia láser. Los vasos de 0.3-1.5 mm responden bien a los láseres pero pueden ser tratados con la misma eficacia por escleroterapeutas experimentados. Aunque los vasos de mediano tamaño entre 1.5 y 3 mm responden moderadamente bien a los láseres, la escleroterapia es la primera elección de tratamiento. Los láseres tienen un papel muy limitado en vasos mayores de 3 mm de diámetro. El fototipo de piel del paciente puede limitar también la utilización de los láseres. Los fototipos de piel IV-VI tienen un gran riesgo de despigmentación con las fuentes de luz, estos pacientes deben tratarse mejor mediante escleroterapia. Debido a que la escleroterapia es el tratamient de elección en las telangiectasias de los miembros inferiores, haremos hincapié en los aspectos fundamentales de esta técnica más adelante en este capítulo. Figura 2.30 - Telangiectasias antes y en el momento de la inyección de un agente esclerosante Enfriamiento epidérmico El enfriamiento epidérmico es una parte integral del tratamiento mediante láseres, tanto para crioanestesia como para protección. Es particularmente de gran importancia cuando se tratan pacientes con fototipos de piel oscuros. La melanina epidérmica puede absorber la luz destinada a los cromóforos diana subyacentes, como la oxihemoglobina, que produce el daño epidérmico. Una forma de superar este problema es enfriar selectivamente la epidermis. Los dispositivos que están diseñados para enfriar la piel reducen el daño epidérmico y permiten la utilización de altas fluencias y el tratamiento de pieles oscuras. Todas la formas de enfriamiento implican poner un medio frío, habitualmente aire frío, aerosoles de criógeno, gel frío o el cristal de zafiro enfriado en contacto con la piel. Para asegurar un enfriamiento adecuado, se deben considerar varios parámetros independientemente del medio: duración de contacto, temperatura de la fuente de frío y la calidad del contacto. Existen tres modos clásicos de enfriamiento: pre-enfriamiento, enfriamiento paralelo y postenfriamiento. El pre-enfriamiento disminuye la temperatura de la piel previamente al pulso del láser. Debido 64 a la posibilidad de lesión por congelamiento de la epidermis, hay un límite en el grado de pre-enfriamiento seguro. El pre-enfriamiento protector se realiza mejor mediante anchuras de pulso menores de 5 ms y se entrega mejor a través de la pulverización de criógeno. El enfriamiento paralelo disminuye la temperatura de la piel al mismo tiempo que el pulso del láser. Con anchuras de pulso cortas, el tiempo de contacto limitado que proporciona el enfriamiento paralelo tiende a proporcionar una protección epidérmica pequeña. El enfriamiento paralelo es mucho más protector cuando es coincidente con pulsos mayores de 5-10 ms. Un medio común de enfriamiento paralelo es el zafiro enfriado. El spray de criógeno es menos apropiado al mismo tiempo que se dispara el láser ya que puede interferir con el haz de luz. El post-enfriamiento se utiliza principalmente para minimizar el dolor y el edema y puede servir para enfriar la piel del calor disipado de los grandes vasos posterior al calentamiento por el haz de luz láser. La temperatura de la piel puede también enfriarse mediante aire atmosférico enfriado a 4-5º C. El tiempo de enfriamiento por este medio puede ser de más largo que otros métodos, pero esto resulta en una penetración más profunda del efecto de enfriamiento. Consecuentemente, puede enfriarse la piel completa (enfriamiento en masa). Este medio no altera el haz de luz del láser, puede ser utlizado independientemenrte de la topografía de la piel y no requiere compresión de la misma, que puede ser importante en el caso del tratamiento de las lesiones vasculares. ESCLEROTERAPIA BÁSICA Con mucha frecuencia los médicos vemos en nuestras consultas pacientes con trastornos varicosos en las piernas. El tratamiento de los mismos puede ser gratificante tanto como para el médico como para el paciente. La escleroterapia puede mejorar la apariencia cosmética de los vasos sanguíneos aberrantes y beneficiar mucho la sintomatología que describen los pacientes, mediante la disminución del dolor, la quemazón y los calambres. La resolución de trastornos varicosos más grandes puede mejorar el riesgo de una secuela de posterior enfermedad venosa. La escleroterapia continúa siendo el estándar de oro en el tratamiento de la enfermedad de pequeñas venas de la extremidad inferior. La comprensión de las indicaciones, mecanismos y manejo del tratamiento es esencial. Este artículo revisa las cuestiones “básicas” del tratamiento escleroterápico de los vasos pequeños. Las venas varicosas y las telangiectasias afectan tanto a los hombres como a las mujeres. En los Estados Unidos, el 8.65% de los hombres y el 12.9% de las mujeres tienen venas varicosas. Las venas telangiectásicas se reportan en una tasa mayor de 28.9% en los hombres y 40.9% en las mujeres en los Estados Unidos. Estos vasos pueden ser no atractivos visualmente y también pueden ser sintomáticos. La enfermedad venosa contribuye a los cambios de dermatitis por estasis, alteración pigmentaria y edema de los miembros inferiores. Hasta la enfermedad venosa leve puede causar el síndrome de “piernas sin descanso”: y dolor. A veces, un paciente se queja de un solo grupo de venas que causan dolor. La escleroterapia puede ser muy efectiva para disminuir el dolor de las venas varicosas y telangiectásicas de las piernas. Muchos factores pueden afectar la predisposición individual a desarrollar venas varicosas. Se cree que la genética juega un papel mayor en el desarrollo de las varices y la incidencia familiar se reportó en un 15% a 40% de casos. Las varices ocurren menos frecuentemente en la población no blanca. El embarazo también afecta la incidencia de las várices y las trastornos varicosos aumentan con los embarazos múltiples. La dilatación de la pared de las venas y el volumen aumentado de la sangre durante el embarazo también puede aumentar la formación de nuevos vasos y aumentar el diámetro de los vasos existentes. De forma similar, las ocupaciones que requieren una caminata significativa, estar parado mucho tiempo o estar sentado durante períodos largos pueden contribuir a la reunión de los vasos sanguíneos de las extremidades inferiores y, por lo tanto, un aumento en las trastornos varicosos. Las enfermeras, los empleados de supermercados y los maestros, por ende, están entre algunos de los pacientes que suelen presentarse con varices para el tratamiento. El cruzado de piernas también puede causar el desarrollo de varices en el área de presión de una pierna sobre la otra. Instruir al paciente sobre este factor causal puede ayudar a disminuir varices ulteriores en la zona. Etiología 65 Varios factores contribuyen a la fisiopatología del desarrollo de los trastornos varicosos. El envejecimiento de los vasos juega un rol importante en la causa de estas condiciones, donde muchos de los mismos factores se ven en el envejecimiento de la piel. La íntima de un vaso sanguíneo se engrosa, se atrofia la lámina elástica y la adventicia se vuelve más fibrosa. Debido a que las trastornos varicosos suelen presentar daño endotelial como parte de su desarrollo, son – por lo tanto – susceptibles a la esclerosis. Además, las trastornos varicosos tiene una adventicia fibrosa y una capa elástica atrófica accesible al esclerosante. La hipertensión crónica puede llevar a una insuficiencia valvular y dilatación de los vasos. Los efectos hormonales por aumento del estrógeno durante el embarazo también contribuyen a la distensión de la pared de los vasos. Los antecedentes del paciente también deberían incluir el uso de terapia de reemplazo hormonal o agentes anticonceptivos orales, pero estos usualmente se usan en una dosis baja y estable con mínimos (si es que hay alguno), efectos notables en la distensión. Vin y Col., mostraron que los efectos del tratamiento de estrógenoprogesterona en el sistema venoso superficial es dosis dependiente. El tamoxifeno también puede causar un aumento en la hipercoagulación y debería anotarse durante la cita de consulta y revisarse con el paciente. Los factores físicos del cruzado de las piernas y la ropa ajustada pueden jugar un rol, causando presión en áreas puntuales y la obesidad u obstrucción pélvica por un tumor o ganglio linfático también puede causar presión sobre la vasculatura de la extremidad inferior. La incompetencia valvular puede ser causada por una disfunción genética o incluso por un número disminuido de válvulas. La tromboflebitis también está relacionada con la disfunción valvular. Agentes esclerosantes El concepto y propósito de un agente esclerosante en el tratamiento de los trastornos varicosos es sencillo. Los esclerosantes se inyectan en el vaso y afectan a la pared de la vena iniciando una lesión en la misma. Si la lesión causa un daño suficiente a la pared del vaso, éste se reabsorberá y fibrosará. Los agentes causan algún daño a la pared celular endotelial y también a algunas de las capas más profundas de la pared del vaso. Este daño más profundo es importante para el éxito de la escleroterapia y en la disminución de la incidencia de la recanalización. Hay tres tipos de esclerosantes: detergentes, agentes osmóticos e irritantes químicos. Los detergentes interactúan con los lípidos superficiales de las membranas celulares y causan la disrupción de las células endoteliales. Los detergentes son químicos con un grupo polar (hidrofílico) y uno no-polar (hidrofóbico). El grupo no-polar de la molécula detergente se alinea con la membrana celular de la célula endotelial debido a que el espacio interno de la membrana plasmática también es no-polar. Este emplazamiento reduce la tensión superficial de la membrana celular, lo cual lleva a la disrupción de la capa endotelial. De forma similar, los detergentes pueden interrumpir las capas más profundas de la pared del vaso también. Los agentes osmóticos causan deshidratación celular mediante la interrupción del balance hídrico de una célula y, por lo tanto, causando daño a las células del nivel endotelial. Los agentes osmóticos también interrumpen las capas murales no celulares del vaso, disminuyendo la posibilidad de recanalización [9]. Hay una relación entre la concentración del esclerosante y la profundidad del daño de la pared del vaso. Los irritantes químicos, la última clase de esclerosantes, tienen su efecto a través de varios mecanismos para dañar la pared del vaso. Un esclerosante ideal limpiaría todas las venas que fueran inyectadas, no tendría efectos colaterales y sería indoloro para el paciente; no obstante, no existe un esclerosante ideal perfecto. Ergo, es importante entender los puntos buenos y malos de cada agente esclerosante. Hay tres agentes esclerosantes más comúnmente usados en el tratamiento de pequeños vasos: solución salina hipertónica, tetradecil sulafato sódico y polidocanol. Se usan otros agentes para algunos de los vasos mayores, hay otros que ya no se usan y existen otros que se utilizan fuera de los Estados Unidos. La solución salina hipertónica viene como una solución de cloruro de sodio al 23.4%. Está aprobada por la US Food and Drug Administration (FDA) para uso como un abortivo, por lo que su uso en la escleroterapia es considerado “off-label”. Brinda un rápido desvanecimiento de los vasos y tiene un bajo riesgo 66 de alergias. Sin embargo, provoca escozor e incomodidad al paciente. Como solución salina, puede causar una sobrecarga de fluido si se usan volúmenes significativos o si muchos vasos muy distales son tratados. La solución salina hipertónica es lo suficiente cáustica para causar el desprendimiento de la piel en el lugar de la inyección en algunos casos. Si se extravasa, puede ocurrir ulceración. No obstante, si se usa apropiadamente, funciona muy bien en el tratamiento de los vasos. La dilución correcta minimiza el riesgo de ulceración y de ramificaciones telangiectásicas. Para el tratamiento de los vasos más pequeños es importante la dilución del cloruro de sodio al 23.4% con solución salina normal a un 11.7%. En vasos muy delicados o en vasos en el área del tobillo, una solución de aproximadamente 6% de cloruro de sodio puede ser apropiada. La solución al 23.4% puede ser usada directamente en vasos reticulares y mayores. A lo largo de los años, se han usado diluciones con lidocaína y heparina. Una solución de dos partes de salina al 23.4% y una parte de lidocaína al 1% con epinefrina (resultando en un 15.6% salina / 0.33% lidocaína) ha sido empleada. Esta solución introduce un posible alergénico y otro agente que igualmente causa irritación. La solución salina normal puede ser usada para la dilución. La heparina también ha sido usada debido a que se cree que disminuye el riesgo de coagulación. Su inclusión, no obstante, introduce nuevamente otro agente con sus complejidades particulares a la mezcla, incluyendo el riesgo alérgico. El tetradecil sulfato sódico ha sido usado ampliamente en los Estados Unidos. En años recientes no ha habido ningún fabricante importante que lo haya producido. Está aprobado por la FDA si el fabricante sigue las guías de producción. Algunas compañías pequeñas están actualmente preparando la solución. Los efectos negativos incluyen la posible ulceración, pigmentación y necrosis y este agente puede ser doloroso en pacientes con tromboflebitis. También tiene el potencial de inducir anafilaxis. Las siguientes diluciones apropiadas para el tamaño del vaso minimizarán el potencial de efectos secundarios: venas telangiectásicas menores de 2 mm de diámetro (0.1%-0.3% concentración); venas varicosas de 2 a 4 mm (0.5%-1% concentración); y venas varicosas mayores (>4 mm) (concentración 1.5%-3%). El polidocanol no está aprobado actualmente por la FDA para el uso en los Estados Unidos, aunque se ha estado presentando para tal aprobación durante algunos años. Hay una extensiva experiencia con el polidocanol en Australia y también se usa en Europa. Debido a que es indoloro (esto es, sin el escozor provocado por la solución salina o el tetradecil de sodio), es bien aceptado por los pacientes. También ha disminuido el riesgo de la descamación y pigmentación de la piel. Las características negativas del agente son el desvanecimiento más lento de los vasos tratados y el riesgo de una reacción alérgica. Debido a este último riesgo, una dosis de prueba de 0.5% de solución debería inyectarse en un vaso antes de una sesión de tratamiento. Las soluciones deberían estar diluidas apropiadamente como sigue: 0.25% al 0.75% para telangiectasias, 1% para vasos de 1 a 2 mm y 2% de solución para vasos de 2 a 4 mm. Hay limitaciones de totales de dosis diarias con polidocanol basado en el peso del cuerpo (2 mg/kg/dia) y están detalladas en las líneas guía del fabricante. Sadick ha mostrado resultados comprables entre la solución salina hipertónica y el polidocanol. Se produce una solución que está compuesta de solución salina (10%), dextrosa (5%), propilenglicol y fenetil alcohol bajo el nombre de marca Sclerodex. Esta sustancia no está aprobada por la FDA, aunque está aprobada en Canadá. Tiene un uso limitado porque sólo puede ser utilizada en vasos muy pequeños, aquellos menores de 1 mm de diámetro. Tiene el riesgo de pigmentación, alergia y necrosis. El fabricante recomienda un volumen máximo de 1cc en cualquier lugar de inyección, con un total por sesión de no más de 10 cc. El morruato de sodio es una sustancia aprobada por la FDA que actualmente no es de uso frecuente y no está indicado en telangiectasias. Debe ser diluida para adecuar la concentración. Sus múltiples efectos colaterales potenciales limitan su uso (Ej., necrosis, hiperpigmentación, dolor, riesgo de embolia pulmonar, alergia y riesgo de anafilaxis). El oleato de etanolamina es de significación histórica en la escleroterapia como uno de los primeros agentes esclerosantes aprobados por la FDA. Sin embargo no es muy usado en la actualidad ya que es una solución viscosa con riesgo de reacción hemolítica. La glicerina cromada ha sido empleada en Europa pero no está aprobada por la FDA. Puede ser usada 67 para telangiectasias y tiene un potencial bajo de hiperpigmentación. Sólo un total de 0.1 cc de solución prediluida puede ser usada en una sola sesión, y puede ser diluida con lidocaína. La glicerina cromada puede ser dolorosa para los pacientes durante la inyección. El yodo poliyodinado es el más poderoso de todos los esclerosantes y es usado en el tratamiento de la unión safeno-femoral, un tratamiento más allá del alcance de este estudio. No está aprobado por la FDA y puede causar necrosis. Por lo tanto, no es apropiado para usar en la escleroterapia de vasos pequeños. Mecanismo de Acción Es la introducción de una sustancia extraña en la luz de un vaso causando trombosis y fibrosis fibrosis. El mecanismo de acción de las sustancias esclerosantes es el de producir daño endotelial seguido por endofibrosis. La extensión del daño producido en la pared del vaso determina la eficacia de la solución inyectada. Figura 2.31 - Representación diagramática del mecanismo de acción de la escleroterapia. A, Colocación apropiada de la aguja dentro de la vena e inyección del agente esclerosante. B, Estadío inicial de la destrucción endotelial y organización incial de la trombosis. C, Último estadío demostrando la fibrosis y la formación de un cordón fibroso. Las células endoteliales son muy complejas y representan el órgano más grande existente en el cuerpo humano, estas células tienen un amplio espectro de actividades metabólicas como la captación y degradación: norepinefrina, epinefrina, bradiquinina, serotonina circulante, conversión de Angiotensina I a II (vasoconstrictor), producción de plasminógeno, producción de heparina y sustancias parecidas a la heparina, producción de prostaciclinas que actúan en los vasos del músculo liso y en la agregación plaquetaria, producción de factor relajante del endotelio, almacenamiento y secreción de histamina, modulación de la inflamación a través de interacciones con TFN (factor necrosis tumoral) e interferón-gamma. Así que sería prácticamente un milagro si la escleroterapia fuese sin ningún efecto secundario o secuelas adversas. La destrucción total del endotelio resulta en la exposición de las fibras colágenas subendoteliales que producen agregación plaquetario y adherencia y liberación de los factores plaquetarios, esta serie de eventos inicia la vía intrínseca de la coagulación por activación del factor XII. Idealmente, los esclerosantes no deberían producir activación o liberación de la actividad tromboplástica, ya que ello iniciaría la vía extrínseca de la coagulación. Una trombosis excesiva es perjudicial: producción de endoesclerosis, recanalización del vaso, inflamación intra y perivascular excesiva con sus resultantes secuelas. Sin embargo, algún grado de trombosis ocurre siempre, el cual debería anclarse a la pared del vaso y prevenir la formación de émbolos. Wolf en 1920, estableció que una esclerosis efectiva resulta en una trombosis que penetra en el espesor total de la adventicia 68 de la pared del vaso. Schneider, ha mostrado exámenes histológicos de varices esclerosadas donde la fijación más fuerte del trombo se produce donde la totalidad del endotelio es destruido. Por lo tanto, el daño endotelial debe ser completo con una formación de trombo mínima con su posterior organización y fibrosis del segmento tratado que sucede 6 semanas después de la compresión, limita la extensión de la trombosis y facilita la endofibrosis. Es necesaria la destrucción del vaso completo y no sólo del endotelio. La razón es la naturaleza multifuncional de las células del músculo liso vascular. Las células del músculo liso vascular son abundantes en las venas superficiales y tienen una gran cantidad de funciones como la síntesis de colágeno, síntesis de elastina y síntesis de proteoglicanos. Si estas células permanecen viables promueven la migración de células endoteliales no dañadas y recanalización del vaso tratado (0.07 mm día). Antecedentes Como en todos los tratamientos médicos y quirúrgicos, es importante obtener una historia meticulosa del paciente. Hay algunas contraindicaciones para la escleroterapia. El embarazo, antecedentes de hipercoagulación y alergia a cualquier agente son contraindicaciones muy específicas. Los antecedentes de hipercoagulación pueden ser revelados por una historia de tromboflebitis, embolia pulmonar o por una trombosis venosa profunda. La alergia a la aspirina, heparina y anestésicos también puede ser importante, dependiendo de la elección de esclerosante. Aquellos pacientes que tienen antecedentes de hematomas fáciles o de sangrado, o aquellos pacientes que están tomando aspirinas, drogas anti-inflamatorias no esteroides o bajo terapia con vitamina E, tienen mayores probabilidad de hematomas y sangrado con la escleroterapia. Los fumadores y aquellos bajo terapia de reemplazo hormonal o anticonceptivos orales pueden tener un riesgo aumentado de coagulación, aunque estos factores no son contradicciones específicas. Se ha mostrado que la terapia hormonal tiene una asociación aumentada con la arborización telangiectásica. El estado de enfermedad sistémica debe ser revisado y debe incluir la discusión de las siguientes condiciones: hipertensión, insuficiencia cardíaca congestiva, diabetes, asma y enfermedad infecciosa. Algunas de estas condiciones pueden ser contraindicaciones relativas debido a una pobre curación y al riesgo de infección. Un buen candidato para la escleroterapia es un paciente activo. El estado de la actividad también es importante en el asesoramiento ya que algunas de las actividades de alto impacto deben evitarse inmediatamente después de la escleroterapia. El estado y los resultados de otros tratamientos por várices en las piernas, incluyendo la escleroterapia, arrancamiento y otros tratamientos quirúrgicos o con láser deberían revisarse con el paciente. El clínico también debería saber la historia familiar del paciente en relación con la predisposición al desarrollo de trastornos varicosos. Ya nos hemos referido anteriormente en este capítulo al examen físico y a datos complementarios para el diagnóstico de la enfermedad varicosa en los miembros inferiores. Materiales y Técnicas de inyección Un escenario básico escleroterápico puede ser sencillo. Las soluciones que debería incluir un kit son las siguientes: el agente esclerosante, solución salina normal, diluyente en caso de una extravasación y posiblemente pasta de nitroglicerina. La elección entre jeringas de 3 cc y de 1 cc es una preferencia personal, pero se recomienda jeringas cerradas. El médico debería tratar con ambos tamaños y decidir cuál es preferible. Todas las jeringas deberían estar bien identificadas en cuanto a qué solución contienen y su porcentaje. Las agujas descartables de 30 G se usan para la inyección, con una aguja más grande para preparar las soluciones. Se usan toallitas de alcohol para limpiar el área antes del tratamiento. Suele ser más fácil visualizar las venas en el área después de limpiarla con alcohol. Las esferas de algodón y esparadrapo (es preferible de papel porque es menos irritante) se usan después de inyectar para una compresión inmediata y para cubrir el punto sangrante de la inyección. Los guantes deben ser usados como una precaución universal. El autor fue entrenado para usar una crema con corticoide de potencia media-alta después de la inyección y antes de aplicar la bola de algodón y la cinta. Aunque no ha habido un estudio para evaluar el uso tópico de la misma, los pacientes parecen encontrarla suavizante y parece disminuir la leve reacción urticante focal que algunos sienten en el lugar de la inyección. Además, puede disminuir el desprendimiento de la piel en el sitio de la inyección mediante la disminución de la reacción inflamatoria local. 69 Cuando se inyecta al paciente con esclerosante, es importante tener una buena iluminación y, si se necesita, magnificación. Inyectar al paciente con el bisel de la aguja angulado hacia arriba y con una pequeña comba en el conector parece ser más fácil para el médico. También, con el bisel hacia arriba, el médico puede juzgar mejor dónde está yendo la solución. Es importante inyectar lentamente. Una inyección rápida puede causar extravasación y aumentar el riesgo de arborización telangiectásica. Si se mueve la aguja, existe el riesgo de que el esclerosante salga de la vena y es más probable la extravasación. Por lo tanto, es importante inyectar lentamente, parar cuando haya resistencia y no apurarse al realizar el procedimiento. La cantidad de esclerosante por sitio varía desde 0.1 hasta 0.5 cc. Se recomienda proceder desde los sitios proximales hacia los distales en las venas más grandes, pero la realidad es que, para la escleroterapia de venas pequeñas, el dermatólogo usualmente trata aquellas que más molestan al paciente. La canilla, la región distal inferior cerca del tobillo y las áreas poplíteas causan una incomodidad mayor y tienen un poco más de riesgo de ulceración. Por tanto, estas locaciones no son buenos lugares para comenzar un plan de tratamiento esclerosante. Si un paciente tiene una enfermedad reticular significativa, usualmente se recomienda que las venas reticulares sean tratadas primero. El doctor David Green ha mostrado algunos resultados excelentes en los cuales los pacientes sólo querían tratar las telangiectasias araña y no las venas reticulares (American Academy of Dermatology, 1999, encuentro anual). Subsiguientemente, el autor ha encontrado que eso era verdad en sus pacientes. Como en todos los tratamientos, es importante la documentación. Algunos médicos encuentran que las hojas preimpresas son útiles al documentar el tratamiento de las venas de la pierna. Si un paciente describe un dolor quemante, es probable que esté ocurriendo una extravasación. Hay un pequeño grupo de pacientes, sin embargo, que tienen un dolor significativo con una escleroterapia precisa. Si ocurre extravasación, el esclerosante debería ser diluido con solución salina normal o con un 1% de lidocaína para disminuir el riesgo de ulceración. Se ha mostrado que la hialuronidasa disminuye el riesgo de ulceración relacionado con la extravasación. Una dosis de 75 unidades de hialuronidasa inyectada en el área extravasada puede ser efectiva para disminuir la ulceración. Ergo, es importante tener una jeringa llena y lista con el agente contraatacante de elección. Si un paciente tiene un calambre mientras que el médico está en el proceso de inyección, el médico debería masajear el área o ir a la otra pierna por un rato. Como ha sido discutido, el área del tobillo tiene un riesgo mayor de ulceración y nunca debería ir primero en el plan de tratamiento de un paciente. Es importante usar una solución diluida en esta región y sólo llevar a cabo una pequeña cantidad de tratamiento en la zona del tobillo en una sesión. Las venas reticulares son gratificantes de tratar. El tratamiento de las venas reticulares usualmente causa una menor sensación de escozor al paciente. Para estos vasos sanguíneos, se prefiere una cantidad más pequeña de esclerosante en cada jeringa (Ej., 0.5 cc). Esto es debido a que cuando se tratan venas reticulares, el médico debería retroceder el émbolo para obtener una chorro de sangre para tener certeza que está en la vena. Una vez hecho esto se debe inyectar lentamente. La resistencia se siente cuando la solución está alcanzando una válvula o tortuosidad y es una indicación para parar de inyectar. La compresión con algodón y esparadrapo se realiza inmediatamente después de retirar la aguja. Compresión La compresión mejora los resultados de la escleroterapia y disminuye el riesgo de recanalización, hiperpigmentación, reacciones flebíticas y arborización telangiectásica. La compresión normalmente se logra con medias elásticas. Estas están graduadas en términos de habilidad compresora, con los rangos comunes de 12 a 40 mmHg. La media de soporte tiene incluso una compresión más graduada que el vendaje. Los pacientes que sólo se sometieron a un tratamiento de venas en araña pueden tener una compresión más ligera, en el rango de 12 a 20 mmHg. Los pacientes con tratamientos de venas reticulares deberían usar medias en el rango de los 20 a 30 mmHg. Las de rango 30 a 40 mmHg. puede ser demasiado compresivas si el paciente está acostado la mayor parte del día. La sobrecompresión podría ser un factor de riesgo para ulceración. Se instruye a los pacientes para que se pongan sus medias justo después de la terapia y, de forma ideal, antes de pararse. Ellos utilizan la media durante la noche, la primera noche después del tratamiento y después también durante el día. Para el tratamiento de venas araña y pequeñas, es apropiado 7 días de uso de la media de compresión. Para 70 tratamiento de venas reticulares, se prefiere 2 a 3 semanas. Se aconseja a los pacientes que deambulen, ya que la inactividad puede aumentar el riesgo de coagulación. También se les aconseja que eviten actividad de alto impacto, como trotar, aeróbicos y kick-boxing. Además, se les dice que usar algún nivel de soporte compresivo diario debería mejorar el estado de las venas de su extremidad inferior. Algunos pacientes encuentran que sus piernas están ‘menos cansadas’ al final del día y prefieren usar las medias compresivas sobre una base regular, lo cual es especialmente importante en trabajos donde el paciente está parado todo el día. Figura 2.32 - Representación diagramática de recanalización de una vena varicosa a través de la trombosis inducida por la escleroterapia (Redibujado de Wenner L: Vasa 15:180, 1986. Efectos colaterales / complicaciones Generalmente, la escleroterapia es un procedimiento seguro y bien tolerado. No obstante, hay algunas áreas de las que hay que estar atento y es importante prevenir a los pacientes sobre estas áreas en la cita de consulta y en el consentimiento informado. Pueden ocurrir hematomas en el sitio de la inyección y es más probable si el paciente toma aspirinas o anti-inflamatorios no esteroides. Este efecto se va con el tiempo. La urticaria localizada también puede ocurrir en el lugar de la inyección y parece aliviarse con el uso tópico de corticoesteroides aplicados antes de la utilización de apósitos y compresión. La urticaria es pasajera y puede ocurrir con la mayoría de los agentes. La teoría es que es causada por la irritación de la pared endotelial de la vena inyectada. Muchos pacientes se quejan de algún grado de dolor en el momento del procedimiento. La hiperpigmentación puede ocurrir hasta en 10% a 30% de las venas, pero es más probable que ocurra en vasos mayores de 2 mm. La terapia de compresión y evitar el bronceado disminuyen esta probabilidad. La hiperpigmentación se aclara con tiempo o puede ser tratada con tretionina tópica o hidroquinonas, o el tratamiento de elección del médico para la hiperpigmentación. Se han reportado costras en el sitio de la inyección en hasta el 10% de las veces y es causado por la pérdida exterior de esclerosante. La arborización telangiectásica - matting, también puede ocurrir, especialmente si el esclerosante se inyecta muy rápido y posiblemente si el porcentaje de concentración es muy fuerte. Se ha mostrado que esto 71 ocurre en hasta el 15% al 20% de los pacientes. El manejo con tratamiento en una visita futura suele ser apropiado. La terapia láser o lumínica puede jugar un rol en el tratamiento de las venas que son muy pequeñas para inyectar. Además, puede ocurrir también edema con la escleroterapia. La parte inferior de la pierna, particularmente el área del tobillo, es propensa a este efecto secundario. La terapia de compresión y la precaución en cuanto al volumen de esclerosante utilizado en una sesión pueden minimizar el edema. Puede ocurrir tromboflebitis superficial con venas de 3 a 5 mm y puede tratarse con compresión, antiinflamatorios no esteroideos, calor y a veces, corticoesteroides intramusculares. Puede ocurrir fibrosis nodular con las venas más grandes y necesita ser minimizada con compresión y tratada con confianza y seguimiento del paciente en el tiempo. La necrosis puede ser causada por pérdidas exteriores del esclerosante; el tema de la colocación de la aguja demanda paciencia y precaución cuando se realiza la esclerosis en otras ocasiones es independiente de la habilidad del clínico que inyecta el esclerosante, la solución puede salir por el orificio que se ha practicado en la vena por medio de la aguja de inyección. A veces, la dilución con lidocaína, solución salina normal o hialuronidasa puede minimizar la necrosis. Pueden ocurrir úlceras con la inyección del esclerosante. La extravasación o inyección en una arteriola también pueden llevar a una ulceración. Si se sospecha extravasación, puede ayudar una solución de salina normal, lidocaína o hialuronidasa, como se discutió previamente. Además, si el médico ve un blanqueo sugestivo de infiltración de arteriola (arteriolar), la aplicación de una pasta de nitroglicerina tópica en el lugar de la inyección puede disminuir el potencial de ulceración mediante el aumento de la microcirculación, la cual puede eliminar el esclerosante de la arteriola. Si ocurre una úlcera, son importantes la paciencia, visitas frecuentes y un buen tratamiento de cuidado de la misma. Manejo de los pacientes Antes de realizar una escleroterapia en el paciente, es importante tener una cita de consulta meticulosa. Durante la misma, se obtienen los detalles de la historia del paciente. Una ficha estandarizada para los pacientes para escleroterapia puede simplificar la obtención del historial. Un examen completo, como se discutió previamente, debería realizarse. Los riesgos, beneficios y efectos secundarios deberían verse con el paciente de forma tal que se obtenga un consentimiento informado. El plan de tratamiento puede ser revisado por el paciente, ayudando a asegurar resultados realistas. Es importante aconsejar a los pacientes que las venas pueden llevar hasta un mes para desaparecer después del tratamiento. El número de sesiones variará con la extensión de la enfermedad, cantidad de terapia realizada en cada sesión y la tasa de éxito del tratamiento. No suelen agendarse sesiones adicionales hasta 4 o 6 semanas después de la terapia. La compresión adecuada debería discutirse, ya que el paciente la necesitará con él en el momento del tratamiento. Se les advierte a los pacientes que quizás necesiten modificar los programas de ejercicios para evitar actividades de alto impacto desde 1 a 3 semanas después de la terapia (1 semana para telangiectasias y hasta 3 semanas para venas reticulares). También se les aconseja a los pacientes en la consulta que eviten afeitarse o humectarse las 24 horas anteriores al (o el día del) procedimiento. Suele hacerse un examen de seguimiento con el paciente después de aproximadamente 1 mes, a menos que tenga algún problema o preguntas y necesite adelantarse. Se les notifica a los pacientes que algunas venas pueden tardar un mes para desaparecer completamente después de la terapia, y el tratamiento posterior, si se necesita, puede planearse en ese momento. Nuevos desarrollos Las nuevas áreas de discusión en escleroterapia incluyen el uso de esclerosante espumoso. La espuma se forma mezclando el aire con el esclerosante. La escleroterapia también está siendo usada en venas en la 72 cara, manos y tórax. Estas áreas son más complejas y deberían revisarse con alguien experimentado en el tratamiento de las mismas. La terapia láser continúa evolucionando con nuevas modalidades. Actualmente, sin embargo, la terapia láser y lumínica deberían considerarse en pacientes que no toleran la escleroterapia debido al miedo a las agujas o a la falla de la terapia previa, o en aquellos que son propensos a la arborización telangiectásica (matting). Radiofrecuencia y Láser Endovenoso (LEV) Introducción La insuficiencia venosa crónica tiene una elevada prevalencia en la civilización occidental. Las varices de las extremidades inferiores constituyen la dolencia vascular más frecuente en el ser humano afectando al 20-25% de las mujeres y al 10-15% de los varones. Michaels et al publicaron recientemente un estudio controlado y aleatorizado demostrando que el tratamiento quirúrgico de las varices sintomáticas no complicadas es coste-efectivo. Si tenemos en cuenta la fisiopatología de la insuficiencia venosa crónica es evidente, que para obtener resultados eficaces y duraderos en el tratamiento de las varices es fundamental eliminar el origen del reflujo venoso. La información obtenida mediante hemodinámica venosa procedente de los estudios mediante ecodoppler, demuestra que las varices de los miembros inferiores son debidas, en la mayoría de los casos (70%) a insuficiencia del cayado y/o troncular de la vena safena interna (VSI). Con menor frecuencia se pueden ver afectados otros sistemas como son la vena safena externa, venas perforantes y/o tributarias. Por ello, desde hace años ha quedado claramente establecido que la ablación del reflujo venoso de la vena safena constituye el talón de Aquiles del tratamiento de las varices, debiendo ser el primer objetivo terapéutico. Con ello, vamos a eliminar el principal mecanismo hemodinámico implicado en el desarrollo y progresión de las varices, la hipertensión venosa generada por la columna de presión hidrostática. Hasta hace pocos años el único tratamiento quirúrgico eficaz y duradero para tratar las varices tronculares ha sido la ligadura del cayado safeno-femoral y stripping de la VSI. Durante la última década, el progreso tecnológico ha permitido el desarrollo y aplicación de nuevas terapias mínimamente inavasivas como la radiofrecuencia endovenosa VNUS Closure (RFA- radiofrecuencia endovenosa - endovenous radiofrequency ablation (ERFA) y el endoláser (EVLT - endovenous laser treatment) o láser endovenoso (LEV). Mecanismo de acción La radiofrecuencia (RF) es energía electromagnética y por tanto no ionizante. Son ondas eléctricas y magnéticas que al entrar en contacto con un tejido provocan la vibración y fricción de sus átomos transformándose en energía térmica (calentamiento óhmico resistivo). El aumento de temperatura generado con la RF comporta una serie de alteraciones de la estructura de la vena tratada. Entre otros, sabemos que a partir de 60º C se produce la rotura de los enlaces de triple hélice de colágeno con un gran aumento en la fuerza molecular contráctil de este. Sin embrago, a la vez es de gran importancia evitar temperaturas muy elevadas, para que no se produzca ebullición, vaporización y carbonización de los tejidos, fenómeno que acontece con otra fuentes de energía como el endoláser al generar picos de 700 a 1.500º C. Por ello, el rango de temperatura empleada con la RF es claramente inferior (95-120 ºC), suficiente para inducir a nivel de la pared venosa los siguientes cambios macro y microscópicos: 1. Destrucción endotelial, 2. Desnaturalización y contracción del colágeno, 3. Acortamiento y engrosamiento de la pared venosa, y 4. Reducción de la luz del vaso. Por tanto, el objetivo terapéutico de la RFA es inducir la oclusión fibrótica de la vena tratada y su posterior desaparición por atrofia. Hace ya más de una década se inició el desarrollo de la radiofrecuencia endovenosa VNUS Closure® (VNUS Medical Technologies, San José, CA, USA) consistente en un generador de RF y un delgado catéter bipolar para su inserción percutánea y navegación en el interior de la vena patológica. Se aplicó en clínica por primera vez en 1998, obteniendo su aprobación por la Food and Drug Administration (FDA) en 1999. Du73 rante los últimos años, su uso se ha extendido de manera progresiva en la mayoría de los países desarrollados. Además, sus indicaciones se han ampliado a otros segmentos venosos diferentes de la VSI como son la vena safena anterior, vena safena externa y venas perforantes. Experiencia clínica y evidencia cientíifca A partir del año 2000, Se empezaron a publicar diversos trabajos tanto clínicos como experimentales que mostraban a la RFA como un método seguro y efectivo para abolir el reflujo de la vena safena. Uno de los más importantes fue el estudio multicéntrico publicado por Merchant et al con 1.222 extremidades tratadas y un seguimiento de cuatro años, demostrando éxito ecográfico y satisfactorio del paciente en más del 85% de los casos. Radiofrecuencia versus stripping (fleboextracción - técnica de Müller) Todavía de mayor trascendencia fue la información procedente de la publicación de cuatro trabajos comparativos prospectivos y aleatorios, frente al “gold estándar” de la cirugía convencional (ligadura del cayado safeno femoral y fleboextracción de la VSI). los resultados de estos trabajos fueron coincidentes: la RFA igualaba en eficacia a la cirugía convencional, pero además era claramente superior en términos de un menor dolor postoperatorio, mejor calidad de vida y más rápida recuperación. A continuación se describen de manera detallada los resultados obtenidos. El estudio de Rautio et al demostró un menor (escala analógica visual), tanto en reposo (p = 0.026) o durante la marcha (p = 0.036). Las diferencias más importantes acontecieron entre el 5º y el 14º días postoperatorio. La necesidad de analgésicos para el grupo de RFA fue de 0.4 ± o.49 comprimidos de ibuprofeno al día vs 1.3 ± 1.09 comprimidos para el stripping (p<0.004). Figura 2.33 - Tinción con hematoxilina-eosina. Vena safena humana ocluida por fibrosis (Archivo Dr. G García-Madrid. García-Madrid y cols, Cir Esp, 2011; 89(7), 422. El tiempo de reincorporación al trabajo fue también claramente muy inferior 6.5 ± 3.3 para la RFA (ablación por radiofrecuencia endovenosa) vs 15.6 ± 6.0 días para la fleboextracción (p<0.001), y la recuperación física fue igualmente mucho más rápida para la RFA (cuestionario RAND-35 de calidad de vida). Estos pacientes fueron seguidos durante tres años sin encontrar diferencias en cuanto a recidiva varicosa. El estudio Endovenous Obliteration vs Ligation and Vein Stripping (EVOLVeS) es un estudio comparativo multicéntrico, prospectivo y aleatorizado frente a cirugía convencional que valoró tanto los resultados del tratamiento como su eficacia a largo plazo. Fueron intervenidas 80 extremidades: 44 (RFA) y 36 (stripping). Durante el seguimiento precoz (4 meses) se analizaron de manera comparativa las complicaciones, el tiempo de recuperación, y variables relacionadas con la capacidad de vida. Las diferencias más importantes entre ambos grupos fueron el tiempo de recuperación tras la intervención, con un retorno a la actividad normal de 1.15 días frente 3.89 (stripping) (p=0.02) y el retorno a la actividad laboral 4.7 días (RFA) frente a 12.4 (stripping) (p<0.05). El grupo de la fleboextracción presentó una morbilidad mayor a las tres semanas, sobre todo con relación a la presencia de hematomas, equimosis y dolor. La mejoría en la escala venous clinical severity score (VCSS) también fue favorable para el grupo de la RFA a las 72 horas y 1 semana. Posteriormente como es lógico estas diferencias se igualaron. La valoración de calidad de vida (CIVIQ2) se mostró claramente mejor para la RFA destacando las mayores diferencias en puntuación global y en la escala de dolor. 74 El impacto sobre los resultados clínicos y hemodinámicos fue nuevamente comparado en esta muestra de pacientes a 1 y 2 años. La RFA obtuvo mejor puntuación en calidad de vida a 1 y 2 años (p<0.001). Ambos tratamientos se mostraron igual de eficaces, sin diferencias a nivel clínico (síntomas, signos y recurrencia de varices), ni hemodinámicos valorados mediante eco-Döppler (ausencia de reflujo: 91.7% vs 89.7% stripping). El 41% de las venas safenas fueron indetectables mediante RFA a los dos años de seguimiento. En este estudio la tasa de recurrencia fue menor para el grupo de RF (14% vs 21%) aunque sin alcanzar significación estadística. Algo similar sucedió con la neovascularización, siendo menor para la RFA (2.8%) que para stripping (13.8%). Stotter et al en el año 2005 publicaron un estudio prospectivo y aleatorio en el cual se comparaban tres técnicas: VNUS Closure (n=20), stripping (n=20), y crio-stripping (n=20). Durante el seguimiento a 6 semanas, la RFA obtuvo la mejor puntuación en calidad de vida (CIVIQ-2) (p=0.012). También demostró ser la menos dolorosa (p=0.014). Igualmente fueron favorables para el grupo de RFA la reincorporación al trabajo (7 días) en comparación con stripping (14 días) y crio-stripping (12 días) (p=0.007). Hinchcliffe et al compararon la RFA (n=16) frente a la cirugía convencional (n=16) en el tratamiento de las varices bilaterales recidivadas de la vena safena interna. Los resultados demostraron superioridad para la RFA en la mayoría de las variables estudiadas: menor tiempo quirúrgico (24.5 min vs 40 min, p=o.02), menos dolor en la escala analógica visual (1.7 vs 3.8, p=0.02), menos equimosis valorada mediante análisis de imagen digital (11.9 vs 21.8, p=0.02) y una reincorporación más rápida a la vida laboral. Conceptos anatómicos y hemodinámicos La aparición de la cirugía hemodinámica de las varices fue consecuencia de la sistematización en el estudio del sistema venoso, que conllevó la definición de varios conceptos que conviene recordar. Anatómicamente pueden definirse cuatro redes venosas en relación con las fascias del tejido celular subcutáneo: – R1 o red primaria: son las venas situadas por debajo de la fascia profunda. Corresponde al sistema venoso profundo. – R2 o red secundaria: la integran las venas situadas entre la fascia profunda y la superficial, es decir, la safena interna, la safena anterior, la safena externa y la vena de Giacomini. – R3 o red terciaria: la integran las venas situadas por fuera de la fascia superficial. Suelen corresponder a ramas de las venas safenas o las originadas desde perforantes. – R4 o red cuaternaria: es un tipo especial de R3 que conecta dos R2. Pueden ser longitudinales (R4l) si comunican con la misma R2 o transversales (R4T) si comunican dos R2 diferentes. Los paquetes varicosos están constituidos mayoritariamente por dilataciones y tortuosidades de R3 y R4. Las R2 y R3 se comunican con las R1 mediante los cayados o por perforantes. - Shunt: circuito retrógrado venovenoso caracterizado por un punto de fuga, un trayecto anómalo y un punto de entrada. - Punto de fuga: paso de una red interior a otra exterior. Por ejemplo, R1 a R2. - Punto de entrada: paso de una red exterior a otra interior. Por ejemplo, R3 a R1 o R2. Clásicamente se describieron cuatro tipos de shunt: - Shunt tipo I: el punto de fuga principal se establece en R1 → R2 sin interposición de ninguna R3. - Shunt tipo II: el punto de fuga principal se establece en R2 → R3/R4 - Shunt tipo III: el punto de fuga principal es R1 → R2, con interposición de R3 o R4 entre aquél y el punto de reentrada. - Shunt tipo IV: constituido por los restantes tipos de shunts no englobados en las otras categorías. Básicamente se trata de shunts en los que el punto de fuga principal es R1 → R3, como, por ejemplo, los de las insuficiencias paraostiales de las safenas, shunts pelvianos, etc. 75 En algunos tipos de shunts existen varios subtipos (shunt tipo III) y también pueden presentarse combinaciones entre ellos (shunt tipos I + III). Posteriormente, esta clasificación fue revisada y actualizada (Teupitz, 2002) pero, como todos estos conceptos fueron descritos para la ciru- gía hemodinámica, el aplicarlos estrictamente a la técnica quirúrgica que nos ocupa no es correcto. Por otra parte, como guía en la sistematización del estudio y para los planteamientos estratégicos, creemos que pueden ser de gran utilidad. Figura 2.34 - Shunt tipo I Figura 2.35 - Shunt tipo II 76 Figura 2.36 - Shunt tipo III Figura 2.37 - Shunt tipo IV 77 La exploración se realiza siempre en bipedestación, excepto la corrección de la posición del cayado de safena interna, que se rectifica en decúbito, siendo muy aconsejable seguir la misma sistemática de estudio para no dejar de recoger datos que puedan ser importantes. Desde este punto de vista, la exploración preoperatoria es, en general, menos minuciosa y va orientada al diagnóstico, a detectar anomalías o situaciones que contraindiquen la técnica y como planteamiento inicial de la estrategia, atendiendo a los criterios de inclusión o exclusión que se citan a continuación: Contraindicaciones absolutas – Trombosis venosa profunda no repermeabilizada. – Trombosis venosa completa de safenas. – Isquemia crónica de los miembros inferiores, estadios III-IV de Fontaine. – Alteración grave del estado general o patología asociada grave. – Dificultades técnicas en la cateterización de los troncos venosos por su tortuosidad o existencia de malformaciones. Contraindicaciones relativas – Isquemia crónica de los miembros inferiores, estadio II-b. – Alteraciones de la coagulación: hipocoagulabilidad primaria, trombofilia y tratamiento con anticoagulantes orales. – Infección dérmica evolutiva. – Obesidad mórbida. – Alergia a anestésicos locales (puede realizarse bajo anestesia general). – Embarazo. Radiofrecuencia vs Láser endovenoso (LEV) Desde el punto de vista técnico como tecnológico existen diferencias importantes entre ambos que han quedado demostradas a nivel experimental en dos trabajos de Schmedt et al cuyos resultados son coincidentes con las observaciones de Weiss. Podemos afirmar por tanto que la RFA muestra una lesión circular , homogénea, sin perforación de la pared venosa, ni carbonización. Desde el punto de vista clínico se han publicado 5 estudios comparativos entre la RFA y el LEV-EVLT. Los dos primeros con ClosurePlus, otros dos con Closure FAST y 1 con Celon RFITT (Olympus, Germany). En el primero, publicado por Puggioni en Figura 2.38 - Generador RFG2 PlusTM. El display de la unidad de control muestra en 2005 fueron tratados 77 pacientes con LEV y 53 con RFA de manetiempo real la potencia, temperatura y ciclos ra consecutiva. El éxito técnico global a 1 mes fue del 93.9% (100% de tratamiento. para el LEV y 96% para la RFA. Hemos de tener en cuenta a la hora de valorar los resultados obtenidos en este estudio un sesgo de diseño científico importante en el seguimiento, pues sólo se se realizó eco-Döppler de seguimeinto al 50% de los pacientes. Se reportaron una mayor número de complicaciones para el LEV 20.8% frente a la RFA 7.6% (p=0.049). Un 2.3 (3/77) de los pacientes tratados mediante LEV mostró protusión del trombo en la vena femoral común. En el años 2006, Almeida reporta una mayor casuística (819 LEV y 128 RF) y un seguimiento más prolongado (1,5 años). La tasa de recanalización es algo superior para RFA 5.5% frente al LEV 1.7%. La tasa de extensión del trombo en la vena femoral Figura 2.39 - Láser Multidiode ENDO 1470 común fue del 0.2% para LEV y ausente para RFA. nm, Láser Intermedic. 78 Figura 2.40 - tecnología de láser de diodo (arseniuro alumínico de Figura 2.41 - Ecógrafo y fibra óptica endovenosa. galio). Hemos probado las tres longitudes de onda exis- tentes, 810 nm, 940 nm y 980 nm, y todas ofre cen resultados satisfactorios. Figura 2.42 - Acceso percutáneo a safena infragenicular para introducción del catéter. 79 Gale et al han publicado recientemente otro estudio comparativo, prospectivo y aleatorio entre RFA Closure-Plus (ya obsoleto) (n=46) y LEV (810 nm, también si no obsoleto, superado por otras longitudes de onda como la de 1470 nm) (n=48) reportando resultados a un mes y al año. Ambos métodos fueron muy efectivos en la reducción de los síntomas (VCSS, CEAP, CIVIQ-2). La RFA mostró una mayor tasa de recanalización tardía (11 RFA y 2 LEV, p=0.002). Por tanto el LEV fue más efectivo que ClosurePlus pero a cambio una mayor tasa de equimosis y malestar durante el periodo postoperatorio (hoy reducido mediante longitudes de onda más largas y de mayor absorción agua como la de 1470 nm). Almeida et al en 2009 publicaron el estudio RECOVERY, un trabajo multicéntrico, comparativo, en el cual se aleatorizaron 87 venas en 69 pacientes. Los grupos fueron LEV (980 m, n=41) y RFA ClosureFAST (n=46) y seguimientos a 1 mes. Los objetivos primarios fueron el dolor postoperatorio, equimosis, tumefacción y complicaciones del procedimiento. Los secundarios escala clínica de severidad venosa y calidad de vida (VCSS y QOL score). El estudio concluye: 1. La RFA es significativamente superior al LEV en términos de recuperación post-procedimiento y parámetros de calidad de vida; 2. Las complicaciones fueron más prevalentes de manera estadísticamente significativa en el grupo LEV (22.0% vs 4.4%, p=0.02). Recientemente, en el 2010 Shepherd et al han publicado otro trabajo comparativo realizado con 131 pacientes RFA ClosureFAST (n=67) y LEV (980 nm, n=64). Se analizó el dolor postoperatorio y la calidad de vida a las 6 semanas (AVQQ, VCSS y SF12). El estudio mostró un menor dolor en los pacientes sometidos a RFA durante los primeros 10 días (p=0.001). Asimismo, ambos grupos mejoraron su calidad de vida tras la intervención sin existir diferencias estadísticamente significativas entre ambos métodos. La vuelta tanto a las actividades cotidianas como al trabajo fue similar para ambos grupos, con una tasa global de vuelta al trabajo dentro de la primera semana del 70%. En otro trabajo del mismo autor, los pacientes con RFA se reincorporaron antes al trabajo que aquellos tratados mediante LEV (5 vs 9 días, p=0.022). En resumen con la inforación de la que disponemos en la actualidad, se puede concluir que la RFA consigue resultados similares al LEV, aunque con menos dolor, equimosis y hematomas en el postoperatorio inmediato, aunque en manos expertas el perfil de efectos secundarios es similar en ambas técnicas. Aunque la fibra de láser con su luz guía permite una visualización fácil del posicionamiento exacto, ningún sistema láser hasta ahora ofrece un mecanismo de retroalimentación de seguridad que permita al médico monitorizar la temperatura de tratamiento. Sin embargo, la fibra óptica del láser es más flexible y más maniobrable y el tiempo de retirada es significativamente menor que la RF (4 min vs 15 min). Pero la gran ventaja de los sisteams láser sobre la RF puede ser económico, ya que el coste del láser, aunque la inversión inicial sea mayor, es más bajo que la RF debido al coste de los catéteres. Tanto la RFA como el LEV eliminan la necesidad de la anestesia general o peridural y de una larga convalescencia en comparación con la cirugía tradicional de ligadura y fleboextracción. La mayoría de los pacientes vuelven a sus actividades normales casi inmediatamente después del procedimiento. Como ya se ha mencionado previamente, los datos obtenidos del seguimiento de los pacientes durante más de una década sugieren un porcentaje de éxito aún mayor que la cirugía tradicional. Como nota adicional, solamente se menciona una nueva técnica de ablación de varices tronculaes por vapor de agua - SVS (steam vein sclerosis). Conclusión Las intervenciones quirúrgicas, las técnicas ablativas endovenosas y la escleroterapia permanecen como la primera elección de tratamiento para las venas varicosas y las veans reticulares mayores de 3 mm de diámetro. El rol actual para las fuentes de luz percutáneas es en: 1. Pacientes con contraindicaicones médicas a los esclerosantes; 2. Pacientes con fobia a las agujas; 3. Pacientes en los que ha fallado la escleroterapia; 4. Vasos de pequeño calibre, menores de 0.3 mm, en los que sea dificultosa su canalización; y 5. Para los vasos del tobillo que son muy difíciles de tratar mediante escleroterapia. La escleroterapia es una técnica muy mano 80 dependiente. Los médicos no familiarizados con la escleroterapia pueden encontrar más útiles los láseres. No obstante, todos los médicos interesados en el tratamiento de las lesiones vasculares de las extremidades inferiores, a pesar de su experiencia, deben abordar el tema con una sñolida formación en la anatomía venosa y la fisiología del reflujo venoso y tratar en una progesión lógica, comenzando con las varicosidades, perforantes incompetentes, venas reticulares y finalmente las telangiectasias. A pesar de los avances terapéuticos recientes, el tratameinto ideal para las venas no deseadas de las extremidades inferiores sigue siendo difícil debido a su naturaleza variable. Actualmente, la variedad de métodos y los cambios en los parámetros pone de relieve la falta de tratamientos estándares en la terapia de las venas de las piernas. Sin embargo, como representa una de las lesiones vasculares más comunes y demandan tratamientos cosméticos, continuará la investigación para mejorar el tratamiento de las venas en los miembros inferiores. Figura 2.43 - Cicatrización de úlcera varicosa mediante la corrección de hipertensión venosa de las varices troncales y veans perfroantes (Cockett) mediante el tratamiento a través láser endovenoso y escleroterapia en microespuma. 81 Bibliografía 1. Barton JK, Frangineas G, Pummel- 1-1, Black JF 2001 Cooperative phenomena in two-pulse, two-color laser photocoagulation of cutaneous blood vessels. Photochemistry and Photobiology 73:642-650 2.Bernstein EF 2007 The new-generation, high-energy, 595 nin, long pulse-duration, pulsed-dye laser effectively removes spider veins of the lower extremity. Lasers in Surgery and Medicine 39:218-- 224 3. Davis LT, Duffy DM 1990 Determination of incidence and risk factors for postsclerotherapy telangiectatic matting of the lower extremity: a retrospective analysis. Journal of Dermatology and Surgical Oncology 16:327-330 4. Dierickx CC, Casparian JM, Venugopalan V, Earinelli WA, Anderson RR 1995 Thermal relaxation of port-wine stain vessels probed in vivo: the need for 1-10-millisecond laser pulse treatment. Journal of Investigative Dermatology 105:709-714 5. Eremia S. Li CY 2001 Treatment of leg and face veins with a cryogen spray variable pulse width 1064-nm Nd:YAG laser a prospective study of 47 patients. Journal of Cosmetics and Laser Therapy 3:147-153 6. Garden JM, Backus AD 1996 Treatment of leg veins with high energy pulsed dye laser. Lasers in Surgery and Medicine 8 (suppl):34 7. Goldman MP, Eckhouse S 1996 Photothermal sclerosis of leg veins. ESC Medical Systems, LTD Photoderm VL Cooperative Study Group. Dermatologic Surgery 22:323-330 8. Goldman MP, Fitzpatrick RE 1990 Pulsed-dye laser treatment of leg telangiectasia: with and without simultaneous sclerotherapy. Journal of Dermatologic and Surgical Oncology 16:338-344 9. Hoopman Ozturk S, Kenkel J 2004 An algorithm for determining ideal pulse width and energy settings vs. vessel diameter using 1064 nin Nd:YAG laser. Lasers in Surgery and Medicine 16(suppl):18 10. Hsia J, Lowery JA, Zelickson B 1998 Treatment of kg telangiectasia using a long-pulse dye laser at 595 nm. Lasers in Surgery and Medicine 20:1-5 11 Kanter A 1998 Clinical determinants of ultrasound guided sclerotherapy outcome. Part I: The effects of age, gender, and vein size. Dermatologic Surgery 24:131-135 12. Kaudewitz P, Klovekorn W, Rother W 2002 Treatment of leg vein telangiectases: 1-year results with a new 940 nm diode laser. Dermatologic Surgery 28:1031-1034 13. Kauvar AN, Lou WW 2000 Pulsed alexandrite laser for the treatment of leg telangiectasia imd reticular veins. Archives of Dermatology 136:1371-1375 14. Levy JL, Elbahr C, Jouvc E, Mordon S 2004 Comparison and sequential study of long pulsed Nd:YAG 1,064 nm laser and sclerotherapy in leg telangiectasias treatment. Lasers in Surgery and Medicine 34:273-276 15. Lupton JR, Alster TS, Romero P 2002 Clinical comparison of sclerotherapy versus long-pulsed Nd : VAG laser treatment for lower extremity telangiectases. Dermatologic Surgery 28:694-697 16. Lone F study of endovenous radiofrequency obliteration (closure procedure) versus ligation and stripping in a selected patient population (EVOLVeS Study). Journal of Vascular Surgery 38:207-214 17. Min RJ, Kbilnani N, Zimmet SE 2003 Endovenous laser treatment saphenous vein reflux: long-term results. Journal of Vascular and Interventional Radiology 14:991-996 18. Mordon S, Brisot D, Fournier N 2003 Using a non uniform pulse sequence can improve selective coagulation with a Nd : YAG laser .06 pus) thanks to Met-hemoglobin absorption: a clinical study on blue leg veins. Lasers in Surgery and Medicine 32: 160170 19. Perrin MR, Guex JJ, Ruckley CV, et al 2000 Recurrent varices after surgery (REVAS), a consensus document. REVAS group. Cardiovascular Surgery 8:233-245 20. Politowski M, Zelazny I 1966 Complications and difficulties electrocoagulation of varices of the lower extremities. Surgery 59:9 32-934 82 21. Polla LL, Tan OT, Garden JM, Parrish JA 1987 Tunable pulsed dye laser for the treatment of benign cutaneous vascular ectasia. Dermatologic 174:11-17 22. Reichert D 1998 Evaluation of the long-pulse dye laser for the treatment of leg telangiectasias. Dermatologic Surgery 24:737740 23. Trelles MA, Allones 1, Alvarez J, et al 2006 The 800-nm diode laser in the treatment of leg veins: assessment at 6 months. Journal of the American Academy of Dermatology 54: 282-289 24. Weiss RA 1993 Evaluation of the venous system by Doppler ultrasound and photoplethysmography or light reflection rheography before sclerotherapy. Seminars in Dermatology 1,2:78-87 25. Wceiss RA 2001 Enclovenotis techniques for elimination of saphenous reflux: a valuable treatment modality. Dermatologic Surgery 27:902-905 26. Weiss RA 2002 Comparison of endovenous radiofrequency versus 810 nm diode laser occlusion of large veins in an animal model. Dermatologic Surgery 28:56-61 27. Weiss RA, Dover JS 2002 Leg vein management: sclerotherapy, ambulatory phlebectomy, and laser surgery. Seminars in Cutaneous Medicine and Surgery 21:76-103 28. Weiss RA, Munavalli G 2005 Endovenous ablation of truncal veins. Seminars in Cutaneous Medicine and Surgery 24:193-199 29. Weiss RA, Weiss MA 1999 Early clinical results with a multiple synchronized pulse 1064 nm laser for leg telangiectasias and reticular veins. Dermatologic Surgery 25:399-402 30. Engel A, Johnson M, Haynes S. Health effects of sunlight exposure in the United States: results from the First National Health and Nutrition Examination Survey 1971–1974. Arch Dermatol 1988;124:72. 31. Kanter A. The effect of sclerotherapy on restless legs syndrome. Dermatol Surg 1992;21:328- 32. 32. Isaacs M. Symptomatology of vein disease. Dermatol Surg 1995;21:321-3. 4) Sadick N. Predisoposing factors of varicose and telangiectatic leg veins. J Dermatol Surg Oncol 1992;18:883-6 5) 33. Weiss R, Weiss M. Resolution of pain associated with varicose and telangiectatic leg veins after compression sclerotherapy. J Dermatol Surg Oncol 1990;16:333-6. 34. Bohler-Sommeregger K, Karnel F, Schuller-Petrovic S, Santler R. Do telangiectases commmunicate with the deep venous system? J Dermatol Surg Oncol 1992;18:403-6. 7 35. Green D. Sclerotherapy for the permanent eradication of varicose veins: theroretical and practical considerations. J Am Acad Dermatol 1998;38:461-75. 36. Vin F, Allaert F, Levardon M. Influence of estrogens and progesterone on the venous system of the lower limbs in women. J Dermatol Surg Oncol 1992;18:888-92. 37. Green D. Mechanism of action of sclerotherapy. Semin Dermatol 1993;12(2):88-97 38. Sadick N. Sclerotherapy of varicose and telangiectatic leg veins: minimal sclerosant concentration of hypertonic saline and its relationship to vessel diameter. J Dermatol Surg Oncol 1991;65-70. 39. Goldman M. Sclerotherapy: treatment of varicose and telangiectatic leg veins, St. Louis, MO: Mosby; 1995. 40. Conrad P, Malouf G, Stacey M. The Australian Polidocanol (Aethosysklerol) Study: results at 2 years. Dermatol Surg 1995;21:334-6. 41. McCoy S, Evans A, Spurrier N. Sclerotherapy for leg telangiectasia—a blinded comparative trial of polidocanol and hypertonic saline. Dermatol Surg 1999;25:381-6. 42. Goldman M. Treatment of varicose and telangiectatic leg veins: double blind prospective comparative trial between Aethoxyskerol and Sotradecol. Dermatol Surg 2002;28:52-5. 43. Sadick N. Hyperosmolar versus detergent sclerosing agents in sclerotherapy: effect on distal vessel obliteration. J 83 Dermatol Surg Oncol 1994;20:313-6. 44. Goldman M. A comparison of sclerosing agents: clinical and histological effects of intravascular sodium morrhuate, ethanolamine oleate, hypertonic saline (11.7%) and sclerodex in the dorsal rabbit ear vein. J Derm Surg Oncol 1991;17:354-62. 45. Drake L, Dinehart S, Goltz R, Graham G, Kordinsky M, Lewis C, et al. Guidelines of care of sclerotherapy treatment of varicose and telangiectatic leg veins. J Am Acad Dermatol 1996;34:523-8. 46. Davis L, Duffy D. Determination of incidence and risk factors for postsclerotherapy telangiectatic matting of the lower extremity: a retrospective analysis. J Dermatol Surg Oncol 1990;16:327-30. 47. Fronek H. Noninvasive examination of the venous system in the leg. presclerotherapy evaluation. J Dermatol Surg Oncol 1989;15:170-3. 48. DeGroot W. Practical phleboloby: sclerotherapy of large veins. J Dermatol Surg Oncol 1991;17:589-95. 49. Zimmet S. The prevention of cutaneous necrosis following extravasaton of hypertonic saline and sodium tetadecyl sulfate. J Dermatol Surg Oncol 1993;19:641-6. 50. Zimmet S. Hyaluronidase in the prevention of sclerotherapy-induced extravasation necrosis: a dose response study. Dermatol Surg 1996;22:73-6. 51. Goldman M, Beaudoing D, Marley W, Lopez L, Butie A. Compression in the treatment of leg telangiectasia: a preliminary report. J Dermatol Surg Oncol 1990;16:322-5. 52. Weiss R, Sadick N, Goldman M, Weiss M. Post-sclerotherapy compression: controlled comparative study of duration of compression and its effects on clinical outcome. Dermatol Surg 1995;25:105-8. 53. Goldman M, Sadick N, Weiss R. Cutaneous necrosis, telangiectatic matting, and hyperpigmentation following sclerotherapy: etiology, prevention, and treatment. Dermatol Surg 1995;21:19-29. 54. Ramelet A-A. Compression therapy. Dermatol Surg 2002;28:6-10. 55. Weiss R, Weiss M. Incidence of side effects in the treatment of telangiectasias by compression sclerotherapy: hypertonic saline vs. policocanol. J Dermatol Surg Oncol 1990;16:800-4. 28) Bihari I, Magyar E. Reasons for ulceration after injection treatment of telangiectasia. Dermatol Surg 2001;27:133-6. 56. Frullini A, Cavezzi A. Sclerosing foam in the treatment of varicose veins and telangiectases: history and analysis of safety and complications. Dermatol Surg 2002;28:11-5. 57. Tessari L, Cavezzi A, Frullini A. Preliminary experience with a new sclerosing foam in the treatment of varicose veins. Dermatol Surg 2001;27:58-60. 58. Bowes L, Goldman M. Sclerotherapy of tericular and telangiectatic veins of the face, hands, and chest. Dermatol Surg 2002;28:46-51. 59. Dover J, Sadick N, Goleman M. The role of lasers and light sources n the treatment of leg veins. Dermatol Surg 1999;25:328-36. 60. Yamaki T, Nozaki M, Fujiwara O, Yoshida E. Comparative evaluation of duplex-derived parameters in patients with chronic venous insufficiency: correlation with clinical manifestations. J Am Coll Surg. 2002;195:822–30. 61. Evans CJ, Allan PL, Lee AJ, Bradbury AW, Ruckley CV, Fowkes FG. Prevalence of venous reflux in the general population on duplex scanning: the Edinburgh vein study. J Vasc Surg. 1998;28:767–76. 62. Michaels JA, Brazier JE, Campbell WB, Macintyre JB, Palfreyman SJ, Ratcliffe J. Randomized clinical trial comparing surgery with conservative treatment for 84 uncomplicated varicose veins. Br J Surg. 2006;93:175–81. 63. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. Stripping the long saphenous vein reduces the rate of reoperation for recurrent varicose veins: five-year results of a randomized trial. J Vasc Surg. 1999;29:589–92. 64. Winterborn RJ, Foy C, Earnshaw JJ. Causes of varicose vein recurrence: late results of a randomized controlled trial of stripping the long saphenous vein. J Vasc Surg. 2004;40:634–9. 65. Labropoulos N, Leon M, Nicolaides AN, Giannoukas AD, Volteas N, Chan P. Superficial venous insufficiency: correlation of anatomic extent of reflux with clinical symptoms and signs. J Vasc Surg. 1994;20:953–8. 66. Labropoulos N, Delis K, Nicolaides AN, Leon M, Ramaswami G. The role of the distribution and anatomic extent of reflux in the development of signs and symptoms in chronic venous insufficiency. J Vasc Surg. 1996;23:504–10. 67. Schmedt CG, Sroka R, Steckmeier S, Meissner OA, Babaryka G, Hunger K, et al. Investigation on radiofrequency and laser (980 nm) effects after endoluminal treatment of saphenous vein insufficiency in an ex-vivo model. Eur J Vasc Endovasc Surg. 2006;32:318–25. 68. Tungjitkusolmun S, Haemmerich D, Cao H, Tsai JZ, Choy YB, Vorperian VR, et al. Modeling bipolar phase-shifted multielectrode catheter ablation. IEEE Trans Biomed Eng. 2002;49:10–7. 69. Schmedt CG, Meissner OA, Hunger K, Babaryka G, Ruppert V, Sadeghi-Azandaryani M, et al. Evaluation of endovenous radiofrequency ablation and laser therapy with endoluminal optical coherence tomography in an ex vivo model. J Vasc Surg. 2007;45:1047–58. 70. Bacon JL, Dinneen AJ, Marsh P, Holdstock JM, Price BA, Whiteley MS. Five-year results of incompetent perforator vein closure using TRans-Luminal Occlusion of Perforator. Phlebology. 2009;24:74–8. 71. Chandler JG, Pichot O, Sessa C, Schuller-Petrovic S, Osse FJ, Bergan JJ. Defining the role of extended saphenofemoral junction ligation: a prospective comparative study. J Vasc Surg. 2000;32:941–53. 72. Manfrini S, Gasbarro V, Danielsson G, Norgren L, Chandler JG, Lennox AF, et al. Endovenous management of saphenous vein reflux. Endovenous Reflux Management Study Group. J Vasc Surg. 2000;32:330–42. 73. Weiss RA. Comparison of endovenous radiofrequency versus 810 nm diode laser occlusion of large veins in an animal model. Dermatol Surg. 2002;28:56–61. 74. Merchant RF, DePalma RG, Kabnick LS. Endovascular obliteration of saphenous reflux: a multicenter study. J Vasc Surg. 2002;35:1190–6. 75. Merchant RF, Pichot O. Long-term outcomes of endovenous radiofrequency obliteration of saphenous reflux as a treatment for superficial venous insufficiency. J Vasc Surg. 2005;42:502–9. 76. Rautio T, Ohinmaa A, Perala J, Ohtonen P, Heikkinen T, Wiik H, et al. Endovenous obliteration versus conventional stripping operation in the treatment of primary varicose veins: a randomized controlled trial with comparison of the costs. J Vasc Surg. 2002;35:958–65. 77. Perala J, Rautio T, Biancari F, Ohtonen P, Wiik H, Heikkinen T, et al. Radiofrequency endovenous obliteration versus stripping of the long saphenous vein in the management of primary varicose veins: 3-year outcome of a randomized study. Ann Vasc Surg. 2005;19:669–72. 78. Lurie F, Creton D, Eklof B, Kabnick LS, Kistner RL, Pichot O, et al. Prospective randomized study of endovenous radiofrequency obliteration (closure procedure) versus ligation and stripping in a selected patient population (EVOLVeS Study). J Vasc Surg. 2003;38:207–14. 79. Lurie F, Creton D, Eklof B, Kabnick LS, Kistner RL, Pichot O, et al. Prospective randomised study of endovenous radiofrequency obliteration (closure) versus ligation and vein stripping (EVOLVeS): two-year follow-up. Eur J Vasc Endovasc Surg. 2005;29:67–73. 85 80. Rautio TT, Perala JM, Wiik HT, Juvonen TS, Haukipuro KA. Endovenous obliteration with radiofrequency-resistive heating for greater saphenous vein insufficiency: a feasibility study. J Vasc Interv Radiol. 2002;13:569–75. 22. Stotter L, Schaaf I, Bockelbrink A. Comparative outcomes of radiofrequency endoluminal abaltion, invagination stripping, and cryostripping in the treatment of great saphenous vein insufficiency. Phlebology. 2006;21:60–4. 81. Hinchliffe RJ, Ubhi J, Beech A, Ellison J, Braithwaite BD. A prospective randomised controlled trial of VNUS closure versus surgery for the treatment of recurrent long saphenous varicose veins. Eur J Vasc Endovasc Surg. 2006;31:212– 8. 82. Almeida JI, Raines JK. Radiofrequency ablation and laser ablation in the treatment of varicose veins. Ann Vasc Surg. 2006;20:547–52. 83. Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Endovenous laser therapy and radiofrequency ablation of the great saphenous vein: analysis of early efficacy and complications. J Vasc Surg. 2005;42:488–93. 84. Gale SS, Lee JN, Walsh ME, Wojnarowski DL, Comerota AJ. A randomized, controlled trial of endovenous thermal ablation using the 810-nm wavelength laser and the ClosurePLUS radiofrequency ablation methods for superficial venous insufficiency of the great saphenous vein. J Vasc Surg. 2010;52:645–50. 85. Almeida JI, Kaufman J, Gockeritz O, Chopra P, Evans MT, Hoheim DF, et al. Radiofrequency endovenous ClosureFAST versus laser ablation for the treatment of great saphenous reflux: a multicenter, single-blinded, randomized study (RECOVERY study). J Vasc Interv Radiol. 2009;20:752–9. 86. Shepherd AC, Gohel MS, Brown LC, Metcalfe MJ, Hamish M, Davies AH. Randomized clinical trial of VNUS ClosureFAST radiofrequency ablation versus laser for varicose veins. Br J Surg. 2010;97:810–8. 87. Shepherd AC, Gohel MS, Lim CS, Hamish M, Davies AH. Pain following 980-nm endovenous laser ablation and segmental radiofrequency ablation for varicose veins: a prospective observational study. Vasc Endovascular Surg. 2010;44:212–6. 88. Goode SD, Chowdhury A, Crockett M, Beech A, Simpson R, Richards T, et al. Laser and radiofrequency ablation study (LARA study): a randomised study comparing radiofrequency ablation and endovenous laser ablation (810 nm). Eur J Vasc Endovasc Surg. 2010;40:246–53. 89. Dunn CW, Kabnick LS, Merchant RF, Owens R, Weiss RA. Endovascular radiofrequency obliteration using 90 degrees C for treatment of great saphenous vein. Ann Vasc Surg. 2006;20:625–9. 32. Zikorus AW, Mirizzi MS. Evaluation of setpoint temperature and pullback speed on vein adventitial temperature during endovenous radiofrequency energy delivery in an in-vitro model. Vasc Endovascular Surg. 2004;38:167–74. 86 APÉNDICE - PARÁMETROS DE TRATAMIENTO DE DIFERENTES CASAS FABRICANTES - CONSENTIMIENTOS INFORMADOS 87 88 Nota: En los tratamientos realizados mediante el láser Cynergy de Cynosure®, únicamente con la longitud de onda 1064, Nd:YAG, los pará,etros de tratamiento son superponibles a los realizados con el láser CoolGlide Excel V, CoolGlkide Vantage o CoolGlide Excel de Cutera™. 89 90 91 92 Dr. Hilario Robledo MD, PhD, FACS, PhL, ABLS, FFMACCS, FEACS Cirugía General y del Aparato Digestivo Doctorado en Medicina y Cirugía Fellow American College of Surgeons American Board of Laser Surgery Fellow Australasian College of Cosmetic Surgery Fellow European Academy of Cosmetic Surgery Jefe Sección Cirugía General-SERGAS (exced,) Funcionario Carrera Estado (exced.) Colegiado Nº: 363604489 Centro Médico Láser Vigo - CMLV Avenida de las Camelias 31 36202 Vigo. Pontevedra. Spain. Tel.: + 34 986 485213 Fax: +34 986 414142 Móvil: 616003003 E-mail: hrobledo@mundo-r.com Centrolaser@mundo-r.com http:// www.cmlv.es http://www.centrolaservigo.com CONSENTIMIENTO PARA ESCLEROTERAPIA 1/2 1. Yo ..............................................................(poner nombre completo del paciente), habiéndoseme explicado detalladamente y en términos claros y sencillo los objetivos, alcances, características y consecuencias del tratamiento, autorizo al Dr. Hilario Robledo, Cirujano, Colegiado Nacional número: 363604489 y a su equipo a realizarme tratamiento de escleroterapia de varices, varículas o telangiectasias en (localización)................................................................................................................................ . Este procedimiento consiste en la inyección dentro de las venas de un agente esclerosante en su forma líquida o de microespuma que irrita la capa endotelial de esa vena, produciendo una inflamación o trombosis de la misma y una fibrosis posterior que hace que la vena se reduzca a la mínima expresión. 2. El procedimiento enunciado en el punto 1° me ha sido totalmente explicada por el médico, por lo que entiendo la naturaleza, alcances y eventuales consecuencias de su realización, y estoy en conocimiento de cada uno de los eventuales riesgos que pudiesen sobrevenir con motivo del tratamiento mencionado. Se me ha dado la oportunidad de hacer preguntas y todas ellas me han sido contestadas satisfactoriamente. Los siguientes puntos me han sido específicamente aclarados: a) Las complicaciones que pueden originarse como consecuencia de la realización de tratamientos esclerosantes pueden ser las descriptas en la bibliografía médica, todas las cuales me han sido informadas, enunciándose a continuación, a título ejemplificativo, las siguientes: inflamación, alteraciones en la coloración de la piel (hiperpigmentación temporal: 25-30% (6-24 meses, el 50% de ellas desapracen sin la necesidad de tratamiento, en los otros casos hay que utilizar algún tipo de tratamiento preferentemente láser Q-Switched, tratamiento no incluido en el presupuesto que se le ha dado), formación de hematomas que se resuelven de forma espontánea, formación de cordones venosos (propios de la esclerosis y que desaparecen con el tiempo), en algunas ocasiones se requiere trombectomía (retirar los trombos del interior de la vena esclerosada, esto no es una complicación sino que forma parte del tratamiento de sus venas) mediante un sencillo procedimiento a las 1-2 semanas de haber realizado la esclerosis (este procedimiento está contemplado dentro del presupuesto que se le ha dado), foliculitis (infección de pelos por compresión que es raro y leve, ampollas alrededor de las almohadillas de compresión (pads de compresión) que es normal y desaparecen por si solas al retirar las mismas, reacciones alérgicas, flebitis, úlceras (necrosis cutánea localizada), necesidad de nuevos tratamientos por revascularización de alguna de las venas esclerosadas 20-100% a los 5 años, especialmente si no ha habido compresión (vendas, medias después del tratamiento), y en casos raros pero descritos en la literatura: trombosis venosa profunda (1/10.000), tromboflebitis, embolismo pulmonar (1/40.000), inyección arterial (extremadamente rara y grave).----------b) Para la realización del presente tratamiento está prevista la realización de una cantidad de sesiones que se le informará al paciente, las que podrán incrementarse o reducirse en relación a la respuesta de mi organismo. -----------------------------------------------------c) Estoy en conocimiento que el hecho de someterme a tratamiento esclerosante en una zona determinada no impide que se desarrollen nuevas varices o spiders vasculares en otras localizaciones (matting/neotelangiectasias), las que podrán ser también pasibles del mismo tratamiento o mediante láser - Matting telangiectásico: (aparición de venitas rojas que antes no notaba 5-75%, habitualmente se resuelve de forma espotánea en el Centro MédiCo Láser Vigo AVenidA de LAs CAMeLiAs, 31 - 36202 Vigo. tLf: 986 485213 - teL/fAx: 986 414142 centrolaser@mundo-r.com - www.cmlv.es - www.vigolaser.com - www.centrolaservigo.com 93 94 95 96 97 98