P kP dt dP =
Anuncio

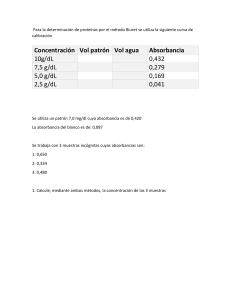
PRIMER EXAMEN PARCIAL DE CINÉTICA QUÍMICA. Febrero 28 de 2013 Dra. Silvia E. Castillo Blum Nombre ___________________________________________________________________ 1. La reacción 2NO + H2 = N2O + H2O llega a terminación y se sabe que sigue la siguiente ley de velocidad: dPN2O dt kPNO PH2 2 Se obtuvieron los datos que se muestran en la siguiente tabla: Corrida PNO0/mmHg PH20/mmHg 1 2 3 4 5 600 600 10 20 600 10 20 600 600 10 Tiempo de vida media, s 19.2 830 10 Temperatura, 0 C 820 820 820 820 840 (Los tiempos de vida media son el tiempo para que la mitad de reacción se lleve a cabo. Las corridas se efectuaron a temperatura y volumen constante) a) Agregue los tiempos de vida media faltantes, y una explicación de su respuesta. b) Calcule k a 8200C en mm Hg-2s-1. c) Calcule la energía de activación. Esto es suficiente para escribir una ecuación en la cual la E* es sólo una cantidad no numérica. 2. Una reacción de primer orden, por ejemplo Co(NH3)5Br2+ + H2O = Co(NH3)5(H2O)3+ + Br- , ocurre en disolución y su progreso es seguido por mediciones periódicas de la absorbancia. La reacción se lleva a cabo completamente. Dado que la absorbancia, A es 0.80 después de 20 min de reacción, 0.35 después de 40 min y 0.20 en el tiempo infinito; calcule la constante de velocidad y la absorbancia al tiempo cero. 3. Una reacción de segundo orden cuyos reactivos se encuentran inicialmente en una concentración 0.1mol dm-3, ha reaccionado un 20%en 40 min. Calcular: a) La constante de velocidad. b) Tiempo de vida media. c) El tiempo que tomaría para que la reacción se lleve a cabo en un 20% si las concentraciones iniciales fueran 0.01mol por litro.