geometría molecular – material
Anuncio

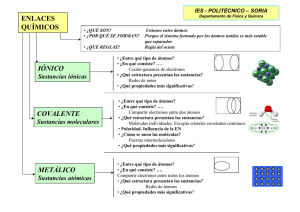
GEOMETRÍA MOLECULAR La forma de combinarse los átomos y los tipos de fuerza que los unen son aspectos importantes a estudiar. Según Pauling, un enlace químico entre dos átomos se produce, cuando se forma un compuesto de determinada estabilidad. Al formarse una molécula se desprende energía, se forma una entidad más estable. La palabra enlace describe todas las interacciones que mantienen unidos los átomos de una molécula estable. Los enlaces se forman cuando los átomos se combinan como resultado de los cambios en la distribución electrónica. Una molécula es un conjunto de átomos que tienen características propias. ¿Por qué algunos átomos se unen para formar moléculas y otros no? Por ej. H H, da H2, pero el helio no se une con otros átomos. ¿Por qué las moléculas tienen formas determinadas? Por ej. CO2 es lineal, H2O es angular. Existen parámetros que describen el enlace: Energía de enlace, longitud de enlace, electronegatividad, polaridad, simetría de enlace, tensión, distancia interatómica, ángulos de enlace. ÁNGULOS DE ENLACE: es el ángulo formado entre las distancias interatómicas. RADIO COVALENTE: es la distancia efectiva entre los núcleos de dos átomos. ENERGÍA DE ENLACE: para una molécula diatómica, es la variación de entalpía que se produce en la disociación de una molécula gaseosa a 298 K para átomos gaseosos en su estado fundamental. ELECTRONEGATIVIDAD: es la capacidad que tiene un átomo de atraer los electrones de un enlace hacia sí. La disposición de los átomos en una molécula puede predecirse por medio de la teoría RPENV (repulsión de pares de electrones del nivel de valencia) que expresa: 1. Un átomo central se une a uno o más átomos. 2. Los pares de electrones en el átomo central toman posiciones alejadas. 3. Los pares de electrones que se comparten se llaman pares de enlace y los que no se comparten, pares no enlazantes. Los pares de electrones no enlazantes determinan la posición de los átomos en las moléculas. 5° Química - 2011 Prof. Ambar Suárez GEOMETRÍA PARA MOLÉCULAS CON ENLACES SIMPLES GEOMETRÍA FORMULA MOLECULAR N° PARES DE ENLACE N° PARES NO ENLAZANTES Lineal AX2 HgCl2 2 0 Triangular AX3 BF3 3 0 Tetraédrica AX4 CH4 4 0 Pirámide trigonal AX3 NH3 3 1 Octaédrica (bipirámide base cuadrada) AX6 SF6 6 0 Angular AX2 H2O 2 2 Bipirámide Trigonal AX6 PCl5 5 0 AX4 IF4- 4 2 AX5 BrF5 5 1 Cuadrada plana Pirámide de base cuadrada EJEMPLOS 5° Química - 2011 Prof. Ambar Suárez