Ajuste por tanteo
Anuncio

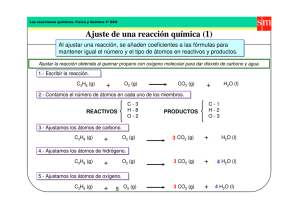
AJUSTE DE UNA REACCIÓN QUÍMICA (Método de tanteo) Una ecuación química ajustada indica los reactivos y productos que intervienen en la reacción, así como la proporción en que lo hacen. El ajuste de una ecuación se basa en la ley de conservación de la materia, de tal forma que el número de átomos de cada tipo que hay antes de que se produzca la reacción tiene que ser el mismo que al final. De esta forma, la ecuación está ajustada cuando hay igual número de átomos de cada elemento en ambos miembros. Por ejemplo, la ecuación H20 —> H2 + O2 NO está ajustada, porque en el primer miembro hay un sólo átomo de O y en el segundo miembro hay dos. Sin embargo, la ecuación 2H20 —> 2 H2 + O2 SI está ajustada, porque en ambos miembros hay 4 átomos de H y 2 átomos de O. El método más utilizado en química para ajustar una ecuación es el de tanteo. Los pasos a seguir pueden verse en el siguiente ejemplo. C3H8 + O2 —> CO2 + H2O El primer caso consiste en asignar arbitrariamente un coeficiente a una de las sustancias (normalmente el “1" y a la sustancia más compleja). 1 C3H8 + O2 —> CO2 + H2O A continuación igualamos por carbonos (como hay 3 en el primer miembro le ponemos un 3 al CO2 1 C3H8 + O2 —> 3 CO2 + H2O ahora está igualado por carbonos Después igualamos por H (como hay 8 en el primer miembro tendremos que poner un coeficiente 4 al H2O , para que haya 4 x 2 = 8 H) 1 C3H8 + O2 —> 3 CO2 + 4 H2O El siguiente paso será ajustar por átomos de O. En el segundo miembro tenemos 3 x 2 + 4 x 1 = 10. Para igualar habrá que poner coeficiente 5 al O2 1 C3H8 + 5 O2 —> 3 CO2 + 4 H2O Aparentemente ya está igualada, pero conviene repasar y comprobar que todos los átomos están ajustados Solución: C3H8 + 5 O2 —> 3 CO2 + 4 H2O