Estados de agregación de la materia La materia puede presentarse
Anuncio
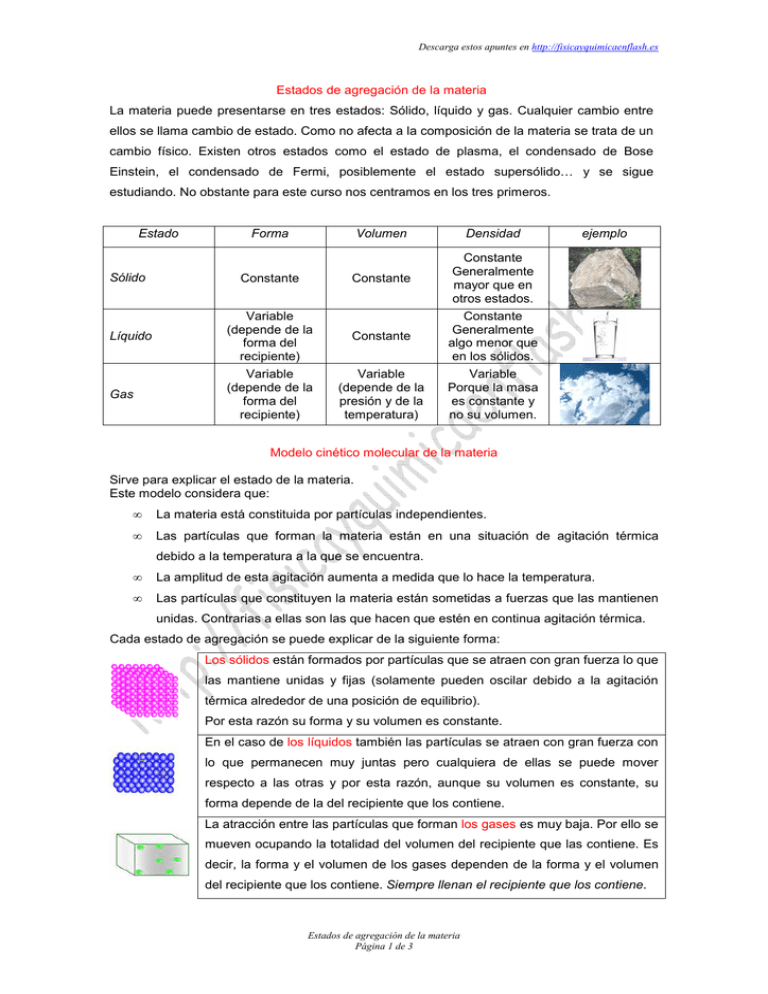
Descarga estos apuntes en http://fisicayquimicaenflash.es Estados de agregación de la materia La materia puede presentarse en tres estados: Sólido, líquido y gas. Cualquier cambio entre ellos se llama cambio de estado. Como no afecta a la composición de la materia se trata de un cambio físico. Existen otros estados como el estado de plasma, el condensado de Bose Einstein, el condensado de Fermi, posiblemente el estado supersólido… y se sigue estudiando. No obstante para este curso nos centramos en los tres primeros. Estado Sólido Líquido Gas Forma Volumen Constante Constante Variable (depende de la forma del recipiente) Variable (depende de la forma del recipiente) Constante Variable (depende de la presión y de la temperatura) Densidad ejemplo Constante Generalmente mayor que en otros estados. Constante Generalmente algo menor que en los sólidos. Variable Porque la masa es constante y no su volumen. Modelo cinético molecular de la materia Sirve para explicar el estado de la materia. Este modelo considera que: • La materia está constituida por partículas independientes. • Las partículas que forman la materia están en una situación de agitación térmica debido a la temperatura a la que se encuentra. • La amplitud de esta agitación aumenta a medida que lo hace la temperatura. • Las partículas que constituyen la materia están sometidas a fuerzas que las mantienen unidas. Contrarias a ellas son las que hacen que estén en continua agitación térmica. Cada estado de agregación se puede explicar de la siguiente forma: Los sólidos están formados por partículas que se atraen con gran fuerza lo que las mantiene unidas y fijas (solamente pueden oscilar debido a la agitación térmica alrededor de una posición de equilibrio). Por esta razón su forma y su volumen es constante. En el caso de los líquidos también las partículas se atraen con gran fuerza con lo que permanecen muy juntas pero cualquiera de ellas se puede mover respecto a las otras y por esta razón, aunque su volumen es constante, su forma depende de la del recipiente que los contiene. La atracción entre las partículas que forman los gases es muy baja. Por ello se mueven ocupando la totalidad del volumen del recipiente que las contiene. Es decir, la forma y el volumen de los gases dependen de la forma y el volumen del recipiente que los contiene. Siempre llenan el recipiente que los contiene. Estados de agregación de la materia Página 1 de 3 Descarga estos apuntes en http://fisicayquimicaenflash.es Cambios de estado La materia puede presentarse en cualquiera de los tres estados de agregación anteriormente citados. El estado de la materia dependerá de los valores de la presión y la temperatura a los que se encuentre. El paso de un estado a otro se llama cambio de estado y se trata de un cambio físico. Sublimación Vaporización Fusión Sólido Líquido Gas Condensación Solidificación Sublimación inversa o regresiva Cambios de estado Los cambios de estado pueden explicarse desde la teoría cinético molecular de la materia. El aumento de temperatura supone un incremento en el nivel de agitación térmica de las moléculas que constituyen la materia. Cuando el estado de agitación aumenta debido a un incremento de la temperatura, la amplitud de oscilación aumente puede ocurrir que las partículas abandonen su posición inicial fluyendo respecto de las otras. Se ha llegado al estado líquido y se ha producido la fusión. Si seguimos aumentando la temperatura puede que las partículas amplíen tanto sus movimientos que puedan ocupar cualquier posición en el recipiente que las contiene con lo que se llega al estado gas. Es el proceso de vaporización. El efecto contrario se produce cuando la temperatura desciende desde el estado gaseoso al líquido (condensación) y luego al sólido (solidificación). Mientras se está produciendo un cambio de estado la temperatura del sistema permanece constante. Ejemplo: se calienta hielo que está a una temperatura de –10ºC su temperatura asciende hasta llegar a 0ºC (punto de fusión del agua). Mientras coexisten el hielo y el agua líquida la temperatura permanece constante a 0ºC aunque se siga suministrando calor. Cuando ya se ha fundido todo el hielo si se sigue calentando la temperatura del líquido sigue ascendiendo hasta llegar a 100ºC (punto de ebullición del agua) entonces el líquido se transforma en vapor. Mientras siga habiendo agua líquida la temperatura sigue a 100ºC. Solamente cuando no hay líquido, si se sigue suministrando calor, la temperatura del gas asciende por encima de 100ºC. Vapor El proceso de vaporización puede darse a cualquier temperatura. Cuando es a una temperatura inferior a la de ebullición hablamos de evaporación. Se trata de un proceso en el Estados de agregación de la materia Página 2 de 3 Descarga estos apuntes en http://fisicayquimicaenflash.es que se establece un equilibrio entre las moléculas de líquido que pasan a estado vapor y las moléculas de gas que pasan a estado líquido. Cuando el recipiente está cerrado este equilibrio se mantienen. Sin embargo, si el recipiente está abierto, estas moléculas pueden ser arrastradas por el aire y no vuelven a líquido con lo que la cantidad de líquido del citado recipiente disminuye y puede llegar a desaparecer con el tiempo. También puede producirse un paso directo de sólido a gas sin pasar por el estado líquido y también a la inversa de gas a sólido. Se trata de un proceso de sublimación o, en el segundo caso, sublimación inversa. Ejemplo: Un ambientador sólido pasa directamente a gas sin pasar por estado líquido. Otro ejemplo es lo que le ocurre al Yodo sólido cuando calienta pasa directamente a gas. Si se coloca sobre los vapores un vidrio de reloj con un trozo de hielo se condensan a sólido inmediatamente. Figuritas de ambientador Yodo sólido Sublimación yodo Estados de agregación de la materia Página 3 de 3 Sublimación inversa del yodo



