Métodos ópticos. TP 6.
Anuncio
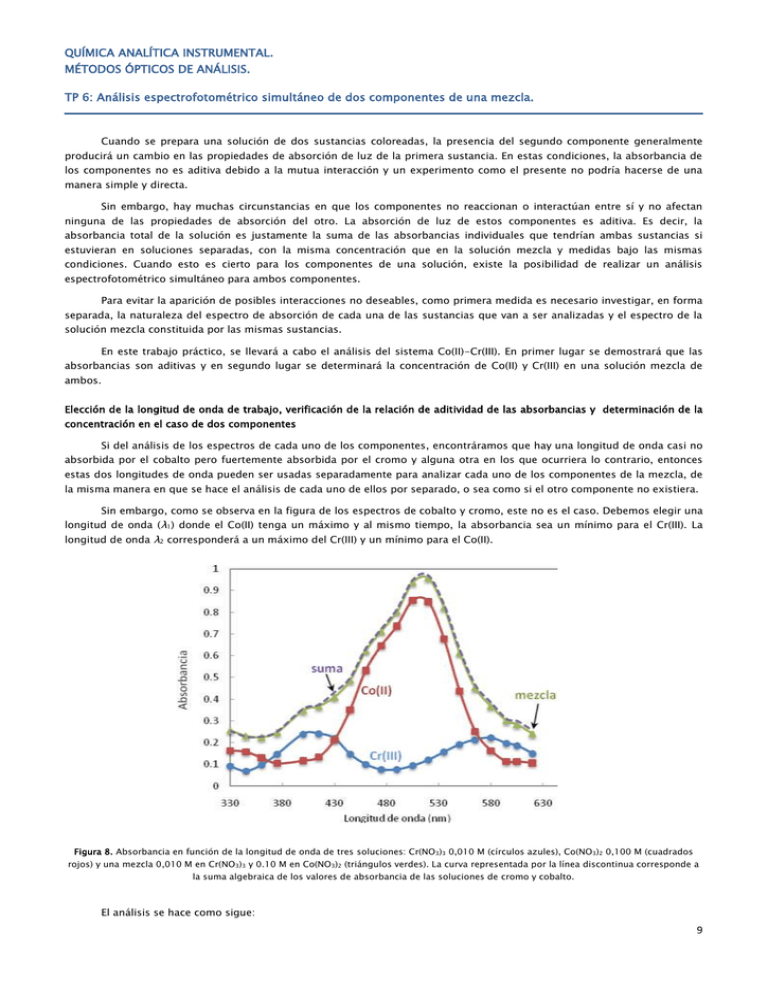
QUÍMICA ANALÍTICA INSTRUMENTAL. MÉTODOS ÓPTICOS DE ANÁLISIS. TP 6: Análisis espectrofotométrico simultáneo de dos componentes de una mezcla. Cuando se prepara una solución de dos sustancias coloreadas, la presencia del segundo componente generalmente producirá un cambio en las propiedades de absorción de luz de la primera sustancia. En estas condiciones, la absorbancia de los componentes no es aditiva debido a la mutua interacción y un experimento como el presente no podría hacerse de una manera simple y directa. Sin embargo, hay muchas circunstancias en que los componentes no reaccionan o interactúan entre sí y no afectan ninguna de las propiedades de absorción del otro. La absorción de luz de estos componentes es aditiva. Es decir, la absorbancia total de la solución es justamente la suma de las absorbancias individuales que tendrían ambas sustancias si estuvieran en soluciones separadas, con la misma concentración que en la solución mezcla y medidas bajo las mismas condiciones. Cuando esto es cierto para los componentes de una solución, existe la posibilidad de realizar un análisis espectrofotométrico simultáneo para ambos componentes. Para evitar la aparición de posibles interacciones no deseables, como primera medida es necesario investigar, en forma separada, la naturaleza del espectro de absorción de cada una de las sustancias que van a ser analizadas y el espectro de la solución mezcla constituida por las mismas sustancias. En este trabajo práctico, se llevará a cabo el análisis del sistema Co(II)-Cr(III). En primer lugar se demostrará que las absorbancias son aditivas y en segundo lugar se determinará la concentración de Co(II) y Cr(III) en una solución mezcla de ambos. Elección de la longitud de onda de trabajo, verificación de la relación de aditividad de las absorbancias y determinación de la concentración en el caso de dos componentes Si del análisis de los espectros de cada uno de los componentes, encontráramos que hay una longitud de onda casi no absorbida por el cobalto pero fuertemente absorbida por el cromo y alguna otra en los que ocurriera lo contrario, entonces estas dos longitudes de onda pueden ser usadas separadamente para analizar cada uno de los componentes de la mezcla, de la misma manera en que se hace el análisis de cada uno de ellos por separado, o sea como si el otro componente no existiera. Sin embargo, como se observa en la figura de los espectros de cobalto y cromo, este no es el caso. Debemos elegir una longitud de onda (λ1) donde el Co(II) tenga un máximo y al mismo tiempo, la absorbancia sea un mínimo para el Cr(III). La longitud de onda λ2 corresponderá a un máximo del Cr(III) y un mínimo para el Co(II). Figura 8. Absorbancia en función de la longitud de onda de tres soluciones: Cr(NO3)3 0,010 M (círculos azules), Co(NO3)2 0,100 M (cuadrados rojos) y una mezcla 0,010 M en Cr(NO3)3 y 0.10 M en Co(NO3)2 (triángulos verdes). La curva representada por la línea discontinua corresponde a la suma algebraica de los valores de absorbancia de las soluciones de cromo y cobalto. El análisis se hace como sigue: 9 - Si cada componente j cumple con la ley de Lambert-Beer, entonces, para una longitud de onda determinada: - Utilizando la misma cubeta para cada muestra a analizar, el factor b será el mismo, entonces combinando ελij y b, como una constante de extinción kλij queda: En esta ecuación, kλij es la constante de proporcionalidad que relaciona la absorbancia Aλij y la concentración Cj, para una sustancia j, a una determinada longitud de onda λi. Si preparamos una serie de soluciones de la sustancia j, de distinta concentración, medimos su absorbancia y graficamos estas lecturas en función de la concentración, obtendremos una recta de pendiente kλij. - Para una solución que contiene n componentes que absorben la luz, cuyas absorbancias son aditivas, la absorbancia total de la solución a una determinada longitud de onda λi, debe ser representada como la sumatoria de las absorbancias individuales: donde Aλi es la absorbancia a la longitud de onda λi, Cj es la concentración molar de j y kλij = ελijb (ελij es la absortividad molar y b el camino óptico). El subíndice j se refiere al componente, el subíndice i se refiere a la longitud de onda usada. - Para un sistema de dos componentes (A y B), utilizando dos longitudes de onda diferentes (λ1 y λ2), las ecuaciones a emplear para el análisis serán: - Resolviendo este sistema, se puede determinar simultáneamente la concentración de los dos componentes en la mezcla, previa determinación de los constantes de extinción: kλ1A, kλ1B, kλ2A y kλ2B, a partir de las gráficas de Beer construidas con valores de absorbancia y concentración de soluciones patrón. Desarrollo experimental Equipo: Espectrofotómetro Spectronic 20 Espectrofotómetro doble haz Cintra Soluciones: Nitrato de cobalto Co(NO3)2 de distintas concentraciones. Nitrato de cromo Cr(NO3)3 de distintas concentraciones. Mezcla Co(NO3)2 / Cr(NO3)3 de concentración conocida. Mezcla desconocida. Materiales necesarios: Cubetas plásticas Papel tipo Tissue Procedimiento: I. Demostrar la aditividad de la absorbancia de las soluciones de Cr(III) y Co(II) a) Se dispondrá de las siguientes soluciones en frascos goteros (verificar las concentraciones con las que se usarán en l la práctica): - Cr(NO3)3 0,010 M. - Co(NO3)2 0,100 M. - Mezcla 0,010 M en Cr(NO3)3 y 0,100 M en Co(NO3)2. b) Determinar el espectro de absorción de las soluciones preparadas en a), contra agua destilada como blanco. Hacer lecturas a: 375, 400, 410, 425, 440, 455, 470, 480, 490, 500, 510, 520, 530, 540, 550, 570, 575, 580, 600 y 625 nm. 10 c) En un mismo gráfico representar los tres espectros experimentales y la suma algebraica de las absorbancias de las soluciones Cr(NO3)3 0,010 M y Co(NO3)2 0,100 M. Los puntos de esta suma deben coincidir con la curva de la mezcla, demostrando que la condición de no interacción se cumple en este sistema. Medidas experimentales de absorbancia λ / nm A1: Cr (III) 0,010 M A2: Co (II) 0,100 M A3: Mezcla Cr/Co Suma algebraica A1 + A2 375 400 … II. Determinación de las constantes k de las gráficas de la ley de Lambert-Beer. a) Se dispondrá de las siguientes soluciones en frascos goteros (verificar las concentraciones con las que se usarán en l la práctica): - Cr(NO3)3 0,005 M, 0,010 M, 0,015 M. - Co(NO3)2 0,050 M, 0,10 M, 0,15 M. b) Seleccionar de los espectros de Cr y Co, las longitudes de onda λ1 y λ2 adecuadas para hacer las lecturas de absorbancia de las seis soluciones anteriores. Recordar que deben escogerse aquellas longitudes de onda para las cuales la diferencia entre la absorbancia de Cr y de Co sea máxima. c) Para cada longitud de onda medida, graficar absorbancia vs. concentración para cada compuesto. Recordar que las rectas deben pasar por el origen. En la figura 9 se muestran dos gráficos esquemáticos, representando el procedimiento en cuestión. Figura 9. Absorbancia en función de la concentración de soluciones patrón de Cr(NO 3)3 (izquierda) y Co(NO3)2 (derecha). d) A partir de las pendientes, determinar los valores de k. III. Determinación de la concentración de Cr y Co en una solución problema A las mismas longitudes de onda del punto anterior, medir la absorbancia de la muestra desconocida. Determinar la concentración de Cr y Co en la muestra, reemplazando los valores de k correspondientes y resolviendo el siguiente sistema de ecuaciones: Bibliografía - Reilly, C. N., Sawyer, D. T., Experiments for Instrumental Methods, McGraw-Hill, 1961. 11

