Proteínas Fibrosas
Anuncio

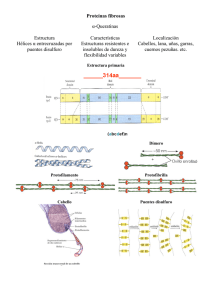
Proteínas Fibrosas • La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje • Las proteínas fibrosas son generalmente fuertes mecánicamente • Son generalmente insolubles • Generalmente tiene un papel estructural Proteínas fibrosas •Función estructural •Piel, tejido conectivo, fibras (pelo, lana, seda) •Secuencia favorece tipo especial de estructura 2ria ⇒ propiedades mecánicas especiales •Alfa Queratinas •Beta-Queratinas •Fibroína •Colágeno •Elastina Estructuras secundarias y propiedades de proteínas fibrosas Estructura α-hélix,enlaces cruzados por puentes S-S Característica Resistente,insoluble dureza y flexibilidad variable Ejemplo α-queratina (cabello, cuernos) Conformación β Filamentos suaves, flexibles Fibroína de seda Triple hélice colágeno Alta fuerza de tensión Colágeno en tendón no se estira, matriz ósea Cadenas de elastina con enlaces X-ados por desmosina y lisnorleu Estiramiento en 2 direcciones con elasticidad Elastina de ligamentos Alfa Queratina • En cabello, uñas, garras, cuernos y picos • Secuencia consiste de segmentos cilíndricos αhelicoidales de 311-314 residuos con extremos Ny C- terminales no helicoidales • Estructura primaria de hélices consiste de repeticiones de 7 residuos : (a-b-c-d-e-f-g)n • a y d son no polares. Promueve asociación de hélices! g c e’ d f b e a no polar b’ a’ f’ d’ g’ c’ α-hélice: 5.4 Å /vuelta cabello: 5.15-5.2 Å /vuelta C-terminal dominio globular α-queratina pelo, lana, uñas, garras, cuernos, cascos α-hélice: 5.4 Å /vuelta cabello: 5.15-5.2 Å /vuelta α-hélice: hacia la derecha coiled coil: hacia la izquierda (superhelix) superficie de contacto: aa. hidrof. Forma complejos supramoleculares: p.ej. filamentos intermedios Fuerza: x-links covalentes que estabilizan estructura 4naria: S-S lana: Cys 11%, cuerno rino 18% Calor húmedo estira el cabello: α-hélices se estiran hacia conf. β Enfriamiento: α-hélices regresan Colágeno – Una Triple Hélice Componente principal de tejido conectivo (tendones, cartílago, hueso, dientes) • unidad básica es tropocolágeno: – 3 cadenas polipeptídicas enrolladas (1000 residuos cada uno) – MW = 285,000 – 300 nm largo, 1.4 nm diámetro – composición única de aminoácidos Colágeno • Cerca de 1 de cada 3 residuos es Gly • Contenido de Prolina es muy alto • Aminoácidos “raros” encontrados : – – – – 4-hidroxiprolina 3-hidroxiprolina 5-hidroxilysina Pro & HyPro juntos constituyen 30% de aa. Gly: 32.3; Ala: 12, Pro: 22 Hélice es ≠ a α-hélix Hacia la izquierda 3 residuos por vuelta También coiled-coil pero hacia la derecha Colágeno tejido conectivo: tendones, cartílago, córnea Secuencia: 3-péptido Gly-X-Y X = Pro, Y = 4-Hyp Gly Mutaciones que cambian Gly x otro aa. (Cys o Ser): alteran secuencia y conformación La Triple Hélice de Colágeno • La composición inusual de aa. del colágeno no es apropiada para hélices alfa u hojas plegadas • Es ideal para la triple hélice de colágeno : 3 hebras helicoidales “entretejidas” • 3.3 residuos por vuelta • Extensiones largas de Gly-Pro-Pro/HyP Bases estructural de la triple hélice de colágeno • Cada 3er residuo mira hacia el centro de la hélice; interior “congestionado” – sólo encaja Gly • Pro y HyPro encajan en las restricciones de phi y psi • Puentes de H- que implican a HyPro estabilizan la hélice • Fibrillas se refuerzan por entrecruzamientos de Lys-Lys Composición de proteínas fibrosas A.ácido α-queratina (lana) Gly 8.1 Ala 5.0 Ser 10.2 Glu + Gln 12.1 11.2 Cys Pro 7.5 Arg 7.2 Leu 6.9 Thr 6.5 Asp + Asn 6.0 Val 5.1 Tyr 4.2 Ile 2.8 Phe 2.5 Lys 2.3 Trp 1.2 His 0.7 Met 0.5 Fibroina (seda) 44.6 29.4 12.2 1.0 0 0.3 0.5 0.5 0.9 1.3 2.2 5.2 0.7 0.5 0.3 0.2 0.2 0 Colágeno Elastina (tendón bov. (aorta cerdo) 32.7 32.3 12.0 23.0 3.4 1.3 7.7 2.1 0 --e 22.1a 10.7c 5.0 0.6 2.1 5.1 1.6 1.6 4.5 0.9 1.8 12.1 0.4 1.7 0.9 1.9 1.2 3.2 3.7b 3.6d a: 39% OH-Pro 0 --e b: 14% OH-Lys c: 13% OH-Pro 0.3 --e d: ≥80% en X-links 0.7 --e e: casi ausente Fibroina = Beta Queratina • • • • Proteínas que forman hojas plegadas extensas Encontradas en fibras de seda Secuencia alternada : Gly-Ala/Ser-Gly-Ala/Ser.... Residuos de una hoja beta se extienden hacia arriba y abajo del plano de la hoja; esto coloca a todas las glicinas en un lado y a todas las alaninas y serinas del otro lado! Las Glys de una hoja se intercalan con las Glys de la hoja adyacente (lo mismo para las Ala/Sers) FIBROINA Hojas beta [Gly-Ala-Gly-Ala-Gly-Ser-Gly-Ala-Ala-Gly-(Ser-Gly-Ala-Gly-Ala-Gly)8] Preguntas: •Qué relación existen entre el colágeno y el escorbuto? •Por qué las articulaciones se han mas frágiles con la edad? •Cuáles son los componentes principales de la elastina y qué diferencia funcional tiene con otras proteínas como el colágeno? •Diferencias entre la fibroína de la seda y la proteína de la “tela de araña”