CICLO CELULAR
Anuncio

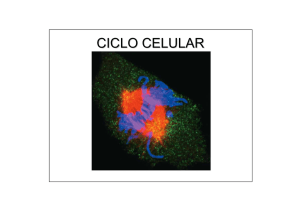
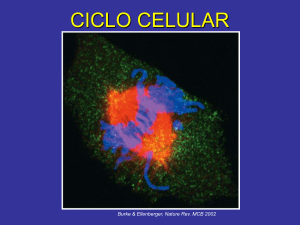
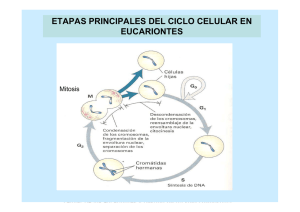
CICLO CELULAR Burke & Ellenberger, Nature Rev. MCB 2002 El ciclo celular consiste en la repetición de una secuencia de eventos ordenados en cuatro fases: G1, S, G2 y M El período comprendido por las fases G1, S y G2 se conoce como interfase. El ciclo celular puede detenerse temporalmente (quiescencia), o permanentemente (p. ej. neuronas y células del cristalino) en un estado dentro de la fase G1 denominado G0. quiescencia (reversible) Cada tipo celular repite el ciclo un número finito de veces; esto se conoce como el potencial de replicación o proliferativo (número de veces que la célula se replica). La salida permanente del ciclo celular producida por el acortamiento telomérico se conoce como senecencia replicativa. El ciclo celular es regulado por nutrientes y factores de crecimiento El crecimiento celular está acoplado al ciclo celular. Si la longitud del ciclo fuera invariable y no estuviera coordinado con el crecimiento de la célula, en ausencia o restricción de nutrientes el tamaño de las células disminuiría en cada división (A). Sin embargo, las células mantienen su tamaño a lo largo de las generaciones debido a su capacidad de modular la duración del ciclo celular (B). La restricción de nutrientes o factores de crecimiento provocan el bloqueo del ciclo celular en G1. Alberts et al., BMC 2002 En los organismos pluricelulares la proliferación celular es un proceso estrictamente regulado En epitelios las células madre (stem cells) permanecen en un estado de G0 (a, en rojo). Daños producidos al epitelio reactivan la proliferación de las células madre (b, en verde) las cuales se diferencian en diversos tipos celulares y reparan el daño (c). La persistencia desregulada del estado activado de las células madre una vez reparado el epitelio, por ejemplo por mutaciones oncogénicas, puede promover la formación de tumores y cáncer (d y e). Beachy et al., Nature 2004 La proliferación y apoptosis es regulada por señales extracelulares Hormonas y factores de acción paracrina controlan la proliferación y diferenciación de la glándula mamaria durante la pubertad, embarazo y la lactancia. Cuando la lactancia finaliza o se suspende, el epitelio alveolar involuciona por apoptosis de las células secretoras. El TGFβ es un factor disparador de la apoptosis en la involución de la glándula mamaria. Secciones de glándula mamaria de ratones en el período de lactancia. En marrón se visualiza la expresión de TGFβ. A: normal; B y C: animal donde se previene la succión. Las flechas en C indican células apoptóticas La prolactina estimula receptores que activan la vía de JAK-STATs. Las STATs inducen la transcripción del gen de la β-caseína. Alberts et al., BMC 2002 Las células madre poseen un potencial replicativo ilimitado y son una fuente de renovación celular en los tejidos adultos Esquema que muestra la distribución de las células madre en el epitelio que forma la epidermis Las células madre (stem cells) de la epidermis localizadas en el ápice de las papilas de la dermis se dividen y originan células de tránsito que mientras se desplazan lateralmente se dividen activamente y amplifican la población. Cuando llegan a la base de las papilas, estas células se disocian del estrato basal, y migran hacia estratos superficiales a la vez que se diferencian en keratinocitos. El potencial replicativo de las células epidérmicas correlaciona con la expresión de β1-integrinas. El nivel de proliferación celular de un tejido puede estudiarse determinando la incorporación de BrdU El potencial replicativo de las células epiteliales epidérmicas correlaciona directamente con la expresión de β1 integrinas. control knock out La bromodeoxiuridina (BrdU) es un análogo de timina que se incorpora en el DNA cuando las células entran en fase S. En la figura se muestran secciones de folículos pilosos de ratones control (A) y knock out (B) para β1-integrinas teñidos con anti-BrdU. Note que los folículos normales presentan mayor cantidad de núcleos marcados (puntos en marrón) que los del ratón deficiente en beta 1 integrinas (asteriscos y flechas en B) La incorporación de 3H-timidina y la citometría de flujo son otras técnicas experimentales para estimar la proliferación celular La incorporación de 3H-timidina ocurre en las células que están en fase S (flecha). (A) Autoradiografía. La determinación de la radioactividad incorporada permite cuantificar las células en estado proliferativo (B). A Microscopía de una sección de epitelio B Células estimuladas a dividirse con insulina en presencia o ausencia de un inhibidor de la señalización (inhibidor del adaptador Grb10). Observe que 10 μg/ml del inhibidor produce el máximo efecto. insulin IR Grb10 Erk Ciclinas D La citometría de flujo revela el contenido de DNA de una población celular y permite calcular el porcentaje de células en fase G1, S y G2/M. PRINCIPIOS GENERALES DEL CICLO CELULAR unidireccionalidad (secuencia temporal de eventos) adaptabilidad (ajustable a las condiciones ambientales) robustez (sistemas redundantes que operan eficientemente en condiciones variables ) El progreso unidireccional del ciclo es asegurado por mecanismos de control o “checkpoints” Alberts et al., BMC 2002 El progreso a través de las distintas fases requiere de la actividad de complejos heterodiméricos formados por kinasas y ciclinas La actividad de las kinasas del ciclo celular (Cdk, Cyclin-dependent kinases) requiere de su asociación con ciclinas. * *Cdh1 es un factor que determina la degradación de las ciclinas mitóticas por el complejo APC. Lodish et al., MBC 2004 La activación de las Cdk requiere de su unión a una ciclina (a) La Cdk no unida a ciclina está autoinhibida por un bucle flexible (T-loop) que bloquea el acceso del substrato al sitio activo unido al ATP. (b) La unión de la ciclina a la Cdk induce un cambio conformacional que expone el sitio activo al solvente y permite la unión del substrato. ATP Las ciclinas cumplen dos funciones básicas: 1) activan las Cdks 2) determinan la especificidad por los substratos Lodish et al., MBC 2004 El nivel de expresión de las ciclinas es el determinante principal de la activación de las Cdk Los niveles de expresion de las ciclinas oscilan durante el ciclo celular. Dichos niveles están controlados a nivel transcripcional y post-traducción. Al final de la mitosis todas las ciclinas son degradadas en proteosomas. La fosforilación de la Cdk constituye otro nivel de regulación de la actividad La kinasa CAK fosforila la treonina 160 en la Cdk2 lo cual incrementa ~ 150 veces su actividad (CAK) Cdk-activating kinasa Los complejos Cdk-ciclinas fosforilan proteínas que controlan eventos específicos del ciclo celular (ej. condensación de la cromatina, ruptura de la membrana nuclear, ensamble del huso mitótico, etc). Lodish et al., MBC 2004 La fosforilación de sitios inhibidores bloquea la actividad de los complejos Cdk/ciclinas Antes de comenzar la mitosis, las Cdk1 y 2 son fosforiladas en un sitio activador (Thr160) por la kinasa CAK, y en uno o dos sitios inhibidores (Thr14, Tyr15) por la kinasa Wee1. En este estado la Cdk es inactiva. Al final de la fase G2, Cdk1 es activada por la fosfatasa dual Cdc25 que remueve el fosfato del sitio inhibidor. dual (Thr 14, Tyr 15) cicl B Cdk1 cicl B Cdk1 Thr160 (CAK) MPF (Mitosis Promoting Factor) = Cdk1-cicl B CAK: Cdk-activating kinase Alberts et al., BMC 2002 Otro mecanismo que regula negativamentge la actividad de Cdks es la expresión de inhibidores CKI: Cdk Kinase Inhibitors Cdk Cdk Los inhibidores (CKI) se unen al complejo CDK-ciclina y bloquean el acceso del dominio catalítico de la Cdk al substrato. Hay inhibidores generales (p21, p27) y específicos (INK4a inhibe Cdk4 y 6 en G1). Alberts et al., BMC 2002 Dos complejos de ubiquitinación, SCF y APC, promueven la degradación de ciclinas y otros reguladores del ciclo celular El complejo APC es activado por fosforilación y su especificidad es regulada por la unión a cofactores específicos (ej. Cdc20 y Cdh1). El complejo SCF esta siempre activo y reconoce substratos fosforilados. inhibidores de G1 S (ej. p21, p27, Sic1 son degradados via SCF) inhibidores de metafase anafase (ej. Wee es degradada via SCF) inhibidores de anafase telofase/citokinesis (ej. ciclinas B, securina son degradadas via APC) APC: Anaphase Promoting Complex SCF: Skp1/Cullin/F-box protein) Reed, NRMCB 2003 Los substratos de APC poseen secuencias conservadas que son reconocidas específicamente por los cofactores Cdc20 y Cdh1 Las ciclinas de fase S y M poseen una secuencia de destrucción (destruction box o degron). (en rojo se resaltan los residuos idénticos en diferentes ciclinas) E1: enzima activada por ubiquitina E2: enzima conjugadora de ubiquitina E3: ubiquitina ligasa )APC EXPERIMENTOS QUE PERMITIERON IDENTIFICAR REGULADORES CLAVES DEL CICLO CELULAR Experimentos de fusión de células revelaron la existencia de factores difusibles que controlan el ciclo celular Experimentos que revela la actividad de las Cdks de fase S Experimento que revela la actividad de las Cdks de fase M El citoplasma de células en fase S induce a núcleos en G1 (A) y no de G2 (B) a iniciar la replicación del DNA. (C) El núcleo en G2 no se modifica y el núcleo de G1 entra en fase S de acuerdo a su propio ritmo. La fusión de una célula en fase M con otra en fase G1 induce eventos en el núcleo de G1 característicos de las primeras fases de la mitosis. Experimentos con oocitos de Xenopus permitieron aislar un factor promotor de la mitosis denominado MPF (Mitosis Promoting Factor) El MPF identificado originalmente es equivalente al complejo de CDK-ciclinas M La microinyección del citoplasma de huevos detenidos en metafase de meiosis II a oocitos de G2 induce la mitosis y la maduración a huevo sin necesidad de progesterona (b). El factor que induce la maduración fue aislado y se denominó ¨Maturation Promoting Factor¨ o MPF. Cuando el MPF purificado es inyectado en células somáticas en interfase promueve la mitosis (c). release from the ovary (ovulation) G2-arrested oocyte (prophase) bajos niveles de actividad MPF mitosis altos niveles de actividad MPF (b) microinjection of cytoplasm (c) microinjection of purified MPF mitosis mitosis G2-arrested oocyte célula en interfase Lodish et al, MBC2004 La actividad del MPF es máxima durante profase y metafase Perfil de actividad del MPF durante la maduración de oocitos de Xenopus, fertilización y etapas iniciales del desarrollo embrionario. huevo oocito Lodish et al, MBC2004 Experimentos con embriones de erizos de mar demostraron que la expresión de ciclinas mitóticas coincide con la actividad cíclica del MPF En las primeras etapas del desarrollo del erizo de mar todas las células del embrión se dividen sincrónicamente, entrando en mitosis simultaneamente. El análisis en geles de poliacrilamida de extractos proteicos de los embriones revela variaciones cíclicas de la expresión de ciclinas B, con un pico máximo al comenzar cada mitosis. ciclina de fase M (B) ribonucleótido reductasa Las ciclinas mitóticas son degradadas por el complejo promotor de la anafase APC al final de la anafase El complejo APC unido al cofactor Cdh1 reconoce y ubiquitina las ciclinas mitóticas, que se degradan en proteasomas. Durante el siguiente ciclo, Cdh1 es fosforilado por las Cdk-ciclinas G1, lo cual impide su unión a APC y permite la acumulación de las ciclinas M. Al final de la anafase la fosfatasa Cdc14 defosforila Cdh1, el cual se une y activa al complejo APC. Secuencia reconocida por APC en las ciclinas mitóticas Lodish et al, MBC2004 Estudios genéticos en S. pombe permitieron identificar Cdc2, la Cdk que forma el complejo equivalente al MPF de Xenopus Cdc2 de S. pombe es homóloga a Cdc28 de S. cerevisiae y equivalente a Cdk1 de vertebrados. Células mutantes recesivas para el gen cdc2 (cdc2-) no se dividen. En contraste, mutantes de ganancia de función (cdcD, dominantes) entran prematuramente a la mitosis, sin crecer lo suficiente. cepa salvaje, tamaño normal microscopía electrónica de barrido que muestra la cepa salvaje en distintas etapas del ciclo. mutante recesiva mutante dominante Cdc: Cell division cycle Lodish et al, MBC2004 Estudios genéticos en S. pombe también permitieron identificar genes reguladores de la actividad del MPF: Wee1 y Cdc25 Fenotipos mutantes en S. pombe modelo de interpretación de los resultados inhibidor activador Lodish et al, MBC2004 Modelo de acción de los principales reguladores de la actividad del MPF en S. pombe S. pombe posee una sola Cdk, Cdc2. Estudios genéticos permitieron identificar cuatro proteínas reguladoras de Cdc2: Cdc13, una ciclina mitótica equivalente a la ciclina B de vertebrados; Wee1, una kinasa que fosforila un sitio inhibidor (Y15) en Cdc2; y CAK, una kinasa que fosforila el sitio activador T161. La activación del complejo Cdc2-Cdc13 requiere de un cuarto regulador, la fosfatasa Cdc25, que defosforila Y15. (Cdc13) defosforilación del sitio inhibidor (Cdc2) sitio inhibidor sitio activador * la Thr161 de Cdc2 es homóloga a la Thr160 de la Cdk1 de vertebrados. Lodish et al, MBC2004 TRANSICIÓN DE LA FASE G1 S Esta transición requiere de la inactivación de inhibidores de la actividad/expresión de Cdk-ciclinas de fase S Cdk-ciclinas de fase S Sic1 Cdc28-Ciclinas B5/6 en S. cerevisiae Cdk2-ciclinas E/A en vertebrados Cdc28-Clb5/6 (S. cerevisiae) p21/p27 Cdk2-E/A (vertebrados) rb ciclinas E (vertebrados) La destrucción abrupta de Sic1 produce la activación simultánea de múltiples complejos Cdk1-Clb5 Sic1, que bloquea a los complejos Cdk-clinas S, es fosforilado gradualmente en G1 por Cdk1-Cln 1/2. Al final de G1, Sic1 supera un umbral de fosforilación que dispara su ubiquitanción y degradación abrupta en el proteosoma. De esta manera, los complejos de Cdk-ciclinas S se desbloquean y simultaneamente disparan la duplicación del DNA. Reed, Nature Rev. MCB 2003 Fase S: La replicación del DNA ocurre una sola vez por ciclo. Durante G2 y M los orígenes de replicación del DNA se encuentran asociados a un complejo multiproteico denominado ORC (Origin Recognition Complex). Durante la fase G1 del ciclo siguiente los factores de iniciación Cdc6 y Ctd1 facilitan la unión de la helicasa Mcm al ORC y forman el complejo de pre-replicación o pre-RC. En las fases posteriores de G2 y M, Cdk-M fosforila a estos factores impidiendo su unión al ORC. (MPF) Lodish et al, MBC2004 La fase S se dispara cuando las Cdk-ciclinas S y la kinasa (DDK) fosforilan componentes del pre-RC. Esto permite el reclutamienbto del factor iniciador Cdc45 que activa la helicasa Mcm y abre la doble hélice del DNA (burbuja de replicación). La fosforilación de Ctd1 y Cdc6 inducen su disociación del complejo. Cdc45 también recluta las proteínas Rpa que protegen las hebras simples del DNA de la degradación por nucleasas. El reclutamiento de la primasa y la DNA polimerasa permiten el inicio de la duplicación del DNA. Cdk-S y Cdk-M mantienen fosforilados a los factores de iniciación impidiendo su re-asociación al ORC. Esto asegura que cada origen de replicación dispare la síntesis del DNA una sola vez por ciclo. Cdc6 fosforilado además es ubiquitinado por SCF y degradado. Otros factores son exportados al núcleo. La degradación de las ciclinas S y M por APC en la anafase, y la actividad de fosfatasas durante G1, permite que los factores de iniciación de la replicación ensamblen un nuevo pre-RC en el siguiente ciclo. Lodish et al, MBC2004 Visualizacion de burbujas de replicación del AND en un cromosoma eucariota microscopía electrónica E. coli tiene un solo origen de replicación. Los cromosomas eucariotas tienen varios, estimaciones indican que la levadura S. cerevisiae tiene alrededor de 300 distribuidos uniformemente en sus 16 cromosomas. Los ORC eucariotas no están muy bien caracterizados, en levaduras comprenden una región de DNA de ~ 100 pb. TRANSICIÓN DE LA FASE G2 M Esta transición es regulada por fosforilación/defosforilación de Cdks de fase M Cdc28-Ciclinas B1-4 (S. cerevisiae) Cdk1-ciclina B = MPF (vertebrados) La fosfatasa Cdc25 activa el MPF al final de G2 y dispara la mitosis Cdc25 es activada por la kinasa Polo y también por MPF generando un circuito de retroalimentación positivo que activa más MPF y además fosforila e inhibe a la kinasa inhibidora Wee1. La consecuencia de este mecanismo regulatorio provoca un aumento brusco y robusto de la actividad de MPF al final de G2. ciclina mitótica (B) CAK daño del DNA reparado Tyr Thr Cdk1 ~ Cdc28 ~ Cdc2 Polo kinase p38 P inhibición, ubiquitinación y degradación en proteosoma chk1 & 2 MPF activo DNA no replicado y/o dañado EVENTOS CONTROLADOS POR MPF/CDK-M EN MITOSIS Fosforilación de las laminas y ruptura de la envoltura nuclear El MPF (Cdc28/Clb5; Cdk1/CiclB) fosforila las laminas A, B y C evento que conduce a la depolimerización de los filamentos intermedios y al desensamble de la lámina nuclear. La lamina B fosforilada permanece anclada a la membrana nuclear interna por un ácido graso. El MPF también fosforila nucleoporinas provocando el desensamble parcial de los poros nucleares. microscopía de barrido de la lámina nuclear MPF El MPF fosforila condensinas y promueve el empaquetamiento de la cromatina cromátides Las condensinas son complejos multiproteicos que se asocian al DNA e inducen su empaquetamiento. Las cohesinas son complejos multiproteicos que se asocian al DNA y mantienen unidas a las cromátides duplicadas. Ambos complejos de cohesinas y condensinas contienen ATPasas denominadas Smc (Structural Maintenance of Chromosomes) y otras proteínas accesorias. Los complejos de condensinas/cohesinas se unen a regiones específicas del DNA denominadas SARs/MARs (scaffold/matrix-attachment regions). metafase Anafase SARs o MARs Visualización de condensinas en cromosomas en metafase En estas imágenes de fluorescencia los cromosomas estan teñidos con anticuerpos contra condensinas (rojo) y el DNA esta teñido con Hoescht (azul) Modelo de condensación de la cromatina fibra de 11 nm (hilera de nucleosomas) fibra de cromatina de 30 nm en un cromosoma de metafase (~2 μm de largo) la doble hebra del DNA (~1,5 cm de largo) se empaqueta por un factor de ~10.000! El MPF fosforila MAPs y promueve el incremento de la inestabilidad dinámica de los microtúbulos de metafase MPF (Cdc28/Clb5; Cdk1/CiclB) fosforila catastrofinas y otras MAPs que incrementan el dinamismo de los microtúbulos. Las catastrofinas se unen a los extremos (+) de los microtúbulos provocando la disociación de monómeros e incrementando la frecuencia de catástrofes (transición de elongación acortamiento). El MPF también fosforila proteínas que conducen a la desintegración del RE y Golgi Se muestra la fragmentación del Golgi durante la mitosis y su re-ensamble al final de la misma. Magnus et al MBC2004 fosforilación de laminas desensamble de la lámina nuclear eventos nucleares fosforilación de nucleoporinas desensamble de poros nucleares fosforilación de proteínas de anclaje de la cromatina a la membrana desestabilización de la envoltura nuclear y de la cromatina fosforilación de condensinas empaquetamiento de la cromatina MPF eventos citoplasmáticos fosforilación de MAPs incremento del dinamismo de los MTs fosforilación de proteínas del RE y Golgi inhibición del tráfico TRANSICIÓN DE METAFASE ANAFASE Esta transición es regulada por proteólisis mediada por APC activación de APC (fosforilación mediada por MPF) Unión de Cdc20 a APC y degradación de securinas Unión de Cdh1 a APC y degradación de ciclinas mitóticas El comienzo de la anafase requiere de la destrucción de las cohesinas La proteína Scc1 actúa como un puente entre proteínas Smc unidas a las cromátides duplicadas. Scc1 es substrato de la proteasa separasa. Separasa es mantenida inhibida en fases previas a la anafase por el inhibidor denominado securina. La activación de APC al comienzo de la anafase promueve la degradación de securina en proteosoma y la separasa degrada Scc1, permitiendo la separación de las cromátidas. anafase cromátidas duplicadas Lodish et al 4th Ed. La unión de APC activo a Cdc20 y promueve la destrucción de securina El MPF fosforila y activa el complejo APC. APC activo se une al factor Cdc20 el cual le confiere especificidad para ubiquitinar a securina. Securina es un inhibidor de la proteasa separasa la cual degrada específicamente a las cohesinas permitiendo la separación de las cromátides. fosforilación por MPF degradación de cohesinas Al final de la anafase, la asociación de APC con el factor Cdh1 promueve la degradación de las ciclinas mitóticas, y por lo tanto la inactivación del MPF inactivo fosforilación La especificidad del complejo APC por las ciclinas mitóticas es deteminada por la unión al factor Cdh1. Cdh1 activo Cdc20 (securinas) La inactivación del MPF revierte los procesos previos y promueve la decondensación de los cromosomas y la reformación del núcleo La fosfatasa Cdc14 es requerida para la inactivación del MPF y para la ocurrencia de la citoquinesis Durante interfase y mitosis temprana Cdc14 es retenida inactiva en el nucleólo. Al final de la anafase Cdc15 y otras kinasas fosforilan y activan a Cdc14 la cual defosforila el factor Cdh1/Hct1 y permite su unión a APC. APC-Cdh1 degrada las ciclinas S y M. nucleolo kinasas (Cdc15) normal Cdc14 Cdc14 Cdh/APC Cdc15 es requerida para la citoquinesis. Levaduras mutantes permancen unidas después de la mitosis. la fosfatasa Cdc14 es necesaria para la formación del huso mitótico intermedio (en verde), estructura que marca el sitio donde ocurre la citocinesis. mutante de cdc15 MPF Zen-4 citocinesis Cdc14 Zen-4 MTs del huso intermedio (ver imagen 25) La inactivación del MPF permite la activación de miosina y el desarrollo de la citoquinesis REGULADORES POSITIVOS Y NEGATIVOS DEL CICLO CELULAR EN CÉLULAS DE MAMÍFEROS La estimulación de integrinas y receptores de factores de crecimiento genera señales que estimulan el progreso de G1 y la entrada en S matriz extracelular integrinas caveolina factores de crecimiento Wnt RTKs Fyn/Shc FAK/Src/ p130Cas Freezled Grb2 Grb2 Ras Rac Rho JNK Dishevelled Raf/MEK Erk β-catenina Tcf/Lef p53 cki ciclina D early genes S phase La transcripción de genes de expresión temprana requiere de la activación de vías de señalización, ej. de ras-MAPK ej. c-fos gene ERK TCF c-Fos↑ ECM integrins JNK c-Jun↑ cdk inhibitors c-Jun/c-Fos (AP1) ciclina D Cdk 4/6 ↑ Factores de crecimiento y la matriz extracelular estimulan la síntesis de ciclinas y Cdks en la fase G1 La estimulación con suero de células en G0 induce un pico de transcripción de genes denominados de “expresión temprana” (c-fos, c-jun). Estos factores de transcripción inducen la expresión de genes de “expresión tardía” (ej. ciclinas D, E), que son necesarios para el progreso de la fase G1. (factores de crecimiento) La transcripción de los genes de expresión temprana ocurre por la activación de factores de transcripción pre-existentes y por lo tanto no requiere de síntesis de proteínas. En contraste, la síntesis de las proteínas es requerida para la transcripción de los genes de respuesta tardía y para la degradación del mRNA. La síntesis de ciclinas D es esencial para el pasaje de G1 a S En presencia de factores de crecimiento las células se tornan independientes de dicha estimulación al final de G1 y entran de manera irreversible a la fase S. Este punto crítico, conocido como punto de restricción, "start“, o de no retorno, depende de la síntesis de ciclinas D. (A) Las células superan el punto de no retorno después de 14 -16 h de incubación con factores de crecimiento y entran en la fase S 6-8 h mas tarde (1). La microinyección de anti-ciclina D (2) inhibe la incorporación de bromodeoxiuridina (BrdU) (3). El porcentaje de células marcadas con BrdU (en fase S) se determina 16 h mas tarde (4, B). A B (no sintetizan DNA) La actividad de los complejos Cdk4/6-D y Cdk2-E fosforilan e inactivan a la proteína supresora de tumores retinoblastoma Rb La proteína Rb bloquea el ciclo celular en G1. Rb interacciona y bloquea la expresión y función de los factores de transcripción E2Fs por un mecanismo que recluta la histona deacetilasas, HDAC y provoca el silenciamiento de E2F y otros genes del ciclo celular. El punto de no retorno implica la generación de un bucle de retroalimentación positiva que implica la hiperfosforilación de Rb por Cdk4/6-D y Cdk2-E al final de G1. Esto conduce a la disociación de HDAC y activación de los factores E2Fs los cuales estimulan su propia transcripción y la de Cdk2, y de las ciclinas de fase S A y E. hipo fosforilación HDAC hiper fosforilación retroalimentación positiva gen inactivo activo HDAC Mid G1 Late G1 Punto de restricción superado (independiente de ciclinas D) En vertebrados, inhibidores de Cdks (CIP/KIP) bloquean Cdk2-E/A Cdk2-E integrinas p53 TGF-β •cumplen una función similar a Sic1 en S. Saccharomyces SCF-ubiquitina - p21CIP - CIP/KIP - p27KIP1 - p57KIP2 * Cdk2-E/A caderinas otro grupo de inhibidores de Cdks: - INK4 (p16) Cdk4/6-ciclinas D Resumen de eventos temprana G1 S tardía APC inactivo Cdh1 G2 anafase telofase activación fosforilado e inactivo APC activo fosforilación Wee fosforilación ↑transcripción SPF Cdc28-Cln3 ↑transcripción M CAK Cdc28-Cln1 Cdc28-Cln2 Cdc28-Clb1 Cdc28-Clb2 activas proteólisis Cdc20 Cdh1 Cdc25 fosforilación proteólisis Cdc34-SCF Sic1 inactivación Cdc28-Clb5 Cdc28-Clb6 inhibidor de inactivas la fase S Sic1 ensamblaje de complejos de pre-replicación Cdc28-Clb3 Cdc28-Clb4 activas Cdc28-Clb5 Cdc28-Clb6 activas inhibidor de la anafase Cdc7-DbF4 kinasa síntesis del DNA complejos activos inhibición del ensamblaje de nuevos complejos de pre-replicación Cdc28-Clb1 Cdc28-Clb2 Cdc28-Clb3 Cdc28-Clb4 Cdc28-Clb5 Cdc28-Clb6 Nomenclatura comparada de levaduras y vertebrados S. cerevisiae vertebrados ciclina Cdk ciclina Cdk mid G1 Cln 3 Cdc28 D (1-4) Cdk4/6 ↑E2F, SBF y MBF G1/S Cln 1, 2 Cdc28 E Cdk2 ↓APC, ↓Sic1, ↓Cdh1 S B 3-6 Cdc28 A M B 1-4 Cdc28 A/B Cdk2 Cdk1 función ↑replicación del DNA ↑huso mitótico, ↑división nuclear MPF ~ Cdc28-Clb ~ Cdc2-Cdc13 ~ Cdk1- cicl B Xenopus S. cerevisiae S. pombe vertebrados Síntesis de proteínas reguladoras del ciclo celular Protein kinases and protein phosphatases that modify Cdks Cdk-activating phosphorylates an activating site in Cdks kinase (CAK) Wee1 kinase phosphorylates inhibitory sites in Cdks; primarily involved in controlling entry into mitosis Cdc25 removes inhibitory phosphates from Cdks; three family members phosphatase (Cdc25A, B, C) in mammals; Cdc25C is the activator of Cdk1 at the onset of mitosis Cdk inhibitory proteins (CKIs) Sic1 (budding suppresses Cdk activity in G1 ; phosphorylation by Cdk1 triggers its destruction yeast) p27 (mammals) suppresses G1/S-Cdk and S-Cdk activities in G1; helps cells to withdraw from cell cycle when they terminally differentiate; phosphorylation by Cdk2 triggers its ubiquitylation by SCF p21 (mammals) suppresses G1/S-Cdk and S-Cdk activities following DNA damage in G1; transcriptionally activated by p53 p16 (mammals) suppresses G1 -Cdk activity in G1; frequently inactivated in cancer Ubiquitin ligases and their activators SCF catalyzes ubiquitylation of regulatory proteins involved in G1 control, including CKIs (Sic1 in budding yeast, p27 in mammals); phosphorylation of target protein usually required for this activity APC catalyzes ubiquitylation of regulatory proteins involved primarily in exit from mitosis, including Securin and M-cyclins; regulated by association with activating subunits Cdc20 APC-activating subunit in all cells; triggers initial activation of APC at metaphase-to- anaphase transition; stimulated by M-Cdk activity Hct1/Cdh1 maintains APC activity after anaphase and throughout G1 ; inhibited by Cdk activity Gene regulatory proteins E2F promotes transcription of genes required for G1/S progression, including genes encoding G1/S cyclins, S-cyclins, and proteins required for DNA synthesis; stimulated when G1 -Cdk phosphorylates Rb in response to extracellular mitogens p53 promotes transcription of genes that induce cell cycle arrest (especially p21) or apoptosis in response to DNA damage or other cell stress; regulated by association with Mdm2, which promotes p53 degradation APOPTOSIS La apoptosis se reconoce por cambios morfológicos y moleculares característicos célula normal co ntr ol ap op tos is Las células que entran en apoptosis se contraen y fragmentan en vesículas o cuerpos apoptóticos. Los núcleos se condensan y el DNA se fragmenta generando un patrón en escalera o ladder. Cambios en la distribución de fosfolípidos (ej. fosfatidil serina) pueden detectarse con anexina fluorescente. célula en apoptosis apoptosis célula deprivada de factores de crecimiento. célula en presencia de insulina. La apoptosis involucra la activación en cascada de proteasas intracelulares denominadas caspasas Las caspasas son sintetizadas como precursores inactivos (procaspasas) que deben ser clivadas para su activación. Estímulos que disparan apoptosis usualmente producen la agregación y autoprocesamiento de caspasas inciadoras. Las caspasas iniciadoras activas posteriormente clivan y activan una o varias caspasas efectoras. activación de procaspasa iniciadora Substratos de caspasas son las laminas de la malla nuclear, proteínas del citoesqueleto, etc. La deficiencia de señalización inducida por factores de crecimiento provoca la apoptosis en varios tipos celulares En ratones knockout para el gen del NGF o su receptor TrkA, se observa la ausencia de las neuronas sensoriales que transmiten sensaciones de dolor. Señal de supervivencia Los factores de crecimiento y la matriz extracelular inhiben la apoptosis mediada por citocromo C de mitocondrias La salida de citocromo C de mitocondrias ensambla un complejo molecular que activa caspasas. receptor integrinas Factor trófico ECM membrana PI-3K 14-3-3 Akt P Bad Bcl-2 Bax PI-3K Bcl-2 mitocondria P Bax Cito c APAF-1 Cito c Akt P Bad 14-3-3 caspasas caspasas La activación de procaspasas también puede ocurrir por estimulación de receptores de superficie proapoptóticos Receptores proapoptóticos (TNFR1, FAS-CD95, TRAIL, etc) pertenecen a la familia del factor necrótico de tumores o ¨tumor necrosis factor (TNF). La apoptosis controlada por factores extracelulares permite remodelar tejidos y órganos durante el desarrollo Pato. apoptosis inhibida en el tejido interdigital. el miembro derecho fue infectado con un virus que expresa un receptor dominante negativo de BMP, que inhibe la señalización de BMP y la apoptosis entre los dígitos apoptotic zone Pollo. apoptosis inducida en el tejido interdigital anterior apoptotic zone expresión del mRNA para BMP4 (en azul) interdigital apoptotic zone posterior apoptotic zone apoptotic zone embriones de pollo Las proteínas BMPs (Bone Morphogenetic Proteins) inducen apoptosis en el tejido interdigital de los miembros de vertebrados. En patos, la apoptosis del tejido interdigital de los miembros es inhibida por noggin, una proteína secretada por células del mesénquima y que inhibe a BMP. Gilbert, Dev. Biol. 6ta Ed. CONTROL O "CHECKPOINTS" EN EL CICLO CELULAR sensor mediador efector Mecanismos de control o "checkpoints" aseguran la correcta duplicación del DNA, su integridad y distribución a las células hijas ATM: Ataxia Telangiectasia Mutated ATR: ATM-Rad3-Related AT Chk1/2: Chekpoint 1/2 (fosfatasa) ATM y ATR son kinasas relacionadas a PI3K; ATM sensa rupturas de la doble hélice, ATR sensa alteraciones que generan cadenas simples (ej. horquillas de replicación detenidas). Chk1 y 2 son kinasas de Ser/Trh substratos de ATM/ATR. La proteína p53 es un efector clave de la respuesta al daño del DNA (“damage checkpoint”) ubiquitinación degradación de p53 en proteosoma En condiciones normales, p53 es ubiquitinado por la ubiquitina ligasa Mdm2 y degradado en el proteosoma. El daño del DNA activa kinasas que fosforilan a p53 y provocan su disociación de Mdm2. De esta manera, p53 se acumula y ejerce su rol activando la transcripción de CKIs. El daño del DNA y otras alteraciones activan mecanismos que arrestan el ciclo celular o promueven la apoptosis radiación ionizante daño del DNA sensors: ATM y ATR kinasas activación P de kinasas Chk1 y Chk2 p53 P estabilización de p53 inhibición de la actividad; degradación en proteosoma P Cdc25 Cdk1 Cdk2 p21CIP Cdk4/6 Rb E2F ↑ proteínas proapoptóticas: Bax, receptores de Fas, etc G2/M G1/S El DNA no replicado activa un mecanismo de control (“DNA replication checkpoint“) que inactiva Cdc25 ATR actúa como sensor del DNA no replicado, y se activa al asociarse al DNA simple cadena de horquillas de replicación arrestadas. ATR fosforila y activa la kinasa Chk1, la cual a su vez fosforila e inactiva la fosfatasa de Cdks Cdc25. La cafeína inhibe ATR y éste mecanismo de control. La incubación de células con hidroxiurea, un inhibidor de la síntesis de deoxinucleótidos, activa el mecanismo de control y provoca la detención del ciclo en la fase S. Células incubadas con hidroxiurea + cafeína no se detienen en la fase S y experimentan errores fatales en la distribución de los cromosomas. cafeína ATR Chk1 Cdc25 CDK1-ciclA/B Un complejo de proteínas controla el correcto anclaje de los microtúbulos del cinetocoro “checkpoint de metafase” sensors Bub, Mad polo mediador Cdc20 efector APC securina En los cinetocoros libres se localizan y activan proteínas de control como Mad y Bub, que retienen y bloquean al cofactor Cdc20. De este modo, Cdc20 no esta disponible para activar APC. La ocupación del último cinetocoro libera Cdc20 que se une y activa APC. APC-Cdc20 ubiquitina el inhibidor de la anafase securina y se dispara la anafase. La kinasa Aurora-B se localiza en los cinetocoros y contribuye a la corrección de defectos de anclaje de los microtúbulos de los cinetocoros. MAD: Mitotic Arrest Defficient BUB: Budding Uninhibited by Benzimidazole Mussachio & Salmon NRNCB 2007 La disponibilidad de Cdc20 permite la activación de APC y la degradación de las cohesinas cinetocoro libre Mad2 todos los cinetocoros unidos a Mts libre degradacion de cohesinas cinetocoros bi-orientados