INSTRUCCIONES DE USO Y PAUTA POSOLÓGICA EN ICP E ICP
Anuncio

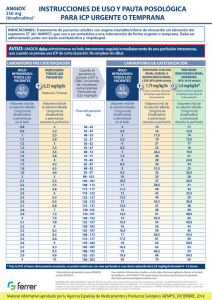
ANGIOX® 250 mg (bivalirudina)1 INSTRUCCIONES DE USO Y PAUTA POSOLÓGICA EN ICP E ICP PRIMARIA INDICACIONES: Indicado como anticoagulante en pacientes adultos que se someten a intervención coronaria percutánea (ICP), incluidos los pacientes con infarto de miocardio con elevación del segmento ST que se someten a intervención coronaria percutánea primaria. Debe ser administrado junto con ácido acetilsalicílico y clopidogrel. AVISO: ANGIOX debe administrarse en bolo intravenoso seguido inmediatamente de una perfusión intravenosa, aun cuando se prevea una ICP de corta duración. No emplear sin diluir. DOSIS RECOMENDADA BOLO INTRAVENOSO: TODOS LOS PACIENTES 0,75 mg/kg + PERFUSIÓN: FUNCIÓN RENAL NORMAL E INSUFICIENCIA RENAL LEVE (VFG: 60-89 ml/min) 1,75 mg/kg/hr o PERFUSIÓN: INSUFICIENCIA RENAL MODERADA (VFG: 30-59 ml/min) 1,4 mg/kg/hr Como mínimo durante el tiempo que dure la intervención Como mínimo durante el tiempo que dure la intervención Peso del paciente (kg) Volumen (ml) de la solución diluida (5mg/ml de bivalirudina) a administrar en el bolo Volumen (ml) de la solución diluida (5mg/ml de bivalirudina) a administrar durante la perfusión Volumen (ml) de la solución diluida (5mg/ml de bivalirudina) a administrar durante la perfusión 38 - 42 43 - 47 48 - 52 53 - 57 58 - 62 63 - 67 68 - 72 73 - 77 78 - 82 83 - 87 88 - 92 93 - 97 98 - 102 103 - 107 108 - 112 113 - 117 118 - 122 123 - 127 128 - 132 133 - 137 138 -142 143 -147 148 - 152 153 - 157 158 - 162 163 - 167 168 - 172 173 - 177 178 - 182 183 - 187 188 - 192 193 - 197 198 - 202 6 7 7,5 8 9 10 10,5 11 12 13 13,5 14 15 16 16,5 17 18 19 19,5 20 21 22 22,5 23 24 25 25,5 26 27 28 28,5 29 30 14 16 17,5 19 21 23 24,5 26 28 30 31,5 33 35 37 38,5 40 42 44 45,5 47 49 51 52,5 54 56 58 59,5 61 63 65 66,5 68 70 11 12,5 14 15,5 17 18 19,5 21 22,5 24 25 26,5 28 29,5 31 32 33,5 35 36,5 38 39 40,5 42 43,5 45 46 47,5 49 50,5 52 53 54,5 56 1 Ficha técnica del producto para ANGIOX; versión 06/2014 Para solicitar información médica o datos sobre farmacovigilancia, llamar al número de teléfono: +34 93 600 37 00 o bien enviar un correo electrónico a la siguiente dirección: pharmacovigilance@ferrer.com NOMBRE DEL MEDICAMENTO: ANGIOX 250 mg de polvo para concentrado para solución inyectable o perfusión. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA: cada vial contiene 250 mg de bivalirudina. Después de la reconstitución, 1 ml contiene 50 mg de bivalirudina. Después de la disolución, 1 ml contiene 5 mg de bivalirudina. Para la lista completa de excipientes ver la sección “Lista de excipientes”. FORMA FARMACÉUTICA: Polvo para concentrado para solución inyectable o perfusión. Polvo liofilizado de color blanco a blanco amarillento. AX/ES/032015/01 Material informativo aprobado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_MARZO_2015. ANGIOX® 250 mg (bivalirudina)1 INSTRUCCIONES DE USO Y PAUTA POSOLÓGICA EN ICP E ICP PRIMARIA Si está clínicamente justificado se puede alargar la perfusión de 1,75 mg/kg de peso corporal/h hasta un máximo de 4 horas tras la intervención coronaria percutánea, y continuarse a una dosis de perfusión reducida de 0,25 mg/kg/h durante 4 - 12 horas, de ser clínicamente necesario. 1. RECONSTITUCIÓN AÑADIR 5 ml de agua para inyección al vial. AGITAR suavemente hasta que se disuelva por completo (alrededor de 2 - 3 minutos). Una vez reconstituido, cada 1 ml contiene 50 mg de bivalirudina. 2. DILUCIÓN EXTRAER 5 ml de la solución reconstituida del vial. Insuficiencia renal: ANGIOX está contraindicado en pacientes con insuficiencia renal grave (VFG < 30 ml/min) y en pacientes sometidos a un tratamiento de diálisis. En pacientes con insuficiencia renal moderada (VFG 30-59 ml/min), la tasa de perfusión debe reducirse a 1,4 mg/kg/h. La dosis en bolo se mantendrá en 0,75 mg/kg. Pasar de heparina a ANGIOX: DE HEPARINA NO FRACCIONADA (HNF) A ANGIOX Suspender la administración intravenosa de HNF durante 30 MINUTOS antes de empezar con ANGIOX DE HEPARINA DE BAJO PESO MOLECULAR (HBPM) A ANGIOX H Forma de administración: Suspender la administración subcutánea de HBPM durante 8 HORAS antes de empezar con ANGIOX DILUIR hasta obtener un volumen total de 50 ml con solución de glucosa para inyección al 5% o solución para inyección de 9 mg/ ml de cloruro sódico (0,9%). No deben emplearse soluciones que contengan partículas. Una vez diluido, cada 1 ml contiene 5 mg de bivalirudina. 3. ADMINISTRACIÓN EXTRAER la dosis de bolo de la bolsa de infusión y administrarla mediante un bolo IV rápido antes de comenzar el procedimiento, asegurarse de que las vías de perfusión IV están cebadas e iniciar y continuar la perfusión inmediatamente tras la administración del bolo para asegurar la continuidad de la liberación del fármaco al paciente. Incompatibilidades de ANGIOX: Incompatibilidades con los siguientes fármacos por vía intravenosa: alteplasa, hidrocloruro de amiodarona, amfotericina B, hidrocloruro de clorpromazina, diazepam, edisilato de proclorperazina, reteplasa, estreptoquinasa, hidrocloruro de vancomicina. Medicamentos incompatibles con ANGIOX a concentraciones más elevadas: dobutamina clorhidrato, famotidina, haloperidol lactato, labetalol clorhidrato, lorazepam, prometacina HCI: para más información, consultar la ficha técnica del producto1. MIN 1 Ficha técnica del producto para ANGIOX; versión 06/2014 Para solicitar información médica o datos sobre farmacovigilancia, llamar al número de teléfono: +34 93 600 37 00 o bien enviar un correo electrónico a la siguiente dirección: pharmacovigilance@ferrer.com NOMBRE DEL MEDICAMENTO: ANGIOX 250 mg de polvo para concentrado para solución inyectable o perfusión. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA: cada vial contiene 250 mg de bivalirudina. Después de la reconstitución, 1 ml contiene 50 mg de bivalirudina. Después de la disolución, 1 ml contiene 5 mg de bivalirudina. Para la lista completa de excipientes ver la sección “Lista de excipientes”. FORMA FARMACÉUTICA: Polvo para concentrado para solución inyectable o perfusión. Polvo liofilizado de color blanco a blanco amarillento. AX/ES/032015/01 Material informativo aprobado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_MARZO_2015.