Factores de crecimiento
Anuncio

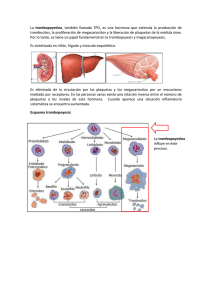
E. Murakami Anexo al TEMA 3: Factores de crecimiento Enero de 2007. Revisado Enero de 2008. 46 Factor de Crecimiento Epitelial (EGF) / Factor de Crecimiento Transformante alfa (TGF-alpha) Factor de Crecimiento Derivado de las Plaquetas (PDGF) Factor de Crecimiento Fibroblástico (FGFs) Factor de Crecimiento Transformante beta (TGF-beta) Citoquinas Interleuquina 1 (IL-1) Factor de Necrosis Tumoral (TNF) FACTORES DE CRECIMIENTO Los factores de crecimiento son señales bioquímicas capaces de modicar las respuestas de las células del organismo. Están involucrados en el control del crecimiento y diferenciación celular. Existen muchísimos tipos de factores de crecimiento diferentes. Muchos de estos factores se encuentran en la sangre y especialmente en las plaquetas. Los Factores de crecimiento son péptidos, es decir, secuencias cortas de aminoácidos, que usualmente transmiten señales entre las células modulando su actividad. Los avances de los últimos años en biología molecular y biotecnología han permitido la identicación de este tipo de elementos y su estudio ha sido decisivo en el tratamiento de diversas enfermedades como veremos más adelante. Se trata habitualmente de proteínas solubles que actúan de mediadores biológicos naturales siendo responsables de distintos eventos celulares como la mitosis, la quimiotaxis (desplazamiento de las células en el medio líquido), la citodiferenciación y la síntesis de la matriz entre otros. Los factores de crecimiento ejercen varios efectos sobre los procesos de reparación y regeneración, y por ejemplo son considerados iniciadores de los procesos de cicatrización. La síntesis de los factores de crecimiento se encuentra mediada por receptores de membrana especícos en la supercie celular, sobre los cuales a su vez ellas actúan, promoviendo una proliferación o una inhibición en diferentes situaciones. Se puede clasicar los factores de crecimiento según sea su especialidad: amplia o reducida. Los de especialidad amplia como el factor de crecimiento derivado de las plaquetas (PDGF) y el factor de crecimiento epitelial (EGF) actúan sobre muchas clases de células, entre ellas tenemos: broblastos, bras musculares lisas, células neurogliales y el último, además, sobre células epiteliales y no epiteliales. Por contraposición, los factores de crecimiento de especicidad reducida solo actúan sobre un tipo de células. Como ejemplo de este tipo de factores de crecimiento podemos citar la eritropoyetina, que tan solo induce la proliferación de los precursores de los hematíes. Los factores de crecimiento actúan de manera local. La estimulación celular se realiza bien por un sistema autocrino, es decir, las células producen y responden al mediador biológico, o por un sistema paracrino en el que la célula que produce el factor se encuentra en las proximidades de las células a las que afecta. Ejemplo: En general, los factores de crecimiento son sintetizados en forma de precursores, siendo necesario para la liberación del factor en forma "activa" un proceso especíco de proteolisis. Su mecanismo de acción siempre comienza al unirse a receptores especícos de membrana. Para cada clase de factor de crecimiento existe un receptor o conjunto de receptores especícos de tal forma que las células responden a un factor de crecimiento sólo si disponen de la proteína receptora apropiada. Los factores son el estímulo necesario para iniciar una cadena de eventos celulares que tienen como resultado las funciones anteriormente mencionadas. El proceso está mediado por un sistema de segundos mensajeros en el que interviene una proteína tirosínquinasa. Debido a este mecanismo, la acción de los factores en el lugar de la lesión continúa aunque hayan desaparecido los mismos del medio, ya que han activado el sistema de segundos mensajeros. 47 Entre los tipos celulares productores de los factores de crecimiento están los broblastos, osteoblastos, células endoteliales y leucocitos, especialmente, monocitos y macrófagos. Además existen lugares de almacenamiento, como son las plaquetas (en los gránulos a) y el hueso (adheridos a la matriz ósea). Los mecanismos reparativos y la liberación de los factores de crecimiento óseo son activados ante cualquier cosa que altere la morfología estructural o celular del tejido óseo. Se incluyen como desencadenantes de activación de los factores: el traumatismo, accidental o quirúrgico, del tejido óseo como por ejemplo en la pérdida dental o la colocación de implantes, la interrupción temporal del aporte vascular asociado a la desvitalización y necrosis del tejido óseo, e incluso las alteraciones humorales con repercusiones en el metabolismo del calcio. Quizás una de las aplicaciones más importantes que los factores de crecimiento tienen a nivel terapéutico sea el plasma rico en plaquetas (PPR), ideal para mejorar el proceso de cicatrización de los tejidos blandos y la regeneración ósea. Se obtiene centrifugando la sangre del propio paciente tal y como se indica en el siguiente esquema: FACTOR DE CRECIMIENTO EPITELIAL (EGF) / FACTOR DE CRECIMIENTO TRANSFORMANTE ALFA (TGF-α) El EGF también es conocido como factor de crecimiento epidérmico y es sintetizado como un precursor de 1217 aminoácidos (cuyo peso molecular es 133.000) que incluye 8 secuencias de aminoácidos homólogas al factor de crecimiento. Los broblastos del ligamento periodontal, los preosteoblastos y precondrocitos expresan un alto número de receptores para el EGF. Entre sus acciones biológicas podemos destacar efectos mitogénicos y quimiotácticos en broblastos y células epiteliales.También induce la migración celular y se ha demostrado que tiene un efecto dosis-dependiente. Además induce la formación rápida del diente. Thesle (1987) demostró la presencia de receptores de EGF en los tejidos apicales de dientes en erupción. Otra importante función del EGF es su papel en la estimulación de la formación del tejido de granulación, así como su capacidad para inhibir la liberación de ácido por la mucosa gástrica. Aunque el EGF no aumenta la síntesis de RNA mensajero para proteínas de la matriz extracelular como el colágeno, los trabajos recientes apuntan a que lo hace por medio de un mecanismo indirecto, atrayendo broblastos por quimiotaxis, y estos a su vez sintetizan colágeno produciéndose un aumento del colágeno total. Por su parte el TGF-α (que junto al TGF-β , del que hablaré más adelante, forma el TGF) posee muchos efectos comunes con el EGF. Los más destacables serían: el aumento en la proliferación y migración de las células epiteliales, la liberación de iones de calcio del hueso, la inhibición de la actividad de los osteoblastos. Además tiene efecto angiogénico e interviene en el desarrollo tumoral por medio de dos mecanismos: uno, estimulando la proliferación celular por un mecanismo autocrino, y otro, induciendo la angiogénesis tumoral mediante un mecanismo paracrino. FACTOR DE CRECIMIENTO DERIVADO DE LAS PLAQUETAS (PDGF) Este factor de crecimiento se encuentra en el PPR citado anteriormente, y su nombre viene porque fue encontrado por primera vez en las plaquetas, donde se almacena dentro de los gránulos alfa. Sin embargo se sabe que también es producido por los macrófagos, las células endoteliales, los monocitos, los broblastos etc, hallándose también en la matriz ósea. Las plaquetas son pequeños fragmentos citoplasmáticos presentes en sangre que derivan del megacariocito, miden 3 µm aproximadamente, actúan en la coagulación de la sangre, en la retracción y disolución del coagulo y en los procesos de cicatrización. 48 Estas son las primeras células que actúan cuando se produce un daño, y sufren desgranulación en los sitios de las heridas, liberando entre otros los factores de crecimiento. Según las cadenas que formen la estructura del factor de crecimiento podemos encontrarnos con 3 formas: PDGF-AA, PDGF-BB y PDGF-AB. El PDGF tiene un peso de 30 Kda, y es secretada por las plaquetas en los estados iniciales de la reparación. Entre sus acciones podemos destacar su participación en la glucogénesis, la regulación del crecimiento y diferenciación celular en el sistema nervioso central durante su desarrollo. Además aumenta la regeneración periodontal y produce mitosis y quimiotaxis en células de linaje odontoblástico, estimula la producción de colágeno tipo I por los oosteolastos, el cual es el principal componente de la matriz extracelular del hueso. También inuyen en la formación otras proteínas además del colágeno citado y disminuye los efectos de los lipopolisacáridos sobre los broblastos. Asimismo podemos destacar que puede estimular las somatomedinas y que se ha involucrado en el desarrollo de agrandamientos gingivales tras la toma de fenitoína. La fenitoína aumentaba la producción de PDGF por los macrófagos y la excesiva producción de este factor en la encía provocaba su hipertroa. Cuando el hueso sufre daño o fractura los osteoblastos expresan en su supercie mayor cantidad de receptores para el Factor de Crecimiento derivado de las plaquetas(PDGF). También juega un papel predominante en la patogenia de la aterosclerosis como principal agente quimiotáctico para las células musculares lisas (CML). En la pared arterial, el PDGF modula de manera autocrina la producción de otros factores de crecimiento de progresión, como el factor de crecimiento derivado de la insulina I (IGF-I), a su vez implicado en la respuesta proliferativa de la CML de la lesión aterosclerótica El Factor de Crecimiento derivado de las plaquetas es de vital importancia en el desarrollo embriológico del esqueleto. El factor de crecimiento derivado de las plaquetas estimula la mitosis debido a que interviene en la regulación del calcio intracelular y del Ph18. FACTOR DE CRECIMIENTO FIBROBLÁSTICO (FGF) Se trata de una familia de polipéptidos cuya misión es la de controlar la proliferación, diferenciación y otras funciones celulares en aquellas células derivadas del mesodermo y neuroectodermo. Existen dos tipos: FGF ácido y FGF básico, y entre sus acciones y efectos más importantes podemos destacar por un lado la estimulación de la angiogénesis por un mecanismo directo, al estimular la mitosis y migración de las células endoteliales y por otro lado la estimulación y coordinación de la mitogénesis de múltiples tipos celulares como células de origen mesenquimatoso, como los broblastos, los osteoblastos, condorcitos, células musculares lisas y mioblastos esqueléticos durante el crecimiento animal, mantenimiento y reparación tisular. FACTORES DE CRECIMIENTO TRANSFORMANTE (TGF - β ) El factor de crecimiento transformante beta (TGF-β ) es una familia de proteínas que incluye al TGF-β , activinas y a la proteína morfogénica de hueso (BMP, por sus siglas en inglés), citocinas que son secretadas y se relacionan estructuralmente en diferentes especies de metazoarios. Los miembros de la familia del TGF-β regulan diferentes funciones celulares como proliferación, apoptosis, diferenciación, migración, y tienen un papel clave en el desarrollo del organismo. El TGF-β está implicado en varias patologías humanas, incluyendo desórdenes autoinmunes y vasculares, así como enfermedades bróticas y cáncer. La activación del receptor del TGF-β propicia su fosforilación en residuos de serina/treonina y dispara la fosforilación de proteínas efectoras intracelulares (smad), que una vez activas se translocan al núcleo para inducir 49 la transcripción de genes blanco, y así regular procesos y funciones celulares. Se están desarrollando novedosas estrategias terapéuticas encaminadas a corregir las alteraciones presentes en patologías que involucran al TGF-β como actor principal. (AU). Los factores de crecimiento más comunes en el plasma rico en plaquetas son ( TGF-β 1 ) y (TGF-β 2), que son mediadores locales cuyas principales actividades son estimular la quimiotaxis y la mitosis de células osteoprogenitoras. También actúan sobre los osteoclastos inhibiendo la resorción ósea, actúan también sobre los broblastos, células endoteliales, etc. Otros efectos son: promueve la formación de matriz extracelular, posee pocos efectos en la migración de los broblastos, inhibe la proliferación de células epiteliales, aumenta la expresión los receptores del PDGF. La TGFβ junto con la TGFα forman la TGF. A continuación encontramos un cuadro más detallado que aglutina los efectos de la TGF-β : CITOQUINAS Las citoquinas o citocinas son un grupo de proteínas de bajo peso molecular producidas durante la respuesta inmune y que actúan mediando interacciones complejas entre células de linfoides, células inamatorias y células hematopoyéticas. Se unen a receptores especícos de la membrana de las células donde van a ejercer su función, iniciando una cascada de transducción intracelular de señal que altera el patrón de expresión génica, de modo que esas células diana producen una determinada respuesta biológica. Entre sus funciones destaca la diferenciación y maduración de células del sistema inmunitario, la comunicación entre células del sistema inmunitario y en algunos casos, ejercen funciones efectoras directas. En la siguiente tabla encontramos los tipos de citocinas existentes así como sus efectos: (Ver tabla 1) 1. INTERLEUQUINAS O INTERLEUCINAS: Se conoce así a una serie de sustancias protéicas pertenecientes al grupo de las citoquinas y que son sintetizadas por los glóbulos blancos o leucocitos y por los histiocitos, y cuya función principal es la de mensajeras entre dichos leucocitos, por lo que su papel en la respuesta inmunitaria es crucial. Las interleuquinas son llamadas numéricamente: IL-1, IL-2, IL-3, hasta IL-18. Las funciones y características detalladas de cada una de las interleucinas se pueden consultar en el cuadro anterior, pero destacaré aquí que las IL-2 han sido la más ampliamente estudiadas en el tratamiento de cáncer. Las IL-2 estimulan el crecimiento y actividad de muchas células inmunes asesinas de cáncer, incluyendo las células NK y las células citotóxicas T. Además, las IL-2 aumentan las respuestas de anticuerpos. Tanto estudios en humanos como con animales muestran que las IL-2 pueden revertir las deciencias inmunes. De manera interesante, los estudios no han mostrado diferencias en la actividad biológica entre las IL-2 que ocurren naturalmente y las IL-2 creadas en el laboratorio. 2. FACTOR DE NECROSIS TUMORAL (TNF): Esta molécula perteneciente al grupo de las citoquinas es una hormonaglicopéptida formada por 185 aminoácidos, que procede de un propétido formado por 212 aminoácidos. Algunas células sintetizan isoformas más cortas de la molécula. Genéticamente el TNF está relacionado con el cromosoma 7p21. Es el mensajero de proteína culpable de iniciar y magnicar la reacción de inamación que padecen los pacientes de artritis reumatoide así como en otras patologías. Lo producen los macrófagos y sinoviocitos, que son las células del revestimiento sinovial. Otras sustancias de tipo señalizador (citoquinas), tal como Interleucina-1 (IL-1) y Endotoxina, pueden estimular a los macrófagos para que en la supercie produzcan, el factor de necrosis tumoral. De ahí, una 50 enzima ayuda a la liberación del FNT. Esta enzima se llama enzima separadora de alfa en el FNT siendo sus siglas en inglés, TACE. Una vez que el FNT se encuentra en la solución, se puede unir a los receptores solubles anterior a unirse a la supercie de linfocitos. Los dos receptores solubles disponibles para que se produzca la unión se llaman P55 y P75. El FNT debe unirse a estos dos receptores antes de poder unirse a la supercie de las células. El FNT estimula lo que llamamos moléculas de unión, que incluye las selectinas. Esto permite a las células blancas a unirse al costado de los vasos sanguíneos y después colocarse entre las células de la pared de vasos para de allí migrar a una área de inamación (en el caso de artritis, estas células migran hacia las articulaciones). El FNT incrementa la producción de proteínas que pueden ser nocivas para las articulaciones (metaloproteinasa) MMP. El FNT también estimula la producción de Interleucina-1 (IL-1) que a su vez puede activar a las células osteoclásticas del hueso. Esto puede ocasionar una resorción o desintegración de hueso, con el transcurso del tiempo. Queda claro, que con todos estos efectos perjudiciales del FNT, lo importante que es controlar y bloquear los efectos negativos en las articulaciones. Por este motivo, se ha invertido tanta energía y se ha realizado tanta investigación con el n de encontrar terapias biológicas que puedan interferir con las múltiples acciones de FNT. En este sentido las investigaciones están centradas en la sustancia inhibidora del factor de necrosis tumoral, basado en el principio de que puesto que al igual que cualquier otra citoquina el TNF necesita un receptor en la membrana citoplasmática al que ligarse para poder iniciar su acción proinamatoria, al bloquear estos receptores especícos del TNF, podría cambiarse el curso de la patología. Bibliography [1] GALVEZ-GASTELUM, Francisco Javier ; SANDOVAL-RODRIGUEZ, Ana Soledad e ARMENDARIZ-BORUNDA, Juan. El factor de crecimiento transformante b como blanco terapéutico. Salud pública Méx, jul./ago. 2004, vol.46, no.4, p.341-350. ISSN 0036-3634. [2] Robbins, Contran, Kumar. Patología humana. 7a ed. Ed. Elservier; 2004. [3] Kumar, Abbas, Fausto. Patología estructural y funcional. 7a ed. Ed. Elservier; 2005. [4] Pardo Mindán. Compendio de anatomía patológica. 1a ed. Ed Harcourt Brace; 1997. [5] Peralta Zaragoza O., Lagunas Martínez A., Madrid Marina V. Factor de crecimiento transformante beta-1: Estructura, función y mecanismos de regulación en cáncer [online] 2001 Jul-Ago [13 pantallas]. Disponible en: URL: http://redalyc.uaemex.mx/redalyc/pdf/106/10643413.pdf [6] García García V, Corral I, Bascones Martínez A. Plasma Rico en Plaquetas y su utilización en implantología dental. Av Periodon Implantol. 2004; 16,2: 81-92. [7] Iáñez Pareja, E. Citoquinas [online] 2001. Disponible en: URL: http://www.ugr.es/~eianez/inmuno/cap_14.htm 52 Bibliography Figure 1. Tabla 1. Citocinas 53 Bibliography Figure 2. Continuación Tabla 1.