MINISTERIO DE EDUCACIÓN DIRECCIÓN REGIONAL DE HERRERA COLEGIO RAFAEL QUINTERO VILLARREAL
Anuncio
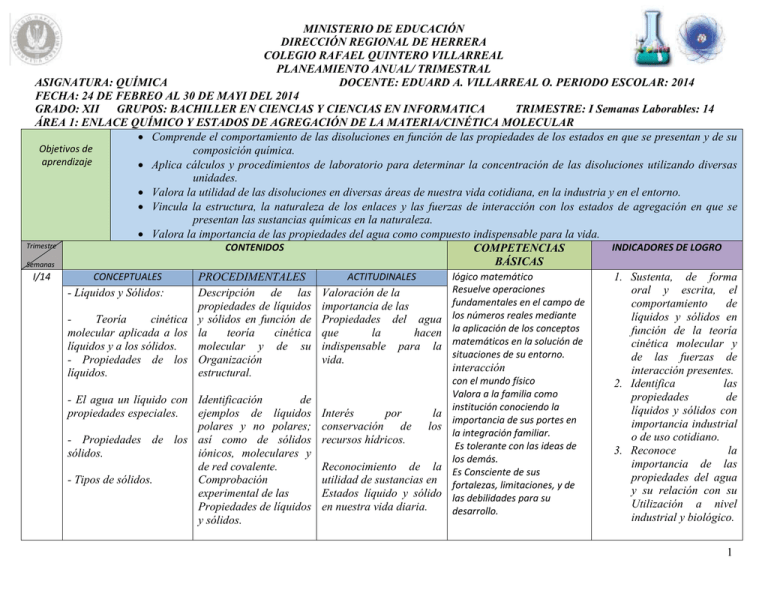
MINISTERIO DE EDUCACIÓN DIRECCIÓN REGIONAL DE HERRERA COLEGIO RAFAEL QUINTERO VILLARREAL PLANEAMIENTO ANUAL/ TRIMESTRAL ASIGNATURA: QUÍMICA DOCENTE: EDUARD A. VILLARREAL O. PERIODO ESCOLAR: 2014 FECHA: 24 DE FEBREO AL 30 DE MAYI DEL 2014 GRADO: XII GRUPOS: BACHILLER EN CIENCIAS Y CIENCIAS EN INFORMATICA TRIMESTRE: I Semanas Laborables: 14 ÁREA 1: ENLACE QUÍMICO Y ESTADOS DE AGREGACIÓN DE LA MATERIA/CINÉTICA MOLECULAR Comprende el comportamiento de las disoluciones en función de las propiedades de los estados en que se presentan y de su Objetivos de composición química. aprendizaje Aplica cálculos y procedimientos de laboratorio para determinar la concentración de las disoluciones utilizando diversas unidades. Valora la utilidad de las disoluciones en diversas áreas de nuestra vida cotidiana, en la industria y en el entorno. Vincula la estructura, la naturaleza de los enlaces y las fuerzas de interacción con los estados de agregación en que se presentan las sustancias químicas en la naturaleza. Valora la importancia de las propiedades del agua como compuesto indispensable para la vida. Trimestre CONTENIDOS INDICADORES DE LOGRO COMPETENCIAS BÁSICAS Semanas I/14 CONCEPTUALES ACTITUDINALES lógico matemático PROCEDIMENTALES 1. Sustenta, de forma Resuelve operaciones oral y escrita, el - Líquidos y Sólidos: Descripción de las Valoración de la fundamentales en el campo de comportamiento de propiedades de líquidos importancia de las los números reales mediante líquidos y sólidos en Teoría cinética y sólidos en función de Propiedades del agua la aplicación de los conceptos función de la teoría molecular aplicada a los la teoría cinética que la hacen matemáticos en la solución de cinética molecular y líquidos y a los sólidos. molecular y de su indispensable para la situaciones de su entorno. de las fuerzas de - Propiedades de los Organización vida. interacción interacción presentes. líquidos. estructural. con el mundo físico 2. Identifica las Valora a la familia como propiedades de - El agua un líquido con Identificación de institución conociendo la líquidos y sólidos con propiedades especiales. ejemplos de líquidos Interés por la importancia de sus portes en importancia industrial polares y no polares; conservación de los la integración familiar. o de uso cotidiano. - Propiedades de los así como de sólidos recursos hídricos. Es tolerante con las ideas de 3. Reconoce la sólidos. iónicos, moleculares y los demás. importancia de las de red covalente. Reconocimiento de la Es Consciente de sus propiedades del agua - Tipos de sólidos. Comprobación utilidad de sustancias en fortalezas, limitaciones, y de y su relación con su experimental de las Estados líquido y sólido las debilidades para su Utilización a nivel Propiedades de líquidos en nuestra vida diaria. desarrollo. industrial y biológico. y sólidos. 1 I/14 CONCEPTUALES PROCEDIMENTALES Disoluciones: - Soluto y disolvente. - Tipos de disoluciones. - Solubilidad y factores que la afectan. - Proceso de disolución. - Velocidad de disolución y factores que la afectan - Concentración de las disoluciones. Fracción molar. Concentración molar (Molaridad). Molalidad Normalidad. Unidades trazas (ppm, ppb). Interconversión de unidades. Preparación, dilución y valoración de disoluciones. -Propiedades coligativas: Aumento de la presión de vapor. Aumento del punto de ebullición. Descenso del punto de congelación. Presión osmótica. Descripción de los componentes de las disoluciones, de las interacciones y cambios energéticos implicados en el proceso de disolución. Identificación de tipos de disoluciones según los estados de agregación y la proporción soluto disolvente. Cálculos de las unidades de concentración. Determinación de la concentración de disoluciones mediante su preparación, dilución y valoración. Comprobación experimental de las propiedades coligativas. ACTITUDINALES Lógico Matemáticas Maneja estructuras básicas, conocimientos y procesos matemáticos, que le permiten comprender y resolver situaciones en su vida diaria. Reconocimiento la utilidad de las disoluciones en la vida diaria identificando ejemplos de las mismas. Valora las aplicaciones Interacción de las propiedades coligativas en nuestra con el mundo físico Actúa responsablemente vida cotidiana. frente al impacto de los avances científicos y tecnológicos en la sociedad y el ambiente. Tratamiento de la información y competencia digital Conoce el uso de tecnologías de la información y comunicación y las aplica para mejorar la interacción en su vida personal, laboral y ciudadana. Conceptual Describe, de forma oral y escrita, el comportamiento de las disoluciones en función de las interacciones soluto – disolvente y de su composición. Realiza cálculos para determinar y expresar la concentración de disoluciones utilizando diferentes unidades de concentración. Prepara y valora disoluciones en el laboratorio aplicando los cálculos y los procedimientos pertinentes. Identifica ejemplos del contexto en los que se manifiestan las propiedades coligativas de las disoluciones. 2 ÁREA 2: MATERIA, ENERGÍA Y SUS CAMBIOS/TRANSFORMACIONES QUÍMICAS OBJETIVOS DE APRENDIZAJE: Trimes tre Seman as Comprende aspectos termodinámicos relacionados con las variaciones de energía y entropía de procesos físicos y químicos que ocurren en el entorno. Aplica cálculos y procedimientos de laboratorio para calcular calores de reacción y de disolución. Valora las implicaciones de los cambios energéticos que ocurren en el entorno tomando conciencia sobre el ahorro de energía y la conservación de los recursos naturales. CONTENIDOS CONCEPTUALES Transformaciones de energía: - Conceptos de entalpía, energía libre y entropía. Leyes de la termodinámica. - Procesos endotérmicos y exotérmicos. - Calores de reacción y de formación. - Calorimetría. - Procesos endergónicos y exergónicos. - Aspectos energéticos de reacciones importantes para la vida y en el contexto: Valor energético de los alimentos (Calorías) Glucólisis Fotosíntesis Combustión Metodología y técnica: COMPETENCIAS BÁSICAS PROCEDIMENTALES ACTITUDINALES Descripción de los cambios de entalpía, energía libre y entropía de procesos químicos importantes. Valoración de la importancia de los cambios energéticos que ocurren en reacciones importantes para la vida y en la industria. Interés por la conservación de los recursos naturales y el ahorro energético. Sensibilización sobre la importancia de una ingesta moderada de calorías a través de los alimentos que consumimos. Resolución de problemas sobre cálculos de calores de reacción, calorimetría, cambios de entalpía, energía y entropía. Determinación experimental de los calores de reacción. Análisis del valor energético de los alimentos. Trabajo grupal Estudio de casos Experiencias de laboratorio INDICADORES DE LOGRO 1. Comunicativa: Nombra, de forma oral y escrita, conceptos de entalpia y termodinamica. 2. Lógico matemático Identifica de forma gráfica, oral y escrita, de una serie de iones, en una reacción la energía liberada. 3. aprender a aprender: Plantearse preguntas. Identificando y manejando la diversidad de respuestas posibles. 4. Tratamiento de la información y competencias digitales. Identifica compuestos inorgánicos a partir de sus respectivas Fórmulas químicas. Discusión dirigida. Método de resolución de problemas. Identifica ejemplos de Procesos endotérmicos, exotérmicos, endergónicos y exergónicos en el contexto. Realiza cálculos para determinar calores de reacción, cambios de entalpía, cambios de energía libre y cambios de entropía. Aplica cálculos y procedimientos para determinar calores de reacción mediante experiencias de laboratorio. Compara el contenido energético de productos alimenticios y opta por un consumo adecuado de calorías. Lectura comprensiva Confección de esquemas y resúmenes 3 Trabajo colaborativo Actividades de evaluación: Pruebas objetivas Desarrollo de talleres Informes de laboratorio Debate Exposición dialogada Investigaciones Construcción de esquemas Resolución de problemas Criterios de apreciación establecidos Exposición de investigaciones Portafolio Asignaturas correlacionadas: biología, física, matemáticas, español, Inglés, agropecuaria. Fuentes literarias: Bibliográficas: BIBLIOGRAFÍA PARA EL DOCENTE: 1. FUNDAMENTOS DE QUÍMICA. Stevens Zumndhal 2. FUNDAMENTOS DE QUÍMICA. Ralph Burns 3. Química conceptos y Aplicaciones. McGraw Hill. 2007. 4. Matematica Química. Rafael Martin H.1985 BIBLIOGRAFÍA PARA ESTUDIANTES: 1. ACOSTA, J. Química 10. Editorial Escolar, 2002. (Las dos primeras áreas) 2. BURNS, R. Química 10. Editorial Pearson. 2009 3. DINGRANDO, HAUNEN, WISTROM. Química. Editorial McGraw Hill. 2003 4. KOTZ, Treichel, Harman. Química y Reactividad. Quinta edición. Editorial Thomson. 2003 5. MENDOZA, N. Melo de; D. Mendoza. Química 10, Editorial SUSAETA. 2006 OBSERVACIONES:____________________________________________ ______________________________________ RESPONSABLES: ______________________________ DIRECTORA: ______________________________________. COORDINADOR (A): ________________________________ FECHA DE ENTREGA: ______________________________. 4