RM de los tumores malignos de endometrio y cérvix*
Anuncio

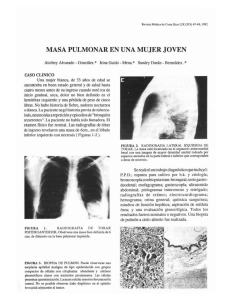
Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. RADIOLOGÍA ARTÍCULO DE AJR RM de los tumores malignos de endometrio y cérvix* E. Sala, S. Wakely, E. Senior y D. Lomas Department of Radiology. Addenbrooke’s Hospital. University of Cambridge. Hills Rd. Cambridge CB2 2QQ. United Kingdom. Objetivo. El objetivo de este trabajo es revisar el papel de la resonancia magnética (RM) en la valoración de tumores del cuerpo y cérvix uterinos, y describir su utilidad en la estadificación, la planificación terapéutica y el seguimiento clínico. Conclusión. A pesar de que la RM no está incorporada oficialmente al sistema de estadificación de la Federación Internacional de Ginecología y Obstetricia (FIGO), está considerada como la técnica de imagen más precisa para el diagnóstico, estadificación, planificación terapéutica y seguimiento de los tumores de endometrio y cérvix. Los protocolos de RM se deben optimizar para obtener los mejores resultados y, a la vez, evitar los errores diagnósticos. Palabras clave: RM dinámica, imagen del tracto genitourinario, oncología ginecológica, RM, imagen oncológica, imagen femenina. El papel de la resonancia magnética (RM) en los tumores ginecológicos ha adquirido una mayor importancia durante las dos últimas décadas. En este momento la evidencia científica indica que la RM es una técnica útil para valorar la patología tumoral pélvica1,2. La RM ha demostrado ser superior a la tomografía computarizada (TC) en la estadificación de los tumores malignos de endometrio y cérvix, y puede servir de ayuda en la diferenciación entre la fibrosis posradioterapia y la recidiva tumoral3. En cuanto a la detección de adenopatías, la capacidad de la RM es similar a la de la TC, ya que ambas técnicas se basan en el criterio del tamaño ganglionar para el diagnóstico de metástasis4. Sin embargo, recientemente se han incorporado contrastes de RM específicos para ganglios linfáticos que prometen ser de utilidad para determinar la afectación metastásica ganglionar5. En algunas situaciones clínicas la RM ha permitido disminuir el coste económico al eliminar o reducir la necesidad de otros procedimientos diagnósticos o quirúrgicos, más caros o agresivos6,7. En este trabajo se revisa el papel de la RM en la estadifica- *Traducción del original: Rocío Díaz Aguilera (Hospital Alto Guadalquivir, Jaén). Primera revisión de la traducción: Ana Blanco Barrio, Editor Adjunto de Radiología (Hospital Morales Meseguer, Murcia); segunda revisión de la traducción: José Mª García Santos, Editor Jefe de Radiología (Hospital Morales Meseguer, Murcia); tercera revisión de la traducción: Mario Pagés Llinás, Editor de Imagen Abdominal de Radiología (Hospital Clinic, Barcelona); visto bueno a la traducción: José Mª García Santos. Address correspondence to: E. Sala (es220@radiol.cam.ac.uk). Publicado en: AJR Am J Roentgenol. 2007;188:1577-87. MRI of malignant neoplasms of the uterine corpus and cervix Objective. In this article, we review the role of MRI in the imaging of malignant neoplasms of the uterine corpus and cervix, describing its role in staging, treatment planning, and follow-up. Conclusion. MRI is not officially incorporated in the International Federation of Gynecology and Obstetrics (FIGO) staging system, but is already widely accepted as the most reliable imaging technique for the diagnosis, staging, treatment planning, and follow-up of both endometrial and cervical cancer. MRI protocols need to be optimized to obtain the best results and avoid pitfalls. Key words: dynamic MRI, genitourinary tract imaging, gynecologic oncology, MRI, oncologic imaging, women’s imaging. ción, la planificación terapéutica y el seguimiento de los tumores malignos del cuerpo y cuello uterinos. Neoplasias malignas del cuerpo uterino Los adenocarcinomas son tumores derivados del epitelio de la mucosa que reviste la cavidad uterina y constituyen el 90% de los carcinomas de endometrio. El resto lo forman otros tipos histológicos, entre los que se incluyen el adenocarcinoma con diferenciación escamosa, el carcinoma adenoescamoso, el carcinoma de células claras y el carcinoma seroso papilar. Los sarcomas uterinos son tumores infrecuentes, de origen mesenquimal, que constituyen el 2-6% de las neoplasias malignas uterinas8. Los tipos histológicos más frecuentes son el sarcoma del estroma endometrial, los tumores müllerianos mixtos y el leiomiosarcoma. Los linfomas uterinos primarios son extremadamente raros y representan únicamente el 1% de los linfomas. Las metástasis uterinas de neoplasias no ginecológicas son raras. La mama y el tracto gastrointestinal son los lugares de origen más comunes. Carcinoma de endometrio El carcinoma endometrial ocupa el cuarto lugar entre las neoplasias malignas más frecuentes de la mujer, y es el carcinoma más común del aparato reproductor femenino9. En el año 2007 Radiología. 2008;50:449-61 449 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix TABLA 1. Claves diagnósticas y posibles fuentes de error de la resonancia magnética en la estadificación del carcinoma de endometrio y cérvix Carcinoma Claves diagnósticas Posibles fuentes de error Endometrio El estudio dinámico con contraste 3D potenciado en T1 es más preciso que la secuencia T2 para la valoración del grado de infiltración del miometrio Pérdida de la definición de la zona de unión; realce de la zona subendometrial visible sólo en el 50-60% de los casos En la fase precoz es donde mejor se aprecia la banda de realce subendometrial (estadio IA frente a IB) Distensión de la cavidad endometrial por un tumor polipoide que comprima el miometrio El máximo contraste entre el miometrio interno y el externo se produce al minuto de la administración de contraste (estadio IB frente a IC) Pobre contraste entre tumor y miometrio El máximo contraste entre el tumor y el miometrio se produce a los 2-3 minutos (estadio IB frente a IC) Extensión tumoral a los cuernos uterinos El realce de la mucosa del cuello uterino en fase tardía (4-5 minutos) excluye la infiltración del estroma cervical Existencia de enfermedad microscópica Valorar el grado de infiltración del miometrio en, al menos, dos planos Patología benigna concomitante (miomas, adenomiosis) Anomalías congénitas uterinas Cérvix Estimación precisa del tamaño tumoral mediante RM (con menos de 5 mm de diferencia respecto a la pieza macroscópica) Los parametrios están situados exclusivamente laterales al cérvix La existencia de un estroma hipointenso íntegro excluye la infiltración del parametrio La pérdida del estroma hipointenso indica la infiltración completa del estroma del cérvix pero no del parametrio La recidiva tumoral en la vagina presenta una intensidad de señal similar a la del tumor primario En T2 puede producirse una sobreestimación de la infiltración del parametrio por hemorragia postbiopsia o por tumores grandes que provoquen un edema estromal El restablecimiento de la anatomía normal del cérvix y de la hipointensidad de señal del estroma del cérvix indican una respuesta completa a la radio-quimioterapia Los cambios iniciales postradioterapia (en los 6 primeros meses) y la infección pueden mostrar realce La RM dinámica con contraste mejora la detección de tumores pequeños y ayuda a distinguir entre la recidiva tumoral y la fibrosis postradioterapia RM: resonancia magnética. se esperaban 39.080 casos nuevos y 7.400 muertes relacionadas en los Estados Unidos9. La incidencia está aumentando debido al incremento de la esperanza de vida y de la obesidad. La supervivencia a los 5 años oscila entre el 96% para el estadio I y el 25% para el estadio IV9. El pronóstico de las pacientes depende de diversos factores como son el estadio, la profundidad de la invasión del miometrio, la invasión linfovascular, el estadio de los ganglios linfáticos y el grado histológico10. La valoración preoperatoria de estos factores ayuda a una mejor planificación terapéutica11. Protocolo de resonancia magnética La preparación de la paciente, así como la técnica realizada, son factores claves para obtener unos resultados óptimos. En principio se requiere estar en ayunas de 4 a 6 horas para evitar los artefactos provocados por el peristaltismo intestinal. Una opción alternativa al ayuno es la administración de un agente antiperistáltico (como el bromuro de butilhioscina o el glucagón) antes de la exploración. Además, es recomendable que la paciente orine antes de comenzar con el estudio, porque la vejiga llena puede provocar artefactos de movimiento y de fase en las secuencias potenciadas en T2. El estudio se hace con la paciente en decúbito supino usando una antena de superficie pélvica multicanal. El protocolo básico (tabla 1) incluye una secuencia axial espín eco (SE) potenciada en T1 con un campo de visión 450 (FOV) amplio, que incluya la pelvis y el abdomen superior para valorar la existencia de adenopatías y la afectación de la médula ósea; secuencias de alta resolución fast espín eco (FSE) potenciadas en T2, en planos axial y sagital, para valorar el tumor primario y, finalmente, secuencias dinámicas con contraste, potenciadas en T1 (con un FOV pequeño) en planos sagital y axial oblicuo para analizar el grado de infiltración del miometrio y del cérvix. Es conveniente que las secuencias FSE de alta resolución potenciadas en T2 utilicen un plano perpendicular al eje longitudinal del cuerpo uterino, que permite evaluar mejor el tumor primario y el grado de infiltración del miometrio12. Para aumentar la precisión diagnóstica en la estadificación se hace sistemáticamente un estudio dinámico 3D potenciado en T1 con supresión grasa, centrado en el cuerpo uterino, en planos sagital y axial oblicuo. Las fases precoces (en el minuto 0 y 1) permiten identificar la zona subendometrial o zona de unión interna (inner junctional zone), puesto que ésta realza antes que la mayor parte del miometrio. La identificación de esta zona es especialmente importante para detectar la invasión precoz del miometrio, ya que la zona de unión entre el endometrio y el miometrio se hace indistinguible en mujeres posmenopaúsicas13. La fase de equilibrio (a los 2-3 minutos tras la inyección del contraste) permite valorar mejor el grado de profundidad de la infiltración del miometrio14, mientras que la fase tardía (a los 4-5 minutos) posibilita ver mejor la invasión del estroma cervical15. La interfase entre el tumor y el miometrio debería estudiarse en al menos dos planos. Radiología. 2008;50:449-61 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix Impacto de las técnicas de imagen en el tratamiento Diagnóstico En un 80% de los casos el carcinoma de endometrio se presenta en un estadio I y, en estas situaciones, el tratamiento suele consistir en una histerectomía abdominal con doble anexectomía y salpinguectomía. Pero el reto está en identificar a aquellas pacientes con mayor riesgo de recaída, en las que hay que llevar a cabo intervenciones más agresivas (por ejemplo, incluyendo linfadenectomía radical) y tratamientos adyuvantes y, a la vez, evitar aplicar un tratamiento excesivamente agresivo en pacientes de bajo riesgo. Además, la reciente incorporación de técnicas laparoscópicas supone una alternativa terapéutica para las pacientes en los estadios iniciales de la enfermedad16,17. Lo fundamental en la valoración preoperatoria del carcinoma endometrial es distinguir entre los estadios IA y IB, especialmente desde el aumento del empleo de la hormonoterapia como tratamiento en pacientes en estadio IA, en las que existe alto riesgo de morbilidad perioperatoria. El riesgo de metástasis ganglionares debe tenerse en cuenta para elegir el tratamiento quirúrgico más adecuado. Diferenciar el estadio IB del IC tiene consecuencias en cuanto al pronóstico y la morbilidad, porque el estadio IB requiere una biopsia ganglionar, mientras que el IC implica, directamente, la linfadenectomía radical. La invasión macroscópica del cuello uterino requiere aplicar radioterapia preoperatoria, o un cambio del plan quirúrgico que pasa por sustituir la histerectomía total abdominal por una histerectomía radical. La estadificación quirúrgica del carcinoma endometrial pretende ser el tratamiento inicial y, a la vez, identificar aquellas pacientes que requieran una terapia adyuvante. El grado de infiltración del miometrio es probablemente el factor pronóstico individual más importante, porque se relaciona con el grado tumoral, con la extensión del tumor al cérvix y con la prevalencia de metástasis ganglionares18,19. La incidencia de adenopatías metastásicas (pélvicas, paraaórticas o ambas) pasa de un 3% en los casos de invasión superficial del miometrio (estadio IB) a un 46% en los que la invasión es profunda (estadio IC)19-21. Sin embargo, no hay que olvidar que en un número elevado de pacientes la determinación del grado de infiltración del miometrio durante la intervención quirúrgica, o en el estudio de la pieza quirúrgica, es poco segura22,23. La linfadenectomía sigue generando controversia en la actualidad y su práctica varía ampliamente según los centros24,25. Entre sus indicaciones están los tumores de grado 1 o 2 con invasión profunda del miometrio, todos los tumores grado 3, la infiltración del estroma cervical y los tipos histológicos de alto riesgo, como el seroso papilar y el de células claras25. La linfadenectomía conlleva un riesgo alto de complicaciones y, por tanto, hay que seleccionar adecuadamente las pacientes que deban someterse a ella para que sea un equipo onco-ginecológico especializado quien se encargue del tratamiento11. En resumen, la RM puede ayudar al manejo preoperatorio de la paciente y a la planificación quirúrgica más adecuada, porque es capaz de determinar con precisión la infiltración del miometrio y del estroma cervical, la afectación ganglionar y la diseminación metastásica. Además, puede aportar información adicional respecto al tamaño uterino, al volumen tumoral o a la presencia de ascitis, así como detectar alteraciones anexiales que pueden modificar el abordaje quirúrgico (abdominal, transvaginal o por laparoscopia). En pacientes con un alto riesgo quirúrgico por comorbilidad, la RM es útil para planificar un tratamiento no quirúrgico, con radioterapia u hormonoterapia (estadio IA). El diagnóstico de carcinoma de endometrio se basa en la biopsia endometrial o en la dilatación con legrado. La RM se reserva para determinar la extensión de la enfermedad. La RM es la técnica de imagen más exacta para el estudio preoperatorio del carcinoma endometrial por el gran contraste entre tejidos que proporciona. El estudio dinámico tras la administración de contraste intravenoso (iv) es necesario para conseguir una valoración precisa de este tipo de tumor11,13,14,26-29. En las imágenes potenciadas en T1 sin contraste el carcinoma endometrial es isointenso respecto al endometrio normal. En las imágenes potenciadas en T2 el tumor puede aparecer hiperintenso, aunque típicamente es heterogéneo e incluso puede ser hipointenso. Después de administrar contraste iv el miometrio interno normal muestra un realce intenso y más precoz que el miometrio externo13,27,28. La diferencia máxima de contraste entre ambas capas del miometrio se produce a los 50 segundos28. En general, el carcinoma endometrial realza antes que el endometrio normal, pero más tarde que el miometrio adyacente, hecho que permite la detección de pequeños tumores, incluso aquellos que están embebidos en el espesor del endometrio. El máximo contraste entre el tumor y el miometrio se produce durante la fase de equilibrio14. Estadificación Los criterios de imagen para establecer el estadio del carcinoma endometrial se basan en el sistema TNM o en la clasificación de la FIGO (Federación Internacional de Ginecología y Obstetricia) (tabla 2). Sin embargo el sistema de clasificación de la FIGO sólo tiene en consideración los datos quirúrgicos e histológicos, pero las técnicas de imagen, aunque útiles para la estadificación preoperatoria del tumor, no están reconocidas por la FIGO como un método para la estadificación definitiva. La RM es significativamente mejor que la ecografía y la TC para determinar la infiltración del cuello uterino y el miometrio30,31. La exactitud global de la RM para la estadificación se sitúa entre el 85 y el 93%13,14,26-30,32,33. El uso sistemático de estudios dinámicos con contraste iv mejora significativamente la exactitud a la hora de valorar el grado de infiltración del miometrio (precisión del 55-77% para imágenes potenciadas en T2 y del 85-91% para el estudio dinámico con contraste)13,14,27,29,34. Estadio I Se incluyen en él los tumores limitados al cuerpo uterino. En el estadio IA (tumores limitados al endometrio) el endometrio puede ser normal o presentar un engrosamiento focal o difuso. Si se observa intacta la zona de transición y una banda de realce precoz subendometrial, puede descartarse la infiltración del miometrio13,17 (fig. 1). Independientemente de la secuencia de RM la interfase tumor-miometrio ha de ser lisa, nítida y bien definida. En estadio IB (fig. 2) el tumor infiltra el miometrio en menos del 50% de su espesor, y la zona de transición y la banda de realce precoz subendometrial son irregulares o están interrumpidas. Si estas referencias no están presentes debe sugerirse un estadio IB. Si durante la fase de equilibrio se observa tumor hipointenso en el miometrio externo estamos ante una infiltración profunda del miometrio, lo que corresponde a un estadio IC. La sensibilidad y la especificidad de la RM para establecer la profundidad de la infiltración del miometrio oscilan entre el 69 y el 94%, y entre el 64 y el 100%, respectivamente13,14,27,29,34. Sin Radiología. 2008;50:449-61 451 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix TABLA 2. Protocolo de resonancia magnética para los carcinomas de endometrio y de cérvix Carcinoma Secuencia Plano Justificación Endometrio Potenciada en T1 Axial Valoración de la médula ósea y adenopatías Potenciada en T2 Axial Valoración de adenopatías y visión global de la pelvis Fast espín eco T2 Sagital Valoración del tumor y de su relación con el miometrio Fast espín eco T2 Axial oblicua (eje corto) Valoración de la infiltración del miometrio en otro plano Potenciada en T1 (sin y con contraste) 3D eco de gradiente con supresión grasa Sagital a los 0, 1, 3 y 5 minutos y axial (eje corto) a los 4 minutos Valoración de la infiltración del miometrio superficial (0 y 1 min) y profundo (3 min) y de la infiltración cervical (5 min) Valoración de la infiltración del miometrio profundo (4 min) en otro plano Cérvix Potenciada en T1 (abdomen superior y pelvis) Axial Valoración de la médula ósea y adenopatías Potenciada en T2 con supresión grasa Axial Valoración de adenopatías y visión global de la pelvis (incluyendo hidronefrosis) Potenciada en T2 Sagital Valoración del tumor y de su extensión al útero, la vagina, la vejiga y el recto Potenciada en T2 Axial oblicua (eje corto) Valoración de la infiltración del parametrio en otro plano La secuencia potenciada en T1 puede ser espín eco convencional o eco de gradiente, que es la que se realiza en numerosos centros por razones de tiempo. La secuencia eco de gradiente es más rápida, aunque presenta una calidad de imagen discretamente menor. A B Fig. 1. Mujer de 64 años con carcinoma endometrial estadio IA. (A) y (B) imágenes sagitales potenciadas en T2 (A) y en T1 con supresión grasa, tras la administración de contraste en fase precoz (60 segundos) (B) que muestran un carcinoma (T) limitado al endometrio. La zona de unión (flechas en A) es indistinguible en T2. Sin embargo, la visualización de una banda de realce subendometrial intacta en T1 (flechas en B) excluye la infiltración de miometrio. embargo, en algunas situaciones concretas, la determinación del grado de infiltración del miometrio puede fallar, como, por ejemplo, cuando el tumor es un gran pólipo que distiende la cavidad uterina y el miometrio está muy adelgazado por la compresión, pero no existe una invasión real de su capa profunda por el carcinoma al que rodea13,21,35. Otras causas de error pueden ser la coexistencia de procesos benignos (como la adenomiosis o los miomas)15,32,35, las anomalías congénitas, los casos en los que la diferenciación entre las distintas capas no sea posible15, la falta de contraste suficiente entre el tumor y el miometrio15,21,29,36-38 y la extensión tumoral a los cuernos uterinos (tabla 3). 452 Estadio II En él se incluyen los tumores que sobrepasan el cuerpo uterino y llegan al cérvix. En el estadio IIA la infiltración del endocérvix aparece como una dilatación del orificio cervical interno y del canal endocervical, con preservación del estroma fibrocervical normal, que es hipointenso (fig. 3). Cuando en las imágenes potenciadas en T2 se observa cómo el estroma fibrocervical hipointenso se interrumpe por la alta señal del tumor, el cuello uterino está infiltrado, lo que corresponde a un estadio IIB. Como el tumor es hipointenso respecto a la mucosa del cuello uterino en la fase tardía del estudio dinámico con contraste, la interrupción del realce normal de la mucosa cervical Radiología. 2008;50:449-61 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix A B Fig. 2. Mujer de 65 años con carcinoma endometrial estadio IB. (A) y (B) imágenes sagitales potenciadas en T2 (A) y en T1 con supresión grasa y con contraste (B) donde se aprecia un carcinoma endometrial (T) con invasión del miometrio. Nótese la interrupción de la zona de unión (flechas en A). El tumor invade menos del 50% del miometrio (flechas en B), lo que se observa mejor en T1. indica la invasión tumoral del estroma cervical, y es útil para diferenciarlo de una protrusión hacia el endocérvix de un tumor polipoideo que se origina primariamente en la cavidad endometrial. La precisión de la RM para detectar la infiltración del cuello uterino alcanza un 92%, con una sensibilidad que oscila entre el 75 y el 80% y una especificidad entre el 94 y el 96%14,39. Estadio III Incluye los tumores que sobrepasan el útero, pero no la pelvis verdadera. La afectación del parametrio, estadio IIIA, se manifiesta como una interrupción de la serosa con extensión directa a la grasa adyacente. En el estadio IIIB el tumor se extiende a la parte superior de la vagina, con una pérdida focal de la hipointensidad normal de las paredes vaginales. El estadio IIIC se caracteriza por la aparición de adenopatías. Estadio IV Corresponde al tumor que se extiende más allá de la pelvis verdadera, o que invade el recto o la vejiga. La pérdida de la hipointensidad normal de la pared vesical o rectal corresponde a un estadio IVA15. El estadio IVB se caracteriza por la aparición de metástasis a distancia, ascitis maligna o implantes peritoneales. Los implantes peritoneales se detectan mejor en la fase tardía de los estudios dinámicos con contraste40. TABLA 3. Clasificación TNM y FIGO del carcinoma de endometrio TNM T1 FIGO* Descripción I Tumor limitado al útero T1a IA Limitado al endometrio T1b IB Invade la mitad o menos del miometrio T1c IC Invade más de la mitad del miometrio II Tumor que invade el cuello uterino IIA Afectación exclusivamente glandular T2 T2a T2b IIB Invade el estroma cervical T3 y/o N1 III Diseminación local y/o regional T3a IIIA Invade la serosa, los anejos o ambos y/o citología peritoneal positiva T3b IIIB Afectación vaginal T3c IIIC Adenopatías pélvicas, paraaórticas o ambas T4 IV Extensión fuera de la pelvis o infiltración vesical o rectal T4a IVA Infiltración vesical, de la mucosa del recto o de ambas M1 IVB Metástasis a distancia *FIGO: la estadificación según la FIGO se basa únicamente en los hallazgos quirúrgicos e histológicos; las técnicas de imagen, a pesar de su utilidad en la valoración preoperatoria, no están reconocidas como método para la estadificación definitiva. Radiología. 2008;50:449-61 453 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix A B Fig. 3. Mujer de 78 años con carcinoma endometrial estadio IIA. (A) y (B) imágenes sagitales potenciadas en T2 (A) y en T1 con supresión grasa y con contraste (B) en las que se aprecia un carcinoma endometrial (T) con infiltración profunda del miometrio y extensión del tumor al conducto del cérvix (flecha en A). Nótese la preservación de la hipointensidad de señal normal del estroma cervical (asteriscos). El realce normal de la mucosa del cuello uterino (flecha en B) excluye la infiltración del estroma. Incidentalmente se observa un pequeño mioma (L). Sarcomas uterinos (leiomiosarcoma, sarcoma endometrial, tumor mülleriano mixto maligno) Los sarcomas uterinos suelen ser tumores muy malignos. Son infrecuentes, con una incidencia de aproximadamente dos casos por cada 100.000 mujeres mayores de 20 años, y representan del 3 al 5% de todos los tumores malignos del útero. Generalmente son lesiones de gran tamaño en el momento del diagnóstico, por lo que es difícil precisar el origen exacto de la masa. La RM permite una determinación preoperatoria adecuada, tanto del tamaño del útero como de su grado de afectación. Las características del tumor en la RM no son específicas, por lo que se hacen generalmente indistinguibles de los carcinomas endometriales8,41,42. Sin embargo, los sarcomas suelen alcanzar un gran tamaño y tienen una apariencia heterogénea, con áreas hemorrágicas y de necrosis quística. En el momento del diagnóstico es habitual que estén infiltrando profundamente el miometrio y ya se hayan diseminado al peritoneo (fig. 4). B C A Fig. 4. Mujer de 55 años con un tumor mixto mülleriano maligno. (A), (B) y (C) imagen sagital potenciada en T2 (A), imagen sagital potenciada en T1 con supresión grasa y con contraste (B) e imagen axial oblicua potenciada en T2 (C) que muestran una gran masa heterogénea (T) con áreas de necrosis quística. El tumor infiltra el miometrio profundo y el estroma del cérvix (asteriscos en A y B). Obsérvese la presencia de adenopatías metastásicas en ambas cadenas obturatrices (N en C) e hidronefrosis izquierda asociada (flecha en C). 454 Radiología. 2008;50:449-61 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix Los leiomiosarcomas constituyen sólo el 1,3% de los tumores uterinos. La mayoría son tumores que crecen en un miometrio normal, pero también se han descrito casos de transformaciones malignas de miomas preexistentes. Algunos autores han sugerido que el contorno irregular en un mioma uterino puede indicar una transformación maligna8,43. Sin embargo, la RM no es capaz de diferenciar con fiabilidad un mioma con fenómenos de degeneración benigna de un leiomiosarcoma. Resonancia magnética de los tumores malignos del cuello uterino El tipo histológico más frecuente de carcinoma de cérvix es el carcinoma escamoso (90%) seguido del adenocarcinoma (510%). Otros tipos histológicos más infrecuentes son el carcinoma de células pequeñas, el carcinoma adenoescamoso y el linfoma. Los hallazgos de estos últimos en la RM son similares a los del carcinoma escamoso44. El carcinoma de células pequeñas, sin embargo, muestra habitualmente signos de mayor agresividad, como la afectación del parametrio, adenopatías pélvicas y metástasis a distancia44. Carcinoma de cérvix El carcinoma de cérvix es la tercera neoplasia ginecológica en frecuencia9. En 2007 se esperaban en Estados Unidos 11.150 nuevos casos y 3.670 muertes por este tumor9. La supervivencia a los 5 años oscila entre un 92% para el estadio I y un 17% para el estadio IV9. En los últimos 50 años se ha producido un marcado descenso en el número de muertes producidas por este tipo de cáncer gracias al desarrollo de la prueba de Papanicolau. Sin embargo, la mejora de la supervivencia en los carcinomas en estadio avanzado ha sido mínima. Protocolo de resonancia magnética La preparación de la paciente y la selección de la antena es similar a lo mencionado para el carcinoma de endometrio. Se puede utilizar una antena de cuerpo, que proporciona una exactitud similar para la estadificación que la de una phased-array. Sin embargo, esta última ofrece una mejor resolución y disminuye el tiempo de exploración45,46. El protocolo básico debe incluir una secuencia axial SE potenciada en T1 con un FOV amplio y una secuencia FSE potenciada en T2 en planos axial y sagital con un FOV pequeño (tabla 1). Los tumores de cérvix se valoran mejor en las secuencias potenciadas en T2. El plano sagital permite determinar la extensión tumoral hacia el cuerpo uterino y la vagina. Debe realizarse una secuencia FSE potenciada en T2 en un plano axial oblicuo perpendicular al eje longitudinal del cérvix para valorar la afectación del parametrio47. Para este mismo fin, sobre todo en mujeres jóvenes que presentan plexos vasculares vaginales y pericervicales prominentes, la secuencia axial T2 puede hacerse con supresión grasa. Para detectar adenopatías debe incluirse una secuencia axial potenciada en T1 del abdomen completo. No es necesario administrar contraste iv para estudiar los tumores del cuello uterino porque no mejora la precisión diagnós- tica con respecto a las secuencias potenciadas en T248,49. Sin embargo, un estudio dinámico con contraste sí puede ayudar a diferenciar los cambios posquirúrgicos de la recidiva tumoral3. Impacto de las técnicas de imagen en el tratamiento La estadificación del carcinoma de cérvix sigue haciéndose según los criterios clínicos que establece la FIGO que, en comparación con la estadificación quirúrgica, pueden llegar a ser incorrectos hasta en un 32% de las pacientes en estadio IB y en más del 65% en estadio III50,51. Las limitaciones de la exploración física están en la imposibilidad para valorar adecuadamente la afectación del parametrio o la invasión de la pelvis, la falta de exactitud para determinar el tamaño tumoral, sobre todo en los tumores endocervicales, y la imposibilidad de detectar adenopatías metastásicas52,53. Como todo ello tiene valor pronóstico, su adecuada evaluación preoperatoria es clave para elegir el tratamiento más apropiado para cada paciente. Lo más importante en la estadificación del carcinoma de cérvix es diferenciar entre la enfermedad limitada (estadios I y IIA), cuyo tratamiento es quirúrgico, y la enfermedad extendida o avanzada (estadios IIB o mayor) en la que el tratamiento es la radioterapia, asociada o no a quimioterapia. La RM es la mejor técnica de imagen para determinar con exactitud la localización del tumor (exofítico o endocervical), su tamaño, el grado de infiltración del estroma y la extensión al cuerpo uterino44,54-56. La precisión de la RM para determinar el tamaño tumoral es muy elevada, con variaciones menores de 0,5 cm respecto a lo medido en la pieza quirúrgica en un 70-90% de los casos57-59. Además, la RM es útil para detectar las adenopatías metastásicas5. Diagnóstico La RM se recomienda en pacientes en estadio clínico IB o superior cuando la lesión sea mayor de 2 cm44,54,55, puesto que existe una probabilidad relativamente alta de que esté afectado el parametrio y de que existan metástasis ganglionares. Otras indicaciones de la RM son las neoplasias en mujeres embarazadas y las pacientes con lesiones endocervicales56. El tumor suele ser isointenso al cuello uterino normal en las secuencias potenciadas en T1, por lo que, en ellas, puede pasar desapercibido. En las secuencias potenciadas en T2 es hiperintenso y, por tanto, fácilmente distinguible del estroma cervical normal, que es hipointenso. En el estudio dinámico con contraste los tumores pequeños realzan homogéneamente y antes que el estroma cervical normal. Los tumores más grandes suelen presentar necrosis, y pueden realzar o no, aunque generalmente presentan un halo de realce periférico que facilita su delimitación60,61. Estadificación La estadificación del carcinoma de cérvix se basa en los sistemas de clasificación TNM y de la FIGO (tabla 4). En estudios llevados a cabo en un único centro la RM ha demostrado ser superior a la TC y a la exploración física para valorar la infiltración del parametrio7,62,63. La precisión de la RM en la estadificación oscila entre el 75 y el 96%57-59,62-65. Un estudio multicéntrico prospectivo publicado recientemente y llevado a cabo de forma conjunta por la American College of Radiology Imaging Network (ACRIN) y el Grupo de Oncología Ginecológica (GOG), ha comparado la RM, la TC y la estadificación clínica de la FIGO en la valoración preterapéutica de mujeres con carcinoma de Radiología. 2008;50:449-61 455 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix TABLA 4. Clasificación TNM y FIGO del carcinoma cervical TNM FIGO* Descripción T1 I Tumor limitado al cérvix T1a IA Carcinoma invasivo identificado sólo microscópicamente T1a1 IA1 Infiltración estromal de hasta 3 mm en profundidad y de hasta 7 mm de extensión horizontal T1a2 IA2 Infiltración estromal de entre 3 y 5 mm en profundidad y de hasta 7 mm de extensión horizontal T1b1 IB1 Tumor clínicamente visible menor de 4 cm T1b2 IB2 Tumor clínicamente visible mayor de 4 cm II Tumor que se extiende fuera del cérvix y a la parte superior de la vagina (no a la zona inferior) T2a IIA Sin infiltración del parametrio T2b IIB Con infiltración del parametrio III Tumor que afecta a la pared pélvica, al tercio inferior de la vagina o a ambos T3a IIIA Afectación del tercio inferior de la vagina T3b IIIB Extensión a la pared pélvica, hidronefrosis o ambos T4 IVA Tumor que afecta a la vejiga, el recto o con metástasis a distancia M1 IVB Metástasis a distancia T2 T3 *FIGO: la estadificación según la FIGO se basa únicamente en los hallazgos quirúrgicos e histológicos; las técnicas de imagen, a pesar de su utilidad en la valoración preoperatoria, no están reconocidas como método para la estadificación definitiva. cérvix invasor en estadio precoz66. El estudio ha puesto de manifiesto que, globalmente, los resultados de la RM son similares a los de la TC en la estadificación prequirúrgica, pero se ha mostrado superior para ver el tumor y para valorar el parametrio. Además, la concordancia entre lectores fue superior con la RM que con la TC66. Estadio I En él se incluyen los tumores limitados al cuello uterino. El estadio IA corresponde al tumor microinvasor que no se puede detectar de forma fiable en imágenes potenciadas en T2. Sin embargo, la microinvasión puede determinarse mediante secuencias dinámicas con contraste en las que aparece como una zona de realce intenso en la fase arterial precoz60. La precisión para diferenciar entre invasión superficial o profunda (> 3 mm) se ha estimado en un 76% para las imágenes potenciadas en T2, en un 98% para el estudio dinámico con contraste y en un 63% para las potenciadas en T1 tras la administración de contraste60. En el estadio IB el tumor es hiperintenso en T2 con respecto al estroma fibrocervical hipointenso adyacente. Las mujeres jóvenes en estadio IA, o con tumores pequeños en estadio IB, que desean preservar su capacidad reproductiva, pueden ser tratadas mediante traquelectomía, técnica quirúrgica en la que se extirpa el cuello del útero conservando el cuerpo y, por tanto, la fertilidad. La RM es una técnica precisa para valorar el grado de infiltración del miometrio y permite, además, evaluar adecuadamente la relación entre el tumor y el orificio cervical interno con una sensibilidad del 100% y una especificidad del 96%67. Estadio II En el estadio IIA las secuencias potenciadas en T2 muestran una afectación de los dos tercios superiores de la pared de la vagina, pero sin afectación del parametrio. La infiltración del estroma cervical (fig. 5) y la extensión al parametrio corresponde a un estadio IIB. La sensibilidad de la RM para valorar el parametrio es del 69% y la especificidad del 93%57-59,62-65. La visualización de un estroma hipointenso intacto excluye la afectación del para- 456 metrio con un valor predictivo negativo del 94-100%56. Si, por el contrario, el estroma está interrumpido focalmente, suele estar infiltrado en todo su espesor. Sin embargo, para tener seguridad de la infiltración del parametrio es necesario observar que el plano entre el tumor y el parametrio es una línea espiculada, que hay una extensión al parametrio de la intensidad de señal de partes blandas del tejido tumoral (fig. 6) o que los vasos periuterinos están englobados por el tumor56. Un inconveniente importante de las imágenes potenciadas en T2 es que en los tumores grandes sobreestima la afectación del parametrio. En ellos, su precisión diagnóstica es del 70%, lo que contrasta con la que alcanza en los tumores pequeños (precisión del 96%). La razón está en que los tumores grandes pueden provocar edema estromal por compresión o inflamación56 (tabla 3). En consecuencia, en las pacientes con tumores de gran tamaño los falsos positivos de infiltración del parametrio pueden aumentar, y esto debe ser tenido en cuenta a la hora de planificar el tratamiento en ellas. Estadio III En el estadio IIIA el tumor invade el tercio inferior de la vagina sin extensión a la pared pélvica. Si tal extensión existe (por ejemplo de la musculatura pélvica o de los vasos ilíacos) o el tumor produce hidronefrosis estamos ante un tumor en estadio IIIB. Estadio IV Es aquél en el que el tumor se extiende a los órganos adyacentes (vejiga o recto) o produce metástasis a distancia (fig. 7). Los hallazgos de RM que sugieren la afectación de la pared vesical son la interrupción focal o difusa de la línea hipointensa correspondiente a la pared posterior de la vejiga, el engrosamiento nodular o irregular de la pared, la existencia de una masa que impronta en la luz vesical o la presencia de edema bulloso. La infiltración del recto es poco frecuente y produce un engrosamiento focal de la pared anterior del recto. La existencia de bandas o líneas gruesas entre el tumor y la pared del recto puede indicar igualmente la infiltración rectal. Radiología. 2008;50:449-61 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix A B Fig. 5. Mujer de 47 años con carcinoma cervical estadio IIB. (A) y (B) imagen sagital potenciada en T2 (A) e imagen axial potenciada en T2 con supresión grasa (B) que muestran un pequeño tumor del cérvix (T) que afecta al labio anterior. Existe infiltración del estroma del cuello uterino en la parte izquierda, lo que se aprecia como una interrupción focal del anillo hipointenso (flecha en B). El estudio histológico mostró infiltración del espesor completo del estroma con extensión al parametrio izquierdo de 2 mm. La sensibilidad de la RM para detectar la infiltración vesical o del recto ha oscilado entre el 71 y el 100%, y la especificidad entre el 88 y el 91%59,64,68. La preservación de estas estructuras puede establecerse de forma fiable mediante RM (con un valor predictivo negativo del 100%), lo cual tiene una repercusión diagnóstica, puesto que es posible evitar cistoscopias o rectoscopias en estas pacientes, y con ello una reducción de los costes de la estadificación, así como de la morbilidad68. Aunque la existencia de adenopatías pélvicas no cambia el estadio de la FIGO, la presencia de ganglios metastásicos inguinales o paraaórticos clasifica el tumor en un estadio IVB. Papel de la resonancia magnética en la valoración de adenopatías en tumores ginecológicos La existencia de adenopatías metastásicas en pacientes con carcinoma de endometrio o cérvix ensombrece el pronóstico y supone un considerable descenso de la tasa de supervivencia69. Por ejemplo, en mujeres en un estadio IB o IIA tratadas quirúrgicamente la supervivencia cae del 85-90% al 50-55% en el caso de que existan adenopatías56. La afectación linfática, que no se tiene en consideración en el sistema de estadificación de la B C A Fig. 6. Mujer de 42 años con carcinoma del cuello uterino estadio IIB. (A), (B) y (C) imágenes sagital (A), axial oblicua (B) y coronal oblicua (C) potenciadas en T2 que muestran un tumor cervical (T) que afecta a ambos labios, anterior y posterior. El tumor infiltra bilateralmente el estroma fibrocervical, lo que aparece como pérdida del anillo hipointenso normal, y se extiende a ambos parametrios (flechas en B). La imagen coronal oblicua muestra la invasión bilateral del parametrio (flechas en C) y la existencia de adenopatías (N en C). Radiología. 2008;50:449-61 457 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix A B C Fig. 7. Mujer de 39 años con cáncer de cérvix estadio IVB. (A), (B) y (C): imágenes sagital (A) y axial con supresión grasa (B y C) potenciadas en T2 que muestran un gran tumor cervical (T en A y B) en el labio anterior del cérvix. La lesión infiltra la pared vesical posterior, la vagina y la uretra (asterisco en C). FIGO para el carcinoma de cérvix, es un factor importante para indicar o no la radioterapia adyuvante, tanto en el carcinoma de endometrio como en el de cérvix. La linfadenectomía es la mejor técnica para el diagnóstico de las metástasis ganglionares; sin embargo, conlleva un riesgo alto de complicaciones, por lo que hay que ser cauto a la hora de seleccionar las pacientes que deben someterse a ella11. Por tanto, desde un punto de vista clínico, la detección preoperatoria de adenopatías es muy importante en mujeres con cáncer de endometrio o del cuello uterino. La TC y la RM muestran una precisión similar en la detección de adenopatías: 83-90% para la TC y 86-90% para la RM7,62,63,70,71. Con ambas técnicas el criterio utilizado es el tamaño, lo que supone una sensibilidad baja (43-73% para la RM) dada la imposibilidad de detectar metástasis en ganglios de tamaño normal5,14,64. Desde hace poco disponemos de contrastes de RM selectivos para los ganglios linfáticos, como las partículas USPIO (ultrasmall superparamagnetic iron oxide), que han producido un aumento de la sensibilidad para detectar adenopatías metastásicas en pacientes con cáncer de endometrio o cérvix, manteniendo la alta especificidad5. Comparando ganglio a ganglio, Rockall et al5 mostraron en su estudio un incremento de la sensibilidad del 29% usando el criterio estándar del tamaño > 1 cm, a un 93% usando los criterios USPIO, y del 27 al 100% comparando los mismos criterios en cada paciente. En el carcinoma del cuello uterino, la tomografía por emisión de positrones (PET)-TC ha demostrado ser de utilidad para detectar adenopatías, con una sensibilidad del 100% y una especificidad del 99,7% para los ganglios de más de 5 mm72. Además, la captación de 18 fluorodesoxiglucosa (18F-FDG) por el tumor primario del cérvix y por sus adenopatías en la FDG-PET ha sido descrita como un factor pronóstico independiente de la supervivencia libre de enfermedad. Por ello, la PET-TC puede ser la técnica de imagen de elección para la evaluación preterapéutica de pacientes con carcinoma de cérvix avanzado, con el fin de valorar adecuadamente la afectación ganglionar y determinar el pronóstico73. 458 Recidiva de la enfermedad La vagina (30-50% de las pacientes) es el lugar donde recidiva con mayor frecuencia el carcinoma de endometrio. En el resto de los casos la recidiva puede manifestarse como adenopatías pélvicas o paraaórticas, diseminación sistémica de la enfermedad al hígado, el pulmón o el hueso, o como carcinomatosis peritoneal. La recidiva del carcinoma de cérvix puede presentarse de forma típica o atípica; la típica consiste en la recurrencia en el muñón vaginal y la aparición de adenopatías. Sin embargo, con el aumento del número de pacientes sometidas a radioterapia pélvica cada vez es más frecuente encontrar patrones de recidiva menos típicos. Entre ellos están la carcinomatosis peritoneal o las metástasis a órganos sólidos como el hígado, las suprarrenales, el pulmón o el hueso74. La recidiva pélvica puede afectar a otros órganos pélvicos75. Así, la presencia de una hiperintensidad anormal en la pared de la vejiga o del recto en secuencias potenciadas en T2 sugiere su infiltración. La recidiva de los carcinomas de cérvix o endometrio en el muñón vaginal tiene una apariencia similar. Se caracteriza por la pérdida de la línea hipointensa normal de la pared vaginal asociada a una masa de partes blandas, hiperintensa en T2, similar al tumor primario (fig. 8). En las pacientes sometidas a radioterapia es crucial diferenciar entre la recidiva tumoral y los cambios provocados por el tratamiento. En la RM la recidiva tumoral aparece generalmente como una masa heterogénea en T2, con un aspecto similar al tumor primario75 (fig. 9). Sin embargo, esta secuencia tiene una especificidad baja para detectar cambios benignos, como la inflamación o el edema, que son una causa de incremento de la intensidad de señal en T2. Los estudios de RM dinámica con contraste han supuesto un aumento de la especificidad para el diagnóstico de la recidiva tumoral, alcanzándose el máximo realce del tumor entre los 45 y los 90 segundos tras la administración del contraste3. No obstante, hay que saber que los cambios iniciales tras la radioterapia y la infección también pueden Radiología. 2008;50:449-61 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix A B Fig. 8. Mujer de 45 años con recidiva de tumor de cérvix tras histerectomía. (A) y (B) imágenes sagital (A) y axial con supresión grasa (B) potenciadas en T2 que muestran una masa de intensidad de señal intermedia en el muñón vaginal compatible con una recidiva tumoral. A B Fig. 9. Mujer de 67 años con recidiva de un carcinoma del cuello uterino tras radioterapia. (A) y (B) imágenes sagital (A) y axial con supresión grasa (B) potenciadas en T2 que muestran una masa heterogénea en el cuerpo uterino (T) compatible con una recidiva tumoral. Obsérvese la existencia de adenopatías en la cadena ilíaca externa derecha (N en B). realzar con el contraste. Para aclarar el diagnóstico en los casos dudosos habrá que aplicar otras medidas como realizar controles periódicos, llevar a cabo biopsias guiadas por técnicas de imagen o hacer uso de la PET. Conclusión A pesar de no estar incorporada de manera oficial al sistema de estadificación de la FIGO, la RM es universalmente aceptada como la técnica de imagen más fiable y precisa para el diagnóstico, estadificación, planificación terapéutica y seguimiento de los carcinomas de endometrio y de cérvix. Los protocolos de estudio deben optimizarse de modo que sea posible obtener los mejores resultados evitando al máximo los errores de interpretación. En el carcinoma endometrial la RM es una técnica fiable para detectar el grado de infiltración del miometrio y del cérvix, que se correlaciona con el riesgo de que existan metástasis ganglionares. Por lo tanto, también lo es para seleccionar las pacientes que sólo requieren biopsia ganglionar frente a las que deben ser sometidas a linfadenectomía por un equipo quirúrgico especializado. La RM tiene un papel primordial en la evaluación del carcinoma de cérvix, sobre todo a la hora de excluir la afectación del parametrio, lo que determinará qué pacientes tienen que someterse a una intervención quirúrgica y quiénes a radioterapia. También ayuda a seleccionar a aquellas pacientes que quieran Radiología. 2008;50:449-61 459 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix preservar su capacidad reproductiva y que tengan un estadio inicial del tumor. Por otro lado, también es útil para la detección de recidivas tumorales tras el tratamiento. En resumen, la RM tiene un papel fundamental en la estadificación tumoral, en la selección de pacientes para determinados tratamientos y en la detección de recidivas tumorales. 21. Sironi S, De Cobelli F, Scarfone G, Colombo E, Bolis G, Ferrari A, et al. Carcinoma of the cervix: value of plain and gadolinium-enhanced MR imaging in assessing degree of invasiveness. Radiology. 1993;188:797-801. 22. Goff BA, Rice LW. Assessment of depth of myometrial invasion in endometrial adenocarcinoma. Gynecol Oncol. 1990;38:46-8. 23. Quinlivan JA, Petersen RW, Nicklin JL. Accuracy of frozen section for the operative management of endometrial cancer. BJOG. 2001;108:798-803. 24. Creutzberg CL. Lymphadenectomy in apparent early-stage endometrial carcinoma: do numbers count? J Clin Oncol. 2005;23:3653-5. Bibliografía 1. Hricak H, Mendelson E, Böhm-Vélez M, Bree R, Finberg H, Fishman EK, et al. Role of imaging in cancer of the cervix. American College of Radiology. ACR appropriateness criteria. Radiology. 2000;215 Suppl:925-30. 25. Maggino T, Romagnolo C, Landoni F, Sartori E, Zola P, Gadducci A. An analysis of approaches to the management of endometrial cancer in North America: a CTF study. Gynecol Oncol. 1998;68:274-9. 26. Barwick TD, Rockall AG, Barton DP, Sohaib SA. Imaging of endometrial adenocarcinoma. Clin Radiol. 2006;61:545-55. 2. Hricak H, Mendelson E, Böhm-Vélez M, Bree RL, Finberg H, Fishman EK, et al. Endometrial cancer of the uterus. American College of Radiology. ACR appropriateness criteria. Radiology. 2000;215 Suppl:947-53. 27. Ito K, Matsumoto T, Nakada T, Nakanishi T, Fujita N, Yamashita H. Assessing myometrial invasion by endometrial carcinoma with dynamic MRI. J Comput Assist Tomogr. 1994;18:77-86. 3. Kinkel K, Ariche M, Tardivon AA, Spatz A, Castaigne D, Lhomme C, et al. Differentiation between recurrent tumor and benign conditions after treatment of gynecologic pelvic carcinoma: value of dynamic contrast-enhanced subtraction MR imaging. Radiology. 1997;204:55-63. 28. Joja I, Asakawa M, Asakawa T, Nakagawa T, Kanazawa S, Kuroda M, et al. Endometrial carcinoma: dynamic MRI with turbo-FLASH technique. J Comput Assist Tomogr. 1996;20:878-87. 4. Scheidler J, Hricak H, Yu KK, Subak L, Segal MR. Radiological evaluation of lymph node metastases in patients with cervical cancer: a meta-analysis. JAMA. 1997;278:1096-101. 5. Rockall AG, Sohaib SA, Harisinghani MG, Babar SA, Singh N, Jeyarajah AR, et al. Diagnostic performance of nanoparticle-enhanced magnetic resonance imaging in the diagnosis of lymph node metastases in patients with endometrial and cervical cancer. J Clin Oncol. 2005;23:2813-21. 6. Heller D, Hricak H. Cost-effectiveness of new technologies for staging endometrial cancer. Eur Radiol. 2000;10 Suppl 3:S381-S5. 7. Hricak H, Powell CB, Yu KK, Washington E, Subak LL, Stern JL, et al. Invasive cervical carcinoma: role of MR imaging in pretreatment work-up—cost minimization and diagnostic efficacy analysis. Radiology. 1996;198:403-9. 8. Rha SE, Byun JY, Jung SE, Lee SL, Cho SM, Hwang SS, et al. CT and MRI of uterine sarcomas and their mimickers. AJR Am J Roentgenol. 2003;181: 1369-74. 9. Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007;57:43-66. 10. Larson DM, Connor GP, Broste SK, Krawisz BR, Johnson KK. Prognostic significance of gross myometrial invasion with endometrial cancer. Obstet Gynecol. 1996;88:394-8. 11. Frei KA, Kinkel K, Bonel HM, Lu Y, Zaloudek C, Hricak H. Prediction of deep myometrial invasion in patients with endometrial cancer: clinical utility of contrast-enhanced MR imaging-a meta-analysis and Bayesian analysis. Radiology. 2000;216:444-9. 12. Shibutani O, Joja I, Shiraiwa M, Asakawa T, Miyagi Y, Kudo T, et al. Endometrial carcinoma: efficacy of thin-section oblique axial MR images for evaluating cervical invasion. Abdom Imaging. 1999;24:520-6. 13. Yamashita Y, Harada M, Sawada T, Takahashi M, Miyazaki K, Okamura H. Normal uterus and FIGO stage I endometrial carcinoma: dynamic gadolinium-enhanced MR imaging. Radiology. 1993;186:495-501. 14. Manfredi R, Mirk P, Maresca G, Margariti PA, Testa A, Zannoni GF, et al. Local-regional staging of endometrial carcinoma: role of MR imaging in surgical planning. Radiology. 2004;231:372-8. 15. Ascher SM, Reinhold C. Imaging of cancer of the endometrium. Radiol Clin North Am. 2002;40:563-76. 16. Eltabbakh GH, Shamonki MI, Moody JM, Garafano LL. Laparoscopy as the primary modality for the treatment of women with endometrial carcinoma. Cancer. 2001;91:378-87. 17. Wong CK, Wong YH, Lo LS, Tai CM, Ng TK. Laparoscopy compared with laparotomy for the surgical staging of endometrial carcinoma. J Obstet Gynaecol Res. 2005;31:286-90. 18. Berman ML, Ballon SC, Lagasse LD, Watring WG. Prognosis and treatment of endometrial cancer. Am J Obstet Gynecol. 1980;136:679-88. 19. Boronow RC, Morrow CP, Creasman WT, Disaia PJ, Silverberg SG, Miller A, et al. Surgical staging in endometrial cancer: clinical–pathologic findings of a prospective study. Obstet Gynecol. 1984;63:825-32. 20. Piver MS, Lele SB, Barlow JJ, Blumenson L. Paraaortic lymph node evaluation in stage I endometrial carcinoma. Obstet Gynecol. 1982;59:97-100. 460 29. Seki H, Kimura M, Sakai K. Myometrial invasion of endometrial carcinoma: assessment with dynamic MR and contrast-enhanced T1-weighted images. Clin Radiol. 1997;52:18-23. 30. Kim SH, Kim HD, Song YS, Kang SB, Lee HP. Detection of deep myometrial invasion in endometrial carcinoma: comparison of transvaginal ultrasound, CT, and MRI. J Comput Assist Tomogr. 1995;19:766-72. 31. Kinkel K, Kaji Y, Yu KK, Segal MR, Lu Y, Powell CB, et al. Radiologic staging in patients with endometrial cancer: a meta-analysis. Radiology. 1999;212:711-8. 32. Hricak H, Stern JL, Fisher MR, Shapeero LG, Winkler ML, Lacey CG. Endometrial carcinoma staging by MR imaging. Radiology. 1987;162:297-305. 33. Hricak H, Rubinstein LV, Gherman GM, Karstaedt N. MR imaging evaluation of endometrial carcinoma: results of an NCI cooperative study. Radiology. 1991;179:829-32. 34. Sironi S, Colombo E, Villa G, Taccagni G, Belloni C, Garancini P, et al. Myometrial invasion by endometrial carcinoma: assessment with plain and gadolinium-enhanced MR imaging. Radiology. 1992;185:207-12. 35. Scoutt LM, McCarthy SM, Flynn SD, Lange RC, Long F, Smith RC, et al. Clinical stage I endometrial carcinoma: pitfalls in preoperative assessment with MR imaging—work in progress. Radiology. 1995;194:567-72. 36. Lee EJ, Byun JY, Kim BS, Koong SE, Shinn KS. Staging of early endometrial carcinoma: assessment with T2-weighted and gadolinium-enhanced T1weighted MR imaging. Radiographics. 1999;19:937-45. 37. Lien HH, Blomlie V, Trope C, Kaern J, Abeler VM. Cancer of the endometrium: value of MR imaging in determining depth of invasion into the myometrium. AJR Am J Roentgenol. 1991;157:1221-3. 38. Yamashita Y, Mizutani H, Torashima M, Takahashi M, Miyazaki K, Okamura H, et al. Assessment of myometrial invasion by endometrial carcinoma: transvaginal sonography vs contrast-enhanced MR imaging. AJR Am J Roentgenol. 1993;161:595-9. 39. Seki H, Takano T, Sakai K. Value of dynamic MR imaging in assessing endometrial carcinoma involvement of the cervix. AJR Am J Roentgenol. 2000;175:171-6. 40. Low RN, Duggan B, Barone RM, Saleh F, Song SY. Treated ovarian cancer: MR imaging, laparotomy reassessment, and serum CA-125 values compared with clinical outcome at 1 year. Radiology. 2005;235:918-26. 41. Sahdev A, Sohaib SA, Jacobs I, Shepherd JH, Oram DH, Reznek RH. MR imaging of uterine sarcomas. AJR Am J Roentgenol. 2001;177:1307-11. 42. Shapeero LG, Hricak H. Mixed müllerian sarcoma of the uterus: MR imaging findings. AJR Am J Roentgenol 1989;153:317-9. 43. Pattani SJ, Kier R, Deal R, Luchansky E. MRI of uterine leiomyosarcoma. Magn Reson Imaging. 1995;13:331-3. 44. Okamoto Y, Tanaka YO, Nishida M, Tsunoda H, Yoshikawa H, Itai Y. MR imaging of the uterine cervix: imaging–pathologic correlation. Radiographics. 2003;23:425-45. 45. Hawighorst H, Schoenberg SO, Knapstein PG, Knopp MV, Schaeffer U, Essig M, et al. Staging of invasive cervical carcinoma and of pelvic lymph nodes by high resolution MRI with a phasedarray coil in comparison with pathological findings. J Comput Assist Tomogr. 1998;22:75-81. Radiología. 2008;50:449-61 Documento descargado de http://www.elsevier.es el 18/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Sala E et al. RM de los tumores malignos de endometrio y cérvix 46. Yu KK, Hricak H, Subak LL, Zaloudek CJ, Powell CB. Preoperative staging of cervical carcinoma: phased array coil fast spin-echo versus body coil spin-echo T2-weighted MR imaging. AJR Am J Roentgenol 1998;171:707-11. 62. Kim SH, Choi BI, Han JK, Kim HD, Lee HP, Kang SB, et al. Preoperative staging of uterine cervical carcinoma: comparison of CT and MRI in 99 patients. J Comput Assist Tomogr. 1993;17:633-40. 47. Shiraiwa M, Joja I, Asakawa T, Okuno K, Shibutani O, Akamatsu N, et al. Cervical carcinoma: efficacy of thin-section oblique axial T2-weighted images for evaluating parametrial invasion. Abdom Imaging. 1999;24: 514-9. 63. Kim SH, Choi BI, Lee HP, Kang SB, Choi YM, Han MC, et al. Uterine cervical carcinoma: comparison of CT and MR findings. Radiology. 1990; 175:45-51. 48. Van Vierzen PB, Massuger LF, Ruys SH, Barentsz JO. Fast dynamic contrast enhanced MR imaging of cervical carcinoma. Clin Radiol. 1998;53: 183-192. 64. Bipat S, Glas AS, van der Velden J, Zwinderman AH, Bossuyt PM, Stoker J. Computed tomography and magnetic resonance imaging in staging of uterine cervical carcinoma: a systematic review. Gynecol Oncol. 2003;91: 59-66. 49. Scheidler J, Heuck AF, Steinborn M, Kimmig R, Reiser MF. Parametrial invasion in cervical carcinoma: evaluation of detection at MR imaging with fat suppression. Radiology. 1998;206:125-9. 65. Sheu M, Chang C, Wang J, Yen M. MR staging of clinical stage I and IIa cervical carcinoma: a reappraisal of efficacy and pitfalls. Eur J Radiol. 2001;38:225-31. 50. Lagasse LD, Creasman WT, Shingleton HM, Ford JH, Blessing JA. Results and complications of operative staging in cervical cancer: experience of the Gynecologic Oncology Group. Gynecol Oncol. 1980;9:90-8. 66. Hricak H, Gatsonis C, Chi DS, Amendola MA, Brandt K, Schwartz LH, et al. Role of imaging in pretreatment evaluation of early invasive cervical cancer: results of the intergroup study American College of Radiology Imaging Network 6651–Gynecologic Oncology Group 183. J Clin Oncol. 2005;23:9329-37. 51. Van Nagell JR Jr, Roddick JW Jr, Lowin DM. The staging of cervical cancer: inevitable discrepancies between clinical staging and pathologic findings. Am J Obstet Gynecol. 1971;110:973-8. 52. Creasman WT. New gynecologic cancer staging. Gynecol Oncol. 1995;58: 157-8. 53. Piver MS, Chung WS. Prognostic significance of cervical lesion size and pelvic node metastases in cervical carcinoma. Obstet Gynecol. 1975;46: 507-10. 54. Scheidler J, Heuck AF. Imaging of cancer of the cervix. Radiol Clin North Am. 2002;40:577-90. 55. Nicolet V, Carignan L, Bourdon F, Prosmanne O. MR imaging of cervical carcinoma: a practical staging approach. Radiographics. 2000;20:1539-49. 56. Kaur H, Silverman PM, Iyer RB, Verschraegen CF, Eifel PJ, Charnsangavej C. Diagnosis, staging, and surveillance of cervical carcinoma. AJR Am J Roentgenol. 2003; 180:1621-31. 57. Subak LL, Hricak H, Powell CB, Azizi L, Stern JL. Cervical carcinoma: computed tomography and magnetic resonance imaging for preoperative staging. Obstet Gynecol. 1995;86:43-50. 58. Togashi K, Nishimura K, Itoh K, Fujisawa I, Asato R, Nakano Y, et al. Uterine cervical cancer: assessment with high-field MR imaging. Radiology. 1986;160:431-5. 59. Hricak H, Lacey CG, Sandles LG, Chang YC, Winkler ML, Stern JL. Invasive cervical carcinoma: comparison of MR imaging and surgical findings. Radiology. 1988;166:623-31. 60. Seki H, Azumi R, Kimura M, Sakai K. Stromal invasion by carcinoma of the cervix: assessment with dynamic MR imaging. AJR Am J Roentgenol. 1997;168:1579-85. 61. Yamashita Y, Takahashi M, Sawada T, Miyazaki K, Okamura H. Carcinoma of the cervix: dynamic MR imaging. Radiology. 1992;182:643-8. 67. Peppercorn PD, Jeyarajah AR, Woolas R, Shepherd JH, Oram DH, Jacobs IJ, et al. Role of MR imaging in the selection of patients with early cervical carcinoma for fertility-preserving surgery: initial experience. Radiology. 1999;212:395-9. 68. Rockall AG, Ghosh S, Alexander-Sefre F, Babar S, Younis MT, Naz S, et al. Can MRI rule out bladder and rectal invasion in cervical cancer to help select patients for limited EUA? Gynecol Oncol. 2006;101:244-9. 69. Inoue T, Morita K. The prognostic significance of number of positive nodes in cervical carcinoma stages IB, IIA, and IIB. Cancer. 1990;65:1923-7. 70. Williams AD, Cousins C, Soutter WP, Mubashar M, Peters AM, Dina R, et al. Detection of pelvic lymph node metastases in gynecologic malignancy: a comparison of CT, MR imaging, and positron emission tomography. AJR Am J Roentgenol. 2001;177:343-8. 71. Yang WT, Lam WW, Yu MY, Cheung TH, Metreweli C. Comparison of dynamic helical CT and dynamic MR imaging in the evaluation of pelvic lymph nodes in cervical carcinoma. AJR Am J Roentgenol. 2000;175:759-66. 72. Sironi S, Buda A, Picchio M, Perego P, Moreni R, Pellegrino A, et al. Lymph node metastasis in patients with clinical early-stage cervical cancer: detection with integrated FDG PET/CT. Radiology. 2006;238:272-9. 73. Xue F, Lin LL, Dehdashti F, Miller TR, Siegel BA, Grigsby PW. F-18 fluorodeoxyglucose uptake in primary cervical cancer as an indicator of prognosis after radiation therapy. Gynecol Oncol. 2006;101:147-51. 74. Fulcher AS, O’Sullivan SG, Segreti EM, Kavanagh BD. Recurrent cervical carcinoma: typical and atypical manifestations. Radiographics. 1999;19 Extra:S103-16. 75. Jeong YY, Kang HK, Chung TW, Seo JJ, Park JG. Uterine cervical carcinoma after therapy: CT and MR imaging findings. Radiographics. 2003;23: 969-81. Radiología. 2008;50:449-61 461