Tipos de reacciones químicas
Anuncio

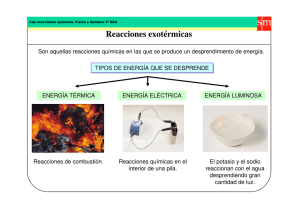
Tipos de reacciones químicas 2quimica.wordpress.com Tipos de reacciones químicas A la hora de clasificar las reacciones químicas pueden seguirse varios criterios, tal y como se muestra en la siguiente tabla. Tipos de reacciones químicas Energía Velocidad Transformación Partícula Endotérmico Lenta Síntesis Precipitación Exotérmico Rápida Descomposición Neutralización Sustitución Redox Simple Metátesis Criterio energético. Reacciones endotérmicas. Son aquellas reacciones que para que transcurran es necesario suministrar energía al sistema. 𝐴𝑙2 𝑂3 + 2𝐹𝑒 → 2𝐴𝑙 + 𝐹𝑒2 𝑂3 ∆𝐻 = +852,6 𝑘𝐽⁄𝑚𝑜𝑙 Reacciones exotérmicas. Reacciones que cuando se producen liberan energía en forma de calor. 1 𝑆𝑂2 + 𝑂2 → 𝑆𝑂3 2 ∆𝐻 = −98,7 𝑘𝐽⁄𝑚𝑜𝑙 Criterio cinético. Reacciones lentas. Son aquellas en las cuales la velocidad de reacción es baja, lo que origina que la reacción transcurra despacio. 3 2𝐹𝑒 + 𝑂2 → 𝐹𝑒2 𝑂3 2 Reacciones rápidas. Este tipo de reacciones trascurren a una velocidad muy elevada y la reacción tiene lugar muy rápidamente e incluso a veces de manera explosiva. 𝐶4 𝐻10 + 2 quimica.wordpress.com 13 𝑂 → 4𝐶𝑂2 + 5𝐻2 𝑂 2 2 1 de 2 Tipos de reacciones químicas 2quimica.wordpress.com Criterio transformativo. Reacciones de síntesis o combinación. Son un tipo de reacciones en las cuales dos o más elementos reaccionan para formar un único producto. 𝑁2 + 3𝐻2 → 2𝑁𝐻3 Reacciones de descomposición. En este tipo, a partir de un reactivo se obtienen varios productos nuevos. ∆ 𝐶𝑎𝐶𝑂3 → 𝐶𝑎𝑂 + 𝐶𝑂2 Reacciones de sustitución o desplazamiento. Las podemos subdividir en dos: • Reacciones de sustitución o desplazamiento simple. Es la reacción de un elemento químico con un compuesto, en al cual el elemento desplaza a otro que se encuentra en el compuesto. • 𝐹𝑒 + 2𝐻𝐶𝑙 → 𝐹𝑒𝐶𝑙2 + 𝐻2 Reacciones de doble desplazamiento (metátesis) o intercambio. En este caso van a reaccionar dos compuestos intercambiando elementos entre sí, generando dos compuestos nuevos. 2 𝑁𝑎𝑂𝐻 + 𝐻2 𝑆𝑂4 → 𝑁𝑎2 𝑆𝑂4 + 2𝐻2 𝑂 Según la partícula intercambiada Reacciones de precipitación. Cuando ocurre este tipo de reacciones, se va a formar un compuesto sólido (precipitado) a partir de la reacción entre dos o más sustancias, normalmente en disolución acuosa. 𝐵𝑎(𝑂𝐻)2 (𝑎𝑞) + 𝐻2 𝑆𝑂4 (𝑎𝑞) → 𝐵𝑎𝑆𝑂4 (𝑠) ↓ +𝐻2 𝑂 (𝑙) Reacciones ácido base (neutralización). Son un tipo de reacciones en las cuales reaccionan un ácido y una base produciéndose habitualmente una sal y agua. 𝐻𝐶𝑙 + 𝑁𝑎𝑂𝐻 → 𝑁𝑎𝐶𝑙 + 𝐻2 𝑂 Reacciones de oxidación reducción (redox). Son procesos químicos en los cuales al menos un elemento gana o pierde electrones simultáneamente, variando su estado de oxidación. El compuesto que gana electrones se oxida y el que pierde se reduce. −2 0 −1 0 𝐻2 ⏞ 𝑆 +⏞ 𝐼2 → 𝐻 ⏞ 𝐼 +⏞ 𝑆 reducción oxidación 2 quimica.wordpress.com 2 de 2