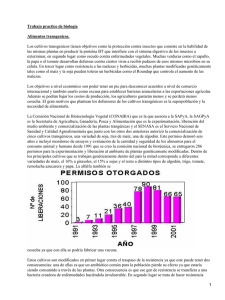
Plantas y cultivos transgénicos
Anuncio

Plantas y cultivos transgénicos Plantas y cultivos transgénicos Cristina Rivas Wagner 1 2 Cristina Rivas Wagner INDICE Introducción ………………………………..………………………….. 04 ¿Qué son las plantas transgénicas ……………………………… 05 Ejemplos de tecnología MG que podrían beneficiar a la agricultura ………………………………………………………… 05 Resistencia a las plagas ……………………………………. 06 Mejora del rendimiento …………………………………….. 07 Tolerancia al estrés biótico y abiótico …………………. 07 Uso de tierras marginales ………………………………….. 08 Beneficios en cuanto a nutrición …………………………… 08 Menor impacto ambiental …………………………………… 09 Otros beneficios de las plantas transgénicas ………… 09 Fármacos y vacunas procedentes de plantas transgénicas …………………………………………………….. 09 Obtención de vectores para transformación directa ……….. 11 Métodos de transformación ………………………………………… 11 Electroporación de protoplastos …………………………… 12 Biobalística ………………………………………………………… 13 Transformación mediante infección con Agrobacterium ……………………………………………… 14 Plantas resistentes a los insectos: La toxina de Bacilus Thuringiensis ………………………………… 21 Plantas resistentes a herbicidas ……………………………………. 24 3 Plantas y cultivos transgénicos Plantas resistentes a Virus: Estrategias para la protección de plantas mediante ingeniería …………….………. 26 Expresión de proteínas de la cubierta y resistencia en plantas transgénicas …………… 27 Uso de RNAs satélites ……………………………………………… 28 Uso de RNA antisentido …………………………………………… 29 Producción de vacunas y compuestos farmacéuticos en plantas transgénicas ……………………………… 31 Anticuerpos en plantas transgénicas ………………………… 32 Vacunas comestibles ………………………………………………. 33 Productos transgénicos del futuro …………………………………….. 36 Conclusión ………………………………………………………………………. 42 Anexos ……………………………………………………………………………. 43 Bibliografía …………………………………………………………………… 47 4 Cristina Rivas Wagner INTRODUCCIÓN | 1 Es imprescindible que mejoremos la producción y distribución de los alimentos, si es que queremos alimentar y librar del hambre a la creciente población mundial, al mismo tiempo que reducimos los impactos ambientales y generamos empleos productivos en las regiones de bajos ingresos. Para lograrlo, será necesario hacer un uso adecuado y responsable de los descubrimientos científicos y las nuevas tecnologías. Los creadores y supervisores de la tecnología MG aplicada a las plantas y los microorganismos, debieran cerciorarse de que sus esfuerzos atiendan esas necesidades. Mediante el uso de la tecnología MG es factible producir alimentos más nutritivos, estables en almacenamiento y, en principio, promotores de la salud (trayendo beneficios por igual a los consumidores de los países industrializados y en vías de desarrollo). Se requieren nuevos esfuerzos, por parte del sector público, para crear cultivos transgénicos que beneficien a los agricultores de escasos recursos de los países en vías de desarrollo y faciliten el acceso de éstos a los alimentos mediante la producción, con mano de obra intensiva, de cultivos básicos como maíz, arroz, trigo, yuca (mandioca), camote (ñame), sorgo, plátano macho (cambur) y batata (boniato). Se necesita el esfuerzo cooperativo de los sectores público y privado para desarrollar nuevos cultivos transgénicos que beneficien a los consumidores, sobre todo a los del mundo en vías de desarrollo. Deben hacerse esfuerzos concertados y organizados para investigar los posibles efectos ambientales (tanto positivos como negativos) de las tecnologías MG en cada una de sus aplicaciones específicas. Dicho efectos deben ser evaluados comparándolos con los causados por las tecnologías agrícolas ordinarias en uso actual. Es necesario implantar sistemas reguladores de salud pública en cada país, para identificar y hacer un seguimiento de cualquier efecto potencial adverso de las plantas transgénicas contra la salud humana, como se hace para cualquier otra nueva variedad vegetal. Las corporaciones privadas e instituciones de investigación deberían establecer acuerdos para compartir la tecnología MG (que está controlada actualmente por medio de patentes y acuerdos de licencia sumamente estrictos) con científicos responsables, que la utilicen para aliviar el hambre y promover la seguridad alimenticia de los países en vías de desarrollo. Además, conviene que los agricultores de escasos recursos del mundo entero cuenten con exenciones especiales para protegerlos de las restricciones inadecuadas en cuanto a la propagación de sus cultivos. Plantas y cultivos transgénicos 5 ¿QUÉ SON LAS PLANTAS TRANSGÉNICAS? | 2 La planta transgénica contiene uno o más genes que han sido insertados en forma artificial en lugar de que la planta los adquiera mediante la polinización. La secuencia génica insertada (llamada el transgen) puede provenir de otra planta no emparentada o de una especie por completo diferente: por ejemplo, el maíz Bt, que produce su propio insecticida, contiene un gen de una bacteria. Las plantas que tienen transgenes a menudo son llamadas genéticamente modificadas o cultivos GM, si bien en realidad todos los cultivos han sido genéticamente modificados con respecto a su estado silvestre original mediante la domesticación, la selección y el mejoramiento controlado a través de períodos prolongados. EJEMPLOS DE TECNOLOGÍA MG QUE PODRÍAN BENEFICIAR A LA AGRICULTURA | 3 Hasta la fecha, la tecnología MG ha servido, más que nada, para producir varios cultivos agrícolas con características "dictadas por el mercado", algunas de las cuales han alcanzado el éxito comercial. El desarrollo de variedades producidas comercialmente en países como Estados Unidos y Canadá, se ha enfocado en aumentar la vida en anaquel de las frutas y verduras, conferir resistencia contra virus o insectos y conferir tolerancia a herbicidas específicos. Aunque estas características han resultado benéficas para los agricultores, ha sido difícil lograr que los consumidores vean algún beneficio como no sea, en casos limitados, un mejor precio debido al abatimiento de los costos y la mayor facilidad de producción (Nelson y cols. 1999; Falck-Zepeda y cols. 1999). Una posible excepción es el desarrollo de tecnología MG para retrasar la maduración de las frutas y verduras, lo que permite tenerlas almacenadas por más tiempo. Los agricultores se beneficiarían con este avance al disponer de mayor flexibilidad en cuanto a producción y cosecha. Los consumidores también se beneficiarían al poder adquirir frutas y verduras, como los jitomates transgénicos modificados para que se ablanden más 6 Cristina Rivas Wagner lentamente que las variedades tradicionales, lo que significa mayor duración en almacenamiento, menor costo de producción, más calidad y menos precio. Existe la posibilidad de que los agricultores de los países en vías de desarrollo se beneficien considerablemente con los cultivos que maduran o se ablandan lentamente, pues eso podría darles mayor flexibilidad para la distribución de la que disponen actualmente. En muchos casos, los agricultores en pequeño sufren graves pérdidas debido a la maduración o reblandecimiento excesivos o descontrolados de sus frutas o verduras. El verdadero potencial de la tecnología MG para ayudar a resolver algunos de los problemas más graves de la agricultura mundial acaba de empezar a ser explorado. Los siguientes ejemplos nos mostrarán cómo puede aplicarse la tecnología MG en algunos problemas agrícolas específicos en los que indicamos los beneficios potenciales. Resistencia a las plagas | 3.1 Obviamente, los agricultores se beneficiarían si se desarrollan plantas transgénicas resistentes a plagas específicas. Por ejemplo, en Hawai se han estado vendiendo y plantando, desde 1996, papayos resistentes a la mancha anular viral de la papaya (Gonsalves 1998). Por otra parte, el ambiente también se beneficiaría al aminorar el uso de plaguicidas. Los cultivos transgénicos que contienen genes de resistencia a los insectos, procedentes de Bacillus thuringiensis, han hecho posible reducir considerablemente la cantidad de insecticida que se le aplica al algodón en Estados Unidos. En un análisis, por ejemplo, se demostró que hubo una reducción de dos millones de hectáreas tratadas en 1999, es decir, un millón de kilogramos de insecticidas químicos, en comparación con 1998 (U.S. National Research Council 2000). Sin embargo, las poblaciones de plagas y organismos fitopatógenos se adaptan rápidamente y se vuelven resistentes a los plaguicidas, y no existen razones para suponer que no ocurrirá lo mismo, y con la misma rapidez, en el caso de las plantas transgénicas. Además, los biotipos de las plagas varían de una región a otra. Por ejemplo, es probable que los cultivos resistentes a insectos diseñados para Estados Unidos y Canadá tengan resistencia a plagas que no ocasionan problemas en los países en vías de desarrollo, y esto ocurre por igual en las plantas transgénicas y en las desarrolladas por medio de técnicas de cruzamiento ordinarias. Incluso en el caso de que los mismos genes de resistencia a los insectos o los herbicidas sean útiles en varias regiones, normalmente es necesario introducirlos en cultivares adaptados a las condiciones locales. Por lo tanto, se requieren más investigaciones sobre las plantas transgénicas que se han vuelto resistentes a plagas locales, a fin de evaluar su sustentabilidad frente a un aumento en las presiones de selección para plagas cada vez más virulentas. Plantas y cultivos transgénicos 7 Mejora del rendimiento | 3.2 Una de las principales tecnologías que desembocaron en la "Revolución verde", fue la creación de variedades de trigo semienanas de alto rendimiento. Los genes responsables de esa reducción de altura fueron los genes japoneses NORIN 10 introducidos en los trigos occidentales durante la década de 1950 (genes del enanismo insensibles a la giberelina). Estos genes tenían dos ventajas: producían una planta más corta y fuerte, que respondía bien a la aplicación de más fertilizante sin colapsarse; y aumentaban directamente el rendimiento al reducir la elongación celular de las partes vegetativas de la planta, de modo que ésta invertía más energía en las partes reproductivas comestibles. Estos genes fueron aislados en fechas recientes, y se demostró que actúan exactamente de la misma manera cuando se les utiliza para transformar otras especies de plantas agrícolas (Peng y cols. 1999). Hoy por hoy, esta técnica de enanismo puede utilizarse para aumentar la productividad de cualquier planta agrícola cuyo rendimiento económico se encuentre en las partes reproductivas, en vez de en las vegetativas. Tolerancia al estrés biótico y abiótico | 3.3 La creación de cultivos con resistencia intrínseca al estrés biótico y abiótico, ayudaría a estabilizar la producción anual. Por ejemplo, el virus de la mancha amarilla del arroz (RYMV) devasta los arrozales africanos al destruir directamente la mayor parte del cultivo, con un efecto secundario en las plantas sobrevivientes, a las que vuelve más vulnerables a las infecciones micóticas. Como resultado, este virus ha puesto en serio peligro la producción arrocera de África. Los métodos ordinarios de control del RYMV, que se basan en las técnicas tradicionales de cruzamiento, no han logrado introducir la resistencia de las especies silvestres en el arroz cultivado. Los investigadores han recurrido a una nueva técnica, que imita la "inmunización genética", al crear plantas de arroz transgénicas que son resistentes al RYMV (Pinto y cols. 1999). Actualmente, las variedades transgénicas resistentes están a punto de ser sometidas a pruebas de campo con el fin de evaluar la eficacia de su resistencia al RYMV. Esta podría ser la solución del riesgo de colapso total de las regiones arroceras del sub-Sahara africano. Podríamos dar muchos otros ejemplos para ilustrar la gama de las investigaciones científicas actuales, como las plantas transgénicas modificadas para combatir el virus de la mancha anular de la papaya (Souza 1999), las papas resistentes al tizón (Torres y cols. 1999) y arroz resistente al tizón bacteriano de la hoja (Zhai y cols 2000), o como ejemplo de un factor abiótico, plantas modificadas para producir un exceso de ácido cítrico en las raíces que, de ese modo, toleran mejor el aluminio presente en los suelos ácidos (de la Fuente y cols. 1997). Estos ejemplos tienen un claro potencial comercial, pero será imprescindible, si es que queremos obtener los máximos beneficios, que la investigación de tecnología MG siga financiada con recursos públicos. Por ejemplo, pese a que la tecnología MG nos da acceso a nuevas pozas genéticas donde se encuentran fuentes de 8 Cristina Rivas Wagner resistencia, será necesario demostrar que dichas fuentes serán más estables que las fuentes de resistencia intraespecíficas usadas de manera ordinaria. Uso de tierras marginales | 3.4 Una inmensa extensión de la superficie terrestre del planeta, tanto en las costas como en el interior de los continentes, se considera marginal porque es excesivamente salina o alcalina. Ya se logró identificar, clonar y transferir a otras plantas un gen de tolerancia a la sal presente en el mangle negro (Avicennia marina). Según se ha visto, las plantas transgénicas toleran mayores concentraciones de sal. Asimismo, el gen gutD, de Escherichia coli, ha servido para generar plantas de maíz transgénicas que toleran la sal (Liu y cols 1999). Estos genes representan una fuente potencial para el desarrollo de sistemas agrícolas que permitan el uso de las tierras marginales (M.S. Swaminathan, com. pers. 2000). Beneficios en cuanto a nutrición | 3.5 La deficiencia de vitamina A es causa de que medio millón de niños queden parcial o totalmente ciegos cada año (Conway y Toennissen 1999). Los métodos tradicionales de mejora de plantas no han logrado producir cultivos que contengan altas concentraciones de vitamina A, de modo que la mayoría de los gobiernos dependen de costosos y complejos programas de complementación para atender este problema. Los investigadores han introducido tres nuevos genes en el arroz: dos de ellos proceden del narciso y uno de cierto microorganismo. El arroz transgénico exhibe mayor producción de beta-caroteno, el precursor de la vitamina A, y la semilla es de color amarillo (Ye y cols. 2000). Este arroz amarillo o dorado, puede ayudar a resolver el problema de la deficiencia de vitamina A entre los niños de las regiones tropicales. La fortificación con hierro es necesaria porque los cereales son deficientes en micronutrientes esenciales como este metal. La deficiencia de hierro provoca anemia en las mujeres embarazadas y los niños pequeños. Por consiguiente, cerca de 400 millones de mujeres en edad reproductiva sufren de esta afección y tienen mayores riesgos de muerte fetal o de parir niños con muy bajo peso, así como una mayor probabilidad de muerte por parto. La anemia ha sido identificada como un factor de riesgo en más de 20% de los casos de muerte posparto en Asia y África (Conway 1999a, b). Mediante el uso de genes relacionados con la síntesis de una proteína fijadora de hierro y con la producción de una enzima que facilita la absorción del hierro presente en los alimentos humanos, se produjo un arroz transgénico con altas concentraciones de hierro (Goto y cols. 1999; Lucca 1999). Estas plantas contienen de dos a cuatro veces más hierro que el arroz no transgénico, pero queda pendiente investigar su asimilación biológica. Plantas y cultivos transgénicos 9 Menor impacto ambiental | 3.6 La disponibilidad y el uso eficiente del agua se han convertido en temas de importancia mundial. Los suelos sometidos a labores de labranza intensa (arado) para el control de las malezas y la preparación del suelo, son propensos a la erosión y sufren una grave pérdida de agua. Las comunidades tradicionales han recurrido por muchos años a sistemas de labranza mínima. Existe la necesidad de crear cultivos que prosperen en tales condiciones, incluyendo la introducción de resistencia a enfermedades de las raíces que se controlan actualmente por medio de la labranza, así como de herbicidas que puedan ser utilizados en vez de la labranza (Cook 2000). Según se ha visto en los países más desarrollados, la tecnología MG es una herramienta útil para introducir resistencia a las enfermedades radiculares en condiciones de labranza mínima. Sin embargo, será necesario un cuidadoso análisis de tipo costo-beneficio, a fin de asegurar el logro del máximo provecho. Asimismo, será necesario evaluar minuciosamente las diferencias regionales en cuanto a técnicas agrícolas, así como el impacto potencial de la sustitución de un cultivo tradicional por uno nuevo de tipo transgénico. Otros beneficios de las plantas transgénicas | 3.7 Las variedades transgénicas de primera generación han beneficiado a muchos agricultores en forma de menores costos de producción, mayores rendimientos o ambas cosas. En muchos casos, también han beneficiado al ambiente porque reducen el uso de plaguicidas o permiten la siembra de cultivos con menos actividades de labranza. Los insectos ocasionan enormes pérdidas agrícolas en el campo y en los productos cosechados que se encuentran en tránsito o almacenamiento, pero las preocupaciones en cuanto a la salud de los consumidores y el impacto ambiental, han limitado el registro de muchos plaguicidas químicos prometedores. Los genes de resistencia a las plagas, cuando son introducidos cuidadosamente en los cultivos para evitar la selección futura de resistencia a las plagas, constituyen alternativas con las que puede reducirse el uso de plaguicidas químicos en muchos cultivos importantes. Además, reducir la contaminación de nuestros alimentos por parte de patógenos que constituyen riesgos de salud por la vía alimenticia (p.ej., las micotoxinas), sería benéfico para los agricultores y consumidores por igual. Fármacos y vacunas procedentes de plantas transgénicas | 3.8 Existen vacunas contra muchas de las enfermedades que le provocan grandes sufrimientos e incluso la muerte a numerosas personas en los países en vías de desarrollo, pero su producción y aplicación son normalmente muy costosas. Casi todas las vacunas deben ser almacenadas 10 Cristina Rivas Wagner en condiciones de refrigeración, y para su aplicación se depende de especialistas debidamente capacitados, lo que se suma a los gastos. En algunos países, incluso el costo de las agujas para inyectar las vacunas puede ser prohibitivo. Por consiguiente, suele suceder que las vacunas no llegan a quienes más las necesitan. Actualmente, los investigadores están estudiando el potencial de la tecnología MG para la producción de vacunas y fármacos por medio de plantas. Esto significaría un acceso más fácil, una producción más económica y una manera alternativa de generar ingresos. Ya se han producido vacunas contra enfermedades infecciosas del aparato digestivo en plantas como la papa y el plátano (banano) (Thanavala y cols. 1995). Otro objetivo adecuado serían los cereales. Recientemente se logró expresar, en semillas de arroz y trigo, un anticuerpo contra el cáncer que reconoce células cancerosas de pulmón, mama y colon y que, por lo tanto, puede ser útil para el diagnóstico y la terapia en lo futuro (Stoger y cols. 2000). Estas tecnologías se encuentran en una fase aún muy temprana de su desarrollo, y será necesario investigar las preocupaciones obvias en cuanto a la salud humana y la seguridad ambiental durante su producción, antes de que dichas plantas sean aprobadas como cultivos especiales. No obstante, la creación de plantas transgénicas para la producción de sustancias terapéuticas tiene un enorme potencial como una manera de ayudar a resolver los problemas de enfermedad en los países en vías de desarrollo. Casi una tercera parte de las medicinas que se utilizan actualmente se derivan de las plantas, uno de los ejemplos más famosos es el de la aspirina (la forma acetilada de un producto natural de las plantas, el ácido salicílico) Se cree que menos de 10% de las plantas medicinales han sido identificadas y caracterizadas, y existe la posibilidad de utilizar la tecnología MG de tal manera que aumente los rendimientos de las sustancias medicinales una vez identificadas. Por ejemplo, las valiosas sustancias contra el cáncer vinblastina y vincristina son los únicos medicamentos aprobados para el tratamiento del linfoma de Hodgkin. Ambas se derivan de la vincapervinca (hierba doncella) de Madagascar, que las produce en muy pequeñas concentraciones junto con 80 a 100 compuestos químicos muy similares. Por consiguiente, la producción de estos compuestos terapéuticos es sumamente costosa. En la actualidad se están llevando a cabo investigaciones intensivas con el fin de descubrir el potencial de la tecnología MG en cuanto se refiere a incrementar las concentraciones de compuestos activos o permitir su producción en plantas más fáciles de cultivar que la vincapervinca (Leech y cols. 1998). Es nuestra recomendación que la investigación y desarrollo de cultivos transgénicos debiera enfocarse en plantas que: (i) aumenten la estabilidad de la producción; (ii) le aporten beneficios nutritivos al consumidor; (iii) reduzcan el impacto ambiental de la agricultura intensiva y extensiva; y (iv) faciliten la producción de fármacos y vacunas; al mismo tiempo que (v) se desarrollen protocolos y reglamentos que aseguren que los cultivos transgénicos diseñados para satisfacer necesidades no alimenticias, como la producción de compuestos farmacéuticos, sustancias químicas industriales, etc., no se difundan o mezclen con otros cultivos alimenticios transgénicos o no transgénicos. Plantas y cultivos transgénicos 11 OBTENCIÓN DE VECTORES PARA TRANSFORMACIÓN DIRECTA | 4 Los vectores utilizados en la transformación de plantas mediante métodos directos, son plásmidos bacterianos en los que han sido clonados los genes a ser introducidos en el genoma vegetal. Estos vectores son de tamaño variable (2 a 50 kb). Una vez identificados los genes y las respectivas secuencias reguladoras, ellos son agrupados, formando una construcción que consta de un promotor, una secuencia codificadora, y una señal de terminación. Esas construcciones son luego introducidas en un vector adecuado, o sea en un plásmido bacteriano. Un vector contiene básicamente, los genes de interés a ser introducidos, los genes marcadores para transformación y selección, un origen de replicación, y un gen que confiere a las bacterias resistencia a un antibiótico. Uno de los genes marcadores más utilizados es el gus (uidA), debido a que su expresión puede ser fácilmente detectada mediante métodos enzimáticos, colorimétricos y de fluorescencia. Como se mencionó, para la selección de las células transformadas se utilizan genes que confieren resistencia a antibióticos. Los más utilizados son el gen neo (npt II), que confiere resistencia a la canamicina, geneticina o paromomicina y el gen hpt, que confiere resistencia a la higromicina. También se puede recurrir a genes que confieren resistencia a herbicidas, como el bar, que codifica a la enzima fosfinotricina acetiltransferasa (PAT), confiriendo resistencia a la fosfinotricina. Existen diferentes métodos de aislamiento de plásmidos bacterianos. Todos ellos siguen tres etapas básicas: crecimiento de la bacteria y amplificación del plásmido, concentración y lisis de las células bacterianas, y purificación del plásmido. El método de aislamiento del plásmido por lisis alcalina ha sido empleado exitosamente en diferentes linajes de bacterias. Se basa en la naturaleza circular de los plásmidos y en el alto peso molecular del ADN cromosómico. Cuando un extracto celular se expone a un pH alcalino (cercano a 12), el ADN linear (cromosómico) se desnaturaliza mientras que el ADN circular (plásmido) permanece intacto. Luego el extracto es neutralizado con una solución de acetato de sodio, en presencia de una alta concentración salina, lo que hace que el ADN cromosómico precipite, junto con las proteínas. MÉTODOS DE TRANSFORMACIÓN | 5 Los biólogos pueden recurrir a tres métodos, para introducir los genes de interés en la célula vegetal. Ellos son: electroporación de protoplastos, biobalística e infección con Agrobacterium. 12 Cristina Rivas Wagner - Electroporación de protoplastos: Se trata de un método utilizado para introducir macromoléculas en células vegetales. Llamamos protoplastos a las células vegetales desprovistas de su pared celular (Figuras 1 y 2). Cuando estos protoplastos son cultivados “in vitro”, pueden reconstituir su pared, dividirse por mitosis y regenerar una planta entera. La obtención de protoplastos requiere de la incubación del tejido vegetal en un medio de digestión compuesto de enzimas pectocelulolíticas, como las que digieren la celulosa, las hemicelulosas, y las pectinas, que son los principales constituyentes de las paredes celulares. Es importante que el pH de las soluciones empleadas favorezca la actividad de las enzimas empleadas, sin comprometer la viabilidad de las células. Luego de la digestión de la pared celular, se procede a la purificación y determinación del número de protoplastos intactos. La electroporación consiste en la inducción de poros reversibles en las membranas celulares, que permiten el pasaje de iones y moléculas. La electroporación de protoplastos se realiza inmediatamente después de su purificación. Para ello, una suspensión de protoplastos se incuba con los plásmidos en los que están clonados los genes de interés, y los genes marcadores, que posibilitan la identificación de las células transformadas. La mayoría de los aparatos de electroporación (electroporadores) utilizan descargas de capacitores, para producir descargas de alto voltaje. La intensidad del pulso está determinada por el voltaje aplicado y la conductividad del medio. El grado de permeabilidad de la membrana, por su parte, depende del campo eléctrico aplicado y del tipo celular. Altos niveles de permeabilidad facilitan la entrada del ADN, pero disminuye la viabilidad de las células. La eficiencia de la transformación puede estimarse mediante dos parámetros: • Frecuencia absoluta de transformación: nº de colonias transformadas nº inicial de protoplastos • Frecuencia relativa de transformación: nº de colonias transformadas . 100 nº inicial de colonias obtenidas La eficiencia de la transformación varía considerablemente entre especies, y entre cultivares de la misma especie. Se han reportado frecuencias absolutas de transformación en el rango de 10-6 a 10-3. Plantas y cultivos transgénicos Figura 1: Protoplastos de (derecha). 13 Oryza sativa (izquierda) y Dahlia pinnata Figura 2: A, pelos radicales de Medicago sativa; B, protoplastos obtenidos a partir de esos pelos radicales luego de 3 minutos de incubación con enzimas para digerir la pared celular. La barra blanca, en ambas fotos corresponde a 10 µm. - Biobalística Esta técnica fue propuesta por Sanford en 1987, para introducir material genético en el genoma nuclear de plantas superiores. En los últimos años se ha usado para transformar bacterias, protozoos, hongos, algas, insectos y 14 Cristina Rivas Wagner tejidos animales. La biobalística, utiliza microproyectiles a alta velocidad, para introducir ácidos nucleicos y otras moléculas en células y tejidos. Este proceso también se conoce con los nombres de “bombardeo con microproyectiles”, “gen gun” (pistola génica), “aceleración de partículas”, etc. Se utilizan micropartículas de 0,2 a 4 µm de diámetro, cubiertas con secuencias de ácidos nucleicos, aceleradas a velocidades superiores a los 1500 km/h. Estas partículas (de oro ó tungsteno) penetran la pared y la membrana plasmática, alojándose aleatoriamente en los organoides celulares. Posteriormente, el ADN se libera de las partículas y se integra en el genoma nuclear del organismo receptor. Se han desarrollado varios mecanismos para lograr la aceleración de las micropartículas, entre los que se destaca uno que funciona mediante la descarga de helio de alta presión. En la Figura 3 se aprecia un esquema de una pistola génica. Figura 3: Fotografía mostrando una pistola génica. - Transformación mediante infección con Agrobacterium. Este método se basa en el uso de una bacteria del género Agrobacterium como herramienta para introducir el gen de interés en el genoma de la planta. Antes de describir la técnica propiamente dicha, veamos algunas características de la especie bacteriana. I) Características del género Agrobacterium Se trata de bacterias aeróbicas y Gram positivas, comúnmente encontradas en el suelo. No forman esporas, poseen forma de bacilo (Figura 4 A) y se mueven por medio de 1 a 6 flagelos. En particular, Agrobacterium tumefaciens, es el agente etiológico de la “agalla de la corona” y A. rhizogenes el de la “raíz en cabellera”, ambas diseminadas en Plantas y cultivos transgénicos 15 casi todos los tipos de suelos, cultivados o no. La infección de una planta con Agrobacterium, comienza con la penetración de la bacteria en el tejido vegetal, a través de una lesión producida por insectos, tratamientos culturales, heladas, etc. Las bacterias son atraídas por sustancias liberadas por las células lesionadas, tales como aminoácidos, azúcares y fenoles. Una vez en contacto con las células vegetales, las bacterias sintetizan microfibrillas de celulosa, propiciando una mejor fijación. Las moléculas liberadas a través de las heridas también son responsables por la activación de genes localizados en la región de virulencia (región vir) del plásmido Ti de la bacteria (Ti: inductor de tumores) que es un plásmido de alto peso molecular, presente en todos los linajes patogénicos de Agrobacterium (Figura 5). La región vir contiene aproximadamente 25 genes, que codifican proteínas que promueven la transferencia de otra región del plásmido Ti de la bacteria, hacia la célula infectada. Esa región se denomina T -ADN, y se integra en forma estable, al genoma vegetal. Una vez en el genoma vegetal, los genes de T-ADN (también conocidos como oncogenes) son transcriptos, codificando enzimas involucradas en la síntesis de hormonas vegetales, tales como las auxinas y citocininas. Como consecuencia de ese desbalance hormonal, las células transformadas proliferan desordenadamente, produciendo un tumor que se conoce vulgarmente con el nombre de “agalla de la corona” (Figura 4 B). En el caso de A. rhizogenes, la expresión de los oncogenes conduce a la producción de raíces en la región donde se produjo la herida, síntoma denominado “raíces en cabellera”. Nótese que en la naturaleza se producen plantas transgénicas, sin la intervención del hombre, cuando el T-ADN bacteriano es “inyectado” a la célula vegetal, para luego integrarse y expresarse en el genoma hospedante. El T -ADN también posee genes que codifican enzimas responsables por la síntesis de opinas, que son aminoácidos y carbohidratos modificados. Las opinas producidas por las células transformadas son utilizadas exclusivamente por la bacteria como fuente de energía. Los linajes salvajes, en general no son utilizados para la obtención de plantas transgénicas, debido a las alteraciones fisiológicas que ellos producen. 16 Cristina Rivas Wagner Figura 4. A: Microfotografía de barrido mostrando A. tumefaciens sobre una célula vegetal, B: Agalla de la corona en girasol. Figura 5: Plásmido Ti de Agrobacterium tumefaciens Plantas y cultivos transgénicos 17 II) Transformación de células de Agrobacterium con el / los genes de interés. Veamos ahora como podemos introducir los plásmidos que contienen los genes de interés, en las células de Agrobacterium (transformación). Pese a que los oncogenes son los responsables de la producción de tumores, las únicas regiones del T- ADN esenciales para su transferencia son las secuencias de aproximadamente 25 pb localizadas en sus extremidades. De este modo, los genes presentes en el T - ADN pueden ser eliminados y sustituidos, sin alterar el proceso de transferencia. Además de las extremidades del T - ADN, la región vir también es esencial para la transferencia. La preparación de un linaje de Agrobacterium para ser utilizado como vector para la transformación de plantas transgénicas, incluye dos etapas: En la primera etapa, se debe obtener un “linaje desarmado”, en el cual el T-ADN original, con sus oncogenes fue eliminado por un proceso de doble recombinación. Actualmente disponemos de linajes desarmados, obtenidos a partir de linajes salvajes de diferentes orígenes. La segunda etapa, implica la preparación de un vector conteniendo el TADN con los genes de interés. Debido a su gran tamaño (aproximadamente 200 kb), el plásmido Ti no puede ser manipulado directamente, por lo que se emplean plásmidos más pequeños (vectores), que resultan fáciles de manipular. Estos vectores contienen las extremidades del T-ADN, entre las cuales se clonan los genes de interés. Una vez obtenido el vector, este debe ser transferido al Agrobacterium mediante un proceso que se conoce con el nombre de transformación. Se han desarrollado tres métodos de transformación: conjugación, electroporación y shock térmico: a) Conjugación: se trata de un método simple y eficiente que no requiere de equipamiento específico y prescinde de la preparación de ADN plasmidial de E. coli. En el protocolo más común, se realiza un cocultivo de dos l inajes de E. coli (“helper” y “donante”) y un linaje de Agrobacterium (receptora), según puede apreciarse en la Figura 6. El linaje “helper” suministra las funciones de movilización (mob) y transferencia ( tra) de plásmidos, entre bacterias compatibles, mientras que el linaje “donante”, contiene el vector que será transferido. Durante la conjugación, el plásmido ‘helper” es transferido al linaje donante, promoviendo posteriormente su movilización hacia Agrobacterium, junto con el vector. El plásmido “helper” no se replica en Agrobacterium, y por lo tanto es eliminado. Luego de la transferencia, se seleccionan los linajes recombinates de Agrobacterium mediante el uso de antibióticos apropiados. La principal desventaja de la conjugación es la posibilidad de que ocurran alteraciones en el plásmido introducido, debido a la recombinación con el plásmido ‘helper”. 18 Cristina Rivas Wagner T - ADN a) binari o A. tumefacien s recep tor a Vir b) T- ADN T- ADN Vir c) T- ADN Vir d) T - ADN Vir Figura 6: Transferencia de un vector hacia Agrobacterium mediante conjugación. El plásmido “helper” pasa a E. coli donante (a y b), y luego a Agrobacterium, promoviendo la transferencia del vector binario (c). El plásmido “helper” no se replica en bacterias y es eliminado (d). El vector binario se mantiene independientemente del plásmido Ti desarmado. b) Electroporación: Consiste en someter a las células del linaje receptor de Agrobacterium a un pulso de alto voltaje, generado por un capacitor, en Plantas y cultivos transgénicos 19 presencia del vector. Como consecuencia del campo eléctrico generado, la membrana plasmática se desestabiliza, produciendo poros por los que se produce el pasaje de macromoléculas. Se trata de un método muy eficiente y relativamente simple, que se utiliza con mucha frecuencia. Su principal limitante es la necesidad de contar con el equipamiento de laboratorio: electroporador y una fuente de alta tensión. c) Shock térmico (“freeze – thaw”): este método se basa en la permeabilización de la membrana en condiciones extremas de temperatura (de –186 a 37ºC), permitiendo el pasaje del vector hacia el Agrobacterium receptor. En los métodos directos de transformación (electroporación y shock térmico), en los cuales el vector es transferido directamente hacia la célula receptora, la probabilidad de que el ADN se altere es mínima, en comparación con el método de conjugación. III) Obtención de plantas transgénicas mediante Agrobacterium. El conocimiento de las bases moleculares del mecanismo de infección por Agrobacterium, y el desarrollo de técnicas de biología molecular, permitieron desarrollar protocolos para introducir en las plantas genes exógenos, utilizando aquella bacteria como vector. Como se ha mencionado en los ítems anteriores, esto fue posible gracias a la obtención de vectores derivados del plásmido Ti ó Ri, y su introducción en linajes de Agrobacterium “desarmados”, en los cuales los oncogenes fueron eliminados. Desde entonces, este sistema de transformación fue ampliamente utilizado, en un gran número de especies. Algunas de las razones que justifican su universalidad, son la alta eficiencia de transformación, el bajo costo operacional y la simplicidad de las técnicas. La mayoría de los protocolos desarrollados, son una modificación del propuesto por Horsch en 1985 para transformar discos foliares de tabaco (Nicotina tabacum) y consta de las siguientes etapas (Figura 7): - Infección: Consiste en el cultivo del explanto vegetal en un medio líquido ó sólido, junto con el linaje desarmado de Agrobacterium que contiene el ó los genes a ser introducido/s en la planta. El tiempo de cultivo puede variar desde algunas horas, hasta varios días. En la elección del explanto debe tenerse en cuenta la facilidad de reproducción “in vitro”. De este modo, dependiendo de las especie y del cultivar, se han utilizado como explantos discos foliares, segmentos de tallos o raíces, tubérculos, cotiledones, protoplastos, embriones somáticos, etc. Generalmente se realiza una herida en el explanto, antes o durante el contacto con la bacteria, ya que a través de ella se liberan las sustancias que inducen a los genes de virulencia del Agrobacterium. Durante esta etapa, se produce la unión de la bacteria a la región donde se encuentra la herida, la inducción de los genes de la región vir, y la transferencia del T-ADN hacia el genoma vegetal. - Selección: En una segunda etapa el explanto es transferido a un medio de regeneración apropiado conteniendo uno ó más antibióticos descontaminantes, que permiten eliminar a las células de Agrobacterium, que a partir de ese momento ya no son requeridas. 20 Cristina Rivas Wagner Normalmente se adiciona al medio de cultivo un agente de selección, que es responsable de la inhibición del crecimiento de las células no transformadas. El efecto nocivo de este agente, en las células transformadas, es anulado por el producto de expresión del gen marcador de selección (generalmente una enzima). De este modo, sólo las células transformadas serán capaces de desarrollarse en este medio de cultivo selectivo. Debemos tener en cuenta que ningún sistema de selección es totalmente eficiente, de modo que pueden producirse algunos “escapes” (plantas no transformadas, que a pesar de no expresar el gen marcador, consiguen regenerarse en presencia del agente de selección). - Enraizamiento: Durante las semanas siguientes, los brotes resistentes al agente de selección son aislados a medida que regeneran, y transferidos a un medio de enraizamiento, rico en auxinas (hormonas vegetales, como el ácido 3-indol acético, 3- indol – butírico, etc, que se caracterizan por inducir la diferenciación de raíces). - Rustificación: Una vez enraizados, los brotes transformados son aclimatados y llevados a invernáculo. potencialmente - Análisis molecular: Para comprobar la integración y expresión del gen foráneo en el genoma de la planta, es necesario un exhaustivo análisis molecular, mediante técnicas como Northern Blot, Southern Blot, Western Blot, etc, que serán descriptas más adelante. Posteriormente, también deben realizarse estudios genéticos de segregación, para demostrar la estabilidad de la integración. Figura 7: Etapas de la transformación con Agrobacterium. Plantas y cultivos transgénicos 21 PLANTAS RESISTENTES A LOS INSECTOS: LA TOXINA DE BACILUS THURINGIENSIS | 6 Las plantas transgénicas resistentes a insectos que se comercializan poseen genes derivados de bacterias (Bacillus thuringensis) que codifican para cristales de proteínas tóxicos para los insectos. Estas toxinas son producidas por las bacterias como protoxinas, y se activan en el tracto digestivo de los insectos. Las toxinas activadas se ligan a receptores específicos del tracto del insecto susceptible. Desde hace más de 30 años se vienen utilizando para la protección de cultivos insecticidas de aplicación foliar producidos mediante la fermentación de la bacteria Bacillus thuringensis (Feldman, 1999). Existen productos foliares Bt para el control de insectos lepidópteros y coleópteros. Estos insecticidas, sin embargo, no han tenido una amplia adopción debido a dificultades en lograr un buen control. Las células de las plantas transformadas con el gen Bt presentan el gen y los parámetros (promotores, procesamiento del ARN mensajero, traducción, localización subcelular) involucrados en la expresión del mismo. Las plantas se transforman así en “productoras de insecticida”, lo que las hace altamente resistentes a un amplio rango de lepidópteros y coleópteros. Desde 1995 se han aprobado varios genes Bt para el uso comercial en los cultivos de algodón, maíz y papa. La papa tiene un gen que genera una proteína específica contra el coleóptero “Colorado potato beatle” (Leptinotarsa decemlineata). Para el cultivo de algodón la toxina específica actúa sobre lepidópteros: “cotton bollworm” (Helicoverpa zea) y “pink bollworm” (Pectinophora gosypiella). En cuanto al cultivo de maíz también existe una proteína con acción específica contra lepidóptero “European y southwestern corn borers” (Diatraea grandiosella) y “corn earworm” (Helicoverpa zea). Las plantas transgénicas Bt fueron creadas para reducir la dependencia de los insecticidas convencionales de amplio espectro y reducir de esta forma el impacto que éstos tienen en el ambiente por ser no específicos y en algunos casos de gran toxicidad. Otra ventaja que presentarían es que se reducirían los costos de aplicación de agroquímicos, lo que iría ligado a un aumento en la producción. Existen reportes de posibles riesgos sobre insectos benéficos (parasitoides y predatores de insectos plaga) e insectos no blanco. Dentro de los posibles riesgos se citan efectos sobre las larvas de parasitoides, al afectarse la calidad del huésped. Por otro lado las larvas podrían verse directamente expuestas a la proteína al alimentarse de tejidos contaminados. Otro efecto negativo podría ser que las mismas no pudieran completar su ciclo debido a la muerte del organismo huésped. Existen posiciones encontradas con respecto a este punto, ya que se ha afirmado que el 22 Cristina Rivas Wagner consumo de dosis subletales de la toxina por parte del huésped podría mejorar el nivel de parasitismo, debido a que podría ver afectada su capacidad de defenderse del parasitoide. Los parasitoides adultos también pueden verse afectados directamente al consumir flores y savia de plantas que producen toxinas, aunque es muy poco probable que estas proteínas se expresen en el néctar. Además las toxinas Bt ejercen sus efectos letales solamente sobre insectos que poseen los receptores apropiados y las proteínas Bt que se expresan en las plantas transgénicas son altamente específicas para Lepidóptera y Coleóptera. La ubicación del huésped por parte del parasitoide depende de señales olfativas, visuales y táctiles que involucran tanto al huésped como a la planta. Se ha postulado que la introducción de un gen foráneo podría llevar a cambios en el perfil de compuestos volátiles por un efecto pleiotrópico o cambios en la mutagénesis insercional. Otro efecto posible sería que la disminución en el daño a las plantas Bt podría disminuir el atractivo de las mismas al parasitoide. Algo similar sucedería con los predatores en los que se han obtenido resultados contradictorios. Los mecanismos no están claros. A la preocupación sobre los posibles efectos en los insectos benéficos se suma la posibilidad de aparición de resistencia por las fuertes presiones de selección ejercidas sobre este carácter monogénico. Con la introducción al mercado de numerosos cultivos conteniendo genes Bt, el tema del manejo de la resistencia a insectos (IRM) ha adquirido importancia. Han surgido programas para controlar la aparición de posibles resistencias. Entre las medidas propuestas para lograr este objetivo se cita: a) el uso de cultivos Bt en un programa de manejo integrado, b) una estrategia que combina una exposición a altas dosis de la toxina asociado con plantación de refugios de cutivos no-Bt anexos a los Bt, c) supervisión y detección de posibles insectos resistentes en campos de productores. Sin embargo, estas medidas no son fáciles de implementar, ya que se introducen nuevos costos al sistema productivo. Además, hay un gran debate científico con respecto a las superficies recomendables para las áreas refugio. Ejemplo de cultivos genéticamente modificados para la resistencia a insectos · Maíz · Algodón · Tomate · Papa Plantas y cultivos transgénicos 23 El barrenador europeo del maíz (izquierda) y el gusano del copo de algodón (derecha) son dos plagas controladas por el maíz Bt y el algodón Bt, respectivamente. Híbridos de maíz resistentes al gusano de la raíz del maíz El gusano de la raíz del maíz (Diabrotica spp.) es una grave plaga en muchas zonas de cultivo del cereal en los Estados Unidos. Daña las raíces de las plántulas jóvenes de maíz y provoca una reducción del desarrollo y el deficiente establecimiento de las plantas. Este insecto es el responsable de la aplicación de la mayor cantidad de insecticida en los campos de maíz estadounidenses. Para combatir esta plaga, se debe aplicar el insecticida directamente al suelo, donde puede dejar residuos o provocar la infiltración hacia el agua subterránea. Al sustituir estos insecticidas químicos, los híbridos resistentes al gusano de la raíz del maíz pueden proporcionar importantes beneficios en cuanto a la calidad 24 Cristina Rivas Wagner Larva del gusano de la raíz del maíz alimentándose de una raíz joven. Escala del daño que causan las larvas al alimentarse de la raíz, desde un daño severo (izquierda) a ningún daño (derecha) PLANTAS RESISTENTES A HERBICIDAS | 7 El control de la maleza es uno de los mayores retos que afronta el agricultor al producir sus cultivos porque la maleza no controlada reduce drásticamente el rendimiento y la calidad de los cultivos. Muchos de los herbicidas que están en el mercado combaten sólo ciertos tipos de maleza y están aprobados para ser usados únicamente en determinados cultivos y en etapas específicas del desarrollo de las plantas. Los residuos de algunos herbicidas permanecen en el suelo un año o más y los agricultores deben prestar mucha atención a los antecedentes de aplicaciones de herbicidas en un campo cuando planean lo que sembrarán allí. Los cultivos tolerantes a los herbicidas pueden resolver muchos de estos problemas porque incluyen transgenes que proporcionan tolerancia a los herbicidas Roundup® (nombre químico: glifosato) o Liberty® (glufosinato). Estos herbicidas son de amplio espectro, lo cual implica que matan a casi todos los tipos de plantas excepto aquellas que tienen el gen de la tolerancia. Por consiguiente, el agricultor puede aplicar un solo herbicida en sus campos sembrados con cultivos tolerantes al herbicida y puede usar Roundup y Liberty eficazmente en la mayoría de las etapas de desarrollo de los cultivos, según se requiera. Otro beneficio importante es que esta clase de herbicida se descompone con rapidez en el suelo, lo cual elimina el Plantas y cultivos transgénicos 25 problema de los residuos remanentes del ciclo anterior y reduce los efectos ambientales. Las variedades tolerantes a los herbicidas son populares entre los agricultores porque permiten un control de la maleza menos complicado y más flexible. Estas variedades comúnmente se comercializan como variedades Roundup Ready® o Liberty Link®. Ejemplos de cultivos genéticamente modificados para tolerar herbicidas: · Remolacha azucarera · Arroz · Maíz · Algodón · Achicoria · Colza (Canola) · Colza argentina · Lino · Tabaco · Soya Parcela de soya infestada por malezas (izquierda) y soya Roundup Ready® después del tratamiento con Roundup. 26 Cristina Rivas Wagner PLANTAS RESISTENTES A VIRUS: ESTRATEGIAS PARA LA PROTECCIÓN DE PLANTAS MEDIANTE INGENIERÍA GENÉTICA | 8 Los virus pueden ser eliminados de las plantas por cultivo de meristemos. Sin embargo, es mucho más rentable prevenir la infección. No se debe olvidar que una planta curada puede volver a ser infectada por el mismo virus. Por lo general los agricultores siembran un mismo tipo de plantas en una misma zona, por lo tanto la enfermedad podría que dar residente en el suelo durante largo tiempo. Además, es inviable curar de virus a las plantas para cada siembra. El mecanismo de resistencia a los virus sobre todo el de reconocimiento del blanco no es totalmente conocido. Para limitar la infección de un virus puede provocarse una especie de vacunación utilizando un virus parcialmente dañado, cuyos efectos son más suaves. Las infecciones siguientes, realizadas por unidades más virulentas, tienen problemas para desarrollarse, tanto si las provoca el mismo virus como especies relacionadas. A este fenómeno se le denomina resistencia cruzada. La protección cruzada es una respuesta compleja causada por la replicación y expresión de un genoma viral completo. La protección cruzada debida a ingeniería genética no utiliza genomas completos. La acumulación de proteínas de la cubierta de un virus (CP) en una célula vegetal confiere resistencia frente al virus de procedencia y a la familia de virus relacionados con él. La expresión de estas proteínas en plantas se denomina “resistencia mediada por proteínas de la cubierta” Actualmente proponen 3 estrategias para proteger a las plantas de los virus usando la ingeniería genética: • Protección cruzada modificada. • Uso de ácidos nucleicos satélites. • Uso de RNA’s antisentido. Ejemplos de cultivos genéticamente modificados con la característica de resistencia a virus: · Papaya · Calabaza · Papa Plantas y cultivos transgénicos 27 Expresión de proteínas de la cubierta y resistencia en plantas transgénicas. Plásmidos derivados del Ti. Muestran sus regiones comunes Se han clonado genes de la cubierta de varios virus en vectores de expresión de plantas usando el sistema de transformación mediado por Agrobacterium tumefaciens el análisis de RNA se lleva acabo por transferencia de Northern y las proteínas de la cubierta se detectan inmunológicamente por Western. El promotor más usado es el del rRNA 35S del CaMV. También ha sido demostrado que las plantas de tabaco transgénicas que expresan proteínas de la cubierta del TMV(virus del mosaico del tabaco) muestren un descenso significativo de los síntomas desarrollados tras la infección. Este fenómeno se ha observado con en otras plantas y con otros virus. En muchos casos la resistencia a los virus se entiende como un descenso en la acumulación de virus en plantas y la reducción de las lesiones locales. Proteína de la cubierta del TMV 28 Cristina Rivas Wagner Cuando el investigador pretende optimizar la protección cruzada sigue el planteamiento de identificar la función de cada proteína. De esta manera discierne entre los genes responsables del fenómeno de protección de aquellos que codifican las proteínas causantes de los síntomas de la enfermedad. En las plantas transgénicas se insertan los genes responsables de la protección. Deben ser capaces de revertir la infección con virus nativos. Existen algunos ejemplos donde esta técnica ha tenido éxito. Veamos algunos: Proteínas de la cubierta del TMV fueron introducidas en plantas de tabaco bajo el control del promotor 35S del CaMV. Los síntomas de una infección posterior fueron más débiles que en las plantas normales. Además del 1060% de las plantas recombinantes no desarrollaron la infección. Plantas protegidas con proteínas de la cubierta del AMV (virus del mosaico de la alfalfa) son igualmente resistentes contra las enfermedades. Cuando inoculamos los RNA’s de los virus AMV y TMV son tan infecciosos en las platas que expresan proteínas de la cubierta como en aquellas que no lo hacen. Uso de RNAs satélites. Se ha observado que algunas secuencias de RNA pueden mejorar los síntomas de la enfermedad causadas por virus de RNA. Son secuencias de pequeño tamaño que se replican y encapsulan normalmente, que no tienen homología con el genoma principal y que no se requieren para la propagación ni replicación del virus. Son los denominados “RNAs satélites”. Su replicación y transmisión dependen de factores codificados en el genoma vírico. Pueden conferir algún tipo de ventaja selectiva porque no se pierden ni durante la proliferación ni por sección natural. La estrategia de protección genética consiste en introducir copias en DNA del vector RNA satélite. Parecen ser capaces de inhibir la formación de síntomas. En uno de los experimentos que demuestran lo anteriormente dicho transformaron plantas de tabaco con RNA satélite de CMV (virus del mosaico del pepino) bajo el control del promotor 35S rRNA del CaMV, usando el sistema de Agrobacterium. Tanto las plantas transgénicas como las de control desarrollaron lesiones cloróticas en las hojas en las que se produjo la infección. Sin embargo, las plantas control desarrollaron síntomas de mosaico en todas las hojas invadidas sistemáticamente, mientras que las transgénicas muestran los síntomas en las 2 o 3 hojas invadidas sistemáticamente. En las posteriores no se producen síntomas. Existen 3 tipos de pruebas para diagnosticar la infectividad de un virus: Transferencia de Northern: Se usan sondas tanto par el RNA viral como para el del RNA satélite. se pretende averiguar el efecto del satélite sobre el genoma viral. Inmunoensayo: para medir la abundancia de proteínas de la cubierta. Plantas y cultivos transgénicos 29 Test de infectividad en Chenopodium amanticolor: Esta es una planta que hospeda al CMV. En ella la formación de lesiones locales es proporcional a la concentración de partícula biológicamente activas del virus. Como resultado de estas pruebas se ha concluido que hay correlación entre la reducción de los síntomas de infección y el descenso en la replicación del virus. Para determinar el espectro de protección de este sistema se inoculan diferentes especies de virus en las plantas transgénicas. Solamente el TAV(tomato aspermy virus) indujo la síntesis del RNA satélite del CMV y redujo los síntomas. El CMV y el AMV son virus estrechamente relacionados filogenéticamente. Sin embargo, la atenuación de los síntomas no está relacionada ni con la reducción de la replicación del RNA genómico ni con la reducción de la infectividad de los extractos de los tejidos. De manera similar se ha investigado el efecto del RNA satélite del TabRV (tobacco rinespot virus) en plantas transgénicas. Cuando el virus infecta la célula produce un incremento drástico en la transcripción del cDNA satélite. Cuando se encuentra con trímeros de este cDNA (por ejemplo: tres copias del monómero situadas en tandem) se produce la reducción de síntomas. Los trímeros son escindidos por la célula a unidades monoméricas. Sin embargo, la introducción de monómeros no reduce los síntomas significativamente. Esto indica que hay un efecto del número de copias de cDNA. La protección se relaciona con el descenso en el nivel de replicación de las partículas víricas infectivas. Con todo esto es difícil de explicar que los síntomas del TAV pueden ser reducidos sin la inhibición completa de la replicación del virus. La explicación que se ha intentado dar dice que el RNA satélite interactúa con los estadíos tempranos de la replicación del virus y los formación de los síntomas no depende tanto de la concentración final del virus sino de su oportuna acumulación con relación al estado de desarrollo de la célula. Puede ser que el DNA satélite, o posibles proteínas codificadas por él, interactúen con el RNA en el proceso de producción de los síntomas. El RNA satélite se introduce bajo el promotor del RNA 35S del CaMV. Es un promotor constitutivo que, sin embargo, se induce en gran manera cuando es infectado por el virus. En la protección mediada por proteínas de la cubierta un exceso de inóculo puede saturarla. Aquí, a más inóculo más se induce. El problema que puede presentar esta estrategia es que la secuencia del gen que protege en un tipo de plantas puede ser virulenta en otras. Incluso puede producirse una mutación que la revierta al estado virulento original en la especie protegida. Uso de RNA antisentido. El RNA antisentido es aquel que puede hibridar con otra cadena de RNA porque es complementario a ella y de sentido opuesto. Esta técnica se usa para prevenir la traducción y consiguientemente la replicación, empaquetamiento y transmisión sistémica del virus. Los RNAs antisentido de varios virus han sido incorporados y expresados en plantas. Los resultados no han sido todo lo espectaculares que cabría esperar: 30 Cristina Rivas Wagner algunos proporcionan una protección débil frente a la infección vírica, otros no producen protección. Sin embargo, existe una gran cantidad de RNA antisentido de virus que no ha sido investigado totalmente. En ellos están puestas las esperanzas de aplicación práctica de la técnica. Hay plantas de tabaco transgénicas ha han sido protegidas de la infección con el virus X de la patata (CVX) mediante la expresión de RNA antisentido contra proteínas de la cubierta. El grado de protección es comparable con el que se obtiene cuando a estas plantas expresan la propia proteína de la cubierta. Con ambas técnicas se redujo el número de lesiones en la hojas inoculadas, se retrasó o desaparición la manifestación de síntomas sistémicos y disminuyó la acumulación de virus. Se ha demostrado que algunos tipos de RNA, incluyendo el RNA satélite del TabRV son capaces de escindirse espontánea y específicamente. Parece que esta reacción autocatalítica está relacionada con la presencia de ribozimas: unas secuencias cortas de RNA particulares; Su estructura secundaria adopta forma de cabeza de martillo. Se han podido sintetizar ribozimas artificialmente que son capaces de eliminar las secuencias blanco que deseemos y, por tanto, prevenir la expresión del producto codificado por ese gen. Las ribozimas tiene dos regiones de 8 nucleótidos que son complementarias a las secuencias que flanquean al punto de ruptura de la secuencia blanco. El potencial de esta técnica parece ser enorme, tanto en virología como en el estudio de otros aspectos relacionados con la regulación genética del metabolismo y el desarrollo. Virus X de la patata. Plantas y cultivos transgénicos 31 PRODUCCIÓN DE VACUNAS Y COMPUESTOS FARMACÉUTICOS EN PLANTAS TRANSGÉNICAS | 9 Aunque las plantas se han utilizado por miles de años con fines medicinales, ha sido recientemente que por medio de la ingeniería genética se han utilizado como biofábricas o biorreactores para producir diversos compuestos de interés farmacéutico. Dado que la demanda por estos compuestos va en aumento en todo el mundo,el uso de esta tecnología también está cada vez más extendido. Actualmente, el alto costo de muchos compuestos farmacéuticos limita su disponibilidad y aplicación. Los producidos en plantas transgénicas son, por el contrario, baratos para producir y almacenar, de fácil escalamiento para producción en masa y más seguros que los derivados de otros sistemas. En este artículo seanaliza el avance en este campo. El uso de reactores o biorreactores para la producción a nivel industrial de determinadas sustancias no es nuevo. Gran cantidad de compuestos de diversos tipos (incluyendo farmacéuticos) se ha estado produciendo por muchos años en diversos sistemas. Esto fue posible debido a que la mayoría de los genes de cualquier origen se puede expresar en sistemas heterólogos. El sistema de expresión ideal sería el que produce el material en mayor cantidad, más seguro y biológicamente más activo con el costo más bajo. El uso de células de mamíferos modificadas con técnicas de DNA recombinante tiene la ventaja de producir compuestos idénticos a los naturales; sin embargo, cultivar estas células es muy costoso y se puede realizar solamente en escala limitada. El uso de microorganismos, tales como bacterias, permite la producción a escala mucho mayor, pero tiene la desventaja de originar productos que no son exactamente iguales a los de origen natural. Por ejemplo, las proteínas que generalmente son glucosiladas (diversos azúcares unidos a la molécula) en seres humanos no son glucosiladas por bacterias. Además, las proteínas humanas que se expresan en altos niveles en Escherichia coli adquieren con frecuencia una conformación artificial y son más propensas a precipitar en forma intracelular debido principalmente a la carencia de puentes disulfuro y a un plegamiento inadecuado. La producción de proteínas recombinantes en plantas tiene muchas ventajas potenciales para generar compuestos farmacéuticos de importancia en medicina clínica. En primer lugar, los sistemas vegetales son más económicos que la infraestructura industrial utilizada en sistemas de fermentación o en biorreactores. En segundo lugar, ya está disponible la tecnología para cosechar y procesar plantas y sus productos a escala industrial. En tercer lugar, el requisito de la purificación del compuesto puede ser eliminado cuando el tejido de la planta que contiene la proteína recombinante se utiliza como alimento (como en el caso de las vacunas comestibles, veáse más adelante). En cuarto lugar, se puede dirigir a las proteínas recombinantes a determinados compartimientos intracelulares, o 32 Cristina Rivas Wagner expresarlos directamente en esos compartimientos (como por ejemplo el cloroplasto). En quinto lugar, se puede producir la proteína recombinante en plantas a escala industrial. Finalmente, los riesgos a la salud que se presentan por posible contaminación del producto recombinante con patógenos humanos son mínimos. Hay dos áreas en donde esta tecnología está teniendo un impacto importante: en la producción de anticuerpos y sus receptores y en la producción de vacunas comestibles. Anticuerpos en plantas transgénicas Desde hace más de diez años, las plantas han demostrado ser sistemas versátiles de producción para muchas formas de anticuerpos como IgG e IgA, IgG/IgA quiméricos y otros. Las plantas tienen un gran potencial como fuente virtualmente ilimitada de anticuerpos monoclonales baratos (llamados ¨planticuerpos¨) para terapia humana y animal. La mayoría de los anticuerpos expresados hasta la fecha han sido en tabaco, aunque también se han utilizado papa, soya, alfalfa, arroz y trigo. La ventaja principal de usar hojas (como en tabaco y alfalfa) para producir el anticuerpo es su rendimiento. Tanto la alfalfa como el tabaco pueden ser cosechados varias veces al año, con una producción potencial de biomasa por año de 17 toneladas/ha y mayor que 50 toneladas/ha, respectivamente. En contraste, la producción máxima de trigo, arroz o maíz difícilmente rebasa las 6 toneladas/ha. Otras ventajas del tabaco incluyen su facilidad para la manipulación genética, la producción de un gran número de semillas (hasta un millón por planta) y la imperiosa necesidad de explorar otros usos para este cultivo. Los anticuerpos producidos en plantas son bastante estables tanto a temperatura ambiente como a 4ºC. El material vegetal que contiene al anticuerpo se puede almacenar y la purificación se puede realizar en una planta de procesamiento que no necesita estar cerca del lugar en donde están las plantas y se puede utilizar todo el año. Hay muchos ejemplos de anticuerpos y sus receptores producidos exitosamente en plantas, aunque sólo uno de éstos se ha probado en seres humanos: un anticuerpo secretor quimérico de IgG/IgA contra un antígeno superficial de Streptococcus mutans, el agente causal de la caries dental. Este anticuerpo producido en tabaco fue aplicado tópicamente a los dientes de varios voluntarios y se encontró que era tan eficaz como un IgG producido en un hibridoma de ratón para prevenir la recolonización de las encías por S. mutans. Para dar otro ejemplo, un anticuerpo contra el virus del herpes (HSV) fue producido en soya y fue muy eficaz en la prevención de la infección vaginal por HSV en ratón. Un aspecto importante que se ha destacado de la producción de anticuerpos en plantas es el potencial bajo costo de producción. Hay pocos estudios de costos y por eso las estimaciones disponibles implican muchas suposiciones. El costo de producir IgG en alfalfa crecida en un invernadero de 250 m2 se estimó en 500-600 dólares/g, comparados con 5000 dólares/g para el Plantas y cultivos transgénicos 33 mismo anticuerpo pero producido por hibridomas (células cancerosas en cultivo in vitro). Es indudable que los niveles de expresión tendrán un impacto significativo en los costos, por ello en el nivel de expresión más alto registrado para un anticuerpo (500 µg/g de hoja para una IgA secretada), el costo final se estimó muy por debajo de 50 dólares/g. Esto contrasta ostensiblemente con los costos de anticuerpo purificado obtenido por cultivo de células (1000 dólares/g) o a partir de animales transgénicos (100 dólares/g). El componente más importante del costo de los planticuerpos será la purificación. La expresión en gérnenes de arroz y trigo abre la posibilidad de administración oral de algunos anticuerpos terapéuticos sin necesidad de purificación. Sin embargo, a pesar de todas estas ventajas, aún no se produce ningún anticuerpo en plantas en forma comercial. Muchos anticuerpos son sujetos a un proceso post-traduccional de glucosilación, que es crítico para su actividad. Sólo hay un estudio publicado en donde se analiza la glucosilación de un anticuerpo producido en plantas con el producido en hibridomas de ratón. Se encontró que los azúcares en el anticuerpo derivado de plantas eran estructuralmente más diversos, siendo el 40% del tipo manosa. El otro 60% tenía enlaces tipo ß-xilosa y ß-fucosa. Estos enlaces son típicos de plantas pero no se encuentran en mamíferos. El ácido siálico, que representaba el ~10% del contenido de azúcar del anticuerpo monoclonal de ratón, no se encontró en el anticuerpo de plantas. Sin embargo, estas diferencias en estructura parecen no tener ningún efecto sobre la unión al antígeno o sobre la afinidad in vitro y pudieran, igualmente, no ser importantes in vivo. Un IgG producido en alfalfa tuvo una vida media en suero en ratones Balb/c similar a la de un anticuerpo producido en hibridomas. Aunque existe una cierta preocupación por la inmunogenicidad potencial y la capacidad alergénica de los planticuerpos, es probable que éstos no presenten problemas para la mayoría de la gente porque las glucoproteínas de plantas son ubicuas en la dieta humana. En este sentido, no hubo evidencia de reacción alérgica a un anticuerpo humano antiratón (HAMA) en 60 pacientes que recibieron la aplicación oral tópica de IgA secretora específica para S. mutans. Vacunas comestibles La producción de diversos antígenos en plantas transgénicas es un hecho demostrado desde hace años. El interés para hacer estos experimentos fue que determinadas proteínas inmunogénicas clave del patógeno se podrían sintetizar en plantas y después usar el tejido vegetal como vacunas comestibles en seres humanos 34 Cristina Rivas Wagner o en animales. Se ha demostrado que esta idea es totalmente viable usando diversas proteínas bacterianas y virales. Actualmente, la vacunación en gran escala enfrenta una serie de dificultades: por un lado los altos costos de las vacunas y por el otro el riesgo de que la distribución en lugares remotos y de difícil acceso no sea adecuada. La mayoría de las vacunas disponibles se aplican por vía parenteral (inyecciones). La Organización Mundial de la Salud ha recomendado en diversas ocasiones buscar alternativas para sustituir a las inyecciones, debido a que se ha encontrado en algunos países que hasta un 30% de las inyecciones se realizan con jeringas no estériles. Considerando el grave problema del SIDA, este hecho es de gran relevancia. La aplicación de vacunas vía oral es una muy buena alternativa para las vacunas vía parenteral, en gran parte por razones de bajo costo y fácil administración. Asimismo, con las vacunas orales se incrementa la probabilidad de adquirir inmunidad en mucosas contra los agentes infecciosos que entran al cuerpo a través de una superficie mucosal. Una preocupación importante con las vacunas orales es la degradación de los antígenos en el estómago e intestino antes de que puedan inducir una respuesta inmune. Para protegerlos de la degradación se han desarrollado varios métodos. Entre éstos se encuentran el uso de cepas recombinantes de microorganismos atenuados (v. gr. Salmonella), de vehículos de bioencapsulación, tales como liposomas, y finalmente las plantas transgénicas. En los primeros trabajos con vacunas derivadas de plantas se utilizaron el tabaco y la papa. En teoría, la especie ideal para expresar los antígenos debería consumirse en fresco y tener altos niveles de proteína soluble; en este sentido, frutos como el plátano y el jitomate o, alternativamente, los cereales, son sistemas convenientes para este fin. Algunos ejemplos que ilustran la variedad de antígenos expresados en plantas transgénicas se dan en la tabla . Los antígenos derivados de plantas han inducido respuestas inmunes a nivel de mucosas y de suero cuando han sido administrados tanto con inyecciones como por vía oral en animales de laboratorio y, en varios experimentos, los han protegido contra el patógeno. De la misma manera, se han realizado exitosamente varias pruebas clínicas con voluntarios humanos en las cuales los antígenos consumidos por vía oral en tejido vegetal fueron capaces de inducir una respuesta inmune significativa. Por esta razón se considera que las vacunas preparadas en plantas tienen un gran potencial. La bioencapsulación de la subunidad B de la toxina lábil de Escherichia coli en maíz transgénico indujo una fuerte respuesta inmune Plantas y cultivos transgénicos 35 en ratones, en comparación con la alcanzada con el antígeno desnudo que fue más débil. Probablemente, esto se debió a que el antígeno estaba protegido contra la degradación en el intestino. La cantidad de tejido vegetal que constituya una dosis de vacuna debe ser pequeña. Por ello, es muy importante alcanzar altos niveles de expresión del antígeno en el tejido vegetal. Se han utilizado diferentes estrategias para aumentar los niveles de expresión de los transgenes; por ejemplo, utilizando diversas señales de regulación de la expresión genética, así como optimizando el uso del codones. Los niveles de expresión se podrían también elevar a través de cruzas de líneas transformadas con líneas establecidas y bien caracterizadas, estrategia que se ha aplicado con éxito para aumentar la producción de proteína total en maíz. Es también importante que cualquier antígeno esté presente en su forma nativa en el tejido vegetal. Esto normalmente se evalúa examinando el tamaño de la proteína sintetizada, su capacidad de formar las estructuras adecuadas (por ejemplo, partículas tipo virus) y, cuando sea relevante, su actividad enzimática o de unión a un receptor. La estabilidad de las proteínas heterólogas y el ensamblaje de estructuras multiméricas dependen en buena medida de la localización subcelular. Hasta ahora, los principales lugares en donde se han expresado antígenos son la superficie celular, el retículo endoplásmico y el aparato de Golgi. Estos sitios han permitido la producción de antígenos funcionales; sin embargo, hay sugerencias para probar otros compartimientos celulares, como por ejemplo el cloroplasto. Una estrategia relacionada con la de vacunas comestibles utiliza a plantas transgénicas que expresan autoantígenos, por lo que una dosis oral de un auto-antígeno puede inhibir el desarrollo de una enfermedad autoinmune a través del mecanismo de tolerancia. Este enfoque ha sido utilizado exitosamente en un modelo de diabetes en ratón. Actualmente en la Unidad Irapuato se trabaja en la producción de plantas transgénicas, principalmente de plátano y jitomate, que contengan diversos antígenos con la idea de generar vacunas comestibles. Los antígenos con los que se trabaja van desde diversos epítopos de Plasmodium falciparum, hasta antígenos de rotavirus, hepatitis B, HIV-SIDA y algunos antígenos de cáncer. Sin embargo, a diferencia de otros grupos que también trabajan en esta área, en el laboratorio se intenta inducir una respuesta inmune de tipo celular; específicamente, se utilizan como coadyuvantes moléculas de citocinas y quimiocinas que induzcan de preferencia interferón γ. Esta estrategia ya ha sido utilizada anteriormente, aunque no con plantas ni por vía oral, sino por vía parenteral. De esta manera, se espera no solamente inducir una respuesta inmune, sino influir en el tipo de respuesta. En los trabajos publicados, por lo regular se ha inducido una respuesta inmune de tipo hormonal, que no siempre es la más efectiva contra infecciones parasitarias o virales. 36 Cristina Rivas Wagner PRODUCTOS TRANSGÉNICOS DEL FUTURO | 10 El tomate Como el tomate es una de las hortalizas más populares en el mundo, se ha visto beneficiado por una larga historia de mejoramiento genético, que continúa en la era transgénica. El licopeno, un componente natural del tomate, es un factor nutricional relacionado con la vitamina A. Se están investigando técnicas transgénicas para producir variedades de tomate con un mayor contenido de licopeno. Otra característica de interés es la maduración tardía. Los tomates que maduran con más lentitud pueden permanecer en la mata por más tiempo y adquirir mejor sabor, en comparación con las variedades comerciales que se cosechan cuando están verdes. El tomate Flavr-Savr®, una de las primeras variedades de cultivos transgénicos aprobadas, era una variedad de maduración tardía. Como la característica había sido incorporada en una variedad cuyo desempeño era deficiente en otros aspectos, no fue un éxito comercial. Los suelos salinos son un problema creciente en muchas partes del mundo. Muchas plantas de cultivo, incluidos los tomates, mueren a causa del contenido elevado de sales en el suelo y en el agua de riego. El desarrollo de un tomate tolerante a la sal ofrece la posibilidad de cultivar esas hortalizas en tierras anteriormente no aptas para la agricultura. Científicos de la Universidad de California y la Universidad de Toronto han desarrollado una planta de tomate que puede tolerar concentraciones elevadas de sal y que retiene la sal en sus hojas, de tal modo que el fruto no tiene un sabor salado. Se estima que pasarán tres años antes de que estén disponibles en el mercado los tomates tolerantes a la sal. El mejor contenido nutricional y la maduración tardía son características transgénicas de interés en los tomates. Plantas y cultivos transgénicos 37 Dos plantas de tomates inoculadas artificialmente con la enfermedad del moteado bacteriano. La planta de la izquierda ha sido manipulada genéticamente con un gen para la resistencia a la enfermedad y la planta de la derecha es una variedad sensible, no manipulada. El arroz dorado Millones de personas en el mundo sufren carencia de vitamina A, que conduce a deterioro de la visión y una mayor sensibilidad a la diarrea, las enfermedades respiratorias y el sarampión. El arroz es un alimento básico en muchos países, en particular en Asia, pero no contiene vitamina A o sus precursores inmediatos. Mediante la inserción de dos genes del narciso y un gen de una especie bacteriana en plantas de arroz, investigadores suizos han producido arroz capaz de sintetizar betacaroteno, el precursos de la vitamina A. Esta variedad de arroz está siendo cruzada ahora con variedades adaptadas y posiblemente se harán ensayos sobre el terreno en uno o dos años Desarrollo de granos de arroz. La canola La canola es un importante cultivo oleaginoso. La investigación transgénica se ha concentrado en mejorar la calidad del aceite de canola aumentando el contenido de vitamina E o modificando el balance de ácidos grasos. 38 Cristina Rivas Wagner La meta de la investigación transgénica en el caso de la canola son los aceites mejorados desde el punto de vista nutricional. Mejor césped para los jardines y las áreas de recreación Existe una serie de problemas ambientales asociados con el uso actual del césped, que incluyen: • • • la cantidad de sustancias químicas aplicadas (fertilizantes, herbicidas, fungicidas y hasta tinturas); la gran cantidad de agua necesaria para mantener saludables los prados, en particular en el oeste; la energía requerida para cortar el césped. Las nuevas variedades transgénicas de césped resolverán algunos de estos problemas al incorporar genes para la tolerancia a los herbicidas, resistencia a las enfermedades y los insectos, menores tasas de crecimiento (que implican menos necesidad de cortar el césped) y tolerancia a la sequía, el calor y el frío. Los primeros de esos productos que llegarán al mercado probablemente serán las variedades Roundup Ready® de pasto azul de Kentucky, de la gramínea Agrestis palustris y de la hierba de búfalos. El control de la maleza en los prados sembrados con estas variedades se puede lograr con el herbicida Roundup, que es más benigno para el medio ambiente que los herbicidas actualmente usados, como el 2,4-D. El girasol Se están investigando una característica de resistencia a las enfermedades, otra de resistencia a las plagas y una más de resistencia a los herbicidas, pero no hay actualmente en el mercado ninguna variedad comercial con esas características. El moho blanco (Sclerotinia) es un problema grave para los productores de girasol en ciertas zonas. La resistencia a esta enfermedad permitiría expandir la superficie en la que se puede cultivar el girasol y mejorar el rendimiento en las zonas actualmente cultivadas. No se espera contar con una variedad comercial antes del 2005. También se investiga la resistencia a la oruga de Argentina, un insecto que come las hojas de la planta de girasol. Se han efectuado algunas investigaciones sobre el desarrollo de girasol que pueda tolerar el rociamiento con el herbicida Roundup. Esta característica permitiría a los agricultores rociar sus campos para combatir las malezas sin matar el cultivo. Plantas y cultivos transgénicos 39 Campo de girasoles. El café y el té Ahora se elabora café descafeinado tratando los granos de café para eliminar la cafeína. Uno de los métodos emplea solventes orgánicos para extraer la cafeína, lo cual genera en algunos consumidores la preocupación de que quedarán residuos de los solventes en el café que beben. Otros métodos son criticados por eliminar algunos componentes apreciados que producen sabor junto con la indeseable cafeína. Un científico en Hawai y otro en Escocia han identificado distintos genes que conducen a la producción de cafeína en los granos de café y las hojas de té. Si se pudieran "anular" esos genes en algunas plantas, se podrían obtener plantas de café y de té que generarían productos descafeinados en forma natural, con todo su sabor y aroma. La cosecha de los granos de café exige actualmente muchos recorridos a través de las plantaciones porque los granos maduran en momentos diferentes. Un científico en Hawai está desarrollando un método para lograr que todos los granos maduren al mismo tiempo, de tal modo que los recolectores puedan cosechar todos los granos en un sólo recorrido por la plantación. 40 Cristina Rivas Wagner Bayas del cafeto, llamadas "granos", madurando en el árbol. Las uvas y el vino La vid (Vitis vinifera) es sensible a varias enfermedades que reducen la cantidad y la calidad de las uvas para vino y de mesa o, incluso, matan la viña. Los genes que confieren resistencia a determinadas enfermedades reducirían el costo de combatir esas enfermedades en los viñedos. Investigadores de la Universidad de Florida han patentado un método para producir vides portadoras de un gen del gusano de seda que proporciona protección contra la enfermedad de Pierce, una enfermedad bacteriana letal que afecta las vides y varias otras plantas. Uvas en maduración. Plantas y cultivos transgénicos 41 El tabaco Se cultiva en la actualidad tabaco exento de nicotina para la proyectada introducción de cigarrillos sin nicotina. Los intentos anteriores para obtener productos con un bajo contenido de nicotina eliminaron parte del sabor junto con la nicotina. El tabaco genéticamente manipulado exento de nicotina no sintetiza la nicotina en la hoja. Tabaco Los árboles Se han transformado árboles como el álamo, el álamo temblón y el abeto con diversos genes para obtener resistencia a los insectos, tolerancia a los herbicidas y cantidades más altas del producto comercial. Por ejemplo, la reducción del contenido de lignina del árbol puede facilitar la recuperación de la pulpa de la madera. Entre las especies de árboles transgénicos que se están ensayando actualmente se incluyen: • • • • • Álamo: tolerancia a los herbicidas resistencia a los insectos. Eucalipto: tolerancia a los herbicidas. Álamo temblón: menos lignina. Liquidámbar: tolerancia a los herbicidas. Abeto blanco: resistencia a los insectos. 42 Cristina Rivas Wagner CONCLUSIÓN | 11 Si durante la última década del siglo pasado las grandes fortunas se crearon en la informática, las telecomunicaciones y en internet, durante las primeras décadas del presente siglo, el conocimiento y los medios para el control del código genético será un factor decisivo de la economía mundial y una fuente de conocimientos para la conservación o la destrucción de la vida en nuestro planeta. En general, habrá cambios importantes en la agricultura de los países desarrollados, un progreso relativo en aquellos en vías de desarrollo, que sean capaces de asimilar racionalmente las nuevas tecnologías y un desarrollo paulatino de la conciencia social, producto de un proceso muy contradictorio a lo largo del cual los científicos ocuparán un lugar decisivo en la función social de su trabajo. Al constituir el conocimiento biológico un centro de la economía y ser centro de la vida, se modificará la frontera actual en la responsabilidad técnica y la responsabilidad social del trabajo de los científicos. En correspondencia con estas necesidades, el derecho internacional tendrá que evolucionar en materia de propiedad intelectual y de conservación ambiental. Sólo así los conocimientos y las nuevas tecnologías que surjan en este campo podrán constituir un factor de progreso para la Humanidad. Plantas y cultivos transgénicos ANEXOS | 12 Ventajas y desventajas de las plantas transgénicas 43 44 Cristina Rivas Wagner Cronología de las plantas transgénicas 1970 Se planteó la hipótesis de que la enfermedad de las plantas denominada agalla del cuello podría ser producida por la transferencia de material genético entre una bacteria, Agrobacterium tumefaciens y células vegetales. 1973 Schell anunció el descubrimiento en cepas de Agrobacterium tumefasciens de un plásmido de un tamaño jamás observado hasta entonces y que el plásmido llamado Ti (del inglés Tumour inducing) es portador del carácter patógeno. 1981 E. Schnepf y H. Whiteley aislaron el primer gen que codifica una proteína insecticida. 1983 M.D. Chilton introdujo en la planta del tabaco un gen bacteriano que confería resistencia al antibiótico cloramfenicol, obteniendo las primeras plantas transgénicas. 1987 Se aplica el método del microcañón o cañón de partículas ideado por Sanford y Wolf 1988 Mediante la técnica de los protoplastos se consiguió por primera vez cereales transgénicos. 1996 Las investigaciones culminaron con la entrada en el mercado de plantas transgénicas (algodón, patata y maíz) resistentes a insectos. 1997 Hasta este año se habían realizado unos 3650 experimentos de campo con cultivos transgénicos y con resultados positivos. Plantas y cultivos transgénicos Agrobacterium tumefaciens y transferencia del TI 45 46 Cristina Rivas Wagner Artículo: Apoyo para la investigación con plantas transgénicas. Plantas y cultivos transgénicos 47 BIBLIOGRAFÍA | 13 Documento elaborado por J.F.Carrasco, extraido de: Butlletí Centre díEstudis de la Natura del Barcelonés Nord., IV (3): Sta. Coloma de Gramenet, 1999. http://www.xtec.es/~jcarrasc/transgenicas.htm Agro-Bio. Asociación sin ánimo de lucro, fundada en noviembre de 2000, con la función primordial de respaldar, promover y difundir el desarrollo de la biotecnología agrícola y sus aplicaciones prácticas bajo principios legales Éticos y científicos que se traduzcan en beneficios para la sociedad colombiana. http://www.agrobio.org/index.php Cultivos transgénicos: una introducción y guía a recursos. Presenta información ecuánime y vínculos con otros recursos relacionados con la tecnología y las cuestiones concernientes a los cultivos transgénicos (también llamados cultivos genéticamente modificados o GM). Los autores del sitio se dedican a la investigación y la enseñanza sobre fitogenética en la Universidad Estatal de Colorado. http://cls.casa.colostate.edu/CultivosTransgenicos/index.html Eibe (European Iniciative for Biotechnology Education): Plantas transgénicas, unidad 9. http://www.ipn.uni-kiel.de/eibe/UNIT09ES.PDF ASEBIO. Asociación Española de Bioempresas. ASEBIO actúa como plataforma de encuentro del sector biotecnológico y representa los intereses de sus asociados ante las administraciones regionales, nacionales y europeas. http://www.asebio.com/ Las plantas transgénicas y la agricultura mundial. Informe elaborado bajo los auspicios de la Royal Society of London, la Academia de Ciencias de Brasil, la Academia de Ciencias de China, la Academia de Ciencias del Tercer Mundo, la Academia Mexicana de Ciencias, la Academia Nacional de Ciencias de la India y la U.S. National Academy of Sciences. http://www.amc.unam.mx/Noticias/contenido_doctrans.html 48 Cristina Rivas Wagner Madigan; Martinko; Parker. (1997). Brock Biología de los microorganismos. 8™ edición. Editorial Pentice-Hall. Alberts, Bruce; Bray, Dennis; Lewis, Julian; Raff, Martin; roberts, Keith & Watson, James D. (1992). Bilogía molecular de la célula. 2™ edición. Editorial Omega. Feldman Riebe, J. The development and implementation strategies to prevent resistance to Bt-expressing crops: and industry perspective. Can. J. Plant Path. 21(2): 101-105. 1999. Miguel A.Gómez Lim. Avance y perspectiva, vol.20. Producción de vacunas y compuestos farmacéuticos en plantas transgénicas. Alberts, B; Jonson, A; Lewis, J; Raff, M; Roberts, K; Walter, P. 2002. Molecular Biology of the Cell. Garland Science. Hartl, D; Jones, E.2001. Genetics. Analysis of genes and Genomes. 5 th. edition. Jones and Bartlett Publishers.