3.- A 25ºC el grado de ionización ce una disolución acuosa de ácido
Anuncio

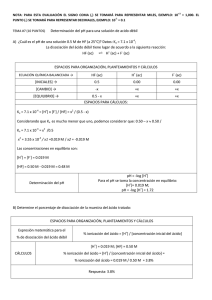
GALICIA / JUNIO 00. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO / OPCION A / CUESTIÓN 3 3.- A 25ºC el grado de ionización ce una disolución acuosa de ácido etanoico ( ácido acético) 0,0101M vale 0,0099. Calcúlese el pH de la misma y la constante de ionización del ácido etanoico a dicha temperatura. Solución: El ácido acético es el ácido más pequeño que contiene el grupo carboxílico –COOH. En disolución acuosa se descompone en ion acetato CH3 -COO- y en iones hidronio H3 O+. La tabla de equilibrio es la siguiente: CH3 -COOH D CO 0.101 CR 0,101a CEQ 0,101(1- a) CH3-COO - +H3O+ 0,101a 0,101a Siendo a = 0,0099 Ka= [CH3 -COO -] · [H3 O+] / [CH3 -COOH] Ka = (0,101· (0,0099))2 / (0,101 (1 - 0,0099)) Ka = 1,0 ·10-5 Esta es la constante de ionización, su valor refleja que es un ácido no demasiado débil. El pH se halla mediante su definición: pH = -log [H3 O+] [H3 O+] = 0,101 · 0,0099 = 9,9·10-4 pH = -log (9,9·10-4) = 3 www.profes.net es un servicio gratuito de Ediciones SM