Visualización de varias especies de protozoos en un
Anuncio

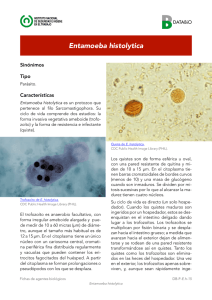
VISUALIZACIÓN DE VARIAS ESPECIES DE PROTOZOOS EN UN PACIENTE CON DIARREA INTERMITENTE. CASO 530 Paciente varón de 34 años de edad, noruego y residente en la provincia de Tarragona, derivado por su médico de cabecera a consultas externas de medicina digestiva por no presentar mejoría ante un cuadro de diarrea intermitente de un año de evolución. En un estudio parasitológico solicitado dos meses antes se observaron abundantes Blastocystis hominis por lo que se instauró tratamiento con 500 mg de metronidazol, tres veces al día durante 10 días. El paciente mantiene un ritmo deposicional alternante con diarrea pastosa 2-3 veces al día y no presenta ningún hallazgo significativo a la exploración física, no se encuentra asténico, ni ha sufrido pérdida de peso. El antecedente epidemiológico más relevante es el de un viaje a Paraguay y otro a la India, durante los cuales no prestó demasiada atención a las medidas higiénico-dietéticas, en los meses anteriores al inicio de la sintomatología. Se solicita una analítica general que no muestra ninguna alteración. Se le realiza una ileoscopia en la que no se objetivan anomalías y en la que la mucosa del colon se aprecia normal; se realizan biopsias escalonadas que no presentan ninguna alteración histopatológica. Se le realiza un coprocultivo que resulta negativo. Se solicita nuevo estudio parasitológico en heces, que pone de manifiesto la presencia de abundantes B. hominis, quistes de Entamoeba hartmanni, quistes de Entamoeba coli, y quistes y trofozoítos compatibles con el complejo Entamoeba histolytica/dispar/moshkovskii que posteriormente se confirmó mediante técnicas complementarias que correspondían a E. histolytica. ¿Cuáles de estas especies de protozoos deben considerarse patógenas para el ser humano, qué manifestaciones clínicas producen y cuál es su epidemiología? El término “ameba”engloba a las especies de protozoos pertenecientes a los géneros Entamoeba, Endolimax y Iodameba, integradas en la familia Entamoebidae. E. histolytica es la única ameba intestinal a la que se reconoce poder patógeno. La infección por E. histolytica puede ser de localización intestinal o extraintestinal. Aproximadamente un 80% de las infecciones intestinales son asintomáticas (pacientes que emiten quistes en las heces); la diarrea amebiana sin colitis asociada, en la que se objetiva dolor abdominal y un aumento en el número de deposiciones que no contienen moco ni sangre, es la manifestación más habitual de la infección intraluminal sintomática (que sería el cuadro clínico del paciente objeto del caso clínico) mientras que en la infección intestinal invasiva, denominada disentería amebiana, la diarrea se acompaña de lesiones ulcerosas de localización colónica, pérdida de peso y presencia de moco, sangre o pus en heces. Esta última manifestación puede presentar complicaciones poco frecuentes como megacolon tóxico, colitis necrotizante aguda o perforación intestinal. La localización extraintestinal es un cuadro grave en que aparecen abscesos de localización hepática que pueden diseminarse a pulmón, pericardio y más raramente a cerebro, acompañados de leucocitosis, fiebre, escalofríos y otros signos de infección sistémica. Las demás especies de amebas intestinales, E. dispar, E. moshkovskii, E. hartmanni, E. coli, E. polecki, Endolimax nana y Iodamoeba butschlii, son consideradas comensales, por lo que su hallazgo únicamente tiene interés epidemiológico. Aun así, se han descrito algunos casos clínicos por estas amebas que cursan con una diarrea leve y autolimitada. La mayoría de estas amebas presentan una distribución mundial, con una mayor prevalencia en zonas subdesarrolladas. E. histolytica es endémica en Méjico, Sudamérica, África y Sudeste Asiático. Se estima que un 10% de la población mundial se encuentra parasitada por el complejo E. histolytica/E. dispar. E. dispar es 10 veces más frecuente que E. histolytica en los países industrializados mientras que en los países en vías de desarrollo la prevalencia de ambas especies es muy semejante. La amebiasis invasiva es la tercera causa de mortalidad por parasitosis después de la malaria y la esquistomatosis, causando unas 100.000 muertes anuales. El hombre es el principal reservorio y se infecta por la ingesta de quistes maduros, que son eliminados por vía fecal contaminando agua y/o alimentos, siendo también posible la transmisión de persona a persona. B. hominis es un parásito intestinal, muy común en humanos, cuya clasificación taxonómica aún no está totalmente resuelta. En un principio fue clasificado como una levadura y actualmente se considera un protozoo que se agrupa junto a las amebas. El papel de B. hominis como patógeno humano también es controvertido. Clásicamente se había considerado no patógeno ya que no invade la mucosa intestinal, pero algunos autores sugieren que la observación en heces de más de cinco parásitos por campo en ausencia de otros enteropatógenos, acompañada de signos clínicos de enfermedad intestinal como diarrea, dolor abdominal, flatulencia, fatiga o anorexia, serían indicativos de su implicación etiológica en la afectación gastrointestinal. La distribución de B. hominis es cosmopolita y se encuentra frecuentemente asociado a otras amebas comensales como E. coli, E. nana y E. hominis. Su prevalencia oscila desde un 0,3% a un 54% en la población general. La vía de transmisión es oro-fecal, a través de la ingestión de aguas o alimentos contaminados. ¿Cuáles son las características morfológicas de las especies de protozoos detectadas en este paciente y cómo deben obtenerse y procesarse las muestras fecales para hacer el diagnóstico por microscopía? Se efectuaron preparaciones de las muestras fecales de nuestro paciente (remitidas en contenedor con solución fijadora de acetato sódico-ácido acético-formalina (SAF) sin concentrar y tras concentración por el método de sedimentación, que fueron observadas en fresco y teñidas con lugol. En estas preparaciones se visualizaron: Trofozoítos ameboides de un tamaño comprendido entre 25 y 45 mm que presentaban un solo núcleo con cromatina periférica fina y bien repartida, un cariosoma pequeño en la mayoría de las formas en posición central, pero que en otras era de localización excéntrica, y un endoplasma con granulación fina (figura 1B), que fueron clasificados como pertenecientes al complejo histolytica/dispar/moshkovskii. Quistes inmaduros de entre 12 y 18 mm, que presentaban un núcleo, una gran masa glucogénica endoplasmática de color pardo rojizo a su tinción con lugol y cuerpos cromatoides con extremos redondeados (figuras 1C-E). También se hallaron quistes maduros esféricos del mismo tamaño, que presentaban un máximo de 4 núcleos y cuerpos cromatoides de iguales características que los descritos en los trofozoítos anteriores (figura 1F). Ambos tipos de quistes fueron identificados como pertenecientes al complejo histolytica/dispar/moshkovskii. En las preparaciones destacaba también la presencia de otros quistes esféricos de tamaño mucho menor, de 6-8 µm, con cuatro núcleos de cariosoma compacto, pequeño y central, cuya cromatina nuclear era periférica y distribuida regularmente (figura 1G). Fueron clasificados como quistes de hartmanni. Asimismo, se apreciaron abundantes quistes esféricos u ovalados, con cuerpos cromatoidales en forma de astilla, de un tamaño que oscilaba entre 20-35 m La mayoría presentaban de 6 a 8 núcleos de localización excéntrica y cariosoma difuso y con cromatina periférica de distribución irregular (figura 1H). En algunos quistes los núcleos estaban desplazados por la presencia de una gran vacuola de glucógeno. Se clasificaron como quistes de E. coli. Por último, se observaron abundantes formas parasitarias refringentes, redondeadas u ovaladas, de gran pleomorfismo y tamaños comprendidos entre 8 y 10 µm, que poseían una gran vacuola central que ocupaba prácticamente el 50-95% de la célula, desplazando los núcleos a la periferia (figura 1A). Estas formas se clasificaron como hominis en la fase denominada de cuerpo central. La técnica más utilizada y disponible en todos los laboratorios para el diagnóstico de amebiasis y otras infecciones gastrointestinales producidas por protozoos es la observación en heces del parásito, ya sea del trofozoíto o de sus formas quísticas, aunque no permite distinguir las especies E. dispar y E. moshkovskii de la especie patógena E. histolytica. Se recomienda la toma de muestra en tres días alternos debido a que las formas parasitarias no se eliminan de forma constante, así como recogerlas con medio conservador y de fijación para minimizar la degeneración y alteraciones morfológicas que sufren los trofozoítos por la demora entre la obtención y procesamiento de la muestra. La visualización microscópica se puede realizar a partir de las preparaciones en fresco con solución salina o también a partir de un frotis fecal teñido con solución yodada o con tinciones permanentes, como la tricrómica de Gomori modificada, que facilitan la observación de algunas estructuras. El empleo de métodos físicoquímicos de concentración (técnica de Ritchie, de formol éter-etílico o formol-acetato de etilo) es muy aconsejable, pues permite mejorar la sensibilidad en la detección de protozoos intestinales que pueden encontrarse en escaso número o distribuidos de forma no homogénea en la muestra. De cualquier modo, los trofozoítos son estructuras muy lábiles que pueden sufrir distorsiones en el proceso de concentración que dificultará su identificación, por lo que en heces diarreicas procedentes de pacientes en que se sospeche amebiasis es muy recomendable el examen en freso en muestras recién emitidas, que además permitirá observar la eventual movilidad por pseudópodos característica de los trofozoítos. Por otro lado, hay que señalar que la exposición al agua antes de la fijación puede provocar la lisis de los trofozoítos y formas en cuerpo central de B. hominis. La observación del frotis fecal debe hacerse de forma minuciosa a 400 aumentos, o a 1.000 aumentos si se trata de tinciones permanentes, usando un micrométrico para medir las diferentes formas parasitarias presentes y barriendo toda la preparación, puesto que la identificación no debe basarse en las características de un solo microorganismo y las infecciones mixtas (como la del caso que presentamos) no son infrecuentes. Conviene recordar que la sensibilidad de la microscopía para la detección de amebas en heces es inferior al 60% si sólo se estudia una muestra, por lo que un resultado negativo en ningún caso descarta la infección. Figura 1 (A-H). Formas en cuerpo central de Blastocystis hominis (A); trofozoítos de E. histolytica (B); quistes inmaduros (C-E) y quiste maduro (F) de E. histolytica; quiste de E. hartmanni (G); quiste de E. coli con visión de 7 núcleos (H). ¿Por qué es importante diferenciar entre las especies del complejo histolytica/dispar/moshkovskii y a qué técnicas puede recurrirse para conseguirlo? La diferenciación entre las especies que componen el complejo E. histolytica/dispar/ moshkovskii no es posible mediante diagnóstico microscópico y, sin embargo, es indispensable puesto que la infección por E. dispar o por E. moshkovskii no requiere tratamiento al ser amebas comensales, mientras que cualquier forma de infección por E. histolytica debe ser tratada, incluida la asintomática o el estado de portador, al representar un riesgo para la comunidad como fuente potencial de nuevas infecciones y para el paciente por la posibilidad documentada de que desarrolle una amebiasis invasiva. Para el diagnóstico de infección por E. dispar y E. hystolitica pueden realizarse cultivos celulares seguidos de análisis isoenzimáticos; sin embargo, éstos sólo están disponibles en laboratorios especializados y presentan un gran número de falsos negativos. Las técnicas de diagnóstico molecular basadas en la amplificación por la reacción en cadena de la polimerasa del gen 18S rADN, aplicadas tanto a heces frescas como fijadas, superan en sensibilidad al diagnóstico microscópico convencional, son muy específicas y permiten diferenciar entre las tres especies del “complejo Entamoeba”, si bien son laboriosas, caras y complejas. Por otro lado existen en el mercado algunos métodos de ELISA de captura capaces de detectar en muestras de heces frescas o congeladas antígenos propios de E. histolytica (lectina Gal/GalNAc y un antígeno rico en serina) y, por lo tanto, de distinguir esta especie de E. dispar y E. moshkovskii. Son técnicas de gran sensibilidad (superior al diagnóstico microscópico) y especificidad, muy adecuadas para laboratorios asistenciales por su rapidez y sencillez de ejecución. En el caso que nos ocupa el diagnóstico de diarrea amebiana se confirmó al resultar positiva la lectina de E. histolytica en heces frescas del paciente mediante el kit Entamoeba CELISA PATH, que según algunos autores es el más específico de los métodos comercializados. ¿Cuál sería el tratamiento indicado para este paciente y la explicación para que presente infección por histolytica a pesar de haber recibido tratamiento con metronidazol? Existen dos tipos de fármacos usados para el tratamiento de la amebiasis: amebicidas luminales para la erradicación de quistes (paromonicina, iodiquinol), y amebicidas tisulares efectivos frente a los trofozoítos (metronidazol, tinidazol, dihidroemetina). Las infecciones invasivas deben ser tratadas con un amebicida tisular seguido de un amebicida luminal, mientras que el tratamiento recomendado para las infecciones intestinales no invasivas y el estado de portador es un agente luminal como la paromomicina. Los amebicidas tisulares como el metronidazol no son eficaces para erradicar los quistes y se ha constatado la persistencia de parásitos en el intestino en un 40-60% de los pacientes tratados únicamente con este fármaco, circunstancia que explicaría el hallazgo de trofozoítos y quistes de E. histolytica en las heces del paciente después de que se le administrase una dosis de 500 mg de metronidazol cada 8 horas durante 10 días para el tratamiento de B. bominis diagnosticado previamente. El tratamiento de las infecciones por B. hominis sólo está justificado cuando las infecciones son sintomáticas, se visualiza un elevado número de organismos en heces y se han excluido otras etiologías. Los tratamientos disponibles incluyen metronidazol, cotrimoxazol y idoquinol, siendo metronidazol el de primera elección, si bien se registran frecuentes fracasos terapéuticos con todos ellos. Caso descrito y discutido por: Servicio de Análisis Clínicos Ester Picó Plana, Mar Olga Pérez Moreno y Mª José Centelles Serrano Hospital Verge de la Cinta Tortosa. Tarragona Correo electrónico: marolgap@terra.es Palabras Clave: Amebas, Entamoeba histolytica, Diarrea, Blastocystis hominis.