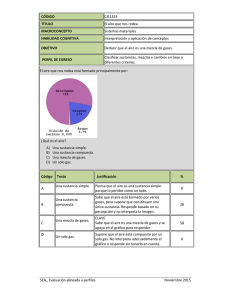
Atrofia cerebral en la esclerosis múltiple
Anuncio

Atrofia cerebral en la esclerosis múltiple María del Pino Sánchez López1, Antonieta Nieto Barco2, José Barroso Ribal2 Departamento de Anatomía Humana y Psicobiología. Universidad de Murcia. Murcia. Departamento de Psicobiología y Metodología de las Ciencias del Comportamiento. Universidad de La Laguna. Islas Canarias. 1 2 RESUMEN. La RM en la EM se ha utilizado mayoritariamente para el estudio de las lesiones cerebrales localizadas en la sustancia blanca. A pesar de ello, las lesiones en la sustancia blanca correlacionan moderadamente con la discapacidad funcional del paciente con EM, lo que sugiere que otros tipos de daño cerebral podrían ocurrir durante la enfermedad y ser responsables de la progresión clínica. En este sentido, la cuantificación de las lesiones corticales o de la atrofia cerebral está arrojando resultados prometedores. En esta revisión resumimos los diferentes métodos basados en la RM usados para cuantificar la atrofia cerebral global y regional en pacientes con EM y los resultados más relevantes publicados hasta la actualidad en las principales formas de la EM. Además, describimos la relación entre atrofia cerebral, otros marcadores de RM, el nivel de discapacidad física y el deterioro cognitivo. Palabras clave: esclerosis múltiple, resonancia magnética, atrofia cerebral, cognición. ABSTRACT. Magnetic Resonance Imaging (MRI) in MS (Multiple Sclerosis) has been mainly used to study the lesions located in the cerebral white matter. Nonetheless, this kind of lesion correlates just moderately with the functional disability observed in MS patients, suggesting that other types of brain damage may occur and be responsible for the clinical progression. In this respect, the quantification of the cortical lesions/integrity and measures of brain atrophy are providing encouraging results. In this review, we summarize both the different MRI-based methods used to quantify global and regional brain atrophy in MS and the results published so far regarding the more frequent clinical courses of this disease. In addition, we describe the relation between brain atrophy and other MRI measures, the level of physical disability, and the level of cognitive impairment in MS patients. Key words: multiple sclerosis, MRI, brain atrophy, cognition. L a Resonancia Magnética (RM), desde su introducción a mediados de los 80, se ha convertido en la técnica paraclínica más importante en el diagnóstico de la EM, aportando resultados positivos en aproximadamente el 95% de pacientes con la enfermedad1. La RM en la EM nos permite visualizar lesiones cerebrales localizadas en la sustancia blanca y establecer el grado de desmielinización, gliosis, edema, inflamación y daño axonal que tienen las placas. También nos permite detectar la existencia de afectación difusa en la sustancia blanca de apariencia normal, aunque para ello son necesarias técnicas poco habituales en la clínica2. Además, es también útil para la comprensión de la historia natural de esta enfermedad, así como para la monitorización de la eficacia de los tratamientos. A pesar de ello, las lesiones en la sustancia blanca correlacionan moderadamente con la discapacidad funcional del paciente con EM, medida con la Expanded Disability Status Scale (EDSS)3, o con la Multiple Sclerosis Functional Composite (MSFC)4. Esta paradoja entre los datos clínicos y la cuantificación de lesiones en la sustancia blanca en las imágenes de RM sugiere que otros tipos de daño cerebral podrían ocurrir durante la enfermedad y ser responsables de la progresión clínica. En este sentido, otras técnicas, como las imágenes por transferencia de magnetización, imágenes por difusión, espectroscopia, o el uso de procedimientos de cuantificación de las lesiones corticales o de la atrofia cerebral, están arrojando resultados prometedores. El presente estudio tiene 3 objetivos: 1) revisar las aproximaciones usadas para cuantificar la atrofia cerebral en pacientes con EM y los principales resultados publicados hasta la actualidad en las principales formas de la EM; 2) describir la relación entre atrofia cerebral, otros marcadores de RM y nivel de discapacidad física; y 3) describir la relación entre atrofia cerebral y nivel de discapacidad cognitiva. Correspondencia: José Barroso – Facultad de Psicología – Campus Universitario de Guajara – 38205 La Laguna – Santa Cruz de Tenerife Islas Canarias – Teléfono: 34(9) 22 317 565. FAX: 34(9) 22 317 461 – E-mail: jbarroso@ull.es Revisión ❑ Medidas de atrofia en pacientes con EM Diversos estudios han puesto de manifiesto que los pacientes con EM presentan distintos grados de atrofia cerebral (global o regional), así como de médula espinal. La pérdida axonal en las lesiones5, 6, así como la reducción del diámetro axonal como consecuencia de la desmielinización7, son dos de los principales procesos patológicos responsables de la atrofia. Además, el daño microscópico detectado en la sustancia blanca de apariencia normal puede ser asimismo responsable de la atrofia presente en la EM. La atrofia ha sido encontrada incluso en las etapas iniciales de la enfermedad8-15. Las medidas de atrofia que se han usado son estimaciones o mediciones directas del volumen ce- REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 13 Revisión A B 13 Figura 1 Ejemplos de medidas lineales de atrofia: A) cálculo ratio bicaudado: distancia mínima entre caudados (línea negra) dividida por el ancho cerebral en el mismo nivel (línea blanca); B) cálculo ancho tercer ventrículo. A B 14 Figura 2 Ejemplo de segmentación del cuerpo calloso: A) corte sagital medial de un paciente con EM; B) segmentación del cuerpo calloso. rebral, total o diferenciando sustancia gris (SG) y blanca (SB), o del volumen ventricular, así como diferentes medidas lineales y de superficie como, por ejemplo, medidas lineales del ancho del cerebro, superficie del cuerpo calloso, ancho del tercer ventrículo (Figura 1; Figura 2). Para realizar estas mediciones se han propuesto diferentes métodos que podemos diferenciar en función de la cantidad de intervención que requieran por parte del investigador: manuales, semi-automáticos y automáticos. Los métodos manuales presentan la dificultad de ser poco reproducibles y suponer un alto consumo de tiempo. En la actualidad se usan mayoritariamente métodos semiautomáticos o automáticos, más precisos, reproREVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE ducibles y que implican un consumo de tiempo significativamente menor. Aunque con estos métodos pueden determinarse a priori las regiones que van a ser objeto de medida (regiones de interés, ROI), su principal ventaja reside en que permiten utilizar una aproximación exploratoria: no es necesario establecer a priori las regiones de interés, sino que explora el total del cerebro. Así, por ejemplo, la Voxel Based Morphometry (VBM) permite realizar un análisis utilizando la información contenida en cada unidad de volumen de la RM, esto es, un análisis voxel a voxel del total del cerebro16, 17 (Figura 3). Los estudios que valoran la atrofia cerebral global a partir de mediciones del volumen del parénqui- Nº 15 - Septiembre de 2010 María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal Figura 3 Ejemplo de segmentación automática de sustancia gris y blanca. De izquierda a derecha: contenido intracraneal (imagen original); segmentación de sustancia gris y segmentación de sustancia blanca, obtenida con una aproximación Voxel Based Morphometry (VBM), ejecutada con el software SPM8. ma cerebral (VPC), independientemente del método y técnica de segmentación usada (ver Pelletier et al.18, para una revisión), encuentran una pérdida significativa en el VPC de los pacientes con EM estimada entre un 2,7 y 4,8%, en relación a controles normales, tanto en muestras de remitentes-recurrentes (RM)11, 14, 19-22 como en muestras heterogéneas según el curso de la enfermedad9, 12, 13, 23-34. Algunos de estos estudios encuentran diferencias entre los cursos clínicos, en ocasiones alcanzando la significación y en otras mostrando sólo una tendencia hacia una mayor atrofia en los pacientes crónicos progresivos12, 25, 27, 29, 32, 33. Esto, junto a las variaciones en los procedimientos, podría explicar las diferencias entre estudios en los porcentajes de pérdida del VPC. Por ejemplo, Sanfilipo et al.30 encontraron una pérdida de VPC de aproximadamente 4,6%, mientras que en el estudio de Tiberio et al.22 se encontró un valor menor de pérdida, de tan sólo el 2,7%. En el primer caso, se estudiaron pacientes con cursos RR y secundariamente –progresivos (SP), mientras que en el segundo, sólo se incluyeron pacientes con curso RR. Algunos estudios indican que, entre los pacientes progresivos, los secundariamente progresivos son los más claramente afectados. Así, Vrenken et al.33 encontraron diferencias significativas entre pacientes con curso SP y RR en volumen cerebral normalizado por el volumen intracraneal, pero no entre los mismos pacientes RR y los primariamente progresivos (PP). Otros estudios, por el contrario, no encuentran diferencias entre los cursos clínicos10, 13, 26, 28. Así, por ejemplo, De Stefano et al.28, comparando pacientes con curso PP y RR, con una duración de la enfermedad equivalente, encontraron que el volumen cortical normalizado fue similar entre estos dos subtipos de pacientes. Algunos autores se han interesado por medir de forma separada sustancia blanca y gris en el parénquima cerebral. En general, los pacientes con EM presentan un menor volumen de sustancia gris o fracción de sustancia gris (en relación al volumen intracraneal) comparados con controles sanos19, 22, 30-32, 34-40. Tedeschi et al.32 estudiaron una muestra amplia de 597 pacientes (RR, SP y PP) y encontraron un decremento del 3,9% en volumen de sustancia gris en los pacientes en comparación con controles. La atrofia en sustancia gris se ha encontrado incluso en etapas tempranas de la enfermedad, con una pérdida de tejido de 2,5% en comparación con controles normales19, y de 3,8% en una muestra con síndromes aislados con alto riesgo de desarrollar EM15. En muestras con una duración media mayor de la enfermedad se ha encontrado un porcentaje mayor de pérdida de volumen de sustancia gris (7,1%)35. Son escasos los estudios en los que no se han observado diferencias entre pacientes y controles en el volumen de sustancia gris14, 41, 42. La falta de significación en estos estudios puede deberse a lo reducido de la muestra usada14, o al método de segmentación binarizado usado41. En el estudio de Horakova et al.42 no se observan diferencias significativas en el volumen de sustancia gris entre pacientes con curso RR y controles, pero sí en el volumen del neocórtex, lo cual puede ser indicativo de que la atrofia cerebral no afecta a todas las estructuras cerebrales de la misma manera43. Con respecto a la atrofia en la sustancia blanca, muchos estudios informan de un menor volumen de sustancia blanca en pacientes con EM comparados con controles9, 19, 22, 32, 34, 36, 37, 40, 41. Sin embargo, otros estudios no han encontrado diferencias significativas entre pacientes y controles, tanto con REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 15 Revisión 13 16 muestras con un curso RR35, 39 como en muestras heterogéneas según el curso clínico de la enfermedad30 o en pacientes con síndromes aislados con alto riesgo de desarrollar EM15. El hecho de que no siempre se aprecie atrofia en sustancia blanca puede deberse a que aunque la pérdida axonal esté presente, sea compensada, en términos de volumen, por gliosis y edema, dos fenómenos que ocurren en áreas segmentadas como placas, y añadidas al volumen de sustancia blanca35. Un resultado que apoya esta explicación es el encontrado en pacientes con síndromes clínicamente aislados que, después de 3 años de seguimiento presentaron una pérdida significativa del volumen de sustancia gris, pero pequeños incrementos en el volumen de sustancia blanca44. En etapas activas de la enfermedad, los incrementos en lesión en sustancia blanca, con la consecuente inflamación y edema, podría causar incrementos en el volumen de sustancia blanca y enmascarar la medida de la atrofia. Otros factores, tales como la resolución de las imágenes, el contraste o el grosor de los cortes, pueden afectar también a la segmentación de la sustancia gris y blanca y, por tanto, obstaculizar la detección de la pérdida de sustancia blanca43. Por otro lado, la degeneración en la sustancia gris podría representar un proceso independiente (daño focal o difuso en la sustancia gris), que está sólo parcialmente relacionado con la degeneración waleriana ocasionada por las lesiones en la sustancia blanca22, 45-49. Recientemente, Antulov et al.50 informan de unos resultados que confirman esta idea. Estos investigadores demuestran que la atrofia en sustancia gris no presenta la misma distribución regional que las lesiones en la sustancia blanca, en pacientes con curso RR y SP. Las posibles diferencias en atrofia de SG o SB según el curso clínico han sido poco estudiadas. Tedeschi et al.32 compararon fracciones de sustancia gris y blanca en una gran muestra de pacientes con EM con diferentes subtipos de la enfermedad (427 RR/140 SP/30 PP). Encontraron menor fracción de sustancia gris y fracción de sustancia blanca para los pacientes con un curso SP comparados con pacientes con curso RR, con valores intermedios en los pacientes con un curso PP. Otros autores también han informado de un menor volumen de sustancia blanca en pacientes con curso SP en relación a pacientes con curso RR25. Diversos estudios han analizado la dilatación ventricular como un indicador de la atrofia cerebral. Para ello se han utilizado diversas medidas: el volumen de todos o algunos ventrículos, o medidas lineales, como, por ejemplo, ancho del III ventrículo, ancho ventrículos laterales, span bifrontal (también llamado ratio bicaudado o ratio intercaudado), diámetro anteroposterior, asta temporal, ratio ventríREVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE culo-cerebro. La mayoría de los autores encuentran mayor atrofia en EM en relación a controles normales8, 13, 24, 26, 35, 40, 44, 51-55, aunque en algunos estudios no encuentran diferencias9, 12, 27. También se ha encontrado una significativa atrofia ventricular en pacientes con síndromes clínicamente aislados, que en el seguimiento desarrollaron una EM, en comparación con aquellos que no fueron diagnosticados de EM56, 57. Con respecto a las diferencias en atrofia ventricular entre los cursos clínicos de la enfermedad, existe alguna evidencia de que los pacientes con un curso SP tienen mayor atrofia ventricular que los cursos RR o PP25, 52, 58, 59, aunque con algunos resultados discrepantes13, 53, 60. La atrofia ventricular puede ser debida a atrofia talámica y de otros núcleos grises subcorticales. La atrofia de los núcleos grises profundos (tálamo y núcleo caudado) ha sido específicamente estudiada por algunos autores27, 61-63. Cifelli et al.61 encontraron un decremento en la densidad neuronal del 22% en el tálamo de pacientes con EM. Houtchens et al.62 realizaron una segmentación del tálamo de 79 pacientes con EM (RR y PP) y 16 controles sanos, encontrando que el volumen talámico fue 16,8% menor en el grupo con EM. Con respecto a otras medidas regionales de atrofia cerebral, los resultados indican que los pacientes con EM, comparados con sujetos controles neurológicamente normales, presentan un volumen hipocampal reducido64, un área o diámetro de médula espinal cervical menor9, 10, 58, 65-67, así como una reducción en el área o volumen de otras estructuras infratentoriales, como tronco cerebral9, 66, 67 y/o cerebelo9, 67, 68. Además, se han encontrado diferencias significativas entre EM y controles en la medida del área del cuerpo calloso o de ésta en relación al intracráneo8, 9, 25, 55, 69-73, con evidencias de diferencias significativas entre los cursos SP y RR, con menores valores en SP25, 60. Más recientemente, el desarrollo de otras técnicas de segmentación de regiones cerebrales ha permitido el estudio de la distribución regional de la atrofia en la EM. Algunos estudios se han centrado en la medida de la atrofia de los lóbulos cerebrales, definida como la fracción de parénquima cerebral regional (sustancia gris + sustancia blanca) de los lóbulos frontal, temporal, parietal y occipital en cada hemisferio. Benedict et al.74 midieron atrofia lobar en 31 pacientes con EM (RR y SP) y 16 sujetos sanos. Los pacientes mostraron significativa atrofia cerebral regional en todos los lóbulos y más particularmente en el parénquima cerebral regional temporal izquierdo. Por su parte, Carone et al.75 definieron 13 regiones hemisféricas por medio de trazado manual de los surcos principales y el sistema de coordenadas Talairach. Los volúmenes de sustancia gris y blanca Nº 15 - Septiembre de 2010 María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal fueron cuantificados para cada región. Los autores informaron que todas las fracciones de sustancia gris regionales fueron significativamente menores para los pacientes, excepto aquellas de regiones temporales anteriores y parietales inferiores. La mayor diferencia en el porcentaje medio entre los grupos fue para la región ganglios basales posteriores/tálamo (-19,3%). Sin embargo, para las fracciones de sustancia blanca regional, sólo 4 de las 13 regiones estudiadas fueron significativamente menores para los pacientes: regiones parietales inferiores, frontales inferiores mediales, temporales posteriores y frontales inferiores. Los autores concluyen que la atrofia en la EM es difusa y está más relacionada con la pérdida de sustancia gris, particularmente en la sustancia gris profunda y regiones fronto-parietales superiores. Todos los estudios citados anteriormente están basados en segmentaciones manuales o semi-automáticas de regiones de interés. Sin embargo, otros estudios han explorado el cerebro de una forma global usando la morfometría basada en el voxel (VBM). Con este procedimiento, varios estudios encuentran atrofia talámica bilateral en la EM17, 75, 77-79, así como en pacientes con síndromes aislados con alto riesgo de desarrollar EM15, 80, aunque también informan de atrofia en otras regiones cerebrales. Así, por ejemplo, Audoin et al.15, en una muestra de pacientes con síndromes aislados con alto riesgo de desarrollar EM, comparados con controles sanos, encontraron una significativa atrofia en el tálamo bilateral, núcleo caudado bilateral, núcleo lenticular bilateral, ínsula bilateral, córtex orbitofrontal bilateral, regiones temporales internas bilaterales e inferiores, córtex cingulado posterior y cerebelo bilateral. Otro estudio VBM17 investigó la distribución regional de la atrofia de sustancia gris en pacientes con EM-PP. En la línea base, los pacientes sólo mostraron atrofia talámica bilateral con respecto a los controles. Después de un año de seguimiento, la pérdida de sustancia gris en los pacientes se extendió a putamen, caudado y áreas corticales. Mesaros et al.81, con una muestra de pacientes con EM con un curso benigno, demostraron que los pacientes, en comparación con controles sanos, presentaron menor volumen en sustancia gris, tanto en regiones subcorticales como frontoparietales. Una submuestra con un curso SP se caracterizó por presentar, además, atrofia de sustancia gris de cerebelo. Por su parte, Morgen et al.82 encontraron en pacientes con EM-RR una reducción en volumen de sustancia gris en el córtex temporal y prefrontal, principalmente en el hemisferio izquierdo. Otros estudios recientes con pacientes con EM-RR confirman que el volumen en sustancia gris está significativamente disminuido en el córtex frontotemporal izquierdo40, 83, 84, pero también en el precuneus, giro cingulado anterior y núcleo caudado bilateralmente40, 84. En resumen, los estudios de VBM confirman la presencia de atrofia focal en los núcleos grises profundos y de atrofia cortical difusa, esencialmente localizada en regiones frontales y temporales. El grosor cortical también ha sido medido en pacientes con EM. Sailer et al.16 encontraron que en 20 pacientes con EM (RR y SP) el grosor cortical medio fue significativamente menor, comparados con controles, en el córtex frontal y temporal en EM reciente y en el córtex motor en pacientes con discapacidad más avanzada. Por su parte, Calabrese et al.85 informaron de menor grosor cortical en los pacientes con posible EM, en los que presentaban un curso RR y SP, en regiones precentral, postcentral, frontal y algunas áreas occipitales. Los estudios longitudinales de la atrofia cerebral en la EM muestran alguna evidencia de progresión de la atrofia utilizando diferentes procedimientos: usando medidas lineales semi-cuantititativas para estimar la atrofia de los ventrículos laterales y III ventrículo8, 52, 55, o empleando técnicas de segmentación parcial midiendo el parénquima cerebral en 4 cortes contiguos después de 1 año86 o 18 meses10, 87. También se encuentran esas evidencias de progresión de la atrofia, midiendo el volumen cerebral después de 3 meses88, un año13 y dos años26, 89; a través de la medida del cambio en volumen ventricular anual13, después de 18 meses90 y a los dos años26, así como cuantificando el volumen de sustancia gris cerebral en EM RR después de 18 meses14. Además, existe evidencia de progresión de la atrofia del cuerpo calloso, en muestras de EM-RR a los 2 años8 y a los 5 años73. Algunos grupos de investigación han estudiado la tasa de pérdida de sustancia gris comparada con la pérdida de sustancia blanca, encontrando que sólo hay evidencias de progresión en la atrofia de la sustancia gris22, 42, 44, 91, 92. Por ejemplo, durante un período de dos años se encontró en una amplia muestra de pacientes con un curso RR (n=147) una pérdida significativa de volumen de sustancia gris (2,6 vs. 0,72%) en comparación con controles normales, mientras que el volumen en sustancia blanca fue estable y similar para pacientes y controles42. En un estudio longitudinal de 3 años44 de pacientes con síndromes clínicos aislados que sugieren una EM, los pacientes que desarrollaron EM presentaron una disminución significativa en la fracción de sustancia gris (-3,3%), pero no hubo cambios en la fracción de sustancia blanca. En unos pocos estudios no se encuentran cambios significativos en el seguimiento en los parámetros de atrofia estudiados12, 93, 94, apuntando los autores que la ausencia de resultados positivos podría explicarse por la ausencia de grupo control, por contar con una REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 17 Revisión Tabla I 1er autorreferencia 13 Ge12 18 Resumen de estudios que informan de estimaciones de atrofia cerebral y de relaciones entre ésta y el curso clínico de la EM Características de los pacientes con EM Tipo Edad Duración EDSS Enfermedad 27 RR, 9 SP 37.8 3.3 2.5 EM Vs. normales ↓ FPC ↑ volumen LCR ↓ VCG, ↑ VV Fox13 6 RR, 6SP, 9PP, 5 benignos 44.7 13.0 4.75 Ge41 Bermel53 Kalkers26 30 RR 42 RR, 18 SP 42 RR, 21 SP, 20 PP 34.9 3.8 2 39.8 6.4 2.0 Chard19 De Stefano20 De Stefano28 Kassubek21 Bermel27 Quarantelli35 Sharma29 Inglese36 Dalton44 26 RR 20 RR 65 RR, 25 PP 33 RR 60 RR, 18 SP 50 RR 43 RR, 9 SP 71 RR 58 CIS 36.1 37 38 34.9 42.5 35.6 42.8 38 17-50 1.8 4.5 7.5 4.6 11.8 9.9 11.6 5 Sastre-Garriga37 Chard14 Amato135 Zivadinov94 Valsasina92 Tiberio22 43 PP 13 RR 41 RR 30 RR 117 RR 21 RR 38.5 36.4 35.1 34.4 33.8 37.54 3.32 1.9 4.0 4.9 8.3 2.1 1.0 2.0 1.9 2.4 3.4 2.5 3.5 2.0 1 (EM: 3 años) 4.5 1.0 1.5 1.4 2.3 1.0 Sastre-Garriga91 Sanfilipo30 31 PP 35 RR, 6 SP 46.0 39.8 3.0 9.5 4.5 3.2 Tedeschi32 427 RR, 140 SP, 30 PP 21 RR 38.1 9.73 2.9 ↓ FPC, ↓ VSG, ↓ VSB, ↓ FSG, ↓ FSB ↓ FPC, ↓ FSG, ↓ FSB 36 2.1 1 ↔ SG regional Audoin76 muestra limitada de pacientes, así como por el uso de períodos cortos de seguimiento. La disparidad en los métodos de cuantificación de la atrofia y las diferencias en procedimientos para los análisis de los resultados son otros factores que explicarían estos resultados. Sólo algunos estudios se han interesado por las diferencias entre los cursos clínicos de la enfermedad en relación a los cambios longitudinales. Los resultados han sido generalmente negativos13, 26, 95, excepto en el estudio de Dalton et al.44, en el que encontraron un aumento significativo de la atrofia ventricular después de un año en una muestra heterogénea, presenREVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE ↓ FSG, ↓ FSB Ratio bicaudado ↓ FPC, ↑ FV Resultados LB-Seguimiento No seguimiento de controles ↓ VCG (0.88% por año) ↑ VV (1.6 mL por año) ↓ FPC, ↑FV ↓ FPC, ↓ FSG, ↓ FSB ↓ VCoN ↓ VCoN (RR y PP) ↓ FPC ↓ FPC ↓ FSG, ↔ FSB, ↑ F_LCR ↓ FPC ↓ FSG, ↓ FSB RR/SP/PP N.S. N.S FPC: N.S. ↑ FV: tendió a > en SP/PP N.S. N.S. ↓ FSG, ↔ FSB ↑ VV (solo en EM) ↓ VSG, ↓ VSB ↑∆ SG, ↔∆ SB ↓ VCoN N.S. ∆ FSG, ↔ FSB ↓ FPC, ↓ FSG, ↓ FSB, ↑∆ SG, ↔∆ SB ∆ FSG, ↔ FSB FSG y FSB: RR≠SP 2 años: ↓ tálamo y prefrontal lateral derecho en EM Vs. Controles tando los pacientes con curso SP mayores niveles de atrofia. En la Tabla I se presenta un resumen de los resultados descritos en este apartado. ❑ Atrofia y carga lesional Los mecanismos patológicos exactos que contribuyen a la atrofia cerebral no están claramente definidos. El estudio de la relación entre la atrofia cerebral y las lesiones en sustancia blanca, presentes en las imágenes de RM (en T2 y en T1 con y sin gadolinio) en paciente con EM, puede ayudar a entender dichos mecanismos. Nº 15 - Septiembre de 2010 María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal Tabla I (Continuación) 1er autorreferencia Características de los pacientes con EM Resultados Tipo Edad Duración Enfermedad EDSS EM Vs. normales Carone75 31RR, 37SP 45.3 13.5 1.5 ↓ FPC, ↓ VSG, ↓ VSB 11/13 regiones SG (SG profunda y Frontoparietales superiores) 4/13 regiones SB Sanfilipo31 34 RR, 6 SP 42.4 11.2 3.3 ↓ VSG, ↓ VSB Prinster 51 RR 38.6 13.1 2.6 ↓ VSG regional Ceccarelli39 32 RR 37.3 8 2.5 ↓ FSG, ↔ FSB 20 RR, 15SP, 5 PP 45.0 10.2 3.7 ↓ VSG, ↓ VSB Horakova42 147 RR 30.7 5.5 1.8 ↔ FSG, ↓ FSB Ceccarelli78 26 RR 27 SP 18 PP 28 SCA 36.3 45 50.2 30.7 9 17.6 8.5 0.0 1.0 6.0 5.5 0.0 MS Vs. SCA: ↓ VSG en giro pre y post central derecho Anderson68 29 SCA 33 RR 11 SP 51.5 1.5 2.5 6.5 ↓ FSG cerebelar (RR y SP) ↓ FSB cerebelar (SP) Battaglini83 59 RR 35 1.8 1.5 ↓ volumen cortical SG Ceccarelli79 18 PP 49.6 10.7 5.5 Atrofia SG: en tálamo y la ínsula derecha Stosic34 39 RR, 10 SP 45.2 11.8 2.8 ↓ FPC, ↓ FSG, ↓ FSB Prinster40 128 RR 36.1 10.1 2.8 ↓ VSG y ↓ VSB regionales ↑ LCR 84 Gordon-Lipkin 38 LB-Seguimiento RR/SP/PP - SG en reg. corticales superiores - N.S. en SB ∆ FSG, ↔ FSB RR≠SP≠PP en regiones SG 3 años: ↓ vol. Córtex SG frontal lateral y parietal bilateralmente En la primera parte se recoge el número de pacientes y el curso clínico, la edad y duración de la enfermedad y la puntuación media obtenida en la EDSS. En la segunda parte se resumen los resultados obtenidos en el contraste entre pacientes y controles, los resultados del estudio de seguimiento, si lo hubo, y las posibles diferencias entre grupos con diferente curso clínico. AC: atrofia central; F_LCR: fracción de líquido cefalorraquídeo; FPC: fracción parénquima cerebral; FSB: fracción sustancia blanca; FSG: fracción sustancia gris; LCR: líquido cefalorraquídeo; SB: sustancia blanca; SCA: síntomas clínicamente aislados que sugieren un diagnóstico de EM; SG: sustancia gris; VCG: volumen cerebral global; VCG: volumen cerebral total; VCN: volumen cerebral normalizado; VCoN: volumen cortical normalizado; VSB: volumen sustancia blanca; VSG: volumen sustancia gris; VV: volumen ventricular. ↓: decremento significativo; ↔: diferencia no significativa; ↑: incremento significativo; ∆: cambio, tasa de pérdida. N.S.: no significativa. La Tabla II recoge un resumen de las principales investigaciones y resultados en este campo. En la mayoría de los estudios que han analizado estas relaciones, se observa que el volumen cerebral global (fracción de parénquima cerebral) correlaciona negativa y significativamente con el volumen de lesiones medido en imágenes potenciadas en T219, 30, 88, 95, 97 y con el volumen de lesiones en T114, 19, 27, 30, 96, 97. Otros estudios han analizado estas relaciones entre atrofia y cantidad de lesión con diseños longitudinales42, 44, 88, 96, 97, lo que permite estudiar predictores del desarrollo de la atrofia cerebral y entender mejor el sustrato patológico de estos cambios. Algunos estudios informan que el volumen de lesión en T2 es un débil predictor del desarrollo de la atrofia cerebral después de 3 meses88 y dos años97 en pacientes con EM-RR. Otros, sin embargo, informan de correlaciones significativas entre cantidad de lesión en las exploraciones iniciales, o cambio en el volumen de lesión, y el desarrollo progresivo de atrofia cerebral en pacientes con EM-RR, a los 5 años42 y en seguimiento de 8 años96, así como en pacientes con síndromes clínicamente aislados durante 3 años44. Por otra parte, algunos autores han encontrado REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 19 Revisión Resumen de estudios que informan de relaciones entre medidas de atrofia cerebral y carga lesional y/o discapacidad funcional Tabla II 1er autorreferencia 13 Resultados Edad 37.8 44.7 30.2 34.9 3.8 3.8 1.6 2 35.9 6.1 2.3 39.8 6.4 2.0 Ratio bicaudado ↓ FPC, ↑ FV Chard19 27 RR, 9 SP 6 RR, 6SP, 9PP, 5 benignos 53 RR 30 RR 30 RR 106 RR 42 RR, 18 SP 42 RR, 21 SP, 20 PP 26 RR Duración EDSS EM 3.3 2.5 13.0 4.75 36.1 1.8 1.0 ↓ FPC, ↓ FSG, ↓ FSB De Stefano20 De Stefano28 Kassubek21 Bermel27 Quarantelli35 20 RR 65 RR, 25 PP 33 RR 60 RR, 18 SP 50 RR 37 38 34.9 42.5 35.6 4.5 7.5 4.6 11.8 9.9 2.0 1.9 2.4 3.4 2.5 ↓ VCoN ↓ VCoN (RR y PP) ↓ FPC ↓ FPC ↓ FSG, ↔ FSB, ↑ F_LCR Hardmeier88 Caon59 138 RR 38.5 163 RR, 27 SP 7.6 3.5 Dalton44 58 SCA Ge12 Fox13 Zivadinov89 Ge41 Pelletier73 Fisher96 Bermel53 Kalkers26 20 Características de los pacientes con EM Tipo EM Vs. Normales ↓ FPC, ↑ LCR ↓ VCG, ↑ VV ↓ FSG, ↓ FSB ↓ CC Lesión T2 Discapacidad N.S. PVC (en SP) N.S. FSG CC FPC, ∆FPC FPC, ∆ FPC FSG, FSG, FSB (N.S.) FSB (N.S.) N.S. N.S. VCoN (RR) FPC N.S. FSG, F_LCR, FSB (ns) FPC ∆ VPC N.S. CC FPC, ∆ FPC N.S. N.S. N.S. VCoN FPC FPC, ATV NS. Ratio intercaudado 17-50 Sastre-Garriga37 43 PP Chard14 13 RR 38.5 36.4 3.32 1.9 1 (EM) 4.5 1.0 Valsasina92 117 RR 33.8 8.3 2.3 Tiberio22 21 RR 37.54 2.1 1.0 Sanfilipo30 35 RR, 6 SP 39.8 9.5 3.2 Tedeschi32 427 RR, 140 SP, 30 PP 38.1 9.73 2.9 ∆ FPC ↓ VSG, ↓ VSB ↑∆ SG, ↔∆ SB ↓ FPC, ↓ FSG, ↓ FSB, ↑∆ SG, ↔∆ SB ↓ FPC, ↓ VSG, ↓ VSB, ↓ FSG, ↓ FSB ↓ FPC, ↓ FSG, ↓ FSB que es el volumen de sustancia gris, más que el volumen de sustancia blanca, el que correlaciona negativa y significativamente con el volumen de lesión en T2 o T119, 30, 32, 35, 41, 42, 88, 92, sugiriendo que sólo la reducción de la sustancia gris puede ser explicada por variaciones en la cantidad de lesión, mientras que la atrofia en la sustancia blanca es parcialmente independiente de la génesis de las lesiones. Este resultado se ha encontrado en pacientes con un curso RR19, 35, 41, 42, 88, 92 , SP30, 32 y en pacientes con síndromes clínicamente aislados sugestivos de EM44. En estos estudios, la correlación entre el volumen de sustancia blanca fue siempre más débil que la correlación con el volumen de sustancia gris, y a menudo por debajo de la significación estadística. Esta relación entre volumen REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Correlación de atrofia cerebral con: Lesión T1 ∆ FPC ∆VSG, ∆VSB FSG, FSB (ns) FSG, FSG FSB (ns) FSB (ns) FSG, FSG, N.S. ↓ FSB (ns) ↓ FSB (ns) FSG, FSB NS. FSG, FSB FSG de sustancia gris y cantidad de lesión también ha sido informada para algunas estructuras de sustancia gris, como el volumen del tálamo en pacientes con diferentes cursos clínicos de la EM62, o el volumen de sustancia gris neocortical para una submuestra de pacientes con EM-RR28. Según De Stefano et al.28, esta relación no parece darse en todas las formas clínicas, pues no se observó en una submuestra de pacientes con un curso PP. Otros estudios han analizado las relaciones entre atrofia de sustancia gris y cantidad de lesión con diseños longitudinales, revelando que los cambios en el volumen de sustancia gris son pobremente predecibles por la cantidad de lesión que presentan los pacientes en la línea base14, 44, 91, 92. Por ejemplo, en un estudio de seguimiento de 117 Nº 15 - Septiembre de 2010 María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal Tabla II 1er autorreferencia (Continuación) Características de los pacientes con EM Tipo Edad Audoin76 21 RR Prinster84 Horakova42 Ceccarelli78 Resultados EM Vs. Normales 36 Duración EDSS EM 2.2 1 51 RR 38.6 13.1 2.6 30.7 36.3 45 50.2 30.7 51.5 5.5 9 17.6 8.5 0.0 Battaglini83 147 RR 26 RR 27 SP 18 PP 28 SCA 29 SCA 33 RR 11 SP 59 RR 35 1.8 1.8 1.0 6.0 5.5 0.0 1.5 2.5 6.5 1.5 ↓ VSG (córtex temporofrontal izq. y precuneos, giro cingulado ant., caudado bilateral, área postcentral derecho. ↔ FSG, ↓ FSB SCA Vs. MS: ↓ VSG en giro pre y post central derecho Ceccarelli79 18 PP 49.6 10.7 5.5 Stosic34 Prinster40 39 RR, 10 SP 128 RR 45.2 36.1 11.8 10.1 2.8 2.8 Anderson68 Correlación de atrofia cerebral con: Lesión T1 Lesión T2 ∆ AT ↔ SG regional ↓ FSG cerebelar (RR y SP) ↓ FSB cerebelar (SP) ↓ SG volumen cortical ↓ VSG (tálamo, ínsula derecha) ↓ FPC, ↓ FSG, ↓ FSB ↓ VSG regional ↓ VSB regional Discapacidad Atrofia SG N.S. (cabeza núcleo caudado derecho) ∆ FPC, ∆ FSG SG regional N.S. y lesión T2 regional (SP y PP) FSG cerebelar con disfunción cerebelar ∆ SG regional N.S. FSG y FSB totales y regionales, LCR LCR FSB FSG bilateral en córtex sensorimotor En la primera parte se recoge el número de pacientes y el curso clínico, edad, duración de la enfermedad y la puntuación en la EDSS. En la segunda parte se resumen los resultados obtenidos en el contraste entre pacientes y controles. En la tercera parte se señalan las medidas de atrofia relacionadas con la carga lesional (en T1 o T2) y con la discapacidad física. AC: atrofia central; AT: atrofia talámica; ATV: ancho tercer ventrículo; CC: cuerpo calloso; F_LCR: fracción de líquido cefalorraquídeo; FPC: fracción parénquima cerebral; FSB: fracción sustancia blanca; FSG: fracción sustancia gris; LCR: líquido cefalorraquídeo; PVC: porcentaje volumen cerebral; SB: sustancia blanca; SCA: síntomas clínicamente aislados que sugieren un diagnóstico de EM; SG: sustancia gris; VCG: volumen cerebral global; VCG: volumen cerebral total; VCN: volumen cerebral normalizado; VCoN: volumen cortical normalizado; VPC: volumen parénquima cerebral; VSB: volumen sustancia blanca; VSG: volumen sustancia gris; VV: volumen ventricular. ↓: decremento significativo; ↔: diferencia no significativa; ↑: incremento significativo; ∆: cambio, tasa de pérdida. N.S.: no significativa. pacientes con EM-RR, el cambio en el volumen de sustancia gris durante 18 meses no estuvo correlacionado con el volumen de lesión en T2 o T1 al inicio del estudio92. En otros estudios se ha buscado determinar si la relación entre cantidad de lesión y atrofia cortical es la misma para todas las regiones corticales. En un estudio con 20 EM con curso RR y SP, los pacientes con una cantidad de lesión en T2 alta (>20 cm3), presentaron un adelgazamiento significativo en el área motora, mientras que los pacientes con una cantidad de lesión en T1 alta (>3 cm3) lo presentaron en las áreas corticales en regiones temporales y frontales y en el córtex motor16. Por su parte, Cha- ril et al.98, correlacionaron cantidad de lesión total en sustancia blanca con grosor cortical total en 425 pacientes con EM-RR. Informaron que la mayoría de las correlaciones significativas fueron observadas para el giro cingulado anterior bilateral, la ínsula, el giro temporal transversal y áreas de asociación del córtex prefrontal, temporal y parietal. Las áreas primarias sensoriales, visuales y motoras mostraron relaciones menos significativas con la cantidad de lesión total. Los autores concluyeron que, dado que la densidad de las lesiones fue particularmente alta en la sustancia blanca periventricular, éstas pueden interrumpir tractos que se originan desde o proyectan hacia áreas cinguladas y de asociación (regiones al- REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 21 Revisión tamente interconectadas con otras áreas corticales y subcorticales), lo que explicaría por qué estas áreas corticales son más vulnerables a la atrofia en EM. La predilección de los procesos atróficos por áreas que están fuertemente interconectadas con otras regiones cerebrales sugiere, según los autores, que la interrupción de tractos de sustancia blanca por las placas de la EM contribuye, al menos en parte, al desarrollo de la atrofia cortical. Si la atrofia cortical es el resultado de la interrupción axonal por las lesiones en la sustancia blanca, entonces las regiones altamente conectadas deberían ser más vulnerables que las regiones con relativamente menos conexiones. Sin embargo, también apuntan los autores que es posible que estas regiones de sustancia gris sean, de algún modo, intrínsecamente más vulnerables a la implicación directa de la enfermedad, pudiendo la atrofia en la sustancia gris ser explicada por un proceso distinto a la degeneración retrógrada o anterógrada debida a las lesiones en la sustancia blanca. En este sentido, algunos apuntan a las lesiones focales y difusas en la sustancia gris como las responsables, parcial e independientemente, de la atrofia en la sustancia gris. Las lesiones corticales explican más varianza en la atrofia cerebral que las lesiones en sustancia blanca99. Recientemente, se han desarrollado nuevas técnicas de RM para mejorar la detección de las lesiones corticales en la EM100, 101 y pueden ayudar a aclarar estas relaciones. 13 ❑ Atrofia y nivel de discapacidad física 22 La correlación entre las lesiones en la sustancia blanca con la discapacidad funcional del paciente con EM, medida con la EDSS3, es débil o moderada102. En este sentido, se ha estudiado si otros indicadores de daño cerebral, entre los que destaca la atrofia global o regional, pueden predecir la discapacidad que presentan los pacientes de una forma más exacta que las lesiones en sustancia blanca. También se ha desarrollado otra escala más reducida, la Multiple Sclerosis Functional Composite (MSFC)4, en el intento de encontrar un instrumento que mejore las correlaciones con las medidas de lesión y atrofia cerebral en la EM. En la Tabla II se presenta un resumen de los estudios y resultados más relevantes sobre la relación entre atrofia y discapacidad. En estudios transversales, se ha informado de correlaciones entre atrofia cerebral y las puntuaciones obtenidas en la EDSS9, 11, 12, 21, 27, 29, 51, 58, 59, 65, 67, 72, 103 y la duración de la enfermedad11, 12, 21, 27, 29, 30, 58, 67, 72, 88, en el sentido que una mayor atrofia se asocia a mayores niveles de disfunción y mayor duración de la enfermedad. Además, Fisher et al.96, estudiando a un grupo de 106 pacientes con EM-RR, encontraron que el camREVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE bio en fracción de parénquima cerebral entre el año 2 y el año 8 del seguimiento estuvo negativamente correlacionado con los cambios en la EDSS y MSFC en el mismo período. Algunos autores consideran que las relaciones entre atrofia global y la discapacidad son esencialmente debidas a la atrofia de la sustancia gris. De Stefano et al.28 estudiaron pacientes con EMRR o PP y encontraron que, en la línea base, el volumen neocortical correlacionó con las puntuaciones en la EDSS. Sanfilipo et al.30 demostraron que la atrofia de sustancia gris correlacionó mejor con la discapacidad neurológica que la atrofia en la sustancia blanca o el volumen de lesión en T1 y T2. Algunos estudios encuentran que la progresión de la atrofia cerebral correlaciona con un empeoramiento de la discapacidad física de los pacientes evaluada a través de la EDSS89, especialmente en las formas secundariamente progresivas10, 12 y primariamente progresivas10. Sin embargo, muchos estudios transversales o longitudinales no han encontrado correlaciones significativas entre atrofia cerebral global y nivel de discapacidad clínica13, 19, 22, 23, 26, 35, 41. Las causas de estos resultados negativos pueden ser varias. Algunos de estos estudios incluyeron pacientes con leve discapacidad, lo que reduce la varianza en las puntuaciones obtenidas en discapacidad, limitando el potencial para detectar correlaciones significativas19, 22, 26. Por otra parte, la heterogeneidad del grupo de pacientes con EM y un seguimiento muy corto podría explicar también la ausencia de correlaciones significativas13. Además, algunos autores han señalado que la puntuación en la EDSS tendría que asociarse mejor con la atrofia de la médula espinal, por las alteraciones motoras presentes en los pacientes con EM con enfermedad avanzada23. En este sentido, se ha encontrado que la escala alternativa a la EDSS, la MSFC, mejora la correlación con la atrofia cerebral104. La MSFC incluye un índice de alteración cognitiva, por lo que se sugiere que la atrofia en la EM podría estar relacionada no sólo con la discapacidad física, sino también con los déficit cognitivos. Un grupo de estudios se han centrado en las relaciones entre discapacidad clínica y atrofia cerebral regional. En un análisis longitudinal con pacientes recientemente diagnosticados de EM, se demostró que un empeoramiento en la EDSS estuvo significativamente correlacionado con la atrofia en regiones periventriculares y regiones neocorticales en áreas parietales, temporales y occipitales105. Locatelli et al.106 midieron la fracción de parénquima cerebral para cada lóbulo y encontraron que la atrofia de los lóbulos frontales estuvo asociada con la puntuación en la EDSS en pacientes con EM-RR. En otro estudio que incluyó también pacientes con EM-SP, la relación con la EDSS se observó para el giro frontal superior Nº 15 - Septiembre de 2010 María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal y el córtex temporal107. Chen et al.108 informaron que la progresión en la discapacidad después de un año observada en 10 de sus pacientes (RR y SP) estuvo asociada con una tasa de adelgazamiento de sustancia gris mayor en el giro precentral y áreas parietales, en comparación con 20 pacientes estables. Por su parte, Charil et al.98 encontraron que la reducción en el grosor cortical que correlacionó con la discapacidad fue especialmente prominente en regiones prefrontales bilaterales y regiones del cingulado anterior. Sailer et al.16 dividieron a sus pacientes en tres grupos de acuerdo a sus puntuaciones en la EDSS. Encontraron que los pacientes con mayor discapacidad (EDSS ≥6; n=6) presentaron regiones adicionales de atrofia localizadas en el área motora, comparados con pacientes con una puntuación en la EDSS más baja. Además, informaron que una duración de la enfermedad mayor estuvo asociada con atrofia adicional en las mismas regiones y encontraron una fuerte correlación entre la EDSS y el área específica del córtex motor (r=-0,69). ❑ Atrofia cerebral y alteraciones neuropsicológicas Entre el 40-60% de los afectados por EM presenta trastornos cognitivos, siendo los más frecuentes las alteraciones de la atención, memoria y velocidad de procesamiento de la información109, 110. La mayoría de los estudios que tienen por objetivo determinar los predictores de la disfunción cognitiva en EM se han centrado en medidas de RM como indicadores de implicación neuropatológica (ver Tabla III para un resumen de estudios y resultados). Por lo que respecta a los estudios que relacionan el rendimiento neuropsicológico con índices de patología cerebral en neuroimagen, las correlaciones obtenidas son razonablemente mejores que las observadas entre las variables de neuroimagen y las variables clínicas111-114, aunque por diversos motivos los resultados no son siempre coincidentes. En general, el grado de correlación entre los parámetros de lesión en la sustancia blanca y la alteración cognitiva es modesta, si la hay115, 116, mientras que las medidas de atrofia cerebral correlacionan en mayor grado con la alteración cognitiva31, 55, 117, 121. El primer estudio en el que se relacionan medidas de disfunción cognitiva con cambios morfológicos en estructuras cerebrales es el de Rao et al.122. Los autores, utilizando imágenes obtenidas mediante tomografía computerizada (TC), encontraron correlaciones significativas entre diferentes medidas de dilatación ventricular (Span bifrontal, ancho del ventrículo lateral en la región del caudado y ancho máximo del tercer ventrículo) y rendimiento cognitivo (memoria y razonamiento conceptual), en pacientes con EM crónicos progresivos, siendo el ancho del tercer ventrículo el mejor predictor de dicha afectación cognitiva. Estudios posteriores, con imágenes de RM, confirmaron la relación entre la dilatación ventricular y la alteración cognitiva. Berg et al.51, en una muestra heterogénea de pacientes con EM, encontraron correlaciones significativas entre el diámetro del III ventrículo y la mayoría de las pruebas incluidas en la BRB-N (del inglés, Brief Repeatable Battery of Neuropsychologycal Test). Por su parte, Benedict et al.107, 123, 124 encuentran una asociación significativa entre el ancho del tercer ventrículo y medidas neuropsicológicas de memoria verbal y espacial, así como de atención y velocidad de procesamiento (aprendizajes de material verbal y espacial, PASAT, SDMT). Similares resultados ha obtenido nuestro grupo de investigación en pacientes con EM- RR y leve afectación neurológica. El ancho del III ventrículo fue el mejor predictor de la presencia de una alteración cognitiva global o de alteraciones en dominios cognitivos específicos, concretamente, en atención y velocidad de procesamiento y en aprendizaje verbal 55. Otros estudios han confirmado la relación entre dilatación del tercer ventrículo y tareas de memoria verbal (aprendizaje de una lista de 14 palabras)125, y entre ancho del tercer ventrículo y memoria verbal, visual, atención y velocidad de procesamiento y capacidad intelectual126. En otro estudio, Bermel et al.53 midieron la dilatación de las astas frontales con otro parámetro de RM (distancia mínima entre los núcleos caudados dividida por el ancho cerebral a la misma altura), y encontraron que esta medida correlacionaba inversamente con el rendimiento en una prueba de atención y velocidad de procesamiento (SDMT). Con una muestra de 123 pacientes con EM-RR, Clark et al.127 observaron correlaciones significativas entre distintas medidas de dilatación ventricular y el rendimiento en distintas tareas cognitivas (Trail Making Test, parte A y B, y tarea de memoria). Además, el nivel de discapacidad física, que fue leve en toda la muestra, correlacionó de forma significativa con el área del tercer ventrículo. En general, estos resultados se han interpretado como indicativos de que la dilatación ventricular refleja los diferentes cambios patológicos que se producen en la región periventricular, como, por ejemplo, la pérdida de sustancia blanca profunda53, con el consiguiente efecto sobre las conexiones corticales - subcorticales122,128, o la atrofia de estructuras profundas, como el tálamo o estructuras límbicas. En otros estudios, se ha valorado la atrofia cerebral de una forma más directa, utilizando estimaciones o medidas volumétricas del tejido cerebral. Aunque los resultados encontrados en estos estudios REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 23 Revisión Tabla III 1er autorreferencia Rao111 13 Clark127 Swirsky-Sacchetti113 Tsolaki125 Barkhof71 Camp132 Berg51 Edwards25 Zivadinov89 Benedict107 24 Resumen de estudios que informan de relaciones entre atrofia cerebral y cognición en la EM Características de los pacientes con EM Tipo Edad Duración EDSS EM (años) 21 RR, 10 CP, 21 CE, 43.9 12.2 3.8 1 benigno 123 RR 36.2 5.0 2.1 16 CP, 24 RR 39.9 6.5 4.7 22 EM (RR y CP) 14 RR 43 PP, 20 TP 34 RR, 32 SP, 8 PP 21 RR, 20 SP 53 RR 21 progresivos, 14 RR Correlación de atrofia cerebral con estado cognitivo o variables cognitivas SCC: medidas VP y resolución rápida de problemas Dilatación ventricular: TMT (A y B) y tarea de memoria SCC: alteración cognitiva global 36.2 32 48.6 42 36.5 30.2 5.8 4.5 10.9 9.4 8.7 3.8 3.2 2.7 5.7 5.5 3.6 1.6 3 (moda) Bermel53 42 RR, 18 SP Christodoulou118 22 RR, 15 SP Benedict123 13 RR, 24 SP 4 44.2 41.8 10.6 11.2 3.7 3.8 2.5 Amato135 41 RR 35.1 4.0 1.5 Benedict74 26 RR, 5 SP 41.8 10.1 2.5 Lazeron134 Benedict124 31 RR, 33 SP, 18 PP 77 RR, 42 SP 47 44.6 15.3 12.2 4 3.5 Sanfilipo31 34 RR, 6S P 42.4 11.2 3.3 Lazeron133 11 RR, 13 SP, 8 PP 48.2 12.2 4.0 Hildebrandt129 45 RR 38.9 5.02 2.6 no son del todo coincidentes, en general, se han obtenido evidencias de relación entre las diferentes medidas de atrofia (volumen de tejido cerebral global, de sustancia gris o sustancia blanca, volúmenes lobares, etc.) y la alteración cognitiva en pacientes con EM. En ocasiones, los estudios han tenido el objetivo de estudiar la relación diferencial entre algunos de estos parámetros y el rendimiento cognitivo, como es el caso del interés por encontrar la contribución relativa de medidas de atrofia cerebral global y medidas de atrofia centralpor ej., 123, 129, o las diferencias entre las correlaciones entre medidas de atrofia cerebral y cantidad de lesión con el rendimiento cognitivo, siendo más fuertes las encontradas con la atrofia cerebral123, 130. Otros grupos han centrado sus investigaciones en el estudio de la contribución diferencial de la atrofia de sustancia gris y REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE DTV: aprendizaje verbal SCC: alteración en la transferencia interhemisférica VC: índice de alteración cognitiva global DTV VC, VCC, VSBsuprat: alteración cognitiva global Menor FPC en pacientes que empeoran cognitivamente Atrofia cerebral en lób. frontales sup. bilateralmente: alteraciones en aprendizaje verbal y espacial, atención y razonamiento conceptual (controlando la influencia de la cantidad de lesión o la atrofia central) RBC: SDMT AC: mayoría pruebas neuropsicológicas ATV: memoria verbal y visual, PASAT, SDMT FPC: memoria visual, PASAT y SDMT VCN: pobre rendimiento en tests de memoria verbal, atención/concentración y fluidez verbal Atrofia frontal: consistencia del aprendizaje Atrofia temporal: memoria Atrofia general o AC: tareas VP VC: fluidez semántica VCN: todas las medidas neuropsicológicas ATV: predictor alteración cognitiva VSG: memoria verbal VSB: velocidad de procesamiento y memoria de trabajo FPC: todos los dominios excepto para el procesamiento visoespacial FV: rendimiento en memoria de sustancia blanca como predictores de alteración cognitiva en la EMpor ej., 82, 131. Camp et al.132 midieron volumen cerebral en 3 cortes consecutivos de RM en pacientes con un curso primariamente progresivo o transicional progresivo y encontraron que correlacionaba, de forma moderada, con un índice de alteración cognitiva global, calculado a partir de tests de memoria, atención, fluidez verbal y razonamiento. En el trabajo de Zivadinov et al.117, los pacientes que presentaban deterioro cognitivo, pero con relativamente poco tiempo de evolución de la enfermedad y un bajo índice de discapacidad física, presentaban una fracción de parénquima cerebral menor que los no deteriorados. Christodoulou et al.118, utilizando una medida de atrofia cerebral central (porcentaje área ventricular central respecto al volumen intracraneal total), encontraron que este pa- Nº 15 - Septiembre de 2010 María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal (Continuación) Tabla III 1 autor Portaccio136 Características de los pacientes con EM Edad Duración EDSS EM (años) 41 RR 35.1 4.0 1.5 Gioia131 28 RR 30.1 3.7 1.5 Amato137 Morgen82,146 Seguimiento: 28 RR 19 RR 37.1 32.4 7.3 1.1 1.8 1.0 Tekok-Kilic148 Sánchez55 38 RR, 18 SP, 3 RP 52 RR 44.7 31.6 11.1 6.23 2.5 2.05 Sicotte64 23 RR, 11 SP 45.5 3.5 3.5 Summers121 30 RR 41.5 7.3 3.0 Benedict139 35 RR, 15 SP 45.8 11.5 3.0 Mineev130 Calabrese138 Sastre-Garriga147 Tiemann126 65 RR 70 RR 2 PP, 3 RR, 10 SP 37 34.8 50.7 7.5 8.4 14.4 4.0 2.4 6.0 4 meses 6.3 1 2.3 er referencia Audoin15 Calabrese149 Tipo 25 RR, 6 progresivos, 35.43 6 diagnósticos recientes 62 CIS 29 100 RR 34.2 Correlación de atrofia cerebral con estado cognitivo o variables cognitivas VCN: memoria verbal, fluencia verbal y atención/ concentración FPC, VSG, VSB (tendencia) ∆ VCN: rendimiento en test fluencia verbal VSG global y regional (córtex prefrontal bilateral, giro precentral y córtex parietal superior y cerebelo derecho): PASAT FPC y ATV: predictores independientes ATV: rendimiento en índice cognitivo global, atención y VP, aprendizaje verbal, programación y coordinación motora SCC: disfunción memoria visual ∆ VH: rendimiento alterado en aprendizaje de pares asociados ∆ VC (primer año): rendimiento cognitivo global y en memoria y atención/VP SGP: recuerdo libre o nuevo aprendizaje ATM: memoria por reconocimiento SGP (tálamo) correlaciona con SDMT VC: alteración cognitiva VCN, VSGNN FSG: rendimiento en PASAT FPC, FSB y VCN: rendimiento en memoria verbal (AVLT) ATV: asociado con 20 variables cognitivas (memoria verbal y visual, funciones visoconstructivas y ejecutivas) N.S. (Atrofia regional en SG) ACreg: memoria verbal y visual, atención y VP, memoria de trabajo, fluencia verbal AC: atrofia central; ACreg: adelgazamiento cortical regional; ATM: atrofia temporal mesial; ATV: ancho tercer ventrículo; DTV: dilatación tercer ventrículo; FPC: fracción parénquima cerebral; FSB: fracción sustancia blanca; FSG: fracción sustancia gris; FV: fracción ventricular; PASAT: Paced Auditory Serial Addition Test; RBC: ratio bicaudado; SCC: superficie cuerpo calloso; SDMT: Symbol Digit Modalities Test; SGP: sustancia gris profunda; TMT: Trail Making Test; VC: volumen cerebral; VCC: volumen cuerpo calloso; VCN: volumen cerebral normalizado; VH: volumen hipocampo; VP: velocidad de procesamiento de la información; VSB: volumen sustancia blanca; VSBsuprat: volumen sustancia blanca supratentorial; VSG: volumen sustancia gris; VSGNN: volumen sustancia gris neocortical normalizado. ∆: cambio, tasa de pérdida. rámetro de RM era el que mejor correlacionaba con el rendimiento cognitivo evaluado con una versión modificada de la BRB-N. Este parámetro de atrofia correlacionó significativamente con todas las pruebas incluidas en esta versión de la BRB-N, excepto con algunos índices de la prueba de aprendizaje y memoria verbal (Selective Reminding Test, SRT). Además, correlacionó con la ejecución en la Torre de Hanoi, una prueba de planificación y aprendizaje procedimental118. Hildebrandt et al.129 utilizaron dos marcadores de atrofia cerebral, fracción de parénquima cerebral y fracción ventricular, para estudiar una muestra de EM-RR. Sólo la medida de atrofia ventricular correlacionó con las variables cognitivas (tarea de aprendizaje y memoria verbal). Mineev et al.130, en una muestra de 65 pacientes con EM-RR, encuentran que la alteración cognitiva depende tanto del volu- men de lesiones focales como de la severidad de los procesos atróficos. Estos autores encontraron correlaciones significativas entre el volumen de parénquima cerebral normalizado y medidas de memoria a corto plazo, memoria de trabajo, atención y velocidad de procesamiento. Por su parte, el grupo de Lazeron133, usando un test para evaluar varios dominios de la atención, midieron la velocidad y la exactitud en el rendimiento de 32 pacientes con EM de diferentes cursos clínicos. Informaron que una mayor reducción en volumen cerebral estuvo significativamente asociada con una menor velocidad de procesamiento, pero no con una menor exactitud en el rendimiento de los pacientes con EM. Este mismo grupo, en un estudio anterior134, midió volumen cerebral relativo en un grupo también heterogéneo de pacientes, encontrando que este REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 25 Revisión 13 26 parámetro predecía el rendimiento en medidas de atención, memoria de trabajo, velocidad de procesamiento de la información, fluidez verbal semántica y aprendizaje y memoria verbal. Por su parte, Edwards et al.25 encontraron una significativa correlación entre un índice cognitivo general y la pérdida de volumen en sustancia blanca supratentorial y cuerpo calloso. El grupo de Benedict analizó cualitativamente la atrofia cortical regional. Evaluaron la atrofia de los surcos corticales en 6 regiones lobares en cada hemisferio; frontal inferior y superior, parietal superior e inferior, occipital y temporal en 35 pacientes con EM (RR y SP). El grado de atrofia fue valorado como normal, leve, moderado o severo, en relación al porcentaje de pérdida de volumen del parénquima en la región. Los autores encontraron que, aun controlando la influencia de la cantidad de lesión o la atrofia central, la atrofia cerebral bilateral en los lóbulos frontales superiores predecía las alteraciones en aprendizaje verbal y espacial, atención y razonamiento conceptual107. Posteriormente, este grupo comparó pacientes con EM (RR y SP) con voluntarios sanos emparejados. Midieron fracción de parénquima cerebral, encontrando que este parámetro predecía el rendimiento en medidas de atención, memoria de trabajo y velocidad de procesamiento de la información123. Locatelli et al.106, usando un diseño transversal, midieron fracción de parénquima cerebral regional para cada lóbulo en 39 pacientes con un curso RR y encontraron que el rendimeinto en el PASAT, una prueba que implica mantenimiento atencional, velocidad de procesamiento y memoria de trabajo, correlacionó con la atrofia en el neocórtex, especialmente atrofia de los lóbulos frontales. El grupo de Amato informa de menores volúmenes en neocorteza en un grupo de pacientes RR en estadios iniciales de la enfermedad que, atendiendo a los resultados en la BRB-N, se consideraron como cognitivamente alterados. De forma específica, la atrofia cortical correlacionaba de forma significativa con un pobre rendimiento en tests de memoria verbal, atención/concentración y fluidez verbal135, 136. En un estudio de seguimiento de 2 años y medio de los mismos pacientes, Amato et al.137 informaron que los cambios en el volumen cortical normalizado fueron significativamente más altos en los pacientes deteriorados cognitivamente que en los pacientes estables. Además, en los pacientes que se deterioraron cognitivamente, los cambios en volumen cortical normalizado correlacionaron negativa y significativamente con el rendimiento en un test de fluencia verbal. Por otra parte, Benedict et al.74 evaluaron la atrofia de los lóbulos en cada hemisferio, así como la atrofia general (fracción de parénquima cerebral) y atrofia central (volumen ventrículo lateral). Este REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE grupo de estudio analizó el poder predictivo de estos parámetros de RM sobre el rendimiento en pruebas de velocidad de procesamiento (PASAT y SDMT) y memoria (CVLT y Test de memoria visoespacial). Encontraron que la atrofia del lóbulo temporal explicó la mayor parte de la varianza del rendimiento en memoria, mientras que la atrofia general o central explicó el rendimiento en tareas que enfatizan la velocidad de procesamiento. La atrofia frontal contribuyó a la predicción de la consistencia del aprendizaje. Este mismo grupo, con una muestra de 82 pacientes con EM (RR y SP)124, encontró que el volumen neocortical estuvo significativamente asociado con muchas medidas neuropsicológicas (memoria verbal y espacial, velocidad de procesamiento y memoria de trabajo) con coeficientes de correlación entre 0,29 y 0,58. En este estudio, el ancho del III ventrículo, que se consideró como indicativo de atrofia talámica, fue también predictor de alteración cognitiva. Recientemente, Calabrese et al.138 informaron que tanto el volumen de lesiones corticales como el volumen de sustancia gris neocortical normalizado eran predictores independientes de la alteración cognitiva global. Los pacientes cognitivamente afectados se diferenciaron de los pacientes cognitivamente normales, tanto en el volumen cerebral normalizado como en el volumen de sustancia gris neocortical normalizado. Otro estudio de pacientes con distintas formas clínicas de EM informó de moderada a fuertes correlaciones entre atrofia talámica y alteración en varios dominios cognitivos, incluyendo velocidad de procesamiento y memoria visoespacial62. Por su parte, Sicotte et al.64 encontraron que la pérdida de volumen del hipocampo estaba asociada con peores rendimientos en un test de aprendizaje y memoria verbal. Benedict et al139 estudiaron la importancia relativa de estructuras del lóbulo temporal medial (hipocampo, amígdala) y estructuras de sustancia gris profunda (tálamo y caudado) en la predicción del rendimiento en tests de aprendizaje y memoria verbal y espacial139. Estos autores encontraron que ambos conjuntos de estructuras juegan un papel significativo, aunque diferente, en la predicción de las alteraciones de memoria presentes en los pacientes con EM. Para medidas de recuerdo libre o nuevos aprendizajes, el volumen de sustancia gris profunda fue mejor predictor, mientras que las medidas volumétricas de lóbulo temporal medial lo fueron para medidas de recuerdo demorado y reconocimiento. En un estudio reciente, Roosendaal et al.140 concluyen que la atrofia de hipocampo derecho encontrada en pacientes con EM (5 Síndromes aislados, 18 RR, 2 SP) precede a la aparición de alteración en pruebas de memoria espacial, un dominio cognitivo frecuentemente alterado en pacientes con EM141, 142. Asimismo, estos autores en- Nº 15 - Septiembre de 2010 María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal cuentran un significativo descenso en la conectividad funcional del hipocampo, incluyendo sus conexiones con el giro cingulado anterior, el tálamo y el córtex prefrontal, especialmente en aquellos pacientes con la atrofia hipocampal más pronunciada140. Para confirmar sus hipótesis sería necesario estudiar longitudinalmente a los pacientes para clarificar cómo los cambios en conectividad funcional y en atrofia se relacionan con el sistema de memoria hipocampal. Algunos estudios no han encontrado las esperadas correlaciones entre atrofia cerebral y rendimiento cognitivo143-145. En el estudio de Glanz et al.143, no encontraron diferencias significativas entre pacientes cognitivamente alterados y preservados en los parámetros de RM empleados (volumen lesión T2, volumen sustancia gris, fracción de parénquima cerebral y volumen de sustancia blanca de apariencia normal) en una muestra de pacientes con síndromes clínicamente aislados o EM recientemente diagnosticados. Estos autores lo atribuyen al hecho de que los pacientes presentan un daño en sustancia blanca muy bajo. Patti et al.144, en una muestra de 327 pacientes con EM- RR, encuentran que los pacientes con alteración cognitiva (20%) no se diferencian de los pacientes con preservación de la cognición en volumen cerebral, ni tampoco en volumen de sustancia gris o blanca. En este estudio, los predictores de la alteración cognitiva fueron el volumen de lesión en T2, el cociente intelectual, la puntuación en la EDSS y la edad de los pacientes. En el análisis de las correlaciones, algunas pruebas cognitivas concretas (fluidez verbal, test de Stroop, tarea de aprendizaje y memoria verbal) mostraron correlaciones significativas, aunque moderadas con los parámetros de atrofia cerebral estudiados. Por su parte, Ukonnen et al.145, en una muestra de pacientes con EM-PP, no encuentran correlaciones significativas entre el rendimiento cognitivo y atrofia cerebral. La alteración cognitiva en estos pacientes se asoció mejor con la lesión cerebral difusa y la cantidad de lesión en T1 y T2. A partir de estos estudios, podemos concluir que la alteración cognitiva en la EM estaría relacionada tanto con atrofia cortical como subcortical, y la heterogeneidad en los resultados indica que las estructuras subcorticales y el neocórtex no están implicadas en el rendimiento cognitivo de la misma manera. En este sentido, algunos autores se han interesado en estudiar la contribución diferencial de la atrofia de sustancia gris y sustancia blanca como predictores de alteración cognitiva en la EM. Por ejemplo, Gioia et al.131 encontraron que el volumen de sustancia gris y el volumen de parénquima cerebral era menor en los pacientes con curso RR con alteración cognitiva que en los pacientes cognitivamente preservados, mientras que no encontraron diferencias significativas en- tre los dos grupos en el volumen de sustancia blanca. En un estudio con un análisis voxel a voxel (VBM), Morgen et al.82, 146 encontraron que puntuaciones bajas en el PASAT en pacientes con EM-RR estuvieron asociadas con un volumen reducido del córtex prefrontal bilateral, precentral, parietal superior y cerebelar derecho, así como con el volumen de sustancia gris global. El volumen de sustancia blanca, sin embargo, no correlacionó de forma significativa con la alteración cognitiva de los pacientes. Estos resultados han sido confirmados recientemente en el estudio de una muestra de pacientes de cursos variados con alteración cognitiva147, en el que se obtienen correlaciones significativas entre la fracción de sustancia gris y el rendimiento en el PASAT. Sin embargo, estos autores encontraron que las fracciones de parénquima cerebral y de sustancia blanca estaban relacionadas con el rendimiento en una tarea de aprendizaje y memoria verbal. En otro estudio, con 40 pacientes con EM (RR y SP), se sugiere que la pérdida de volumen en sustancia blanca está más asociada con déficit en velocidad de procesamiento y memoria de trabajo, mientras que la pérdida de volumen en la sustancia gris lo está más con alteración en memoria verbal y alteraciones emocionales31. Recientemente, en un grupo de pacientes con síndromes clínicamente aislados con un alto riesgo de desarrollar una EM, que presentaron alteraciones cognitivas restringidas a velocidad de procesamiento y memoria de trabajo, no se observaron correlaciones entre estas alteraciones y la atrofia de sustancia gris15. Aunque en su estudio no incluyeron medidas de sustancia blanca, los autores hipotetizan que en las etapas iniciales de la EM, los déficit aislados en VP y memoria de trabajo en pacientes con síndromes clínicamente aislados o pacientes con EM inicial, estarían directamente relacionados con el estado de la sustancia blanca, mientras que después de algunos años, otras habilidades cognitivas, tales como la memoria verbal, pueden verse afectadas probablemente debido al deterioro de la sustancia gris. Tekok-Kilic et al.148 exploraron la asociación entre atrofia de sustancia gris regional y funciones neuropsicológicas, controlando la influencia de la dilatación del III ventrículo. Estos autores encontraron que la atrofia central y cortical, independientemente, fueron predictores significativos de la presencia de alteración en la velocidad de procesamiento y memoria en la EM. Recientemente, Calabrese et al.149 han valorado la atrofia cortical ampliando el número de regiones corticales analizadas y el tamaño de la muestra (N=100). Identifican dos patrones de adelgazamiento cortical, uno frontotemporal y otro extendido en pacientes con o sin alteración cognitiva. El adelgazamiento cortical frontotemporal bilateral significativo se observó en REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 27 Revisión 13 28 los pacientes con EM preservados cognitivamente comparados con los controles normales, mientras que en los pacientes con una alteración cognitiva leve, se observó un adelgazamiento cortical extendido, implicando casi todas las áreas corticales. Las lesiones situadas en el Cuerpo Calloso (CC) es otro de los hallazgos típicos en la EM69, 150. La atrofia del cuerpo calloso se ha asociado con alteraciones en la velocidad de procesamiento de la información151-153, con medidas de fluidez verbal154, con medidas de habilidad visoespacial155, aunque también se ha relacionado con la alteración cognitiva valorada globalmente25, 113, 128, 156, 157. Además, la atrofia del cuerpo calloso se ha asociado con alteraciones en la transferencia interhemisférica de la información evaluada con pruebas lateralizadas, estando parcialmente bloqueada o enlentecida en los pacientes con EM que presentan atrofia70, 71, 73, 151, 158, 159, con mayor afectación en aquellos pacientes que siguen un curso progresivo159. En otros estudios, aunque no se observaron signos de atrofia del cuerpo calloso, sí se produjeron alteraciones de la transmisión interhemisférica en una muestra de EM-RR con leve discapacidad160. Según Barkhof et al.71, la atrofia del esplenio del cuerpo calloso parece tener mayor importancia en la predicción de déficit en tareas de desconexión interhemisférica. Algunos estudios longitudinales han explorado la relación entre el perfil cognitivo y los parámetros de RM89, 95, 161, 168. Como veremos, los resultados encontrados no permiten extraer conclusiones firmes, por razones similares a las comentadas en los apartados anteriores. Añadiremos, además, las diferencias entre los estudios en el método elegido para cuantificar los parámetros de RM, así como los parámetros usados y el problema del reposicionamiento de las imágenes de RM en algunos estudios. Los primeros estudios longitudinales161-163 no encontraron evidencias robustas de la relación entre los cambios en el rendimiento en test neuropsicológicos y los cambios en RM a lo largo del seguimiento. En estas investigaciones se utilizaron muestras de pacientes con EM-RR y leve discapacidad que permanecieron relativamente estables después del seguimiento. Además, en todos estos estudios, las imágenes de RM fueron procesadas visualmente y puntuadas por observadores usando criterios según el tamaño y número de lesiones. Posteriores estudios han utilizado métodos cuantitativos para analizar la RM. Hohol et al.95 estudiaron una muestra heterogénea de pacientes, a los que administró la BRB y midieron el volumen de lesión total en imágenes de RM potenciadas en T2. Además, cuantificaron la atrofia cerebral (ratio de volumen entre cavidad intracraneal respecto al cerebro). Los autores no encontraron en el grupo toREVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE tal cambios en funciones cognitivas después de un año, sólo ligeras mejorías en pruebas de memoria. Únicamente, el volumen de lesión total después de un año correlacionó negativamente con el PASAT, especialmente en aquellos pacientes con un curso crónico. Cuatro pacientes empeoraron después de un año su puntuación en la BRB-N. Estos pacientes presentaron un incremento medio en volumen de lesión total significativamente mayor que aquellos pacientes cuyo perfil cognitivo mejoró o se mantuvo estable. En otro estudio longitudinal se analizó la relación de medidas de cantidad de lesión y medidas de atrofia cerebral con la alteración cognitiva, en un seguimiento de 2 años89. Este estudio incluyó en su muestra pacientes con una EM-RR con escasa duración de la enfermedad (1-5 años) y leve disfunción neurológica. Obtuvieron un índice cognitivo para cada paciente a partir de las puntuaciones en tests que miden atención, concentración y velocidad de procesamiento, memoria, razonamiento abstracto conceptual, habilidades visoperceptivas, inteligencia verbal y lenguaje. Este índice lo correlacionaron con el volumen lesional en T1, DP/T2 y el volumen de parénquima cerebral. Los autores demostraron que el deterioro cognitivo depende más del desarrollo de atrofia del parénquima cerebral que de la cantidad de lesión cerebral en T1 o T2. En concreto, 15 sujetos de su muestra empeoraron en los test neuropsicológicos, 33 permanecieron estables y 5 mejoraron. No se encontraron diferencias significativas entre los 3 grupos a los 2 años en medidas de cantidad de lesión, mientras que el volumen de parénquima cerebral disminuyó en los pacientes que habían empeorado. Además, la pérdida de parénquima cerebral correlacionó con el cambio en la EDSS. Otros estudios que valoran longitudinalmente la función cognitiva y los parámetros de RM sólo incluyen medidas de lesión166, 167. Piras et al.167 estudiaron 12 pacientes con EM-RR con leve discapacidad durante 8 años y medio. Encontraron relativa preservación cognitiva. Únicamente, se objetivó un empeoramiento significativo en el índice de deterioro (calculado a partir de algunos subtests del WAIS) y en memoria verbal tras demora, evaluada con el Selective Reminding Test. Sin embargo, no encuentran correlaciones significativas entre este cambio cognitivo y el aumento de lesiones en diferentes áreas cerebrales en RM, cuantificadas visualmente, lo cual atribuyen a que el déficit cognitivo en el seguimiento sea debido a lesiones no visibles en RM convencional. Sperling et al.166 estudiaron longitudinalmente la cantidad de lesión regional junto con la función cognitiva. Midieron el volumen de lesión Nº 15 - Septiembre de 2010 María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal total en DP, así como en 4 grandes regiones cerebrales: frontal, parietal, temporal y zona posterior y estudiaron la función cognitiva con la BRB-N, en el inicio, al año y a los 4 años de seguimiento. Los autores no objetivaron cambios significativos en el rendimiento cognitivo, únicamente una tendencia a empeorar en memoria verbal tras demora, evaluada también con el Selective Reminding Test, que correlacionó modestamente con cambio en volumen de lesión frontal y total. En cuanto al volumen de lesión total y por regiones, tampoco se objetivó un cambio significativo en el seguimiento. A pesar de esta relativa preservación cognitiva y de la carga lesional en RM, los autores informan que los volúmenes de lesión en sustancia blanca frontal y parietal estuvieron fuertemente asociados con tareas que requerían atención compleja sostenida (PASAT, SDMT) y memoria de trabajo con material verbal (SRT). Estas correlaciones significativas y negativas fueron evidentes en la línea base, al año y a los 4 años. Muchos de los pacientes incluidos en este estudio recibieron tratamiento con fármacos immunomoduladores en algún momento del seguimiento; sin embargo, únicamente se informa de resultados para la muestra completa. Más recientemente, Camp et al.168 estudiaron longitudinalmente la función cognitiva y varios parámetros de RM cerebral en 99 pacientes con curso primariamente progresivo. Cuantificaron la cantidad lesional en T2 y T1, así como una estimación de la atrofia cerebral en 6 cortes consecutivos. Estudiaron la función cognitiva con la BRB-N y un test de razonamiento espacial y verbal, en el inicio, al año y a los 2 años de seguimiento. Los autores no objetivaron cambios significativos en el seguimiento en el rendimiento cognitivo, únicamente algún cambio absoluto en algún test en un tercio de la muestra. En cuanto a los parámetros de RM, tampoco se objetivaron modificaciones significativas. A pesar de esta relativa preservación, los autores informan que el cambio en la cantidad de lesión hipointensa en T1 correlacionó significativamente con el observado en dos tareas atencionales (PASAT y SDMT). Summers et al.121 exploraron longitudinalmente a 30 pacientes con EM y curso RR con poca duración de la enfermedad. La tasa de progresión de la atrofia cerebral medida durante el primer año fue un buen predictor de alteración cognitiva 5 años después, controlando variables como la edad, género y años de educación. Finalmente, señalar el estudio de Pelletier et al.73, en el que se realiza un seguimiento focalizado en la atrofia del cuerpo calloso y la transmisión interhemisférica. Estos autores evaluaron la progresión de ambas en relación a la discapacidad física y evo- lución de las lesiones en RM durante un periodo de 5 años. Para ello, compararon 30 pacientes con EMRR, leve discapacidad y escasa duración de la enfermedad con sujetos controles sanos. Encontraron que los pacientes con EM empeoraron a los 5 años en la atrofia del cuerpo calloso, así como en la alteración funcional de transferencia interhemisférica. El número de lesiones en T2 correlacionó con la implicación callosa y esta relación persistió a los 5 años. ❑ Conclusiones En la EM se han utilizado prácticamente todos los procedimientos y medidas disponibles para valorar la posible presencia de atrofia cerebral. Los datos reunidos hasta el momento, aunque inconsistentes en algunos casos, ponen de manifiesto que en la EM se produce una pérdida significativa de tejido cerebral, siendo esta pérdida más prominente en los pacientes con curso secundariamente-progresivo. La atrofia cerebral no afecta sólo a la sustancia blanca, de hecho es difícil a veces apreciar pérdida de volumen en sustancia blanca, sino también a la sustancia gris. Los estudios regionales señalan que la atrofia cortical es difusa, aunque se observa una mayor afectación en la corteza frontal y temporal. Diversas estructuras subcorticales presentan también atrofia como, por ejemplo, el tálamo, ganglios basales y el hipocampo. Se ha observado también atrofia en el cuerpo calloso y el cerebelo. Hay abundantes datos a favor de una asociación entre el volumen de lesiones en sustancia blanca y la atrofia cerebral. Cuando se diferencia entre tipos de atrofia, algunos estudios informan que sólo la reducción de la sustancia gris puede ser explicada por variaciones en la cantidad de lesión; la atrofia en la sustancia blanca sería menos dependiente de la carga lesional. En general, una mayor atrofia se asocia con mayores niveles de discapacidad física, aunque abundan los resultados negativos. Desde el estudio pionero de Rao et al., la relación de la atrofia con el deterioro cognitivo se ha establecido a partir de medidas de dilatación ventricular y medidas directas de la pérdida de volumen cerebral global. Los dominios cognitivos que se han relacionado con la atrofia son la memoria de trabajo, atención y velocidad de procesamiento. Esta relación se observa también cuando se analiza la atrofia cortical, la atrofia talámica, hipocampal o del cuerpo calloso. Las numerosas evidencias disponibles actualmente señalan la importancia de la atrofia en la EM, lo que implicaría que éste debe ser un parámetro a tener en cuenta en los futuros ensayos clínicos de los pacientes con EM. Aun así, se necesitan más investigaciones para identificar la contribución relativa de la patología REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 29 Revisión de la sustancia blanca y la gris, sobre todo en las fases iniciales de la enfermedad, y qué regiones cerebrales son más sensibles a la atrofia. Así mismo permanece abierto el debate sobre si la distribución de las lesiones y de la atrofia regional podrían ser elementos crí- ticos para que aparezcan patrones específicos de déficit cognitivos. Dada la escasez de datos disponibles, se hace necesario también estudiar longitudinalmente la relación entre la evolución de la función cognitiva y de los parámetros de atrofia en la RM. 13 Bibliografía 30 1.- Paty DW, Oger JJ, Kastrukoff LF, Hashimoto SA, Hooge JP, Eisen AA, et al. MRI in the diagnosis of MS: a prospective study with comparison of clinical evaluation, evoked potentials, oligoclonal banding, and CT. Neurology 1988; 38 (2): 180-185. 2.- Rovira A. Resonancia Magnética en el diagnóstico y manejo de la esclerosis múltiple. Neurología 2000; 15 (7): 288-302. 3.- Kurtzke JF. Rating neurologic impairment in multiple scleroris: an expanded disability status scale (EDSS). Neurology (Cleveland) 1983; 33: 1444-1452. 4.- Rudick R, Antel J, Confavreux C, Cutter G, Ellison G, Fischer J, et al. Recommendations from the National Multiple Sclerosis Society Clinical Outcomes Assessment Task Force. Ann Neurol 1997; 42 (3): 379-382. 5.- Ferguson B, Matyszak MK, Esiri MM, Perry VH. Axonal damage in acute multiple sclerosis lesions. Brain 1997; 120 (Pt 3): 393-399. 6.- Fu L, Matthews PM, De Stefano N, Worsley KJ, Narayanan S, Francis GS, et al. Imaging axonal damage of normal-appearing white matter in multiple sclerosis. Brain 1998; 121 (Pt 1): 103-113. 7.- Prineas JW y Connell F. The fine structure of chronically active multiple sclerosis plaques. Neurology 1978; 28 (9 Pt 2): 68-75. 8.- Simon JH, Jacobs LD, Campion MK, Rudick RA, Cookfair DL, Herndon RM, et al. A longitudinal study of brain atrophy in relapsing multiple sclerosis. Neurology 1999; 53: 139-148. 9.- Liu C, Edwards S, Gong Q, Roberts N y Blumhardt LD. Three dimensional MRI estimates of brain and spinal cord atrophy in multiple sclerosis. J Neurol Neurosurg Psychiatr 1999; 66: 323-330. 10.- Losseff NA, Wang L, Lai HM, Yoo DS, Gawne-Cain ML, McDonald WI, et al. Progressive cerebral atrophy in Multiple Sclerosis. A serial MRI study. Brain 1996; 119: 2009-2019. 11.- Rudick RA, Fisher E, Lee J-C, Simon J, Jacobs L, y el Multiple Sclerosis Collaborative Research Group. Use of the brain parenchymal fraction to measure whole brain atrophy in relapsing-remitting Multiple Sclerosis. Neurology 1999; 53: 1698-1704. 12.- Ge Y, Grossman RI, Udupa JK, Wei L, Mannon LJ, Polansky M, et al. Brain Atrophy in Relapsing-Remitting Multiple Sclerosis and Secondary ProgresREVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE 13.- 14.- 15.- 16.- 17.- 18.- 19.- 20.- 21.- 22.- 23.- Nº 15 - Septiembre de 2010 sive Multiple Sclerosis: Longitudinal Quantitative Analysis. Radiology 2000; 214: 665-670. Fox NC, Jenkins R, Leary SM, Stevenson VL, Losseff NA, Crum WR, et al. Progressive cerebral atrophy in MS. A serial study using registered, volumetric MRI. Neurology 2000; 54: 807-812. Chard DT, Griffin CM, Rashid W, Davies GR, Altmann DR, Kapoor R, et al. Progressive grey matter atrophy in clinically early relapsing-remitting multiple sclerosis. Mult Scler 2004; 10 (4): 387-391. Audoin B, Zaaraoui W, Reuter F, Rico A, Malikova I, Confort-Gouny S, et al. Atrophy mainly affects the limbic system and the deep grey matter at the first stage of multiple sclerosis. J Neurol Neurosurg Psychiatry 2010; [Epub ahead of print]. Sailer M, Fischl B, Salat D, Tempelmann C, Schönfeld MA, Busa E, et al. Focal thinning of the cerebral cortex in multiple sclerosis. Brain 2003; 126 (Pt 8): 1734-1744. Sepulcre J, Sastre-Garriga J, Cercignani M, Ingle GT, Miller DH, Thompson AJ. Regional gray matter atrophy in early primary progressive multiple sclerosis: a voxel-based morphometry study. Arch Neurol 2006; 63 (8): 1175-1180. Pelletier D, Garrison K, Henry R. Measurement of whole-brain atrophy in multiple sclerosis. J Neuroimaging 2004; 14 (3 Suppl): 11S-19S. Chard DT, Griffin CM, Parker GJM, Kapoor R, Thompson AJ, Miller DH. Brain Atrophy in clinically early relapsing-remitting multiple sclerosis. Brain 2002; 125: 327-337. De Stefano N, Iannucci G, Sormani MP, Guidi L, Bartolozzi ML, Comi G, et al. MR correlates of cerebral atrophy in patients with multiple sclerosis. J Neurol 2002; 249 (8): 1072-1077. Kassubek J, Tumani H, Ecker D, Kurt A, Ludolph AC, Juengling FD. Age-related brain parenchymal fraction is significantly decreased in young multiple sclerosis patients: a quantitative MRI study. Neuroreport 2003; 14 (32): 427-430. Tiberio M, Chard DT, Altmann DR, Davies G, Griffin CM, Rashid W, et al. Gray and white matter volume changes in early RRMS: a 2-year longitudinal study. Neurology 2005; 64 (6): 1001-1007. Filippi M, Mastronardo G, Rocca MA, Pereira C, Comi G. Quantitative volumetric analysis of brain María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal 24.- 25.- 26.- 27.- 28.- 29.- 30.- 31.- 32.- 33.- 34.- magnetic resonance imaging from patients with multiple sclerosis. J Neurol Sci 1998; 158 (2): 148153. Phillips MD, Grossman RI, Miki Y, Wei L, Kolson DL, van Buchem MA, et al. Comparison of T2 Lesion Volume and Magnetization Transfer Ratio Histogram Analysis and of Atrophy and Measures of Lesion Burden in Patients with Multiple Sclerosis. AJNR Am J Neuroradiol 1998; 19: 1055-1060. Edwards SGM, Liu C y Blumhardt LD. Cognitive correlates of supratentorial atrophy on MRI in multiple sclerosis. Acta Neurol Scand 2001; 104: 214-223. Kalkers NF, Ameziane N, Bot JC, Minneboo A, Polman CH, Barkhof F. Longitudinal brain volume measurement in multiple sclerosis: rate of brain atrophy is independent of the disease subtype. Arch Neurol 2002; 59 (10): 1572-1576. Bermel RA, Sharma J, Tjoa CW, Puli SR, Bakshi R. A semiautomated measure of whole-brain atrophy in multiple sclerosis. J Neurol Sci 2003; 208: 57-65. De Stefano N, Matthews PM, Filippi M, Agosta F, De Luca M, Bartolozzi ML, et al. Evidence of early cortical atrophy in MS. Relevance to white matter changes and disability. Neurology 2003; 60: 11571162. Sharma J, Sanfilipo MP, Benedict RH, WeinstockGuttman B, Munschauer FE 3rd, Bakshi R. Wholebrain atrophy in multiple sclerosis measured by automated versus semiautomated MR imaging segmentation. AJNR Am J Neuroradiol 2004; 25 (6): 985-996. Sanfilipo MP, Benedict RH, Sharma J, WeinstockGuttman B, Bakshi R. The relationship between whole brain volume and disability in multiple sclerosis: a comparison of normalized gray vs. white matter with misclassification correction. Neuroimage 2005; 26 (4): 1068-1077. Sanfilipo MP, Benedict RH, Weinstock-Guttman B, Bakshi R. Gray and white matter brain atrophy and neuropsychological impairment in multiple sclerosis. Neurology 2006; 66: 685-692. Tedeschi G, Lavorgna L, Russo P, Prinster A, Dinacci D, Savettieri G, et al. Brain atrophy and lesion load in a large population of patients with multiple sclerosis. Neurology 2005; 65 (2): 280-285. Vrenken H, Geurts JJ, Knol DL, van Dijk LN, Dattola V, Jasperse B, et al. Whole-brain T1 mapping in multiple sclerosis: global changes of normal-appearing gray and white matter. Radiology 2006; 240 (3): 811-820. Stosic M, Ambrus J, Garg N, Weinstock-Guttman B, Ramanathan M, Kalman B, et al. MRI characteristics of patients with antiphospholipid syndrome and multiple sclerosis. J Neurol 2010; 257 (1): 6371. 35.- Quarantelli M, Ciarmiello A, Morra VB, Orefice G, Larobina M, Lanzillo R, et al. Brain tissue volume changes in relapsing-remitting multiple sclerosis: correlation with lesion load. Neuroimage 2003; 18 (2): 360-366. 36.- Inglese M, Ge Y, Filippi M, Falini A, Grossman RI, Gonen O. Indirect evidence for early widespread gray matter involvement in relapsing-remitting multiple sclerosis. Neuroimage 2004; 21 (4): 18251829. 37.- Sastre-Garriga J, Ingle GT, Chard DT, Ramió-Torrentà L, Miller DH, Thompson AJ. Grey and white matter atrophy in early clinical stages of primary progressive multiple sclerosis. Neuroimage 2004; 22 (1): 353-359. 38.- Gordon-Lipkin E, Chodkowski B, Reich DS, Smith SA, Pulicken M, Balcer LJ, Frohman EM, Cutter G, Calabresi PA. Retinal nerve fiber layer is associated with brain atrophy in multiple sclerosis. Neurology 2007; 69 (16): 1603-1609. 39.- Ceccarelli A, Rocca MA, Falini A, Tortorella P, Pagani E, Rodegher M, et al. Normal-appearing white and grey matter damage in MS. A volumetric and diffusion tensor MRI study at 3.0 Tesla. J Neurol 2007; 254 (4): 513-518. 40.- Prinster A, Quarantelli M, Lanzillo R, Orefice G, Vacca G, Carotenuto B, et al. A voxel-based morphometry study of disease severity correlates in relapsing-- remitting multiple sclerosis. Mult Scler 2010; 16 (1): 45-54. 41.- Ge Y, Grossman RI, Udupa JK, Babb JS, Nyúl LG, Kolson DL. Brain atrophy in relapsing-remitting multiple sclerosis: fractional volumetric analysis of gray matter and white matter. Radiology 2001; 220 (3): 606-610. 42.- Horakova D, Cox JL, Havrdova E, Hussein S, Dolezal O, Cookfair D, et al. Evolution of different MRI measures in patients with active relapsing-remitting multiple sclerosis over 2 and 5 years: a casecontrol study. J Neurol Neurosurg Psychiatry 2008; 79 (4): 407-414. 43.- Grassiot B, Desgranges B, Eustache F, Defer G. Quantification and clinical relevance of brain atrophy in multiple sclerosis: a review. J Neurol 2009; 256 (9): 1397-1412. 44.- Dalton CM, Chard DT, Davies GR, Miszkiel KA, Altmann DR, Fernando K, et al. Early development of multiple sclerosis is associated with progressive grey matter atrophy in patients presenting with clinically isolated syndromes. Brain 2004; 127 (Pt 5): 1101-1107. 45.- Simon JH. Brain atrophy in multiple sclerosis: what we know and would like to know. Multiple Sclerosis 2006; 12: 679-687. 46.- Wegner C, Esiri MM, Chance SA, Palace J, Matthews REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 31 Revisión 47.- 13 48.- 49.- 50.- 51.- 52.- 53.- 32 54.- 55.- 56.- 57.- 58.- PM. Neocortical neuronal, synaptic, and glial loss in multiple sclerosis. Neurology 2006; 67 (6): 960967. Bö L, Geurts JJ, van der Valk P, Polman C, Barkhof F. Lack of correlation between cortical demyelination and white matter pathologic changes in multiple sclerosis. Arch Neurol 2007; 64 (1): 76-80. Chard D, Miller D. Grey matter pathology in clinically early multiple sclerosis: evidence from magnetic resonance imaging. J Neurol Sci 2009; 282 (1-2): 5-11. Geurts JJ, Stys PK, Minagar A, Amor S, Zivadinov R. Gray matter pathology in (chronic) MS: modern views on an early observation. J Neurol Sci 2009; 282 (1-2): 12-20. Antulov R, Carone DA, Bruce J, Yella V, Dwyer MG, Tjoa CW, et al. Regionally Distinct White Matter Lesions Do Not Contribute to Regional Gray Matter Atrophy in Patients with Multiple Sclerosis. J Neuroimaging 2010. Berg D, Mäurer M, Warmuth-Metz M, Rieckmann P, Becker G. The correlation between Ventricular Diameter Measured by Transcranial Sonography and Clinical Disability and Cognitive Dysfunction in patients with Multiple Sclerosis. Arch Neurol 2000; 57: 1289-1292. Turner B, Ramli N, Blumhardt LD y Jaspan T. Ventricular enlargement in multiple sclerosis: a comparison of three-dimensional and linear MRI estimates. Neuroradiology 2001; 43: 608-614. Bermel RA, Bakshi R, Tjoa C, Puli SR y Jacobs L. Bicaudate Ratio as a magnetic resonance imaging marker of brain atrophy in multiple sclerosis. Arch Neurol 2002; 59: 275-280. Butzkueven H, Kolbe SC, Jolley DJ, Brown JY, Cook MJ, van der Mei IA, et al. Validation of linear cerebral atrophy markers in multiple sclerosis. J Clin Neurosci 2008; 15 (2): 130-137. Sánchez MP, Nieto A, Barroso J, Martín V, Hernández MA. Brain atrophy as a marker of cognitive impairment in mildly disabling relapsing-remitting multiple sclerosis. Eur J Neurol 2008; 15 (10): 1091-1099. Brex PA, Jenkins R, Fox NC, Crum WR, O’Riordan JI, Plant GT, et al. Detection of ventricular enlargement in patients at the earliest clinical stage of MS. Neurology 2000; 54 (8): 1689-1691. Dalton CM, Brex PA, Jenkins R, Fox NC, Miszkiel KA, Crum WR, et al. Progressive ventricular enlargement in patients with clinically isolated syndromes is associated with the early development of multiple sclerosis. J Neurol Neurosurg Psychiatry 2002; 73 (2): 141-147. Lycklama à Nijeholt GJ, van Walderveen MAA, Castelijns JA, van Waesberghe JHTM, Polman C, Scheltens P, et al. Brain and spinal cord abnor- REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE 59.- 60.- 61.- 62.- 63.- 64.- 65.- 66.- 67.- 68.- 69.- 70.- 71.- Nº 15 - Septiembre de 2010 malities in Multiple Sclerosis. Correlation between MRI parameters, clinical subtypes and symptoms. Brain 1998; 121: 687-697. Caon C, Zvartan-Hind M, Ching W, Lisak RP, Tselis AC, Khan OA. Intercaudate nucleus ratio as a linear measure of brain atrophy in multiple sclerosis. Neurology 2003; 60 (2): 323-325. Schreiber K, Sørensen PS, Koch-Henriksen N, Wagner A, Blinkenberg M, Svarer C, et al. Correlations of brain MRI parameters to disability in multiple sclerosis. Acta Neurol Scand 2001; 104: 24-30. Cifelli A, Arridge M, Jezzard P, Esiri MM, Palace J, Matthews PM. Thalamic neurodegeneration in multiple sclerosis. Ann Neurol 2002; 52 (5): 650653. Houtchens MK, Benedict RH, Killiany R, et al. Thalamic atrophy and cognition in multiple sclerosis. Neurology 2007; 69 (12): 1213-1223. Taylor I, Butzkueven H, Litewka L, MacGregor LR, Szoeke C, Cook M, et al. Serial MRI in multiple sclerosis: a prospective pilot study of lesion load, whole brain volume and thalamic atrophy. J Clin Neurosci 2004; 11 (2): 153-158. Sicotte NL, Kern KC, Giesser BS, Arshanapalli A, Schultz A, Montag M, et al. Regional hippocampal atrophy in multiple sclerosis. Brain 2008; 131 (Pt 4): 1134-1141. Kidd D, Thorpe JW, Thompson AJ, Kendall BE, Moseley IF, MacManus DG, et al. Spinal cord MRI using multi-array coils and fast spin echo. II. Findings in multiple sclerosis. Neurology 1993; 43 (12): 26322637. Filippi M, Campi A, Colombo B, Pereira C, Martinelli V, Baratti C, et al. A spinal cord MRI study of benign and secondary progressive multiple sclerosis. J Neurol 1996; 243 (7): 502-505. Edwards SGM, Gong QY, Liu C, Zvartau ME, Jaspan T, Roberts N, et al. Infratentorial atrophy on magnetic resonance imaging and disability in multiple sclerosis. Brain 1999; 122: 291-301. Anderson VM, Fisniku LK, Altmann DR, Thompson AJ, Miller DH. MRI measures show significant cerebellar gray matter volume loss in multiple sclerosis and are associated with cerebellar dysfunction. Mult Scler 2009; 15 (7): 811-817. Simon JH, Schiffer RB, Rudick RA y Herndon RM. Quantitative Determination of MS induced corpus callosum atrophy in vivo using MR imaging. AJNR Am J Neuroradiol 1987; 8: 599-604. Pelletier J, Habib M, Lyon-Caen O, Salamon G, Poncet M, Khalil R. Functional and magnetic resonance imaging correlates of callosal involvement in multiple sclerosis. Arch Neurol 1993; 50 (10): 10771082. Barkhof F, Elton M, Lindeboom J, Tas MW, Schmidt María del Pino Sánchez López, Antonieta Nieto Barco, José Barroso Ribal 72.- 73.- 74.- 75.- 76.- 77.- 78.- 79.- 80.- 81.- 82.- WF, Hommes OR, et al. Functional correlates of callosal atrophy in relapsing-remitting multiple sclerosis patients. A preliminary MRI study. J Neurol 1998; 245: 153-158. Paolillo A, Pozzilli C, Gasperini C, Giugni E, Mainero C, Giuliani S, et al. Brain atrophy in relapsing-remitting multiple sclerosis: relationship with “black holes”, disease duration and clinical disability. J Neurol Sci 2000; 174: 85-91. Pelletier J, Suchet L, Witjas T, Habib M, Guttman CRG, Salamon G, et al. A longitudinal study of callosal atrophy and interhemispheric dysfunction in relapsing-remitting multiple sclerosis. Arch Neurol 2001; 58: 105-111. Benedict RH, Zivadinov R, Carone DA, WeinstockGuttman B, Gaines J, Maggiore C, et al. Regional lobar atrophy predicts memory impairment in multiple sclerosis. AJNR Am J Neuroradiol 2005; 26 (7): 1824-1831. Carone DA, Benedict RH, Dwyer MG, Cookfair DL, Srinivasaraghavan B, Tjoa CW, et al. Semi-automatic brain region extraction (SABRE) reveals superior cortical and deep gray matter atrophy in MS. Neuroimage 2006; 29 (2): 505-514. Audoin B, Davies GR, Finisku L, Chard DT, Thompson AJ, Miller DH. Localization of grey matter atrophy in early RRMS: A longitudinal study. J Neurol 2006; 253 (11): 1495-1501. Khaleeli Z, Cercignani M, Audoin B, Ciccarelli O, Miller DH, Thompson AJ. Localized grey matter damage in early primary progressive multiple sclerosis contributes to disability. Neuroimage 2007; 37 (1): 253-261. Ceccarelli A, Rocca MA, Pagani E, Colombo B, Martinelli V, Comi G, et al. A voxel-based morphometry study of grey matter loss in MS patients with different clinical phenotypes. Neuroimage 2008; 42 (1): 315-322. Ceccarelli A, Rocca MA, Valsasina P, Rodegher M, Pagani E, Falini A, et al. A multiparametric evaluation of regional brain damage in patients with primary progressive multiple sclerosis. Hum Brain Mapp 2009; 30 (9): 3009-3019. Henry RG, Shieh M, Okuda DT, Evangelista A, Gorno-Tempini ML, Pelletier D. Regional grey matter atrophy in clinically isolated syndromes at presentation. J Neurol Neurosurg Psychiatry 2008; 79 (11): 1236-1244. Mesaros S, Rovaris M, Pagani E, Pulizzi A, Caputo D, Ghezzi A, et al. A magnetic resonance imaging voxel-based morphometry study of regional gray matter atrophy in patients with benign multiple sclerosis. Arch Neurol 2008; 65 (9): 1223-1230. Morgen K, Sammer G, Courtney SM, et al. Evidence for a direct association between cortical atrophy 83.- 84.- 85.- 86.- 87.- 88.- 89.- 90.- 91.- 92.- 93.- 94.- and cognitive impairment in relapsing-remitting MS. Neuroimage 2006; 30: 891-898. Battaglini M, Giorgio A, Stromillo ML, Bartolozzi ML, Guidi L, Federico A, et al. Voxel-wise assessment of progression of regional brain atrophy in relapsing-remitting multiple sclerosis. J Neurol Sci 2009; 282 (1-2): 55-60. Prinster A, Quarantelli M, Orefice G, Lanzillo R, Brunetti A, Mollica C, et al. Grey matter loss in relapsing-remitting multiple sclerosis: a voxel-based morphometry study. Neuroimage 2006; 29 (3): 859-867. Calabrese M, Atzori M, Bernardi V, Morra A, Romualdi C, Rinaldi L, et al. Cortical atrophy is relevant in multiple sclerosis at clinical onset. J Neurol 2007; 254 (9): 1212-1220. Stevenson VL, Miller DH, Leary SM, Rovaris M, Barkhof F, Brochet B, et al. One year follow up study of primary and transitional progressive multiple sclerosis. J Neurol Neurosurg Psychiatry 2000; 68 (6): 713-718. Sailer M, Losseff NA, Wang L, Gawne-Cain ML, Thompson AJ y Miller DH. T1 lesion load and cerebral atrophy as a marker for clinical progression in patients with multiple sclerosis. A prospective 18 months follow-up study. Eur J Neurol 2001; 8: 37-42. Hardmeier M, Wagenpfeil S, Freitag P, Fisher E, Rudick RA, Kooijmans-Coutinho M, et al. Atrophy is detectable within a 3-month period in untreated patients with active relapsing remitting multiple sclerosis. Arch Neurol 2003; 60 (12): 1736-1739. Zivadinov R, Sepcic J, Nasuelli D, De Masi R, Monti Bragadin L, Tommasi MA, et al. A longitudinal study of brain atrophy and cognitive disturbances in the early phase of relapsing-remitting multiple sclerosis. J Neurol Neurosurg Psychiatr 2001; 70: 773-780. Luks TL, Goodkin DE, Nelson SJ, Majumdar S, Bacchetti P, Portnoy D, et al. A longitudinal study of ventricular volume in early relapsing-remitting Multiple Sclerosis. Mult Scler 2000; 6 (5): 332-337. Sastre-Garriga J, Ingle GT, Chard DT, Cercignani M, Ramió-Torrentà L, Miller DH, et al. Grey and white matter volume changes in early primary progressive multiple sclerosis: a longitudinal study. Brain 2005; 128 (Pt 6): 1454-1460. Valsasina P, Benedetti B, Rovaris M, Sormani MP, Comi G, Filippi M. Evidence for progressive gray matter loss in patients with relapsing-remitting MS. Neurology 2005; 65 (7): 1126-1128. Inglese M, Rovaris M, Giacomotti L, Mastronardo G, Comi G y Filippi M. Quantitative brain volumetric analysis from patients with multiple sclerosis: a follow-up study. J Neurol Sci 1999; 171: 8-10. Zivadinov R, Bagnato F, Nasuelli D, Bastianello S, REVISTA ESPAÑOLA DE ESCLEROSIS MÚLTIPLE Nº 15 - Septiembre de 2010 33