Modelo Simplificado de Flujo Sanguíneo no-Newtoniano en
Anuncio

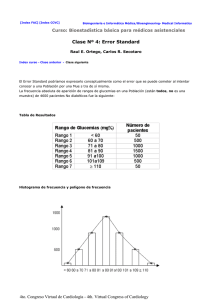
[Index FAC] [Index CCVC] Bioetica/Bioethic Modelo Simplificado de Flujo Sanguíneo no-Newtoniano en Microcapilares con Adhesión de Leucocitos Di PaolO José, Bregains Aníbal F., Fresno Rodríguez Cristóbal, Campana Diego M., Ubal Sebastián. Grupo Biomecánica Computacional, Facultad de Ingeniería, UNER, Oro Verde, Entre Ríos, Argentina. Introducción: Los modelos matemáticos de situaciones fisiológicas o fisiopatológicas son cada vez más utilizados en el ámbito de la salud debido a sus características no invasivas y a su poder de predicción cuando se los emplea para situaciones nuevas, reales o supuestas. En este sentido, los modelos planteados con suficientes hipótesis simplificatorias, capaces de capturar las características más importantes de ciertos fenómenos y cuya resolución computacional sea mucho más "económica", son siempre de gran utilidad. Objetivos: En este trabajo se presenta un modelo matemático simplificado para estudiar el comportamiento del flujo sanguíneo dentro de un tramo de un capilar con adhesión de leucocitos que obstruyen parcialmente el área de paso. Materiales y métodos: El modelo se basa en la hipótesis de validez de las condiciones de flujo unidimensional no-newtoniano de ley de potencia en cada sección del capilar, y se resuelve a través de un algoritmo computacional que insume escasos segundos de ejecución. Resultados: Los datos que el algoritmo requiere son: los parámetros del modelo de ley de potencia para la viscosidad de la sangre, el porcentaje máximo de obstrucción de área, el radio del capilar en el tramo no obstruido, la forma de la obstrucción y el caudal medio de sangre a lo largo de un pulso cardíaco. Por su parte, los resultados muestran la variación con la coordenada axial de la caída de presión y los esfuerzos cortantes para distintos grupos de datos. Discusión: Los resultados concuerdan cualitativamente con resultados publicados, obtenidos con modelos más complejos y algoritmos de alto costo computacional. Conclusiones: El modelo propuesto constituye una simplificación válida mediante la cual se puede obtener, de manera prácticamente instantánea, una buena aproximación de los valores de presión y esfuerzo de corte existentes dentro de capilares con adhesión. La importancia de ello es la información disponible en tiempo real. INTRODUCCIÓN Los modelos matemáticos de situaciones fisiológicas o fisiopatológicas son cada vez más utilizados en el ámbito de la salud debido a sus características no invasivas y a su poder de predicción cuando se los emplea para situaciones nuevas, reales o supuestas. En este sentido, los modelos planteados con suficientes hipótesis simplificatorias, capaces de capturar las características más importantes de ciertos fenómenos y cuya resolución sea mucho más "económica", son siempre de gran utilidad. En la actualidad, poseer una herramienta no invasiva para la valoración de la fluidodinámica del paciente 4to. Congreso Virtual de Cardiología - 4th. Virtual Congress of Cardiology es de suma importancia para los profesionales médicos encargados de su diagnóstico y tratamiento [1]. Dentro de este campo, la modelización matemática de los fenómenos fisiológicos y fisiopatológicos se encuentra en continuo avance y desarrollo y representa una de las opciones de gran interés para la comunidad científica. Los modelos deben estar previamente validados de manera conveniente mediante la comparación de sus resultados con mediciones experimentales o con resultados de modelos más completos [2]. OBJETIVOS En este trabajo se presenta un modelo matemático simplificado para la modelización de la fluidodinámica sanguínea dentro de vasos de muy pequeño calibre que poseen una reducción de la luz de paso debido a la adhesión de leucocitos en sus paredes. El modelo propuesto se basa en una descripción no newtoniana de la sangre a través de la denominada ley de potencia, asumiendo una geometría rígida y axisimétrica para el capilar. La solución del mismo permite obtener los valores numéricos de la caída de presión y esfuerzos de corte en las paredes de los capilares con adhesión de leucocitos en diferentes condiciones. Los resultados obtenidos se validaron mediante la comparación con modelos tridimensionales más complejos y de mayor costo computacional [3]. MATERIALES y MÉTODOS El código computacional que resuelve el modelo matemático requiere los siguientes datos: la forma del canal de flujo (dominio donde se resuelven las ecuaciones), el caudal medio de sangre a lo largo de un pulso cardíaco y el hematocrito. Cabe destacar que dentro de la morfología del canal se incluye el diámetro del capilar en el tramo sin obstrucción, el diámetro en el tramo obstruido, el número de leucocitos adheridos consecutivamente en una determinada zona longitudinal del vaso y el largo total del tramo considerado. La descripción matemática del flujo sanguíneo requiere en primer lugar la representación del dominio. En este trabajo se considera un tramo de capilar de forma cilíndrica recta de 45 m m de longitud y 18 m m de diámetro libre. En condiciones fisiológicas los leucocitos presentan un diámetro de 8,8 m m pero frente a este tipo de patologías los mismos se adhieren a la pared vascular presentando un aplastamiento en su hemisferio inferior, quedando de forma aproximadamente elíptica con un radio menor de 3 m m de longitud. Para lograr una simetría axisimétrica, necesaria para construir un modelo unidimensional, se simula la adhesión del leucocito como si éste formara un anillo concéntrico de manera que rodee toda la pared del capilar y produzca una obstrucción disminuyendo el calibre del vaso. Dado que en condiciones reales las obstrucciones no son axisimétricas, ello obliga a adoptar un valor de estenosis representativo de dicha situación, que puede encontrarse a través de la comparación de los resultados del modelo simplificado con los obtenidos con un modelo de mayor complejidad [3]. La figura 1 muestra el dominio axisimétrico en donde se puede observar un corte longitudinal y un corte transversal para el caso de un leucocito adherido. La selección de la obstrucción puede realizarse con distintos criterios que en general producen resultados por defecto o por exceso respecto a resultados publicados, por lo cual se opta por una estenosis cuyos resultados ajusten mejor con los encontrados en la bibliografía [3]. 4to. Congreso Virtual de Cardiología - 4th. Virtual Congress of Cardiology Figura 1: Esquematización del dominio axisimétrico considerado para diferentes criterios: en verde, estenosis repartiendo el área de obstrucción correspondiente a un leucocito alrededor del vaso; en azul, estenosis repartiendo el doble del área de obstrucción correspondiente a un leucocito (la que produce resultados concordantes con otros publicados [3]); en rojo, estenosis con diámetro interior igual a la luz libre en la situación real. A) Corte longitudinal. B) Corte transversal en la región de estenosis. En el comportamiento de la viscosidad de la sangre, se considera al fluido circulante como una suspensión concentrada y homogénea de eritrocitos. La modelización del mismo se basa en la hipótesis de flujo unidimensional no newtoniano de ley de potencia (ec. 1) [4, 5] a los efectos de obtener una expresión analítica sencilla para la distribución de presión (ec. 4) a lo largo de la coordenada axial del vaso. donde: µ: viscosidad de la sangre [Pa s]; g : tasa de deformación [s-1]; m y n : parámetros del modelo La determinación de los parámetros m y n se realiza a partir de un ajuste con el modelo no newtoniano de Casson [3,4]. Para ello, se requiere del conocimiento del rango de variación de para lo cual se halla un valor promedio de ésta ( ) en términos del hematocrito sanguíneo, el diámetro del tramo sin estenosis y el caudal sanguíneo medio. donde: V: velocidad Media [m/s]; Q : caudal medio temporal en una onda de pulso [m3/s]; A : área de pasaje mínima [m3 ]; R: radio del capilar [m]. 4to. Congreso Virtual de Cardiología - 4th. Virtual Congress of Cardiology Para el dominio considerado, en condiciones fisiológicas y para un hematocrito de 0,4, el caudal circulante posee un rango de variación entre 0,03 [nl] y 3,0 [nl] [3], por lo cual se esperan tasas de deformaciones promedios mínimas y máximas entre 15 [s-1 ] y 600 [s-1 ], respectivamente. En la figura 2 se observa el ajuste del modelo de ley de potencia para tasas de deformaciones correspondientes a caudales entre 0,05 a 0,25 [nl]. Para valores de caudales menores a 0,05 [nl] el ajuste no es válido. Para el presente modelo la expresión que describe las variaciones de presión en coordenadas cilíndricas es [5]: donde: dp: variación de presión en dos secciones infinitamente próximas [Pa]; z : coordenada axial[m]; R(z) : radio del vaso en el tramo considerado [m]. Figura 2: Ajuste del modelo de ley de potencia con el modelo de Casson en la región de tasas de deformación (g) de interés para el análisis del modelo de flujo simplificado. La integración de la ecuación (3) permite obtener el perfil de presiones en función de la coordenada axial: La ecuación (4) se integra numéricamente mediante el método de Simpson [6]. Una vez obtenido el perfil de presiones se puede calcular el esfuerzo de corte (t) en la pared del capilar 4to. Congreso Virtual de Cardiología - 4th. Virtual Congress of Cardiology y la denominada resistencia del flujo RESULTADOS y DISCUSIÓN Para la solución del modelo, el procesamiento y análisis de los resultados se desarrolló un algoritmo computacional que insume escasos segundos de ejecución. Dentro de lo que las hipótesis de este trabajo lo permiten, los resultados se compararon con los correspondientes a un modelo tridimensional [3] utilizando la geometría representada con color azul en la figura 1. La comparación fue realizada utilizando una variable integradora del fenómeno como lo es la resistencia en el tramo analizado (F). En la figura 3A) puede apreciarse el relativo buen acuerdo entre los resultados de este trabajo y los publicados, sobre todo en la región de tasas de corte más altas, que es la de mayor interés. Por su parte, la figura 3B) demuestra que a pesar de su simplicidad, el modelo captura las principales características mecánicas del problema, si se tienen en cuenta los pequeños errores de los resultados respecto a los de modelos más completos y complejos, sobre todo en la región de interés (0.05 a 0.35 [nl]). Figura 3: Comparación de los resultados de este trabajo y los de Das y col. [3]. A) Resistencia de flujo en función del caudal. 4to. Congreso Virtual de Cardiología - 4th. Virtual Congress of Cardiology Figura 3B: B) Error porcentual de la resistencia de flujo en función del caudal. En lo que respecta a las predicciones de las variaciones de presión y esfuerzo de corte a lo largo de la coordenada axial, las comparaciones anteriores permiten un cierto grado de confianza en el valor de los resultados que siguen. En la figura 4A) se presentan los resultados correspondientes a la caída de presión en un tramo sin leucocito, donde puede verse una variación lineal característica del flujo laminar de un fluido newtoniano, mostrando así que en el vaso libre los efectos no newtonianos no tienen influencia [7]. Asimismo se compara la variación de presión cuando el tramo analizado posee dos leucocitos adheridos consecutivamente. Puede observarse la fuerte caída de presión en los tramos obstruidos y el mantenimiento de la pendiente de variación en los sectores no obstruidos. Las caídas de presión producidas por cada leucocito mantienen la misma forma y son del mismo orden. 4to. Congreso Virtual de Cardiología - 4th. Virtual Congress of Cardiology Figura 4: A) Variación de la caída de presión con la coordenada axial para dos leucocitos adheridos consecutivamente a lo largo del eje del vaso (rojo) y variación de la caída de presión para el vaso libre (verde). El esfuerzo de corte, figura 4B), permanece constante en la zona donde no existe estrechamiento, situación que se relaciona con una caída de presión constante (ver ec. (5)) como se observa antes y después de cada leucocito. Por otro lado, la zona de estrechamiento presenta un acentuado aumento del esfuerzo de corte, situación propia en estos casos. Figura 4B: B) Esfuerzo de corte para dos leucocitos adheridos consecutivamente. 4to. Congreso Virtual de Cardiología - 4th. Virtual Congress of Cardiology Si bien los esfuerzos cortantes no revisten riesgos por su magnitud, de la figura 4A) se ve claramente que la adhesión de leucocitos aumenta fuertemente la caída de presión y por ende el trabajo de flujo. CONCLUSIONES El modelo propuesto ha demostrado aptitudes mediante las cuales se pueden obtener de manera prácticamente instantánea, una buena aproximación de los valores de presión y esfuerzo de corte existentes en los capilares con adhesión de leucocitos dentro de un cierto rango de caudales. Si bien se han realizado hipótesis simplificatorias que alejan al modelo del comportamiento real del flujo sanguíneo en capilares, en particular la axisimetría, se ha hecho evidente la importancia que posee el flujo axial en este tipo de fenómenos dado que el modelo logra capturar las características mecánicas más importantes, como por ejemplo la resistencia al flujo. Ello sugiere un gran predominio del flujo central en las características del sistema in vivo. A su vez se pueden obtener resultados adicionales como: las variaciones de la resistencia con el diámetro del capilar sanguíneo y el número de leucocitos, los perfiles de velocidades, y otras que por motivos de extensión no se han incluido. Cabe destacar la importancia de la información obtenida en tiempo real y de forma no invasiva que puede ser útil en futuras investigaciones de patologías vasculares. BIBLIOGRAFIA 1. 2. 3. 4. 5. 6. 7. Pacher A.; Lombardo R.; Obra de cátedra, Cátedra de Fisiopatología: http://www.fac.org.ar/fisiop/index.html. Facultad de Ingeniería – UNER, 2004. Filipowicz, G. H., "Obtención del radio óptimo de un catéter angioplástico para mediciones confiables de caída de presión transestenótica". Proyecto Final de Carrera, Facultad de Ingeniería – UNER, 2001. Das, B.; Johnson P. C.; Popel A. S.; "Computational fluid dynamic studies of leucocite adhesion effects on non-Newtonian blood flow through microvessels", 2000. Cho Y. I.; Kensey K. R.; "Effects of the non-newtonian viscosity of blood on flows in a diseased arterial vessel. Part 1: steady flows"; 1991. Bird, R. B., Armstrong, R. C. and Hassager, O., " Dynamics of Polymer Liquids ", John Wiley and Sons, New York, 1977. Nakamura, S.; " Métodos Numéricos Aplicados con Software ", Prentice may Hispanoamericana, S. A., 1992. Whitaker, S., " Introduction to Fluid Mechanics ", Robert E. Krieger Publishing Company, Inc., 1981. Publicación: Octubre 2005 Tope Preguntas, aportes y comentarios serán respondidos por los autores de la lista de Cardiología Clínica Llene los campos del formulario y oprima el botón "Enviar" Preguntas, aportes o comentarios: 4to. Congreso Virtual de Cardiología - 4th. Virtual Congress of Cardiology Nombre y apellido: País: Argentina Dirección de E-Mail: Enviar Borrar Dr. Diego Esandi Co-Presidente Comité Científico Dra. Silvia Nanfara Co-Presidente Comité Científico Prof. Dr. Armando Pacher Presidente Comité Técnico/Organizador Correo electrónico Correo electrónico Correo electrónico ©1994-2005 CETIFAC - Bioingeniería UNER Webmaster Actualización: 11-oct-05 4to. Congreso Virtual de Cardiología - 4th. Virtual Congress of Cardiology