EL ATP, MOLÉCULA PORTADORA DE ENERGÍA PARA LOS
Anuncio

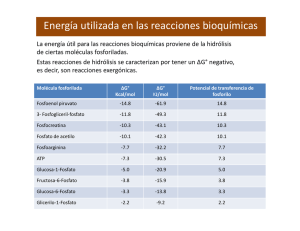
EL ATP, MOLÉCULA PORTADORA DE ENERGÍA PARA LOS PROCESOS BIOLÓGICOS ADP El ADP puede usarse para producir nuevo ATP. ADP + Pi Alimentos Trabajo O2 Obtenemos la energía química mediante la oxidación de biomoléculas presentes en los alimentos. ATP mecánico CO2 + H2O Trabajo de transporte Trabajo de biosíntesis La forma activa del ATP requiere de Mg2+ Estructura del ATP La hidrólisis del ATP libera energía útil para las reacciones bioquímicas. Energía utilizada en las reacciones bioquímicas La energía útil para las reacciones bioquímicas proviene de la hidrólisis de ciertas moléculas fosforiladas. Estas reacciones de hidrólisis se caracterizan por tener un ∆G° negativo, es decir, son reacciones exergónicas. Molécula fosforilada ∆G° Kcal/mol ∆G° KJ/mol Potencial de transferencia de fosforilo Fosfoenol piruvato -14.8 -61.9 14.8 3- Fosfogliceril-fosfato -11.8 -49.3 11.8 Fosfocreatina -10.3 -43.1 10.3 Fosfato de acetilo -10.1 -42.3 10.1 Fosfoarginina -7.7 -32.2 7.7 ATP -7.3 -30.5 7.3 Glucosa-1-Fosfato -5.0 -20.9 5.0 Fructosa-6-Fosfato -3.8 -15.9 3.8 Glucosa-6-Fosfato -3.3 -13.8 3.3 Glicerilo-1-Fosfato -2.2 -9.2 2.2 El sistema ATP/ADP actúa como intermediario en la mayoría de las reacciones bioquímicas. El ADP recibe el grupo fosforilo de otros compuestos con mayor potencial de transferencia de fosforilo. El ATP transfiere su fosforilo a otros compuestos cuyo potencial de transferencia de fosforilo es menor. POTENCIAL DE TRANSFERENCIA DE FOSFORILO Es la tendencia termodinámica que tiene un compuesto fosforilado de ceder su grupo fosforilo. POR QUÉ LA HIDRÓLISIS DEL ATP ES EXERGÓNICA? OOOǀ ǀ ǀ Adenina – Ribosa – O – P – O – P – O – P – Oǁ ǁ ǁ O O O OOǀ ǀ Adenina – Ribosa – O – P – O – P – Oǁ ǁ O O + Oǀ -O – P – Oǁ O 1. Porque los productos de la hidrólisis se estabilizan por resonancia. 2. Porque la molécula de ATP es inestable debido al rechazo entre sí de las cargas negativas. CÁLCULO DEL ∆G° DE LA HIDRÓLISIS DEL ATP Se realiza a partir de otras reacciones, aprovechando la característica de aditividad de las reacciones , así como la participación del ATP como intermediario común. ATP + Glucosa Glucosa-6-P + H2O ATP + H 2O ADP + Glucosa-6-P Glucosa + Pi ADP + Pi ∆G° = -4 Kcal/mol ∆G° = -3.3 Kcal/mol ∆G° = -7.3 Kcal/mol CÁLCULO DEL ∆G° DE REACCIÓN Se utiliza la ecuación: ∆G° = - RT lnKeq Ejemplo: Glucosa-1-P Glucosa-6-P Partiendo de una concentración inicial de Glucosa-1-P de 0.020 M, en el equilibrio se encontraron las siguientes concentraciones: |Glucosa-1-P| = 0.001 M, |Glucosa-6-P| = 0.019 M Keq = |Glucosa-6-P| |Glucosa-1-P| = 0.019 0.001 = 19 ∆G° = (-1.987 cal*mol-1 * K-1) * 298 K * ln (19) ∆G° = - 1.745 cal*mol-1 ADITIVIDAD DE LOS VALORES DE ∆G° DE REACCIÓN En ocasiones no es posible medir directamente el ∆G° de alguna reacción, por lo que se recurre a la característica de aditividad, encontrado las adecuadas reacciones acopladas A B ∆G°1 B C ∆G°2 C D ∆G°3 ∆G°(A→D) = ∆G°1 + ∆G°1 + ∆G°3 A las reacciones que se pueden ordenar así, se les llama Reacciones acopladas, mientras que a las substancias que participan como substrato en una reacción y como producto en otra reacción (como es el caso de B y C) se les llama intermediarios comunes. Transferencia de fosforilo al ADP Algunas moléculas con mayor nivel energético que el ATP le transfieren su grupo fosforilo al ADP, sintetizando ATP, el cuales utilizado en posteriores reacciones. 3-Fosfogliceril-fosfato + ADP 3-Fosfoglicerato + ATP ∆G° = -4.5 Kcal/mol Fosfoenol-piruvato + ADP Fosfocreatina + ADP Piruvato + ATP Creatina + ATP ∆G° = -7.5 Kcal/mol ∆G° = -3.0 Kcal/mol Transferencia de energía a través de otros nucleósidos El ATP puede transferir su energía a los nucleósidos difosfato, produciendo nucleósidos trifosfato , los cuales podrán utilizarse en otras reacciones. ATP + UDP ADP + UTP ATP + dGDP ADP + dGTP Escición pirofosfatólica del ATP ATP + H2O PPi + H2O ATP + AMP AMP + PPi 2Pi 2ADP ∆G° = -10.0 Kcal/mol ∆G° = -4.6 Kcal/mol