lectura
Anuncio
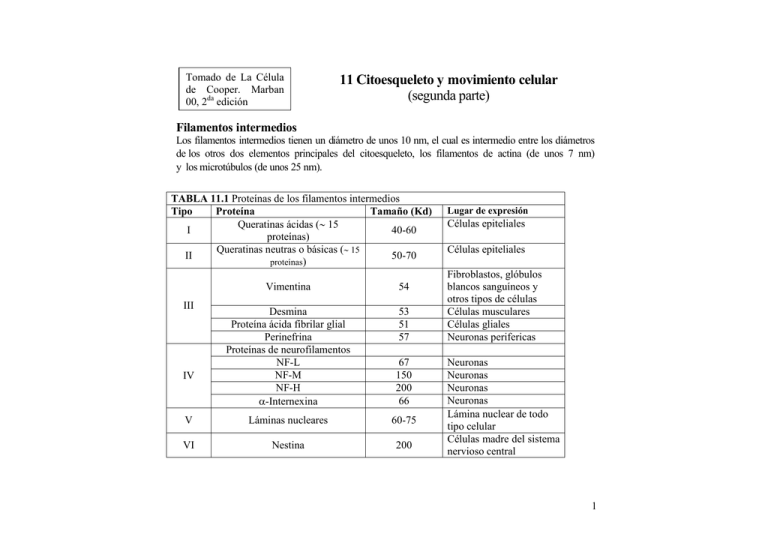
Tomado de La Célula de Cooper. Marban 00, 2da edición 11 Citoesqueleto y movimiento celular (segunda parte) Filamentos intermedios Los filamentos intermedios tienen un diámetro de unos 10 nm, el cual es intermedio entre los diámetros de los otros dos elementos principales del citoesqueleto, los filamentos de actina (de unos 7 nm) y los microtúbulos (de unos 25 nm). TABLA 11.1 Proteínas de los filamentos intermedios Tipo Proteína Tamaño (Kd) Queratinas ácidas (∼ 15 I 40-60 proteínas) Queratinas neutras o básicas (∼ 15 50-70 II proteínas) Vimentina 54 Desmina Proteína ácida fibrilar glial Perinefrina Proteínas de neurofilamentos NF-L NF-M NF-H α-Internexina 53 51 57 67 150 200 66 V Láminas nucleares 60-75 VI Nestina 200 III IV Lugar de expresión Células epiteliales Células epiteliales Fibroblastos, glóbulos blancos sanguíneos y otros tipos de células Células musculares Células gliales Neuronas perifericas Neuronas Neuronas Neuronas Neuronas Lámina nuclear de todo tipo celular Células madre del sistema nervioso central 1 A diferencia de los filamentos de actina y de los microtúbulos, los filamentos intermedios no están directamente implicados en los movimientos celulares. Parecen desempeñar básicamente un papel estructura¡ proporcionando resistencia mecánica a las células y tejidos. Proteínas de intermedios los filamentos Mientras que los filamentos de actina y los microtúbulos son polímeros constituidos por un solo tipo de proteínas (actina y tubulina, respectivamente), los filamentos intermedios están compuestos por diversas proteínas que se expresan en distintos tipos de células. Más de 50 proteínas diferentes de filamentos intermedios han sido identificadas y clasificadas en seis grupos en función de las similitudes entre sus secuencias de aminoácidos (Tabla 11.1). Los tipos I y II son dos grupos de queratinas, constituidos cada uno por aproximadamente 15 proteínas diferentes, que se expresan en las células epiteliales. Cada tipo de célula epitelial sintetiza al menos una queratina de tipo I(ácida) y una de tipo II (neutra/básica), que copolimerizan para formar filamentos. Algunas queratinas de tipo I y II (denominadas queratinas duras) son constituyentes de estructuras tales como pelo, uñas y cuernos. Las otras queratinas de tipo I y II (queratina blandas) son abundantes en el citoplasma de las células epiteliales, expresándose queratinas diferentes en los distintos tipos celulares diferenciados. Las proteínas tipo III de filamentos intermedios incluyen a la vimentina, que se encuentra en diferentes tipos de células, incluyendo fibroblastos, células de músculo liso y glóbulos blancos sanguíneos. Otra proteína tipo III, la se expresa de manera específica en las células musculares, donde conecta los discos Z de los elementos contráctiles individuales. Una tercera proteína tipo III de filamentos intermedios se expresa de forma específica en las células gliales, y una cuarta en neuronas de¡ sistema nervioso periférico. Las proteínas tipo IV de filamentos intermedios incluyen a las tres proteínas de neurofilamentos (NF) (designadas NF-L, NF-M, y NF-H de light -ligera-, medium -media-, heavy -pesado-, 2 respectivamente). Estas proteínas forman los filamentos intermedios principales de muchos tipos de neuronas maduras. Abundan principalmente en los axones de las neuronas motoras y se piensa que desempeñan un papel crítico en el sostén de estás prolongaciones largas y delgadas, que pueden extenderse más de un metro de longitud. Otra proteína tipo IV (a-internexina) se expresa en una etapa anterior de¡ desarrollo neurona¡, previa a la expresión de las proteínas de neurofilamentos. La única proteína tipo Vi de filamentos intermedios (nestina) se expresa en una etapa anterior del desarrollo de las neuronas, en las células madre del sistema nervioso central. Las proteínas tipo V de filamentos intermedios son las láminas nucleares, que se encuentran en la mayoría de las células eucariotas. En vez de ser parte del citoesqueleto, las láminas nucleares son componentes de la envoltura nuclear (véase Fig. 8.3). También difieren de las otras proteínas de filamentos intermedios en que se ensamblan formando una malla ortogonal debajo de la membrana nuclear. Fig 11.31: Estructura de las proteínas de filamentos intermedios. Las proteínas de filamentos intermedios contienen un dominio en α-hélice como eje central de, aproximadamente, 310 aminoácidos (350 aminoácidos en las láminas nucleares). El domnio de cabeza N-terminal y el dominio de cola C-terminal varían en tamaño y forma A pesar de la considerable diversidad en el tamaño y en la secuencia de aminoácidos, las diferentes proteínas de filamentos intermedios muestran una organización estructura¡ común (Fig. 11.31). Todas las proteínas de filamentos intermedios tienen un dominio en, a-hélice como eje central de aproximadamente 310 aminoácidos (350 aminoácidos en las láminas nucleares). Este dominio de eje central está franqueado por dominios amino- y carboxilo- terminales, que varían entre las diferentes proteínas 3 de filamentos intermedios en tamaño, secuencia y estructura secundaria. Como se tratará a continuación, el dominio central en a-hélice juega un papel fundamental en el ensamblaje de los filamentos, mientras que los dominios variables de la cabeza y la cola presumiblemente determinan las funciones específicas de las diferentes proteínas de los filamentos intermedios.Ensamblaje de los filamentos intermedios El primer paso en el ensamblaje de los filamentos es la formación de dímeros en los cuales los dominios de eje central de dos cadenas polipeptídicas están enrollados uno alrededor de¡ otro en una estructura de espiral enrollada (coiled-coil), similar a la formada por las cadenas pesadas de la miosina II (Fig. 11.32). Los dímeros entonces se asocian de un modo escalonado antiparalelo para formar tetrámeros, que se ensamblan extremo con extremo para formar protofilamentos. El filamento intermedio resultante contiene aproximadamente ocho protofilamentos enrollados uno alrededor de¡ otro en una estructura a modo de cuerda. Debido a que el ensamblaje se produce a partir de tetrámeros antiparalelos, ambos extremos de los filamentos intermedios son equivalentes. Por lo tanto, y a diferencia de los filamentos de actina y de los microtúbulos, los filamentos intermedios son apolares; no tienen diferenciados un extremo «más» y «menos». Fig 11.32: Ensamblaje de los filamentos intermedios. Los dominios del eje central de dos polipéptidos se enrollan uno con otro en una estructura espiral enrollada (coiled-coil) para formar dímeros. Los dímeros se asocian entonces de un modo escalonado antiparalelo para formar tetrámeros. Los se asocian extremo con extremo para formar protofilamentos y lateralmente par formar filamentos. Cada filamento contiene aproximadamente ocho protofilamentos enrollados uno alrededor del otro en una estructura a modo de cuerda. 4 El ensamblaje de filamentos requiere interacciones entre los tipos específicos de proteínas de filamentos intermedios. Por ejemplo, los filamentos de queratina siempre se ensamblan a partir de heterodímeros que contienen un polipéptido de tipo I y uno de tipo II. Por el contrario, las proteínas de tipo III pueden ensamblarse en filamentos constituidos por un único polipéptido (p. ej., vimentina) o constituidos por dos proteínas de tipo III diferentes (p. ej., vimentina más desmina). Sin embargo, las proteínas de tipo III no forman copolímeros con las queratinas. Entre las proteínas de tipo IV, la a-internexina puede ensamblarse en filamentos consigo misma, mientras que las tres proteínas de neurofilamentos copolimerizan para formar heteropolímeros. Los filamentos intermedios suelen ser más estables que los filamentos de actina o los microtúbulos y no exhiben el comportamiento dinámico asociado a estos otros elementos de¡ citoesqueleto (p. ej., el intercambio rotatorio de los filamentos de actina que se muestra en la Fig. 11.4). Sin embargo, las proteínas de filamento intermedio suelen ser modificadas por fosforilación, que puede regular su ensamblaje y desensamblaje en la célula. El ejemplo más claro es la fosforilación de las láminas nucleares (véase Fig. 8.31), que da como resultado en el desensamblaje de la lámina nuclear y la disgregación de la envuelta nuclear durante la mitosis. Los filamentos intermedios citoplasmáticos, como la vimentina, también se fosforilan en la mitosis, lo que produce su desensamblaje y desorganización en las células en división. 5 Organización intracelular de los filamentos intermedios Los filamentos intermedios forman una elaborada red en el citoplasma de la mayoría de las células, extendiéndose a partir de un anillo que rodea al núcleo hasta la membrana plasmática (Fig. 11.33). Tanto los filamentos de queratina como los de vimentina se fijan a la envuelta nuclear, aparentemente con la función de posicionar y anclar el núcleo dentro de la célula. Además, los filamentos intermedios pueden asociarse no sólo con la membrana plasmática sino también con los otros elementos del citoesqueleto, filamentos de actina y microtúbulos. Por lo tanto, los filamentos intermedios proporcionan un andamiaje que integra a los componentes del citoesqueleto y organiza la estructura interna de la célula. Fig 11.33: Organización intracelular de los filamentos de queratina. Micrografía de células epiteliales teñida con anticuerpos fluorescentes contra la queratina (verde). El núcleo se ha teñido de azul. Los filamentos de queratina se extienden a partir de un anillo que rodea al núcleo hasta la membrana plamática. (Nancy Kedersha/ Inmunogen/Photo Researches, Inc.) 6 Fig 11.34: Fijación de los filamentos intermedios a los desmosomas y hemidesmosomas. (A) Micrografía electrónica mostrando filamentos de queratina (flechas) unidos a placas densas de proteínas intracelulares a ambos lados de un desmosoma. (B) Esquema de un desmosoma. Los filamentos intermedios estan anclados a lugares de adhesión célula-célula mediante la desmoplaquina. (C) esquema de un hemidesmosoma.Los filamentos intermedios estan unidos unidos a la integrina por la plectina.(A. Don Fawcett/Photo Researchers, Inc.) Los filamentos de queratina de las células epiteliales están fuertemente anclados a la membrana plasmática en dos áreas especializadas de contacto celular, los desmosomas y hemidesmosomas (Fig. 11.34). Los desmosomas son uniones entre células adyacentes, en las que los contactos célula-célula están mediados por proteínas transmembrana relacionadas con las cadherinas. En su lado citopiasmático, los desmosomas se asocian con una placa densa característica de proteínas intracelulares, a la que se anclan los filamentos de queratina. Estos anclajes están mediados por la desmoplaquina, un miembro de una familia de proteínas denominadas plaquinas, que unen filamentos intermedios y los vinculan a otras estructuras celulares. Los hemidesmosomas son uniones morfológicamente similares entre las células epiteliales y el tejido conectivo subyacente, en las que los filamentos de queratina se unen a las integrinas a través de otros miembros de la familia de las plaquinas (p. ej., plectina). Por lo tanto, los desmosomas y hemidesmososmas unen los filamentos intermedios a regiones de contacto célula-célula o célula-sustrato, respectivamente, de forma similar a como se une el citoesqueleto de actina a la membrana plasmática en las uniones adherentes y en las adhesiones focales. Es importante destacar que los filamentos de queratina anclados a ambos lados de los desmosomas sirven como un nexo mecánico entre las células adyacentes de una capa epitelial, lo que proporciona estabilidad mecánica a todo el tejido. 7 Fig 11.35:Micrografía electrónica de puentes de plectina entre filamentos intermedios y microtúbulos. Micrografía de un fibroblasto teñido con un anticuerpo contra la plectina. La micrografía ha sido coloreada artificialmente para mostrar la plectina (verde), los anticuerpos contra la plectina (amarillo), Los filamentos intermedios (azul), y los microtúbulos (rojo). (Cortesía de Tatiana Svitkina y Gary Borisy, University of Wisconsin / Madison) Además de unir los filamentos intermedios a las uniones celulares, algunas plaquinas unen los filamentos intermedios a otros elementos de¡ citoesqueleto. La plectina, por ejemplo, se une a filamentos de actina y a microtúbulos además de a filamentos intermedios, por lo que puede proporcionar puentes entre estos componentes del citoesqueleto (Fig. 11.35). Se piensa que estos puentes con los filamentos intermedios refuerzan y estabilizan los filamentos de actina y los microtúbulos, lo que incremento la estabilidad mecánica de la célula. Dos tipos de filamentos intermedios, la desmina y los neurofilamentos, desempeñan un papel especializado en el músculo y en las células nerviosas, respectivamente. La desmina conecta los ensamblajes individuales de actinamiosina de las células musculares entre sí y a la membrana plasmática, vinculando de esta manera la acción de los elementos contráctiles individuales. Los neurofilamentos son los filamentos intermedios principales en la mayoría de las neuronas maduras. Son particularmente abundantes en los largos axones de las motoneuronas, donde parece que se anclan a los filamentos de actina y a los microtúbulos a través de miembros neuronales de la familia de las plaquinas. Se piensa que los neurofilamentos desempeñan un papel importante en proporcionar soporte mecánico y en estabilizar otros elementos del citoesqueleto en estas extensiones largas y delgadas de las células nerviosas. 8 Funciones de las queratinas y neurofilamentos: enfermedades de la piel y sistema nervioso Aunque durante mucho tiempo se ha considerado que los filamentos intermedios proporcionan un soporte estructural a la célula, sólo recientemente se ha obtenido una evidencia directa de su función. Algunas células en cultivo no fabrican proteínas de filamentos intermedios, lo que indica que estas proteínas no se requieren para el crecimiento de las células n i vitro. De forma similar, al inyectar anticuerpo contra vimentina en células cultivadas se disgregan las redes de filamentos intermedios sin afectar al crecimiento celular o al movimiento. Por lo tanto, se ha pensado que los filamentos intermedios se necesitan principalmente para fortalecer el citoesqueleto de las células en los tejidos de los organismos multicelulares, donde éstos están sujetos a una gran variedad de tensiones mecánicas que no afectan a las células en el ambiente aislado de una placa de cultivo. La evidencia experimental de tal papel in vivo de los filamentos intermedios se obtuvo por primera vez en 1991 mediante estudios en el laboratorio de Elaine Fuchs. Estos investigadores utilizaron ratones transgénicos para investigar los efectos in vivo de la expresión de un mutante de deleción de queratina, que codificaba un polipéptido incompleto que imposibilitaba que se formaran filamentos normales de queratina (Fig. 11.36). Este gen mutado de queratina se introdujo en los ratones transgénicos, donde fue expresado en las células basales de la epidermis e impedía la formación de un citoesqueleto de queratina normal. Este hecho desembocó en el desarrollo de alteraciones graves en la piel, incluyendo ampollas debido a lisis celular epidérmica tras un trauma mecánico suave, tal como frotarse la piel. De esta forma las alteraciones de la piel de estos ratones transgénicos supusieron un apoyo directo al supuesto papel de las queratinas en proporcionar resistencia mecánica a las células epiteliales de los tejidos. 9 Fig 1136: Demostración experimental de la función de la queratina. Un plásmido que codifica una queratina mutante que interfiere en el ensamblaje normal de los filamentos de queratina se microinyectó dentro de un pronúcleo de un huevo fecundado. El embrión microinyectado fue entonces transferido a una madre de alquiler. Y algunos miembros de la descendencia incorporaron el gen de la queratina mutante en su genoma. La expresión del gen mutado en estos ratones transgénicos alteró el citoesqueleto de queratina de las células de la epidermis, dando lugar a la aparición de ampollas en la piel debido a lisis celular tras una tensión mecánica suave 10 Estos experimentos también apuntaron a la base molecular de una enfermedad genética humana, la epidermolisis bullosa simple (EBS). Al igual que los ratones transgénicos que expresan los genes de queratina mutante, los pacientes con esta enfermedad desarrollan ampollas en la piel como consecuencia de una lisis celular después de un trauma leve. Esta similitud condujo a realizar estudios de los genes de la queratina en los pacientes EBS, que demostraron que la EBS está causada por mutaciones en el gen de la queratina que interfieren en el ensamblaje normal de los filamentos de queratina. De esta forma, tanto los estudios experimentales en ratones transgénicos como el análisis molecular de una enfermedad genética humana han demostrado el papel de las queratinas en permitir soportar tensiones mecánicas a las células de la piel. Estudios posteriores han mostrado que las mutaciones en otras queratinas son responsables de otras enfermedades congénitas de la piel, que se caracterizan de forma similar por una fragilidad anormal en las células epidérmicas. Otros estudios en ratones transgénicos han implicado a neurofilamentos alterados en enfermedades de las neuronas motoras, particularmente en la esclerosis lateral amiotrófica (ELA). La ELA, conocida como enfermedad de Lou Gehrig y como la enfermedad que afecta al renombrado físico Stephen Hawking, resulta de una pérdida progresiva de las neuronas motoras, que a su vez conduce a una atrofia muscular, parálisis, y posterior muerte. La ELA y otros tipos de enfermedades de las motoneuronas se caracterizan por la acumulación y ensamblaje anormal de los neurofilamentos, lo que sugiere que las alteraciones en los neurofilamentos podrían contribuir a estas patologías. De acuerdo con esta posibilidad, se ha hallado que la sobreexpresión de NF-L o de NF-H en ratones transgénicos da lugar al desarrollo de un estado similar a la ELA. Aunque aun no se comprenden los mecanismos implicados, estos experimentos sugieren claramente que los neurofilamentos intervienen en la patogénesis de las enfermedades de las neuronas motoras. 11