Técnicas para la determinación de compuestos
Anuncio

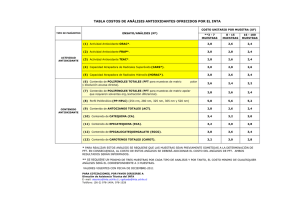
Técnicas para la determinación de compuestos antioxidante en alimentos. – Laura Agudo Medina – ISSN: 1989-9041, Autodidacta © TÉCNICAS PARA LA DETERMINACIÓN DE COMPUESTOS ANTIOXIDANTE EN ALIMENTOS. Laura Agudo Medina biomedina@hotmail.com 1.- RADICALES LIBRES Y COMPUESTOS ANTIOXIDANTES Radical libre (RL) es cualquier especie química capaz de existir de forma independiente y que presenta uno o más electrones desapareados en su estructura. Como consecuencia, son altamente reactivos lo que hace que tengan una vida media del orden de milisegundos, aunque varía según el tipo de radical libre (Halliwell y col., 1992). Los radicales libres también son conocidos como especies reactivas oxigénicas o del oxígeno, ROS, y especies reactivas del nitrógeno, RNS. A bajas concentraciones los radicales libres son necesarios para el buen funcionamiento celular pudiendo actuar como segundos mensajeros estimulando la proliferación celular y/o actuando como mediadores para la activación de las células. Sin embargo, un exceso de los mismos puede acumularse hasta niveles tóxicos dando como resultado que se produzcan diversas acciones sobre el metabolismo de los principios inmediatos, que pueden ser origen del daño celular (Davies, 1995). La capacidad que tenga cada radical libre para actuar como agente oxidante está determinada por factores como su reactividad, especificidad, selectividad y difusibilidad. Son responsables del daño oxidativo de macromoléculas biológicas como el DNA, lípidos, carbohidratos y proteínas. Participan en los mecanismos fisiopatológicos de muchas enfermedades, como algunos tipo de cáncer, diabetes, patologías cardiovasculares, procesos reumáticos, patologías gastroentéricas, afecciones broncopulmonares o procesos neurodegenerativos. También están implicados en procesos fisiológicos como el envejecimiento, el daño causado por el ejercicio físico agotador y otros. Aunque se produce un gran daño oxidativo, el organismo ha desarrollado un sistema de defensa antioxidante que intenta evitar o neutralizar la agresión. Un antioxidante es “cualquier sustancia que en presencia de un sustrato oxidable retrasa o inhibe la oxidación del mismo” (Mataix y Battino, 2002). Se caracterizan por ser muy heterogéneos, pueden ser hidrosolubles y liposolubles, localizarse intra y extracelularmente, y proceder de diferentes fuentes ya que algunos son nutrientes o proceden de éstos y otros son productos del metabolismo. 27 Técnicas para la determinación de compuestos antioxidante en alimentos. – Laura Agudo Medina – ISSN: 1989-9041, Autodidacta © Los antioxidantes pueden actuar: A. Previniendo la formación de ROS. B. Interceptando el ataque de ROS. C. Secuestrando los metabolitos reactivos y convirtiéndolos en moléculas menos reactivas. D. Facilitando la reparación del daño causado por ROS. E. Manteniendo un ambiente favorable para la actuación de otros antioxidantes. F. Amplificando la resistencia de las dianas biológicas sensibles al ataque de ROS. Según el modo de acción, los antioxidantes se clasifican en primarios, secundarios ó terciarios: Primarios: Impiden la formación de radicales libres, frenan la reacción en cadena de los radicales libres, especialmente de las especies reactivas del oxígeno (ROS) ó son quelantes de metales de transición. Se comportan como captadores de estos ROS. Secundarios: Interrumpen la reacción de propagación de los radicales libres ó desplazan las especies reactivas del oxígeno (ácido ascórbico, carotenoides, glutation y la mayoría de las enzimas antioxidantes). Terciarios: Reparan el daño causado a las moléculas por los radicales libres ó eliminan aquéllas que se han estropeado. En el organismo humano los radicales libres están controlados mediante un amplio espectro de antioxidantes de origen endógeno (enzimas antioxidantes, glutatión, albúmina, transferrina, ácido úrico, bilirrubina) y exógenos a través de la dieta (vitamina E y C, carotenoides, selenio, compuestos fenólicos) (Gutteridge, 1995). Entre los componentes del sistema antioxidante endógeno destacan las enzimas antioxidantes: catalasa, superóxido dismutasa (SOD) y glucosa fosfato deshidrogenasa. La SOD es una enzima distribuida en todo el organismo. Hay dos tipos intracelulares de SOD: la que está presente en la mitocondria, que contiene manganeso en su centro activo (Mn-SOD) y la del citosol, que tiene iones de cobre y zinc (Cu-Zn-SOD). La Catalasa es una enzima intracelular que se localiza en el interior de los glóbulos rojos. El equilibrio entre la actividad de la Catalasa respecto de SOD es fundamental para mantener el balance REDOX. La GPx es un complejo enzimático, existen cuatro formas diferentes de esta enzima y todas ellas tienen selenio en su centro activo (Holben DH y col., 1999). Cuando la agresión supera las defensas se habla de estrés oxidativo, es decir, el balance oxidativo entre la producción de radicales libres y las defensas antioxidantes se rompe. Si esto ocurre las especies reactivas generadas pueden iniciar procesos 28 Técnicas para la determinación de compuestos antioxidante en alimentos. – Laura Agudo Medina – ISSN: 1989-9041, Autodidacta © patológicos graves envejecimiento. como diabetes, cáncer, enfermedades cardiovasculares, 2.- BENEFICIOS QUE SE OBTIENEN DE UNA DIETA RICA EN POLIFENOLES. Son numerosos los estudios que han mostrado que los polifenoles poseen propiedades antioxidantes, inhibiendo la peroxidación lipídica y captando radicales libres hidroxilo, supéroxido y alcoxi (Sichel et al., 1991). Protegen de la oxidación a las lipoproteínas de baja densidad (LDL) desempeñando un papel clave en la prevención de la aterosclerosis. También pueden prevenir la trombosis, inhibiendo la agregación plaquetaria, la permeabilidad y fragilidad capilar (Mazza, 2000). Son considerados reguladores del sistema inmune y como antiinflamatorios, probablemente debido a la modulación del metabolismo del ácido araquidónico, reduciendo los niveles de tromboxano. Modulan la actividad enzimática de la ciclooxigenasa, lipoxigenasa, fosfolipasa A2, hialuronidasa, e inhiben la acción de la angiotensina convertasa, mieloperoxidasa (que produce el hipoclorito y otros prooxidantes) y xantinooxidasa (que produce los radicales superóxido). Hay que destacar el potencial anticarcinógeno, ya que pueden estimular el bombeo de ciertos agentes cancerígenos hacia el exterior de las células o bien activar a las enzimas de detoxificación (Mazza, 2000). 3.- EXTRACCIÓN DE COMPUESTOS ANTIOXIDANTES DE LOS ALIMENTOS Los compuestos antioxidantes de los alimentos se extraen con disolventes de diferentes polaridades de acuerdo con el carácter hidrofílico o lipofílico de los compuestos que se desean evaluar. El disolvente más comúnmente utilizado en la obtención de extractos lipofílicos es el hexano. También se han utilizado el eter dietílico y cloruro de metileno entre otros. Para la extracción de compuestos con carácter hidrofílico se han utilizado metanol, etanol, mezclas de etanol/agua, acetona/agua y metanol/agua así como extracción en medio ácido (pH=2) con metanol/agua, seguida de acetona/agua y agua/acetonitrilo en medio ácido, todos ellos ensayados en diferentes proporciones. Recientemente se ha observado que el tipo de disolvente y la polaridad puede afectar a la transferencia del electrón singlete y a la del átomo de hidrogeno, los cuales son esenciales en la medida de la capacidad antioxidante. Asimismo, la presencia de compuestos no antioxidantes (ciertos aminoácidos y ácidos uránicos) en los extractos ensayados, también pueden afectar a estos resultados. Esto sugiere que la comparación de resultados sea solo llevada a cabo en muestras en las que se utiliza el mismo método y el mismo disolvente de extracción y que las sustancias interferentes deben ser comprobadas. (Pérez Jimenez y col, 2006). 3.1. Técnicas para la determinación de la actividad antioxidante La determinación de la actividad antioxidante de los alimentos es importante para predecir el potencial antioxidante in vitro de los mismos antes de ser ingeridos; así mismo, nos permite determinar la protección frente a la oxidación y el deterioro del alimento que disminuye su calidad y valor nutricional. 29 Técnicas para la determinación de compuestos antioxidante en alimentos. – Laura Agudo Medina – ISSN: 1989-9041, Autodidacta © Los métodos de determinación de la actividad antioxidante se basan en distintos sistemas generadores de radicales libres. Dichos radicales reaccionarían con la muestra y en virtud de la capacidad antioxidante de esta se inhibiría la generación de los primeros. Así, lo que se determina realmente es el efecto antioxidante ya que la actividad antioxidante no se puede medir de forma directa. Lo ideal seria medir la actividad antioxidante de cada componente de la muestra por separado, sin embargo, y sobre todo en el caso de muestras naturales, es muy difícil determinar el número y concentración de los compuestos antioxidantes presentes en la muestra. En la actualidad, debido a la complejidad de los procesos de oxidación, no existe un método que refleje de forma completa el perfil antioxidante de una muestra, por tanto, es bueno trabajar con varios métodos para facilitar la comparación e interpretación de los resultados. Las características “ideales” que debe reunir un método de determinación de capacidad antioxidante son: sencillez, mecanismo químico definido y punto final fijo, reproducibilidad, adaptabilidad a sustancias antioxidantes hidrofílicas y lipofílicas y elevado rendimiento de análisis. Las medidas de la actividad antirradicalaria se pueden realizar mediante dos estrategias distintas, en función de la información que se desea obtener (SánchezMoreno, 2002): ● Determinación directa: El radical se emplea como un factor de cuantificación (produce una señal analítica). La adición del antioxidante, antes o después de la generación del radical, provoca una disminución de la señal. En el ensayo de postadición se forma el radical en ausencia de la muestra y así, cuando se añade la sustancia antioxidante se produce un descenso en la señal debido a la disminución de la concentración del radical. En ensayos de inhibición, la muestra se añade a los sustratos de oxidación antes que sea generado el radical, La reacción comienza con la adición del oxidante (ABTS●+, DPPH, etc). Determinación indirecta: La presencia de radicales libres produce la pérdida o aparición de un reactivo, y por tanto, en presencia de un antioxidante se provoca el aumento o disminución de la señal (métodos, ORAC, FRAP, etc). 3. 1. 1.sulfónico). Método del ABTS●+ (Ácido 2,2’-azinobis (3- etilbenzotiazolín)-6- El radical ABTS●+ se genera a partir de su precursor el Ácido 2,2’-azinobis (3etilbenzotiazolín)-6-sulfónico (ABTS), ver figura 11 (Ronald L. Prior, 2005). El radical catiónico obtenido es un compuesto de color verde-azulado, estable y con un espectro de absorción en el UV-visible. Es un radical artificial que no mimetiza bien la situación in vivo, termodinámicamente puede ser reducido por compuestos que tengan un potencial redox menor que el del ABTS (0.68V), pudiendo reaccionar con el radical, muchos compuestos fenólicos con un potencial más bajo. El punto final de la reacción lo marca la sustancia antioxidante empleada, fijando tiempos cortos o muy elevados que pueden interferir en los resultados finales, lo cual, es un inconveniente. La ventaja de este ensayo es que puede realizarse tanto en muestras hidrosolubles como liposolubles, eligiendo el disolvente apropiado en cada caso. Existen varios métodos de generación del radical ABTS●+: 30 Técnicas para la determinación de compuestos antioxidante en alimentos. – Laura Agudo Medina – ISSN: 1989-9041, Autodidacta © - Enzimáticamente (mioglobina, peroxidasa de rábano). - Químicamente (Dióxido de manganeso, persulfato potásico, radicales peroxilo). - Electroquímicamente. En el presente estudio, se ha realizado el método ABTS●+ generando el radical químicamente utilizando persulfato potásico. La oxidación con persulfato potásico se lleva a cabo a temperatura ambiente, en ausencia de luz, en un tiempo de 12 a 16 h. El persulfato potásico y el ABTS reaccionan estequiométricamente (1:0.5). Una vez generado el radical la medida se realiza mediante un ensayo de post-adición. Este método se aplica en la determinación de la actividad antioxidante de frutas, verduras, bebidas estimulantes. Preparación de reactivos: - ABTS 7mM. Para 10 ml Disolver 0,0384 g de sal amónica cristalizada de ABTS en 10 ml de agua destilada. - Solución persulfato potásico 2,45mM. Para 100 ml Disolver 0,0662 g del reactivo en 100 ml de agua destilada. -Etanol al 96 % v/v. - Preparación radical ABTS*. Mezclar a partes iguales la solución de ABTS 7mM y la de persulfato pototásico 2,45mM. La mezcla se mantiene en oscuridad a temperatura ambiente durante 16 horas para la formación del radical. Esta solución es estable durante dos días. La solución de ABTS* se diluye con etanol para obtener una absorbancia de 0,8 730 nm. Esto se consigue mezclando 2,5 ml de la solución del radical con aproximadamente 100 ml de etanol. Recta de calibración con la disolución de TROLOX. La solución madre se prepara disolviendo 0,01gr de Trolox en 5 ml de metanol y 5ml de agua destilada. A partir de esta solución se hacen las diluciones que serán los distintos puntos de la recta, con unas concentraciones de 19, 39, 59, 79, 99, 119, 159 y 199 µM. 3.1.2.- Método FRAP (Ferric ion Reducing Antioxidant Power).Benzi y strain, 1996; Pulido y col; 2000 En este método se determina la capacidad antioxidante de forma indirecta. Se basa en el poder que tiene una sustancia antioxidante para reducir el Fe 3+ a Fe2+ que es menos antioxidante. El complejo férrico-2,4,6-tripiridil-s-triazina (TPTZ) incoloro es reducido al complejo ferroso coloreado. Se trata de un método espectrofotométrico ya que se mide la absorbancia del Fe 2+. Así, cuanto más antioxidante es la sustancia objeto de estudio, mayor es la reducción y mayor la concentración de Fe2+ y más alta la señal de absorbancia. El complejo va a poder ser reducido por productos con potenciales redox menores a 0,7 V (potencial redox del Fe3+ -TPTZ). 31 Técnicas para la determinación de compuestos antioxidante en alimentos. – Laura Agudo Medina – ISSN: 1989-9041, Autodidacta © Debido a que el potencial redox del Fe3+-TPTZ es comparable con el del ABTS se pueden analizar compuestos similares con ambos métodos aunque las condiciones de la reacción sean distintas. El mecanismo del FRAP es de transferencia de electrones, a diferencia de otros métodos donde se produce captura de radicales libres, según esto, el FRAP puede ser útil, en combinación con otros métodos, en la determinación de la capacidad antioxidante de productos que contengan distintos tipos de antioxidantes. Preparación de reactivos: - Ácido clorhídrico (HCl) 40mM. Diluir 535 µl de HCl (37%) en 100 ml de agua destilada. - Solución TPTZ 10 mM. Pesar 0,0312 g del reactivo TPTZ y disolverlos en un matraz de 10 ml con HCl 40 mM. - Solución FeCl3-6H2O 20 mM. Disolver 0,1352 g de FeCl3-6H2O en 25 ml de agua destilada. - Tampón acetato 0,3 mM pH 3,6. Para 250 ml, disolver 0,0061 g de acetato sódico (NaAc) en 200 ml de agua destilada. Ajustar el pH a 3,6 utilizando HCl 40mM, y completar hasta los 250 con agua destilada. - Solución de trabajo diario FRAP: Esta solución de trabajo deberá de prepararse a diario. Mezclar 2,5 ml de solución TPTZ con 2,5 ml de solución FeCl3-6H2O 20 mM y 25 ml de tampón acetato. Esta preparación debe mantenerse durante todo el proceso en el baño a 37ºC. Recta de calibración con la disolución de TROLOX. La solución madre se prepara disolviendo 0,01g de Trolox en 5 ml de metanol y 5ml de agua destilada. A partir de esta solución se hacen diluciones que serán los distintos puntos de la recta, con unas concentraciones de 79, 119, 159, 199, 239, 279, 319, 359 y 399 µM. 3.1.3.- Método ORAC (Oxigen Radical Absorbance Capacity). El fundamento del método ORAC se basa en la habilidad que tienen los compuestos antioxidantes para bloquear radicales libres por donación de un átomo de hidrógeno: X + AH XH + A● En este método, el radical artificial AAPH (2,2’-Azobis-(2-aminopropano)dihidrocloruro) oxida a la fluoresceína de forma que esta pierde su fluorescencia. De esta forma, las sustancias antioxidantes presentes en el extracto obtenido a partir del alimento disminuirían dicha pérdida de fluorescencia. Preparación de soluciones Disolución reguladora de fosfato 75mM pH 7,4. Para 1000 ml, disolver 10,35 g de NaH2PO4, H2O en 800 ml de agua destilada. Ajustar el pH a 7,4 y completar hasta 1 litro. Solución de AAPH 300 mM. Para 10 ml, disolver 0,8136 g de dihidrocloruro de 2,2´azobis-2-amidinopropano en 10 ml de disolución reguladora de fosfato 75 mM pH=7,4. 32 Técnicas para la determinación de compuestos antioxidante en alimentos. – Laura Agudo Medina – ISSN: 1989-9041, Autodidacta © Solución de fluoresceina patrón 7,0 mM. Para 10 ml, disolver 0,0263 g de fluoresceina en 10 ml de disolución reguladora de fosfato 75 mM pH=7,4. Solución diaria de trabajo de fluoresceina 70 mM. Para 50 ml, diluir 10 µl de la solución patrón en disolución reguladora de fosfato 75 mM pH=7,4 y completar hasta 10 ml. De aquí se toman 500 µl y se llevan hasta 50 ml con la misma disolución reguladora. Recta de calibración con la disolución de TROLOX. La solución madre se prepara disolviendo 0,01g de Trolox en 5 ml de metanol y 5 ml de agua destilada. A partir de esta se hacen diluciones que serán los distintos puntos de la recta, con unas concentraciones de 10, 20, 30, 40, 50, 60, 70, 80, 90 y 100 µM. Método Folin-Ciocalteau La medida del contenido de fenoles totales se realiza utilizando el método de Folin– Ciocalteau (Singleton, y col., 1999), que determina la capacidad que tienen los polifenoles para reducir el Mo(VI) a Mo (V), como resultado de tal reacción, el reactivo de color amarillo adquiere un intenso color azul que se mide con el espectrofotómetro. Preparación de reactivos: Reactivo de Folin-Ciocalteau (Sigma- Aldrich) Reactivo de Carbonato sódico al 10%. Disolver 10g de Na2CO3 en 100ml de agua bidestilada. Recta de calibración con la disolución de Ácido gálico. La solución madre se prepara disolviendo 0,01g de ácido gálico en 10ml de agua bidestilada. A partir de esta solución se hacen diluciones que serán los distintos puntos de la recta, con unas concentraciones de 10, 20, 30, 40, 50, 60, 70, 80, 90 y 100 ppm. BIBLIOGRAFÍA Belitz y Grosch. (1988) Química de los alimentos. Ed. Acribia. España, Zaragoza. Christopher Isaac Escamilla Jiménez, Elvis Yane Cuevas Martínez, Jorge Guevara Fonseca. (2009) Flavonoides y sus acciones antioxidantes. Rev Fac Med UNAM Vol. 52 No. 2 Marzo-Abril. Manach C, Scalbert A, Morand C, Rémésy C, Jimenez L. (2004) Polyphenols. Food sources and bioavailability. Am J Clin Nutr; 79: 727-47. Martínez-Valverde I., Periago M.J., Ros G. (2000) Significado nutricional de los compuestos fenólicos de la dieta. Arch. Latinoamer. Nutr. 50, 5-18. Mazza. Alimentos funcionales. (2000) Aspectos bioquímicos y de procesados. Zaragoza, Acribia. Muñoz Jáuregui A.M y Ramos Escudero F. (2007) Componentes fenólicos de la dieta y sus propiedades biomedicinales. Revista horizonte médico. Vol 7, nº 1. Junio. O´Brien, J., Morrissey, P.A. (1989) Nutritional and toxicological aspects of the Maillard browning reaction in foods. Crit. Rev. Food Sci. Nutr., 28, 211-248. 33 Técnicas para la determinación de compuestos antioxidante en alimentos. – Laura Agudo Medina – ISSN: 1989-9041, Autodidacta © Olano, A., Martínez-Castro, I. (1996) Nonenzymatic browning. In Handbook of food analysis. L.M.L. Nollet, Ed. New York: Marcel Decker., 1683-1721. Ou, B.; Huagn, D. Hampsch-Woodill, M. Flanagan, J.A. Deemer, E.K. (2002) Analisys of antioxidant in common vegetable employing oxygen radical absorbance capacity (ORAC) and ferric reducing antioxidant power (FRAP) assays: a comparative study. J.Agric. Food. Chem. 50. 3122-3128. Pérez-Jimenez, J y Saura-Calixto, F; (2006) Effect of solvent and certain food constituents on different antioxidant capacity assays. Food Research internacional, 39, 791-800. Rao A V, S Agarwal. (2000) Role of antioxidant lycopene in cancer and heart disease. J. Am. Coll. Nutr. 19:563-9. Rice-Evans CA, Miller NJ, Paganga G. (1996) Structure-antioxidant activity relationship of flavonoids and phenolic acids. Free Radic Biol Med; 20:933-956. Ronald L. Prior. (2005) Standarized methods for the determination of Antioxidant Capacity and phenolics in foods and dietary supplements. J. Agric. Food Chem. 53, 4290-4302. Sánchez-Moreno, C. (2002) Review: methods used to evaluate the free radical scavenging activity in foods and biological systems. Food Sci. Tech. Int, 8(3), 121-137. Sanz, M.L., Olano, A., del Castillo, M.D. (2003) Nuevos indicadores químicos para el control de la calidad de alimentos. Alim. Nutri. Salud, 10, 91-99. 34