tabla periódica
Anuncio

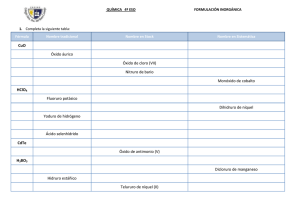
Facultad de Química, UNAM Curso: Química General I, gpo 8 Colección de ejercicios UNIDAD 2 1. Describe cuál fue la contribución al conocimiento de la estructura atómica hecha por cada uno de los siguientes científicos: J. Dalton, J. J. Thomson, R. Millikan, E. Rutherford y J. Chadwick. 2. ¿Cuáles fueron las contribuciones en el ordenamiento de los elementos químicos de: Döbereiner, Newlands, Mendeleiev y Moseley? 3. Completa la información que falta en la siguiente tabla: Especie química N° protones N° neutrones N° electrones Número atómico (Z) Número de masa (A) Fósforo-32 Cl 17 36 Na 11 7+ Mn 25 55 S2- 18 As 42 V5+ 23 23 16 32 33 28 - Br 35 80 Yodo-131 28 Si 4. El elemento oxígeno existe como tres isótopos en la Naturaleza, con 8, 9 y 10 neutrones en el núcleo, respectivamente. (a) Escribe los símbolos químicos completos de esos tres isótopos. (b) Describe las similitudes y diferencias de los tres tipos de átomos de oxígeno. 5. La especie química que contiene 24 protones, 26 neutrones y 22 electrones, tiene la fórmula: a) 50 3 24 X b) 26 2 24 X c) 50 2 24 X d) 50 2 22 X 6. ¿Cuál de las siguientes opciones contiene más electrones que neutrones? a) 25 2 12 X b) 26 13 X c) 75 3 33 X d) 33 2 16 X 7. Escribe el símbolo del isótopo constituido por 92 protones, 92 electrones y 143 neutrones. 8. Un isótopo tiene A=140 y en su núcleo hay 84 neutrones, ¿cuánto vale Z? 9. Un isótopo tiene Z=92 y A=230. Calcula el número de neutrones que tiene. Semestre 2014-2 1 NMLV/GHM 10. El siguiente esquema es una representación de 20 átomos de un elemento ficticio al que llamaremos nevadio (Nv). Los círculos negros son 293 Nv y los blancos 295 Nv . Suponiendo que esta muestra es estadísticamente representativa del elemento, calcula el % de abundancia de cada isótopo. Si la masa del nevadio-293 es 293.15 uma y la del nevadio-295 es 295.15 uma, ¿cuál es la masa atómica promedio de ese elemento? 11. Sin consultar una tabla periódica, responde: La configuración electrónica [Xe] 6s2 corresponde a un elemento de la… a) Familia 16, periodo 6 b) Familia 16, periodo 2 c) Familia 2, periodo 6 d) Familia 2, periodo 2 12. El tamaño de los átomos en el 2º periodo de la tabla periódica disminuye de izquierda a derecha. Explica esta tendencia. 13. Explica qué son los electrones de valencia y cuál es su relación con el número de la familia a la que pertenece un elemento. 14. El níquel, el paladio y el platino son integrantes de la familia 10, todos ellos tienen 10 electrones de valencia. ¿Cuál es el grado de oxidación más estable de estos tres elementos? 15. ¿A qué se refiere el número de oxidación de un elemento? Menciona ejemplos. 16. Sin consultar la tabla periódica, escribe las configuraciones electrónicas e identifica los números de la familia y período al que pertenecen cada uno de los elementos cuyos números atómicos se indican a continuación: Z Configuración electrónica N° de familia N° de periodo 4 13 18 50 37 32 Semestre 2014-2 2 NMLV/GHM 17. Los óxidos se pueden agrupar como ácidos, básicos y anfóteros; de acuerdo a esta clasificación, completa la tabla siguiente: Fórmula del óxido ¿Óxido ácido, básico o anfótero? Nombre Óxido de potasio P2O5 Al2O3 Óxido plumboso Óxido de cloro (VII) SO3 BeO Óxido férrico MnO ZnO 18. Completa la información que se solicita en la siguiente tabla: Elemento Ecuación para su reacción con el oxígeno Ecuación para la reacción del óxido con el agua Carácter ácido o básico del óxido Li Na K P Cl S 19. ¿Qué elemento de la siguiente tabla periódica podría formar un óxido de fórmula Y2O3? 1º periodo 2º periodo 3er periodo 1 D G Q 2 Grupos representativos 3 4 5 6 J R T K X L 7 8 E M Z a) R b) G c) J d) L Explica por qué. Semestre 2014-2 3 NMLV/GHM 20. ¿Cuál es el la fórmula más probable para el compuesto que formarían Y y Q? 1º periodo 2º periodo 3er periodo a) b) c) d) 1 2 Grupos representativos 3 4 5 6 X W Y Z P Q R 7 8 S T U M YQ Y2Q Y3Q YQ3 21. Indica (nombre y símbolo) qué elementos de la tabla periódica son gases y cuáles líquidos a temperatura ambiente. 22. Un metal M, forma un óxido de fórmula M2O3. De acuerdo con esto, ¿cuál es la configuración de la capa de valencia del átomo M? a) ns2np1 b) np6 c) 4s13d10 d) 4f7 23. El tamaño de un átomo metálico: a) En un grupo, generalmente se incrementa de abajo hacia arriba en la tabla periódica. b) En un grupo, generalmente se incrementa de arriba hacia abajo en la tabla periódica. c) Generalmente se incrementa de izquierda a derecha en un mismo periodo. d) Es más pequeño que el de sus correspondientes iones. 24. ¿Qué propiedad es característica de los elementos del grupo 1 de la tabla periódica? a) son metales pesados b) son metales duros c) no reaccionan con agua a temperatura ambiente d) tienen bajas energías de ionización 25. ¿En qué se parecen y en qué se distinguen los elementos de un mismo grupo de la tabla periódica? ¿Y los de un mismo periodo? 26. Indica qué inciso contiene a elementos de la misma familia química, para los que no, identifica a los elementos ajenos: a) b) c) d) sodio, potasio, magnesio argón, neón, helio oxígeno, arsénico, azufre nitrógeno, carbono, fósforo Semestre 2014-2 4 NMLV/GHM 27. Señalar en la siguiente plantilla de la tabla periódica lo siguiente: i) Cómo varía, de forma general, el radio atómico en un grupo. ii) Casilla y símbolo para los elementos de mayor y menor electronegatividad. iii) Cuáles elementos son los semimetales o metaloides. iv) Cómo cambia el carácter metálico a lo largo de un periodo. v) Cómo varía la afinidad electrónica de los elementos en una familia. vi) Cómo varía la 1ª energía de ionización de los elementos. vii) Es un elemento sintético. viii) Es el bloque “f”. 28. Analiza las siguientes fórmulas: NaI, MgCl2, CaO, Al2O3, CCl4 y predice qué formula tienen los compuestos formados por cada uno de los siguientes pares de elementos. A continuación de la fórmula, escribe el nombre de cada sustancia: a) C y F _____________________________________________________ b) Al y S ____________________________________________________ c) K y Cl ____________________________________________________ d) Ca y Br ___________________________________________________ e) Ba y O ___________________________________________________ 29. ¿Cuál es una propiedad característica de los elementos de transición? a) b) c) d) Sus sales son incoloras Tienen n° de oxidación variable Forman bases fuertes Tienen comportamiento no metálico Semestre 2014-2 5 NMLV/GHM 30. ¿Cuál par de los siguientes elementos esperarías que exhibieran la mayor similitud en sus propiedades químicas y físicas: B, Ca, F, He, Mg, P? Explica por qué. 31. Los elementos X, Y y Z forman los compuestos: XCl4, XZ2 y YO. ¿Qué fórmula tendrá el compuesto formado por Y y Z? (Considera los estados de oxidación normales del Cl y del O). a) b) c) d) YZ YZ2 Y2Z YZ3 32. Si la fórmula de un óxido es X2O3, ¿Cuál es la fórmula del cloruro de X? a) b) c) d) XCl3 XCl X3Cl XCl6 33. De los siguientes pares de elementos subraya al más electronegativo y encierra en un círculo a los que sean metales. a) Be, Ba b) I, F c) Ca, Br d) Fe, Ar e) P, Zn 34. Representa en una gráfica las temperaturas de fusión de los metales alcalinotérreos contra sus números atómicos. ¿Qué conclusión puedes obtener de esta gráfica? Elemento Be Mg Ca Sr Ba T de fusión (°C) 1283 650 851 770 710 N° atómico 4 12 20 38 56 35. Consulta en la bibliografía las T de ebullición de estos elementos y elabora una gráfica similar a la de la pregunta anterior. ¿Qué tendencia se observa? NOTA: resolver estos ejercicios en su cuaderno, no son para entregar. A partir del jueves 27-feb se revisarán las respuestas en clase, solicitando la participación de los alumnos. Semestre 2014-2 6 NMLV/GHM