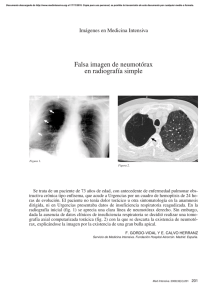
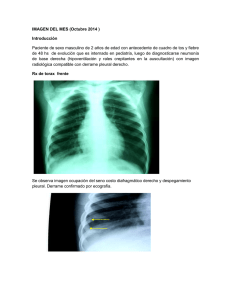
neumotórax - Osakidetza
Anuncio

NEUMOTÓRAX Hospital Universitario Donostia 47 PROTOCOLO NEUMOTÓRAX AUTORES Coordinador: Carlos Hernández Ortiz • José M. Izquierdo Elena. Cirugía Torácica. Hospital Donostia. • Jon Zabaleta Jiménez. Cirugía Torácica. Hospital Donosita. • Borja Aguinagalde Valiente. Cirugía Torácica. Hospital Donostia. • Ana Martínez Benito. DUE consulta externa Cirugía Torácica. • Belén Ferrereras Ibeas. DUE Sala Hospitalización Cirugía Torácica • José Ángel Redin Espinal. Servicio de Urgencias. Hospital Donostia • Hur Lertxundi Arrieta. Servicio de Urgencias. Hospital Donostia. • Miguel Basabe Zapirain. Servicio de Urgencias. Hospital Donostia. • Carolina De Miguel García. DUE. Servicio de Urgencias. Hospital Donostia. • M. Carmen Andonegui Melida. Servicio de Urgencias. Hospital de Mendaro. • Francisco J. Esponda Inchauspe. Servicio de Urgencias. Hospital de Zumárraga. • Juan M. Iñiguez de Heredia Bengoechea. Servicio de Urgencias. Hospital Comarcal del Bidasoa. • Alejandro Masíe Mebuy. Servicio de Urgencias. Hospital del Alto Deba. • Victoria Garay Pelegrin. Equipo Médico de Valoración de Incapacidades de Guipúzcoa. Fecha de aprobación: 2 de marzo de 2012 Komunikazio Unitatea / Unidad de Comunicación DONOSTIA OSPITALEA / HOSPITAL DONOSTIA Depósito Legal: SS-677-2012 PROTOCOLO NEUMOTÓRAX Hospital Universitario Donostia NEUMOTÓRAX Indice 1. METODOLOGÍA ................................................................................................. 5 2. INTRODUCCIÓN................................................................................................. 5 3. FISIOPATOLOGÍA DEL NEUMOTÓRAX.................................................................. 7 4. SEMIOLOGÍA 5. EXPLORACIONES COMPLEMENTARIAS................................................................ 9 6. OPCIONES DE TRATAMIENTO.............................................................................. 9 7. TRATAMIENTO QUIRÚRGICO............................................................................. 10 8. EVACUACIÓN DEL AIRE PLEURAL. TÉCNICAS DE DRENAJE TORÁCICO.............. 8.1. PUNCIÓN-ASPIRACIÓN........................................................................... 8.2. TÉCNICA DE SELDINGER........................................................................ 8.3. DISECCIÓN ROMA.................................................................................. 8.4. Complicaciones de los drenajes..................................................... 16 8.5. Cuidados básicos del drenaje pleural.......................................... 17 9. DEFINICIÓN DE CONCEPTOS............................................................................. 18 ................................................................................................. 8 10. TRATAMIENTO Y SEGUIMIENTO........................................................................ 10.1. NEUMOTÓRAX ESPONTÁNEO IDIOPÁTICO.............................................. 10.1.1. PRIMER EPISODIO NEI PEQUEÑO ESTABLE, ASINTOMÁTICO.... 10.1.2. PRIMER EPISODIO NEI PEQUEÑO ESTABLE, CON SÍNTOMAS... 10.1.3. PRIMER EPISODIO NEI PEQUEÑO INESTABLE, O GRANDE....... 10.1.4. NEI RECIDIVANTE.................................................................... 10.2. NEUMOTÓRAX ESPONTÁNEO SECUNDARIO............................................ 10.3. NEUMOTÓRAX CATAMENIAL.................................................................. 10.4. NEUMOTÓRAX TRAUMÁTICO.................................................................. 10.5. NEUMOTÓRAX IATROGÉNICO................................................................. 10.6. NEUMOTÓRAX POR BAROTRAUMA......................................................... 10.6.1. PACIENTES EN VENTILACIÓN ASISTIDA................................... 10.6.2. NEUMOTÓRAX Y BUCEO........................................................... 10.6.3. NEUMOTÓRAX Y TRANSPORTE AÉREO..................................... 10.7. NEUMOTÓRAX A TENSIÓN..................................................................... 11 12 14 15 19 19 20 20 20 21 22 22 23 23 24 24 24 25 26 11.BIBLIOGRAFÍA ............................................................................................... 27 ANEXO I. PRESIONES INTRATORÁCICAS DURANTE LA VENTILACIÓN......................... 32 3 ANEXO II. CONSENTIMIENTO INFORMADO PARA EL DRENAJE PLEURAL................... 33 ANEXO III. LOCALIZACIÓN DE UN DRENAJE TORÁCICO ANTERIOR............................. 34 ANEXO IV. PUNTOS DE REFERENCIAS TORÁCICOS.................................................... 35 ANEXO V. INFORMACIÓN PARA EL PACIENTE CON NEUMOTÓRAX............................. 36 ANEXO VI. RECOMENDACIONES TRAS PUNCIÓN-ASPIRACIÓN .................................. 37 ANEXO VII. RECOMENDACIONES DESPUÉS DE LA VIDEOTORACOSCOPIA ................. 38 ANEXO VIII. RECOMENDACIONES DESPUÉS DEL DRENAJE PLEURAL........................ 39 NEUMOTÓRAX 1. METODOLOGÍA Esta es una puesta al día de nuestro Protocolo Neumotórax que comenzamos a utilizar en 1994. El objetivo de dicho protocolo fue utilizar un procedimiento de tratamiento del neumotórax (Nx) basado en la punción aspiración ambulatoria. Fue una innovación terapéutica, ya que hasta entonces todos estos pacientes se hospitalizaban en el Servicio de Cirugía Torácica como mínimo durante cuatro días y se les trataba con drenaje pleural aspirativo, cumpliendo la normativa SEPAR* vigente1. Este proyecto fue Becado por el Departamento de Sanidad del Gobierno Vasco (nº 29340.OEJ) y por el Fondo de Investigaciones Sanitarias (FIS 97/1239) y obtuvo el 2º Premio Arthur Andersen a la Innovación en la Gestión y Administración Sanitaria (Madrid, 1995). En 1999 divulgamos nuestros resultados2 y en 2006 publicamos el Protocolo Neumotórax del Hospital Donostia3. Entre otras ventajas conseguimos, disminuir las hospitalizaciones por neumotórax espontáneo idiopático (NEI), que los pacientes hospitalizados por esta patología estén menos tiempo ingresados, y que se traten en el hospital más cercano a su residencia. Para esta actualización del Protocolo, hemos creado un grupo de trabajo con especialistas de Cirugía Torácica, especialistas de los Servicios de Urgencias de todos los hospitales públicos de la red sanitaria de Guipúzcoa, un especialista en neumología del Equipo de Valoración de Incapacidades de Guipúzcoa, y con Diplomados Universitarios en Enfermería de Cirugía Torácica y de Urgencias. Basados en la experiencia adquirida en estos 17 años y en la revisión bibliográfica actual, redactamos un primer borrador, con los cambios que hemos considerado oportunos. Este borrador, se ha ido discutiendo y modificando con las aportaciones de todos los miembros del grupo. Finalmente, el último manuscrito se ha consensuado entre todos los Servicios implicados. 2. INTRODUCCIÓN El neumotórax se define como la presencia de aire en el espacio pleural que transforma la presión habitualmente negativa en continuamente positiva, con el consiguiente colapso pulmonar. Dependiendo de su etiología seguimos clasificándolos en espontáneos y adquiridos. Los neumotórax espontáneos ocurren en ausencia de traumatismo torácico y se clasifican en idiopáticos y secundarios (Tabla 1). *Sociedad Española de Patología del Aparato Respiratorio. 5 NEUMOTÓRAX Tabla 1. Clasificación etiológica de los neumotórax Neumotórax Espontáneos • Primario o idiopático (sin alteración pulmonar clínica aparente) • Secundario (con alteración pulmonar clínica) • Catamenial Neumotórax Adquiridos • Traumático • Iatrogénico • Neumotórax por barotrauma Neumotórax a tensión El NEI es el más frecuente de todos y constituye un problema socioeconómico importante, tanto por su incidencia como por su tendencia a recidivar. Afecta a pacientes jóvenes (promedio de 20 años) y sin enfermedad pulmonar conocida. El cálculo aproximado de su incidencia en Guipúzcoa, fue de 8,2/100.000 habitantes/año2. Sólo en nuestro Hospital durante los últimos 10 años (1/1/2001 al 31/12/2010) se diagnosticaron 1.016 casos de neumotórax, de estos, 182 (18%) se consideraron NEI. Dentro de este grupo (NEI), 150 son hombres y 32 mujeres y el 75% era fumador en el momento del Nx. En el 54% el Nx fue izquierdo y en el 46% derecho. Se llaman Nx espontáneos secundarios, aquellos que se producen en pacientes con alguna enfermedad pulmonar subyacente (EPOC, infecciones pulmonares, déficit de alfa 1 antitripsina, fibrosis quística, histicitosis X,…). Cuando el Nx se presenta en una mujer y el episodio coincide con el ciclo menstrual, hay que tener en cuenta la posibilidad de que se trate de un Nx catamenial. En cuanto al tratamiento, existe una gran variabilidad de procedimientos en la literatura médica4. Durante años el Nx se consideró una complicación de la tuberculosis hasta que Gailliard, en 1888 informa de pacientes en los que la tuberculosis no es la causa y acuña el término “neumotórax del soldado”; destaca su benignidad y propone su tratamiento con reposo. El drenaje no se empezó a utilizar hasta bien entrado el siglo XX. En la actualidad, a pesar de la eficacia de la punción aspiración ambulatoria en el primer episodio del NEI, aún no se utiliza todo lo que debiera fuera del Reino Unido. En España1, hasta la cuarta actualización de la “Normativa sobre diagnóstico y tratamiento del neumotórax” de la SEPAR en 20085, no se incorpora la aspiración simple ambulatoria, como método equiparable en resultados al drenaje convencional,... En 1937, Isaac A. Bigger realiza la primera toracotomía para resección de bleps (bullas < 2cm) subpleurales y en la década siguiente comienza a usarse de forma generalizada en ciertos casos de Nx. En los años 70 del siglo pasado, las minitoracotomías axilares o laterales reemplazan a la posterolateral clásica y a finales de la década de los 80, se desarrolla la tecnología videotoracoscópica6 “VATS” (video-assisted thoracopscopic surgery). En nuestro hospital comenzamos a utilizar la técnica VATS para tratar los neumotórax a principios de los 90. 6 NEUMOTÓRAX 3. FISIOPATOLOGÍA DEL NEUMOTÓRAX En reposo, la presión en el espacio pleural es inferior a la atmosférica (unos 5 cm de H2O menos). Los valores más bajos de presión intrapleural (ANEXO I), se producen al expandirse la caja torácica durante la inspiración forzada (hasta – 100 cm de H2O) y los más altos al final de una espiración forzada (hasta + 80 cm de H2O). La presión intrapleural no es uniforme, a nivel apical la presión es más negativa que a nivel de la base. Esta diferencia provoca una mayor distensión de los alvéolos apicales. Este contraste puede ser incluso mayor en individuos altos, lo que favorecería la rotura alveolar o la aparición de bullas apicales. Al producirse una perforación en la pleura visceral, el aire alveolar se “escapa” hacia el espacio pleural. La presión intrapleural va perdiendo su negatividad hasta hacerse constantemente positiva y el pulmón va perdiendo volumen hasta el colapso total, si la perforación no cicatriza. Cuando la presión intrapleural se iguala a la atmosférica, el aire pulmonar cesa su movimiento (el paciente deja de ventilar con el pulmón afectado). Además, el aumento de la presión intrapleural produce una disminución del retorno venoso que puede originar una insuficiencia cardíaca de aflujo. La causa habitual de un NEI es la perforación de una bulla subpleural. Se barajan diversas hipótesis sobre su etiología. Quizás la más aceptada actualmente es la propuesta por West7, basada en la rotura alveolar debido a la mayor distensión de los alveolos apicales. El aire escaparía al espacio intersticial, avanzando hasta la pleura visceral donde produciría pequeñas bullas subpleurales, que al romperse causarían el Nx. Se ha comprobado gracias al microscopio electrónico y por medio de técnicas de inmuno-histoquímica, que existe una degradación de las fibras elásticas de la pared de las bullas, debido probablemente a un desequilibrio entre la elastasa y la alfa1antitripsina8. Se desconoce la causa inmediata de la rotura de las bullas subpleurales, es indudable que no está en relación con el esfuerzo físico. Parece razonable establecer una relación entre las caídas bruscas de presión barométricas9 y el desencadenamiento del Nx (factor ambiental climático10). Existe también cierta influencia de la baja altitud geográfica en la incidencia del NEI, así como de la temperatura del aire inspirado, ya que el aumento de temperatura determina un aumento de la presión dentro de las bullas11. Existe una influencia estadísticamente significativa del tabaco, posiblemente debido a la inflamación bronquial que produce, lo que facilitaría una hiperpresión alveolar. Es posible que el ejercicio físico intenso, al favorecer la perfusión pulmonar, evite la producción de Nx en sujetos constitucionalmente predispuestos. Así mismo, el aumento progresivo de la presión arterial pulmonar con la edad mejoraría la perfusión de los vértices, anulando el factor vascular etiológico12. El neumotórax espontáneo secundario, se origina por una patología pulmonar subyacente que provoca una erosión en la pleura visceral. Hemos separado el Nx catamenial ya que tiene características específicas. Su mecanismo etiológico permanece aún confuso. Se ha sugerido que en el 38 % de los casos hay una lesión diafragmática que permitiría el paso de aire intraabdominal acumulado durante la menstruación13. 7 NEUMOTÓRAX El Nx traumático se ocasiona por una lesión pulmonar por impacto, que provoca la entrada de aire en el espacio pleural. La etiología más frecuente es la fractura costal que perfora el parénquima pulmonar. La herida torácica penetrante y las lesiones traumáticas del árbol traqueobronquial se ven menos frecuentemente. En el medio hospitalario, son habituales las técnicas diagnósticas y terapéuticas con riesgo de producir un Nx iatrogénico: PAAF, cateterización venosa central… El Nx por barotrauma, se produce por un aumento excesivo de la presión dentro del sistema respiratorio. Provoca una ruptura de alvéolos, lo que puede dar lugar a un enfisema subcutáneo, un neumomediastino, neumotórax o incluso, embolización arterial gaseosa. Finalmente, cualquier Nx puede convertirse en un Nx hipertensivo. Esta situación se produce por un mecanismo valvular unidireccional, que permite la entrada de aire en la cavidad pleural sin permitir su salida cuando la presión intrapleural supera a la atmosférica. El acumulo progresivo de aire conduce a una hiperpresión intratorácica, con desplazamiento del mediastino contralateralmente. Se pueden generar así, trastornos cardiocirculatorios y ventilatorios muy graves. 4. SEMIOLOGÍA Los NEI ocurren predominantemente en sujetos jóvenes, varones, longilíneos y delgados con buen estado de salud. Los neumotórax secundarios se presentan generalmente en pacientes de mayor edad con patología pulmonar conocida. Habitualmente, la sintomatología depende de la magnitud del Nx y de la reserva funcional respiratoria del sujeto. En el examen físico podemos encontrar a menudo la tríada clásica descrita por Gailliard: 1) Disminución o ausencia de vibraciones vocales 2) Hipersonoridad o timpanismo 3) Disminución o ausencia de murmullo vesicular La comparación entre ambos hemitórax es lo más importante. Un paciente con enfisema pulmonar puede tener estos tres signos en los dos lados, sin tener neumotórax. La radiología es indispensable para confirmar el diagnóstico. En más del 10% de los casos, el Nx es asintomático. Sin embargo, cuando hay síntomas, aproximadamente el 80% presentan clínica en reposo o realizando una actividad normal14: - Dolor torácico (pleurítico) de inicio agudo que se acentúa con los movimientos respiratorios. A veces se irradia hacia el cuello o hacia el abdomen. El dolor puede ser leve o severo al comienzo y continuar como dolor sordo. 8 NEUMOTÓRAX - Taquipnea y disnea, más intensas en enfermos con enfermedad pulmonar previa. - tos seca, o más esporádicamente, expectoración hemoptoica, síncope. - Otras manifestaciones: enfisema subcutáneo; hipoxemia, hipercapnia15; alcalosis respiratoria. Una de las características de los NEI, es el riesgo de recurrencia después de un primer episodio. La tasa de recidivas oscila desde un 25 a un 50 por ciento; la mayoría ocurren dentro del primer año3. El género femenino, la estatura alta, y el fracaso de dejar de fumar se asocian con un riesgo aumentado de recidiva16. 5. EXPLORACIONES COMPLEMENTARIAS Ante la sospecha clínica de Nx, se debe realizar una radiografía de tórax (RxT) posteroanterior y lateral en inspiración para confirmar el diagnóstico. En los casos dudosos, se puede hacer una radiografía en inspiración-espiración, o una TAC torácica. El diagnóstico definitivo se establece visualizando la línea de la pleura visceral en la RxT, además se puede apreciar hiperclaridad y ausencia de la trama vascular. Cuando se diagnostica en el Servicio de Urgencias, es conveniente canalizar una vía venosa, realizar determinación de bioquímica, hemograma, y coagulación; ECG; Saturación de O2, y si ésta es menor del 93% o si el paciente tiene antecedentes respiratorios, se efectuará una gasometría arterial basal15. Actualmente hemos dejado de incluir la TAC torácica de rutina en el estudio de los Nx espontáneos una vez resuelto el primer episodio3. Consideramos justificada esta prueba, sólo si se prevé tratamiento quirúrgico, en los casos de difícil diagnóstico o cuando se sospecha patología pleuropulmonar sobreañadida. 6. OPCIONES DE TRATAMIENTO Disponemos de múltiples opciones de tratamiento: abstención terapéutica y observación domiciliaria (el aire se reabsorbe alrededor del 1 al 2% de su volumen al día17); reposo hospitalario con oxigenoterapia18; punción evacuadora19; catéter pleural fino con o sin aspiración; drenaje pleural grueso (toracostomía cerrada) con o sin aspiración20; drenaje y pleurodesis química (doxiciclina) o talcage; toracoscopia y pleurodesis; VATS con resección de bullas21,22,23,24; toracotomía25; abrasión pleural o pleurectomía. Independientemente del tipo de tratamiento, se debe aconsejar abandonar el tabaco a los fumadores. 9 NEUMOTÓRAX La elección del tratamiento depende de varios factores: volumen del Nx, sintomatología, situación basal del paciente, tipo etiológico, presencia de patología pulmonar, número de episodios, profesión del paciente y la práctica de actividades de riesgo. Como norma general, el primer episodio de un NEI se debe tratar con medios poco agresivos (observación, punción-aspiración, drenaje pleural); en los neumotórax espontáneos secundarios, adquiridos, a tensión o en los NEI recurrentes, hay que añadir otros procedimientos para prevenir las recidivas (drenaje y pleurodesis, cirugía): • Abstención terapéutica, la proponemos en los casos con Nx pequeño y escasa repercusión clínica. La expansión pulmonar se consigue lentamente por reabsorción del aire intrapleural. La filtración del aire se puede acelerar con la administración de oxígeno26. No hay evidencia de que el reposo absoluto sea beneficioso. • Evacuación del aire con punción-aspiración o drenaje pleural27, tiene como objetivo la expansión pulmonar rápida. En nuestra serie de los últimos 10 años, 121 pacientes de los 182 con NEI se trataron con éxito con punción aspiración (66%). No hay evidencia de que mantener una succión permanente aporte beneficio una vez extraído el aire pleural, aunque su uso es frecuente de forma empírica en ciertos casos de fuga aérea mantenida o falta de reexpansión pulmonar completa. El índice de recurrencia tras el tratamiento con aspiración o drenaje pleural se cifra en alrededor del 30% tras un primer episodio de neumotórax espontáneo1. • Pleurodesis a través del drenaje torácico, se hace instilando alguna sustancia irritante como la doxiclina (pH ácido) o el talco (irritación mecánica) en la cavidad pleural. El objetivo es provocar un proceso inflamatorio en ambas serosas pleurales para que se creen adherencias y evitar las recidivas (sólo aconsejable en ciertos casos de Nx espontáneos secundarios). • Tratamiento quirúrgico tiene sus indicaciones específicas como son las recidivas de los NEI y en caso de complicaciones en un primer episodio de Nx. Puede hacerse por VATS o por toracotomía. 7. TRATAMIENTO QUIRÚRGICO El objetivo de la cirugía es doble, por un lado resección de las bullas, zonas patológicas subpleurales o vértice pulmonar, y pleurodesis con o sin pleurectomía parietal apical28. Habitualmente utilizamos la VATS, siempre bajo anestesia general y ventilación mecánica unipulmonar con 3 incisiones axilares de 1 cm. Comparándola con el abordaje abierto (toracotomía axilar, lateral o minitoracotomía posterior), ofrece un postoperatorio menos doloroso, con menor repercusión respiratoria y alta más precoz29,30,31 (1 día de hospitalización postoperatoria frente a 3 - 4 días). La única desventaja es una tasa de recidiva discretamente mayor29,30 (4% frente a 1%). Estas cifras no han variado mucho desde el inicio de la VATS, Landreneau32 y col. informaron en 1993 de un índice de recidivas del 1% con la toracotomía posterolateral, 3,6% con la 10 NEUMOTÓRAX minitoracotomía axilar y cerca del 4% con la VATS. En España, el grupo de Alicante33 obtiene un 1,8% de recurrencias en los Nx primarios y secundarios operados con VATS (seguimiento medio de 14,4 meses) y el Hospital Universitario 12 de Octubre de Madrid34, 5,1% en los Nx primarios post VATS (seguimiento medio de 60 meses). En nuestro Hospital, la recidiva post VATS en los Nx espontáneos primarios y secundarios con un seguimiento de 48 meses es del 3,7%28. La técnica quirúrgica es similar con ambas vías, en la VATS se utilizan grapadoras endoscópicas para la resección parenquimatosa y la pleurodesis la hacemos con gasa u otro material abrasivo, mientras que la pleurectomía se puede hacer de forma parcheada. En la cirugía abierta hacemos toracotomías de unos 6 cm sin sección muscular. La pleurectomía apical en la cirugía abierta se empieza a nivel de la incisión, separando la pleura parietal de la fascia endotorácica hasta el vértice torácico. Después de la cirugía se deja un catéter pleural que se retira habitualmente a las 24 horas. Reservamos la toracotomía para los casos con adherencias mediastínicas o en las recidivas post VATS. Hemos cambiado el listado de las indicaciones quirúrgicas, eliminando las bullas mayores de 2 cm y los Nx con paquipleuritis o asociados a empiema3. Las últimas guías de actuación clínica30,33,34 resumen las indicaciones a los siguientes casos: • En el primer episodio de NEI, por motivos sociales o laborales (tripulación aérea, buzos o personas que viven aisladas o en zonas mal comunicadas). • Neumotórax recidivante • Neumotórax contralateral • Neumotórax bilateral simultáneo • Fuga persistente más de cinco días • Ausencia de reexpansión pulmonar • Neumotórax a tensión o muy mal tolerado clínicamente, en el primer episodio • Neumotórax catamenial • Hemotórax espontáneo importante asociado (más de 1.000 cc o de 200 cc/h en las primeras 3 horas medidos tras la colocación del drenaje o retención intratorácica de coágulos) 8. EVACUACIÓN DEL AIRE PLEURAL. TECNICAS DE DRENAJE TORACICO35 Se debe dar la información del procedimiento al paciente: punción aspiración manual con catéter o catéter/drenaje permanente hasta la resolución del Nx (consentimiento informado, Anexo II). En caso de situación de urgencia o riesgo vital, se debe realizar un consentimiento verbal y reflejarlo en la historia clínica. 11 NEUMOTÓRAX A no ser que esté contraindicado, es aconsejable administrar una premedicación para reducir el estrés y prevenir respuestas vagales exageradas: Morfina (5 mg) asociado a Atropina (0,5 mg) vía intramuscular, 10 minutos antes del procedimiento; o por vía venosa, Morfina (2-3 mg) y Atropina (0,5-1 mg). Se coloca al paciente en posición semi-incorporada (cabecera de la cama a 45º), O2 con Ventimask al 35%, y monitorización, ECG y TA. Por lo general, utilizamos un acceso por el 2º espacio intercostal (borde superior de 3º costilla) en línea medio clavicular. Otra vía fiable es a través del triángulo axilar (por encima de la 4ª o 5ª costilla; ANEXO III y IV). El procedimiento debe ser aséptico: esterilización de la piel, infiltración de anestesia local desde la piel hasta la pleura parietal (Figura 1), toracocentesis para comprobar la salida de aire al aspirar y apertura de la piel con la punta del bisturí del tamaño similar al catéter. 8.1. Técnica de la punción-aspiración con catéter fino: El equipo de catéter fino que utilizamos (Pleurocath®), puede ser de dos tipos: Aguja introductora con jeringa o aguja introductora sin jeringa. Figura 1. Infiltración de anestésico local. Cuando utilizamos el Pleurocath® aguja introductora con jeringa, se punciona con la aguja conectada a la jeringa (Figura 2), introduciendo la punta en la cavidad pleural mientras ejercemos presión negativa con la jeringa de modo que al entrar en la cavidad pleural observamos la salida de aire. Se saca el fiador de la aguja junto a la jeringa y se introduce el catéter por la luz de la aguja (Figura 3), dirigiéndolo hacia el vértice torácico. Conviene introducir el catéter hasta su segunda marca (dos rayas rojas). Después se retira la aguja sosteniendo el catéter para que no se salga (Figura 4), y se fija a la piel con un punto de seda36. 12 NEUMOTÓRAX Figura 2. Punción con aguja introductora conectada a jeringuilla. Cuando manejamos el Pleurocath® sin jeringa, en el momento en que la aguja introductora que contiene el catéter entra a la cavidad pleural, éste se puede hacer progresar con facilidad empujándolo suavemente. En ambos casos, es importante no introducir más de lo necesario la aguja introductora ni realizar cambios de dirección bruscos, para evitar que el bisel lesione un vaso sanguíneo de la pared torácica o el pulmón. Figura 3. Introducción del catéter por la luz de la aguja. 13 NEUMOTÓRAX Después de introducir el catéter hasta la marca de seguridad, se retira la aguja (Figura 4) y se fija el drenaje con un punto a la piel. Finalmente, se conecta el catéter a la llave de 3 pasos y se comienza a aspirar el aire lentamente con una jeringa de 60 cc. Después de evacuar todo el aire hasta un máximo de 3,5 litros, se cierra la llave de tres pasos y se hace un control radiológico inmediato. Si después de extraer 3,5 litros continua aspirándose aire, se conecta a una válvula de Heimlich y se gestiona el ingreso en Cirugía Torácica ante la sospecha de fístula pleuropulmonar. Figura 4. Extracción de la aguja dejando el catéter pleural. 8.2. Técnica de Seldinger: Se introduce la aguja, conectada a la jeringa, en la cavidad pleural y se aspira hasta obtener aire, con lo que se comprueba que se está en el espacio pleural. Se desconecta la jeringa de la aguja y se introduce la guía metálica por la luz de la aguja (Figura 5). Se retira la aguja dejando la guía en su sitio y se introduce un dilatador canulando la guía con un movimiento rotatorio. Se retira el primer dilatador y se vuelve a introducir otro de mayor calibre. Por último se introduce el drenaje torácico definitivo dirigido como siempre por la guía y finalmente se retira la guía dejando el tubo pleural. Esta técnica facilita la maniobra de introducción del drenaje sin necesidad de disección y es útil para drenar hemo-neumotórax traumáticos con fracturas costales, para minimizar los daños en la pared torácica. 14 NEUMOTÓRAX Figura 5. Equipo de drenaje Seldinger 8.3. Disección roma: Después de abrir la piel, se procede a disecar los planos musculares hasta la costilla. Se van separando las fibras musculares abriendo justo lo necesario las pinzas tipo Kocher o las tijeras (nunca hay que cerrar las tijeras en el interior ni avanzar con las tijeras abiertas, el objetivo no es cortar, sino separar). Introducción del drenaje empujando con firmeza el trocar con la palma de la mano derecha en el extremo distal del trocar y poniendo un tope con la mano izquierda cerca de la punta (Figura 6). Una vez dentro de la cavidad pleural, se retira 1 cm el trocar para esconder su punta dentro del tubo y se empuja este, dirigiéndolo hacia el vértice; se retira completamente el trocar y se fija el tubo a la piel con un punto de seda. Se recomienda esta técnica para la introducción de tubos medios/gruesos en casos de Nx complicados (derrame, hemotórax, a tensión,…). Figura 6. Toracostomía cerrada para drenaje pleural. 15 NEUMOTÓRAX 8.4. Complicaciones de los drenajes. Las complicaciones que pueden presentarse durante la colocación de un drenaje pleural son variadas: lesión de vasos de la pared torácica o diafragma con aparición de hematomas de partes blandas o hemotórax, lesión del parénquima pulmonar, sección de parte del catéter fino con el bisel de la aguja, salida del catéter mal fijado, aumento del neumotórax por dejar mal cerrada la llave de tres pasos (Figura 7), edema pulmonar ex-vacuo secundario a la reexpansión pulmonar demasiado rápida, enfisema subcutáneo... Figura 7. Llave de tres pasos del catéter pleural. Si notamos resistencia al introducir un catéter fino, es posible que la punta de la aguja se haya salido de la cavidad pleural y el catéter se haya curvado (Figura 8). En estos casos es muy importante retirar el catéter junto con la aguja para evitar seccionar el catéter con el bisel de la aguja introductora, y comenzar de nuevo la técnica desde el principio. Figura 8. Punta de catéter doblada, si intentamos retirar el catéter sin mover la aguja, el bisel cortará el extremo distal del tubo. No existen contraindicaciones absolutas para la colocación de un drenaje pleural. No obstante, las coagulopatías deben ser corregidas antes de colocar un drenaje. 16 NEUMOTÓRAX 8.5. Cuidados básicos del drenaje pleural. En los catéteres finos, es importante conocer el funcionamiento de la llave de tres pasos, para hacer la extracción del aire y dejarla bien cerrada después de la aspiración (Figura 7). – Comprobar la posición del cierre de la llave de tres pasos. – Vigilar la fijación del catéter a la piel. – Vigilar la estanqueidad de la herida alrededor del drenaje, si es necesario colocar un antiséptico en pasta para sellar bien el orificio. – Controlar el apósito y las posibles codaduras. Si el paciente debe permanecer varios días con el catéter: – Control diario de la permeabilidad. Los drenajes de pequeño calibre se obstruyen con más facilidad, motivo por el cual es conveniente purgarlos una o dos veces al día instilando 3 ml de suero fisiológico a su través. – Si hay asociado derrame pleural, control diario del débito, características del líquido. Un débito hemático superior a 100 ml/h durante más de 6 h o de 150-200 ml/h durante 2-3 h debe hacernos pensar en una valoración quirúrgica tanto si es una hemorragia posquirúrgica como tras un traumatismo, herida penetrante torácica o neumotórax. – Control diario de las fugas aéreas mediante apreciación visual o mediante el medidor de la magnitud de las pérdidas aéreas que incorporan los Pleur-evac®. – Un paciente con el drenaje pinzado que comienza con disnea, se debe conectar a una válvula de Heimlich o a un sello de agua (Pleur-evac®) y abrirlo. Después, avisar al médico de guardia. – El drenaje torácico no debe pinzarse nunca salvo indicación médica. – No deben elevarse los sistemas de sello de agua por encima de la cintura del enfermo para evitar la entrada accidental de su contenido a la cavidad pleural. – El cambio del sistema de sello de agua debe realizarse con rapidez, previo pinzado del drenaje. – Ante la desconexión accidental del drenaje se procederá a su reconexión inmediata y comunicación al médico responsable. – Ante la salida accidental de un drenaje pleural se debe colocar un apósito estéril vaselinado no compresivo sobre el orificio de entrada y se avisará al médico de guardia. 17 NEUMOTÓRAX 9. DEFINICIÓN DE CONCEPTOS • Paciente con neumotórax clínicamente estable: sin disnea, con menos de 24 rpm, entre 60 y 120 lpm, saturación de O > 95% con aire ambiente, y TA normal. • Clínicamente inestable: cualquier paciente que no cumpla la definición de estable. • Tamaño del neumotórax: Hay distintas formas de describir la magnitud del neumotórax, utilizamos cualquiera de las dos siguientes: medición de la distancia entre la superficie pulmonar y la pared torácica en la Rx postero-anterior de tórax en inspiración: se dice que un Nx es pequeño cuando es menor de 2 cm, medida horizontalmente y a nivel de la mitad del pulmón, y neumotórax grande cuando la separación es igual o mayor de 2 cm. Cálculo del volumen del Nx con la fórmula de Light4: Volumen Nx = (1-L3/H3) x 100, o lo que es lo mismo, (H3-L3)/ H3 x 100; donde L es el diámetro del pulmón colapsado y H el diámetro del hemitórax (Figura 9). Decimos que un Nx es pequeño, cuando su volumen es menor del 20% y grande cuando es superior. Figura 9. Cálculo del volumen del neumotórax. • Neumotórax recidivante: decimos que un Nx es recidivante cuando hay una recaída tras un episodio previo después de 24 horas de la retirada del drenaje y aunque sea en el lado contralateral. Se estima que el porcentaje de recidivas del NEI tratado con reposo, punciónaspiración o drenaje, es aproximadamente del 30%. Si la recidiva no es intervenida quirúrgicamente, la posibilidad de episodios recurrentes es muy elevada. • Neumotórax parcial: cuando el Nx es asimétrico, por ejemplo por tener adherencias pleurales o patología pulmonar subyacente. El aire puede quedar atrapado en cavidades pleurales. Se tratarán como los neumotórax de pequeño tamaño. • Drenaje torácico fino o catéter pleural: 8 – 14 Fr/Ch (1 French = 1 Charrier = 0,3 mm de diámetro externo). 18 NEUMOTÓRAX • Drenaje de mediano calibre: 14 – 24 Fr/Ch. • Drenaje grueso: > 24 Fr/Ch. 10. TRATAMIENTO Y SEGUIMIENTO 10.1. NEUMOTORAX ESPONTANEO IDIOPATICO. La SEPAR1,5, la British Thoracic Society37,38 (BTS) y el American College of Chest Physicians39 (ACCP), han publicado sus respectivas guías para el tratamiento de los pacientes con neumotórax espontáneos. La SEPAR en su última actualización de 20085, ha introducido la punción-aspiración ambulatoria en el NEI, como opción terapéutica. La BTS, aconseja punción-aspiración sin hospitalización y el ACCP, hospitalización y drenaje pleural hasta la resolución del Nx. En la red pública de Guipúzcoa y desde 1994, estamos utilizando un protocolo de tratamiento ambulatorio en el NEI2 (Figura 10), basado en la punción-aspiración con catéter fino. El tratamiento lo realizan los médicos de los Servicios de Urgencias Hospitalarias. Figura 10. Algoritmo de tratamiento del neumotórax espontáneo idiopático (NEI) en su primer episodio. (Rx: radiografía simple en inspiración. ¿CT?: valorar avisar a Cirujano Torácico). CET: Consulta externa de Cirugía Torácica. 19 NEUMOTÓRAX 10.1.1. Paciente con un primer episodio de NEI pequeño y asintomático, o con escasos síntomas. - Alta a domicilio con analgésicos y reposo relativo durante 2 semanas. - Hoja de recomendaciones (ANEXOS V y VI). - Seguimiento: Desde el Servicio de Urgencias del Hospital Universitario Donostia se cita directamente a la consulta externa de Cirugía Torácica (CET). Desde los Hospitales Comarcales, se envía una solicitud por correo electrónico (HDO.ZERBITZUTORAXEKO-KIRURGIA.NMTX@ osakidetza.net, teléfono de contacto: 943 00 75 30), con los datos del paciente: nombre y apellidos, fecha del alta, diagnóstico y teléfono. La DUE de la CET organiza la cita con un intervalo máximo de dos semanas informándole telefónicamente al paciente. Es conveniente entregar a los pacientes el informe del Servicio de Urgencias y las radiografías para que las lleven a la CET. - Si después de dos semanas persisten los síntomas o no hay signos de reabsorción del Nx, solicitaremos una TAC y procederemos según los hallazgos: Alta definitiva u hospitalización para drenaje pleural. 10.1.2. Paciente con un primer episodio de NEI pequeño, estable, pero con síntomas (dolor). - Ingreso en observación: oxigenoterapia al 35 %, analgesia intravenosa. - Se realiza radiografía de tórax (RxT) de control, después de 6 horas. Si no hay aumento del Nx y se ha controlado el dolor, se le da de alta y revisión en CET; se recomienda reposo relativo hasta la desaparición del neumotórax y como mínimo durante dos semanas. En caso contrario (aumento del Nx o continua con dolor), punción-aspiración (apartado 10.1.3). 10.1.3.Paciente con un primer episodio de NEI, pequeño e inestable; o paciente con primer episodio de NEI grande y clínicamente estable o inestable. - Punción aspiración con catéter fino en el Servicio de Urgencias, hasta encontrar resistencia, o un máximo de 3,5 litros (Si el volumen de aire aspirado es > 3,5 litros, traslado al SCT con catéter abierto a Válvula de Heimlich). - Tras la aspiración se realiza RxT de control: - Si hay expansión pulmonar: Ingreso en Observación. Catéter cerrado mínimo 6 horas, O2 y analgesia. - Después de 6 horas con el catéter cerrado, se realiza RxT, si es normal o solo persiste un Nx apical asintomático, se extrae el catéter, alta (ANEXO VI) y citar en CET. - Si en el control de las 6 horas hay Nx igual o mayor, se traslada a cargo del SCT, abriendo el catéter y conectándolo a válvula de Heimlich. No se conectará aspiración continua, 20 NEUMOTÓRAX hasta pasadas 24 horas; de esta manera, disminuye la posibilidad de edema exvacuo y evitamos el Nx a tensión. No cambiamos el catéter por un tubo grueso, porque si la fístula es grande, preferimos tratamiento quirúrgico definitivo. - Si a las 6 horas hay un Nx más pequeño que el previo, se puede valorar hacer una aspiración adicional o cursar el ingreso al SCT. - Si no hay reexpansión pulmonar se puede optar por el ingreso en el SCT con catéter conectado a válvula de Heimlich o intentar nueva aspiración y control radiológico posterior. Cuando ha fallado un primer intento de aspiración, en la mayoría de los casos se consigue la resolución del neumotórax manteniendo el catéter una media de 48 horas. En ciertos casos y a criterio de los médicos de Urgencias o del cirujano torácico, se puede valorar enviar a su domicilio al paciente con el catéter pleural conectado a una válvula de Heimlich y control ambulatorio en la CET. - Siempre que se estime que una punción puede ser dificultosa (Nx pequeño, adherencias pleurales, situación dudosa,…), se pedirá una TAC para localizar el lugar adecuado para la punción; si se considera necesario, avisar al cirujano torácico de guardia. - Seguimiento: En todos los casos hacemos un seguimiento en CET al cabo de dos semanas de la resolución del Nx. Desde el Servicio de Urgencias del Hospital Universitario Donostia se cita directamente a la CET y desde los Hospitales Comarcales, se envía una solicitud a (HDO. ZERBITZUTORAXEKO-KIRURGIA.NMTX@osakidetza.net, teléfono de contacto: 943 00 75 30), con los datos del paciente: nombre y apellidos, fecha del alta, diagnóstico y teléfono. La DUE de consultas organiza la cita con un intervalo máximo de dos semanas. Es conveniente entregar a los pacientes el informe del Servicio de Urgencias y las radiografías para que las lleven a la CET. 10.1.4. Paciente con NEI recidivante. - Traslado al SCT para cirugía programada. - Si el Nx es grande, o si el paciente está clínicamente inestable, se coloca un catéter pleural fino sin aspirar y se conecta a una válvula de Heimlich antes de su traslado. - En los casos con Nx pequeño y clínicamente estables, el paciente es hospitalizado con oxigenoterapia hasta la intervención quirúrgica. - Se solicita el estudio preoperatorio a su ingreso y se cursa consulta al Servicio de Anestesia. La estancia hospitalaria postoperatoria de la VATS es de un día de media y en las minitoracotomías 4 días (ANEXOS VII y VIII). - Seguimiento: Se cita a la CET a las dos semanas del alta hospitalaria aconsejando reposo relativo durante este tiempo. 21 NEUMOTÓRAX 10.2. NEUMOTÓRAX ESPONTÁNEO SECUNDARIO - Colocar un catéter pleural fino independientemente del tamaño, y sin aspirar, conectarlo a una válvula de Heimlich para su traslado al SCT. - Si el Nx es pequeño o hay adherencias, es conveniente hacer previamente una TAC torácica para localizar el lugar de la punción (avisar al cirujano torácico, si se cree conveniente). - Al día siguiente de su ingreso, se valorará tratamiento conservador con aspiración continua y/o pleurodesis (doxiciclina o talco disuelto inyectado por el tubo pleural), o tratamiento quirúrgico (videotoracoscopia/toracotomía, resección de bullas y pleurectomía y/o pleurodesis). - Seguimiento: Una vez resuelto el Nx, se aconseja control por su médico de atención primaria o neumólogo de zona. 10.3. NEUMOTORAX CATAMENIAL Es un Nx que aparece en mujeres jóvenes durante la menstruación, tiene tendencia a recidivar. En el 90 % de los casos el Nx es derecho, y se diagnostica una endometriosis torácica en la mitad de los casos estudiados40 (Tabla 1). Tabla1. Porcentajes de los hallazgos intraoperatorios en el Nx catamenial. Lesiones diafragmáticas 38,8% Endometriosis y perforación diafragmática 12,3% Endometriosis diafragmática sin perforación 10,2% Perforación diafragmática sin endometriosis 16,3% Endometriosis en la pleura visceral 29,6% Bullas/cicatrices 23,1% No hay alteraciones visibles 8,5% Hay una adecuada descripción de los hallazgos operatorios en 140 de 154 casos. En el grupo con lesiones diafragmáticas, había 2 casos en combinación con bullas, 1 caso en combinación con endometriosis parenquimatosa y bullas, y 1 caso en combinación con endometriosis de la pleura visceral. - Si es grande, colocar catéter fino, abierto a válvula de Heimlich sin aspirar y trasladar al SCT. Si es muy pequeño y con escasos síntomas, puede ingresar sin necesidad de drenaje, solo con oxigenoterapia y analgesia. 22 NEUMOTÓRAX - En los casos con sintomatología frecuente y mal tolerada, el tratamiento debe combinar cirugía y terapia hormonal. Es aconsejable hacer la cirugía durante la menstruación. En el acto quirúrgico, se hace una exploración exhaustiva de la superficie diafragmática, pleura parietal y visceral. En caso de hallazgos patológicos, se suturan las perforaciones diafragmáticas, se extirpan los focos de endometriosis y/o se cubre el diafragma con una malla sintética41,42. - Después de la cirugía, se aconseja añadir una terapia hormonal profiláctica para suprimir la actividad ectópica del endometrio. Los efectos secundarios de este tratamiento son los del hipoestrogenismo, especialmente osteoporosis, lo que limita la duración del tratamiento a solo 6 meses43. - Durante los períodos de amenorrea fisiológica (embarazo y lactancia) no debería haber episodios de Nx, aunque puede haber excepciones44. - Seguimiento: Durante un año aconsejamos revisiones en la CET o por neumólogo de zona. 10.4. NEUMOTORAX TRAUMATICO - Se coloca un catéter (fino o grueso dependiendo de la gravedad del accidente y del criterio del facultativo) y se conecta a un sistema con válvula de agua sin aspiración (para poder controlar débito aéreo y pérdidas hemáticas). Si el Nx es completo o a tensión o se acompaña de múltiples fracturas, volet torácico o hemotórax importante45,46,47,48, se aconseja colocar tubo grueso con la técnica de Seldinger o con disección roma (20/24 Fr). - En pacientes con probabilidad de ventilación mecánica, preferiblemente usar tubo grueso. - Hay que hacer una valoración global del traumatismo y decidir el Servicio donde debe ingresar, según la prioridad de sus lesiones. - Seguimiento: Dependerá de las lesiones y secuelas del traumatismo. El Nx traumático no precisa seguimiento una vez resuelto. 10.5. NEUMOTORAX IATROGENICO - El tratamiento debe ser lo menos agresivo posible, ya que hay escasas probabilidades de recidivas. La mayoría se resuelve sin drenaje. En los pequeños, sería conveniente observación y control radiológico unas 6 horas después; si no ha variado, valorar alta y revisión por su médico de cabecera. Si ha aumentado, tratar como un primer episodio de NEI grande. - Si es grande, se puede tratar como un primer episodio de NEI grande clínicamente estable o inestable, y control posterior por su médico de cabecera (ver apartado 10.1.3.). 23 NEUMOTÓRAX - Los pacientes con antecedentes de EPOC, que desarrollen un Nx iatrogénico, deben tratarse con drenaje torácico fino49 conectado a válvula de Heimlich y traslado al SCT. - Seguimiento: Una vez resuelto el Nx debe hacer seguimiento por su médico de atención primaria. 10.6. NEUMOTORAX POR BAROTRAUMA 10.6.1. Neumotórax en pacientes con respiración asistida. - Los pacientes sometidos a ventilación mecánica con presión positiva, tienen mayor riesgo de desarrollar un Nx por barotrauma. - Se debe utilizar un drenaje pleural mediano o grueso50, con o sin aspiración continúa dependiendo del débito por la fístula. Mientras se mantenga la respiración asistida, será difícil que se cierre la fístula parenquimatosa, y habrá que continuar con el drenaje hasta el cese de la fuga aérea. - Una vez resuelto el Nx, no es necesario seguimiento por esta patología. 10.6.2. Neumotórax y buceo autónomo con botella. - En el buceo autónomo con botella, conforme el buceador se sumerge, la presión ambiental aumenta (1 atmósfera, cada 10 metros) y el aire de su organismo disminuye de volumen según la Ley de Boyle Mariote. Al contrario, conforme el buceador asciende, la presión disminuye y el volumen de gas de sus pulmones o cavidades se expande. Si el ascenso es excesivamente rápido, se facilita el barotrauma. Es evidente que un paciente con enfisema pulmonar o bullas, tiene mayor riesgo de sufrir un barotrauma pulmonar en el buceo. - En el lugar del accidente, un Nx pequeño por barotrauma debe ser tratado con oxígeno al 100 %. Los Nx grandes, además del O2 requerirán la inserción de un catéter fino en la cavidad pleural. Si acuden a un Servicio de Urgencias, se seguirá el mismo procedimiento que en los NEI. - Si el Nx se presenta en combinación con embolismo aéreo o con una enfermedad por descompresión (formación de burbujas de nitrógeno en la sangre o tejidos), no debe iniciarse el tratamiento en cámara hiperbárica, hasta que hayamos colocado un catéter intrapleural conectado a válvula Heimlich. - La presencia de un Nx es contraindicación absoluta de bucear, mientras no se considere curado. 24 NEUMOTÓRAX - La guía sobre el buceo de la BTS51 recomienda la cirugía abierta bilateral en los NEI con bullas superficiales. Hasta hace poco, la cirugía VATS, se podía asociar a tasas de recidiva entre el 5 y el 10 %, por lo tanto no parece un procedimiento adecuado en estos casos. Sin embargo, dependiendo de la experiencia de cada grupo, la VATS bilateral con pleurectomía apical, podría ofrecer una seguridad similar a la cirugía abierta. La resección de las bullas y la pleurectomía proporcionan una protección elevada contra la recidiva del Nx, pero no hay evidencia científica sobre los riesgos de neumomediastino o embolia gaseosa, que podrían originarse por alteraciones posquirúrgicas en el parénquima pulmonar. Las decisiones en cuanto a la disposición de bucear deben ser tomadas a la luz de todas estas consideraciones. - Dependiendo de las normas de cada escuela o club de buceo, los antecedentes de Nx de cualquier tipo, enfermedad pulmonar obstructiva crónica, fibrosis quística, bronquiectasias, enfermedad intersticial, o cirugía torácica previa, pueden ser considerados como contraindicaciones absolutas para el buceo autónomo con botella. - Seguimiento: Cuando se decide seguir buceando después de un primer episodio de NEI, hay que hacer cirugía bilateral. Después de ambas intervenciones quirúrgicas (toracotomía o VATS bilateral en dos tiempos con resección de bullas/vértice pulmonar y pleurectomía), hay que esperar 6 meses para volver a bucear. Se aconseja confirmar la normalidad morfológica de ambos pulmones con una TAC y comprobar la función respiratoria con PFR completas y gasometría arterial, a los 6 meses de la cirugía. 10.6.3. Neumotórax y transporte aéreo. - En el transporte aéreo, se utilizan dos tipos de aviones: los que no tienen la cabina presurizada y los presurizados. En los aviones no presurizados, la presión atmosférica en el interior del aparato va descendiendo con la altura. Conforme disminuye la presión atmosférica, baja la presión parcial de O2 en el ambiente, lo que conduce a alteraciones significativas de los gases sanguíneos. La altura máxima de vuelo sin uso de O2 suplementario, para las personas normales, es de 3.000 metros. A medida que disminuye la presión, aumenta el volumen de los gases de forma proporcional (Ley de Boyle Mariote), lo que puede producir lesiones por barotrauma y agravamiento de un posible Nx. - Los aviones presurizados, son aquellos en los que la presión atmosférica en su interior, varía poco con la altura. Aunque las cabinas de los aparatos estén presurizadas, la presión de aire en la cabina durante el vuelo a altitud de crucero, es más baja que la presión del aire a nivel del mar. A una altitud de crucero normal de 11.000 a 12.200 metros (36.000-40.000 pies), la presión de aire en la cabina es equivalente a la presión de aire en el exterior a 1.800-2.400 metros sobre el nivel del mar. En consecuencia, la sangre absorbe menos O2 y los gases en el interior del cuerpo se expanden. Este hecho tiene repercusión sobre la fisiología respiratoria y con cierta frecuencia va a provocar pequeños trastornos a distintos niveles: oído medio, senos paranasales, piezas dentarias cariadas y tubo digestivo52. Es conveniente advertir a los pacientes con enfisema pulmonar o bullas, de las consecuencias que pueden derivarse de un cambio brusco de la presión atmosférica dentro de la cabina. 25 NEUMOTÓRAX - Cuando ocurre un Nx durante un vuelo, hay que tratarlo con O2, y analgésicos. Habitualmente, con este tratamiento es suficiente para mantener al paciente hasta el aterrizaje del avión. El Nx por barotrauma, se produce durante el ascenso del avión; durante el descenso, el volumen del Nx disminuye. - Un Nx de cualquier tipo y tamaño es suficiente para contraindicar el vuelo, dado que en cualquier momento se puede producir una súbita expansión de los gases intrapleurales. Según la normativa SEPAR53, un paciente con Nx no debería ser admitido en un avión hasta 72 h después de la retirada del drenaje pleural y con una RxT realizada a las 48 h de retirar el drenaje que confirme su resolución. Sin embargo, la guía británica aconseja evitar los viajes en avión en un intervalo de 6 semanas desde la resolución del NEI54. - La Aerospace Medical Association55 acepta que algunas compañías aéreas puedan aceptar el transporte de pasajeros con un drenaje pleural. En cuyo caso, se recomienda colocar una válvula de Heimlich. - Habría que ser más restrictivo en pacientes con mayor riesgo de fracaso respiratorio en caso de presentar un neumotórax (fumadores y pacientes con enfermedades pulmonares de base). En el caso de pacientes que han padecido un Nx espontáneo secundario que no han sido intervenidos quirúrgicamente el período sin volar se amplía al año54. Cuando ha habido una intervención quirúrgica de pulmón, se aconseja evitar el vuelo aéreo durante al menos 6 semanas tras la cirugía56,57. En pacientes con un episodio de NEI y que utilizan el avión con frecuencia, es conveniente realizar una TAC para verificar si hay bullas y recomendar su extirpación y la pleurectomía parcial por cirugía abierta o VATS. - Seguimiento: Después de la cirugía se debe hacer una verificación de la función respiratoria, una TAC torácica y confirmar la ausencia de alteraciones a las 6 semanas de la cirugía. 10.7. NEUMOTORAX A TENSION - Debe tratarse lo más rápidamente posible, con O2 y con un catéter pleural fino (Pleurocath®). Después de anestesiar la zona, se puede dejar una aguja intramuscular introducida en la cavidad pleural, para permitir la salida de aire mientras vamos preparando el material. Una vez colocado el drenaje, se conecta a una válvula de Heimlich. Posteriormente, el paciente debe trasladarse a cargo del SCT, ya que el Nx a tensión es indicación quirúrgica. - El Nx a tensión puede ocurrir en cualquier tipo de Nx, ocurre cuando la presión intrapleural excede a la presión atmosférica tanto en la inspiración como en la espiración. La etiología parece ser un mecanismo valvular en el orificio parenquimatoso, que facilita la entrada de aire en el espacio pleural durante la inspiración y no permite su salida durante la espiración58. Se produce un deterioro progresivo de la función cardiorrespiratoria. - Seguimiento: Una revisión a las 6 semanas de la IQ con TAC en la CET. 26 NEUMOTÓRAX 11. BIBLIOGRAFÍA 1. Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Normativa sobre diagnóstico y tratamiento del neumotórax. Ed. Doyma. Barcelona, 1991. 2. Hernández C, Zugasti K, Emparanza J, Boyero A, Ventura I, Isaba L, Berruete M, Castro E, Cabeza R. Neumotórax espontáneo idiopático: tratamiento basado en la aspiración con catéter fino frente a drenaje torácico. Arch. Bronconeumol. 35: 179-182, 1999. 3. Hernández C, Busto MJ, Basabe M, López D, Goya M, Berruete M, Lasa M, Agiriano I, Garay V. Protocolo neumotórax. Hospital Donostia. Depósito Legal: SS-305/06. 2006. 4. Light RW. Pneumothorax. In: Pleural diseases. 4th ed. Baltimore: Williams and Wilkins, 2001. 5. Rivas JJ, Jiménez MF, Molins L, Pérez A, Lanzas J. Normativa sobre el diagnóstico y tratamiento del neumotórax espontáneo. Arch Bronconeumol. 44:437-48, 2008. 6. Levi JF, Kleinmann P, Riquet M, Debesse B. Percutaneous parietal pleurectomy for recurrent spontaneous pneumothorax. Lancet. 336:1577-1578, 1990. 7. West JB. Distribution of mechanical stress on the lung, a possible factor in localization of pulmonary disease. Lancet, 24i: 839-41, 1971. 8. Haraguchi S, Fukuda Y. Histogenesis of abnormal elastic fibers in blebs and bullae of patients with spontaneous pneumothorax: ultrastructural studies. Acta Pathol. Jpn. 43: 709-22, 1993. 9. Noppen M. Spontaneous pneumothorax: epidemiology, pathophysiology and cause. European Respiratory Review. 19(117):217-9, 2010. 10. Obuchi T, Miyoshi T, Miyahara S, Hamanaka W, Nakashima H, Yanagisawa J, et al. Does pneumothorax occurrence correlate with a change in the weather? Embase Surgery Today. 41(10):1380-1384), 2011. 11. Borro JM. Factores asociados al neumotórax espontáneo. Arch. Bronconeumol. 27:51-53, 1991. 12. Bense L, Wiman LG, Hedenstierna G. Onset of symptoms in spontaneous pneumothorax: correlations to physical activity. Eur. J. Respir. Dis. 71:181, 1987. 13. Alifano M, Roth Th, Broët S, Regnard JF. Catamenial Pneumothorax: A Prospective Study. Chest, 134(3):1004-1008, 2003. 27 NEUMOTÓRAX 14. Sahn SA, Heffner JE. Spontaneous pneumothorax. N. Engl. J. Med. 342:868-874, 2000. 15. Norris RM, Jones JG, Bishop JM. Respiratory gas exchange in patients with spontaneous pneumothorax. Thorax, 23: 427–33, 1968. 16. Sadikot RT, Greene T, Meadows K, Arnold AG. Recurrence of primary spontaneous pneumothorax. Thorax, 52:805-809, 1997. 17. Flint K, Hillawi AH, Johnson AM. Conservative management of spontaneous pneumothorax. Lancet, 1(8378): 687-9, 1984. 18. Northfield TC. Oxygen therapy for spontaneous pneumothorax. Br. Med. J. 4: 86-88, 1971. 19. Harvey J, Prescott RJ. Simple aspiration versus intercostal tube drainage for spontaneous pneumothorax in patients with normal lungs. BMJ. 309:1338-1339, 1994. 20. Laws D, Neville E, Duffy J, on behalf of the British Thoracic Society Pleural Disease Group, a subgroup of the British Thoracic Society Standards of Care Committee BTS guidelines for the insertion of a chest drain. Thorax. 58:ii53-ii59 doi:10.1136/thorax.58.suppl_2.ii53, 2003. 21. Inderbitzi RGC, Leiser A, Furrer M, Althaus U. Three years experience in video-assisted thoracic surgery (VATS) for spontaneous pneumothorax. J. Thorac. Cardiovasc. Surg. 107:1410-1415, 1994. 22. Pompeo E, Tacconi F, Mineo D, Mineo TC. The role of awake video-assisted thoracoscopic surgery in spontaneous pneumothorax. J. Thorac. Cardiovasc. Surg. 133(3): 786-790, 2007. 23. Hatz RA, Kaps MF, Meimarakis G, Loehe F, Müller C, Fürst H et al. Long-term results after video-assisted thoracoscopic surgery for first-time and recurrent spontaneous pneumothorax. Ann. Thorac. Surg. 70:253-7, 2000. 24. Cardillo G, Carleo F, Giunti R, Carbone L, Mariotta S, Salvadori L, et al. Videothoracoscopic talc poudrage in primary spontaneous pneumothorax: a single-institution experience in 861 cases. J Thorac Cardiovasc Surg. 131:322-8, 2006. 25. Sawada S, Watanabe Y, Moriyama S. Video-Assisted Thoracoscopic Surgery for Primary Spontaneous Pneumothorax: Evaluation of Indications and Long-term Outcome Compared With Conservative Treatment and Open Thoracotomy. Chest. 127(6): 2226-22, 2005. 26. Nelly AM. Treatment of spontaneous pneumothorax. Curr Opin Pulm Med. 15:376-9, 2009. 28 NEUMOTÓRAX 27. Aguinagalde B, Zabaleta J, Fuentes M, Bazterargui N, Hernandez C, Izquierdo JM, y col. Percutaneous aspiration versus tube drainage for spontaneous pneumothorax: systematic review and meta-analysis. Eur J Cardiothorac Surg. 37:1129-1135, 2010. 28. Zabaleta J, Aguinagalde B, Alvarez C, Fuentes M, Bazterargui N, Izquierdo JM, y col. Videoassisted thoracoscopic surgery for the treatment of primary pneumothorax: talc pleurodesis or pleural abrasion? Retrospective multicentre study. Chest Disease Reports. 1:19-21, 2011. 29. Barker A, Maratos EC, Edmonds L, Lim E. Recurrence rates of video-assisted thoracoscopic versus open surgery in the prevention of recurrent pneumothoraces: a systematic review of randomised and nonrandomised trials. Lancet 2007;370:329-35. 30. Sedrakyan A, van der Meulen J, Lewsey J, Treasure T. Video assisted thoracic surgery for treatment of pneumothorax and lung resections: systematic review of randomised clinical trials. BMJ 2004;329:1008-10. 31. Dubois L, Malthaner RA. Video-assisted thoracoscopic bullectomy and talc poudrage for spontaneous pneumothoraces: effect on short-term lung function. J Thorac Cardiovasc Surg 2010;140:1272-75. 32. Landreneau RJ, Hazelrigg SR, Mack MJ, Dowling RD, Burke D, Gavlick J. Postoperative pain-related morbidity: video-assisted thoracic surgery versus thoracotomy. Ann Thorac Surg. 56:1285-9, 1993. 33. Galbis JM, Mafé JJ, Benlloch S, Baschwitz B, Rodríguez JM. Cirugía videotoracoscópica en el tratamiento de los neumotórax: consideraciones sobre 107 procedimientos consecutivos. Arch Bronconeumol. 39: 310-313, 2003. 34. Gómez-Caro A, Moradiellos FJ, Larrú E, Díaz-Hellín V, Marrón C, Pérez-Antón JA, y col. Eficacia y morbilidad del tratamiento con cirugía videoasistida del neumotórax espontáneo primario. Arch Bronconeumol. 42:57-61, 2006. 35. Hernández C, Ferreras B, López D, Preciado MJ, Txoperena G, Lizundia A, Corcuera I. Protocolo Drenaje Torácico. Hospital Donostia. Depósito Legal: SS-306/06. 2006. 36. Hernández C, Jiménez R, Busto MJ, Zabaleta J, Aguinagalde B, Zulaika N, Olazabal P. Manual sobre suturas, ligaduras, nudos y drenajes. Hospital Donostia. Depósito Legal: SS-1051/2007. 37. Miller AC, Harvey JE. Guidelines for the management of spontaneous pneumothorax. Standards of Care Committee, British Thoracic Society. BMJ. 307:114-6, 1993. 29 NEUMOTÓRAX 38. MacDuff A, Arnold A, Harvey J, and on behalf of the BTS Pleural Disease Guideline Gro Management of spontaneous pneumothorax: British Thoracic Society pleural disease guideline. Thorax. 65(Suppl_2): ii18 - ii31. 2010. 39. Baumann MH, Strange Ch, Heffner JE, Light R, Kirby ThJ, Klein J, et al. Management of spontaneous pneumothorax an American College of Chest Physicians Delphi Consensus Statement; the ACCP Pneumothorax Consensus Group. Chest, 119: 590-602, 2001. 40. Korom St, Canyurt H, Missbach A, Schneiter D, Kurrer MO, Haller U, et al. Catamenial pneumothorax revisited: Clinical approach and systematic review of the literature. J. Thorac. Cardiovasc. Surg. 128(4): 502-508, 2004. 41. Alifano M; Roth, Broët S, Schussler O, Magdeleinat P, Regnard JF. Catamenial Pneumothorax: A Prospective Study. Chest, 134(3): 1004-1008, 2003. 42. Bagan P, Le Pimpec Barthes F, Assouad J, Souilamas R, Riquet M. Catamenial pneumothorax: retrospective study of surgical treatment. Ann. Thorac. Surg. 75: 378-381, 2003. 43. Pritts EA. Treatment of endometriosis. N. Engl. J. Med. 345: 266-274, 2001. 44. Rodríguez P, Medina M, Cortes E, Barber MA, Freixinet J, García JA. Neumotórax complicado en una gestante a término: tratamiento mediante cesárea y videotoracoscopia simultáneas. Prog Obstet Ginecol. 51:682-685, 2008. 45. Galán G, Peñalver JC, Paris F, Caffarena J M Jr, Blasco E, et al. Blunt chest injuries in 1696 patients. Eur J Cardio-thorac Surg. 6:284-287, 1992. 46. Henry M, Arnold T, Harvey J; Pleural Diseases Group, Standards of Care Committee, British Thoracic Society. BTS Guidelines for the management of spontaneous pneumothorax. Thorax. 58:ii39-52, 2003. 47. Harrison BP, Roberts JA. Evaluating and managing pneumothorax. Emerg Med. 37:18-25, 2005. 48. Moya MA, Seaver C, Spaniolas K, Inaba K, Nguyen M, Veltman Y, et al. Occult pneumothorax in trauma patients: Development of an objective scoring system. J Trauma Injury Infect Crit Care. 63:13-17, 2007. 49. Anderson CL, Crespo JC, Lie TH. Risk of pneumothorax not increased by obstructive lung disease in percutaneous needle biopsy. Chest, 105:1705–8, 1994. 50. Pollack MM, Fields AI, Holbrook PR. Pneumothorax and pneumomediastinum during pediatric mechanical ventilation. Crit. Care Med. 7: 536–9, 1979. 30 NEUMOTÓRAX 51. Godden D, Currie G, Denison D, Farrell P, Ross J, Stephenson R, et al. British Thoracic Society guidelines on respiratory aspects of fitness for diving. Thorax, 1: 3-13, 2003. 52. Goitia A, Aguirre J, De Prado Mª M, Estellés AV, Zurita A, Millán JM. Tus pacientes también vuelan. Aspectos médicos de la aviación comercial. Semergen. 25 (9): 806-817, 2000. 53. García F, Borderías L, Casanova C, Celli B R, Escarrabill J, González N, y co. Patología respiratoria y vuelos en avión. Arch Bronconeumol. 43(2):101-125, 2007. 54. Henry A, Arnold T, Harvey J. BTS guidelines for the management of spontaneous pneumothorax. Thorax. 58 Suppl 2:39-52, 2003. 55. Akero A, Christensen CC, Edvardsen A, Skjonsberg OH. Hypoxaemia in chronic obstructive pulmonary disease patients during a commercial flight. Eur Respir J. 25:725-30, 2005. 56. Dillard TA, Beninati WA, Berg BW. Air Travel in patients with chronic obstructive pulmonary disease. Arch. Emerg. Med. 151: 1793-96, 1991. 57. Tso E. High-altitude illness. Emerg. Med. Clin. North Am. 10 (2): 231-3, 1992. 58. Light RW. Tension pneumothorax. Intensive Care Med. 20: 468–9, 1994. 31 NEUMOTÓRAX ANEXO I. PRESIONES INTRATORÁCICAS DURANTE LA VENTILACIÓN. En reposo, el espacio pleural tiene una presión inferior a la atmosférica (– 5 cm de H2O de media). A la presión atmosférica se la considera como valor cero, aunque su valor real sea de 760 mmHg. Durante la ventilación pulmonar se producen variaciones de los volúmenes y de las presiones intratorácicas que se pueden simplificar con la ley de Boyle Mariote (PxV = Constante). Durante la respiración superficial, en la inspiración se mueve el aire de la atmósfera hacia los alvéolos por la actividad de los músculos inspiratorios (diafragma, intercostales externos). La presión intrapleural (Ppl) pasa de – 3 a – 10 cm de H2O. Durante la espiración, se expulsa el aire pulmonar gracias a la fuerza elástica retráctil pulmonar, y la Ppl pasa de – 10 a – 3 cm de H2O. En una inspiración forzada aumenta la fuerza muscular (diafragma, intercostales externos, músculos del cuello y del tórax) y dependiendo de esta fuerza, el volumen aéreo intrapulmonar se amplía disminuyendo proporcionalmente la presión intrapleural (Ppl = – 80 o – 100 cm de H2O). En una espiración forzada, intervienen los músculos espiratorios además de la fuerza retráctil pulmonar, y la Ppl se hace positiva (mayor a la presión atmosférica) pudiendo alcanzar presiones de + 80 cm de agua, al mismo tiempo que disminuye el volumen de aire pulmonar (ley de Boyle Mariote). Esquema ventilatorio: Se reduce el árbol respiratorio a un alvéolo y una sola vía aérea en la caja torácica. La presión alveolar (Palv) es la resultante de estas dos fuerzas opuestas, una excéntrica, dependiente de la Ppl y otra concéntrica, que depende de la elasticidad pulmonar, del surfactante alveolar (Presión de la resistencia elástica = Pre) y de la fuerza muscular que actúe. Durante la espiración, la presión en el interior de la vía aérea disminuye a medida que nos alejamos del alvéolo, debido a la resistencia al flujo aéreo de las vías aéreas. En el recorrido de la vía aérea desde el alveolo hacia el exterior, se llega a un punto donde la presión dentro y fuera de 32 NEUMOTÓRAX la vía aérea se igualan (Punto de igual Presión = PIP). Desde este punto, la vía aérea tiende al colapso por la diferencia de presiones; colapso que se ve impedido por la estructura cartilaginosa bronquial. ANEXO II. CONSENTIMIENTO INFORMADO DEL DRENAJE TORACICO 33 NEUMOTÓRAX ANEXO III. LOCALIZACIÓN DE UN DRENAJE TORÁCICO ANTERIOR O LATERAL Puncionar en la línea media clavicular, por el segundo espacio intercostal (borde superior de la tercera costilla). Las referencias anatómicas son: el ángulo de Louis (la 2ª costilla se une al esternón a este nivel) y la primera costilla suele situarse bajo la clavícula por lo que, paradójicamente, la primera costilla que palpamos suele ser la segunda. Triángulo axilar “seguro” para la inserción de un drenaje torácico. 34 NEUMOTÓRAX ANEXO IV. PUNTOS DE REFERENCIA Y MÁRGENES DE SEGURIDAD 35 NEUMOTÓRAX ANEXO V. INFORMACIÓN PARA EL PACIENTE CON NEUMOTÓRAX 36 NEUMOTÓRAX ANEXO VI. HOJA DE RECOMENDACIONES TRAS PUNCIÓN-ASPIRACIÓN DE NEUMOTORAX ESPONTÁNEO IDIOPATICO 37 NEUMOTÓRAX ANEXO VII. DOCUMENTO DE RECOMENDACIONES AL ALTA HOSPITALARIA NEUMOTÓRAX OPERADO POR VIDEOTORACOSCOPIA 38 NEUMOTÓRAX ANEXO VIII. DOCUMENTO DE RECOMENDACIONES AL ALTA HOSPITALARIA NEUMOTÓRAX TRATADO CON DRENAJE PLEURAL 39 PROTOCOLO NEUMOTÓRAX AUTORES Coordinador: Carlos Hernández Ortiz • José M. Izquierdo Elena. Cirugía Torácica. Hospital Donostia. • Jon Zabaleta Jiménez. Cirugía Torácica. Hospital Donosita. • Borja Aguinagalde Valiente. Cirugía Torácica. Hospital Donostia. • Ana Martínez Benito. DUE consulta externa Cirugía Torácica. • Belén Ferrereras Ibeas. DUE Sala Hospitalización Cirugía Torácica • José Ángel Redin Espinal. Servicio de Urgencias. Hospital Donostia • Hur Lertxundi Arrieta. Servicio de Urgencias. Hospital Donostia. • Miguel Basabe Zapirain. Servicio de Urgencias. Hospital Donostia. • Carolina De Miguel García. DUE. Servicio de Urgencias. Hospital Donostia. • M. Carmen Andonegui Melida. Servicio de Urgencias. Hospital de Mendaro. • Francisco J. Esponda Inchauspe. Servicio de Urgencias. Hospital de Zumárraga. • Juan M. Iñiguez de Heredia Bengoechea. Servicio de Urgencias. Hospital Comarcal del Bidasoa. • Alejandro Masíe Mebuy. Servicio de Urgencias. Hospital del Alto Deba. • Victoria Garay Pelegrin. Equipo Médico de Valoración de Incapacidades de Guipúzcoa. Fecha de aprobación: 2 de marzo de 2012 Komunikazio Unitatea / Unidad de Comunicación DONOSTIA OSPITALEA / HOSPITAL DONOSTIA Depósito Legal: SS-677-2012 NEUMOTÓRAX Hospital Universitario Donostia 47