PRÁCTICA N° 7
Anuncio

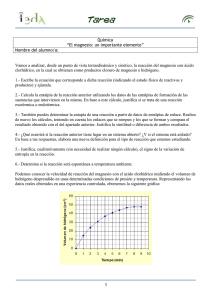
PRÁCTICA N° 7 DETERMINACION EXPERIMENTAL DEL PESO EQUIVALENTE DEL MAGNESIO I. OBJETIVO GENERAL Determinar el peso equivalente experimental en los procesos en que intervienen reacciones químicas redox. II. OBJETIVOS ESPECÍFICOS Al finalizar la práctica el alumno será capaz de: 1. 2. 3. 4. 5. 6. 7. 8. Definir e identificar agente oxidante y reductor. Balancear las semireacciones de una ecuación redox. Balancear la ecuación global de una ecuación redox. Calcular el volumen de hidrógeno, que debe desprender un peso conocido de magnesio, al reaccionar con ácido clorhídrico en las condiciones del laboratorio. Determinar experimentalmente el volumen real de hidrógeno desprendido por esa cantidad de magnesio. Comparar el valor calculado y el valor experimental de hidrógeno. Calcular el peso equivalente del magnesio a partir del volumen medido de hidrógeno. Comparar el valor de peso equivalente obtenido experimentalmente con el peso teórico. MARCO TEÓRICO Existen varios métodos para la determinación de pesos equivalentes, en esta práctica utilizaremos el método de desplazamiento del hidrógeno. Este consiste en medir el volumen de hidrógeno que se desprende, en condiciones ordinarias, cuando se hace reaccionar un ácido diluido con un peso conocido de un metal. La ley de Dalton es de uso práctico para este experimento, a fin de medir la cantidad de gas producido en la reacción química. Se puede medir el volumen del gas a la presión atmosférica y a temperatura conocida. Si el gas fuera puro, se podría usar de inmediato la ley de los gases para calcular el número de moles producidos por la reacción. Sin embargo, en las condiciones del experimento, el gas recogido contiene vapor de agua además del gas que interesa. La verdadera presión del gas producido es, por lo tanto, según la ley de Dalton, igual a la presión total menos la presión parcial del vapor de agua. Experimentalmente se ha hallado que la 65 presión del vapor de agua en presencia de agua líquida es constante a una temperatura dada, su valor puede obtenerse de tablas (Tabla 20) y así usarse en los cálculos. TABLA 20. Presión del vapor de agua en mm Hg a diferentes temperaturas en °C. Temperatura (°C) 20 21 22 23 24 25 26 27 28 29 0,0 0,2 0,4 0,6 0,8 17,535 18,650 19,827 21,068 22,377 23,756 25,209 26,739 28,349 30,043 17,753 18,880 20,070 21,324 22,648 24,039 25,509 27,055 28,680 30,392 17,974 19,113 20,316 21,583 22,922 24,326 25,812 27,374 29,015 30,745 18,197 19,349 20,565 21,845 23,198 24,617 26,117 27,696 29,354 31,102 18,422 19,587 20,815 22,110 23,476 24,912 26,426 28,021 29,697 31,461 PROCEDIMIENTO EXPERIMENTAL . • • • • • • • • • Lave y enjuague con agua destilada, un tubo neunométrico y sujételo a un soporte universal por medio de una pinza doble para bureta. Agregue en el tubo 10 mL de una solución de ácido clorhídrico 2M y llene completamente el tubo neunométrico con agua destilada. Pese dos cintas de magnesio que estén recién pulidas, limpias y secas. Sujete una de las cintas de magnesio a un alambre unido a un tapón de corcho monoharado. Llene un vaso de precipitado de 250 mL, hasta las ¾ partes de su capacidad con agua destilada y colóquelo en la base del soporte universal. Retire el tubo neunométrico de la pinza e introduzca el corcho con la cinta en el tubo como muestra la figura 21. Observe, si el agujero del corcho está vacío y llene completamente con agua destilada para evitar que quede aire atrapado en el tubo. Con el dedo índice tape el agujero del corcho, invierta rápidamente el tubo y colóquelo dentro del vaso de precipitado de 250 mL, tal como se observa en la figura 21. Sujete nuevamente el tubo al soporte mediante pinza doble para bureta y ajuste el tubo de tal manera que el tapón casi toque el fondo del vaso. 66 • • • • Coloque un termómetro lo más cerca posible del tapón para determinar si ocurre algún cambio de temperatura durante la reacción. Cuando haya finalizado la reacción espere 5 minutos para que se iguale la temperatura del agua en el vaso. Determine el volumen del gas dentro del tubo y la diferencia en centímetros entre el nivel del agua del vaso y el nivel del agua en el tubo. Anote la temperatura. Lave de nuevo el tubo y repita el mismo procedimiento para la otra cinta. Altura de la Columna de agua Fig. 21 Procedimiento experimental en la determinación del peso equivalente 67 DATOS EXPERIMENTALES Parámetros Cinta N° 1 Cinta N° 2 Masa del magnesio (g) volumen de hidrógeno desprendido (mL) Temperatura en °C Altura de la columna de agua (mm) Presión de vapor de agua (mm de Hg) Densidad del agua (g/mL) Presión atmosférica (mm de Hg) Densidad del mercurio (g/mL) TRATAMIENTO DE LOS DATOS Altura de la columna de agua (H mm H2O) (H mm H2O) = nivel de agua en el tubo - nivel de agua en el vaso (13) Presión equivalente a una columna de mercurio (h mm Hg) (h mm Hg) = H mm H2O x densidad del H2O / densidad de Hg (14) Presión atmosférica (P atm) P atm = Presión del gas húmedo + h mm Hg (15) Presión del gas húmedo = P atm - h mm Hg (16) Presión del gas seco = Presión de gas húmedo – Presión de vapor del H2O Moles de H2 = PV / RT (18) (17) donde : P = presión de gas seco en atm V = volumen de gas en L T = temperatura en que se encuentra el sistema en °K 68 Recuerde: Un equivalente-gramo es la cantidad de compuesto que, en una reacción química de oxido-reducción, pierde o acepta exactamente un mol de electrones. N° de equivalentes-g oxidados = N° de equivalentes-g reducidos (19) Peso Equivalente Experimental (P.E exp) P.E exp = Masa de magnesio (g) / N° de moles de electrones intercambiados (20) En base al número de moles de H2 que se obtenga y a las semireacciones redox determinará los equivalentes–g y el peso equivalente experimental del magnesio. RESULTADOS Parámetros Cinta N° 1 Cinta N° 2 Presión Equivalente de la columna de agua (mm Hg) Presión del gas húmedo (mm Hg) Presión del gas seco (mm Hg) Moles de H2 Moles reducidos de H+ Número de moles intercambiados Peso equivalente experimental del Mg Promedio del Peso Equivalente del Magnesio __________________________ Peso Equivalente teórico __________________________________ Error Relativo Porcentual____________________________________ 69 CUESTIONARIO 1.- En un experimento de laboratorio se hicieron reaccionar ácido clorhídrico concentrado y aluminio. Se desprendió gas hidrógeno, que fue recogido sobre agua a 25°C, su volumen fue de 355 mL a una presión total de 750 mm Hg. ¿Cuántos moles de hidrógeno fueron recogidos? R= 0.0821 L atm/mol °K 2.- Determine el peso equivalente teórico del metal magnesio cuando reacciona con ácido clorhídrico. BIBLIOGRAFÍA 1. CHANG, R y COLLEGE, W. Química. Séptima edición. McGraw-Hill, México, 2002. 2. DAUB, W y SEESE, W. Química. Séptima edición. Prentice Hall, México, 1996. 3. PRETRUCCI, HARWOOD, y HERRING, G. Química General. Octava edición. Prentice Hall, Madrid, 2003. 4. MOORE, KOTZ, STANITSKI, JOESTEN y WOOD. El Mundo de la Química. Segunda edición, Addison Wesley Longman, México, 2000. 5. HANDBOOK of CHEMISTRY and PHYSICS . Edición 52. The Chemical Rubber CO. Ohio, 1971-1972 70