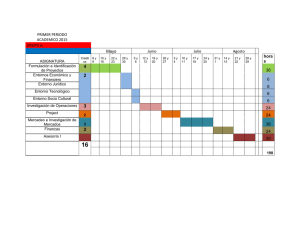
universidad nacional abierta ya distancia
Anuncio

UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA ESCUELA DE CIENCIAS BÁSICAS PROGRAMA DE QUÍMICA 401541– RADIOQUÍMICA JOHNY ROBERTO RODRIGUEZ PEREZ (Director Nacional) DIANA PAOLA MEDINA Diseñador LEONARDO JAIMES MARTINEZ Alistamiento Bucaramanga 2016 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA ASPECTOS DE PROPIEDAD INTELECTUAL Y VERSIONAMIENTO El presente protocolo académico fue diseñado en el año 2013 por la L.Q., MSc., DIANA PAOLA MEDINA, quien es docente de la UNAD. Adscrita a la sede nacional JCM. La Lic. Medina, es Licenciada en Química de la Universidad Distrital Francisco José de Caldas y Magíster en Ciencias Farmacéuticas de la Universidad Nacional de Colombia. Para el periodo 2016_16-01 se realiza el alistamiento del curso por el Docente PhD., Qco. LEONARDO JAIMES MARTINEZ del CEAD Bucaramanga. Este documento se puede copiar, distribuir y comunicar públicamente bajo las condiciones siguientes: • Reconocimiento. Debe reconocer los créditos de la obra de la manera especificada por el autor o el licenciador (pero no de una manera que sugiera que tiene su apoyo o apoyan el uso que hace de su obra). • No comercial. No puede utilizar esta obra para fines comerciales. • Sin obras derivadas. No se puede alterar, transformar o generar una obra derivada a partir de esta obra. • Al reutilizar o distribuir la obra, tiene que dejar bien claro los términos de la licencia de esta obra. • Alguna de estas condiciones puede no aplicarse si se obtiene el permiso del titular de los derechos de autor • Nada en esta menoscaba o restringe los derechos morales del autor. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA INTRODUCCIÓN El presente módulo está dirigido a estudiantes de Química, bajo la modalidad de estudio de educación superior a distancia. El documento está estructurado en tres grandes unidades, Estructura nuclear y radiactividad, Comportamiento de los materiales radiactivos y Protección radiológica, seguridad nuclear y aplicaciones, que a su vez se subdividen en capítulos y lecciones. El contenido de cada una de las partes fue seleccionado, teniendo en cuenta los saberes mínimos que se esperaría debe alcanzar un estudiante de la Universidad Nacional Abierta y a Distancia en el campo de la radioquímica. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA INDICE DE CONTENIDO INTRODUCCIÓN UNIDAD 1: ESTRUCTURA NUCLEAR Y RADIACTIVIDAD Capítulo 1: Principios generales de la Radioquímica LECCIÓN 1: INTRODUCCIÓN HISTÓRICA 1.1 Descubrimiento, evolución y desarrollo de la radioquímica LECCIÓN 2: CONCEPTOS BÁSICOS 2.1 Electrones protones y neutrones 2.2 Nucleones 2.3 Átomo 2.4 Dimensiones del átomo y del núcleo LECCIÓN 3: ELEMENTOS QUÍMICOS Y NÚCLIDO 3.1 Elemento químico 3.2 Núclido 3.2.1Notación LECCIÓN 4: TIPOS DE NÚCLIDOS 4.1 Isótopos 4.2 Isótonos 4.3 Isóbaros 4.4 Isómeros LECCIÓN 5: PROCEDENCIA DE LOS NÚCLIDOS 5.1 Tabla de núclidos 5.2 Núclidos naturales 5.3 Núclidos artificiales Capítulo 2: Estructura nuclear LECCIÓN 6: ESTRUCTURA NUCLEAR 6.1 Masa y energía 6.2 Radio nuclear 6.3 Momento angular (spin) y momento magnético LECCIÓN 7: MODELOS NUCLEARES 7.1 Las fuerzas naturales 7.2 Las partículas subatómicas 7.3 Potencial nuclear 7.4 Modelo nuclear de capas LECCIÓN 8: ENERGÍA DE ENLACE DEL NÚCLEO LECCIÓN 9: ECUACIÓN SEMIEMPÍRICA DE LA MASA DE NÚCLIDOS LECCIÓN 10: PARÁBOLAS DE ESTABILIDAD Capítulo 3: El fenómeno de la radiactividad LECCIÓN 11: NÚCLIDOS ESTABLES 11.1 Núclidos estables 11.1.1 Línea de estabilidad UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 11.1.2 Reacciones químicas y estructura nuclear LECCIÓN 12: NÚCLIDOS RADIACTIVOS 12.1 Núclidos radiactivos 12.2 Radiactividad 12.3 Desintegración LECCIÓN 13: ACTIVIDAD 13.1 Actividad 13.2 unidades de actividad 13.3 Becquerelio 13.5 Curio LECCIÓN 14: CONCENTRACIÓN RADIACTIVA 14.1 Concentración radiactiva 14.2 Padres e hijos LECCIÓN 15: TIPOS DE RADIACTIVIDAD 15.1 Rayos alfa 15.2 Rayos beta 15.3 Captura de electrón 15.4 Transición isomérica 15.5 Emisión de neutrones 15.6 Fisión espontánea 15.7 Rayos gamma 15.8 Rayos X 15.9 Electrones de conversión 15.10 Electrones de Auger 15.11 Emisión de protones UNIDAD 2: COMPORTAMIENTO DE LOS MATERIALES RADIACTIVOS Capítulo 4: Las radiaciones y la materia LECCIÓN 16: LEYES DE LA RADIACTIVIDAD 16.1 Ley básica de la radiactividad 16.2 Leyes de la radiactividad en términos del período LECCIÓN 17: ACTIVIDAD ESPECÍFICA 17.1 Actividad específica nuclídica 17.2 Actividad específica química 17.3 Actividad específica global LECCIÓN 18: SERIES RADIACTIVAS 18.1Series radiactivas naturales 18.2 Serie artificial del neptunio 18.3 Tipos de radiación en las cuatro series mas importantes LECCIÓN 19: ACTIVIDADES DE PADRE E HIJO RADIACTIVOS 19.1 Casos generales LECCIÓN 20: EQUILIBRIO RADIACTIVO 20.1 Equilibrio radiactivo según la teoría 20.2 Equilibrio y no equilibrio 20.3 Equilibrio secular de todos los eslabones. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Capítulo 5: Reacciones nucleares LECCIÓN 21: INTERACCIÓN DE LAS RADIACIONES Y LA MATERIA 21.1 Energía de las radiaciones 21.2 Poderes de penetración y de ionización 21.3 Fuente 21.4 Blindaje 21.5 Densidad Espesor 21.6 Constancia de penetración de una radiación determinada LECCIÓN 22: COMPOSICIÓN Y ACCIÓN DE LAS RADIACIONES 22.1 Rayos alfa 22.2 Rayos beta 22.3 rayos gamma 22.4 Rayos X LECCIÓN 23: MAGNITUDES Y UNIDADES DE RADIACIÓN 23.1 Exposición 23.2 Dosis 23.3 Factor de calidad 23.4 Equivalente de dosis 23.5 Índices LECCIÓN 24: REACCIONES NUCLEARES 24.1 Generalidades 24.2 Sección eficaz 24.3 los neutrones 24.4 Otros proyectiles LECCIÓN 25: DATACIÓN POR CARBONO-14 Capítulo 6: Fisión y Fusión nuclear LECCIÓN 26: FISIÓN 26.1 Concepto 26.2 Reacción en cadena 26.3 Núclidos fisionables LECCIÓN 27: OBTENCIÓN DE NÚCLIDOS FISIONABLES POR NEUTRONES TÉRMICOS 27.1 Obtención de U-235 27.2 Obtención del Pu-239 27.3 Obtención del U-233 LECCIÓN 28: PRODUCTOS DE FISIÓN 28.1 Neutrones producidos en la fisión 28.2 Energía liberada en la fisión 28.3 Masas, fisionable, fisionada, convertida en energía LECCIÓN 29: FUSIÓN 29.1 Concepto 29.2 iniciación de la fusión 29.3 Control de la fusión 29.4 Perspectivas de la fusión controlada LECCIÓN 30: REACTORES NUCLEARES 30.1 Definición UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 30.2 Acciones de los neutrones en un reactor 30.3 Partes de un reactor 30.4 Tipos de reactores 30.5 Cálculo de actividades producidas UNIDAD 3: PROTECCIÓN RADIOLÓGICA, SEGURIDAD NUCLEAR Y APLICACIONES) Capítulo 7: Efectos biológicos de las radiaciones LECCIÓN 31: MECANISMOS DEL DAÑO BIOLÓGICO 31.1 Formación de iones, radicales libres y peróxidos 31.2 Diferencias de respuesta biológica ante La irradiación LECCIÓN 32: RADIOPATÍA Y MUERTE POR IRRADIACIÓN AGUDA DE TODO EL CUERPO HUMANO 32.1 Síntomas de irradiaciones agudas en todo el cuerpo LECCIÓN 33: DOSIS MEDIA LETAL Y DOSIS MÁXIMA PERMISIBLE (DMP) 33.1 Dosis media letal 33.2 dosis máxima permisible (DMP) 33.3 Seguridad que brindan las DMP 33.4 Órgano crítico 33.5 Período físico, biológico y efectivo LECCIÓN 34: EFECTOS SOMÁTICOS Y GENÉTICOS DE LA RADIACIÓN 34.1 Efecto sobre el individuo 34.2 Efecto sobre la especie LECCIÓN 35: CONTACTO CORPORAL CON EMISORES GAMMA 35.1 Efectos de apuñar emisores gamma 35.2 Dosis al coger un emisor gamma Capítulo 8: Protección Radiológica LECCIÓN 36: APARATOS PARA MEDIR LA RADIACIÓN 36.1 Sumadores e intensímetros 36.2 Cámaras de gas 36.3 Dosímetros de película 36.4 Instrumentos de medida aconsejables LECCIÓN 37: BLINDAJE 37.1 Blindaje para rayos alfa 37.2 Blindaje para rayos beta 37.3 Blindaje para rayos gamma 37.4 Blindaje para rayos X 37.5 Blindaje para neutrones LECCIÓN 38: PROTECCIÓN CONTRA LAS RADIACIONES IONIZANTES 38.1 Precauciones contra fuentes externas 38.2 Fuentes encerradas y fuentes no encerradas 38.3 Precauciones contra las fuentes no encerradas LECCIÓN 39: NORMAS PARA EL TRABAJO CON FUENTES 39.1 Normas sobre descontaminación UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA LECCIÓN 40: NIVELES TOLERABLES DE CONTAMINACIÓN 40.1 Accidentes con radionúclidos Capítulo 9: Aplicaciones LECCIÓN 41: ALIMENTOS LECCIÓN 42: MEDIO AMBIENTE LECCIÓN 43: FARMACIA Y MEDICINA LECCIÓN 44: ARQUEOLOGÍA LECCIÓN 45: OTROS UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA LISTADO DE TABLAS Tabla 1. Constantes físicas Tabla 2. Núclidos con valores de A pequeños Tabla 3. Núclidos con valores de A mayores que 40 Tabla 4. Propiedades de las emisiones radiactivas Tabla 5. Valor Q (factor de calidad) para cada tipo de radiación Tabla 6. Cuadro comparativo entre reacciones químicas y reacciones nucleares Tabla 7. Radiopatía y muerte por dosis aguda en todo el cuerpo Tabla 8. Dosis máximas permisibles para exposición ocupacional Tabla 9. Algunos Blindajes típicos para radiación beta UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA LISTADO DE GRÁFICOS Y FIGURAS Figura 1. Porción de una tabla de núclidos Figura 2. Modelo nuclear de la gota líquida Figura 3. Parábola de la estabilidad de los isóbaros con A = 73. (Núclidos p-i, i-p) Figura 4. Línea de la estabilidad Figura 5. Penetración y nocividad de las radiaciones Figura 6. Partícula alfa Figura 7. Experimento de transmisión de radiaciones. El número de radiaciones absorbidas es 𝐼0 − 𝐼, y depende del espesor x del absorbedor. Figura 8. Curva exponencial de atenuación de rayos X o gamma. Se indican las capas hemirreductora y decimorreductora. Figura 9. Coeficiente másico de atenuación de rayos X y gamma en plomo, según la energía del fotón. Se indica la contribución de cada uno de los tres efectos. Figura 10. Estructura química de timina y su posterior producto Figura 11. Cámara de gas UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA UNIDAD 1 Nombre de la Unidad Introducción ESTRUCTURA NUCLEAR Y RADIACTIVIDAD La radioquímica es una rama de la química, que tiene como objeto de estudio, los materiales radiactivos, sus propiedades y su comportamiento, y la utilización de radionúclidos en el estudio de problemas químicos y biológicos. En esta primera unidad se presentan tres capítulos en los cuales se desarrollan los principios fundamentales para abordar el estudio de la Radioquímica, tales como, principios generales de la radioquímica, que incluye una breve historia del descubrimiento de la radiactividad y conceptos básicos del área; estructura nuclear como parte fundamental de la comprensión del fenómeno de la radiactividad y finalmente una introducción al conocimiento de dicho fenómeno. Justificación Intencionalidades Formativas Denominación de capítulos Como parte fundamental del curso es importante que el estudiante se apropie de conceptos de algunos términos claves para la comprensión de procesos radiactivos involucrados en el presente curso Conocimiento de los hechos históricos, conceptos y de las teorías y principios relacionados con los contenidos de la asignatura. Capítulo 1: Principios generales de la radioquímica, Capítulo 2: Estructura nuclear Capítulo 3: El fenómeno de la radiactividad UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA CAPITULO 1: PRINCIPIOS GENERALES DE LA RADIOQUÍMICA Introducción La radioquímica es una rama de la química, que tiene como objeto de estudio, los materiales radiactivos, sus propiedades y su comportamiento, y la utilización de radionúclidos en el estudio de problemas químicos y biológicos. Para introducirnos en el campo de la radioquímica, se hace necesario recordar y conocer el concepto de algunos términos indispensables para la comprensión de procesos radiactivos. En el presente capítulo se presenta inicialmente un preámbulo a los hechos históricos que originaron la radioquímica. Más adelante se presenta el concepto de palabras claves en el mundo de la radioquímica, como lo son el átomo, electrón, protón, neutrón, núcleo, elemento químico, núclido, tipos de núclidos, entre otros. Lección 1: Introducción histórica 1.1 Descubrimiento, evolución y desarrollo de la radioquímica El día 2 de marzo de 1896, se considera la fecha del descubrimiento de la radiactividad (Adloff, 1997); no obstante, existieron muchos acontecimientos anteriores que permitieron llegar a dicho descubrimiento. Así mismo, otros tantos ocurrieron posteriormente permitiendo la generación de la radioquímica. La primera evidencia de estos cambios en los núcleos fue encontrada en 1896 por el francés Henry Becquerel, como una consecuencia directa del descubrimiento, unos meses antes, de los rayos X. Becquerel encontró que una sal de uranio que guardaba en un cajón emitía ciertas radiaciones que velaban las placas fotográficas vírgenes. Parecía que el uranio despedía extrañas radiaciones. El término actual, "radiactividad", no apareció sino años después, en un trabajo de Pierre y Marie Curie, conocidos investigadores en este campo (Biblioteca digital, 2013). Pierre y Marie Sklodowska Curie concluyeron de sus estudios que los rayos provenientes del uranio eran un fenómeno de carácter atómico, el cual no estaba relacionado ni con el estado físico ni químico, y le dieron el nombre de radiactividad. Por lo tanto la radiactividad es una propiedad atómica, el otro carácter de la radiactividad, que es un fenómeno espontáneo, en el que no influye ningún agente físico conocido (Iturbe, 2001). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA En 1919, en el laboratorio de Ernest Rutherford se provocó por primera vez un cambio nuclear artificial. Desde entonces, y sobre todo a partir del descubrimiento del neutrón, los científicos nucleares encontraron un sinnúmero de nuevos núcleos atómicos y multitud de aplicaciones energéticas y no energéticas de los mismos. Algunas de ellas nos han sido de enorme utilidad, pero otras han puesto a la humanidad al borde de un cataclismo planetario (Biblioteca digital, 2013). Lección 2: Conceptos básicos Las siguientes definiciones se realizaron teniendo en cuenta lo planteado por Guzmán (1989) e Iturbe (2001), en sus respectivas obras; así como consultas en las páginas web citadas en la bibliografía. 2.1 Electrones protones y neutrones Electrón El electrón corriente es una partícula cuya masa en reposo es 9,11 x 10-31 Kg y que lleva la unidad elemental de carga eléctrica negativa, o sea 1,602 x 10-19 Culombios negativos. Se habla del “electrón corriente”, que es negativo, porque también hay electrones positivos, llamados positrones. Protón El protón corriente es una partícula cuya masa en reposos es de 1,673 x 10 -27 Kg y que lleva la unidad elemental de carga eléctrica positiva, osea 1,602 x 1019Culombios positivos. También hay protones negativos –antiprotones-, que no interesan para los fines de este curso. Neutrón El neutrón es una partícula cuya masa en reposo es de 1,675 x 10 -27 Kg y que tal como lo indica su nombre, carece de carga eléctrica. Los valores de masas y cargas de dichas partículas elementales, se encuentran resumidos en la Tabla 1. No obstante es importante recordar que tanto el protón, como el neutrón, tienen una masa casi dos mil veces mayor que la del electrón; y que la masa del neutrón es muy levemente superior a la del protón; 1,4 partes por mil de más. En las definiciones anteriores de las partículas con las que se construyen los átomos, se menciona la masa “en reposo”; pues ocurre que, a grandes velocidades, la masa aumenta, como se verá más adelante. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 2.2 Nucleones Es el nombre genérico que abarca tanto a los neutrones como a los protones. Todo protón es un nucleón; todo neutrón es también un nucleón. Por ejemplo, en un conjunto de 27 protones y 33 neutrones, hay 60 nucleones. Hay que tener presente que las masas del neutrón y del protón son prácticamente iguales, como se indicó anteriormente. Tabla 1. Constantes físicas Masa (Kg) Masa (uma) Carga (C) Carga (uec) PROTÓN 1,673 X 10-27 1 + 1,602 x 10-19 +1 NEUTRÓN 1,675 X 10-27 1 0 0 ELECTRÓN 9,11 X 10-31 0 - 1,602 x 10-19 -1 2.3 Átomo Es una partícula divisible, compuesta de un núcleo integrado principalmente por nucleones, y de un conjunto de electrones que giran alrededor de dicho núcleo (Guzmán, 1989). La masa de un átomo es sumamente pequeña, 10 -27 a 10-25 Kg. Es más cómodo indicar las masas atómicas en unidades de masa atómica (o dalton). Por definición, la unidad de masa atómica u es la 1/12 parte de la masa en reposo de un solo átomo del núclido 12C en estado fundamental nuclear y atómico, así: Masa de un átomo de 12C = 12 u = 12 dalton, 1u = 1,660565 x 1027 Kg 2.4 Dimensiones del átomo y del núcleo Considerando el átomo como una esfera, su radio va desde 49 picómetros para el menos voluminoso, que es el de helio, hasta 334 pm para el más voluminoso, que es el del Cesio. A su vez, el radio del núcleo es millares de veces menor y se cuantifica en la fórmula: R = 1,4 A1/3 En la Cual R es e radio del núcleo, en unidades “fermi”, que son fentómetros (1 fm = 10-5 metros) y A es el número de nucleones. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA No debe olvidarse que casi toda la masa del átomo está en el núcleo, porque “cada uno” de los nucleones tiene masa muy superior a la de “todos” los electrones juntos. La densidad del núcleo es inconcebiblemente grande: 140 millones de toneladas por centímetro cubico. En la superficie del planeta tierra la mayor densidad es la del metal osmio: 22,57 gramos /centímetro. Densidad tan colosal como la de los núcleos atómicos se halla en las estrellas neutrónicas. Lección 3: elementos químicos y núclido 3.1 Elemento químico Es el conjunto de átomos de un mismo número de protones. A cada elemento químico corresponde un número fijo de protones en cada uno de los átomos que lo constituyen. No es el número de electrones el que determina el carácter químico de un átomo, sino el número de protones; en efecto: un átomo puede adquirir o perder electrones, sin que por ello deje de pertenecer al respectivo elemento químico; en Cambio, la ganancia o pérdida de cualquier número de protones hace que el átomo pase a pertenecer a un elemento químico diferente del original. Las expresiones “elemento” y “átomo” guardan entre si la relación del todo a la parte; por lo regular, el “elemento" es del universo sensible; el “átomo”, en cualquier caso es del universo elemental. 3.2 Núclido Es un conjunto de átomos caracterizado por el número de protones y por el número de neutrones y, en ciertos casos en que estos dos números no bastan, por el nivel relativo de energía. 3.2.1Notación Todo núclido pertenece a determinado elemento químico. De cada elemento químico hay varios núclidos, entre naturales y artificiales. Por las definiciones se ve que, para determinar un elemento químico, basta con saber el número de protones en cada átomo; en cambio, para determinar un núclido, se requiere no sólo el número de protones, sino también el de neutrones y, a veces, también el nivel relativo de energía. Números Z, N, A. Número Z (o número atómico) es el número de protones que hay en cada átomo de un núclido o de un elemento. Recuérdese que el número de protones, por sí UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA solo, determina un elemento químico; y que el número de protones es una de las notas características en la determinación de un núclido; por eso, el concepto del número Z es aplicable a elementos y a núclidos. Número N es el número de neutrones que hay en cada átomo de un núclido. Número A (o número másico) es el número de nucleones que hay en cada átomo de un núclido. Puesto que “nucleones” es el término genérico para protones y neutrones, es claro que: A=Z+N Notación de los núclidos Un núclido se designa mediante el símbolo del elemento químico al cual pertenece y el número de sus nucleones. A veces, esta notación es insuficiente y hay que agregar la indicación del nivel relativo de energía. 𝐴 𝑍𝑋 Donde X es el símbolo químico del elemento, A es el número másico y Z es el número de protones. Es frecuente prescindir del índice Z, pues aporta información redundante con el símbolo. De este modo se acepta como notación de un núclido el nombre de un elemento seguido por un entero, que siempre se asigna al número másico. Al núclido de seis protones y seis neutrones se le puede simbolizar o designar así: carbono doce, 12C, C(12), 12C, carbono 12. El número de protones Z representa también: - El número atómico - La posición del elemento en la tabla periódica - El número de electrones alrededor del núcleo en el átomo neutro. Por otra parte, al escribir el número de nucleones, o sea el número A, se puede calcular de manera inmediata el número de neutrones, porque A = Z + N; si ya se tienen A y Z, se obtiene N por diferencia. Ej. 1. Para designar el núclido cuyos átomos tienen 6 protones y 7 neutrones, se empieza por buscar, en una tabla periódica, cuál es el elemento de 6 protones en sus átomos: es el carbono, cuyo símbolo químico es C; puesto que el núclido pedido tiene 7 neutrones en cada átomo, resulta un número A de 13 nucleones, a saber: los 6 protones y los 7 neutrones. Se escribe: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 13C; C(13); 13C; carbono 13. De estas cuatro notaciones, la primera es la más moderna; no obstante las demás son válidas y también son muy utilizadas. Ej. 2. Para designar el núclido que tiene 27 protones y 33 neutrones en cada uno de sus átomos, y que está a mayor nivel de energía (pues ocurre que hay dos núclidos diferentes, ambos de 27 protones y 33 neutrones), se escribe: 60mCo La “m” agregada al número de nucleones es una abreviatura de “metastable”. Cuando se escribe simplemente 60Co, se alude al núclido de menor nivel de energía. Ej. 3. Si son tres los núclidos que tienen iguales números Z y A, se atribuye “m2” al de mayor energía, “m1” al de energía intermedia, y solamente el símbolo químico y el número A al de menor energía. Hay, v.g., tres núclidos diferentes, cada uno de 77 protones y 115 neutrones; por tener 77 protones, los tres pertenecen al elemento químico iridio; y por tener 192 nucleones (suma de Z y N) los tres serán 192Ir; para distinguirlos, se escriben así: El de mayor energía: 192m2Ir El de energía intermedia: 192m1Ir El de menor energía: 192Ir Lección 4: Tipos de núclidos 4.1 Isótopos Son los núclidos de igual número de protones y distinto número de neutrones. Por tanto, tienen distinto número de nucleones. Puesto que los isótopos tienen igual número de protones, pertenecen al mismo elemento químico. Ejemplo: 24Mg (Z = 12, N=12), 25Mg (Z=12, N=13) y 26Mg (Z=12, N=14). 4.2 Isótonos Son los núclidos de igual número de neutrones y distinto número de protones. Por tanto, tienen distinto número de nucleones. Ejemplo: 26Mg (Z =12, N =14), 27Al (Z =13, N =14); y 28Si (Z = 14, N= 14). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 4.3 Isóbaros Son los núclidos de igual número de nucleones (igual número másico) y distinto número de protones. Por tanto, tienen distinto número de neutrones. Ejemplo: 36Ar (Z = 18, N = 18); 36Cl (Z=17, N=19) y 36S (Z=16, N=20). 4.4 Isómeros Son los núclidos de igual número de protones e igual número de neutrones, pero de distinto nivel de energía. Por tanto, tienen también igual número de nucleones. El isómero que tiene la energía más débil representa el estado fundamental. Los otros existen en estados excitados o metaestables. Ejemplo: 196m2Au, 196m1Au y 196Au; para los tres, Z = 79 y N = 117; pero el primero tiene mayor nivel de energía que el segundo, y este, a su vez, mayor nivel de energía que el tercero. 4.5 Isodiáferos Tienen el mismo exceso de neutrones con relación a los protones; la diferencia NZ = A – 2Z es constante. Ejemplo: 32 36 34 36 38 16Si, 15P, 16S, 17Cl, 18Ar Lección 5: Procedencia de los núclidos 5.1 Tabla de núclidos Así como hay la tabla de elementos químicos, llamada tabla periódica, con los elementos químicos conocidos hasta el momento, también existe la tabla de núclidos, que tiene más de 1.900 casillas, algunas de las cuales encierran dos o tres isómeros, conque el número de núclidos es cercano a 3000. Y cada año hay algunos más. La tabla de núclidos es la representación de los núclidos en el plano. En las tablas usuales de núclidos, Z crece de uno en uno de abajo hacia arriba; N crece de uno en uno, de izquierda a derecha; A, en consecuencia, crece de dos en dos, de suroeste (S.O.) a noroeste (N.E.) Por lo tanto: Los isótopos figuran en una línea horizontal. Los isótonos, en una vertical. Los isóbaros, en la dirección S.E. a N.O. Los isómeros, en la misma casilla, separados entre sí por delgadas barras verticales. (Estas explicaciones deben seguirse frente a la tabla de núclidos: ver Figura 1). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Tomado de Guzmán (1981) Figura 1. Porción de una tabla de núclidos Para localizar rápidamente en la tabla un núclido determinado, se busca de S.O. a N.E. cualquier casilla que tenga el numero A del núclido en cuestión; hecho esto, se busca de S.E. a N.O. de esa casilla, aquélla que tenga el símbolo químico del núclido de que se trate. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 5.2 Núclidos naturales Son los núclidos que, sin intervención humana, existen en el planeta Tierra en cantidad perceptible. El 14C, por ejemplo, no se considera núclido natural, porque está en proporción prácticamente imperceptible: 1,6 pg de 14C por cada gramo de carbono de los seres vivos. Algunos elementos químicos no tienen ni un solo núclido natural; ellos son: el tecnecio (Z = 43), el promecio (Z = 61) y los transuránicos (Z mayor que 92). Hay veintiún (21) elementos químicos que tienen un solo núclido natural; como el sodio, que esta únicamente como 23Na; el aluminio, como 27Al; el fosforo, como 13P; el cobalto, como 59Co. Los demás elementos se presentan en la naturaleza como una mezcla definida de dos o más núclidos. El nitrógeno tiene dos núclidos naturales; el oxígeno, tres; el hierro, cuatro, etc., hasta el estaño (Z = 50), que tiene diez. En las tablas de núclidos, bajo el símbolo de los núclidos naturales hay un número en caracteres destacados: es el porcentaje "en átomos” en que se halla el núclido natural respecto del elemento natural. Ejemplo: Bajo el símbolo del 12C (en la figura 1) se lee el numero 98,89; ello significa que por cada 100 átomos de carbono natural, hay 98,89 átomos de 12C. Como ya se ha indicado, las tablas de núclidos presentan el porcentaje “en átomos” en que se halla el núclido natural respecto de cada 100 átomos del elemento natural, Si, por cualquier razón, se desea conocer con suficiente exactitud el porcentaje “másico”, es decir, el número de gramos del núclido por cada 100 gramos del elemento natural, bastará con multiplicar el porcentaje atómico que da la tabla de núclidos por el numero A del núclido en cuestión y dividir por el peso atómico del elemento al que pertenezca el núclido. Ejemplo: El 235U, cuyo porcentaje atómico es 0,720, arrojará un porcentaje másico de: 0,720 X 235 = 0,711 % másico 238,03 5.3 Núclidos artificiales Son los núclidos que incluyen la intervención humana, para su existencia. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA CAPITULO 2: ESTRUCTURA NUCLEAR Introducción Las propiedades químicas de un elemento están relacionadas con su estructura electrónica, pero la radiactividad es una propiedad del núcleo. En 1932, se logró determinar que el núcleo estaba formado por 2 tipos de partículas: los protones y los neutrones. Los protones tienen carga positiva de 1.602x10-19C y una masa de 1.673x10-27Kg. Los neutrones no tienen carga y su masa es un poco mayor que la del protón, es decir, 1.675x10-27Kg. Los numerosos experimentos realizados por Rutherford permitieron determinar que el núcleo atómico es aproximadamente esférico y que su radio está entre los valores de 10-5m y 10-2m. Lección 6: Estructura nuclear 6.1 Masa y energía El núcleo del átomo es una agregación dinámica de partículas elementales, fuertemente cohesionadas y que genéricamente se denominan nucleones. Estas partículas son los protones, cada uno de ellos con una unidad elemental de carga positiva y los neutrones, de masa ligeramente superior a la de los protones pero eléctricamente neutros. Casi toda la masa del átomo está contenida en el núcleo (99,9%), “porque cada uno” de los nucleones tiene una masa muy superior a la de “todos” los electrones juntos. Sin embargo el núcleo ocupa un volumen muy pequeño del átomo. La densidad del núcleo es inconcebiblemente grande: tomando su valor A como masa nuclídica y calculando su volumen según la fórmula del radio nuclear (se muestra en el siguiente apartado) resulta que para cualquier núcleo, la densidad es de unos 140 millones de toneladas por centímetro cúbico. En la corteza terrestre, la mayor densidad la tiene el osmio, que tiene 22,57 g/cm3. La equivalencia de la masa y la energía es una relación fundamental de la química nuclear: E = mc2 Donde E: energía, m: masa, c: velocidad de la luz UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA De acuerdo con Aldloff (1997), la energía equivalente a una unidad de masa atómica es: E = uc2 = 1,660 x 10-27 Kg (3 x 108 ms-1)2 = 1,492 x 10-10 J La unidad de energía utilizada en química nuclear es el electrón voltio (eV) que representa la energía cinética de un electrón en el vacío bajo una diferencia de potencial de un voltio: 1 eV = 1,602 x 10-19 C x 1 voltio = 1,602 x 10-19 J A continuación expresaremos uc2 en eV: 1,492 𝑥 10−10 𝐽 𝑢𝑐 = 𝑒𝑉 = 931,5 𝑥 108 𝑒𝑉 = 931,5 𝑀𝑒𝑉 −10 1,602 𝑥 10 𝐽 2 En donde, 1 MeV = 1 millón de eV = 106 eV = 1,602 x -13 J En consecuencia e1 equivalente energético de 1u según la ecuación de Einstein es: 1u = 931,5 MeV / c2 c2 = 931,5 MeV u-1 Por tanto la expresión 1 u = 931,5 MeV que se encuentra frecuentemente en la literatura es incorrecta. Las masas en reposo (V = 0) y las energías equivalentes de los tres constituyentes del átomo son las siguientes: Protón: 1,007276u = 938,2796 MeV/ c2 Neutrón: 1,008665u = 939,5731 MeV/c2 Electrón: 5,485 x 10-4 u = 0,511 MeV/ c2 En general se indica la masa del electrón en reposo con el símbolo 𝑚0 . Hay que notar que el neutrón es más pesado que el protón. 6.2 Radio nuclear El radio del núcleo es proporcional a la raíz cúbica de su número de nucleones, según la fórmula: r = 1,4 A1⁄3 En donde r es el radio nuclear en “unidades fermi”, que son fentómetros (10-15 metros) y A es el número de nucleones o número másico. Puesto que el valor de A, va de 1 a 263, el radio del núcleo va desde 1,4 fm para el núcleo del átomo de H corriente, hasta unos 9 fm para el núcleo de A = 263 del elemento 106. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 6.3 Momento angular (spin) y momento magnético De acuerdo con Adloff (1997), los nucleones poseen un spin intrínseco s igual a ± ½. El momento angular orbital de los nucleones en el núcleo es un número entero l. El momento angular total j de un nucleón es j=l+s=l±½ El momento angular total del núcleo (spin) es la suma vectorial de los momentos angulares de todos los nucleones J = ∑ ⃗j El spin de los núcleos con A par es cero o un número entero; con A impar no es entero y en estado fundamental los núcleos par-par tienen un spin cero. La espectroscopía RMN utiliza el momento magnético de los núcleos. A pesar de su carga cero, el neutrón posee un momento magnético igual a -1,91 𝜇𝑁 (magnetones nucleares); el momento del protón es 2,79 𝜇𝑁 . Los nucleones con spin cero (J = 0) no tienen momento magnético. Todos los núcleos tienen numerosos estados excitados cuyas propiedades difieren de las del estado fundamental en cuanto a la energía, vida media promedio, forma, radio, spin, momento cuadrupolar y momento magnético. 6.4 Reacciones químicas y estructura nuclear Ninguna acción química, por violenta que sea, llega jamás a afectar la estructura del núcleo. Lección 7: Modelos nucleares 7.1 Las fuerzas naturales Existen cuatro fuerzas naturales, las cuales se asocian a vectores (bosones) y cumplen un papel de soporte en las interacciones. - Fuerza de gravitación: Es la fuerza más común; es el origen de la atracción universal y representa la fuerza más débil pero con un alcance inmenso, pues rige la caída de los cuerpos (Ley de Newton), el movimiento de los objetos celestes (Ley de Kepler) y el universo en su conjunto. La atracción de gravitación existe también a escala del átomo, núcleo y partículas, pero es del todo despreciable con relación a las otras fuerzas. Todavía no se conoce el gravitón, el vector hipotético de la fuerza de gravitación. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA - La fuerza electromagnética: La fuerza nuclear La fuerza débil 7.2 Las partículas subatómicas Las partículas pueden clasificarse de acuerdo con Adloff (1997), según la naturaleza de las interacciones (fuertes o débiles). Cada partícula está asociada con una antipartícula que tiene la misma masa y spin y se distinguen por el signo de la carga y otras propiedades. - Los leptones (“livianos”) Los hadrones (una centena) 7.3 Potencial nuclear Teniendo en cuenta que la fuerza fuerte resulta de un intercambio de mesones π con nucleones, de ahí si nombre de fuerza de intercambio. Las fuerzas nucleares no se derivan de un potencial, aunque en el núcleo no existe ninguna partícula central que pueda atraer los otros nucleones; tampoco se conoce una función matemática para describir las fuerzas nucleares, por consiguiente, éstas se representan por un potencial nuclear. La forma y la naturaleza de este potencial dependen del fenómeno que se requiere estudiar. A grandes distancias, sólo el protón sufre una repulsión coulombiana por parte de los protones dentro del núcleo. Cuando la distancia es inferior a 2,4 fm, el protón y el neutrón se encuentran en contacto con el núcleo. En estas condiciones ambos suben la fuerza fuerte de atracción nuclear y caen al interior del pozo de potencial nuclear cuya profundidad es del orden de 25 a 30 MeV. Las fuerzas nucleares tienen un alcance muy débil y se extinguen rápidamente al exterior del núcleo. 7.4 Modelo nuclear de capas A ciertos números de nucleones corresponden núcleos con una estabilidad extraña semejante a la inercia química de los átomos de gases nobles que tienen capas electrónicas completas. Estos números de nucleones, llamados números mágicos, son 2, 8, 20, 28, 50 y 82 para los protones y neutrones; 126 y 152 son números mágicos adicionales para los neutrones. Los núcleos con números mágicos de neutrones o protones son prácticamente esféricos; los núcleos doblemente mágicos tienen un número mágico de neutrones y de protones: 4He, 16O, 40Ca. El modelo de capas se basa en lo mencionado anteriormente; éste muestra que dentro del núcleo, los nucleones ocupan niveles discretos de energía y los núcleos más estables tienen capas nucleónicas cerradas. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA El efecto de los números mágicos aparece en las abundancias naturales de ciertos isotopos, por ejemplo el vanadio posee dos isotopos estables, la abundancia del 51V con un número mágico de 28 neutrones, es 99,75 %; la abundancia de 16O doblemente mágico es 99,75%, el 4He es por su abundancia el segundo elemento en el universo. Todas las familias radiactivas naturales terminan en un isótopo de plomo, número atómico 82, y una de ellas en el 208Pb doblemente mágico (con 126 neutrones y 82 protones). 7.5 Modelo de gota líquida Este es uno de los primeros modelos de la estructura nuclear, propuesto por Bohr en 1935. En él se describe el núcleo como un fluido clásico compuesto por neutrones y protones y una fuerza central coulombiana repulsiva proporcional al número de protones Z y con origen en el centro de la gota. La naturaleza mecano-cuántica de estas partículas se introduce a partir del principio de exclusión de Pauli, que establece que fermiones (los nucleones son fermiones) del mismo tipo no puede estar en el mismo estado cuántico. Así, el líquido es en realidad lo que se conoce como líquido de Fermi, en alusión al gas de Fermi que forman los electrones. Este sencillo modelo reproduce las principales características de la energía enlace de los núcleos. Es un buen modelo para predecir niveles energéticos en núcleos poco deformados. El modelo de la gota líquida (Figura 2), es un modelo muy útil en radioquímica para la descripción de los núcleos y de ciertas reacciones nucleares (Adloff, 1997). Tomado de Wikipedia, 2013. Figura 2. Modelo nuclear de la gota líquida Desde el punto de vista cuantitativo se observa que la masa de un núcleo atómico es inferior a la masa de los componentes individuales (protones y UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA neutrones) que lo forman. Esta no conservación de la masa está conectada con la ecuación de Einstein, por la cual parte de la masa está en forma de energía de ligazón entre dichos componentes. Cuantitativamente se tiene la siguiente ecuación: 𝐵 𝑚𝑁 = 𝑍𝑚𝑝 + (𝐴 − 𝑍)𝑚𝑛 - 𝑐 2 𝑚𝑁 , 𝑚𝑝 , 𝑚𝑛 , son respectivamente la masa del núcleo, la masa de un protón y la masa de un neutrón. 𝑍, 𝐴, 𝐴 − 𝑍, son respectivamente el número atómico (que coincide con el número de protones), el número másico (que coincide con el número de nucleones) y AZ por tanto coincide con el número de neutrones. 𝐵 es la energía de enlace entre todos los nucleones (Wikipedia, 2013). Lección 8: Energía de enlace del núcleo La masa M de un núclido, compuesto de Z protones, N neutrones y Z electrones siempre es más pequeña que la suma de las masas de sus constituyentes; expresadas en unidades u: 𝑀 < 𝑍𝑚𝑝 + 𝑍𝑚0 + 𝑁𝑚𝑛 < 𝑍𝑚𝐻 + 𝑁𝑚𝑛 La masa 𝑚𝐻 = 1,007825 u es la suma de la masa del protón 𝑚𝑝 y del electrón 𝑚0 (se desprecia la energía de enlace del electrón de 13,6 eV). La formación del núclido a partir de los constituyentes está acompañada de una pérdida de masa igual a 𝛥𝑀 tal que: 𝑀 = 𝑍𝑚𝐻 + 𝑁𝑚𝑁 − ∆𝑀 La masa 𝛥𝑀 que desaparece se llama defecto de masa y es convertida en la energía de enlace o de ligadura del núcleo. Por tanto cuanto mayor es la pérdida de masa, más fuertes son la cohesión y la estabilidad del núcleo (pues el núclido es relativamente más liviano). Aquí de nuevo en el balance se desprecia la energía de enlace de los electrones. Sin embargo la energía total de enlace 𝐸𝑒𝑙 de los electrones de un átomo es aproximadamente igual a la siguiente expresión: 𝐸𝑒𝑙 = 15,73 𝑍 7/3 𝑒𝑉. Dicha energía, para los átomos más pesados es aproximadamente del orden de 1 Me\/ como en el caso del 92U: 𝐸𝑒𝑙 = 15,73 (92)7/3 ≈ 6 𝑥 105 𝑒𝑉 ≪ 𝑢𝑐 2 , que comparada con la energía total de enlace del núcleo (nucleones) del átomo de 238U es ≈: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 𝑢𝑐 2 = 238 𝑢 𝑋 931,5 𝑀𝑒𝑉𝑢−1 ≈ 2 𝑥 1011 𝑒𝑉 La energía ∆𝑀𝑐 2 equivalente a la pérdida de masa, representa la energía de enlace B del núcleo, un valor siempre positivo. ∆𝑀𝑐 2 ≡ 𝐵 = (𝑍𝑚𝐻 + 𝑁𝑚𝑛 − 𝑀)𝑐 2 Como ∆𝑀 está en unidades u, la expresión anterior en MeV queda de la siguiente forma: 931,5 𝑀𝑒𝑉 1𝑢 Como B representa la energía que será liberada en la formación de los núclidos a partir de Z átomos de hidrogeno y 𝑁 = 𝐴 − 𝑍 neutrones, también representa la energía necesaria para descomponer el núclido en sus constituyentes, la cual tiene un papel semejante a la entalpia de formación de un compuesto químico, pero cambiada de signo: ∆𝑀𝑐 2 ≡ 𝐵 = [𝑍𝑚𝐻 + (𝐴 − 𝑍)𝑚𝑛 − 𝑀]𝑢 𝑥 ∆H0f = ∆H0 (productos)- ∑ ∆H0 (elementos): para una mol B = ∑ Mc 2 (nucleones + electrones) - Mc 2 (núclido): para un núclido Para calcular B es preciso sumar las masas de los constituyentes (en u) y conocer la masa exacta 𝑀 del núclido (en u). Con el fin de simplificar las operaciones se utilizan los excesos de masa atómica 𝐴: ∆= 𝑀 − 𝐴 en unidades u o MeV, en donde M es la masa atómica medida o calculada. Para el núclido 12C, M = A, entonces A = 0. El exceso de masa atómica del núclido 1H es: ∆ = 𝑀1𝐻 − 1 = 1,007825𝑢 − 1 = 7825 𝜇𝑢 = 7825 𝑥 10−6 𝑥 931,5 = 7,288 𝑀𝑒𝑉 Los Valores de los excesos de masa figuran en tablas y pueden ser negativos o positivos, por ejemplo: ∆ neutrón = 8,071; ∆ 4He = 2,425; ∆ 16O = - 4,736; ∆ 56Fe = -60,604; ∆ 238U = 47,280 MeV Para el núclido 4He, formado por 2 neutrones, 2 protones y dos electrones la energía de enlace B será: 𝐵 = [2 𝑋 1,00782 + 2 𝑋 1,008665 − 4,002602]𝑢(931,5 𝑀𝑒𝑉 𝑢−1 ) = 28,30 𝑀𝑒𝑉 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA O también usando los Valores Δ en MeV: 𝐵 = (𝑍∆𝐻 + 𝑁∆𝑛 ) − ∆ 𝑛ú𝑐𝑙𝑖𝑑𝑜 𝐵 = (2 𝑋 7,289 𝑀𝑒𝑉 + 2 𝑋 8,071 𝑀𝑒𝑉) − 2,424 𝑀𝑒𝑉 = 28,30 𝑀𝑒𝑉 y la pérdida de masa será: ∆𝑀 = 28,30 𝑀𝑒𝑉 / 931,5 𝑀𝑒𝑉𝑢−1 = 0,0304 𝑢 = 5,04 𝑋 10−29 𝑘𝑔 = 4,53 𝑋 10−12 𝐽 La fracción de la masa convertida en energía es: (28,30 𝑀𝑒𝑉 / 931 𝑀𝑒𝑉 𝑢−1 ) = 0,007533 2 𝑥 1,007825 𝑢 + 2 𝑥 1,008665 𝑢 que corresponde ≈ al 1%. En química clásica, la variación de masa en una reacción es despreciable. En la formación del 4He, Ia energía nuclear liberada sería igual a: 4,53 𝑥 10−12 𝐽 6,02 𝑥 1023 𝑎𝑡. 𝑥 = 2,73 𝑥 109 𝑘𝐽 𝑚𝑜𝑙 −1 𝑎𝑡. 𝑚𝑜𝑙 mientras que la energía de enlace entre los átomos de Cl en la molécula Cl2 equivale a 243 KJ mol-1. Como se observa, la energía nuclear es aproximadamente 106 veces mayor que la energía química, la cual equivale a la relación entre la fuerza nuclear y la fuerza electromagnética. Lección 9: Ecuación semiempírica de la masa de núclidos Según Adloff (1997), el modelo nuclear de la gota liquida explica de manera sencilla algunas propiedades del núcleo, así como el mecanismo de reacciones nucleares a baja energía (Fig. 2). Esta es una descripción estadística que no considera las propiedades individuales de los nucleones. En este modelo el núcleo se asimila a una gota liquida y los nucleones desempeñan el papel de las moléculas en el líquido. Las moléculas están ligadas por fuerzas de Van der Waals, mientras que los nucleones por fuerzas nucleares. A corta distancia los protones sufren atracción nuclear mientras que a mayor distancia, repulsión coulombiana. El modelo conduce a una ecuación semiempírica de la masa (fórmula de Weizsäcker), y sirve para calcular la masa de un núclido y la energía de enlace en función de solo dos parámetros, Z y A. La ecuación consta de 5 términos: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 𝐵 = 𝐸𝑣 + 𝐸 (1) 𝑠 (2) + 𝐸 𝑐 (3) + 𝐸 𝑎𝑠 + 𝐸 𝑎𝑝 (4) (5) (1) Energía de volumen 𝐸𝑣 Cuando el factor B/A es casi constante en un núclido dado, la energía total del núcleo es proporcional al número de nucleones, 𝐸𝑣 = 𝑎𝑣 𝐴 (2) Energía superficial 𝐸𝑠 El primer término sobrestima la energía de enlace porque los nucleones en la superficie tienen menos vecinos que los que se encuentran en la profundidad y sus energías de enlace son más débiles. El número de nucleones en la superficie es proporcional a la superficie del núcleo. El radio de la gota liquida es proporcional a 𝐴1/3 y por la superficie de la gota (4𝜋𝑟 2) varía como 𝐴2/3 , entonces: 𝐸𝑠 = −𝑎𝑠 𝐴2/3 donde el signo menos (-) indica que el término disminuye la energía de enlace. El numero relativo de nucleones que ocupan la superficie aumenta cuando A disminuye, lo que explica la disminución de B/A cuando A < 60. (3) Energía coulombiana 𝐸𝑐 Este término proviene de la repulsión coulombiana entre los protones. La energía de Coulomb entre dos especies cargadas q, q1 varia con la distancia 𝑑 como 𝑞𝑞 ′ / 𝑑; cada protón rechaza los otros (Z - 1) protones, de donde, 𝐸𝑐 ≈ 𝑍(𝑧 − 1) 𝑑 Por tanto el valor promedio de la distancia 𝑑 entre dos protones es proporcional al radio nuclear y varía como 𝐴1/3 . Haciendo 𝑍 ( 𝑍 − 𝑙) ≈ 𝑍 2 , se tiene: 𝑍2 𝐸𝑐 = −𝑎𝑐 1/3 𝐴 Este término también es negativo por cuanto disminuye la energía de ligadura del núcleo. De la variación de 𝐸𝑐 con respecto a 𝑍 2 resulta que el efecto de repulsión aumenta con respecto a A, lo cual origina la disminución continua de B/A para A > 60. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA (4) Efecto de asimetría 𝐸𝑎𝑠 En los núcleos livianos se observa que los más estables tienen el mismo número de protones y neutrones, N = Z y N/Z = 1. Estos núclidos simétricos tienen una mayor energía de enlace, pero la estabilidad disminuye cuando aumenta la asimetría N - Z = A - 2Z cuyo efecto aparece en la descripción cuántica del núcleo, de donde 𝐸𝑎𝑠 = −𝑎 (𝐴−2𝑧)2 𝐴 lo cual se hace cero en los núcleos simétricos. (5) Energía de apareamiento 𝐸𝑎𝑝 Los núcleos más estables tienen un número par de protones y neutrones, cuyo efecto también se refleja en su abundancia natural. La estabilidad disminuye para N o Z impar y es mínima para los núcleos impar-impar: 𝐸𝑎𝑝 = ± 𝑎𝑎𝑝 𝐴−1 Se utiliza el signo positivo para los núcleos par-par y negativo para los núcleos impar-impar; la expresión se hace igual a cero para los núcleos i-p o p-i que tienen un número de masa impar. Resumiendo: la energía de enlace como función de A y Z, es: 𝐵 = 𝑎𝑣 𝐴 − 𝑎𝑠 𝐴 2/3 𝑍2 (𝐴 − 2𝑍)2 𝑎𝑎𝑝 − 𝑎𝑐 1/3 − 𝑎𝑎𝑠 ± 𝐴 𝐴 𝐴 Los diferentes coeficientes (𝑎𝑣 , 𝑎𝑠 , etc.), se han determinado empíricamente ajustando con los mejores valores experimentales: 𝐵 = 14,1𝐴 − 13,0𝐴2/3 − 0,6 𝑍2 (𝐴 − 2𝑍)2 130,0 − 20,0 ± 𝑀𝑒𝑉 𝐴 𝐴 𝐴1/3 Se debe tener en cuenta que esta expresión no considera el efecto de los números mágicos. Como ejemplo, calculemos la energía de enlace del núclido 65Cu: A = 65, Z = 29, N = 65-29 = 36. Como es núclido i-p, 𝐸𝑎𝑝 = 0 y A - 2Z = 7, entonces B = 565,7 MeV. La masa M del núclido en unidades u es: 𝐵 𝑀 = 29𝑚𝐻 + 36 𝑚𝑛 − 𝐶 2 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 𝑀 = [(29 𝑋 1,0078) + (36 𝑋 1,0087)]𝑢 − 565,7𝑀𝑒𝑉 = 64,93𝑢 931,5𝑀𝑒𝑉 𝑢−1 El valor experimental es 64, 9278 u. Lección 10: Parábolas de estabilidad En este caso se consideran solamente los isóbaros, es decir; la familia de núclidos que tienen el mismo A. Ya que por el fenómeno de la radiactividad, los núclidos se desintegran en una o varias etapas en isóbaros estables. En una familia de isóbaros, el más liviano es el más estable y todos los inestables tienden a transformase en este núclido. Para un valor dado de A, encontramos que la ecuación semiempírica de B puede escribirse como una función cuadrática de Z: 𝐵 = 𝑎 + 𝑏𝑍 + 𝑐𝑍 2 , donde las constantes a, b y c dependen de A. Si se representa a B = f(Z) en el plano [Z,B], resulta una parábola para A impar (en donde 𝑎𝑎𝑝 es cero) y dos parábolas para A par según el signo del término de apareamiento. El isóbaro más liviano tiene la mayor energía de enlace y está localizado en el punto mínimo de la parábola. Se puede calcular su número atómico 𝑍𝐴 haciendo dB/dZ = 0, obteniéndose: 𝑍𝐴 = 𝐴 0.015 𝐴2/3 + 2 El Z del isóbaro más estable es el entero más cercano a 𝑍𝐴 . Si observamos la parábola de los isóbaros con A = 73 (Fig. 3) podemos ver que el valor mínimo corresponde a 𝑍𝐴 = 32,3. El isóbaro estable es el 73Ge, Z = 32. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Tomado de Adloff, 1997 Figura 3. Parábola de la estabilidad de los isóbaros con A = 73. (Núclidos p-i, i-p) En su texto Adloff (1997), presenta también las dos parábolas de isóbaros con A = 64. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA CAPITULO 3: EL FENÓMENO DE LA RADIACTIVIDAD Introducción La radiactividad fue descubierta en 1896 por el químico francés Becquerel durante sus estudios sobre la fluorescencia. Desde entonces se han desarrollado numerosas aplicaciones. Después del desastre de 1986 en Chernobyl (Ucrania), más de 6.000 niños desarrollaron cáncer de tiroides. Es un fenómeno que ocurre en los núcleos de ciertos elementos (radioisotopos) que, al ser inestables, son capaces de transformarse en núcleos de átomos de otros elementos, por medio de desintegraciones radiactivas. Este proceso libera grandes cantidades de energía, en forma de radiaciones electromagnéticas (rayos X o rayos gamma) o en emisiones de partículas (núcleos de helio, electrones o positrones, protones u otras), siendo capaz de ionizar la materia, al extraer los electrones ligados a los átomos. La energía liberada al cambiar de forma puede detectarse con un contador Geiger. En el presente capítulo se contemplan entre otros, los conceptos de actividad y concentración radiactiva, con las respectivas unidades; tipos de radiactividad, entre otros. Lección 11: Núclidos estables 11.1 Núclidos estables Son aquéllos cuyos núcleos conservan su composición y energía a través del tiempo, mientras no sufran ataques que sean capaces de afectar dichos núcleos. En la Tabla de Núclidos, los primeros estables son : 1H; 2H, 3He, 4He, 6Li, 7Li, 9Be, 10B, 11B, 12C, 13C, etc. (Se sugiere que se siga sobre la tabla de núclidos toda esta explicación, lo que exige la localización de todos y cada uno de los núclidos que se citan). 11.1.1 Línea de estabilidad Una curva con todos los núclidos estables (los ubicados en el mínimo de las parábolas isobáricas), en el plano [N, Z] o [A, N], constituye lo que se llama la línea de la estabilidad (Figura 4) o Curva de Segré (Adloff, 1997). Según Guzmán UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA (1989) es la escalera ascendente que, en la Tabla de Núclidos, conforma la sucesión ordenada de casillas ocupadas por los núclidos estables. Tomado de Educar Chile, 2013. Figura 4. Línea de la estabilidad Todos los núclidos estables están en la naturaleza, entendida ésta como la superficie de nuestro planeta; pero no todos los núclidos naturales son estables; por ejemplo: el 232 90Th está en la naturaleza, pero no es estable; otro tanto se diga 235 238 de los núclidos 234 92U, 92U y 92U. Como lo explica Guzmán (1997), la sucesión escalonada de núclidos estables línea de estabilidad-, da origen a una escalera que sube de S.O. a N.E., en ángulo que, al principio de la Tabla, es de 45 grados (sexagesimales); luego, la escalera es menos empinada. Dada la conformación de la Tabla de Núclidos, ya explicada: “N” crece de izquierda a derecha, como Ia “x” en Ia Geometría Analítica, y “Z” crece de abajo hacia arriba, como la "y" y en las coordenadas bidimensionales, ocurre que: Para valores pequeños de "A" (número de nucleones, o sea: protones más neutrones) (Tabla 2), Ia Línea de estabilidad es aquélla en que “N” es igual o aproximadamente igual a "Z" (es decir, x = y). En efecto, son estables, entre otros: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Núclido N (x) Z (y) A (x + y) 1 1 2 4He 2 2 4 6Li 3 3 6 10B 5 5 10 12C 6 6 12 14N 7 7 14 16O 8 8 16 2H Adaptada de Guzmán, 1989. Tabla 2. Núclidos con valores de A pequeños La primera excepción se presenta con el 8Be, en que N = Z = 4 y que no es estable; el único Be estable es el 9Be-9, que está en la naturaleza en 100 por ciento y para el cual N = 5; Z = 4. Para valores de A mayores que 40, la línea de estabilidad está integrada por casillas de núclidos en que N es mayor que Z. Observe los ejemplos en la Tabla 3. Núclido N (x) Z (y) A (x + y) 24 21 45 48Ti 2 2 4 51V 3 3 6 138Ba 5 5 10 139La 6 6 12 140Ce 7 7 14 8 8 16 126 82 208 126 83 209 45Sc 205 Tl 208Pb 209Bi Adaptada de Guzmán, 1989. Tabla 3. Núclidos con valores de A mayores que 40 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Observe que, después del 209Bi (Z = 83) ya no hay ningún núclido estable. Para el 209Bi, la relación N: Z es 126:83 = 1,52. Recuerde que al principio de Ia Tabla, Ia relación de estabilidad era: N: Z = 1. También se llama la atención del lector sobre esto: puesto que, como ya se sabe, "N" crece de izquierda a derecha, resulta claro que a Ia derecha de la línea de estabilidad hay exceso de neutrones; y a la izquierda hay defecto de neutrones, lo que equivale a decir: exceso de protones. Es mejor observar con atención la Tabla y comprender bien lo explicado, para que, posteriormente, se visualice por qué en ciertos núclidos hay la tendencia de que un neutrón se convierta en protón, mientras que, en otros núclidos, la tendencia es la contraria: un protón se convierte en neutrón; también se entenderá mejor la emisión de neutrones y la de protones. Lección 12: Núclidos radiactivos 12.1 Núclidos radiactivos Guzmán (1989) propone la siguiente definición: Núclidos radiactivos son aquellos núclidos que se transforman en otros núclidos, de manera espontánea y gradual a través del tiempo. - Se llaman también “radionúclidos” -. 12.2 Radiactividad Radiactividad es el cambio espontáneo y gradual de un núclido en otro núclido (Guzmán, 1989). La radiactividad es una reacción nuclear de "descomposición espontánea", es decir, un núclido inestable se descompone en otro más estable que él, a la vez que emite una "radiación". El núclido hijo (el que resulta de la desintegración) puede no ser estable, y entonces se desintegra en un tercero, el cual puede continuar el proceso, hasta que finalmente se llega a un núclido estable. Se dice que los sucesivos núclidos de un conjunto de desintegraciones forman una serie radiactiva o familia radiactiva (Foro Nuclear, 2013). 12.3 Desintegración Es el cambio espontaneo de un átomo radiactivo individual en otro átomo. Mientras la radiactividad es un fenómeno gradual de conjunto, la desintegración es un fenómeno instantáneo individual. Entre la radiactividad y la desintegración existe una relación análoga a la que hay entre los conceptos demográficos de “mortalidad" en un país y la “muerte” de cada individuo. Lección 13: Actividad 13.1 Actividad UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Es el número de desintegraciones por unidad de tiempo. Como se ve, la “Radiactividad” es el fenómeno, en tanto que la “actividad" es la medida o cuantificación del fenómeno. Es conveniente comprender a cabalidad los términos “radiactividad” “desintegración" y “actividad”. 13.2 unidades de actividad 13.2.1 Becquerelio Es la unidad de actividad en el Sistema Internacional; se define como 1 desintegración por segundo. Su símbolo es Bq. Por ser una unidad muy pequeña, casi siempre se la emplea precedida de un prefijo numérico que la multiplique: 30 GBq; 1,48 TBq. 13.2.2 Curio Es la actividad de 3,7 x 1010 desintegraciones por segundo. Su símbolo es Ci. A pesar de que no es una unidad coherente de ningún sistema, todavía se emplea bastante, lo mismo que sus múltiplos y submúltiplos: MCi, KCi, mCi, µCi, nCi, pCi, según el caso: en los cálculos de producción de radionúclidos en explosiones nucleares, se habla de megacurios (MCi); en unidades médicas de telecobaltoterapia, se trata de kilocurios (KCi), en gammagrafía industrial, solamente se emplea curios (Ci) ; en aplicaciones terapéuticas de radiofármacos, milicurios (mCi); en diagnóstico, microcurios (p,Ci); en cálculos de contaminación ambiental, nanocurios y picocurios (nCi y pCi). Por las definiciones es claro que 1 Ci = 3,7 x 1010 Bq. El numero 3,7 x 1010 desintegraciones por segundo proviene de la primera definición del curio, que aludía al número de desintegraciones por segundo que sufría un gramo de radio; hoy en día, se puede calcular el número de Bq por unidad de masa para cualquier radionúclido; el resultado que se obtenga depende de los valores que se tomen para ciertas constantes, como el número de Avogadro y otras; para el Ra-226, verbigracia, los cálculos señalan que cada gramo sufre entre 3,66 x 1010 desintegraciones por segundo (según las constantes que se empleen); estos números no estén muy lejos (en términos relativos) del 3,7 x 1010 que entra en la definición del “curio”. Lección 14: Concentración radiactiva 14.1 Concentración radiactiva Es el cociente entre la actividad de un radionúclido y el volumen liquido o gaseoso en el cual esta uniformemente distribuido. Ej.: Si se disuelven 60 mCi de 198Au en 24 mililitros de solución, la concentración radiactiva será de 2,5 mCi/mL. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 14.2 Padres e hijos El radionúclido que, por ser tal, sufre el fenómeno de la radiactividad, se llama "padre” respecto del núclido estable o radiactivo en el cual se convierte gradualmente a través del tiempo; a su vez, el producto de la radiactividad del padre se llama "hijo" respecto de aquél. Ejemplo 1. El 60Co se transforma, espontáneamente y de átomo en átomo, en estable; el 60Co es el padre del 60Ni; el 60Ni (estable) es hijo del 60Co. Ejemplo 2. El 226Ra pasa a 222Rn, que también es radiactivo; el del 222Rn; a su turno, el 222Rn, hijo del 226Ra; es padre del 218Po. 226Ra 60Ni es el padre Se da el caso que, en ciertos radionúclidos, parte de los átomos se transforma en un hijo, y la parte restante en otro hijo diferente; por Ejemplo: En el radionúclido 40K, el 89 % de los átomos se transforma en 40Ca, y el 11% en 40Ar; así el 40K tiene dos hijos ambos estables (Guzmán, 1989). Lección 15: Tipos de radiactividad Las fuentes radioactivas y su inadecuada manipulación resultan riesgosas para el ser humano debido a que la exposición no se percibe siempre por medios sensoriales o sensitivos. En general, la radiación se divide en dos categorías: ionizante y no ionizante. Son radiaciones con energía necesaria para arrancar electrones de los átomos. Cuando un átomo queda con un exceso de carga eléctrica, ya sea positiva o negativa, se dice que se ha convertido en un ión (positivo o negativo). Entonces son radiaciones ionizantes los rayos X, las radiaciones alfa, beta, gamma de neutrones. Las radiaciones ionizantes pueden provocar reacciones y cambios químicos con el material con el cual interaccionan. Por ejemplo, son capaces de romper los enlaces químicos de las moléculas o generar cambios genéticos en células reproductoras. Las no ionizantes, como su nombre lo indica, son aquellas que no pueden producir ionización sobre la materia en que inciden. A continuación se describirán las radiaciones ionizantes, las cuales son las causantes de graves daños biológicos. 15.1 Rayos alfa EI rayo alfa es una partícula compuesta de dos protones y dos neutrones, que sale del núcleo de los átomos de ciertos radionúclidos. También se conoce como “partícula alfa" (Guzmán, 1989). Su forma de decaimiento tiene lugar UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA principalmente en elementos pesados con número atómico mayor a 82 y raramente en elementos livianos. La partícula alfa tiene idéntica composición que los núcleos de 4He: 2p + 2n; su estabilidad nuclear es extraordinaria; electrostáticamente, tiene dos cargas elementales positivas, debidas a sus dos protones; su masa es casi 7300 veces mayor que la de un electrón. EI rayo alfa, después de recorrer un corto trayecto (pocos centímetros en aire, o varios micrómetros en agua), pierde Ia totalidad de su energía cinética inicial, adquiere dos electrones porque traía dos cargas positivas que tienden a neutralizarse y por este proceso el rayo alfa queda convertido en un átomo neutro de 4He. EI efecto nuclear de la emisión de una partícula alfa es el siguiente: "Z" disminuye en 2 unidades, puesto que se pierden 2 protones, y "A" disminuye en 4 unidades, porque en total se pierden 4 nucleones. A continuación, algunos ejemplos de emisores alfa; es necesario que los núclidos involucrados se localicen en la Tabla de Núclidos: 235 92𝑈 ∝ 231 90𝑇ℎ 226 88𝑅𝑎 ∝ 222 86𝑅𝑛 222 86𝑅𝑛 ∝ 218 84𝑃𝑜 Para los tres ejemplos, obsérvese que: a) El núclido de Ia izquierda es el padre, o sea el que sufre el proceso de el núclido de Ia derecha es el hijo. Al perderse un conjunto de (2p + 2n), la pérdida de los dos protones causa disminución de 2 unidades en el valor Z; esto se aprecia en Ia tabla, donde se hallará al núclido hijo 2 pisos más abajo que el núclido padre; por otra parte, la pérdida de los 2 neutrones implica un desplazamiento de dos casillas hacia la izquierda; al perderse simultáneamente dos protones y dos neutrones el núclido hijo quedara 2 niveles hacia abajo y 2 columnas hacia la izquierda de la casilla del núclido padre; Z disminuye en 2 unidades, y A disminuye en 4 unidades (Guzmán 1989). 15.2 Rayos beta 15.2.1 Rayos “beta menos" El rayo "beta menos” es un electrón negativo que sale del núcleo de los átomos de ciertos radionúclidos, inmediatamente después de que un neutrón se convierte espontáneamente en protón. También se conoce como partícula ”beta menos” y se simboliza β- . UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA La partícula β- tiene las propiedades de carga y masa de los electrones negativos. Una vez cumplida su trayectoria, lo que ocurre cuando ha perdido la totalidad de su energía, no se diferencia de cualquier electrón relativamente quieto y se une a un átomo positivamente cargado, o bien, queda como electrón libre. El efecto nuclear sobre el núclido emisor de partículas β- es el siguiente: Z aumenta en 1 unidad, puesto que en el núcleo nace un protón a costa del neutrón que deja de existir como tal; A permanece constante, pues si bien es cierto que en el proceso se pierde un neutrón, no es menos cierto que se gana un protón, y ambos son nucleones: nucleón que se pierde y nucleón que se gana se compensan; por eso A queda igual. Ejemplos: 32 15𝑃 𝛽− 231 90𝑇ℎ 14 6𝐶 𝛽− 222 86𝑅𝑛 (estable) 233 91𝑃𝑎 𝛽− 218 84𝑃𝑜 (radiactivo) (estable) Note que: a) La emisión "beta menos” conlleva transmutación de elemento, puesto que cambia el número de protones, en virtud de que un neutrón se convirtió espontáneamente en protón: el P (Z = 15) se convirtió en S (Z = 16); el C se convirtió en nitrógeno; el protactinio se convirtió en uranio. b) Los emisores de "beta menos” se acumulan a la derecha de la escalera conformada por las casillas de los núclidos estables. Ya que “N” crece de izquierda a derecha, es de esperar que, cuanto más a la derecha de la línea de estabilidad, mayor será el exceso de neutrones y, por tanto, la tendencia a que uno de los neutrones se transmute en protón; de hecho, los emisores "beta menos' situados más a la derecha, tienen como hijo a otro emisor "beta menos” y así sucesivamente, hasta llegar a la línea de estabilidad. Ej: 90Br 𝛽− 90Kr 𝛽− 90Rb 𝛽− 90Sr 𝛽− 90Y 𝛽− 90Zr (Estable) Si bien la partícula β- es un electrón negativo, debe tenerse en cuenta que no salió de la región de electrones del átomo, sino que salió del núcleo donde surgió como consecuencia de la transformación de un neutrón en protón. Por otra parte, la partícula β- sale del núcleo y luego del átomo a tremenda velocidad: desde por encima del 40 por ciento hasta por encima del 99 por ciento de la velocidad de la luz en el vacío. 15.2.2 Rayos “beta más" UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA El rayo "beta más” es un electrón positivo que sale del núcleo de los átomos de ciertos radionúclidos, inmediatamente después de que un protón se convierte espontáneamente en neutrón. Se conoce también como “partícula beta más". La partícula β+ tiene las mismas propiedades que la partícula β- en cuanto a masa, energía, velocidad y alcance; pero su calidad de electrón positivo (que es Ia antimateria del electrón ordinario), hace que, cumplida su trayectoria por agotamiento de la energía cinética, se aniquile mutuamente con un electrón corriente: las dos partículas se convierten en energía electromagnética. El efecto nuclear de la emisión de un rayo β+ es el siguiente: "Z" disminuye en 1 unidad, puesto que dejó de existir un protón; “A” permanece constante, pues si bien se perdió un nucleón (el protón), también se ganó un nucleón (el neutrón). Ejemplos de emisores β+ (localizar en la Tabla de núclidos): 11 6𝐶 𝛽+ 11 5𝐵 13 7𝑁 𝛽+ 13 6𝐶 15 8𝑂 𝛽+ 15 7𝑁 Al analizar la Tabla de Núclidos se evidencia que los emisores β+ abundan a la izquierda de la línea de estabilidad (exceso de protones), pero están acompañados por otros radionúclidos, que también sufren conversión de un protón en neutrón por un proceso muy diferente. 15.3 Captura de electrón Es el proceso por el cual uno de los electrones orbitales de los átomos de ciertos radionúclidos se precipita en el núcleo, donde neutraliza electrostáticamente un protón, que queda convertido en neutrón. Otro electrón orbital más externo Ilena la vacante dejada por el electrón que se precipitó en el núcleo; el electrón desplazado deja a su vez una vacante, que se llena con otro electrón aún más externo, y así sucesivamente, según la complejidad del átomo. El electrón capturado por el núcleo suele ser de la órbita K, pero también se presenta captura de otras órbitas. El efecto nuclear de la captura de electrón es el siguiente: “Z” disminuye en 1 unidad, por la pérdida del protón que fue neutralizado; “A” permanece constante, porque al perderse un protón y ganarse un neutrón no se altera el número de nucleones. El efecto básico en la captura de electrón es el mismo que en la emisión β+ ; pero el proceso es muy diferente: la emisión β+ es asunto puramente nuclear, mientras que la captura de electrón es un mecanismo electrónico nuclear. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Ejemplos: 49 23𝑉 ∈ 49 22𝑇𝑖 37 18𝐴𝑟 ∈ 37 17𝐶𝑙 41 20𝐶𝑎 ∈ 41 19𝐾 15.4 Transición isomérica Es el proceso por el cual el núcleo de los átomos de ciertos radionúclidos pasa de un estado de energía a otro menor, sin cambio en el número ni en la calidad de los nucleones. Esta pérdida de energía se manifiesta por la emisión de radiación electromagnética y, en menor grado, por emisión de un electrón orbital hacia el exterior del átomo. Se simboliza TI Efectos nucleares: Aunque quedan constantes los números “Z", “N” y "A", el núclido hijo tiene inferior estado de energía y diferentes propiedades físicas que el núclido padre. Ejemplos: 46𝑚 21𝑆𝑐 TI 46 21𝑆𝑐 (que es emisor β- ) 53𝑚 26𝐹𝑒 TI 53 26𝐹𝑒 (que es emisor β+ ) 137𝑚 56𝐵𝑎 TI 137 56𝐵𝑎 196𝑚2 79𝐴𝑢 TI 196𝑚1 79𝐴𝑢 (que es estable) (Que también sufre TI) 15.5 Emisión de neutrones Entre los núclidos con fuerte exceso de neutrones y con números “Z” de 33 a 37 (As, Se, Br, Kr, Rb) y Iuego de 51 a 55 (Sb, Te, I, Xe, Cs), hay varios que como alternativa minoritaria respecto de Ia emisión β- , emiten neutrones. Esto significa que, en esos radionúclidos, la gran mayoría de los átomos se desintegran por β- , pero una pequeña proporción lo hacen por expulsión de un neutrón. Ejemplos: 90 35𝐵𝑟 ∈ 140 53𝐼 ∈ 89 35𝐵𝑟 (que es emisor β- y, en menor proporción, emite neutrones) 139 53𝐼 (que es emisor β y, en menor proporción, emite neutrones) UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA EI efecto nuclear, desde luego, es la disminución de "A" en 1 unidad, por el neutrón que salió, el cual es nucleón, "Z" queda constante, Dicho número “A” es igual o cercano a 90 y 140. Los emisores de neutrones revisten decisiva importancia en el control de los reactores nucleares; pero son irrelevantes respecto de las aplicaciones médicas. 15.6 Fisión espontánea Entre los núclidos cuyo valor “Z” es igual o mayor que 90, varios sufren fisión espontánea. Este tipo de radiactividad consiste en la división de un átomo pesado en dos átomos más pequeños, de masas comparables, y en dos o tres neutrones. Los dos átomos principales en que se divide el átomo pesado se llaman “fragmentos de fisión”; sus números “A” están en relación 9 a 14, aproximadamente. Véase el ejemplo, más abajo. Si los átomos que se fisionan son muchos millones, la partición ocurre de numerosos modos, lo que origina unos 200 núclidos diferentes, cada pareja de los cuales guarda entre sí, aproximadamente, la relación mencionada: 9 a 14. Algunos radionúclidos sufren fisión espontánea en todos o casi todos sus átomos, como ocurre con el 250 96𝐶𝑚 (Localice en la Tabla de Núclidos): otros, en alto porcentaje de sus átomos, como sucede con el 256 100𝐹𝑚 ; otros, en fin, en un pequeño porcentaje, 235 como pasa con el U, que se desintegra espontáneamente por alfa y, en muy pequeña proporción, por fisión espontánea. A continuación, un ejemplo con el 235U: 235 94 139 1 1 Fisión esp. 92𝑈 38𝑆𝑟 + 54𝑋𝑒 + 0𝑛 + 0𝑛 En este ejemplo, el núclido que se fisiona es el conjunto de átomos de 235U; cada uno de esos átomos se parte en dos; en el átomo del ejemplo, los fragmentos de fisión fueron: 94Sr y 139Xe: para otros átomos de 235U, los fragmentos de fisión son diferentes; como ya se indicó, si son muchos los átomos fisionados, resultarán 200 fragmentos de fisión diferentes. Al observar el ejemplo anterior, surge la pregunta de ¿por qué entre los productos de la fisión aparecen dos o tres neutrones? Para valores grandes de “A”, la relación N: Z se aproxima a 1,5; para valores pequeños de "A", esa relación tiende a 1,0. Al romperse un átomo muy pesado, cada fragmento de fisión quedaría con exceso de neutrones; por eso ocurre la expulsión de los neutrones que acamparían siempre a los dos fragmentos de fisión. En este apartado, se habla de fisión espontánea, ya que también existe la fisión “provocada” que ocurre en los reactores nucleares y en las bombas atómicas: gradual y Controladamente en los primeros, rápida y explosivamente en las últimas. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Para avanzar otro paso en la comprensión y el manejo de la Tabla de Núclidos, busque los siguientes núclidos fisionables: 252Fm; 246Fm; 256Fm, y 244Fm, En el primero, menos del 5% de los átomos sufren fisión espontánea; el resto, o sea más del 95%, se desintegran por emisión alfa. En el segundo, más del 5%, pero menos del 95% de los átomos experimentan fisión espontánea; los demás se transmutan por emisión de partículas alfa. En el tercero, más del 95% de los átomos sufren fisión espontanea; menos del 5%, o sea los restantes, cambian por emisión alfa. En el cuarto, el 100% de los átomos presentan fisión espontanea. 15.7 Rayos gamma Hay rayos gamma nucleares y extranucleares. El rayo gamma nuclear es una onda electromagnética de alta energía, sin masa ni carga, que sale del núcleo del átomo de ciertos radionúclidos cuando ese núcleo pasa a un nivel inferior de energía. El rayo gamma extranuclear es una onda electromagnética de una sola energía, sin masa ni carga, que se produce fuera del átomo después de la emisión de rayos β+ (positrones), porque el electrón positivo (como ya se mencionó), una vez agotada su energía cinética, entra en contacto con un electrón corriente, lo que constituye un encuentro de materia con antimateria; el positrón y el electrón corriente se aniquilan mutuamente, para convertirse en dos rayos gamma, que parten en sentidos opuestos y cada uno de los cuales tiene la energía equivalente a la masa de un electrón. Hay radionúclidos que podrían llamarse "emisores gamma", como son los cuatro que se citaron al hablar de transición isomérica. Otros radionúclidos son emisores mixtos, como el 60Co que, por emisión β- , pasa primero a un estado muy efímero (picosegundos) de 60Ni; de éste, por una primera emisión gamma, a otro estado muy efímero de 60Ni; de este último a su vez, por una segunda emisión gamma, al núclido 60Ni estable. Si los mencionados estados efímeros no lo fueran tanto, si alcanzaran a durar siquiera algunos milisegundos, como ocurre con el 12Be o con 12B, figurarían en la tabla como 60m2Ni y 60m1Ni respectivamente, como sucede con los núclidos 196m2Au y 196m1Au; los estados muy efímeros no se incluyen en las tablas, por razones prácticas; normalmente interesan a los investigadores en el tema. 15.8 Rayos X El rayo X es una onda electromagnética de alta energía, sin masa ni carga, que sale de la región de electrones de un átomo, como consecuencia de los reajustes subsecuentes a la creación de vacantes en las orbitas. Si un electrón es expulsado de una órbita interna, esa remoción deja vacante una posición, que se llena inmediatamente con un electrón de alguna de las orbitas externas (no necesariamente de la órbita externa contigua); el salto del electrón UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA externo al nivel vacante, deja a su vez una vacancia, que se llena de modo análogo, por el paso de otro electrón de orbita más externa, y así sucesivamente. Los electrones que saltan de orbita externa a vacancia interior pierden energía; esa energía se manifiesta, principal pero no exclusivamente, por emisión de una onda electromagnética, que es un rayo X. Por lo regular, la expulsión de un electrón de orbita interna causa una serie de saltos electrónicos, cada uno de los cuales se cumple con pérdida de energía en forma de un rayo X; por tanto, al salir de su órbita un solo electrón, se producirán varios rayos X, cada cual de cierta energía. Considérese, por ejemplo, la salida de un electrón de la órbita K, en un elemento cuyos átomos tienen órbitas, L, M, N. En este caso se producirán cuando menos seis clases de rayos X: los que nacen de los saltos LK, MK, NK, ML, NL, NM. Son 6 energías diferentes. Como proceso de radiactividad, los rayos X se producen en la captura de electrón, principalmente de la órbita K, como ya se mencionó. Adicionalmente, habrá vacancias electrónicas y, por tanto, producción de rayos X, por una acción alternativa a la emisión gamma, que se expondrá a continuación. 15.9 Electrones de conversión Son electrones orbitales que salen despedidos del átomo, cuando hay desexcitación del núcleo y como una alternativa a la emisión de rayos gamma. Se debe tener claro que el núcleo, al pasar a un nivel inferior de excitación, generalmente emite un rayo gamma, cuya energía es igual a la cuantía de la desexcitación; sin embargo, como alternativa, la energía de desexcitación se transfiere internamente (o sea, dentro del átomo) a algún electrón de orbita cercana al núcleo; dicho electrón saldrá del átomo con una energía cinética igual a la diferencia entre la energía perdida por el núcleo y la energía de ligadura que mantenía al electrón en su órbita. La designación 𝑒𝑐𝑘 se refiere a electrones de conversión expulsados de la órbita K. Aunque se producen electrones de conversión procedentes de todas las órbitas, la probabilidad es mucho mayor para las orbitas internas, hasta el punto que solamente K y, en menor grado, L, dan contribución significativa al fenómeno. La probabilidad de producción de electrones de conversión es mayor a menor energía gamma. 15.10 Electrones de Auger Son electrones orbitales que salen despedidos del átomo como consecuencia de reajustes electrónicos provocados por vacancia de un electrón de orbita interna y como una alternativa a Ia emisión de rayos X. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Como ya se indicó, la vacancia “espontánea" de electrones ocurre por dos causas; proceso de captura de electrón y producción de electrones de conversión, también llamados "electrones de conversión interna”. La transición de electrones de orbitas externas hacia orbitas internas se cumple con pérdida de energía del sistema electrónico, pérdida que se manifiesta principalmente por emisión de rayos X, y alternativamente por expulsión de alguno de los “otros” electrones; estos son los electrones de Auger. Cuando hay una pérdida de energía del núcleo, ésta se manifiesta por emisión de rayos gamma y de electrones de conversión, alternativamente; una pérdida de energía electrónica se manifiesta por emisión de rayos X y de electrones de Auger, también alternativamente. No hay diferencia esencial entre los rayos X y los rayos 𝛾. Hay diferencias en cuanto a su procedencia, su energía promedio y su variedad. Los rayos gamma proceden del núcleo de los átomos o de la aniquilación de positrón y electrón fuera del átomo; los rayos X proceden de la región de electrones. En procesos radiactivos, la energía promedio es mayor para gamma que para X; por esta razón, en el espectro el electromagnético se acostumbra a situar los rayos gamma en una región de mayor energía (menor longitud de onda) que Ia destinada a los rayos X, aunque hoy en día ya existen máquinas que generan rayos X más energéticos que los más potentes rayos gamma; pero esos aparatos se emplean en investigaciones especiales; los equipos corrientes para uso médico y para radiografía industrial producen rayos X bastante más débiles que los rayos gamma. Finalmente, en promedio, las energías de los rayos gamma por la desintegración de un átomo son menos "numerosas” que las de los rayos X; una de las razones es la variedad de órbitas electrónicas, que implican saltos de energías muy diversas. 15.11 Emisión de protones Hay unos cuantos núclidos con exceso de protones que, como alternativa minoritaria a la emisión β+ , despiden protones. Este tipo de radiactividad reviste escasa importancia; no obstante se menciona debido a que es un tipo de radiactividad que debe conocerse. Esta se simboliza como “(p)" en algunas casillas de la Tabla de Núclidos. Ejemplos: Los isótopos 116, 118 y 120 del cesio. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA ACTIVIDADES DE AUTOEVALUACIÓN DE LA UNIDAD 1 1. Con respecto a las entidades protón, neutrón y electrón, indique: a. Cuáles de ellas son partículas? b. Cuáles tienen carga eléctrica? c. Cuáles tienen igual cantidad absoluta de carga eléctrica (sin considerar el signo de la misma)? d. Cuáles tienen igual signo de carga eléctrica? e. Cuales se encuentran dentro del núcleo?, f. cuáles tienen aproximadamente la misma masa? 2. Existe alguna diferencia entre un elemento químico y un núclido? Justifique su respuesta. 3. Exprese la diferencia entre: Isótopos, Isótonos, Isóbaros, Isómeros. Dé dos ejemplos de cada uno. 4. Indique el número de neutrones que tienen los siguientes núclidos: 14C, 26Mg, 27Al, 38Ar. 18 60Co, 5. Cuáles son los principales núclidos artificiales? 6. Qué elementos químicos no tienen ni un solo núclido natural. 7. Qué hace que un núclido sea radiactivo? 8. Defina: radiactividad, qué es actividad y desintegración. ¿Cuáles son las unidades de actividad? 9. Convierta la actividad de 0,074 mCi en: a) µCi b) Ci g) Desint/min. c) Bq d) MBq e) Desint/seg. f) Desint/hora Nota: apoyo para el punto g); 0,074 𝑚𝐶𝑖 𝑥 1𝐶𝑖 𝑥 1000 𝑚𝐶𝑖 3,7 𝑥 1010 𝑑𝑒𝑠𝑖𝑛𝑡 𝑠𝑒𝑔. 𝑥 1 𝐶𝑖 𝑥 60 𝑠𝑒𝑔. 1 𝑚𝑖𝑛. = 1,64 𝑥 108 𝑑𝑒𝑠𝑖𝑛𝑡/𝑚𝑖𝑛. 10. Que es la concentración radiactiva y cómo se puede expresar? 11. Exprese la concentración radiactiva 5,82 mCi/mL, en: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA a) µCi/mL e) GBq/cm3 b) Ci/L f) TBq/cm3 c) µCi/cm3 g) Desint/min.cm3 d) mCi/L 12. Elabore un cuadro comparativo entre los tipos de radiactividad. 13. Si Z es el número de protones de un radionúclido y A su número de nucleones; cuáles serían los nuevos valores de Z y A que tendría el núclido hijo en cada uno de los siguientes casos: a) El padre emite B+ e) Emite 𝛾 b) Emite α c) Emite n d) Emite p f) Sufre ∈ g) Sufre TI h) Emite 𝛽 − UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA FUENTES DOCUMENTALES DE LA UNIDAD 1 Adloff, J-P. (1997). Introducción a la radioquímica, Instituto de Ciencias Nucleares y Energías Alternativas, Bogotá, Colombia. Biblioteca digital (2013). Cambios nucleares y sus aplicaciones. Consultado abril 10 de 2013, en: http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/097/htm/sec_7.h tm Biblioteca digital (2013b). Interacción de la radiación y la materia. Consultado abril 30 de 2013, en: http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/094/htm/sec_6.h tm Educar Chile (2013). Fenómenos nucleares y sus aplicaciones. Consultado abril 13 de 2013, en: http://www.educarchile.cl/psu/estudiantes/Contenidos.aspx?sector=4&nivel=4&eje _tem_sem=124 Foro Nuclear (2013). ¿Qué es la radiactividad?. Consultado abril 15 de 2013, en: http://www.foronuclear.org/consultas-es/consultas-al-experto/que-es-laradiactividad Guzmán, M.E., (1989). Nucleónica Básica. Instituto de Asuntos Nucleares, Bogotá, Colombia. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA UNIDAD 2 Nombre de la Unidad Introducción Justificación Intencionalidades Formativas Denominación de capítulos COMPORTAMIENTO DE LOS MATERIALES RADIACTIVOS Los elementos radiactivos sufren una trasmutación, decaimiento o transformación como se les llama, por desintegración nuclear, para formar otros elementos. Reacción nuclear es el proceso por el cual un núcleo atómico, al ser atacado por un fotón o por una partícula, se convierte en un núcleo diferente, que emite uno o más fotones o partículas. En la presente unidad, se explica la forma en que puede interactuar la materia con las radiaciones, en qué consiste una reacción nuclear y los procesos de fisión y fusión. Como parte fundamental del curso es importante que el estudiante comprenda de qué manera puede interaccionar la materia y las radiaciones, cómo reaccionan los núcleos de un átomo y los diferentes tipos de reacciones nucleares que son empleadas en distintos campos; para que pueda aplicar los conceptos involucrados en su quehacer como profesional de la química. Comprensión de los procesos químicos y físicos relacionados con la radiactividad. Capítulo 4: Las radiaciones y la materia Capítulo 5: Reacciones nucleares Capítulo 6: Fisión y Fusión nuclear UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA CAPITULO 4: LAS RADIACIONES Y LA MATERIA Introducción Los empleos de la radiación están basados en las propiedades: penetración de la materia y depósito de energía. Las radiografías, por ejemplo, son posibles gracias a que los rayos X penetran de manera distinta a los diferentes materiales. Por su lado, en la radioterapia se busca depositar energía en los tejidos malignos para eliminarlos. Lo que le sucede a la radiación al pasar por la materia es, por tanto, de primordial interés en varios campos. Uno es el ya mencionado de la medicina. Otro, de gran importancia es el de la protección radiológica. Además, la presencia misma de la radiación en general no es evidente si no se cuenta con detectores espaciales, cuya función es hacernos notar los efectos que la radiación les induce. A continuación se describen las denominadas leyes de la radiactividad; series radiactivas naturales y artificiales más importantes; equilibrio radiactivo; entre otros, como bases fundamentales para la comprensión de la interacción radiaciónmateria. Lección 16: Leyes de la radiactividad 16.1 Ley básica de la radiactividad "La actividad de un radionúclido es directamente proporcional al número de átomos radiactivos que estén presentes en un instante dado". Según eso, si hay dos muestras de un mismo radionúclido, y en la primera hay 17 veces más átomos radiactivos que en la segunda, ocurrirá que en la primera también habrá 17 veces más desintegraciones por unidad de tiempo que en la segunda. Es muy importante distinguir entre el número de átomos radiactivos (N) y el número de átomos que se desintegran por unidad de tiempo (A); los primeros estén “en capacidad” de desintegrarse; los segundos son los que realmente se desintegran en la unidad de tiempo. La fórmula de la ley básica es: A=λ N “A” es Ia actividad, en desintegraciones por unidad de tiempo, es decir, “átomos desintegrados por unidad de tiempo”; “N” es el número total de átomos radiactivos que hay en la muestra “en un instante dado", y λ es la constante de proporcionalidad, llamada constante de desintegración o constante radiactiva. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA La constante " λ " es para un conjunto de átomos, la “fracción” de ellos que se desintegra por unidad de tiempo; aplicada a un solo átomo individual, es la "probabilidad" respecto de la unidad que ese átomo particular tiene de sufrir desintegración en la unidad de tiempo. Puesto que “fracción” y "probabilidad" son números abstractos, y por tanto adimensionales (o sea que no tienen unidad alguna de medida), las unidades de " λ " son las correspondientes a "tiempo-1”; por ejemplo para el 60Co, λ = 4,166 X 10-1 s-1; según eso, si hay una muestra de 60Co que, en un instante dado, contiene 2,400 x 1011 átomos de ese radionúclido, la actividad será, por aplicación de la formula 4,166 x 10-9 s-1 x 2,400 x 1011 átomos 4,166 x 10-9 átomos x 2,400 x 1011 átomos= 1000 segundo segundo Conviene estudiar otro ejemplo, para aclarar el concepto: supóngase que se tiene exactamente un millón de átomos del radionúclido 28Al para el cual, según Guzmán (1989), el valor de “lambda” es: λ =0,005144 s-1. La probabilidad señalada por el numerador es de 5,144 partes por mil, osea 0,514 4 por ciento, o 0,005 144 por uno; ello significa que “para cada átomo individualmente considerado” la probabilidad de sufrir desintegración en el curso del próximo segundo es de 5,144 por mil; y, para el conjunto del millón de átomos, esa misma probabilidad implica que, en el curso del próximo segundo, en realidad se desintegrarán 0,005 144 X 1 millón = 5 144 átomos. VARIACION DE “N” Y DE "A" A TRAVES DEL TIEMPO La fórmula A = λ N relaciona 𝑁 y 𝐴 para un instante dado; pero ocurre que tanto “𝑁” como “𝐴” cambian a través del tiempo; en efecto: como el radionúclido se va desintegrando, gradualmente disminuye el número de átomos disponibles, o sea que “N” disminuye conforme pasa el tiempo; por otra parte, y ya que la actividad es proporcional al número de átomos radiactivos, como lo indica la fórmula de la ley básica, esta actividad también disminuye con el transcurso del tiempo; de hecho, los valores de "𝑁" y de “𝐴” solamente permanecen durante un tiempo infinitamente pequeño, puesto que bastará un tiempo muy corto para que haya menos átomos y, en consecuencia, menos actividad; en la formula A=λ N, el único valor que no cambia es 𝜆. Dado que es necesario poder calcular los valores de “𝑁” y de "𝐴" a través del tiempo, se expresa la fórmula de la ley básica en forma de ecuación diferencial y se resuelve, con lo cual se llega, por lo pronto, a la siguiente fórmula, que indica la variación en el número de átomos radiactivos a través del tiempo: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 𝑁 = 𝑁0 𝑒 −𝜆𝑡 Fórmula en la cual: "𝑁0 " es el número inicial de átomos, el que existe en un instante de referencia denominado "tiempo cero”; “𝑁” es el número de átomos que queda cuando ha transcurrido cualquier tiempo “𝑡” contando a partir del tiempo de referencia denominado "tiempo Cero”; “𝜆” es la constante radiactiva; y “𝑒” la base de los logaritmos naturales, que es un número irracional, que no es necesario memoriza; por otra parte, no se hará énfasis en las fórmulas que se expresan en términos de “ 𝜆 ", sino en aquéllas que se dan en términos de una muy importante constante física llamada “periodo”, que se explicará más adelante. Las fórmulas que incluyen a "𝜆" que es una probabilidad por unidad de tiempo, se mencionan aquí porque se necesitan para obtener otras, que son muy usuales. A partir de la ecuación de la ley básica (A = λ N) resulta 𝑁 = 𝐴/𝜆; análogamente, 𝑁0 = 𝐴0 /𝜆; finalmente al reemplazar 𝑁 y 𝑁0 , se tendrá la variación en la actividad a través del tiempo: 𝐴 = 𝐴0 𝑒 −𝜆𝑡 en donde 𝐴0 es la actividad inicial, o sea la actividad a tiempo 0; y 𝐴 la actividad remanente cuando ha transcurrido cualquier tiempo "t”. PERIODO FISICO Llamado también “periodo de semidesintegración” o simplemente “periodo" (en inglés "half life”) es el tiempo que debe transcurrir para que el número de átomos radiactivos de un radionúclido determinado quede reducido a la mitad de su valor inicial. Como el número de átomos radiactivos es directamente proporcional a la actividad, como lo indica la ley básica, se puede definir el período de otra manera: Periodo físico es el tiempo que debe transcurrir para que la actividad de un radionúclido determinado quede reducida a la mitad de su valor inicial. El periodo físico es una constante propia de cada radionúclido; no se altera con la presión, la temperatura, la acción química ni condición ambiental alguna. Para algunos radionúclidos, es de ínfimas fracciones de segundo (Busque en la tabla de núclidos el periodo del 11Li); para otros, es de algunos segundos (Busque el 10C y lea el periodo que la Tabla le asigna); para otros es de algunos minutos (Busque C-11); horas (24Na; cerciórese); días (131l); meses (65Zn); años (60Co); siglos (192m2lr); milenios (239Pu), etc., algunos tienen periodos de muchos miles de billones de años (consulte el periodo del 204Pb). Notas: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA a) Para el valor del periodo, ha sido consultado en Guzmán (1989) b) El término “billón” debe entenderse como un millón de millones, o sea 10 12. En los Estados de Norteamérica existe el término "billion", que vale mil millones y, con gran frecuencia, se traduce “billón” lo que constituye un grave error. c) Se ha hecho alusión al periodo “físico”, porque también hay periodo "biológico” y periodo “efectivo”, ambos relacionados con radionúclidos; que se tratarán más adelante. LA CONSTANTE RADIACTIVA Y EL PERIODO Partiendo de la ecuación 𝑁 = 𝑁0 𝑒 −𝜆𝑡 y tomando como tiempo transcurrido “𝑡” 1 período; por definición de período resultará que “𝑁” (número de átomos que todavía quedan sin alteración cuando ha transcurrido el tiempo 𝑡), será igual a la mitad de 𝑁0 ; es decir: En general: 𝑁 = 𝑁0 𝑒 −𝜆𝑡 ; si se toma 𝑡 = 𝑇 (o sea un tiempo igual al período), la primera ecuación quedaría: 𝑁 = 𝑁0 𝑒 −𝜆𝑇 ; pero, por la definición de período, 𝑁= 𝑁0 𝑁0 1 ln 2 ∴ = 𝑁0 𝑒 −𝜆𝑇 ∴ = 𝑒 −𝜆𝑇 ∴ − ln 2 = −𝜆𝑇 ∴ ln 2 = 𝜆𝑇 ∴ 𝜆 = 2 2 2 𝑇 16.2 Leyes de la radiactividad en términos del período De acuerdo con Guzmán (1989) es difícil conseguir valores de 𝜆 para cada radionúclido; por lo cual, una buena tabla de núclidos debe dar los valores de los periodos físicos, de cada uno. Debido a lo anterior, es más conveniente expresar las leyes de la radiactividad en términos del período que en términos de la constante radiactiva; para ello, bastará con reemplazar a "𝜆" por su valor según la ln 2 formula 𝜆 = 𝑇 , quedando la Ley básica (A=λ N) de la siguiente manera: 𝐴= 𝑁 𝑙𝑛 2 𝑇 en donde "𝐴" es la actividad, preferiblemente en becquerelios; “N” el número de átomos radiactivos en un instante dado; "T” el periodo del radionúclido de que se trate: si la actividad se dio en becquerelios (átomos por segundo), el período se deberá reducir a segundos. La ecuación 𝐴= 𝑁 𝑙𝑛 2 𝑇 , permite interconvertir actividades y número de átomos; a su vez, el UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA número de átomos se relaciona con masas. Para aclarar lo dicho, a continuación, un problema de interconversión de “actividad” y “átomos”: - Un radioterapeuta dispone de una fuente de 2000 curios de masa del radionúclido, en gramos?. 60Co. Cuál es la Se puede suponer, con buena exactitud, que la masa nuclídica del 60Co es de 60. El periodo físico (vida media), es de 5,272 años. El año se puede considerar de 365,24 días, aunque los astrónomos lo calculan de 365,242 198 79 días, esta exactitud no es necesaria para los fines de este curso. Debe anotarse que las fuentes de 60Co son una mezcla del radionúclido 60Co y del núclido estable, natural, 59Co: los técnicos introducen en un reactor nuclear una muestra de cobalto natural, que es 59Co, de gran pureza; en el reactor, algunos trillones de átomos de 59Co sustraen 1 neutrón, con lo cual quedan convertidos en 60Co; lo cual será discutido más adelante. SOLUCIÓN: 3,7 𝑋 1013 𝐵𝑞 2000𝐶𝑖 = 2000𝐶𝑖 𝑋 = 7,4 𝑥 10 13 𝐵𝑞 𝐶𝑖 A partir de la formula 𝐴 = manera: 𝑁 𝑙𝑛 2 𝑇 ; se tienen átomos de 60Co, de la siguiente 𝐴𝑇 7,4 𝑥 1013 𝐵𝑞 𝑥 5,272 𝑎ñ𝑜𝑠 365,24 𝑑í𝑎𝑠 86400 𝑠𝑒𝑔𝑢𝑛𝑑𝑜𝑠 𝑁= = 𝑥 𝑥 ln 2 ln 2 1 𝑎ñ𝑜 1 𝑑í𝑎 = 1,7761 𝑥 1022 á𝑡𝑜𝑚𝑜𝑠 𝑑𝑒 60Co Teniendo en cuenta que 1 átomo-gramo contiene 6,02 𝑥 1023 átomos y que un átomo-gramo de 60Co equivale a 60 gramos; se tiene: 1,7761 𝑥 1022 á𝑡𝑜𝑚𝑜𝑠 𝑥 1 á𝑡𝑜𝑚𝑜𝑔𝑟𝑎𝑚𝑜 60 𝑔 𝑥 = 1,7702 𝑔𝑟𝑎𝑚𝑜𝑠 6,02 𝑥 1023 á𝑡𝑜𝑚𝑜𝑠 1 á𝑡𝑜𝑚𝑜𝑔𝑟𝑎𝑚𝑜 De acuerdo con lo anterior; una fuente de 2 KCi de 60Co contiene 1,770 g del radionúclido; el resto de su masa está constituido por 59Co estable y probablemente, por impurezas presentes en el cobalto natural; como podrían ser Fe y Ni, principalmente. También es posible calcular el número de átomos radiactivos que “quedan” después de un tiempo “t”, si se conoce cuantos había a tiempo cero y se sabe el UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA periodo “T” del radionúclido, expresando la fórmula 𝑁 = 𝑁0 𝑒 −𝜆𝑡 en términos del período: 𝑁 = 𝑁0 𝑒 − 𝑡 ln 2 𝑇 Así mismo, la fórmula 𝐴 = 𝐴0 𝑒 −𝜆𝑡 en términos del período, permite calcular qué actividad “A” queda, después de un tiempo "t”, si se sabe qué actividad “𝐴0 ” había en el instante de referencia elegido como “tiempo cero”: 𝐴 = 𝐴0 𝑒 − 𝑡 ln 2 𝑇 En cuanto a la concentración radiactiva, es directamente proporcional a la actividad, como se ve en la fórmula que la define; si se conserva constante el volumen de la solución, se tendrá: 𝐶 = 𝐶0 𝑒 − 𝑡 ln 2 𝑇 Caben dos importantes advertencias: 1- Adimensionalidad de conjunto en todo exponente. En todas las fórmulas que incluyen el cociente t/T, las unidades de tiempo y de periodo deben cancelarse entre sí. Por ejemplo, si el tiempo “t" se da en días, y el periodo “T” en años, es forzoso pasar los años a días para que las unidades de tiempo se anulen mutuamente. Ello es así, porque ningún exponente, tomado en bloque, puede tener unidades de medida; los factores individuales que componen el exponente si pueden tener unidades; pero ellas se cancelan con las unidades de otros factores del mismo exponente. En conjunto, pues, todo exponente es adimensional. (Es necesario recordar esto). 𝑡 ln 2 2- En la fórmula 𝑁 = 𝑁0 𝑒 − 𝑇 , "N" es el número de átomos que “quedan” o “restan”, o “aún existen” a tiempo "t”; no se deben confundir con los átomos que se desintegran o pierden entre tiempo "0" y tiempo “t”; los átomos desintegrados serán iguales a la diferencia entre los átomos iniciales "𝑁0 " y los átomos que todavía están vivos "N", en la misma forma en que los pesos gastados en unas vacaciones serán iguales a la diferencia entre los pesos que se tenían al comenzar las vacaciones y los pesos que quedan todavía disponibles al terminarlas. La confusión entre “átomos que quedan” y "átomos que se desintegran” es curiosamente frecuente, a pesar de que esas dos cantidades son contrarias entre sí, ya que “N” alude a átomos vivos, en tanto que los átomos desintegrados se pueden considerar átomos muertos. Análogamente, en la formula 𝐴 = 𝐴0 𝑒 − 𝑡 ln 2 𝑇 , “A” es la actividad que UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA todavía queda, que está disponible; la que se ha gastado será (𝐴0 − 𝐴); algo semejante será para las concentraciones. A modo de resumen; encontramos 4 fórmulas importantes relacionadas con las leyes de la radiactividad: 𝐴= 𝑁 𝑙𝑛 2 𝑇 (1), 𝑁 = 𝑁0 𝑒 − 𝑡 ln 2 𝑇 (2), 𝐴 = 𝐴0 𝑒 − A continuación se proponen relacionados con el tema: 𝑡 ln 2 𝑇 (3), y resuelven 𝐶 = 𝐶0 𝑒 − 𝑡 ln 2 𝑇 (4) algunos problemas ejemplos, EJEMPLO 1. Un médico nuclear tiene una fuente de 198Au que, el 17 de mayo del presente año tenía 2,664 GBq. Qué actividad quedaba para el 4 de junio del mismo año? El médico busca respuesta en microcurios. Solución: Para obtener respuesta en microcurios, hay dos caminos: el primero consiste en reducir los gigabecquerelios a microcurios y trabajar con unidades antiguas; el segundo Camino radica en trabajar únicamente en Sistema Internacional y, una vez obtenida la respuesta, pasarla a microcurios. Parece más plausible la segunda opción, por lo del Sl: Es un problema de actividades (no de átomos ni de concentraciones); por tanto sirve la fórmula tres (3): a) En unidades antiguas: 2,664 𝑥 109 𝐵𝑞 𝑥 1𝜇𝐶𝑖 = 72000 𝜇𝐶𝑖 = 𝐴0 3,7 𝑥 104 𝐵𝑞 𝑡 = 18 𝑑í𝑎𝑠 (𝑑𝑒𝑙 17 𝑑𝑒 𝑚𝑎𝑦𝑜 𝑎𝑙 4 𝑑𝑒 𝑗𝑢𝑛𝑖𝑜); 𝐴 =? 𝑇 = 2,695 𝑑í𝑎𝑠 𝐴 = 72000 𝜇𝐶𝑖 𝑒 − 18 ln 2 2,695 = 703 𝜇𝐶𝑖 b) En unidades del SI: 𝐴0 = 2,664 𝑥 109 𝐵𝑞; 𝐴 =? 𝑡 = 18 𝑑í𝑎𝑠; 𝑇 = 2,695 𝑑í𝑎𝑠 𝐴 = 2,664 𝑥 109 𝐵𝑞 𝑒 − 18 ln 2 2,695 = 2,6 𝑥 107 𝐵𝑞 Se realiza el factor de conversión de Bq a 𝜇𝐶𝑖: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 1𝜇𝐶𝑖 = 703 𝜇𝐶𝑖 3,7 𝑥 104 𝐵𝑞 Rta.: La fuente ya no tiene ni un mCi al 4 de junio; su actividad es de 700 microcurios. 2,6 𝑥 107 𝐵𝑞 𝑥 EJEMPLO 2. En el día de hoy, se tienen 87,9 µg de 125l (T = 60,14 días). ¿Cuántos becquerelios habrá dentro de 120 días? El problema tiene algunas complicaciones, porque parte de “masa” de hoy y pregunta por “actividad” posterior. Hay varias maneras de solucionarlo; a continuación se muestran dos: Primer Camino: a) Reducir la “masa” de hoy a “átomos” de hoy. b) Reducir los “átomos” de hoy a Bq de hoy. c) Reducir los Bq de hoy a Bq de fecha posterior. Segundo Camino: d) Reducir la “masa” de hoy a “átomos” de hoy, pero con una ligera variación respecto de a) e) Reducir los “átomos” de hoy a “átomos de fecha posterior” f) Reducir los átomos de fecha posterior a becquerelios en esa misma fecha posterior. Si se examinan los dos caminos o planes de solución planteados, se evidencia que, en esencia, la diferencia entre ellos consiste en que en el primer Camino se aplica la fórmula del decaimiento radiactivo a la actividad (parte C). En el Segundo Camino la fórmula del decaimiento radiactivo se aplica a los átomos (parte e). Se anota que la fórmula del decaimiento radiactivo, que se ha mencionado para "N", para "A" y para "C" (átomos, actividades y concentraciones radiactivas), también se puede aplicar a "masas radiactivas”, lo que da origen a otros caminos de solución. Desde luego, cualquiera que sea el Camino, se debe llegar al mismo resultado. Primer Camino: a) Calcular átomos de hoy: 1𝑔 1 á𝑡𝑜𝑚𝑜𝑔𝑟𝑎𝑚𝑜 6,02 𝑥 1023 á𝑡𝑜𝑚𝑜𝑠 87,9 𝜇𝑔 = 87,9𝜇𝑔 𝑥 𝑥 𝑥 106 𝜇𝑔 125 𝑔 1 á𝑡𝑜𝑚𝑜𝑔𝑟𝑎𝑚𝑜 = 4,2333 𝑥 1017 á𝑡𝑜𝑚𝑜𝑠 𝑑𝑒 ℎ𝑜𝑦 b) Se emplea la fórmula de interconversión de “átomos” y “actividades” (fórmula (1)): UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 𝐴= 𝑁 𝑙𝑛 2 4,2333 𝑥 1017 á𝑡𝑜𝑚𝑜𝑠 = = 5,6471 𝑥 1010 𝐵𝑞 𝑇 60,14 𝑥 24 𝑥 3600 𝑠 c) Decaimiento de la actividad calculada anteriormente en 120 días: 𝐴 = 𝐴0 𝑒 − 𝑡 ln 2 𝑇 = 5,6471 𝑥 1010 𝐵𝑞 𝑥 𝑒 − 120 𝑑 𝑥 𝑙𝑛2 60,14 𝑑 = 1,42 𝑥 1010 𝐵𝑞 Segundo camino: d) Masa de hoy a átomos de hoy (con una ligera variación respecto de a)): 106 𝑔 6,02 𝑥 1023 𝑢 1 á𝑡𝑜𝑚𝑜 87,9 𝜇𝑔 = 87,9𝜇𝑔 𝑥 𝑥 𝑥 = 4,2333 𝑥 1017 á𝑡𝑜𝑚𝑜𝑠 1𝜇𝑔 1𝑔 125 𝑢 e) Átomos de fecha posterior: 𝑁 = 𝑁0 𝑒 − 𝑡 ln 2 𝑇 = 4,2333 𝑥 1017 á𝑡𝑜𝑚𝑜𝑠 𝑥 𝑒 − 120 𝑑 𝑥 𝑙𝑛2 60,14 𝑑 = 1,0617𝑥 1017 á𝑡𝑜𝑚𝑜𝑠 𝑓𝑖𝑛𝑎𝑙𝑒𝑠 f) Conversión de los átomos finales en “Bq finales”: 𝑁 𝑙𝑛 2 1,0617𝑥 1017 á𝑡𝑜𝑚𝑜𝑠 𝑥 ln 2 𝐴= = = 1,42 𝑥 1010 𝐵𝑞 𝑇 60,14 𝑥 24 𝑥 3600 𝑠 Lección 17: Actividad específica Esta expresión tiene tres significados distintos, dado que ningún autor asigna diferente nominación formal para los tres conceptos, Guzmán (1989) estima necesario subsanar ambigüedades, de la siguiente manera: 17.1 Actividad específica nuclídica Es el cociente entre la actividad de un radionúclido y su propia masa radiactiva. Se simboliza con 𝐴𝑒𝑛 . Formula: 𝐴𝑒𝑛 = 𝐴 𝑀𝑛 La 𝐴𝑒𝑛 , es una constante propia de cada radionúclido; lo único que varía son las unidades en que se expresa: antes de la adopción del Sistema Internacional se daba en Ci/g; ahora se puede expresar en Bq/Kg. Hay publicaciones científicas que dan la actividad específica nuclídica de un buen número de radionúclidos, pero no hace falta consultar esos datos, puesto que es fácil calcularlos, sin más UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA informacion que la del periodo (Tabla de Núclidos) y Ia masa nuclidica (que, con error inferior al 1%, tiene el mismo valor que el número másico o el de nucleones: 60 para el 60Co, 235 para el 235U, etc. Para calcular la actividad especifica nuclidica de cualquier radionúclido, se debe partir de cualquier actividad, convertir dicha actividad en número de átomos, por Ia 𝑁 𝑙𝑛 2 fórmula 𝐴 = 𝑇 . Luego, convertir ese número de átomos en gramos. Finalmente, dividir la actividad con que se ha trabajado por la masa resultante de los pasos anteriores. Como ejemplo ilustrativo: calcular la 𝐴𝑒𝑛 del 226Ra (T = 1600 años). La masa nuclídica, como ya se ha dicho varias veces, se puede tomar como 226, con error inferior al 1%. Si se necesita conocer la 𝐴𝑒𝑛 en Ci/g, en atención a que la primera definición de curio se basaba en 1 gramo de radio: en consecuencia, se parte de 1 Ci, o sea: 3,7 E(10) Bq. Por pasos: a) Conversión de la actividad en número de átomos: 𝑁 𝑙𝑛 2 𝐴𝑇 ∴𝑁= 𝑇 ln 2 𝑑í𝑎𝑠 10 3,7𝑥 10 á𝑡𝑜𝑚𝑜𝑠/𝑠 𝑥 1600 𝑎ñ𝑜𝑠 𝑥 365,24 1 𝑎ñ𝑜 𝑥 86400 𝑠/1 𝑑í𝑎 𝐴= = ln 2 = 2,6952 𝑥 1021 á𝑡𝑜𝑚𝑜𝑠 b) Conversión de los átomos en gramos: 2,6952 𝑥 1021 á𝑡𝑜𝑚𝑜𝑠 𝑥 1 á𝑡𝑜𝑚𝑜𝑔𝑟𝑎𝑚𝑜 226 𝑔 𝑥 = 1,0118 𝑔 23 6,02 𝑥 10 á𝑡𝑜𝑚𝑜𝑠 1 á𝑡𝑜𝑚𝑜𝑔𝑟𝑎𝑚𝑜 c) Cociente entre la actividad utilizada y su masa: 𝐴= 𝐴 1 𝐶𝑖 = = 0,99 𝐶𝑖/𝑔 𝑀𝑛 1,0118 𝑔 En el sistema internacional: 𝐴𝑒𝑛 3,7 𝑥 1010 𝐵𝑞 = = 36,6 𝑇𝐵𝑞/𝐾𝑔 0,0010118 𝐾𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 17.2 Actividad específica química Es el cociente entre la actividad de un radionúclido y la masa total del elemento químico al cual pertenece. La masa del elemento incluye: a) La masa del propio radionúclido, puesto que todo radionúclido es un núclido, y todo núclido pertenece a algún elemento quimico. b) La masa de los isotopos que acompanan al radionuclido, si los hay. (A veces, el radionuclido no esta acompañado por ninguno de sus isotopos, lo que origina el concepto de "carrier free", que se menciona poco mas adelante). La actividad especifica quimica se simbolizara con 𝐴𝑒𝑞 . Fórmula: 𝐴 𝑀𝑞 Por lo regular, los radionúclidos estan incorporados de manera uniforme en la masa del elemento químico natural que es isotópico respecto del radionúclido. Asi, el 60Co, potente emisor gamma, esta distribuído dentro de cobalto elemental estable. El 198Au, emisor de beta menos y gamma, a veces viene en alambres de oro puro. El 32P, si se trata de fuente solida, suele estar incorporado en P natural. Algunas veces no hay isotopo estable del radinúclido, casos en los cuales se dice que el radionúclido esta libre de portador, más adelante se hará referencia a esto. 𝐴𝑒𝑞 = 17.3 Actividad específica global Es el cociente entre la actividad de un radionuclido y la masa total de la sustancia en que se halla uniformemente distribuido. La masa total incluye: a) La masa del propio radionuclido. b) La masa de los isótopos acompañantes, si los hay. c) La masa de los núclidos no isotópicos acompanantes, si los hay. La actividad especifica global se simbolizará con 𝐴𝑒𝑔 . Su fórmula: 𝐴𝑒𝑔 = 𝐴 𝑀𝑔 Para obtener la 𝐴𝑒𝑔 bastaré con determinar la masa total mediante una balanza. Hay que anotar que el radionúclido deber estar uniformemente distribuido en la masa que lo acompaña; en este aspecto la actividad es específica se asemeja a la concentracion radiactiva; no debe olvidarse, sin embargo, que la concentración inplica la distribución de un radronúclido en un fluido (líquido o gas), mientras que la actividad específica alude a la distribucion de un radionúclido en sólido. Ejemplo de cálculo de las tres actividades específicas Suponga que se tienen 148 GBq de 32P (T = 14,3 días). El radionúclido está incorporado en una masa 5860 gramos de fosfato trisódico dodecahidratado Na3PO4 + 12 H2O, cuyo peso molecular es de 380,12. Calcular las actividades UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA específicas nuclídica, química y global; se piden respuestas en unidades del Sistema Internacional. Las tres actividades especificas tienen el mismo numerador, o sea la actividad, que es de 148 E(9) Bq. Puesto que solamente varia el valor de los denominadores, se debe calcular, sucesivamente, a) La masa nuclídica del 32P ; b) La masa química del fosforo ; c) La masa global, que ya esta dada por el enunciado. a) Cálculo de la masa nuclídica del 32P: 𝐴= 𝑁 𝑙𝑛 2 𝐴𝑇 148 𝑥 109 á𝑡𝑜𝑚𝑜𝑠 𝑥 143 𝑥 3600 𝑠 ∴𝑁= = = 2,6381 𝑥 1017 á𝑡𝑜 𝑇 ln 2 𝑠 𝑥 ln 2 2,6381 𝑥 1017 á𝑡𝑜𝑚𝑜𝑠 = 2,6381 𝑥 1017 á𝑡𝑜𝑚𝑜𝑠 𝑥 1 á𝑡𝑜𝑚𝑜𝑔𝑟𝑎𝑚𝑜 32 𝑔 𝑥 23 6,02 𝑥 10 á𝑡𝑜𝑚𝑜𝑠 1 á𝑡𝑜𝑚𝑜𝑔𝑟𝑎𝑚𝑜 = 1,4023 𝑥 10−5 𝑔𝑟𝑎𝑚𝑜𝑠 = 1,4023 𝑥 10−8 𝐾𝑔 = 𝑀𝑛 b) Cálculo de la masa química del fósforo: La masa química (probablemente sería mas correcto llamarla "masa isotópica”) está conformada, por la masa nuclídica del 32P (que se acaba de calcular) y por la masa de fósforo estable contenido en la masa de fosfato trisodico hidratado; hay que evaluar ésta: El Na3PO4 + 12 H2O se puede condensar así: Na3PO16H24 cuyo peso molecular es 380,12; la molécula contiene un (1) solo atomo de P, que tiene peso atómico de 30,97376; con una regla de tres simple: Si en 380,12 gramos de la sal hay 30,97376 gramos del elemento fósforo, en los 5860 gramos de la sal cuantos gramos de P habrá; esto arroja 477, 50 gramos de P. Luego 𝑀𝑞 = 1,4023 𝑥 10−8 𝐾𝑔 + 0,47750 𝐾𝑔 = 0,47750 𝐾𝑔, c) Masa global 5860 gramos = 5,860 Kg. Aplicando las fórmulas: 𝐴𝑒𝑛 = 148 𝑥 109 𝐵𝑞 1,0554 𝑥 1019 𝐵𝑞 = 1,4023 𝑥 10−8 𝐾𝑔 𝐾𝑔 = 10,6 𝐸𝐵𝑞 (𝑒𝑥𝑎𝑏𝑒𝑐𝑘𝑒𝑟𝑒𝑙𝑖𝑜 𝑝𝑜𝑟 𝐾𝑔) Kg UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 𝐴𝑒𝑞 = 𝐴𝑒𝑔 148 𝑥 109 𝐵𝑞 3,0995 𝑥 1011 𝐵𝑞 𝐺𝐵𝑞 = = 309 0,47750 𝐾𝑔 𝐾𝑔 Kg 148 𝑥 109 𝐵𝑞 2,5256 𝑥 1010 𝐵𝑞 𝐺𝐵𝑞 = = = 25,3 5,860 𝐾𝑔 𝐾𝑔 Kg RADIONÚCLIDO LIBRE DE PORTADOR (“CARRIER FREE”) Es cualquier radionúclido que no esté acompañado por ninguno de sus isótopos estables. Por ejemplo, si una muestra que tiene 1,11 gigabecquerelios (30,0 milicurios) de 113mln uniformemente distribuidos en 8 kilogramos de azufre pulverizado puro, sin que haya nada de indio estable (113ln + 115In), se dice que se dispone de 113mln libre de portador; el azufre acompañante no afecta la calidad de "libre de portador”, porque no es isótopo del 113mIn. Lección 18: Series radiactivas Una serie radiactiva es el conjunto de tres o más núclidos genéticamente consecutivos. Por “genéticamente consecutivos” se entiende que cada núclido intermedio (es decir, todos menos el primero y el último) es hijo del anterior y padre del siguiente; en otras palabras, cada núclido, excepto el primero fue engendrado por otro de la misma serie; o cada núclido excepto el último, engendró a otro de la misma serie. Toda serie completa termina con un núclido estable; pero dentro de cada serie, se pueden estudiar conjuntos parciales. Por tanto, una serie radiactiva, incluye, como mínimo, dos radionúclidos que tienen la relación “padre-hijo”. Existen series naturales y artificiales. Entre éstas últimas hay algunas de gran interés en medicina, como por ejemplo: 90Sr 𝛽− (28,5 años) → 99Mo 113Sn 𝛽− (66 h) → 90Y 99mTc 𝜖 (115,1 d) → 𝛽− (64,1 h) → 𝑇.𝐼. (6 h) → 113mIn 99Tc 90Zr (estable) 𝛽− (210000 años) → 𝑇.𝐼. (99,48 min.) → 113In 99Ru (estable) (estable) 18.1Series radiactivas naturales En la naturaleza hay tres series muy conocidas y de gran importancia: la del Uranio, la del torio y la del actinio. Pero hay otras menos conocidas y menos UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA importantes como la serie del gadolinio (de cuatro eslabones) y la del platino (de tres eslabones): Serie del gadolinio: 𝛼 152Gd (1,1 x 1014 años) → 𝛼 años) → 140Ce (estable). 148Sm 𝛼 (7 x 1015 años) → 144Nd (2,1 x 1015 Serie del platino: 190Pt 𝛼 (6,1 x 1011 años) → 186Os 𝛼 (2 x 1015 años) → 182W (estable). La definición de serie radiactiva, alude a tres eslabones como mínimo; razón por la cual; no es posible considerar series iniciadas por 174Hf, 147Sm y 40K; debido a que estos radionúclidos naturales dan origen a secuencias de dos eslabones únicamente. LAS TRES SERIES NATURALES MÁS IMPORTANTES Son la serie del Uranio, que inicia con 238U; la serie del torio, que se inicia con 232Th y la serie del actinio, iniciada con 235U. Serie del uranio Esta serie comienza con 238U (T= 4,47 x 109 años) y termina con el 206Pb (estable). Se conoce como “serie 4n+2” porque todos los eslabones de la cadena tienen número A que al ser dividido por 4, deja residuo 2. Más adelante se verá porque se hace relación al divisor 4 y no a otro dígito. La vcadena incluye radionúclidos de gran interés, por sus aplicaciones; como el 238U, 226Ra, 222Rn, 210Pb. Serie del torio Empieza con el 232Th (T = 1,405 x 1010 años) y acaba en el 208Pb (estable). Se denomina “serie 4n”, porque todos los núclidos de esta cadena tienen número A que es múltiplo exacto de 4. Serie del actinio Se inicia con el 235U (T = 1,405 x 1010 años) radionúclido, cuyo nombre primitivo era “actinouranio” y termina en el 207Pb (estable). Se designa como “serie 4n+3” porque todos sus eslabones tienen número A que al dividirse por 4 deja residuo 3. 18.2 Serie artificial del neptunio Los científicos produjeron artificialmente la serie 4n+1; en vista de que no existía dicha serie en la naturaleza. Dicha serie es la serie del neptunio; la cual parte del 237Np (T = 2,14 x 106 años) y acaba en 209Bi (estable). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 18.3 Tipos de radiación en las cuatro series mas importantes (serie del U, Th, actinio y Np) Cada miembro de las cuatro series radiactivas, excepto el núclido final estable, toma uno de los siguientes caminos: o emite α, o emite β-, o emite α y β- en determinadas proporciones; en cada caso, con o sin radiación gamma. La radiación γ no altera a A; la radiación β-, tampoco; por su parte la radiación α disminuye al número A en 4 unidades; lo cual edxplica; la razón por la cual cualquiera que sea el tipo de radiación de un miembro de la serie, su número A sólo puede diferir del número A de otro miembro de la misma serie en un múltiplo entero de 4 (incluyendo cero). Así mismo el residuo resultante de dividir cualqier A de una misma serie por el número 4, es constante; este residuo sólo puede ser 0, 1, 2, 3; por estas razones, sólo pueden existir series 4n, 4n+1, 4n+2 y 4n+3. Lección 19: Actividades de padre e hijo radiactivos 19.1 Casos generales Hay conjuntos “padre + hijo”, ambos radiactivos, cuyas respectivas actividades es necesario calcular para tiempo t, apartir de un momento llamado cero. En las ecuaciones que se mostrarán, se empleará subídice 1 para el padre y 2 para el hijo; las letras y los números diferentes de 1 y 2 que aparezcan como subíndices, harán referencia al tiempo trancurrido; es decir, A 20 significa actividad del hijo a tiempo cero. Para todas las ecuaciones se supondrá que a tiempo cero, hay cierta actividad del padre (A10) y ninguna actividda del hijo, osea: A20 = 0 (ni un solo atomo del hijo). Desde el tiempo t = 0, empieza a decaer el padre, y es precisamente ese decaimiento radiactivo el que engendra los átomos radiactivos del hijo. La presencia de estos átomos radiactivos, origina actividad, con la cual el hijo empieza a aumentar en actividad, mientras el padre disminuye continuamente en actividad y en número de átomos radiactivos. No obstante, el hijo a su vez sufre su propio decaimiento radiactivo, con que su actividad, por lo que su actividad no crece indefinidamente; llegará el isntante en que la actividad del hijo alcance un límite (su máxima actividad), de allí en adelante, la actividad del hijo disminuye ininterrumpidamente, hasta que agotado completamente el padre, ya no habrá tampoco actividad del hijo. A continuación se muestran las ecuaciones respectivas. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA - Actividad del padre através del tiempo en términos de A y T: 𝐴1𝑡 = 𝐴10 𝑒 - − 𝑡 𝑙𝑛 2 𝑇1 Actividad del hijo através del tiempo: 𝐴2𝑡 = 𝐴10 𝑡 𝑙𝑛 2 𝑡 𝑙𝑛 2 𝑇1 − − [𝑒 𝑇1 − 𝑒 𝑇2 ] 𝑇1 − 𝑇2 Actividad máxima del hijo Como ya se indicó, la actividad del hijo crece continuamente desde cero hasta un máximo; luego decrece continuamente hasta el agotamiento del padre. Para hallar el instante en que ocurre la máxima actividad, se utiliza la ecuación: 𝑡𝑚 = 𝑇1 𝑇2 ln(𝑇1 /𝑇2 ) 𝑇1 − 𝑇2 ln 2 Actividad del padre a tiempo 𝑡𝑚 En el instante en que el hijo alcanza su máxima actividad, la actividad del padre es igual a la actividad del hijo; para 𝑡 = 𝑡𝑚 , la curva de actividad del padre se corta con la actividad del hijo. Por lo que 𝐴1 = 𝐴2 . Relación de actividades a través del tiempo: 𝑡 ln 2 (𝑇1 −𝑇2 ) 𝐴2𝑡 𝑇1 − 𝑇1 −𝑇2 = [1 − 𝑒 ] 𝐴1𝑡 𝑇1 − 𝑇2 Lección 20: Equilibrio radiactivo Equilibrio radiactivo entre dos radionúclidos “padre + hijo” es aquella situación en que, a partir de cierto instante y hasta el agotamiento de los radionúclidos, su relación de actividades es prácticamente constante. Un radionúclido puede considerarse agotado, cuando ha sufrido desintegración durante diez períodos o más sin haber experimentado reposición total o parcial de los átomos desintegrados. En diez períodos la actividad inicial queda reducida a menos de la milésima parte (1 / 1024); ningún radionúclido cuya actividad se reduzca a menos de la milésima parte sirve para los propósitos para los cuales se adquirió. En diez períodos las fuentes de telecobaltoterapia quedarían con menos curios que dedos hay en una mano; una fuente líquida, destinada a fines terapéuticos, cuya actividad inicial fue por ejemplo, de 111 megabecquerelios, al cabo de diez periodos de decaimiento sin reposición queda reducida a menos de tres microcurios; etc. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 20.1 Equilibrio radiactivo según la teoría Equilibrio transitorio en la teoría El equilibrio transitorio entre dos radionúclidos (padre + hijo), se alcanza en la ecuación que relaciona las actividades a través del tiempo: 𝑡 ln 2 (𝑇1 −𝑇2 ) 𝐴2𝑡 𝑇1 − 𝑇1 −𝑇2 = [1 − 𝑒 ] 𝐴1𝑡 𝑇1 − 𝑇2 Siempre y cuando se cumplan dos condiciones: - En primer lugar, 𝑇1 > 𝑇2 - Segundo: 𝑡 ≫ 𝑇2 De acuerdo con (Guzmán 1989), la ecuación que representa el equilibrio transitorio, es la siguiente: 𝐴2𝑡 = 𝐴1𝑡 𝑇1 𝑇1 − 𝑇2 Equilibrio secular Guzmán (1989) propone que se entienda por equilibrio secular, aquel tipo de equilibrio que se expresa en la siguiente ecuación: 𝐴2𝑡 =1 𝐴1𝑡 No obstante, se deben cumplir las condiciones propuestas por Guzmán (1989) para considerarse que existe tal equilibrio. 20.2 Equilibrios y no equilibrios A continuación se plantea, analiza y resuelve un problema a modo de ejemplo. En éste se contemplarán y resolverán las siguientes cuestiones: a) Presentación del par radiactivo “padre + hijo”, con sus respectivos periodos y tipos de radiactividad. b) Reducción de los periodos a una unidad común de medida para facilitar los cálculos. c) Análisis que determine si el par considerado es posible de equilibrio radiactivo o no. Si lo es, se debe hacer el cálculo del momento en que inicia el equilibrio. d) Si hay equilibrio radiactivo, determinar si es transitorio o secular. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA e) Determinar el instante de máxima actividad del hijo radiactivo. Se utilizará (e), para indicar que el núclido es estable, (a) para años que se considerará 1 año como 365,24 días. Ej. 1) El caso del 90Sr a) 90Sr (28,5 a) β- 90Y (64,1 h) β- 90Zr (e). b) T1 = 249824,16 h, T2 = 64,1 h c) T1 > T2 porque 249824,16 h > 128,2 h. El par 10 𝑇1 𝑇2 equilibrio radiactivo que empezará a 𝑡 = 𝑇 −𝑇 1 = 90Sr + 90Y si es posible de 2 10 𝑥 249824,16 x 64,1 ℎ = 641,16 ℎ = 26,715 𝑑 249824,16 − 64,1 d) T1 > 1001 T2 porque 249824,16 h > 641164,1 h; por tanto, habrá equilibrio secular. e) 𝑡𝑚 = (𝑇1 𝑇2 ) ln(𝑇1 /𝑇2 ) (𝑇1 − 𝑇2 ) (ln 2) = 249824,16 x 64,1 𝑥 ln(249824,16/64,1) (249824,16 −64,1)(ln 2) ℎ = 764,8 ℎ = 31, 867 𝑑. 20.3 Equilibrio secular de todos los eslabones. Hasta el momento se ha hablado del posible equilibrio de “padre + hijo” radiactivos. Sin embargo, si el primer padre de una serie tiene periodo mucho mayor que el de cualquiera de sus descendientes, al cabo de cierto tiempo se produce el equilibrio secular entre todos los radionúclidos de la serie, los cuales adquieren la actividad del primer padre, lo cual se expresa en la siguiente ecuación: 𝐴1 = 𝐴2 = 𝐴3 = ⋯ = 𝐴𝑢 𝐴1 es la actividad del primer padre de la serie; 𝐴2 es la actividad del primer hijo, que desempeñará el papel de segundo padre; 𝐴3 es la actividad del tercer eslabón de la serie y así sucesivamente, hasta incluir a Au, que es el último eslabón radiactivo de la cadena. Este equilibrio general se presenta en las tres series naturales (la del uranio, la del actinio y la del torio), que cumplen holgadamente con los requisitos que tal equilibrio exige, puesto que en las tres series el periodo físico del primer padre (sea 238U, 235U o 232Th) es muchísimo mayor que el período de cualquiera de sus descendientes; además el tiempo transcurrido es muy grande, como si hubieran pasado por lo menos cuatro mil quinientos millones de años desde la formación de la tierra. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA CAPITULO 5: REACCIONES NUCLEARES Introducción El término reacción nuclear se aplica a una variedad de procesos que involucran colisiones entre núcleos. En una reacción nuclear típica inciden núcleos a sobre núcleos blanco X. Los núcleos a y X interactúan a través de las fuerzas nucleares (y electromagnéticas si alguno de ellos tiene carga eléctrica no nula) y producen nuevos núcleos b e Y. En este capítulo se describen cómo y porque pueden ocurrir las radiaciones nucleares y los conceptos que ello involucra. Lección 21: Interacción de las radiaciones y la materia Todos los empleos de la radiación están basados en cualquiera de las dos siguientes propiedades: penetración de la materia y depósito de energía. Las radiografías, por ejemplo, son posibles gracias a que los rayos X penetran de manera distinta a los diferentes materiales. Por su lado, en la radioterapia se busca depositar energía en los tejidos malignos para eliminarlos. Lo que le sucede a la radiación al pasar por la materia es, por tanto, de primordial interés en varios campos. Uno es el ya mencionado de la medicina. Otro, que más nos incumbe aquí, el de la protección radiológica. Además, la presencia misma de la radiación en general no es evidente si no se cuenta con detectores espaciales, cuya función es hacernos notar los efectos que la radiación les induce. 21.1 Energía de las radiaciones Toda radiación, sea nuclear o electrónica, sale del átomo provista de determinada energía, que cede gradualmente a la materia a lo largo de su trayectoria. La sesión de energía se manifiesta en cambios físicos, químicos y biológicos. Entre tales cambios uno de los más importantes es la ionización, que ya se ha mencionado. 21.2 Poderes de penetración y de ionización A mayor ionización “por unidad de recorrido” que cause una radiación, menor es su alcance o poder de penetración. Las partículas alfa, por ejemplo, al atravesar el aire arrancan unas mil veces más electrones en cada milímetro de recorrido, que las partículas beta de igual energía inicial; pero la alfa solamente penetra unos milímetros en aire, en tanto que la beta llega a varios metros en el mismo medio. Hay por lo menos dos razones para que las partículas alfa ocasionen tan intensa ionización y tengan tan poco alcance en comparación con las partículas beta; por una parte su lentitud; y por otra, su doble carga. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Lo anterior se explica, porque por un lado, la alfa es muy pesada; tiene unas 7300 veces mayor masa que la beta; a igual energía cinética, la velocidad es menor para mayor masa; como consecuencia, la alfa es mucho más lenta que la beta; siendo tan lenta, tiene más tiempo para actuar sobre las moléculas del medio que atraviesa. Por otro lado, la alfa está conformada por dos protones y dos neutrones; por consiguiente, está dotada de dos (2) cargas eléctricas elementales; la beta es un electrón negativo para beta "menos”; positivo para beta “más”; un electrón sea positivo o negativo tiene una sola carga eléctrica elemental. La alfa, por tener doble carga; ejerce una acción más intensa sobre los electrones de las moléculas que se hallan en su camino. El poder ionizante "por unidad de recorrido" y el poder de penetración dependen de tres factores: la clase de radiación, la energía inicial de la misma, la clase de material afectado. En la Figura 5, puede observarse la capacidad de penetración y nocividad de las radiaciones. Tomado de: INSHT (2013) Figura 5. Penetración y nocividad de las radiaciones Para tener una idea general de la capacidad de penetración de las principales radiaciones en materiales sólidos, líquidos y gaseosos, debe recordarse lo siguiente: Los rayos alfa se detienen con una hoja de papel, o con unos micrómetros de agua o con pocos centímetros de aire. Los rayos beta se detienen con un vidrio grueso de escritorio o con unos milímetros de agua, o con algunos metros de aire. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Los rayos gamma se detienen con varios decímetros de metal denso, o con varios metros de agua; el aire es pobrísimo escudo contra la radiación gamma. 21.3 Fuente Es todo aparato o sustancia capaz de emitir radiaciones ionizantes diferentes de la radiación natural. Por ejemplo, los radionúclidos usados en la industria; los aparatos de rayos X; los reactores nucleares. La definición exceptúa la radiación natural; de lo contrario, el mismo cuerpo humano sería una fuente por su contenido en varios radionúclidos, como el 14C y el 40K. 21.4 Blindaje Es toda sustancia interpuesta entre una fuente y un punto de interés. Por ejemplo, una pared de concreto interpuesta entre un tubo de rayos X y la persona que lo opera; un recipiente de uranio interpuesto entre una fuente de 30 Ci de 60Co y el cuerpo del gammágrafo; una gruesa lámina de lucita (plexiglás) interpuesta entre una fuente de cincuenta mCi de 90Sr y los ojos del médico que la manipula. 21.5 Densidad Espesor Es el producto de la densidad de una lámina por su espesor (como su nombre lo indica). Ejemplo: la densidad del aluminio es de 2,70 g/cm3); una lámina de aluminio cuyo grosor sea de 3,0 milímetros, tendrá un valor “densidad espesor” de: 2,70 𝑔/𝑐𝑚3 𝑥 0,30 𝑐𝑚 = 0,81 𝑔/𝑐𝑚2 El valor "densidad espesor” se expresa con la fórmula: 𝑅 = (𝐷) (𝑠) en la cual: 𝑅 es el valor "densidad espesor”, cuyas unidades de medida son: unidades de masa sobre unidades de superficie; 𝐷 es la densidad del material considerado; y 𝑠 es el espesor de la lámina. En ocasiones, al hablar de la penetración de las radiaciones ionizantes, se entiende por “𝐷” la densidad del material en el cual penetra la radiación; por “𝑠" la longitud que alcanza a penetrar la radiación antes de ser completamente detenida; y por "𝑅" su penetración expresada en “densidad espesor”; se utiliza la letra “𝑅” por ser la inicial del término inglés "range" (recorrido; alcance de un proyectil). 21.6 Constancia de penetración de una radiación determinada UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Dada una radiación (por ejemplo: beta menos) y la energía de la misma (ej.: 1 MeV), la penetración de esa radiación tendrá enormes variaciones si se expresa en unidades de longitud, de acuerdo con el material en el cual penetre. Así, una partícula que alcance a penetrar 3,7 mm en aluminio, llegará a 10 mm en agua (casi el triple que en aluminio) y a 7700 mm (7,7 metros) en aire a condiciones de presión y temperatura normales (P.T.N.), cabe mencionar que en agua penetra 2088 veces más que en aluminio; o 770 veces más que en agua. No obstante, si la penetración no se expresa en unidades de longitud sino en unidades de densidad espesor, la penetración de una misma radiación es constante, siempre y cuando los valores Z de los materiales afectados no difieran demasiado entre sí. Así, la radiación que penetra 3,7 mm en Al ó 10 mm en H2O, ó 7700 mm en aire a Lección 22: Composición y acción de las radiaciones A continuación se hará una breve exposición de las radiaciones ionizantes, en cuanto a composición; masa; carga eléctrica; energía; velocidad; mecanismos de ionización; poder de penetración. 22.1 Rayos alfa Como se indicó antes, un rayo alfa, o partícula alfa, es un conjunto de 2 protones y 2 neutrones, conjunto que sale del núcleo de los átomos de ciertos radionúclidos bastante pesados: de valor Z igual o mayor que 60, y de valor A igual o mayor que 144. La composición de la partícula alfa (2 p + 2 n) es la misma que la de un núcleo de 4He; se trata de una configuración muy estable en cuanto a la mutua unión de los 4 nucleones: la masa de la partícula alfa es bastante menor que la suma de las masas individuales de sus componentes: una porción muy notable de la masa de los nucleones integrantes de la partícula alfa se convierte en energía de ligamento, de conformidad con lo que establece la formula relativística 𝐸 = 𝑚𝑐 2 . La masa de una partícula alfa resulta de 6,64476 𝑥 10−27 𝐾𝑔; haciendo las conversiones pertinentes mediante la citada formula de Einstein, la masa en reposo de la partícula alfa corresponde a 3727, 41 𝑀𝑒𝑉. La carga electrostática de un rayo alfa es +2 unidades elementales y se debe a la presencia de sus 2 protones, cada uno de los cuales tiene 1 carga eléctrica elemental positiva, o sea 1,602189 2 𝑥 10−19 culombios positivos por cada protón. La energía equivalente a la masa en reposo de una partícula alfa es, como ya se mencionó, de 3727,41 MeV; no se debe confundir con la energía cinética de que esta provista al abandonar el núcleo atómico de donde procede: las partículas alfa de los que emiten este tipo de radiación tienen energía cinética que, para la gran mayoría, esta entre 4 MeV y 9 MeV; pero hay alfas de energía menor que 4 MeV, como también las hay con energía mayor que 9 MeV: el limite 4 - 9 MeV rige, para UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA la gran mayoría, afirmación que se comprueba al examinar una buena tabla de núclidos. Se considerara “relativística” a una partícula cuya energía cinética fuera igual o mayor que la centésima parte del equivalente energético de su masa en reposo; con tal criterio, las partículas alfa serian relativísticas si su energía cinética igualara o superara el 1 por ciento de 3727,41 MeV, o sea, poco más de 37 MeV; pero las energías cinéticas reales estén entre 4 MeV y 9 MeV; conque las partículas alfa naturales no son relativísticas; por tanto, y con error inferior al 1 por ciento, obedecen a las formulas newtonianas; así, para efectos de energía cinética, masa y velocidad, se les puede aplicar la fórmula clásica: 𝑚𝑣 2 𝐸= 2 Sobre esa base resulta que las partículas alfa de menor energía cinética (4 MeV) se desplazan a unos 13,9 Mm/s, en tanto que las de mayor energía cinética (9 MeV) viajan a unos 20,8 Mm/s. En cuanto al mecanismo de ionización de las partículas alfa, opera por la fuerte atracción que ejerce su doble carga positiva sobre los electrones de los átomos integrantes de las moléculas que la partícula encuentra en su camino; atracción que es más duradera, en virtud de la velocidad relativamente baja de las partículas alfa (no llega al 7 por ciento de la velocidad de la luz): la relativa lentitud con que se mueve la partícula y la atracción intensa que sus 2 protones ejercen sobre los electrones de la vecindad de su camino, hacen que la partícula arranque muchos electrones por unidad de recorrido, con lo cual su energía cinética se agota rápidamente; por ello, la alfa tiene bajísimo poder de penetración: si el material afectado por la radiación es aire a P.T.N., las alfas de 4 MeV penetran tan solo unos 23 milímetros, y las de 9 MeV unos 8,3 centímetros; en agua o en tejido humano blando, la penetración es: unos 35 micrómetros para las alfas de 4 MeV y unos 114 micrómetros para las de 9 MeV. No obstante, cuando penetra la materia presenta un alto poder de ionización, formando verdaderas columnas de iones (cuando penetra en un centímetro de aire puede producir hasta 30.000 pares de iones), véase Figura 6. Tomado de: monografías.com (2013) Figura 6. Partícula alfa UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 22.2 Rayos beta Rayos beta menos Un rayo "beta menos”, o partícula β- es un electrón negativo, que nace en el núcleo de los átomos de algunos radionúclidos cuando un neutrón se transforma espontáneamente en protón. El fenómeno se presenta en núclidos con exceso de neutrones (a la derecha de la línea de estabilidad) o bien, con defecto de protones (por debajo de la línea de estabilidad); o sea, que los emisores β- se hallan, por lo general, a la derecha y abajo de la línea de estabilidad, línea conformada por las casillas de los núclidos estables. Como la partícula β- es un electrón, su masa en reposo es la misma de un electrón corriente: 9,11 x 10-31 Kg (más exacta: 9,109534 x 10-31). La masa de la partícula β- es mucho mayor que la de un electrón orbital, porque aquélla es relativística. Si se convierte la masa en energía (por la fórmula E = m c2) y se lleva a MeV, resultará que el equivalente energético de la masa de un electrón es 0,511 003 4 MeV = 511,003 4 KeV. Para este caso, se considera relativística una partícula cuya energía cinética sea la centésima parte o más, de la energía equivalente a la masa en reposo; si se acepta ese criterio, los electrones serán relativísticos cuando su energía cinética sea igual o mayor que 5,11 KeV; bien: ocurre que la energía cinética de las partículas β-, para la gran mayoría de los radionúclidos que emiten este tipo de radiación, está comprendida entre 50 KeV y 4 MeV; es decir: prácticamente todas las partículas β- son relativísticas y su "masa en movimiento' viene dada por la fórmula: 𝑚𝑣 = 𝑚0 √1 − 𝛽 2 Donde 𝑚0 es la masa en reposo, 𝑚𝑣 la masa del cuerpo dotado de velocidad "𝑣" y 𝛽 la fracción adimensional 𝑣/𝑐. Por otra parte, las relaciones de energía cinética, masa y velocidad se obtienen por la fórmula relativística: 𝐸𝑘 = 𝑚0 𝑐 2 [ 1 √1−𝛽 2 − 1] La carga eléctrica de las partículas β- es de -1 e, es decir, 1 carga elemental negativa = 1,602 E (-19) culombios negativos. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Según lo arriba expresado, todas las partículas β- tienen velocidad relativística; efectivamente (si se desarrolla la fórmula expuesta anteriormente), los rayos β - de 50 KeV llevan velocidad de 0,413 c (41,3% de la velocidad de la luz); los de 4 MeV se desplazan a 0,994c (99,4% de la velocidad de la luz). La ionización causada por los rayos β- se debe a la acción repulsiva sobre los electrones de los átomos que se hallan a lo largo de su trayectoria; es decir, el electrón negativo relativístico repele a un electrón orbital, que también es negativo pero que, al contrario que el rayo atacante, se halla relativamente inmóvil. La ionización por unidad de recorrido es del orden de mil veces menos que con la radiación alfa, por dos razones; la primera, que la partícula β- tiene una sola carga electrostática, en comparación con la doble carga de la alfa; y la segunda, que como la partícula viaja a velocidades relativísticas, permanece muy poco tiempo en las cercanías de los electrones orbitales, en agudo contraste con los rayos alfa, que son comparativamente lentos. Por las mismas causas, la penetración de los rayos β-, aunque es más bien modesta, es mucho mayor que la correspondiente a los rayos alfa; las partículas βde 50 KeV alcanzan 26 mm en aire a PTN; las de 4 MeV llegan a 17 metros en aire normal. En cuanto a la penetración en agua y en tejido humano blando, los rayos β- de 50 KeV alcanzan a entrar 40 micrómetros en agua, o sea, un poco más que las alfas de 4 MeV; los de 4 MeV, por su parte, penetran 20 mm en agua o en tejido humano blando, el cual, por su composición, se asimila al agua, lo mismo que por su número “Z equivalente”. La mayor parte de las partículas beta tienen energías menores que 4 MeV, mientras que casi todas las partículas alfa tienen energías mayores que 4 MeV”. Respecto de la penetración beta en aire, agua, tejido humano blando, vidrio, lucita, aluminio y demás materiales de valores "Z" cercanos, se puede calcular con muy buena exactitud mediante las fórmulas de Katz y Penfold, las cuales se expresan a continuación (Guzmán, 1989): Para energías entre 0,01 MeV y 3 MeV: 𝑅 = 412 𝐸1,265−0,0954 ln 𝐸 Para energías entre 3 MeV y 20 MeV: 𝑅 = 530 𝐸 − 106 En ambas fórmulas 𝐸 es la energía cinética de la radiación beta, expresada en MeV; y 𝑅 (range) es el alcance, expresado en miligramos por centímetro cuadrado (mg/cm2). Dichas fórmulas expresan el alcance (o sea la penetración), en unidades de "densidad espesor”, lo que permite calcular la penetración en cualquier material, si se conoce la densidad de tal material y si su "Z equivalente” no está muy lejos del valor 7,31 que es el del aire. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 22.3 Rayos gamma y Rayos X Supóngase que se envía un haz delgado de intensidad 𝐼0 (número de fotones) de rayos 𝑋0 gamma monoenergéticos sobre un material de espesor x, y se coloca detrás de éste un detector, como lo muestra la Figura 7. En el material, el haz será atenuado por las tres interacciones ya mencionadas, llegando al detector sólo la cantidad 𝐼, menor que 𝐼0 . La atenuación obedece la ley exponencial (Biblioteca digital, 2013b): 𝐼 = 𝐼0 𝑒 −𝜇𝑥 , donde 𝑒 es la base de los logaritmos naturales, y 𝜇 se llama coeficiente lineal de atenuación. Normalmente 𝑥 se expresa en unidades de cm, por lo que 𝜇 estará dado en cm-1. Tomado de: Biblioteca digital (2013b) Figura 7. Experimento de transmisión de radiaciones. El número de radiaciones absorbidas es 𝐼0 − 𝐼, y depende del espesor x del absorbedor. Nótese que la ecuación tiene la misma forma que la ley de decaimiento radiactivo. La Figura 8 muestra una curva de atenuación típica. Cuando x= 0, o sea sin absorbedor, la intensidad medida 𝐼 = 𝐼0 . El valor del coeficiente lineal de atenuación 𝜇 determina qué tan rápidamente cae la curva de atenuación. En analogía con la vida media, se puede definir la capa hemirreductora 𝑥1/2 como el grueso de absorbedor que reduce la intensidad inicial a la mitad. Dos capas hemirreductoras la reducen a una cuarta parte, y así sucesivamente, 𝑛 capas hemirreductoras la reducen por un factor 1/2𝑛 . La capa hemirreductora está relacionada con el coeficiente lineal de atenuación según la ecuación: 𝑥1/2 = 0.693/𝜇 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA También se define la capa decimorreductora 𝑥1/10 como el espesor que reduce la intensidad a una décima parte. Dos de éstas la reducen a un centésimo, y 𝑛 capas decimorreductoras la reducen a un factor 110𝑛 . La capa decimorreductora se relaciona con 𝜇 según la ecuación: 𝑥1/10 = 2.203/𝜇 Tomado de: Biblioteca digital (2013b) Figura 8. Curva exponencial de atenuación de rayos X o gamma. Se indican las capas hemirreductora y decimorreductora. Una cantidad que se usa normalmente es el coeficiente másico de atenuación 𝜇𝑚 , que se obtiene al dividir el coeficiente lineal entre la densidad 𝑝 del material 𝜇𝑚 = 𝜇/𝑝 Si las unidades de 𝑝 son g/ cm³, las de 𝜇𝑚 con cm² / g. Si se emplea el coeficiente másico de atenuación, la ley de atenuación queda de la siguiente forma: 𝐼 = 𝐼𝑜 𝑒 −𝜇𝑚 (px) Los coeficientes lineal y másico de atenuación difieren de un material a otro, según sean bueno o malos absorbedores de rayos X y gamma. También sus valores dependen de la energía de la radiación. La Figura 9 muestra un ejemplo UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA de la variación del coeficiente másico de atenuación para un buen absorbedor, el plomo, según la energía. Allí se puede ver también la contribución relativa que ofrecen cada uno de los tres efectos de atenuación. Tomado de: Biblioteca digital (2013b) Figura 9. Coeficiente másico de atenuación de rayos X y gamma en plomo, según la energía del fotón. Se indica la contribución de cada uno de los tres efectos. La absorción de energía por el material está relacionada por la atenuación, pero no son iguales. La atenuación en un experimento como el de la Figura 6 implica absorción de energía sólo si se trata de efecto fotoeléctrico; en los otros dos efectos, la atenuación del haz inicial implica la absorción de sólo una parte de la energía de los fotones. Se define entonces un coeficiente de absorción ua, que siempre es menor o igual al de atenuación. A modo de resumen, se presenta la Tabla 4: Tomada de: Educar Chile (2013) Tabla 4. Propiedades de las emisiones radiactivas UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Lección 23: Magnitudes y unidades de radiación 23.1 Exposición La exposición es una medida de la ionización producida por una radiación; su unidad es el Roentgen. Un Roentgen (R) es la exposición (X o gamma) recibida por un kilogramo de aire en condiciones estándar de presión y temperatura (CSPT) si se produce un número de pares de iones equivalente a 2.58 x 104 Culombios. Como la carga de un ion es 1.602 x 10-19 Culombios, esto equivale a que se produzcan 1.61 x 1015 pares de iones/ kilogramo de aire. En resumen, 1 R2.58 X 10-4 Coulombs/ kg de aire en CSPT, 1 R1.61 X 1015 pares de iones/ kg de aire en CSPT. Esta definición es totalmente equivalente a la antigua, en que se tomaba 0.001293 gramos (1 cm³ de aire en vez de un kilogramo, y una unidad electrostática de carga en vez de un Coulomb. Del número de iones producidos en aire por un Roentgen se puede calcular la energía empleada, si se recuerda que la energía necesaria para cada ionización del aire es de 34 eV, equivalente a 5.4 x10 -18 joules (J). Resulta ser: 1 R 0.00869 J/ kg de aire. Como en tejido la energía de ionización es diferente que en aire, 1 R 0.0096 J/ kg de tejido. La exposición, también puede ser expresada en términos de electrones / volumen Roentgen es la exposición en que, por cada cm3 de aire a presión y temperatura normal (aN), se forman 2,082 x 109 electrones. Es decir, 1R = 2,082 x 109 electrones/cm3 aN. 23.2 Dosis Esta magnitud se basa en la transferencia de energía de cualquier radiación a cualquier sustancia. Se puede definir de la siguiente manera: Dosis es el cociente entre la energía cedida por cualquier radiación a cualquier sustancia afectada. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA UNIDADES DE DOSIS El gray En el Sistema Internacional, la unidad de dosis es el “julio sobre kilogramo", que recibe el nombre de “gray” y se abrevia “Gy”. Tiene múltiplos, como el KGy, el MGy; y submúltiplos, como el mGy, µGy. El Gy es una unidad coherente, porque se obtiene como el cociente entre dos unidades que tienen coeficiente unitario: 1 Gy = 1 J / 1 Kg de aire. (Recuérdese que son “coherentes” aquellas unidades de medida que se obtienen como productos o como cocientes de unidades básicas que tienen como coeficiente el numero 1; ejemplos: 1J = 1N x 1m; 1Pa = 1N / 1m2; 1erg = 1dina x 1cm; 1Gy =1J / 1 Kg). Quizás convenga advertir que el gray no es “cualquier julio sobre cualquier kilogramo", sino "1 julio de energía cedida por una radiación sobre 1 kilogramo afectado por la radiación El rad Antes del gray, la unidad de dosis era el rad (rd): se definía como la dosis correspondiente a la transferencia de 100 ergios a 1 gramo de sustancia irradiada. La relación entre el gray y el rad se obtiene a partir de las respectivas definiciones: 1𝐺𝑦 = 1𝐽 𝐾𝑔 𝑥 107 𝑒𝑟𝑔 1𝐽 𝑥 1 𝐾𝑔 1000 𝑔 𝑥 1 𝑟𝑑 100 𝑒𝑟𝑔/𝑔 = 100 𝑟𝑑; osea, 1𝐺𝑦 = 100 𝑟𝑑. 23.3 Factor de calidad Es el número que determina la peligrosidad relativa de las diversas radiaciones. El daño biológico no depende solo de la energía transferida a una masa corporal, sino también del tipo de radiación que cede la energía; en otros términos: a igual energía transferida por unidad de masa, los efectos biológicos son diferentes para distintos tipos de radiación: 1 Gy transferido por neutrones térmicos, por ejemplo, es 2,3 veces más nocivo que 1 Gy transferido por rayos gamma. Para cuantificar la peligrosidad relativa de las radiaciones, se toma como referencia unitaria la peligrosidad de los rayos X, a la cual se le asigna el factor de calidad Q = 1. El mismo factor Q = 1 se aplica a los rayos 𝛾, 𝛽 − y 𝛽 + (Tabla 5). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Radiación Valor Q X, gamma, 𝛽 − , 𝛽 + . 1 Neutrones térmicos 2,3 Neutrones cuya energía no se conozca; partículas pesadas de una sola carga, de energía desconocida 10 Partículas pesadas de varias cargas cuya energía se desconozca 20 Adaptada de Guzmán (1989) Tabla 5. Valor Q (factor de calidad) para cada tipo de radiación 23.4 Equivalente de dosis Con esta magnitud se mide el daño biológico que las radiaciones causan a los mamíferos. Cuantitativamente, el equivalente de dosis es el producto de la dosis por el factor de calidad que corresponda a la radiación que produce la dosis. Unidades de equivalente de dosis Existen dos unidades de equivalente de dosis: el sievert (Sv) y el rem (rem), respectivamente. El sievert es la dosis de cualquier radiación ionizante que, aplicada a un mamífero, causa el mismo efecto biológico que 1 gray de rayos X. El rem (abreviación inglesa de "röentgen equivalent for mammals”) es la dosis de cualquier radiación ionizante que, aplicada a un mamífero, causa el mismo efecto biológico que 1 rad de rayos X. Relación entre el sievert y el rem Entre estas dos unidades de equivalente de dosis existe la misma relación que hay entre las dos unidades de “dosis” de donde provienen: 1 Sv = 100 rem. RELACIONES DE EXPOSICION, DOSIS Y EQUIVALENTE DE DOSIS Para los radiólogos y para la radiografía industrial, a cada roentgen corresponde aproximadamente 1 rad y también 1 rem; y, con unidades modernas: a cada roentgen corresponde 1 centigray y también 1 centisievert. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Esto no significa que “exposición” sea lo mismo que "dosis" o que “equivalente de dosis”: los tres conceptos se refieren a fenómenos físicos muy diferentes: la exposición se obtiene como el cociente entre la carga eléctrica producida por rayos X o 𝛾 sobre aire, y la masa de aire afectada; la dosis, como el cociente entre la energía transferida por cualquier radiación a cualquier sustancia, y la masa de la sustancia afectada; el equivalente de dosis, como el producto de la dosis sufrida por un mamífero, y el factor de peligrosidad de la radiación que produjo esa dosis. Sucede que hay algunas correspondencias puramente numéricas; por ejemplo; a 1 R corresponde aproximadamente 1 rd en aire o en órganos del cuerpo humano, como se verá a continuación: Conversión de roentgens a rads, en aire Se hará esta conversión con factores ya estudiados, más uno que aún no se ha mencionado: Para arrancar 1 electrón en las moléculas del aire se requiere, en promedio, una energía de 33,73 eV. 1𝑅 = (1,602 𝑥 10−19 𝐽) 2,58 𝑥 10−4 𝐶 1 𝑒𝑙𝑒𝑐𝑡𝑟ó𝑛 33,73 𝑒𝑉 𝑥 𝑥 𝑥 (1 𝑒𝑉) 𝐾𝑔 (𝑎) 1,602 𝑥 10−19 𝐶 1 𝑒𝑙𝑒𝑐𝑡𝑟ó𝑛 𝑥 (1 𝑟𝑑. 𝑔) (107 𝑒𝑟𝑔) (𝐾𝑔 (𝑎)) 𝑥 𝑥 = 0,870 𝑟𝑑 100 𝑒𝑟𝑔 1𝐽 (1000 𝑔) Conversión de roentgens a rads, en tejido humano Tal conversión es muy compleja; hay que tener en cuenta no solamente la naturaleza y la posición del tejido, sino también la energía de la radiación. Sin embargo, puede afirmarse con tolerable margen de error que cuando el cuerpo humano está expuesto a 1 roentgen, absorbe 1 rad; o sea, que hay correspondencia numérica entre la exposición y la dosis. En efecto, el factor promedio de conversión de roentgens a rads en tejido blando, para diez (10) radiaciones comprendidas entre las más débiles de rayos X y las muy penetrantes de 137Cs y 60Co, es de 0,94 ± 1,5%; en cambio, para hueso compacto, los datos son muy disparejos para las distintas energías, con un promedio de 2,07 ± 63,3%; sin embargo, una dispersión tan grande no reviste demasiada gravedad, porque los huesos constituyen solamente el diez por ciento de la masa del cuerpo humano; el factor promedio ponderado entre tejido blando y huesos resulta de 1,05; esto justifica lo que se ha indicado, en el sentido de que a "n” roentgens corresponden "n” rads; osea: a "n” R corresponden “n” cGy. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA DOSIS INTEGRAL ABSORBIDA Es la energía total absorbida por un cuerpo y debida a radiación ionizante. Como energía, se puede expresar en J, erg, etc., también se puede y debe expresar en "gray-kilogramos”, producto que, como su nombre lo señala, se obtiene de multiplicar la dosis (Gy) por la masa corporal que la recibe (Kg). 23.5 Índices “Índice” es la derivada de cualquier efecto mensurable de la radiación ionizante con respecto al tiempo. Si al efecto mensurable de la radiación se le llama 𝐸𝑚 , el índice será: 𝐼𝑚 = 𝑑𝐸𝑚 𝑑𝑡 Si el efecto mensurable es parejo a través del tiempo, o sea; si en cada lapso, por pequeño que sea, se produce efecto de igual cuantía que en el lapso inmediatamente anterior o en el siguiente, el índice será el cociente entre la cuantía total del efecto mensurable y el tiempo durante el cual operó dicho efecto mensurable: 𝐸𝑚 𝑡 𝐼𝑚 = Como se puede ver, el índice viene a ser un concepto análogo al de la velocidad; la velocidad se define como la derivada del espacio con respecto al tiempo: v = (ds)/(dt); si el movimiento es uniforme, la velocidad viene dada por la fórmula v = s/t (Obsérvese la analogía de conceptos y de fórmulas). Índice de exposición Es la derivada de la exposición con respecto al tiempo, para un punto dado: 𝐼𝑒 = 𝑑𝐸 𝑑𝑡 Si la exposición llega al punto considerado de manera uniforme, o sea, que en cada fracción determinada de segundo la exposición sea la misma que en la fracción de segundo anterior 0 que en la fracción de segundo siguiente, el índice de exposición será el cociente entre la exposición total sufrida por el punto, y el tiempo durante el cual la exposición estuvo afectando al punto en cuestión: 𝐼𝑒 = 𝐸 𝑡 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Índice de dosis Es la derivada de la dosis con respecto al tiempo para un punto dado: 𝐼𝑑 = 𝑑𝐷 𝑑𝑡 Lo mismo que en el caso de la exposición: si la dosis llega al punto considerado de manera continua y pareja a lo largo de un tiempo “t", el índice de dosis será el cociente entre la dosis total absorbida en el punto, y el tiempo durante el cual la dosis estuvo afectando ese punto: 𝐼𝑑 = 𝐷 𝑡 Índice de contaje El índice de contaje es la derivada del número de cuentas con respecto al tiempo: dC/dt; si las cuentas en el aparato se producen a ritmo parejo, el índice de contaje se obtiene como el cociente entre el contaje total y el tiempo durante el cual se tomó dicho contaje: 𝐶 𝐼𝑐 = 𝑡 Entre los índices de contaje es muy empleado el de “cuentas por minuto”, que se abrevia “cpm” Lección 24: Reacciones nucleares 24.1 Generalidades Reacción nuclear es el proceso por el cual un núcleo atómico, al ser atacado por un fotón o por una partícula, se convierte en un núcleo diferente, que emite uno o más fotones o partículas. El núcleo atacado se llama blanco; el fotón o la partícula que ataca al núcleo se llama proyectil; el núcleo resultante de la transformación causada por el ataque, recibe el nombre de producto; el fotón o la partícula o el conjunto de partículas emitidos hacia el exterior del núcleo atacado, se conocen como radiación emitida (Guzmán 1989). En 1919, Rutherford utilizando partículas alfa transmutó el nitrógeno en oxígeno. Se expresa de la siguiente manera (Recursostic, 2013): 14 7𝑁 + 42𝐻𝑒 → 17 8𝑂 + 11𝐻 La reacción anterior, también se puede escribir de la siguiente manera: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 14 (∝, 𝑝) 178𝑂 7𝑁 A continuación encontrará un cuadro comparativo entre reacciones químicas y reacciones nucleares (Tabla 6). Reacciones químicas Los átomos se reordenan por la ruptura y formación de enlaces químicos Solo los electrones están implicados en la ruptura y formación de los enlaces. Las reacciones van acompañadas por la absorción o liberación de cantidades de energía relativamente pequeñas. Reacciones nucleares Los elementos o los isótopos de un elemento generan otro elemento al cambiar la constitución del núcleo del átomo. En las reacciones pueden participar protones, neutrones, electrones y otras partículas elementales. Las reacciones van acompañadas por la a bsorción o liberación de enormes cantidades de energía. Ej: 73Li + 11H → 2 42H + 23000000Kcal Ej: 𝐶𝐻4 + 2𝑂2 → 𝐶𝑂2 + 2 𝐻2 𝑂 + 200 𝐾𝑐𝑎𝑙 La temperatura, presión, concentración de los reactantes y catalizadores, son factores que determinan la velocidad de una reacción. Las velocidades de reacción generalmente no se ven afectadas porla temperatura, la pr esión o los catalizadores. Tabla 6. Cuadro comparativo entre reacciones químicas y reacciones nucleares UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Ecuaciones nucleares Una ecuación nuclear es una representación simbólica de una reacción nuclear. El decaimiento radiactivo se representa por medio de ecuaciones nucleares. La expresión generalizada es la siguiente: 𝐴 𝑍𝑋 Núcleo radiactivo 𝐴 𝑍 𝑌 + 𝑒𝑚𝑖𝑠𝑖ó𝑛 𝑟𝑎𝑑𝑖𝑎𝑐𝑡𝑖𝑣𝑎 Núcleo formado 𝐴 = 𝑁ú𝑚𝑒𝑟𝑜 𝑚á𝑠𝑖𝑐𝑜 𝑍 = 𝑁ú𝑚𝑒𝑟𝑜 𝑎𝑡ó𝑚𝑖𝑐𝑜 Al balancear una ecuación nuclear, se deberá cumplir que: 1. El número total de protones y neutrones en los productos y en los reactantes debe ser el mismo (conservación de la masa). 2. El número total de cargas nucleares en los productos y en los reactantes debe ser el mismo (conservación de la carga nuclear). BALANCE DE Z Y A EN LAS REACCIONES De acuerdo con Guzmán (1981), en toda reacción nuclear, la suma de cargas eléctricas de blanco y proyectil es igual a la suma de cargas eléctricas de producto y radiación emitida. De igual manera, el número conjunto de nucleones de blanco y proyectil es igual al número conjunto de nucleones de producto y radiación emitida. Ejemplo de una reacción nuclear: Blanco: Al-27 Proyectil: neutrones de 15 MeV Producto: Na-24 Radiación emitida: α Al-27 + n = Na-24 + α Balance de “Z”: Z del blanco (13) + Z del proyectil (0) = Z del producto (11) + Z de la radiación emitida (2) UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Balance de “A”: A del blanco (27) + A del proyectil (1) = A del producto (24) + A de la radiación emitida (4). Mediante el balance de Z y de A es posible determinar el blanco, o el proyectil, o el producto, si se conocen los otros tres términos; en cambio, no siempre se puede inferir cual sea la radiación emitida, debido a que ésta puede estar constituida por dos o más partículas cuya suma en Z y en A sea igual a la de una o más partículas diferentes; por ejemplo, es igual la suma de cargas eléctricas y de nucleones para un núcleo de deuterio (núcleo de H-2) que para Ia suma de 1 protón y 1 neutrón separados. Normalmente es más usual indicar las reacciones nucleares de la siguiente manera: Primero, el blanco; luego, y entre un paréntesis, el proyectil y la radiación emitida, separados por una coma; después, ya fuera del paréntesis, el producto: Al-27 (n, α) Na-24 Para referirse a esta reacción nuclear, se acostumbra expresar oralmente: Reacción neutrón-alfa sobre el Al-27. No es indispensable pronunciar el nombre del producto, ni suele hacerse, pues lo dicho ya basta para determinarlo; Por ejemplo: Para Z = 13 + 0 = 2 + ? El interrogante es 11. Para A = 27 + 1 = 4 + ? Este nuevo interrogante es 24. Un núclido de Z = 11 y A = 24, que corresponde al Na-24. 24.2 Sección eficaz Es la probabilidad de que un proyectil determinado que ataque un blanco determinado origine una reacción nuclear determinada. Cuando se define una reacción nuclear, no basta con especificar el proyectil y el blanco; pues estos dos términos conducen a diversidad de reacciones nucleares, si bien con distinta probabilidad para cada una de ellas. Ejemplo: 27Al (n, α) 24Na; 27Al (n, p) 27Mg; 27Al (n, 2n) 26Al Los tres casos anteriores, en que el blanco es igual (27Al) y el proyectil es el mismo (neutrón relativístico), se interpretan así: Si se lanza un flujo de neutrones de cierta energía sobre el núclido 27Al, algunos de los núcleos atacados se convertirán en 24Na, con emisión de una partícula alfa; otros núcleos del blanco se convertirán en 27Mg, con emisión de un protón; otros UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA núcleos del mismo blanco se convertirán en 26Al con emisión de dos neutrones; esta tercera reacción se menciona como “reacción neutrón – 2 neutrón sobre el 27Al”. Al escuchar tal enunciado, se debe estar en capacidad de determinar mentalmente cuál es el producto. Las tres reacciones tienen diferentes probabilidades, aunque todas ellas realmente ocurren; ciertamente (así lo han determinado los científicos), si los proyectiles son neutrones de 14 a 15 MeV que atacan un blanco de AI-27 puro, casi el 60 por ciento de los núcleos afectados por el proyectil van a convertirse en 24Na; casi el 40 por ciento quedaran convertidos en 27Mg; y relativamente muy pocos quedarán como Al-26 (Guzmán, 1989). El barn es la unidad de medida para secciones eficaces; se simboliza “b”. El barn se define como 10-24 cm2 / átomo. Para cualquier reacción nuclear, la probabilidad de 1 barn ya es bastante grande ("tan grande como un establo" se cuenta que decían los científicos que idearon el vocablo inglés “barn”) pero hay reacciones nucleares cuya probabilidad se mide en cientos y aun miles de barns; por ejemplo; para neutrones térmicos (que se definirán en el siguiente párrafo), el 10B, que constituye el 20 por ciento del boro natural, ofrece una probabilidad de 0,5 b para la reacción “neutrón-gamma” y una probabilidad de 3 836 barns para la reacción "neutrón-alfa". Como comparación: para el 15N, la sección eficaz de la reacción nuclear "neutrón térmico-gamma" es apenas de 24 microbarns; el 33S, que está en el 0,75% en el azufre natural, da tres secciones eficaces para proyectiles de neutrones térmicos: 0,002 b para “neutrón térmico-protón”; 0,140 b para “neutrón térmico-alfa" y 0,015 b para "neutrón térmico gamma”; con el 45Sc (único núclido del elemento mononuclídico escandio), hay sección eficaz de 9,6 barns para la reacción "neutrón térmico-gamma” que lleva al producto 46mSc; y 16,9 b para la reacción “neutrón térmico-gamma” conducente al producto 46Sc; el 46mSc es un radionúclido con periodo de 18,7 segundos, que por transición isomérica va a 46Sc, el cual emite gamma y beta menos, con periodo de 84 días, para llegar a 46Ti estable. 24.3 Los neutrones El neutrón es un proyectil excelente, precisamente por su falta de carga eléctrica; su carácter neutro hace que no sea rechazado por la región de electrones de los átomos "blanco, ni por los núcleos de los mismos, cuyos protones los hacen muy positivos. Además, como se verá más adelante, es un proyectil que se obtiene en flujos de varios billones por centímetro cuadrado y por segundo, en los reactores nucleares. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Clasificación de los neutrones Se acostumbra clasificar los neutrones por energías; pero hay casi tantas clasificaciones como autores tratan el tema; en este caso se adopta la siguiente clasificación de acuerdo con Guzmán (1989). Térmicos: Los de 0,025 eV Intermedios: De 0,5 eV a 10 KeV Rápidos: De 1 0 KeV a 10 MeV Relativísticos: De 10 MeV en adelante Neutrones térmicos: sufren captura, especialmente para la reacción "neutrón gamma". Neutrones intermedios: se entiende por "moderación" la disminución de la energía y, por tanto, de la velocidad, que presenta cualquier neutrón como consecuencia de una sucesión de choques elásticos con núcleos atómicos; la pérdida de energía es mayor cuanto más ligero es el núcleo con el cual choca el neutrón. Para los neutrones intermedios, la acción predominante es la moderación. Neutrones rápidos: en la mayor parte del espectro de energía, los neutrones rápidos sufren moderación; cerca del tope, moderación y reacciones nucleares. Un neutrón de 1 MeV de energía cinética inicial, quedara convertido en neutrón térmico luego de 18 colisiones (en promedio) con núcleos de hidrogeno, o de 90 colisiones con núcleos de berilio, o de 114 colisiones con núcleos de carbono. El paso de 1 MeV a 0,025 eV representa una caída de energía por un factor de 40 millones. Si se hacen cuentas, se halla que cada choque del neutrón de 1 MeV de energía inicial con átomos de H representa una pérdida del 62,185% de la energía; el choque con un átomo de Be implica la pérdida del 17,675r% de la energía; y cada choque con un átomo de C supone que, en promedio, se pierde el 14,234% de la energía. Neutrones relativísticos: De los 10 a los 30 MeV, moderación y reacciones nucleares, especialmente "neutrón - alfa", "neutrón-protón” y "neutrón - 2 neutrones"; por encima de los 30 MeV, unas reacciones nucleares en que la radiación emitida es un conjunto de varias partículas. El neutrón como proyectil El proyectil más empleado para las reacciones nucleares es el neutrón, lo que se debe, como ya se ha indicado, a que su carácter neutro le facilita la entrada en el núcleo sin sufrir desviaciones o repulsiones por campos eléctricos. Entre los neutrones, los más fecundos son los térmicos, porque tienen buena probabilidad de reacción "neutrón - gamma" con casi todos los núclidos, como se ve en la tabla de núclidos; ya se ha mencionado que a veces los neutrones térmicos exhiben alta sección eficaz para otras reacciones, como ocurre con la UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA reacción "neutrón térmico - alfa” sobre el 6Li (940 barns) o sobre el 10B (3836 barns); también hay buena sección eficaz para la reacción "neutrón térmicoprotón” en casos tales como el del 14N (1 ,81 b). En cuanto a los neutrones de 14 a 15 MeV, están bien estudiados porque se producen abundantemente en la reacción “deuterón - neutrón" sobre un blanco de tritio: 3H (d, n) 4He; esta reacción se lleva a cabo en aparatos llamados generadores de neutrones. 24.4 Otros proyectiles Un modo usual de conseguir proyectiles consiste en someter iones a grandes aceleraciones en campos electromagnéticos; el haz de iones suficientemente acelerados tiene la energía necesaria para vencer la barrera de repulsión electrostática del núcleo, penetrar en él y causar la reacción nuclear. Por ejemplo: si se ioniza 1H, quedan protones susceptibles de acelerarse; con 2H, deuterones; con 3H, tritiones; con 4He, proyectiles alfa, etc. Muchos equipos hoy en día, permiten la aceleración iones muy pesados, que han llevado a la producción de núclidos transuránicos. Ejemplo: 243Am (18O, 5n) 256Lw 4n) 257No 238U (22Ne, 6n) 254No 248Cm (13C, Lección 25: Datación por carbono-14 El término “datación” se toma aquí como "determinación de una fecha por métodos de laboratorio". La atmosfera terrestre sufre el ataque continuo de rayos cósmicos de inmensas energías: fotones de 40 GeV y aún más, que causan intensas reacciones nucleares en las altas capas, con producción de protones, neutrones, partículas alfa y muchos otros iones. Los neutrones producidos se vuelven térmicos (0,025 eV) por sucesivos choques elásticos con núcleos de núclidos ligeros; estos neutrones térmicos tienen buena sección eficaz (1,81 barns) para la reacción "neutrón térmico - protón” sobre el 14N del aire, que constituye el 99,64 por ciento del nitrógeno natural: 14N (nt, p) 14C UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA El 14C, cuyo periodo es de 5 736 años, se mezcla uniformemente con el CO2, con los bicarbonatos y, en general, con todos los compuestos orgánicos de la tierra. Los seres vivos (hombres, animales, vegetales) incorporan una proporción fija de 14C en el carbono de sus células, de tal modo que en el carbono de los seres vivos hay 16 desintegraciones por minuto por gramo de carbono. Si el ser vivo queda enterrado, obviamente deja de incorporar 14C a su organismo; entonces comienza a gastarse, por su carácter radiactivo, el 14C que existía en el momento de enterrarse el que fue un ser viviente; transcurridos algunos siglos, si se mide el contenido de 14C ya no se encontrarán 16 desintegraciones / (minuto) (gramo de C), sino menos, de acuerdo con el tiempo que lleve enterrado el espécimen y según lo indicado por la fórmula: 𝐴 = 𝐴0 𝑒 − 𝑡 ln 2 𝑇 En donde 𝐴0 es la actividad inicial, a tiempo cero, o sea 16 desint. / (min.)(g de C). 𝐴 es la actividad a tiempo 𝑡; T es el periodo del 14C: 5 736 años. Se despeja 𝑡, que representa la edad de la muestra desenterrada. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA CAPITULO 6: FISIÓN Y FUSIÓN NUCLEAR Introducción La fisión y la fusión nuclear, son dos tipos de reacciones nucleares distintas; mientras que en la Fisión nuclear, un átomo relativamente pesado se descompone en otros más ligeros en una reacción que suele acompañarse de la emisión de partículas radiactivas y de producción de grandes cantidades de energía (reacción común en la fabricación de bombas nucleares y es la que se induce en las centrales nucleares actuales para la obtención de energía eléctrica); en la Fusión nuclear: se unen dos núcleos ligeros para formar otro más pesado (tiene lugar en el interior de las estrellas, en las llamadas reacciones termonucleares y les proporciona su brillo y su producción energética). La fisión puede provocar problemas ambientales derivados de la necesidad de transportar y almacenar los residuos radiactivos peligrosos que produce y conlleva a estrictos controles de seguridad. En reacciones de fusión, los experimentos realizados se enfrentan a un problema de primer orden: la dificultad de controlar las enormes cantidades de energía que se manejan en el proceso. No obstante, se considera que es la fuente de energía del futuro, por cuanto no produce residuos radiactivos peligrosos y podría obtenerse de combustibles tan económicos como el deuterio (hidrógeno 2) del agua del mar. En el presente capítulo se detalla más acerca de cada una de ellas. Lección 26: Fisión 26.1 Concepto Fisión es el proceso por el cual el núcleo de un átomo pesado se rompe en dos porciones de masas semejantes, con emisión de neutrones y de energía. Cada una de las dos porciones en que se parte el núcleo se llama "fragmento de fisión” y constituye un nuevo núcleo; los números “A” de los fragmentos de fisión están entre sí en la relación de 1: 1,4 aproximadamente. La fisión es una reacción nuclear especial, diferente de las reacciones nucleares corrientes: a) En las reacciones nucleares corrientes hay un solo producto principal, mientras que en la fisión hay dos (a veces, incluso tres). b) En las reacciones nucleares corrientes se necesita siempre un proyectil que ataque al núcleo y lo altere; en la fisión no siempre se requiere proyectil y, cuando UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA no se requiere, procede conforme a las leyes de la radiactividad. Ej.: El radionúclido con periodo de 3,3 milisegundos, sufre fisión espontanea. 244Fm, C) Las reacciones nucleares corrientes pueden afectar a cualquier núclido, sin importar cuál sea su Z ni cual sea su A; las reacciones de fisión solamente proceden con núcleos de Z igual o mayor que 90 y de A igual o mayor que 227. 26.2 Reacción en cadena Es la serie de fisiones que ocurren cuando por lo menos uno de los neutrones emitidos actúa como proyectil contra núcleos vecinos fisionables, en sucesivas generaciones. Para que haya reacción en cadena, se requiere que haya suficientes átomos fisionables por elemento de volumen en la vecindad del punto donde ocurrió la primera reacción individual, de tal modo que la probabilidad de que uno de los neutrones emitidos acierte sobre otro núcleo fisionable sea 1 (o sea del 100 por ciento), al menos en el curso de algunos centenares de generaciones consecutivas. Esto origina el concepto de "masa crítica”. La masa crítica es la mínima masa del núclido fisionable de determinada pureza que se requiere para que, en conformación geométrica determinada y con determinado grado de compactación, ocurra la reacción en cadena. De lo dicho se desprende que la masa crítica es función de varios factores, que no únicamente de la masa en sí: núclido fisionable (diferentes exigencias para el 235U que para el 239Pu, a título de ejemplo); pureza del núclido fisionable (El 235U de 99,99 % de pureza requiere diferentes condiciones que el 235U de 99,00% de pureza); densidad promedia (siendo iguales las otras condiciones, una esfera compacta de 239Pu hace masa crítica en condiciones distintas que otra esfera del mismo radionúclido que sea porosa o fofa); geometría (la conformación esférica es la más favorable; siendo iguales los otros factores exige menos masa que por la conformación cilíndrica y mucho menos que la conformación laminar). 26.3 Núclidos fisionables Aparte de los núclidos que sufren fisión espontánea, los principales núclidos fisionables por neutrones disparados desde el exterior de núcleo son el 235U, el 239Pu y el 233U fisionables tanto por neutrones térmicos como por neutrones rápidos; el 238U y el 232Th, fisionables únicamente por neutrones rápidos (Guzmán, 1989). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Lección 27: Obtención de núclidos fisionables por neutrones térmicos 27.1 Obtención de U-235 El 235U se encuentra en la naturaleza en proporción atómica del 0,720% del uranio natural; lo cual significa que por cada 100 átomos del elemento natural “uranio” hay 0.720 átomos del núclido 235U. El porcentaje másico del 235U en el uranio natural será: % másico = 0,720 𝑥 235,04393 238,029 = 0,711% 𝑚á𝑠𝑖𝑐𝑜 En el U-nat (uranio natural), existen tres núclidos isotópicos: El 238U (99,28% atómico); el 235U (0,720% atómico o 0,711% másico) y el 234U (0,0055% atómico). El problema radica en separar al 235U de su isótopo 238U. No se puede apelar a reacciones químicas, porque los dos núclidos son químicamente iguales, por pertenecer al mismo elemento uranio. La separación por métodos físicos es difícil y costosa, porque las masas nuclídicas están muy cercanas entre sí, pero no hay alternativa. Entre los métodos físicos el que primero se utilizó es el de la difusión gaseosa a través de membranas porosas; el uranio natural se lleva a moléculas gaseosas de hexafluoruro (UF6); puesto que el flúor natural es mononuclídico (100 por ciento 19F), quedan solamente dos clases de moléculas: 235UF 6 y 238UF6 En una sucesión de numerosas barreras porosas, cuyos huecos no tienen más de 10 nanómetros de diámetro, pasa el gas en proporción inversa al peso molecular, conque se logra el lento enriquecimiento del gas, en el sentido de que aumenta la proporción del hexafluoruro de 235U, hasta que se obtiene la concentración deseada. La difusión gaseosa de los dos hexafluoruros no es el único método fisión de separación; se habla de otros; entre ellos, el método de separación por centrifugación. 27.2 Obtención del Pu-239 En reactores nucleares, donde hay colosales flujos de neutrones, se someten placas de uranio natural metálico a la reacción "neutrón térmico – gamma”, para la cual es alta la sección eficaz (2,70 barns): 238U (n, γ) 239U Este producto (239U) es un emisor "beta menos” de corto periodo: 23,5 minutos y se transforma pronto en 239Np, que también es un emisor "beta menos” de periodo UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA corto: 2,355 días; éste pasa a anos. En resumen: 238U 239Pu, (n, γ) 239U (T = 23,5 min) β- que tiene un periodo bastante largo: 24 390 239Np (T = 2,355 d) β- 239Pu 27.3 Obtención del U-233 Es completamente análoga a la del Pu-239; se parte de torio metálico, Th-232: 232Th (n, γ) 233Th (T = 22,3 min) β- 233Pa (T = 27, 0 d) β- 233U Este 233U no se gasta apreciablemente en toda una vida humana, porque su periodo es de 1,59 x 105 años. La sección eficaz para la reacción "neutrón térmico - gamma” sobre el 232Th es mejor (7,40 b) que para el 238U; pero el último emisor beta (233Pa) tiene período mayor que en el caso de producción del Pu. Lección 28: Productos de fisión También se llaman “fragmentos de fisión” y son dos por cada átomo fisionado. Resultan varios centenares, pero casi todos tienen número A entre 73 y 161, para fisión de 235U. Los fragmentos de fisión más abundantes están alrededor de A = 95 y de A = 134. La suma de los porcentajes no da 100, si no 200. 28.1 Neutrones producidos en la fisión Para el 235U, por cada átomo fisionado resulta un promedio de 2,5 neutrones (para el 239Pu, en promedio, 3 neutrones); la energía cinética de esos neutrones va de 0 a 20 MeV; la energía más frecuente es de 0,72 MeV; y la energía promedio es de 2 MeV. En cuanto a los neutrones emitidos en el proceso de radiactividad de los fragmentos de fisión, se suelen dividir en “prontos” y “retardados”; los prontos son prácticamente instantáneos; los retardados tienen períodos comprendidos entre fracción de segundo y 1 minuto. 28.2 Energía liberada en la fisión Para cada átomo de 235U, fisionado por un neutrón térmico, se libera una energía de 198 MeV, distribuida así: energía inmediata (correspondiente a la energía cinética de los fragmentos de fisión y los rayos gamma prontos): 177 MeV; energía retardada (correspondiente a la energía por desintegración beta y gamma): 10 MeV; energía de neutrones: 11 MeV. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 28.3 Masas, fisionable, fisionada, convertida en energía Masa fisionable es la masa conformada por los átomos que son susceptibles de fisionarse. La masa fisionable es ligeramente mayor que la masa crítica. Masa fisionada es la masa conformada por los átomos fisionables que realmente se fisionaron. La masa fisionada se puede calcular como el cociente entre la energía total y la energía liberada por cada fisión de un átomo (198 MeV / átomo); el cociente es el número de átomos fisionados, átomos que se pueden llevar a gramos, kilogramos, etc. Masa convertida en energía es lo que su nombre indica: la porción de masa que desaparece como tal y se manifiesta en la energía de la fisión con arreglo a la fórmula: E=mc2. Problema. Se dice que la masa crítica para la bomba de 235U que destruyó la ciudad japonesa de Hiroshima en agosto de 1.945 era de 20 Kg. La energía liberada fue de unos 20 kilotones (1 kilotón = 1012 calorías gramo; 1 caloría gramo 4,18 1) Calcular: a) Masa fisionable. b) Masa fisionada. c) Masa convertida en energía. a) Si la masa crítica fue realmente de 20 Kg, la masa fisionable contenida en la bomba tuvo que ser algo mayor que 20 Kg. b) Masa fisionada: Si resulta una energía de 198 MeV por cada átomo fisionado, a cuantos átomos corresponderán 20 x 4,18 x 1012 J: 1 á𝑡𝑜𝑚𝑜 𝑑𝑒 𝑈 − 235 𝑋 𝑎𝑡𝑜𝑚𝑜𝑠 𝑑𝑒 𝑈 − 235 = ; 198 𝑀𝑒𝑉 20 𝑥 4,18 𝑥 1012 𝐽 𝑋 = 2,6356 𝑥 1024 á𝑡. 𝑑𝑒 𝑈 − 235 = 2,6356 𝑥 1024 á𝑡𝑜𝑚𝑜𝑠 𝑥 1 á𝑡𝑜𝑚𝑜 𝑔𝑟𝑎𝑚𝑜 6,02 𝑥 1023 á𝑡𝑜𝑚𝑜𝑠 𝑥 235 𝑔 1 á𝑜𝑚𝑜 𝑔𝑟𝑎𝑚𝑜 = 1028,9 𝑔 = 1 𝐾𝑔 𝑑𝑒 235U. c) la masa convertida en energía: E = m c2 ∴ m = E/c2 = 20 𝑥 4,18 𝑥 1012 (2,999 𝑥 108 )2 gramos. = 9,3013 𝑥 10−4 𝐾𝑔 ; la masa convertida en energía fue de 0,9 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Lección 29: Fusión 29.1 Concepto La fusión es el proceso por el cual dos núcleos de átomos ligeros se unen para producir un núcleo más pesado, con emisión de energía. Según esto, la fusión es un proceso de naturaleza contraria a la fisión. Mientras la fisión es una partición de átomos pesados; la fusión es la integración de átomos ligeros en uno más pesado. Las dos reacciones, sin embargo, son similares en que en ambas, la masa conjunta de los productos finales es menor que la masa conjunta de los materiales que reaccionan: de allí el desprendimiento de energía. La fusión nuclear, está actualmente en líneas de investigación, debido a que todavía hoy no es un proceso viable, ya que se invierte más energía en el proceso para que se produzca la fusión, que la energía obtenida mediante este método. La fusión, es un proceso natural en las estrellas, produciéndose reacciones nucleares por fusión debido a su elevadísima temperatura interior. Las estrellas están compuestas principalmente por Hidrógeno y Helio. El hidrógeno, en condiciones normales de temperatura, se repele entre sí cuando intentas unirlo (fusionarlo) a otro átomo de hidrógeno, debido a su repulsión electrostática. Para vencer esta repulsión electrostática, el átomo de hidrógeno debe chocar violentamente contra otro átomo de hidrógeno, fusionándose, y dando lugar a Helio, que no es fusionable. La diferencia de masa entre productos y reactivos es mayor que en la fisión, liberándose así una gran cantidad de energía (muchísimo mayor que en la fisión). Estos choques violentos, se consiguen con una elevada temperatura, que hace aumentar la velocidad de los átomos. La primera reacción de fusión artificial, tuvo origen en la investigación militar, fue una bomba termonuclear (o también llamada bomba-H o de Hidrógeno), para obtener la temperatura adecuada que inicia el proceso de fusión (unos 20 millones de grados centígrados) se utilizó una bomba atómica. 29.2 iniciación de la fusión La fusión, para iniciarse requiere muy altas temperaturas (del orden de cien millones de grados Kelvin), con el fin de vencer la barrera de repulsión culombiana entre núcleos; a diferencia de la fisión que es espontanea en ciertos radionúclidos y procede de acuerdo a las leyes de la radiactividad; en otros, es provocada por neutrones. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 29.3 Control de la fusión Aún no se conoce que haya sido posible efectuar reacciones de fusión controlables a voluntad. Lo contrario ocurre en la fisión, que se, maneja a los niveles deseados en los reactores nucleares. Los científicos de las naciones avanzadas experimentan hace muchos años con lo que denominan “plasma”: masas de elementos ligeros totalmente ionizados, o sea, desprovistos de todos los electrones; se confina el plasma en el interior de potentes campos electromagnéticos, graduando los cuales se comprime fuertemente la masa ionizada, lo que produce en determinados puntos temperaturas de millones de grados, que resultan insuficientes para iniciar la reacción. 29.4 Perspectivas de la fusión controlada Si se lograra efectuar la reacción de fusión controlada, se dispondría de una fuente de energía que satisfaga las necesidades energéticas de la especie humana por muchos millones de siglos, ya que la materia prima es prácticamente inagotable; el hidrógeno liviano (H-1) está en algo más del 11% en océanos, lagos, ríos, glaciares, agua subterránea, hielo de los polos, cumbres de las altas montañas; el deuterio se encuentra en proporción de 150 átomos de H-2 por cada millón de átomos de hidrógeno natural. Un aspecto muy importante es el hecho de que la fusión no deja residuos por sí misma, excepto los neutrones, los cuales, considerados en libertad son un núclido (Z = 0; A = 1) emisor puro de "beta menos", con energía máxima de 0,8 MeV y periodo de 10,6 minutos. Lección 30: Reactores nucleares 30.1 Definición Reactor nuclear es una maquina destinada a efectuar de modo gradual y controlado la reacción de fisión en cadena. El tipo de reactor más conocido es el reactor térmico (la fisión se produce por neutrones lentos). El combustible es U natural (U-235 en la proporción en que se encuentra en la naturaleza) o enriquecido en el componente 235. La sustancia fisionable está dispuesta en barras distribuidas regularmente en el moderador. Como moderador se emplea grafito (rebaja la velocidad de los neutrones rápidos que salen) y como refrigerante agua a presión. Para absorber los neutrones y frenar o detener la reacción, se emplean barras de Cd. El agua de refrigeración del reactor está sometida a presión de 150 at y alcanza temperaturas superiores a 300ºC. Se hace circular a través de un cambiador de calor donde cede calor al agua de otro circuito secundario que se calienta, y se UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA expande a través de una turbina que al girar mueve un generador de energía eléctrica. Esta es la energía que se extrae de la central nuclear. 30.2 Acciones de los neutrones en un reactor Supóngase que, en un momento dado, se estén fisionando muchos átomos de un núclido fisionable; por cada átomo fisionado se producen dos o tres neutrones más dos fragmentos de fisión, más 198 MeV. Los neutrones producidos pueden tomar diferentes caminos: a) Algunos se escapan sin hacer blanco en ningún núcleo. b) Otros hacen blanco en núcleos del material fisionable, pero producen una reacción nuclear diferente de la fisión. Ej.: U-235 (n, y) U-236. La sección eficaz para esta reacción nuclear de "captura” de neutrón es 98,6 b. c) Otros hacen blanco en núcleos de material no fisionable, también para una reacción nuclear corriente. Ej.: 10B (n, α) 7Li. La sección eficaz para esta reacción nuclear es de 3 836 b. Los demás hacen blanco en material fisionable y producen fisión. Ej.: 235U (n, fisión) 2 fragm. + 2 ó 3 n + 198 MeV. La sección eficaz para la fisión es de 582,2 b. 30.3 Partes de un reactor Se hará referencia a los reactores en que la fisión está provocada por térmicos. Tales reactores funcionan con 235U, con 239Pu ó con 233U. Combustible Es el nombre que se da al núclido fisionable; generalmente se trata de 235U (sección eficaz para fisión: 582,2 b) o de 239Pu (sección eficaz para fisión: 742,5 b). El combustible debe estar en cantidad suficiente para que, dadas su configuración geométrica y su concentración en núclido fisionable, conforme una masa ligeramente mayor que la crítica cuando esté en su sitio en el interior del reactor. Moderador Es un material de núcleos ligeros, dispuesto para termalizar los neutrones rápidos producidos en la fisión. Los neutrones rápidos, al sufrir una sucesión de choques elásticos con núcleos livianos, pierden gradualmente energía, sin causar reacción nuclear de ningún tipo sobre dichos núcleos livianos, hasta llegar a ser de 0,025 eV, que es la energía adecuada para producir fisión en los combustibles de que trata. Los moderadores que se usan para los reactores son: el agua ordinaria (H2O), el agua pesada (D2O) y el grafito (C). Cuando se emplea agua como moderador, debe estar libre de iones en solución; de lo contrario, los neutrones térmicos UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA causarían reacciones nucleares sobre esos iones, con lo cual el agua se contaminaría. Reflector Es un material de núcleos ligeros, dispuesto para hacer regresar hacia el sitio del combustible a los neutrones que escapan. Este rechazo hacia el lugar del combustible ocurre por choques elásticos; por tanto, sirven como reflectores los mismos materiales moderadores: agua ordinaria, agua pesada y grafito. Absorbedor Es un material dispuesto para disminuir el ritmo de la fisión, mediante la captura de neutrones térmicos, lo que tiene el efecto de aumentar los neutrones mencionados en C) y, correlativamente, disminuir los neutrones citados en d). EI absorbedor debe tener alta sección eficaz para capturar neutrones térmicos, bien a través de la reacción "neutrón térmico, alfa”; bien por medio de la reacción "neutrón térmico, gamma"; o por otra que implique alta probabilidad de capturar neutrones térmicos. Los absorbedores más usuales incluyen al boro o al cadmio; debido a que el 10B (20% atómico en el elemento B) tiene sección eficaz de 3 836 b para la reacción "neutrón térmico, alfa); el 113Cd (12,3% atómico en el elemento Cd) ostenta sección eficaz de 20000 barns para la reacción "neutrón térmico, gamma". El absorbedor suele estar dispuesto en barras verticales que suben o bajan a voluntad del operador del reactor; al subir y alejarse del cuerpo del material fisionable, absorben menos neutrones y la reacción en cadena aumenta; al bajar, compiten con el combustible en la captura de neutrones, con lo cual la reacción de fisión disminuye en su ritmo. Refrigerante Es un fluido que circula por el núcleo del reactor o por su vecindad, para evitar que el aumento de temperatura ocasionado por la fisión arruine el núcleo; en algunos reactores, el refrigerante sirve para extraer y aprovechar el calor producido. Los principales refrigerantes son: el agua ordinaria; el agua pesada; el aire; el nitrógeno; una aleación de sodio y potasio. Blindaje biológico Es el material estructural que rodea el núcleo de un reactor, para proteger a las personas contra la intensa radiación producida por concepto de neutrones de todas las energías y por los rayos gamma. El blindaje biológico suele estar constituido por muros de hormigón armado, de dos o tres metros de espesor, que reducen el índice de dosis a valores tolerables en la cara externa del muro. Sitios de irradiación Son los destinados a la colocación de las muestras que se desea someter al flujo de neutrones o de rayos gamma. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 30.4 Tipos de reactores Se puede hacer la división atendiendo a diferentes criterios. Según el tipo de neutrones usados en la fisión se dividen en: 1.- Reactor térmico. Como el 1º construido. Funciona con neutrones lentos (térmicos) y usa como combustible el U natural (con la proporción de isótopos que se encuentran en la naturaleza, pero sin impurezas). El combustible se coloca en varillas distribuidas entre el moderador y las barras controladoras (forman un sistema heterogéneo). 2.- Reactor rápido. Funciona con neutrones rápidos o de mucha energía. El combustible debe ser U enriquecido en su componente 235 o incluso U- 235 puro. Si el combustible se halla en suspensión o en disolución en el moderador forma un sistema homogéneo (reactores homogéneos). Según el tipo de refrigerante 1.- Refrigerados por agua (que en algunos casos puede actuar de moderadoragua pesada-). 2.- Refrigerados por gas (aire -así era se refrigeraba la pila fe Fermi-, dióxido de carbono, etc). 3.- Refrigerados por un metal líquido (sodio, etc) Tipos de reactores refrigerados por agua El fluido que retira la energía calorífica que se produce en el reactor es agua. 1.-En el tipo BWR (Boling water reactor) existe un sólo circuito, el agua se vaporiza en el reactor y el vapor producido se expande contra la turbina a la que pone en movimiento. El agua enfriada en las torres de refrigeración se hace retornar al reactor por medio de bombas. El vapor de agua de este tipo de reactores es siempre radiactivo, porque el agua contiene gases radiactivos debido a las radiaciones del reactor. Los principales son el 13N, 16N, 17N, 18O, 19O. El más activo de todos es el 17N. 2.- El reactor de tipo PWR (Presión water reactor) o RAP como la del esquema de la página existen dos circuitos de agua independientes. El agua del circuito primario, que es la que está en contacto con la radiación, retira el calor del reactor. El agua en él se mantiene a gran presión para que no hierva y está circulando continuamente en ese circuito impulsada por bomba. El circuito primario cede calor, en un intercambiador de calor, al secundario. En el secundario se forma el vapor que al expandirse contra la turbina produce el movimiento. El agua de este circuito se enfría en las torres de evaporación y se hace recircular con bombas por el circuito secundario para volver a expandirse contra la turbina. El agua del circuito secundario está aislada del circuito primario y no se contamina. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA ACTIVIDADES DE AUTOEVALUACIÓN DE LA UNIDAD 2 1. Una solución de Cr-51, el 3 de abril tenía una concentración de 1,591 GBq/cm3. Qué actividad en milicurios, quedará en cada mL de solución el 2 de diciembre del mismo mes; si en el lapso considerado no se tocó la fuente, la cual fue afectada únicamente por el decaimiento causado por el transcurso del tiempo. (Utilizar fórmula de decaimiento radiactivo de la concentración). 2. Cuántos días deben transcurrir para que el número de átomos radiactivos de una fuente de Zn-65 se reduzca al 88% de su valor original. 3. Considere una fuente de telecobaltoterapia. Cuánto tiempo debe transcurrir para que se pierda el 93% de su actividad?. 4. Considere una partícula alfa que es detenida por una hoja de papel de base 90 (densidad espesor = 90 g/m2). Calcule: a) Cuánto penetraría esa partícula en mg/cm2; b) Cuál sería la penetración en aire a presión y temperatura normales, expresada en unidades adecuadas; c) Cuánto penetraría en aluminio cuyo peso específico es de 2,7; emplee en su respuesta unidades que estén precedidas por un número mayor que 1, pero menor que 1000. El peso específico del aire es 0,001293, Ra=90 g/m2 (lo mismo que para papel); para la penetración en unidades de longitud: Ra = Dasa ∴ sa = Ra/Da = 90 g/m2 dividido por 0,001293 g/cm3 = 6,9656 cm; se puede decir que la penetración en aire normal es de 7 cm. 5. Una dermoplaca de Sr-90 + Y-90 tiene ventana protectora frontal de 89 mg/cm2. Halle el espesor absoluto de esa ventana, en milímetros y en micrómetros; se sabe que el material de la ventana es níquel. Consulte la densidad del níquel (tabla periódica); utilice la fórmula RN = DNsN; despejar sN. 6. Una fuente de telecobaltoterapia que opera a determinadas condiciones, produce en cierto sitio, por concepto de radiación dispersada (efecto Compton), un índice de exposición de 76 mR/h. Una persona distinta del paciente permanece en el sitio mencionado durante todo el tiempo de una irradiación, que fue de 12 min. 30 seg. a) qué exposición sufrió esa UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA persona. b) qué dosis expresada en dos unidades diferentes. c) qué equivalente de dosis, expresado en dos unidades diferentes. 7. Una fuente gammagráfica de Ir-192 produce, en determinado punto de acceso restringido, un índice de exposición de 396 mR/h. Durante cuánto tiempo puede una persona permanecer en ese punto, para que su dosis sea solamente de 2,5 milirads. 8. Indique el producto de cada una de las reacciones nucleares siguientes: Al-27 (d; p, 𝛼) Mg-24 (n, p) Al-27 (𝛾; 2𝑝, 𝑛) Al-27 (n, 𝛼) Mg-26 (d, 𝛼) Na-23 (n, 𝛾) Na-23 (d, p) Al-27 (p; 3p, n) Mg-25 (𝛾, 𝑝) Apoyo: “d” es deutrón, es decir, un núcleo de deuterio (H-2, 1 protón + 1 neutrón). En cada problema, hay que hacer balance de Z y de A; por ejemplo para la reacción Al-27 (d; p, 𝛼): Z; 13 + 1 = 1 + 2 + ?; en donde ..? = 11 A; 27 + 2 = 1 +4 + ?; en donde ..? = 24 El producto tiene Z = 11; por tanto es Na, y tiene A = 24; que corresponde finalmente a Na-24 9. Se encuentra un papiro, que sometido al contaje de C-14, en experimento realizado en 1989, se obtuvo 8,2 desintegraciones por minuto, por gramo de carbono. A) Aproximadamente, en qué año se enterró el papiro. B) De cuántos años sería el error en la determinación anterior, si el valor real de la actividad no fuera de 8,2 sino de 8,1 (desint) / (min) (g de C). 10. Si se fisiona un átomo de Pu-239 y se producen 3 neutrones de fisión, ¿cuál es el producto de fisión más ligero, si el más pesado es Cs-137. Recuerde balancear Z y A. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA FUENTES DOCUMENTALES DE LA UNIDAD 2 Adloff, J-P., (1997). Introducción a la radioquímica, Instituto de Ciencias Nucleares y Energías Alternativas, Bogotá, Colombia. Biblioteca digital, (2013b). Interacción de la radiación y la materia. Consultado abril 30 de 2013, en: http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/094/htm/sec_6.h tm Foro Nuclear, (2013). ¿Qué es la radiactividad?. Consultado abril 15 de 2013, en: http://www.foronuclear.org/consultas-es/consultas-al-experto/que-es-laradiactividad Guzmán, M.E., (1989). Nucleónica Básica. Instituto de Asuntos Nucleares, Bogotá, Colombia. INGEOMINAS, (2002). Curso de protección radiológica para el manejo de material radiactivo, Consultado abril 24 de 2013, en: http://www.ingeominas.gov.co/getattachment/Nucleares/Otrasactividades/memorias-Curso-P-R-.pdf.aspx INSHT, (2013). Radiaciones ionizantes: normas de protección. Consultado mayo 1 de 2013, en: http://www.insht.es/InshtWeb/Contenidos/Documentacion/FichasTecnicas/NTP/Fic heros/301a400/ntp_304.pdf Iturbe J. L., (2001). FUNDAMENTOS DE LA RADIOQUIMICA, Universidad Autónoma del Estado de México Toluca. Monografias.com (2013).Energía nuclear. Consultado mayo 15 de 2013, en: http://www.monografias.com/trabajos/enuclear/enuclear.shtml OMS, (2012). Radiaciones ionizantes: efectos en la salud y medidas de protección. Consultado junio 8 de 2013, en: http://www.who.int/mediacentre/factsheets/fs371/es/ Recursostic, (2013). Radiactividad. Consultado mayo 16 de 2013, en: http://recursostic.educacion.es/newton/web/materiales_didacticos/radiactividad/aul aradiactividad.pdf UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA UNIDAD 3 Nombre de la Unidad PROTECCIÓN RADIOLÓGICA, SEGURIDAD NUCLEAR Y APLICACIONES Introducción Justificación Intencionalidades Formativas Denominación de capítulos Trabajar en radioquímica es en ocasiones un desafío complejo para el químico: la necesidad de protegerse contra la radiación implica muchas veces la necesidad de efectuar procesos en celda, donde los telemanipuladores reemplazan a las manos en las operaciones, y además contrarreloj, pues la población de átomos radiactivos disminuye en forma constante. Sin embargo, estas características no configuran en sí mismas un carácter distintivo, pues otros procesos químicos requieren también instalaciones especiales y a menudo ejecución rápida. En la presente unidad se consideran los efectos biológicos de las radiaciones, así como lo referente a la protección para evitar al máximo dichos efectos; finalmente se presenta una breve descripción de las posibles aplicaciones de la radioquímica. Como parte fundamental del curso, se debe proporcionar al estudiante información acerca de los efectos de la radiación en los seres vivos y cómo puede intervenir él como profesional de la química en la generación de soluciones a problemáticas del entorno en el que se encuentra involucrada la radioquímica. Sensibilización de problemáticas propias de un campo disciplinar que pueden ser solucionadas desde la radioquímica. Capítulo 7: Efectos biológicos de las radiaciones Capítulo 8: Protección radiológica Capítulo 9: Aplicaciones UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA CAPÍTULO 7: EFECTOS BIOLÓGICOS DE LAS RADIACIONES El efecto nocivo de niveles bajos de radiación en la salud humana ha sido extensamente estudiado. Los datos epidemiológicos provenientes de poblaciones expuestas a explosiones atómicas, a exposición médica (diagnóstico y terapia) y a exposición ocupacional son temas en constante revisión. Dependiendo de muchos parámetros complejos, cuando la radiación ionizante transfiere energía a un sistema biológico, provocará uno o más resultados finales. La incidencia general y/o la severidad del resultado final estarán relacionadas con la dosis absorbida por el sistema. Para organismos complejos como el humano, hay dos tipos de efectos relacionados con la dosis: somáticos y genéticos. El daño somático se refiere al daño ocurrido en los tejidos del individuo irradiado, mientras que el daño genético se refiere al daño que afectará las generaciones futuras. Lección 31: Mecanismos del daño biológico Existen dos teorías referentes al mecanismo del daño biológico (Guzmán 1989): Teoría de la acción directa o del impacto: Las radiaciones ionizantes transfieren energía a masas muy pequeñas, por lo cual la relación energía/masa afectada, es muy grande. Debido a esto, las radiaciones ejercen acción nociva inmediata sobre las moléculas integrantes de las células y sobre ciertas sustancias de vital importancia, como las enzimas. Teoría de la acción indirecta: Las radiaciones rompen moléculas de agua, con producción de iones, radicales libres y peróxidos, que atacan las moléculas de ADN y ARN, los cromosomas y las enzimas. El mecanismo de la ruptura de las moléculas de agua y subsiguiente formación de productos nocivos, se resume a continuación: 31.1 Formación de iones, radicales libres y peróxidos La enfermedad por radiación es una enfermedad producida por radicales libres al igual que el síndrome de isquemia-reperfusión, que algunas intoxicaciones, y otros muchos cuadros patológicos. La mayor parte de los iones formados por el efecto de la radiación, lo son a partir de moléculas de agua, pues no en vano el agua es la molécula más abundante del organismo. Un radical libre es cualquier átomo o molécula capaz de existencia independiente, que posee en su capa electrónica externa un electrón no pareado. En virtud de ello, se trata de sustancias con una gran capacidad para reaccionar con las moléculas cercanas, a las que pueden UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA causar cambios químicos y estructurales que lleguen a traducirse en la pérdida de su función. Aunque no son ni mucho menos los únicos, los radicales libres más abundantes en la naturaleza son los radicales libres de oxígeno, pues en gran parte se producen en el curso de la respiración celular normal además de en muchos procesos patológicos, fundamentalmente en algunas intoxicaciones paraquat, diquat, paracetamol, bajo la acción de algunas sustancias químicas empleadas como antineoplásicos- las antraciclinas-,en la isquemia, y posterior reperfusión de los órganos, en los leucocitos polimorfonucleares que han sido activados por substancias extrañas al organismo y por supuesto, bajo la acción de la radiación. Cuando la molécula de oxígeno adquiere un electrón, aparece un radical llamado superóxido, representado por O2-. Es probablemente el más abundante de los radicales libres de oxígeno, aunque no el más reactivo. No obstante, de forma espontánea, con el concurso de algunos metales de transición como el cobre o el hierro, o por intermedio de enzimas específicas, como las superoxidodismutasas, puede transformarse, por adquisición de un nuevo electrón, y de dos protones, en peróxido de hidrógeno, o agua oxigenada, que, aunque es capaz de intervenir en casi todas las reacciones radicalares, no es técnicamente un radical libre, pues no tiene electrones desapareados. El radical hidroxilo es el resultado de la adquisición, por parte de la molécula del oxígeno, de tres electrones, con rotura molecular y adición de un protón. El radical libre hidroxilo es una de las substancias químicas más reactivas. En virtud precisamente de esa reactividad, el radical hidroxilo, representado por HO-, es la más nociva de las formas radicalares del oxígeno. El radical hidroxilo es el responsable de la mayor parte del daño ocasionado al DNA celular y a las membranas causado inicialmente por las radiaciones ionizantes. Las reacciones del HO- pueden ser de tres tipos: abstracción de H, adición, y transferencia electrónica. En cuanto a esta última, siguiendo un principio clásico de la química de los radicales libres, la reacción de un radical libre con una especie química no radicalar produce un radical libre diferente, que puede ser más o menos activo que el radical libre original. El ejemplo más típico de la reacción de abstracción de hidrógeno es la reacción del radical hidroxilo con los ácidos grasos de las membranas celulares, para producir, tras algunas transformaciones complejas de las moléculas del ácido graso, una reacción en cadena, denominada lipoperoxidación, en la que se van produciendo cada vez más radicales libres, y que si no es detenida por los agentes antioxidantes de la propia membrana o por agentes externos, puede llegar a producir lesiones de la membrana, además de productos de degradación, como el hidroxinonenal o el malondialdehido que de por sí tienen propiedades cancerígenas. Cuando la producción del radical hidroxilo se da cerca de una cadena de DNA, el radical puede reaccionar con la desoxiribosa, transformándola en una gran cantidad de diferentes productos, algunos de los cuales han revelado propiedades mutágenas en UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA algunas bacterias. Además, puede actuar directamente sobre las bases púricas y pirimidínicas, en general por adición, por ejemplo, en el doble enlace de la timina, para convertirla en timina-glicol, al que confiere el carácter de radical libre. Este puede reaccionar posteriormente con el oxígeno, para formar peroxitimina, francamente reactiva, que puede unirse a moléculas adyacentes, modificando la estructura de la cadena de DNA Algunos de los productos del ataque oxidativo del radical hidroxilo no sufren transformación ulterior, y son excretados en la orina, donde pueden cuantificarse. Por ejemplo, se calcula que la timinaglicol, y la timidinaglicol - timinaglicol (Figura 10) que todavía tiene unida la desoxiribosa -y el 5-hidroximetiluracilo son excretados en cantidad aproximada de 100nmol (10-9 mol) cada uno, cada día, en un ser humano normal. Figura 10. Estructura química de timina y su posterior producto Si todas estas moléculas procedieran del resultado de la reparación de cadenas de DNA (alguna cantidad es producida por las bacterias intestinales, y otra proviene de la presente en los alimentos), corresponderían a una media de 1000 bases de DNA dañadas en cada una de las células que componen el organismo. Dado que estos son solamente algunos de los productos de degradación del ataque radicalar al DNA, los daños que precisan ser reparados diariamente pueden ser mucho más numerosos. 31.2 Diferencias de respuesta biológica ante la irradiación Para los agentes farmacológicos en general es válida la regla de que, para obtener un efecto biológico dado, se requiere dar una determinada dosis mayor que la dosis umbral. La dosis umbral es aquella que marca el límite arriba del cual se presenta un efecto, y debajo del cual no hay efecto. Algunos de los efectos de la radiación caen en este caso, los no estocásticos. Otras sustancias no tienen una respuesta de este tipo, es decir no tienen umbral, por lo tanto no hay una dosis mínima para producir un efecto. Consecuentemente, cualquier dosis dada UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA produce un efecto; para obtener un efecto cero, se requiere una dosis cero. Los efectos estocásticos de la radiación se comportan de esta manera. La rapidez con la cual se absorbe la radiación es importante en la determinación de los efectos. Una dosis dada producirá menos efecto si se suministra fraccionada, en un lapso mayor, que si se aplica en una sola exposición. Esto se debe al poder de restauración del organismo; sin embargo hay que tomar en cuenta que esta recuperación no es total y siempre queda un daño acumulativo. El lapso entre el instante de radiación y la manifestación de los efectos se conoce como periodo latente. Con base en esto se pueden clasificar los daños biológicos como agudos (a corto plazo), que aparecen en unos minutos, días o semanas, y diferidos (largo plazo), que aparecen después de años, décadas y a veces en generaciones posteriores. El daño biológico tendrá diferentes manifestaciones en función de la dosis. A bajas dosis (menos de 100 mSv o 10 rem) no se espera observar ninguna respuesta clínica. Al aumentar a dosis mayores, el organismo va presentando diferentes manifestaciones hasta llegar a la muerte. La dosis letal media, aquella a la cual 50% de los individuos irradiados mueren, es de 4 Sv (400 rem). Ordinariamente, cuando se hace referencia a dosis equivalentes, se quiere indicar una dosis promedio al cuerpo total. Esto es importante ya que en ocasiones pueden aplicarse grandes dosis de radiación a áreas limitadas (como en radioterapia) con un daño local. Si estas mismas dosis se aplican a todo el cuerpo pueden ser letales. Por ejemplo, una persona podría recibir 10 Sv (l 000 rem) en un brazo y experimentar una lesión local, pero esa misma dosis a cuerpo entero le causaría inexorablemente la muerte. Lección 32: Radiopatía y muerte por irradiación aguda de todo el cuerpo humano A continuación se presenta una tabla (Tabla 7) propuesta por Guzmán (1989), en la cual se muestran porcentajes de casos de radiopatía y de muertes, de acuerdo a la dosis de radiación recibida. DOSIS % CASOS % CASOS (Rad) RADIOPATÍA MUERTE 50 0 0 100 5 0 150 20 0 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 200 45 0 250 75 3 300 90 10 350 98 20 400 100 38 450 100 50 500 100 70 550 100 80 600 100 90 700 100 98 750 100 100 Tomada de Guzmán (1989) Tabla 7. Radiopatía y muerte por dosis aguda en todo el cuerpo 32.1 Síntomas de irradiaciones agudas en todo el cuerpo A continuación se presenta a modo de resumen un cuadro de síntomas y pronóstico para ciertas dosis agudas que afecten todo el cuerpo humano (Guzmán, 1989): 25 rem (0,25 Sv). Ningún efecto clínico detectable. Probablemente ningún efecto diferido. 50 rem (0,50 Sv). Ligeros cambios pasajeros en la sangre. Ningún otro efecto detectable clínicamente. Posibles efectos diferidos, pero muy probable un efecto medio en un individuo medio. 100 rem (1 Sv). Náusea y fatiga con posibles vómitos. Cambios marcados en la sangre, con restablecimiento diferido. Acortamiento de la vida probable. 200 rem (2 Sv). Náusea y vómito en las primeras 24 horas. A continuación del período latente de una semana, caída del cabello, pérdida del apetito, debilidad general y otros síntomas tales como diarrea, e irritación de garganta. Posiblemente fallecimiento, al cabo de dos a seis semanas de una pequeña fracción de los individuos irradiados. Restablecimiento probable, de no haber complicaciones por poca salud anterior, o superposición de lesiones e infecciones. 400 rem (4 Sv). Náusea y vómito al cabo de una o dos horas. Después de un periodo latente de una semana, comienzo de caída del cabello, pérdida del apetito UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA y debilidad general acompañada de fiebre. Inflamación grave de boca y garganta en la tercera semana. Palidez, diarrea, hemorragia nasal y rápida extenuación hacia la cuarta semana. Muerte del 50% de los individuos irradiados a partir de la tercera semana. 600 rem (6 Sv). Náusea y vómito al cabo de una o dos horas. Corto período latente a partir de la náusea inicial. Diarrea, vómitos, inflamación de boca y garganta hacia el final de la primera semana. Finalmente, fallecimiento probable de todos los individuos irradiados. Lección 33: Dosis media letal y dosis máxima permisible (DMP) 33.1 Dosis media letal Es aquella dosis que habiendo afectado la totalidad del cuerpo de los animales, mata al 50% de ellos. Cuando se define que la muerte se produzca dentro de los 30 días siguientes de la irradiación, se designa como DL 50/30. El concepto de dosis media letal, aplicado a un solo individuo, sería aquella dosis aguda que, habiendo afectado la totalidad del cuerpo del individuo, implica una probabilidad de muerte del 50%. La dosis media letal de acuerdo con Guzmán (1989) para el hombre en rads es de 450, para una ameba es 120000, mientras que para un cerdo es de 275. 33.2 dosis máxima permisible (DMP) Es la mayor dosis que puede recibir todo el cuerpo o un órgano de una persona y que a la luz de los actuales conocimientos, se espera que no causará efectos nocivos clínicamente observables en ningún momento de la vida de la persona, ni en sus descendientes. En la Tabla 8, se presentan algunas dosis máximas permisibles, según el órgano. ÓRGANOS AFECTADOS DMP ANUAL (rems) DMP trimestral(rems) Cuerpo en total; gónadas; médula ósea roja 5 3 Huesos, tiroides, piel de todo el cuerpo 30 15 Manos, antebrazos, pies, tobillos 75 40 Otros órganos, incluido el cristalino 15 8 Adaptada de Guzmán (1989) Tabla 8. Dosis máximas permisibles para exposición ocupacional UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 33.3 Seguridad que brindan las DMP Por pequeña que sea toda radiación ionizante, causa algún daño en el organismo; por lo cual se debe procurar que la dosis recibida se acerque lo más posible a cero. Sin embargo si por razones laborales la persona debe ser expuesta; lo importante es que no sobrepase las DMP, ya que éstas han sido determinadas científicamente y se encuentran por debajo de las dosis que producen daño clínicamente perceptible. En cuanto a las irradiaciones médicas que lleven a absorciones de dosis superiores o incluso muy superiores a las DMP, se debe tener en cuenta que el médico especializado en medicina nuclear o en radioterapia, dispone de los conocimientos necesarios para evaluar el beneficio y el daño de cada irradiación: si el beneficio pesa más que el daño, la irradiación se imparte; de lo contrario se prescinde de ella. 33.4 Órgano crítico Guzmán 1989, propone como órgano crítico a aquel órgano del cuerpo humano en que el cociente entre cualquier dosis absorbida por ese órgano y la DMP anual para el mismo, es mayor que en cualquier otro órgano, por acción de un radionúclido determinado, en condiciones dadas de solubilidad y vía de entrada. Cuando un radionúclido ingresa al cuerpo, produce dosis en varios órganos, pero en diferente cuantía para cada cual; el cociente entre esa cuantía y la DMP para el respectivo órgano, determina cual es el órgano crítico. La dosis recibida por un órgano, es función no solamente del radionúclido y su actividad, sino también de la calidad de soluble o insoluble, y de la vía de entrada en el cuerpo. Por tanto, se debe especificar esos tres factores (radionúclido, solubilidad, vía de entrada) para conocer cuál es el órgano crítico. Ejemplo: Rb-87; soluble; ingestión: páncreas. Rb-87; soluble; inhalación: páncreas, hígado, cuerpo en total. Rb-87; insoluble; ingestión: intestino delgado inferior. Rb-87; insoluble; inhalación: pulmones. Como se puede evidenciar, el cuerpo en total puede considerarse a veces como el órgano crítico. Además, en ciertos casos, hay más de un órgano crítico para un mismo conjunto de los tres factores, lo que implica cocientes máximos iguales entre sí. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 33.5 Período físico, biológico y efectivo A continuación, se definirá cada uno de los periodos de acuerdo con Guzmán (1989). El período físico es el tiempo que debe transcurrir para la desintegración de la mitad de los átomos de un radionúclido. Depende exclusivamente del radionúclido. El período biológico es el tiempo que debe transcurrir para que un órgano del cuerpo humano elimine, por procesos biológicos, la mitad de los átomos de un elemento. El período biológico depende tanto del órgano considerado como del núclido (sea radiactivo o estable; pues si bien el organismo hace la distinción química entre elementos, por lo general es incapaz de hacer distinción física entre dos núclidos isotópicos). El período efectivo es el tiempo que debe transcurrir para que la mitad de los átomos de un radionúclido se elimine de un órgano del cuerpo humano, por la acción conjunta de los procesos de radiactividad y de expulsión biológica. En consecuencia, el período efectivo, depende de dos factores: el radionúclido y el órgano en que se halla. Se puede demostrar que el período efectivo es igual al producto sobre la suma de los períodos físico y biológico: 𝑇𝑒 = (𝑇𝑓 )(𝑇𝑏 ) (𝑇𝑓 + 𝑇𝑏 ) Se puede evidenciar que el período efectivo, es menor que el período físico o biológico. Lección 34: Efectos somáticos y genéticos de la radiación El daño biológico por radiación puede manifestarse directamente en el individuo que recibe la radiación o en su progenie. En el caso en que el daño se manifieste en el individuo irradiado se trata de un daño somático, es decir, el daño se ha circunscrito a sus células somáticas. Por otro lado, el daño a las células germinales resultará en daño a la descendencia del individuo. Se pueden clasificar los efectos biológicos en el hombre como somático y hereditario. El daño a los genes de una célula somática puede producir daño a la célula hija, pero sería un efecto somático no hereditario. El término "daño genético" se refiere a efectos causados por mutación en un cromosoma o un gen; esto lleva a un efecto hereditario solamente cuando el daño afecta a una línea germinal. Síndrome de irradiación aguda es el conjunto de síntomas por la exposición de cuerpo total o una gran porción de él a la radiación. Consiste en náusea, vómito, anorexia (inapetencia), pérdida de peso, fiebre y hemorragia intestinal. Según su UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA periodo de latencia, los efectos se han clasificado en agudos (a corto plazo) y diferidos (a largo plazo). Los efectos agudos pueden ser generales o locales. Los locales pueden ser eritema o necrosis de la piel, caída del cabello, necrosis de tejidos internos, la esterilidad temporal o permanente, la reproducción anormal de tejidos como el epitelio del tracto gastrointestinal, el funcionamiento anormal de los órganos hematopoyéticos (médula ósea roja y bazo), o alteraciones funcionales del sistema nervioso y de otros sistemas. Los efectos diferidos pueden ser la consecuencia de una sola exposición intensa o de una exposición por largo tiempo. Entre éstos han de considerarse: las cicatrices atróficas locales o procesos distróficos de órganos y tejidos fuertemente irradiados, las cataratas del cristalino, el cáncer de los huesos debido a la irradiación del tejido óseo, el cáncer pulmonar, las anemias plásticas ocasionadas por radiolesiones de la médula ósea, y la leucemia. 34.1 Efecto sobre el individuo a) Daños en la piel: eritema, depilación, necrosis de la piel y de los tejidos vecinos. La piel se enrojece y presenta aspecto seco y quebradizo, especialmente bajo las uñas; se puede desarrollar cáncer de la piel, que se extiende a veces a otras partes del cuerpo. b) Esterilidad temporal o permanente, si se irradian las gónadas, que son muy sensibles a la radiación ionizante (Ley de Bergonie y Tribondeau). No obstante, las dosis para causar esterilidad permanente son de algunos cientos de rads, las mismas que, de afectar a todo el cuerpo, causarían la muerte del individuo. c) Disminución o anormalidad en el proceso de reproducción de tejidos, como los hematopoyéticos y el epitelio del tracto gastrointestinal. d) Daño en los ojos: formación de cataratas (opacidad del cristalino). e) Cáncer en los huesos o en los pulmones o en la piel; leucemia. La localización del cáncer depende de la fuente y de la vía de entrada. f) Alteraciones sanguíneas: como consecuencia de altas dosis, hay fuerte descenso de glóbulos blancos, entre cuyas funciones figuran la de combatir las infecciones y la de eliminar las sustancias tóxicas del cuerpo; así, la persona fuertemente irradiada queda indefensa ante la enfermedad, la infección y la acumulación de productos tóxicos. Así mismo las altas dosis causan disminución en el número de glóbulos rojos, con que la persona irradiada muestra palidez, desaliento, debilidad y otros síntomas de anemia. La alteración más grave de la sangre es la leucemia, que puede aparecer varios años después de la irradiación, ya por dosis agudas altas, ya por dosis pequeñas distribuidas en largos períodos. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA g) Acortamiento de la vida probable; se dice que entre 5 y 10 días por cada roentgen de exposición en todo el cuerpo. h) La muerte. 34.2 Efecto sobre la especie Las células humanas contienen 23 pares de cromosomas; en cada cromosoma están los genes, responsables de los caracteres hereditarios. Hay tres causas de aberraciones en los cromosomas y mutaciones en los genes: enfermedades, agentes químicos, radiación ionizante. La radiación actúa por cesión de energía en el núcleo de la célula o cerca de él (teoría del impacto) y por formación de iones, radicales libres y peróxidos (teoría de la acción indirecta). La inmensa mayoría de las mutaciones es nociva; en los seres humanos las mutaciones se manifiestan en diversas taras físicas o mentales de los descendientes. El número de mutaciones genéticas es proporcional a la dosis absorbida por los padres desde el comienzo del desarrollo de las gónadas hasta el momento de la procreación. De allí la necesidad de limitar cuanto sea posible la irradiación de los miembros de la población, sobre todo con respecto a personas menores de 25 años y a mujeres en edad de procrear. Lección 35: Contacto corporal con emisores gamma 35.1 Efectos de apuñar emisores gamma La parte del cuerpo más propensa a recibir altas dosis accidentales de radiación gamma es la mano, porque es el órgano que queda más cerca de la fuente en los momentos de liberar a ésta de la cerradura y de volverla a guardar, entre otros. Cuando suceden este tipo de situaciones, bastan muy pocos segundos para que las consecuencias sean muy graves; pues para cualquier emisor gamma, siendo iguales las demás condiciones, una distancia de 2,5 milímetros ocasiona dosis diez mil veces mayor que a 25 cm. 600 rem (o sea 6 Sv). Quemadura de radiación, semejante a la de primer grado. Sensación de calor o de picazón después de pocas horas del accidente. Luego de varias horas, enrojecimiento, que se desvanece después de horas o días, pero que puede reaparecer a las dos o tres semanas. Posiblemente siga descamación seca o una peladura en la parte irradiada de la piel. Se requiere atención médica para evitar la infección. Es muy probable la recuperación completa. 1000 rem. Quemadura de radiación, semejante a la de segundo grado. Inflamación, seguida de hinchazón. En el curso de una a tres semanas, se forman ampollas, que se revientan y dejan a la vista llagas dolorosas susceptibles de UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA infectarse. La mano se pone rígida, el movimiento de los dedos suele ser doloroso. Se necesita atención médica, para evitar la infección y para mitigar el dolor. El daño apreciable a la vista se cura en el transcurso de unos meses; pero pueden quedar secuelas, tales como adelgazamiento de la piel y daños en el tejido subcutáneo y en los vasos sanguíneos; así mismo el tejido afectado estará en el futuro más expuesto a daño y será más sensible a la presión o al calor. 2000 a 3000 rem. Quemadura de radiación semejante a una escaldadura. Ampollas. A las pocas horas, intenso dolor y tumefacción. Es urgente la atención médica para aliviar el dolor. Es posible que la herida no se cure si no se efectúa la remoción quirúrgica del tejido expuesto, seguida de injerto. Para el futuro habrá problemas: dolor, poca resistencia, reapertura de la herida. Más de 3000 rem. Muerte del tejido afectado, que debe ser removido quirúrgicamente. Si la dosis es de varios millares de rem, el individuo afectado sufrirá un proceso largo y doloroso que terminará al cabo de algunos años, con la amputación de uno o varios dedos, o de toda la mano. 35.2 Dosis al coger un emisor gamma La fuente casi nunca entra en contacto directo con la piel, pues lo normal es que el emisor se halle encerrada en una cápsula inamovible de acero, cuyo espesor de paredes es de 2,5 mm por lo menos. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA CAPÍTULO 8: PROTECCIÓN RADIOLÓGICA Introducción A raíz del descubrimiento de la radiactividad y de los rayos X a finales del siglo XIX, se pusieron de manifiesto los daños producidos por las radiaciones ionizantes. Desde entonces, la identificación de muchos usos importantes y beneficiosos de las radiaciones ionizantes, el desarrollo de nuevos procesos tecnológicos que las generan y el conocimiento del daño que pueden ocasionar han crecido a la par. De esta manera, se ha demostrado la importancia de establecer ciertas medidas de seguridad que garanticen un nivel adecuado de protección al ser humano. Estas normas constituyen el origen de una disciplina denominada Protección Radiológica. En este capítulo se presenta principalmente, el blindaje requerido para cada tipo de radiación, los instrumentos de medida para el control de la misma y algunas normas para el trabajo con fuentes radiactivas. Lección 36: Aparatos para medir la radiación 36.1 Sumadores e Intensímetros Sumadores son los aparatos que a lo largo del tiempo van acumulando cualquier efecto mesurable de la radiación (Exposición, dosis, equivalente de dosis, cuentas, pulsos, etc.). Los sumadores se pueden comparar con el contador de kilómetros de un automóvil, dispositivo que suma o acumula recorrido total entre determinados límites de tiempo. Intensímetros son los aparatos que en cualquier instante, dan la derivada con respecto al tiempo de cualquier efecto mensurable de la radiación (índice de exposición, índice de dosis, cuentas por minuto, miliroentgens por hora, etc.). Estos se pueden comparar con el velocímetro de un automóvil, que presenta la rapidez del vehículo en cualquier instante. Todos los instrumentos que miden los efectos de la radiación, por complicados que sean, pertenecen a uno de esos dos tipos: sumadores o intensímetros. Hay algunos aparatos en los cuales, por operación de un mando, el instrumento actúa alternativamente: ya como sumador, o como intensímetro. 36.2 Cámaras de gas Una cámara de gas (Figura 11) es un sistema de electrodos para recolectar iones, y de dispositivos para la medida de la carga o de la corriente de dichos iones. El tipo más común de detector de radiaciones ionizantes es el detector de cámara UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA gaseosa. Este detector está basado precisamente en la capacidad de la radiación de formar iones al atravesar el aire u otro gas específico. Cuando se dispone un alto voltaje entre dos zonas de una cámara llena de gas, los iones positivos serán atraídos hacia el polo negativo del detector (el cátodo), y los electrones libres lo serán hacia el polo positivo (el ánodo). Si ambos electrodos se conectan a un instrumento de medida de la diferencia de potencial creada, aparecerá una señal tanto mayor, cuanta mayor sea la dosis de radiación detectada por el instrumento. Este principio da lugar a la cámara de ionización, que puede detectar grandes cantidades de radiación, o al conocido detector de Geiger-Müller, que se utiliza para medir cantidades de radiación muy pequeñas. Figura 11. Cámara de gas 36.3 Dosímetros de película Trozo de película similar a la empleada en radiografía dental, colocado entre dos filtros metálicos (Al o Cu) dentro de una carcasa de plástico. La película utilizada es especialmente sensible a las radiaciones ionizantes. La película utilizada se ennegrece en mayor o menor medida en función de la energía (radiación) que recibe. La placa en la que se pone la película cuenta con diferentes filtros destinados a ampliar la sensibilidad y para poder diferenciar radiaciones fuertes y débiles. Una vez que la radiación ha impresionado la película la medida se realiza comparando los tonos negros con otras películas sometidas a diferentes radiaciones (patrón). 36.4 Instrumentos de medida aconsejables El médico o radiólogo que maneje fuentes de radiación, ionizante, debe disponer por lo menos de los siguientes instrumentos de medida: a) Dos dosímetros de lectura directa por cada persona que trabaje con las fuentes; si se estropea o se descarga un dosímetro, quedará el otro. Adicionalmente, uno de los dosímetros puede servir como sumador de exposiciones en sitios diferentes del cuerpo. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA b) Un portapelículas por cada persona que trabaje con fuentes, amén de la película o películas pertinentes, y, desde luego el servicio de revelado y evaluación por parte de una entidad de comprobada idoneidad. c) Un intensímetro adecuado por cada fuente gamma o X, o β. Si la persona trabaja con neutrones, deberá proveer los instrumentos pertinentes. Lección 37: Blindaje 37.1 Blindaje para rayos alfa (α) Es claro que los rayos alfa no requieren blindaje; pues bastan una o dos hojas de papel para frenarla por completo. Además, aunque no existe un blindaje tan tenue, queda reemplazado con igual eficacia por unos pocos centímetros de aire. 37.2 Blindaje para rayos beta (β) Este tipo de radiación puede ser detenido completamente mediante un blindaje apropiado cuyo espesor depende de la energía de las partículas beta y de la densidad del material blindante (Tabla 9). Debe tenerse en cuenta que las partículas beta, al ser frenadas en un material blindante, generan rayos X que puede requerir a su vez un blindaje. A fin de minimizar este fenómeno es conveniente utilizar materiales de bajo número atómico para blindar la radiación beta; normalmente se usan materiales de baja densidad como blindajes, tal como madera, vidrio, plástico, etc. Tomado de Facultad de ingeniería UBA (2013) Tabla 9. Algunos Blindajes típicos para radiación beta Para efectos de calcular el blindaje requerido para fuentes emisoras beta puede obtenerse a partir del alcance (R), el cual se obtiene mediante las siguientes ecuaciones (INGEOMINAS, 2002): 𝑅 (𝑚𝑔/𝑐𝑚2 ) = 412 ∗ 𝐸1.265− 0.0954 𝑙𝑛𝐸 Cuando la energía máxima de las partículas beta está comprendida en el rango 0.01 ≤ E ≤ 2.5 MeV 𝑅 (𝑚𝑔/𝑐𝑚2 ) = 530 ∗ 𝐸 − 106 Cuando la energía máxima de las partículas beta es mayor a 2.5 MeV. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 𝑅 (𝑚𝑔/𝑐𝑚2 ) = 𝑋 (𝑐𝑚) ∗ 𝛿(𝑚𝑔/𝑐𝑚3 ) donde 𝑋 es el espesor del material blindante y δ es su densidad. Cuando se utilizan materiales con número atómico (Z) mayor a 13, es necesario calcular la fracción de energía cinética que se transforma en radiación X, y de acuerdo a la intensidad obtenida, se analiza si se requiere atenuar esta radiación, y por tanto calcular el blindaje necesario. La fracción que se transforma en fotones X se puede calcular por la siguiente expresión: 𝑓 = 3.5 ∗ 10−4 𝑍 ∗ 𝐸 donde Z es el número atómico del absorbedor y E la energía máxima de las partículas beta emitidas. 37.3 Blindaje para rayos gamma (γ) Para el caso del blindaje de fuentes radiactivas emisoras de radiación gamma a diferencia de la radiación corpuscular alfa o beta que pueden ser absorbidas completamente por el material, ésta se atenúa exponencialmente sin llegar a ser absorbida totalmente. Su intensidad puede reducirse aumentando el espesor del blindaje, pero nunca se puede llevar a cero. La expresión matemática que representa la atenuación es: 𝑋 = 𝑋0 𝑒 −𝜇𝑥 𝑋 corresponde a la tasa de exposición transmitida que no han interactuado con el material; 𝑋0 corresponde a la tasa de exposición sin blindaje; 𝜇 el coeficiente de atenuación lineal y 𝑥 el espesor del material blindante. El valor del coeficiente de atenuación lineal, m, depende del tipo de radiación, de la energía de y del tipo de material utilizado como blindaje. Sus unidades se expresan en cm-1, cuando x se expresa en cm, ya que el exponente debe ser adimensional. En algunos casos se acostumbra a expresar el espesor del material en términos de la densidad, denominándose espesor másico, y se obtiene de acuerdo a la expresión: 𝑥𝑚 = 𝑥 ∗ 𝛿 𝑥𝑚 representa el espesor másico (g.cm-2) 𝛿 representa la densidad del blindaje (g.cm-3) 𝑥 representa el espesor del blindaje (cm) Cuando se utiliza el espesor másico, en la expresión para determinar el haz transmitido, se debe reemplazar el coeficiente de atenuación lineal m por el coeficiente másico de atenuación (𝜇𝑚 = 𝜇/𝛿), con unidades (cm2g-1). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA La expresión: 𝑋 = 𝑋0 𝑒 −𝜇𝑥 se satisface para haces estrechos, es decir, para haces colimados. En algunas situaciones se tienen fuentes cuyos haces de radiación son anchos o sin ninguna colimación generando campos isotrópicos, en estas situaciones el blindaje, además de absorción y transmisión, contribuye notablemente a la transmisión por la presencia de radiación dispersa. Con el fin de tener en cuenta esta radiación y poder evaluar su contribución la expresión antes anotada se ve modificada por un factor denominado build up, B, cuyo valor depende de la energía de la radiación incidente, del material utilizado como blindaje y de su espesor. Considerando este término, la expresión queda así: 𝑋 = 𝑋0 𝐵 −𝜇𝑥 Donde B es un factor de build up el cual es adimensional y representa el incremento de la tasa de exposición debido a la dispersión, su valor no puede ser determinado teóricamente, por lo tanto, su valor se determina experimentalmente para cada material utilizado como blindaje, energía, espesor y geometría. 37.4 Blindaje para rayos X Los rayos X en sí mismos, no se diferencian en nada de los rayos gamma de igual energía; por tanto, su blindaje obedece a las mismas normas que se aplican a los emisores gamma de igual o semejante energía. No obstante, los rayos X son considerados más débiles que los gamma (menos energía y por tanto, menos frecuencia y más longitud de onda); en consecuencia, el blindaje para rayos X suele ser bastante más delgado, en materiales iguales empleados para rayos gamma. 37.5 Blindaje para neutrones Los mejores blindajes contra neutrones son los de materiales de núcleos ligeros, por dos razones; la primera, que por ser pequeña la masa de los núcleos, el choque elástico absorbe una buena proporción de la energía del neutrón incidente, por lo que se necesita menos choques y por tanto, menor espesor para termalizar los neutrones, ya que los neutrones térmicos, son menos peligrosos, a igualdad de flujo, que los de energías superiores. La segunda, que para la mayoría de los núcleos ligeros, las secciones eficaces de captura de neutrón son muy pequeñas, o bien el producto es estable, así que no hay activación del blindaje. Entre los blancos ligeros que cumplen especialmente las condiciones anteriores, se encuentran los núclidos de los elementos carbono, hidrógeno, oxígeno y silicio. Las sustancias corrientes que tienen composición rica de dichos blancos y que constituyen clásicos vendajes para neutrones son el agua ordinaria y el agua pesada (hidrógeno y oxígeno); la parafina y el aceite (hidrógeno y carbono) y el concreto (carbono, oxígeno, silicio y metales de poca activación). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA El agua tiene el peligro de escurrirse y, además, se evapora; este último efecto se disminuye si se superpone una película de aceite. La parafina y el aceite ofrecen el riesgo de incendio. Se concluye, pues, que los mejores blindajes para neutrones son los de concreto. Por eso se emplean en los reactores. Lección 38: Protección contra las radiaciones ionizantes 38.1 Precauciones contra fuentes externas Fuentes externas son aquellas que ejercen su acción desde el exterior del cuerpo humano; por ejemplo, las fuentes de telecobaltoterapia, las fuentes gammagráficas, los aparatos de rayos X. Existen una serie de procedimientos básicos que permiten alcanzar una protección razonable, basados en el tiempo mínimo de operación, distancia razonablemente máxima entre el operador y la fuente, blindaje adecuado entre el operador y la fuente y monitoreo de las áreas de trabajo. En el documento de referencia INGEOMINAS (2002), se expone muy claramente, el manejo de cada uno de éstos parámetros; por lo que se recomienda al estudiante revisar dicha referencia. La contaminación externa se puede producir cuando el material radiactivo presente en el aire (polvo, líquidos, aerosoles) se deposita sobre la piel o la ropa. Generalmente, este tipo de material radiactivo puede eliminarse del organismo por simple lavado. La exposición a la radiación ionizante también puede resultar de la irradiación externa (por ejemplo, la exposición médica a los rayos X). La irradiación externa se detiene cuando la fuente de radiación está blindada o la persona sale del campo de irradiación. 38.2 Fuentes encerradas y fuentes no encerradas Se llama fuente encerrada a toda fuente sólidamente revestida de material de suficiente resistencia mecánica para impedir el contacto con el cuerpo humano y la dispersión, en condiciones corrientes de utilización y desgaste. A una fuente que no se ajuste a esta definición, de denomina fuente no encerrada. 38.3 Precauciones contra las fuentes no encerradas Una fuente no encerrada, penetra en el organismo humano, por ingestión, inhalación, a través de una herida o absorción cutánea; siendo más frecuentes, los dos primeros. En principio, toda la fuente no encerrada, es una fuente externa; por tanto, se deben tener los cuidados que ya se han mencionado contra fuentes externas. Además, se debe evitar al máximo que la fuente no encerrada externa se convierta en una fuente externa. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Lección 39: Normas para el trabajo con fuentes RECOMENDACIONES INTERNACIONALES El desarrollo conceptual y filosófico de la Protección Radiológica ha sido desarrollado por la Comisión internacional de Protección Radiológica (ICRP) en su publicación No 60. El Organismo Internacional de Energía Atómica (OIEA), la Organización Mundial de la salud (WHO) la Organización Panamericana de la Salud (PAHO), la organización Internacional del Trabajo (ILO), la Organización para la Alimentación y la Agricultura de las Naciones Unidas (FAO) y la Agencia Nuclear de Energía (NEA) de la Organización para la Cooperación Económica y Desarrollo (OECD), han elaborado la publicación conjunta “Normas Básicas de Seguridad para la Protección contra las Radiaciones Ionizantes y el Uso Seguro de Fuentes de Radiación” (NBS) (Safety Series No 115). Este documento establece un puente entre las recomendaciones conceptuales de la ICRP y las funciones de los gobiernos relacionadas con la implementación de tales recomendaciones de manera efectiva. Dicha información se encuentra disponible en la web y debe ser consultada por el estudiante. A continuación se presentan algunas normas básicas planteadas por Guzmán (1989): Normas para evitar la ingestión de fuentes: a) Trabajar con blusa y guantes b) Abstenerse de comer, beber, fumar, o aplicarse cosméticos en las zonas donde se trabaje con fuentes no encerradas. c) Abstenerse de pipetear con la boca. d) Evitar el contacto de los guantes sobre la piel o los vestidos, excepto cuando se tenga la certeza de que no están contaminadas. e) Antes de quitarse los guantes, se deben lavar con agua y detergente y se deben someter a monitoreo con un intensímetro sensible; si se halla contaminación y resulta difícil eliminarla, los guantes se deben tratar como residuo radiactivo. f) No salir del laboratorio sin haberse sometido a cuidadoso monitoreo sobre la piel, las manos, los vestidos, los zapatos. Normas para evitar la inhalación de fuentes: a) Si hay oportunidad de elegir, se deben seleccionar fuentes liquidas evitando las pulverizadas. b) Al operar con fuentes pulverizadas, o con fuentes líquidas que vayan a sufrir elevación de temperatura, se debe utilizar una vitrina de succión. c) Si el buen criterio señala inmediato peligro de inhalación de radionúclidos, se debe emplear además, una máscara filtro. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Otras normas para el trabajo con fuentes: a) Cuando las fuentes no se encuentren en uso, se debe guardar en un depósito destinado exclusivamente a este fin, completamente protegido de cualquier alteración. b) Para cada fuente determinada, se debe trabajar con la mínima actividad compatible con la operación que se vaya a realizar. c) Si se tienen varias fuentes de largo período, como agujas de radio-226 y las dermoplacas de Sr-Y-90, se debe establecer y cumplir la norma del recuento a intervalos regulares, según una lista general que es preciso elaborar y actualizar; el sistema de una tarjeta para cada fuente, facilita el recuento, los ingresos, las bajas, los gastos parciales y las transferencias a otras personas; entre otras normas típicas de todo laboratorio. 39.1 Normas sobre descontaminación Como consecuencia de accidentes o explosiones nucleares puede producirse la irradiación y contaminación de personas. Con objeto de no actuar de improvisto es necesario tener previstas y planificadas una serie de actuaciones. En el caso de que las personas precisen primeros auxilios de reanimación o tratamiento de urgencia, estos primarán sobre las medidas de descontaminación. Es indispensable intentar conocer desde el primer momento cuales son los radionúclidos contaminantes, así, como sus formas físicas y químicas, ya que esto facilitara la actuación del personal sanitario. En el caso de contaminación externa, la conducta que se sigue está encaminada a eliminarla y evitar que se incorpore al organismo a través de las heridas, orificios naturales, o inhalación, en el caso de atmosferas contaminantes. Las medidas consisten en quitar la ropa, almacenándola en bolsas de plástico, duchado con agua tibia y jabón neutro, en el caso de que la contaminación sea difusa, o simple lavado de las zonas contaminadas, en el caso de que este se reduzca a áreas definidas. El lavado y enjuague se repiten las veces necesarias, controlando con un detector que la descontaminación sea lo más perfecta posible. En el caso de heridas y para evitar la incorporación de los agentes contaminantes a través de vasos linfáticos y sanguíneos, es conveniente la compresión de las venas próximas a las heridas y el lavado de las mismas con suero fisiológico, aplicando antisépticos y apósitos estériles. Las medidas de descontaminación interna son más complejas y están relacionadas con las características metabólicas y capacidad difusora del radioisótopo, sus características físicas (actividad, energía, período de semidesintegración), así como la vía de entrada y tropismo especial por determinados órganos. Por ejemplo, sabemos que el yodo radiactivo accede al tiroides, el cesio al músculo, el estroncio a huesos, etc. Las primeras medidas que se toman tienden a favorecer la eliminación de los radionúclidos, para lo que se hace tomar líquidos abundantes a la persona contaminada o laxantes suaves, UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA fluidificantes bronquiales, etc., así como medicamentos convenientes para intentar formar complejos químicos con los radionúclidos, o para bloquear su captación por los órganos críticos. Lección 40: Niveles tolerables de contaminación El nivel máximo permisible de contaminación en las personas, el equipo, los muebles y las superficies de los laboratorios es de 100 microrads por hora (278 pico gray/segundo, o, 1 microgray/hora) si se trata de radionúclidos de radiotoxicidad elevada; y de 1 milirad/hora (10 micro gray/ hora), para radionúclidos de moderada radiotoxicidad. 40.1 Accidentes con radionúclidos Durante los accidentes en plantas de energía nuclear puede liberarse material radiactivo al medio ambiente. Los radionúclidos más preocupantes para la salud humana son el yodo y el cesio. Durante la respuesta a esas emergencias es probable que se produzca exposición ocupacional, interna o externa, de los rescatadores, del personal de primeros auxilios y trabajadores de las centrales nucleares. Las dosis de radiación pueden ser suficientemente altas como para causar efectos agudos, tales como quemaduras en la piel o síndrome de irradiación aguda. Quienes viven muy cerca de centrales nucleares pueden sufrir exposición externa a los radionúclidos presentes en una nube radiactiva o depositados en el suelo. También se pueden contaminar externamente por partículas radiactivas depositadas en la piel o la ropa. También puede haber exposición interna si los radionúclidos se inhalan, ingieren o introducen en heridas abiertas. La población en general no es probable que se vea expuesta a dosis suficientemente altas para causar efectos agudos, pero sí a dosis bajas que podrían aumentar el riesgo de efectos a largo plazo, como el cáncer. El consumo de agua o alimentos contaminados contribuye a la exposición global a la radiación. Si se libera yodo radiactivo en el medio ambiente y penetra en el organismo por inhalación o ingestión, se concentrará en el tiroides aumentando el riesgo de cáncer de tiroides. El riesgo de cáncer de tiroides es mayor en los niños que en los adultos, en particular en los menores de 5 años y en aquellos cuyas dietas son generalmente carentes en yodo (OMS, 2012). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA CAPÍTULO 9: APLICACIONES Introducción De acuerdo con Cristallini (2011), entre las últimas aplicaciones radioquímicas, se encuentran; Radioquímica ambiental (radionucleidos usados como trazadores ambientales, usos en salvaguardias); aplicaciones analíticas (análisis por activación, dilución isotópica, titulaciones radiométricas, autor radiografía, separaciones de radionucleidos por cromatografía iónica de muestras de comida y ambientales, investigaciones de productos de degradación de pesticidad, etc.; aplicaciones de análisis clínicos (radioinmunoanálisis); aplicaciones biológicas (investigaciones metabólicas, distribución de fármacos en el organismo, etc.); aplicaciones en electrónica (estudios de electrodeposición y reacciones en los electrodos, etc.); aplicación en técnicas de datación de objetos antiguos y datación geológica; aplicaciones médicas, como por ejemplo la obtención de radioisótopos emisores de positrones de vida media corta (2-100 m) y la síntesis de compuestos marcados radiofármacos. También se aplicaron nuevas técnicas radioquímicas, como pueden ser: Nuevas técnicas de espectrometría alfa y gamma con detectores de elevada resolución y software para análisis de datos; nuevas técnicas separativas (cromatografía extractiva aniónica y catiónica, cromatografía líquida de alta presión, electromigración, etc.); nuevos esquemas de separación para diferentes tipos de matrices, biológicas, ambientales, etc.; nuevas técnicas separativas utilizadas en plantas radioquímicas (mezcladores-decantadores, contactores centrífugos, columnas pulsantes, etc.) en los procedimientos de extracción por solventes (butex, purex, etc.); entre otros tantos. A continuación se dedicará el presente capítulo a algunas de las aplicaciones más comunes, como lo es en alimentos, medio ambiente, farmacia y medicina, arqueología y geología, entre otros. Lección 41: Alimentos Según Iturbe (2001), la irradiación de alimentos es una de las pocas técnicas de alimentos que ha sido objeto de mucha evaluación científica, escrutinio público, entre otras. Se ha demostrado que la técnica puede ayudar a resolver los problemas del suministro de alimentos y su inocuidad, sin que ello conlleve algún riesgo para el medio ambiente o la salud humana. Todos los alimentos destinados al tratamiento por medios físicos (ya sea por pasteurización, enlatado, congelación, deshidratación o irradiación) deben ser de buena calidad y manipularse adecuadamente. En el proceso de irradiación de alimentos se puede utilizar la radiación gamma del 60Co o 137Cs; rayos X o electrones generados por una máquina a una energía UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA máxima de cinco y diez megavolts, respectivamente. La cantidad de energía absorbida por un alimento durante el proceso de irradiación normalmente se mide en unidades de Gray (Gy) o rad (1 Gy = 100 rads). Las autoridades internacionales de salud han garantizado la seguridad de las irradiaciones de todos los alimentos, con niveles de dosis de radiación de 10 KGy. Al igual que sucede con otros procesos a que se someten los alimentos (por ejemplo, el tratamiento por calor o la desecación), la irradiación produce en ellos cambios químicos. Los tipos de radiaciones con que se tratan los alimentos, tienen suficiente energía para provocar la expulsión de electrones al medio receptor, produciendo la ionización. Los iones y radicales libres que se forman originalmente cuando la radiación ionizante pasa por el alimento son inestables en la mayoría de los casos y pueden reaccionar entre sí o con los componentes del alimento y producir compuestos denominados “productos radiolíticos”. Lección 42: Medio ambiente Es de gran importancia el estudio de los radioisótopos presentes en el medio ambiente (contaminación radioactiva), tanto de los naturales como de los producidos artificialmente, ya que los niveles elevados de estos afectan tanto a la salud humana como al medio ambiente. Se denomina contaminación radiactiva o contaminación nuclear a la presencia no deseada de sustancias radiactivas en el entorno. Ésta contaminación puede proceder de radioisótopos naturales o artificiales. La primera de ellas se da cuando se trata de aquellos isótopos radiactivos que existen en la corteza terrestre desde la formación de la Tierra o de los que se generan continuamente en la atmósfera por la acción de los rayos cósmicos. Cuando estos radioisótopos naturales se encuentran en concentraciones más elevadas que las que pueden encontrarse en la naturaleza (dentro de la variabilidad existente), se puede hablar de contaminación radiactiva. Ejemplos de estos radioisótopos pueden ser el 235U, el 210Po, el radón, el 40K o el 7Be. En el segundo caso, el de los radioisótopos artificiales, son los radioisótopos que no existen de forma natural en la corteza terrestre, sino que se han generado en alguna actividad del hombre. En este caso la definición de contaminación es menos difusa que en el caso de los radioisótopos naturales, ya que su variabilidad es nula, y cualquier cantidad se podría considerar contaminación. Por ello se utilizan definiciones basadas en las capacidades técnicas de medida de estos radioisótopos, de posibles acciones de limpieza o de peligrosidad (hacia el hombre o la biota). Ejemplos de estos radioisótopos artificiales pueden ser el 239Pu, el 244Cm, el 241Am o el 60Co. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA Es común confundir la exposición externa a las radiaciones ionizantes (p.ej. en un examen radiológico), con la contaminación radiactiva. Es útil en este último caso pensar en términos de suciedad cuando se habla de contaminación. Como la suciedad, esta contaminación puede eliminarse o disminuirse mediante técnicas de limpieza o descontaminación, mientras que la exposición externa una vez recibida no puede disminuirse. Lección 43: farmacia y medicina La Radiofarmacia es una especialidad farmacéutica que estudia los aspectos farmacéuticos, químicos, bioquímicos, biológicos y físicos de los radiofármacos. La Radiofarmacia aplica dichos conocimientos en los procesos de diseño, producción, preparación, control de calidad y dispensación de los radiofármacos, tanto en su vertiente asistencial – diagnóstica y terapéutica – como en investigación. Se responsabiliza del buen uso de los radiofármacos a través de la adecuada selección, custodia y gestión de los mismos, en aras de conseguir una óptima utilización con calidad, segura y costo-efectiva, de acuerdo con las exigencias de la buena práctica radiofarmacéutica. Un radiofármaco es un producto usado con finalidad terapéutica o radiodiagnóstica. El radiofármaco está formado por un reactivo inerte el cual se une con un isótopo radiactivo, a este proceso se le denomina radiomarcaje y se realiza en la radiofarmacia día a día según las necesidades de cada paciente. Los radiofármacos en el ámbito hospitalario pueden ser administrados por vía oral o intravenosa, y son útiles tanto para aplicaciones diagnósticas y terapéuticas. Los estudios diagnósticos incluyen realizada de forma rutinaria los procedimientos clínicos como la gammagrafía ósea, las exploraciones de los riñones, las exploraciones de tiroides, PET, etc. En más del 90% de los casos, los compuestos radiactivos se utilizan con fines de diagnóstico. Un ejemplo para el uso terapéutico de un radiofármaco que incluyen el tratamiento de un bocio hiperactividad de la glándula tiroides mediante la administración de yodo radiactivo. En este caso, la radiación se administra como dosis adecuada, proporciona el beneficio terapéutico esperado. Un radiofármaco contiene al menos dos componentes principales: 1. un radionúclido que produce las características de radiación deseada 2. un compuesto químico con propiedades estructurales o químico que determina la distribución dentro el cuerpo y el comportamiento fisiológico del radiofármaco Las impurezas pueden alterar la biodistribución de los radiofármacos, dando resultados de imágenes distorsionadas de centellografía. Como una secuencia UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA que puede ser grandes fracasos terapéuticos o de diagnóstico utilizando el agente de radiofármaco. El control adecuado de la calidad debe detectar tanto pureza radioquímica, así como la estabilidad del compuesto de la envolvente. En la medicina, la Radioterapia utiliza las radiaciones ionizantes con fines terapéuticos. Se basa en administrar dosis altas de radiación a los tumores cancerosos, destruyéndolos o dañándolos de tal manera que no puedan crecer, propagarse o multiplicarse. El Radiodiagnóstico tiene como fin el diagnóstico de las enfermedades, utilizando imágenes y datos obtenidos por medio de radiaciones ionizantes o no ionizantes. Lección 44: Arqueología En arqueología y geología, se utiliza como complemento a las investigaciones. Puesto que en los restos que se encuentran a lo largo del mundo, poseen ciertas dosis de componentes radioactivos. El estudio de dichos componentes, permite determinar la edad, la región y hasta las razones de su muerte (En el último caso, tratándose de seres vivos). Particularmente en Geología se puede averiguar la edad de las rocas a través del estudio de algunos radioisótopos (potasio40 O uranio-235, por ejemplo). Lección 45: Otros Los científicos usan la radiación gama del Co-60 u otras fuentes en la investigación agrícola para desarrollar granos resistentes a las enfermedades, o altamente productivos. Las semillas se exponen a la radiación gama para inducir mutaciones. Las plantas más saludables y vigorosas que crecen de semillas irradiadas, se seleccionan y se propagan para obtener variedades nuevas y mejoradas para uso comercial. Como ya se mencionó, la preservación de alimentos mediante radiación es otra aplicación benéfica. El alimento se expone a radiación gama o un haz de partículas beta suministradas respectivamente por Co 60 o Cs 137. Se destruyen los microorganismos que pudieran causar deterioro del alimento, pero sólo se eleva ligeramente la temperatura de éste. El alimento no se vuelve radiactivo como resultado de este proceso, pero aumenta notablemente su duración en almacén. Las técnicas nucleares también se han utilizado para el control de plagas, tal como ocurrió en sus inicios con el control de la mosca de la fruta, o como ocurre en la actualidad con la irradiación de gusanos de tebo, lo que asegura su exportación hacia los mercados del primer mundo. Sin embargo, en algunos países no se ha utilizado la energía nuclear para la producción de energía eléctrica, la desalinización del agua de mar o para la UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA generación de calor industrial y domiciliario. Estas aplicaciones requieren que cada país cuente con reactores nucleares de potencia. Un reactor nuclear de potencia utiliza el calor generado por la reacción nuclear en cadena, para calentar grandes masas de agua, lo que a su vez puede generar vapor a gran presión y utilizar este vapor para generar movimiento en turbinas productoras de electricidad. En algunos países, el calor también es usado como medio de calefacción, siendo distribuido a los hogares que lo demandan, o bien distribuido a las industrias que lo utilizan en sus procesos productivos. Otra aplicación de gran interés es el uso de los reactores nucleares de potencia para la desalinización del agua de mar, lo que permite distribuir agua de gran calidad a zonas pobladas o para el uso en la agricultura en zonas desérticas. Energía Nuclear Casi toda la electricidad para uso comercial es producida por máquinas que consisten en una turbina que mueve un generador eléctrico mediante un eje. La energía necesaria para hacer girar a la turbina puede suministrarla una caída de agua, como en las plantas hidráulicas, o el vapor de agua generado en una caldera mediante el calor de un combustible, como en las plantas térmicas. Estas centrales generadoras queman combustibles fósiles, como son el carbón, el petróleo o el gas natural. La demanda mundial de energía, principalmente a partir de combustibles fósiles, ha continuado creciendo a una velocidad acelerada durante unos 250 años. Aún a las tasas actuales de consumo, la reserva mundial estimada de combustibles fósiles, es suficiente sólo para unos pocos siglos. Aunque Estados Unidos posee grandes depósitos de carbón y de esquistos petrolíferos, importa hoy aproximadamente 40% de sus necesidades de petróleo. Es obvio que necesitan desarrollarse fuentes alternas de energía. Hoy el uranio constituye la alternativa más productiva y aproximadamente 12% de la energía eléctrica que se consume en Estados Unidos es generada en plantas térmicas que operan con una reacción nuclear a base de uranio, como “combustible”. Una central nuclear es una planta térmica en la que el calor lo produce el reactor de fisión en vez de una cámara de combustión. Los principales componentes de un reactor nuclear son (1) una disposición de material reactivo fisionable, que constituye el núcleo del reactor, (2) un sistema de control, que regula la velocidad de fisión y por lo mismo la tasa de generación de calor y (3) un sistema de enfriamiento, que elimina el calor del reactor y también mantiene el núcleo a la temperatura adecuada. Un cierto tipo de reactor emplea pastillas metálicas que contienen uranio enriquecido con U 235, desde un nivel normal de 0.7 %, hasta aproximadamente 3 %. Se modera, o controla, la reacción autosostenida de fisión, mediante las barras o varillas de control de posición regulable. Estos elementos contienen sustancias que refrenan y capturan algo de los neutrones que se UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA producen. Para enfriar se usan agua ordinaria, agua pesada, sodio fundido y otros. La energía obtenida de la reacción nuclear es en forma de calor, y se usa en la producción de vapor para impulsar las turbinas que impulsan a los generadores de electricidad. Dos eventos que demostraron los peligros potenciales de la energía nuclear fueron los accidentes en la isla Three Mile, en Pennsylvania, EUA (1979) y Chernobyl, URSS (1986). Ambos accidentes fueron originados por la pérdida de refrigerante en el núcleo del reactor. Los reactores en la isla Three Mile están envueltos por cascarones de concreto y por lo tanto dejaron escapar una cantidad relativamente pequeña de material radiactivo a la atmósfera. Como en la Unión Soviética no se usan estructuras de contención para las plantas nucleares, el accidente de Chernobyl ocasionó 31 muertes y la renunciación de 135000 pobladores. La descarga de grandes cantidades de Y 131, Cs 134 y Cs 137, podrían originar problemas de salud a largo plazo en esa población, que ya estuvo expuesta. Otra desventaja principal de las plantas nucleares es que producen desechos altamente radiactivos, algunos de los cuales tienen semividas de miles de años. Hasta ahora, no se ha logrado un acuerdo acerca de cómo disponer con seguridad de tales productos radiactivos. En Estados Unidos los reactores diseñados para la producción comercial de electricidad usan óxido de uranio, U3O8 , enriquecido con el isótopo fisionable U235, relativamente escaso. Como es limitado el suministro de U 235, se ha desarrollado un tipo nuevo de reactor, llamado reactor de cría. Estos reactores están diseñados para producir más material fisionable a la vez que se lleva a cabo la reacción. En un reactor de cría, los neutrones convierten a isótopos no fisionables, como el U 238 o el Th 232, en isótopos fisionables Pu 239 o U 233. Estas transmutaciones hacen posible aumentar en gran medida el suministro de reactivo fisionable, para los reactores nucleares. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA ACTIVIDADES DE AUTOEVALUACIÓN DE LA UNIDAD 3 1. Cuáles son los mecanismos, mediante los cuales las radiaciones causan daños biológicos? En qué consiste el mecanismo por formación de iones, radicales libres y peróxidos? 2. Elabora un cuadro como el siguiente, en el cual se evidencien algunos de los síntomas de irradiaciones agudas en todo el cuerpo: DOSIS 100 rem (1 Sv) Síntomas Efectos Náusea y fatiga con posibles vómitos. Cambios marcados en la sangre. Acortamiento de la vida probable n dosis… 3. En qué consisten la dosis media letal y la dosis máxima permisible DMP? Cuál es el órgano más crítico del ser humano? 4. De qué manera afecta a un individuo y a la especie en general, las irradiaciones? De qué dependen dichos efectos? 5. Consulta sobre los últimos instrumentos utilizados para medir la radiación, elabore un cuadro que incluya nombre, imagen del instrumento y fundamento. 6. Complementa el siguiente cuadro: Tipo de radiación Alfa (α) Requiere blindaje si no X Tipo de blindaje requerido Bastan una o dos hojas de papel para frenarla por completo, o simplemente con unos pocos centímetros de aire. ………… 7. Describa cada uno de los siguientes variables en las que se basan los procedimientos básicos que permiten alcanzar una protección razonable: tiempo mínimo de operación, distancia razonablemente máxima entre el operador y la fuente, blindaje adecuado entre el operador y la fuente y UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA monitoreo de las áreas de trabajo. Para ello debe consultar otras fuentes; se recomienda el documento de INGEOMINAS (2002). 8. Consulte sobre las normas existentes en Colombia y a nivel internacional, para el trabajo con fuentes radiactivas. 9. Complete el siguiente cuadro, en el cual se deben describir por lo menos las seis principales aplicaciones de la radioquímica: Campo de aplicación Ventajas Desventajas FUENTES DOCUMENTALES DE LA UNIDAD 3 Adloff, J-P. (1997). Introducción a la radioquímica, Instituto de Ciencias Nucleares y Energías Alternativas, Bogotá, Colombia. Cohen, I.M.; Furnari J.C., (2012). Las Tendencias Modernas de la Radioquímica y sus Aplicaciones. Revista Química viva, Número 2, Buenos Aires Argentina. Disponible en: http://www.cchen.cl/index.php?option=com_content&view=category&id=298&Itemi d=101 Cristallini O. (2011). Una mirada a la expansión de las áreas de la Radioquímica. Instituto de Energía y Desarrollo Sustentable Comisión Nacional de Energía Atómica. Consultado junio 8 de 2013, en: http://www.cab.cnea.gov.ar/ieds/images/extras/hojitas_conocimiento/ciencia/pag_4 3-44_cristallini_expans_ar_radioq.pdf Facultad de ingeniería UBA (2013). Radiaciones ionizantes en el contexto de la seguridad e higiene en el trabajo. Consultado junio 1 de 2013, en: http://www.ingenieria.uba.ar/archivos/posgrados_apuntes_RadiacionesIonizantes. Guzmán, M.E., (1989). Nucleónica Básica. Instituto de Asuntos Nucleares, Bogotá, Colombia. Historia de la protección radiológica. http://www.youtube.com/watch?feature=player_embedded&v=CLdWacpzXN8 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA INSHT (2013). Radiaciones ionizantes: normas de protección. Consultado mayo 1 de 2013, en: http://www.insht.es/InshtWeb/Contenidos/Documentacion/FichasTecnicas/NTP/Fic heros/301a400/ntp_304.pdf Iturbe J. L., (2001). FUNDAMENTOS DE LA RADIOQUIMICA, Universidad Autónoma del Estado de México Toluca. Monografias.com (2013).Energía nuclear. Consultado mayo 15 de 2013, en: http://www.monografias.com/trabajos/enuclear/enuclear.shtml OEI (2013). Radiactividad. Organización de Estados Iberoamericanos. Consultado junio 2 de 2013, en: http://www.oei.org.co/fpciencia/art19.htm OMS (2012). Radiaciones ionizantes: efectos en la salud y medidas de protección. Consultado junio 8 de 2013, en: http://www.who.int/mediacentre/factsheets/fs371/es/ UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA RESPUESTAS AUTOEVALUACIONES DE CADA UNIDAD RESPUESTAS - AUTOEVALUACIÓN (UNIDAD 1) 1. a) Las tres, b) protón y electrón, c) protón y electrón, d) Ninguna, e) protón y neutrón, f) protón y neutrón. 2. Revisa la lección 3. 3. Revisa la lección 4 4. Para 60Co, # de neutrones = A – Z = 60 – 27 = 33; para 14C, 6 neutrones; 26Mg, tiene 14 neutrones; 27Al, 14 neutrones; 38Ar, 20 neutrones. 18 5. Revisa la lección 5 6. El tecnecio (Z = 43), el promecio (Z = 61) y los transuránicos (Z mayor que 92). 7. Revisa la lección 12 8. Revisa las lecciones 12 y 13 9. a) 74 µCi b) 7,4 x 10-5 Ci c) 2,7 x 106 Bq d) 2,7 MBq e) 2,7 x 6 9 10 desint/seg. f) 9,9 x 10 desint/hora g) 1,64 x 108 desint/min. 10. Revisa la lección 14 11. Exprese la concentración radiactiva 5,82 mCi/mL, en: a) 5,82 x 103 µCi/mL b) 5,82 Ci/L 3 d) 5,82 x 10 mCi/L e) 0,22 GBq/cm3 10 g) 1,29 x 10 desint/min.cm3 c) 5,82 x 103 µCi/cm3 f) 2,2 x 10-4 TBq/cm3 12. Consulte la lección 15 y complemente consultando otras fuentes. 13. Si Z es el número de protones de un radionúclido y A su número de nucleones; cuáles serían los nuevos valores de Z y A que tendría el núclido hijo en cada uno de los siguientes casos: a) Z-1; A b) Z-2; A-4 c) Z, A-1 d) Z-1; A-1 e) Z; A f) Z-1; A g) Z; A h) Z + 1; A RESPUESTAS - AUTOEVALUACIÓN (UNIDAD 2) 1. 25 mCi UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA 2. 45 días 3. 20 años 4. a) 9 mg/cm2 b) 7 cm en aire a presión y temperatura normales c) Penetraría 33 micrómetros en aluminio 5. 0,1 mm; 100 µm 6. a) 15,8 mR b) 15,8 mrd = 1,58 x 10-4 Gy c) 15,8 mrem = 1,58 x 10-4 Sv. 7. 23 segundos. 8. Como se indicó en el Apoyo, el producto corresponde a Na-24. 9. a) año 3543 antes de Cristo, b) el error sería de 101 años 10. El producto de fisión más ligero es el Y-100, emisor β- de T = 0,5 segundos, que pasa a Zr-100, luego a Nb-100 y finalmente, a Mo-100 estable. RESPUESTAS - AUTOEVALUACIÓN (UNIDAD 3) 1. 2. 3. 4. 5. 6. 7. Revisa la lección 31. Organiza en el cuadro propuesto, la información de la lección 32.1 Revisa la lección 33 Revisa la lección 34 Complementa la información de la lección 36 con otras fuentes. Utiliza la información de la lección 37. Consultar en el documento: INGEOMINAS (2002). Curso de protección radiológica para el manejo de material radiactivo, en: http://www.ingeominas.gov.co/getattachment/Nucleares/Otrasactividades/memorias-Curso-P-R-.pdf.aspx 8. Complemente con otras fuentes la información suministrada en las lecciones 39 y 40. 9. Complemente con otras fuentes la información suministrada en el capítulo 9. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA FUENTES DOCUMENTALES Adloff, J-P. (1997). Introducción a la radioquímica, Instituto de Ciencias Nucleares y Energías Alternativas, Bogotá, Colombia. Biblioteca digital (2013). Cambios nucleares y sus aplicaciones. Consultado abril 10 de 2013, en: http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/097/htm/sec_7.h tm Biblioteca digital (2013b). Interacción de la radiación y la materia. Consultado abril 30 de 2013, en: http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/094/htm/sec_6.h tm Cohen, I.M.; Furnari J.C., (2012). Las Tendencias Modernas de la Radioquímica y sus Aplicaciones. Revista Química viva, Número 2, Buenos Aires Argentina. Disponible en: http://www.cchen.cl/index.php?option=com_content&view=category&id=298&Itemi d=101 Cristallini O. (2011). Una mirada a la expansión de las áreas de la Radioquímica. Instituto de Energía y Desarrollo Sustentable Comisión Nacional de Energía Atómica. Consultado junio 8 de 2013, en: http://www.cab.cnea.gov.ar/ieds/images/extras/hojitas_conocimiento/ciencia/pag_4 3-44_cristallini_expans_ar_radioq.pdf Educar Chile (2013). Fenómenos nucleares y sus aplicaciones. Consultado abril 13 de 2013, en: http://www.educarchile.cl/psu/estudiantes/Contenidos.aspx?sector=4&nivel=4&eje _tem_sem=124 Facultad de ingeniería UBA (2013). Radiaciones ionizantes en el contexto de la seguridad e higiene en el trabajo. Consultado junio 1 de 2013, en: http://www.ingenieria.uba.ar/archivos/posgrados_apuntes_RadiacionesIonizantes. Foro Nuclear (2013). ¿Qué es la radiactividad?. Consultado abril 15 de 2013, en: http://www.foronuclear.org/consultas-es/consultas-al-experto/que-es-laradiactividad Guzmán, M.E., (1989). Nucleónica Básica. Instituto de Asuntos Nucleares, Bogotá, Colombia. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA PROTOCOLO ACADEMICO DEL CURSO: 401541-RADIOQUÍMICA INGEOMINAS (2002). Curso de protección radiológica para el manejo de material radiactivo, Consultado abril 24 de 2013, en: http://www.ingeominas.gov.co/getattachment/Nucleares/Otrasactividades/memorias-Curso-P-R-.pdf.aspx INSHT (2013). Radiaciones ionizantes: normas de protección. Consultado mayo 1 de 2013, en: http://www.insht.es/InshtWeb/Contenidos/Documentacion/FichasTecnicas/NTP/Fic heros/301a400/ntp_304.pdf Iturbe J. L., (2001). FUNDAMENTOS DE LA RADIOQUIMICA, Universidad Autónoma del Estado de México Toluca. Monografias.com (2013).Energía nuclear. Consultado mayo 15 de 2013, en: http://www.monografias.com/trabajos/enuclear/enuclear.shtml OEI (2013). Radiactividad. Organización de Estados Iberoamericanos. Consultado junio 2 de 2013, en: http://www.oei.org.co/fpciencia/art19.htm OMS (2012). Radiaciones ionizantes: efectos en la salud y medidas de protección. Consultado junio 8 de 2013, en: http://www.who.int/mediacentre/factsheets/fs371/es/ Recursostic (2013). Radiactividad. Consultado mayo 16 de 2013, en: http://recursostic.educacion.es/newton/web/materiales_didacticos/radiactividad/aul aradiactividad.pdf Wikipedia (2013). Estructura nuclear. Consultado abril 11 de 2013, en: http://es.wikipedia.org/wiki/Estructura_nuclear Video. Historia de la protección radiológica. Consultado junio 1 de 2013, en: http://www.youtube.com/watch?feature=player_embedded&v=CLdWacpzXN8