química orgánica general
Anuncio

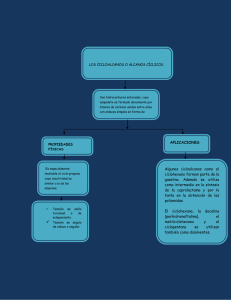
UNIVERSIDAD DEL VALLE VICERRECTORIA ACADÉMICA DIRECCIÓN DE EDUCACIÓN DESESCOLARIZADA CURSO DE QUÍMICA ORGÁNICA GENERAL AUTORA: LUZ MARINA JARAMILLO PhD Profesora Titular Facultad de Ciencias - Departamento de Química Santiago de Cali, 2001 Luz Marina Jaramillo Ph. D. Depto de Química ALCANOS Y CICLOALCANOS Objetivos Específicos Introducción Contenido 3.1 PROPIEDADES FÍSICAS DE LOS ALCANOS ........................................................................................... 110 3.2 PROPIEDADES FÍSICAS DE LOS CICLOALCANOS ..................................................................................112 3.3 FUENTE NATURAL DE HIDROCARBUROS ALIFÁTICOS .......................................................................... 113 3.4 ANÁLISIS CONFORMACIONAL DE LOS ALCANOS ..................................................................................115 3.4.1 Reacciones de Halogenación de Alcanos: Sustitución por Radicales Libres ......................119 3.4.2 Mecanismo de Halogenación: Concepto de Mecanismo de Reacción ................................121 3.4.3 Radicales alquilo como especies intermediarias..................................................................127 3.4.4 Halogenación de Alcanos superiores ...................................................................................131 3.4.5 Combustión ...........................................................................................................................133 3.5 CICLOALCANOS .............................................................................................................................. 135 3.5.1 Isomería cis-trans en Cicloalcanos Disustituidos .................................................................755 3.5.2 Estructuras: Tensiones y Calores de Combustión................................................................137 3.5.3 Conformaciones del Ciclohexano.. .......................................................................................139 3.5.4 Reacciones de los Cicloalcanos ...........................................................................................145 Luz Marina Jaramillo Ph. D. Depto de Química 109 Objetivos Específicos Al finalizar el estudio de este material el estudiante estará en capacidad de: • Describir las fuentes naturales de los aléanos y cicloalcanos. • Con base en un análisis de las estructuras moleculares, predecir las tendencias en los puntos de ebullición, de fusión y solubilidad. • Explicar con criterios mecanísticos las reacciones de halogenación por radicales libres. • Describir la naturaleza y comportamiento de las especies intermediarias conocidas como radicales libres. • Representar con proyecciones "silla de caballo" y/o Newman las conformaciones mas estables y mas inestables del etano, propano, n-butano, etc. • Dibujar las conformaciones "silla" del ciclohexano. • Nombrar correctamente un derivado del ciclohexano usando los prefijos cis y trans, conociendo su estructura espacial en conformación silla. • Completar una ecuación, escribiendo el (los) producto(s) principal(es) a partir de la estructura de un alcano o cicloalcano, reactivos y condiciones experimentales, Introducción En este capítulo se inicia el estudio sistemático de las familias de compuestos orgánicos con los Aléanos y Cicloalcanos de los cuales se interpreta su comportamiento físico como una consecuencia de su estructura y se describen las fuentes naturales que producen muchos de ellos. Posteriormente se familiariza al estudiante con el significado del análisis conformacional o carácter dinámico de las estructuras moleculares para continuar con el estudio de la reactividad química de estos hidrocarburos, introduciendo el concepto fundamental del mecanismo de reacción a través de la halogenación de aléanos, una clase de reacción de la mas general: sustitución por radicales libres. Luz Marina Jaramillo Ph. D. Depto de Química 110 3.1 Propiedades físicas de los Aléanos El estado físico de todos los hidrocarburos alifáticos en general, está relacionado íntimamente con su peso molecular. Los compuestos de peso molecular bajo son gases y líquidos, mientras que los de peso molecular elevado son sólidos. Los puntos de ebullición y de fusión son bajos para los miembros inferiores de las tres familias (alcanos, alquenos y alquinos), es así que son gases hasta C-4; líquidos de C-5 a C-17 y desde C-18 en adelante son sólidos. Por otro lado, los puntos de ebullición aumentan en una razón aproximadamente constante de 20-3 0°C por cada -CH2- adicional en la serie homologa (Tabla 3.1). Tabla 3.1 Propiedades Físicas de algunos Alcanos. d 20oC (g/ml) Nombre IUPAC p.f. (° C) pe. (°C) Metano -182 -164 - Etano -172 -88.5 - Propano -187 -42 - n-Butano -138 0 - 2-Metilpropano -159 -12 - n-Pentano -130 36 0.626 2,2-Dimetilpropano -17 10 0.614 n-Hexano -95 69 0.659 3-Metilpentano -118 63 0.676 2-Metilpentano -153 60 0.653 2,2-Dimetilbutano -100 50 0.649 2,3 -Dimetilbutano -129 58 0.668 n-Heptano -90.5 98 0.684 n-Octano -57 126 0.703 Luz Marina Jaramillo Ph. D. Depto de Química 111 Las moléculas de los hidrocarburos alifáticos saturados no poseen momentos dipolares permanentes, solo presentan atracciones tipo London. En consecuencia sus puntos de fusión y ebullición varían principalmente con el peso molecular. Pero cuando se trata de cadenas hidrocarbonadas ramificadas, los puntos de ebullición bajan, porque reducen el contacto efectivo intermolecular, impidiendo la distorsión de las nubes electrónicas y la formación de dipolos momentáneos. Los isómeros ramificados de los hidrocarburos alifáticos tienen puntos de ebullición mas bajos que el hidrocarburo lineal del mismo peso molecular. En estos hidrocarburos parece haber debilitamiento de las fuerzas intermoleculares. La estructura global de las moléculas muy ramificadas es prácticamente esférica. Ejemplos: n En general los alcanos son compuestos de baja polaridad, insolubles en agua y en solventes altamente polares. En este caso la regla empírica "lo semejante disuelve lo semejante" se aplica bien a ellos. Estos compuestos son solubles en solventes orgánicos no-polares como ciclohexano o benceno que son también hidrocarburos y en solventes ligeramente polares como éter etílico, acetato de etilo, etc. Pueden usarse para disolver otros compuestos de baja polaridad. La razón de la baja polaridad se debe a los enlaces covalentes entre átomos iguales como C-C o entre átomos cuyas electronegatividades difieren muy poco como C-H. Además los enlaces están dirigidos de manera que las polaridades débiles que puedan existir se cancelen originando moléculas no-polares. Por último, todos los aléanos son menos densos que el agua. Ejercicio 3.1. Sin mirar las tablas cuál de cada uno de los siguientes pares de isómeros estructurales esperaría que tuviera el punto de ebullición mas alto: Explique. Luz Marina Jaramillo Ph. D. Depto de Química 112 a) hexano ó 2,2-dimetilbutano? b) 1-pentanol ó 2,2-dimetil-1-propanol? 3.2 Propiedades físicas de los Cicloalcanos Las tendencias en las propiedades físicas en los hidrocarburos cíclicos guardan gran similitud con aquellas de los hidrocarburos de cadena abierta. Son compuestos poco polares, insolubles en agua. Varios de ellos se emplean como solventes como son el ciclopentano, ciclohexano, metilciclohexano, cicloheptano, etc. Se conocen anillos hasta de 10 y 12 carbonos pero los mas comunes son hasta de 8 carbonos. Sus puntos de ebullición también varían gradualmente en 30 °C por cada -CH2-adicional (Tabla 3.2). Compare los puntos de ebullición de los alcanos con aquellos de los cicloalcanos y observe que los puntos de ebullición, de fusión y densidades son mayores para los cicloalcanos, Por ejemplo n-pentano (p.f. -130 °C; p.e. 36 °C) versus ciclopentano (p.f. -94 °C; p.e. 49 °C). Tabla 3.2 Propiedades físicas de algunos Cicloalcanos Nombre IUPAC p.f. (°C) Ciclopropano Ciclobutano -127 p.e. (°C) d 20oC (g/ml) -80 -33 13 0.688 0.704 Ciclopentano -94 49 0.746 Ciclohexano 6.4 81 0.788 Cicloheptano -12 117 0.810 Ciclooctano 14 147 0.830 Metilciclopentano -142 72 0.749 Metilciclohexano -126 100 0.769 Luz Marina Jaramillo Ph. D. Depto de Química 113 3.3 Fuente Natural de Hidrocarburos Alifáticos A) Gas Natural y Petróleo. La fuente principal de hidrocarburos es el petróleo en conjunto con el gas natural que lo acompaña. El gas natural con un contenido de 60 a 90 % de metano, según su origen se ha formado por la descomposición anaeróbica (descomposición en ausencia de aire) de las plantas y animales. Los otros componentes del gas natural son el etano y el propano junto con nitrógeno y dióxido de carbono. Los depósitos de gas natural se hallan normalmente asociados a los yacimientos petrolíferos. El petróleo por su parte se ha formado también por la descomposición (durante millones de años) de plantas y animales probablemente de origen marino. El petróleo crudo llamado también aceite crudo, es una mezcla compleja de compuestos alifáticos y aromáticos, incluyendo compuestos con azufre y nitrógeno (1-6 %). En efecto, se han detectado en una muestra simple de petróleo hasta 500 compuestos. Pero la composición varía según el depósito. El aceite crudo por si mismo no es muy útil sin embargo puede descomponerse o separarse en fracciones útiles por destilación fraccionada que es la primera etapa en el proceso conocido como refinación del petróleo. Debido a la relación entre punto de ebullición y peso molecular, la destilación fraccionada constituye una separación preliminar de acuerdo con el número de carbonos. A pesar de la separación, cada fracción es una mezcla compleja de alcanos con un rango de átomos de carbono, sumándose los isómeros que son compuestos con el mismo número de carbonos. La Tabla 3.3 alista tales fracciones por el número de carbonos y rango en el punto de ebullición durante la destilación. En ella también se incluye el principal uso de cada fracción. La fracción de gasolina es demasiado escasa para las necesidades de una sociedad orientada hacia el uso de automóviles, además es de pobre calidad. Para aumentar la producción y mejorar la calidad, las fracciones de punto de ebullición alto se someten a procesos de rompimiento catalítico ("cracking"), isomerización catalítica y reformación catalítica. Luz Marina Jaramillo Ph. D. Depto de Química 114 El proceso de "cracking" desarrollado en los años 30, convierte alcanos superiores en alcanos de cadena mas corta y en alquenos, aumentando el rendimiento de la gasolina. Los alquenos formados por este procedimiento, son quizás las materias primas mas importantes para la síntesis de sustancias alifáticas en gran escala. Tabla 3.3 Fracciones de Petróleo Nombre Fracción Rango p.e. (°C) No. de Carbonos Uso Gas bajo 20 C1-C4 Calefacción Éter de Petróleo 20-60 C5-C6 Solvente Ligroina 60-100 C6-C7 Solvente Gasolina Natural 40-205 C5-C10 cíclicos Automóviles Queroseno 175-230 C11-C12 Aviones Gasóleo 230-305 C13-C17 Diesel Aceite lubricante 305-405 C18-C25 Lubricantes Asfalto Sólidos no volátiles Policíclicos Impermeabilizar La isomerización catalítica transforma aléanos de cadena recta en ramificados, esto aumenta el octanaje o índice de octano (índice que expresa el poder antidetonante de un carburante). Entre mas ramificados son los hidrocarburos que componen una muestra de gasolina, mayor es su índice de octano. El alcano ramificado con las mejores características antidetonantes es el conocido "isooctano" (2,2,4-trimetilpentano) al cual se le asignó un índice de octano de 100. El proceso de reformación catalítica convierte aléanos y cicloalcanos de fracciones superiores en hidrocarburos aromáticos los cuales también aumentan el octanaje de la gasolina y proporcionan materias primas para la síntesis en gran escala de otra gama de compuestos. B) Carbón. La segunda fuente importante de hidrocarburos es el Carbón el cual se ha formado por la descomposición bacteriana de plantas bajo ciertos grados de presión. El carbón se clasifica por su contenido de carbono en: Luz Marina Jaramillo Ph. D. Depto de Química 115 Antracita (o carbón duro) el cual constituye el mas alto contenido de carbono. Carbón bituminoso (carbón blando), Lignito y finalmente la Turba, carbón ligero y esponjoso de formación reciente y bajo contenido calórico. El proceso conocido como "destilación destructiva" se refiere al calentamiento y destilación en ausencia de aire del carbón. En este proceso resultan tres productos crudos: Gas de carbón, formado por CH4, y H2. Alquitrán de hulla, destilado condensable. Coque, residuo rico en carbono (aproximadamente 97%) Durante la Primera y Segunda Guerra Mundial los alemanes desarrollaron procesos para obtener combustibles líquidos de carbón. Con las crisis petrolífera contemporánea se han retomado tales procesos para mejorarlos y obtener a un costo menor el máximo de combustibles líquidos de carbón. 3.4 Análisis Conformational de los Aléanos Ya se estudió con cierto detalle la estructura del etano y diferentes representaciones de esta molécula en el papel (Sec. 1.11.1). También se mencionó que los átomos o grupos unidos por enlaces δ, pueden rotar libremente, alrededor de estos enlaces. Esta propiedad da origen a una infinidad de ordenamientos atómicos (número ilimitado de orientaciones espaciales) en la misma molécula, llamadas conformaciones o confórmeros. Para el etano es posible identificar dos de estos extremos conformacionales : a) Uno en el cual todos los átomos de hidrógeno están paralelos entre sí de tal manera que aquellos de un carbono tapan o eclipsan a los del otro. Este ordenamiento corresponde a la llamada conformación eclipsada, b) El otro extremo conformacional o conformación es uno donde los hidrógenos están completamente alternados o escalonados y resulta la conformación alternada. Para visualizar tales orientaciones espaciales en el papel usamos entre otras representaciones las llamadas estructuras "silla de caballo" o las "proyecciones Newman" (Figura 3.1). Estas últimas son especialmente útiles para mostrar estructuras en moléculas simples. El carbono del frente (C-1) en la estructura silla de caballo, se representa por un círculo en la proyección Newman. Los hidrógenos sobre este carbono se desprenden desde el centro del círculo con ángulos de 120° entre sí. Luz Marina Jaramillo Ph. D. Depto de Química 116 Los hidrógenos sobre el carbono de atrás se desprenden desde el perímetro del círculo también a ángulos de 120° . Usted no puede ver el carbono de atrás en las proyecciones Newman. En el caso de la conformación eclipsada se muestran los hidrógenos del carbono de atrás (C-2) pero en realidad son tapados por los de adelante. Para llegar a la conformación alternada ha sido necesario un giro de 60°. El ángulo entre dos hidrógenos vecinos de los carbonos C-l y C-2 es de 60°. Proyecciones "Silla de Caballo" Proyecciones "Newman" Conformación ECLIPSADA Conformación ESCALONADA Figura 3.1 Métodos para visualizar las dos conformaciones del Etano Eclipsada y Escalonada. En realidad la rotación alrededor del enlace δ no es enteramente libre. La conformación eclipsada de etano es ≈ 3 kcal/mol (12.6 kJ/mol) menos estable (o de energía más alta) que la conformación alternada, debido a que hay mayores repulsiones entre los electrones de los enlaces C-H. Esto significa que es necesario vencer una barrera de energía de rotación de 3 kcal/mol para pasar de la conformación alternada a la eclipsada. Esta diferencia de energía es la energía torsional la cual es disponible a temperatura ambiente y por tanto la rotación puede ocurrir. En el equilibrio de interconversión de las dos Luz Marina Jaramillo Ph. D. Depto de Química 117 conformaciones hay un mayor porcentaje de moléculas en la conformación alternada que es la mas estable. Cualquier conformación que se desvíe del ordenamiento escalonado o alternado de los átomos o grupos sobre un par de carbonos cruzados C-C, exhibe tensión torsional. El próximo miembro de la familia es el propano (CH3CH2CH3). Observe que el C-3 con sus hidrógenos lo visualizamos en conjunto como el grupo metilo (CH3), ya que las proyecciones silla de caballo y Newman se usan para mostrar la disposición de los átomos o grupos en un enlace C-C seleccionado. La representación de un modelo de bolas y varillas para propano se observa en la Figura 3.2. Proyecciones "Silla de Caballo" Rotación Proyecciones "Newman" Conformación ECLIPSADA Conformación ESCALONADA Figura 3.2. Estructuras "Silla de Caballo" Eclipsada y Escalonada del propano El butano (CH3CH2CH2CH3), como el etano, puede existir en conformaciones eclipsada y alternada. Visualizando al butano a través de los dos carbonos del centro (C-2, C3), la presencia de los grupos metilo da origen a dos tipos de conformaciones alternadas que difieren en las posiciones relativas de los grupos metilo. cual Luz Marina Jaramillo Ph. D. Depto de Química La conformación alternada en la 118 los grupos metilo están lo mas lejos posible (formando ángulo de 180°) se denomina confórmero anti (I) y es el más estable energéticamente. En la otra conformación alternada denominada confórmero oblicuo (III) o "gauche" (del francés "izquierdo" o "torcido") los dos grupos metilo están más próximos formando un ángulo de 60° entre sí. Por supuesto que también existirán dos tipos de conformación eclipsada: una donde dos hidrógenos quedan paralelos a grupos metilo (II) y otra donde los dos pares de hidrógenos y los dos grupos metilo están paralelos entre sí (IV). Esta última conformación es la que presenta mayores repulsiones entre los electrones enlazantes. La Figura 3.3 muestra todas estas conformaciones Figura 3.3 Proyecciones Newman de los principales confórmeros del n-butano En general la conformación mas probable adoptada por los hidrógenos de los grupos metileno o sustituyentes en hidrocarburos de cadena recta es una en la cual todos los átomos o grupos quedan alternados, formando un zig-zag. Por ejemplo el ndecano podría representarse como: Ejercicio 3.2 Represente las conformaciones I a IV con estructuras "silla de caballo". Luz Marina Jaramillo Ph. D. Depto de Química 119 Solución: Haga Ud. lo mismo con III y IV. Ejercicio 3.3. Dibuje proyecciones Newman para las conformaciones anti y oblicua de 1-Bromo-2-cloroetano. 3.4.1 Reacciones de Halogenación de Alcanos: Sustitución por Radicales Libres Los alcanos como clase o familia de compuestos orgánicos se caracterizan por su inercia general a muchos reactivos químicos. Se les ha denominado parafinas (del Latín "parum affinitus" o poca afinidad). Los enlaces C-C y C-H son bastantes fuertes y no se rompen a menos que se calienten a temperaturas muy altas. Además no reaccionan con ácidos concentrados y bases, ni son afectados por la mayor parte de los agentes oxidantes o reductores. La reacción más típica de los alcanos y los cicloalcanos es la halogenación ( Ec. 3.1) en la cual un átomo de hidrógeno se sustituye por un átomo halógeno para formar un haluro de alquilo (R-X), donde X es principalmente Cl y Br y un haluro de hidrógeno. La reacción en términos generales es lo que llamaríamos una específicamente una reacción de sustitución Luz Marina Jaramillo Ph. D. Depto de Química reacción de sustitución y más 120 por radicales libres (se ha demostrado que tales especies participan en alguna etapa del mecanismo de la reacción). La reacción de halogenación se efectúa sin dificultad al mezclar un alcano con halógenos como cloro o bromo en presencia de luz solar o UV. Esta reacción también ocurre a temperaturas suficientemente altas. Los miembros más bajos de la serie de los aléanos (metano, etano, propano, butano) reaccionan con los halógenos cloro (Cl2) y bromo (Br2) en fase gaseosa. La halogenación de metano puede describirse mediante la ecuación 3.2: Si la reacción es equimolar entre el alcano y el halógeno solamente se sustituye un átomo de hidrógeno por el halógeno, pero en presencia de un exceso del halógeno (por ej: cloro) pueden sustituirse varios átomos de hidrógeno: Aparte del cloro también el bromo reacciona bajo esas condiciones. La reacción con flúor es tan violenta que llega a ser explosiva y solo podría realizarse a muy bajas temperaturas. Con el yodo es demasiado lenta para considerarse reactivo hacia los hidrocarburos alifáticos. El orden de reactividad relativa para los halógenos es entonces: F2 >> Cl2 >> Br2 >> l2 (Orden decreciente de reactividad) Luz Marina Jaramillo Ph. D. Depto de Química 121 A su vez el etano reacciona equimolarmente con bromo o cloro para dar un solo producto de monosustitución: 3.4.2 Mecanismo de Halogenación: Concepto de Mecanismo de Reacción. Uno de los conceptos más útiles en el estudio de las reacciones de compuestos orgánicos es el concepto de mecanismo de reacción. Para comprender qué es un mecanismo de reacción, debemos saber primero: Qué es una reacción química. Una descripción interesante la ha proporcionado el profesor B. Widom de la Universidad de Cornell (Science, 1965, 1555): "Una reacción química es el resaltado de una secuencia compleja de procesos moleculares elementales. Cada molécula en una mezcla de reacción sufre cambios continuos en su estado, energía, geometría, etc. La mayor parte de estos cambios, son quizás demasiado minúsculos y escasamente notables, otros son repentinos como es el resultado de choques extremadamente perturbadores. Los procesos son aparentemente sin propósito, cada molécula puede llegar a estar excitada o en estado fundamental con regularidad. Pero cuando visualizamos la mezcla de reacción impredecible como un sistema microscópico la confusión molecular es invisible y lo que vemos en su lugar, es al parecer un trayecto hacia el equilibrio, rápido al principio, luego mas lento, hasta que finalmente el equilibrio se alcanza y la reacción química termina". Un mecanismo de reacción nos da así un panorama del trayecto de la reacción, etapa por etapa, hacia el equilibrio. El mecanismo muestra cuáles enlaces se rompen y cuáles se forman y el orden en que ocurren estos eventos. Es un esfuerzo por entender los cambios de estado, hibridación, esqueleto carbonado, grupo funcional, geometría y de energía que acompaña a estos procesos. Un mecanismo de reacción es en cierto sentido, un mapa del camino seguido por reactantes para llegar a los productos. Luz Marina Jaramillo Ph. D. Depto de Química 122 Aunque hoy muchos mecanismos se comprenden bien, algunos son todavía un misterio. En síntesis puede decirse que un mecanismo de reacción es la construcción teórica que usamos para explicar observaciones experimentales. Para el caso particular de la cloración de metano y en general de la halogenación de alcanos se ha demostrado que el mecanismo de esta reacción ocurre en las siguientes etapas: Las etapas (2) y (3) se repiten una y otra vez mientras existan moléculas de Cl2 y CH4. Es lo que se conoce como una reacción en cadena, "aquella en la que continuamente se consumen y regeneran los intermediarios en una serie de etapas de propagación" El mecanismo descrito se conoce como halogenación por radicales libres o reacción en cadena por radicales libres. El ciclo de propagación puede romperse por las etapas de terminación, que destruyen los radicales libres formando compuestos estables. La cloración del metano se termina principalmente por la combinación de unos radicales libres con otros. Pero en general estas reacciones no son verdaderamente importantes por la baja Luz Marina Jaramillo Ph. D. Depto de Química 123 probabilidad de colisión de dos radicales libres en la mezcla de reacción. La halogenación de los alcanos es promovida por luz o calor. Así tenemos que el metano y el cloro no reaccionan a temperatura ambiente en la oscuridad, pero si a temperatura ambiente si la mezcla se irradia con luz ultravioleta (hv), o en la oscuridad si la mezcla se calienta por encima de 250 °C. Análisis Energético La etapa de iniciación en el mecanismo de halogenación de alcanos es el rompimiento homolítico de la molécula de halógeno. En la cloración de metano la molécula de cloro se rompe produciendo átomos reactivos de cloro o radicales libres de cloro. Esta etapa es endotérmica e involucra una energía de 58 kcal/mol (energía de disociación de enlace de Cl-Cl), proporcionada por la luz UV o el calor. Una vez formados los primeros átomos o radicales de cloro, comienza la serie de reacciones denominadas etapas de propagación. Puede determinarse el AH de cada etapa de propagación estableciendo la diferencia entre la energía liberada para la formación de los enlaces y la requerida para el rompimiento de los mismos enlaces. Los valores de las energías de disociación de enlace aparecen reportados en la Tabla 1.2 y son considerados negativos cuando se asocian a la formación del enlace y positivos cuando se refieren al rompimiento. El radical cloro (muy reactivo!) abstrae un átomo de H del metano rompiendo homolíticamente el enlace C-H y formando el enlace H-Cl, esta etapa es ligeramente endotérmica, mientras que el ataque del radical metilo a la molécula de cloro es exotérmico Luz Marina Jaramillo Ph. D. Depto de Química 124 Finalmente la suma de las etapas de propagación produce la ecuación global y la suma de las entalpías respectivas, el ΔH total. El resultado neto es la generación de 24.5 kcal/mol, sin embargo es necesario suministrar energía inicialmente para comenzar el proceso en cadena, ya que el paso inicial (rompimiento de la molécula de Cl2) es altamente endotérmico (58 kcal/mol). Una vez que se rompan las primeras moléculas de cloro esta energía es suficiente para que los pasos (2) y (3) se sucedan infinidad de veces antes que la serie se interrumpa, de ahí que esta cantidad de energía no se involucra en el cálculo. Energía de Activación Como todos sabemos, en las reacciones exotérmicas los productos están en un nivel energético mas bajo que los reactantes (Figura 3.4a) y en las reacciones endotérmicas los reactantes están en un nivel mas bajo que los productos (Figura 3.4b). Deberíamos esperar que todas las reacciones exotérmicas precedieran espontáneamente, pero pocas reacciones son espontáneas. Así sea la reacción exotérmica o endotérmica, generalmente es necesario aplicar una cantidad mínima de energía al sistema para iniciarla. Una vez empezada, una reacción exotérmica a menudo produce energía suficiente para mantenerse a si misma, mientras que una reacción endotérmica se para si se deja de suministrar energía. Luz Marina Jaramillo Ph. D. Depto de Química 125 Progreso de la reacción Progreso de la reacción Figura 3.4 Representación gráfica de: a. R. Exotérmica b. R. Endotérmica. La Energía de Activación (Ea), es la mínima cantidad de energía requerida para iniciar una reacción o también la diferencia de energía entre los reactantes y el punto mas alto en la curva de energía potencial a lo largo de la coordenada de reacción. Al punto de energía máxima se denomina complejo activado. Son unidades de Ea: kcal/mol o kJ/moL El complejo activado no es un intermediario aislable sino más bien un estado de transición de alta energía. La energía de activación que es la barrera energética que debe vencer cada reacción química está íntimamente relacionada con la velocidad de reacción, ya que reacciones con valores altos de Ea son mas lentas y aquellas con Ea pequeñas suelen ocurrir en forma rápida. Por otro lado un cambio en la temperatura afectará en mayor o menor grado la velocidad de una reacción química dependiendo de la magnitud de Ea. En la cloración del metano, la Energía de Activación de la etapa (2) (endotérmica) es 4 kcal/mol El primer "estado de transición" etapa (2) conduce al intermediario radical metilo (CH3*), el cual tiene que pasar por otro "estado de transición" etapa (3) para llegar finalmente a los productos. (CH3-Cl + Cl* ). Puede observarse en la Figura. 3.5 que la etapa 2 tiene una energía de activación mayor que la etapa 3, por lo tanto esa etapa debe ser el paso lento de la reacción de halogenación. Además en esa etapa se forma una especie intermediaria que es el radical metilo. Luz Marina Jaramillo Ph. D. Depto de Química 126 Figura 3.5 Perfil de Energía de las etapas de propagación en la Cloración del Metano En resumen la cloración de metano y de cualquier otro alcano puede describirse en un mecanismo de tres etapas fundamentales: a) Una etapa de iniciación (etapa 1). b)Dos etapas de propagación, donde la primera de estas, es una etapa lenta y endotérmica que genera especies intermediarias llamadas radicales alquilo. La segunda es una etapa rápida y exotérmica que lleva al producto o productos esperados. También pueden ocurrir etapas secundarias de terminación, donde algunos radicales acumulados en la mezcla de reacción se recombinan interrumpiendo el ciclo de propagación. Ejercicio 3.4 a) Ilustre el mecanismo (por etapas) de la bromación de metano, b) Haga los cálculos energéticos para la etapa de iniciación y cada etapa de propagación, c) Calcule el AH t de la reacción global, (ayuda: use los datos de la tabla 12).d) Dibuje un perfil de energía con las etapas de propagación semejante a la fig. 3.5. Luz Marina Jaramillo Ph. D. Depto de Química 127 3.4.3 Radicales alquilo como especies intermediarias En la discusión anterior se ha introducido la noción de una especie intermediaria llamada radical metilo (CH3*). Encontraremos a lo largo del estudio de la química orgánica varias clases de intermediarios o especies químicas transitorias que participan en etapas del mecanismo de una reacción orgánica. Dentro de éstas especies figuran los llamados radicales libres o simplemente radicales, los cuales se caracterizan porque poseen en su estructura un electrón desapareado que está mas o menos localizado sobre un elemento no metálico como C, Si, N, O, S, etc. Típicamente los radicales orgánicos presentan un átomo de carbono que es trivalente y tiene siete electrones en su capa de valencia como en la siguiente estructura hipotética. Suele representarse con un punto en las estructuras de Lewis con rayas como I. La presencia de un electrón solitario en tales especies los hace paramagnéticos. La geometría de los radicales orgánicos es variable, algunos son especies planares donde la hibridación del carbono es sp2. Otros radicales se interpretan como piramidales y en este caso la hibridación del carbono sería sp3. Tal información se ha conseguido mediante la aplicación de ciertos métodos físicos y cálculos teóricos con orbitales moleculares. Uno de los métodos físicos más utilizados es la resonancia de espín electrónico (ESR) o resonancia paramagnética electrónica (EPR). Este método espectroscópico detecta la transición de un electrón entre los niveles de energía asociados con las dos posibles orientaciones del espín en un campo magnético. Otro método físico empleado es la denominada espectroscopia de infrarojo (IR) que se basa en la excitación de moléculas a un estado de energía más alto cuando absorbe radiación infraroja, permitiendo aumentar la amplitud de los movimientos vibrationals de los enlaces en la molécula. Aunque no es parte de los objetivos de este curso, la descripción de las técnicas mencionadas, si es importante conocer la interpretación que se ha logrado a través de ellas sobre la geometría de algunos radicales orgánicos. Luz Marina Jaramillo Ph. D. Depto de Química 128 El radical metilo es el más simple de los radicales orgánicos y exhibe estructura aproximadamente planar, con el carbono hibridizado sp2 y el electrón desapareado sobre el orbital p ortogonal al plano donde reposan los 3 enlaces C-HA medida que se va reemplazando cada átomo de hidrógeno por grupos alquilo el radical se desvía de la planaridad. Así el radical ter-butilo se ha interpretado más como una estructura piramidal, donde el electrón desapareado reposa sobre un orbital sp3. Para radicales con un grupo alquilo o dos, la geometría puede considerarse aún próxima a la del radical metilo. Cuando se reemplaza un hidrógeno por halógeno (X), hidroxilo (OH) o amino (-NH2) la geometría del radical resultante, tiende a la piramidalización. Aunque los radicales libres son especies transitorias (con existencia efímera) que surgen como intermediarios en etapas de una reacción química, no todos son igualmente estables. Ha podido establecerse que entre mas sustituido se encuentre el carbono que contienen el electrón desapareado, más estable es el radical. De acuerdo al patrón de sustitución en diferentes aléanos podemos tener radicales primarios, secundarios y terciarios. El orden decreciente de estabilidad para tales radicales incluyendo el metilo, sería: La energía requerida puede obtenerse por calentamiento o radiación UV. En la reacción de cloración o bromación de metano suele usarse cualquiera de las dos alternativas. Sin embargo es también posible iniciar reacciones en cadena vía radicales libres adicionando Luz Marina Jaramillo Ph. D. Depto de Química 129 ciertas sustancias llamadas iniciadores, las cuales generan radicales bajo condiciones bastante moderadas. Entre los iniciadores más comunes se cuentan los peróxidos que contienen el enlace peroxídico (-0-0-) como en el peróxido de hidrógeno o agua oxigenada (H-O-O-H). Son ejemplos El valor de energía entre paréntesis es la cantidad necesaria para romper el enlace O-O-, que es mucho mas baja que la requerida para romper otros enlaces covalentes. Observe que el radical benciloxilo (Ec. 3.5) se descompone acto seguido en radicales fenilo liberando dióxido de carbono. Otros iniciadores contienen el enlace -N=N- y son compuestos azo. El más común entre ellos es el azobisisobutironitrilo (AIBN). (3.6) Luz Marina Jaramillo Ph. D. Depto de Química 130 Cualquiera de las sustancias mencionadas (en cantidades catalíticas o minúsculas), generan los primeros radicales que inician un proceso en cadena semejante al descrito para la cloración del metano o etano. Ejercicio 3.5 El cloruro de sulfurilo (S02Cl2), es un agente clorante para hidrocarburos (Ec. 3.7). La cloración ocurre cuando una mezcla de hidrocarburos y cloruro de sulfurilo es iniciada por peróxidos. Describa el mecanismo en cadena (por etapas) para la cloración de etano con una cantidad catalítica de diterbutilperoxido. Solución El proceso se inicia con la ruptura del enlace peroxídico (-O-O-). El radical t-butoxilo abstrae un átomo de cloro del cloruro del sulfurilo generando el radical, SO2Cl*, el cual se descompone para dar radicales (o átomos) de Cl* altamente reactivos que generan el ciclo de propagación. Luz Marina Jaramillo Ph. D. Depto de Química 131 Las etapas (3), (4) y (5) se repiten indefinidamente hasta que se consumen los reactivos. La descomposición de SO2Cl* en SO2 y Cl* es parte del ciclo de iniciación y de propagación. ¿Si usted suma algebraicamente las ecuaciones (3), (4) y (5) cómo queda descrita la ecuación global? No olvide cancelar las especies que aparecen a la derecha e izquierda del ciclo de propagación. 3.4.4 Halogenación de Aléanos superiores En los alcanos de tres o mas átomos de carbono hay diferentes tipos de hidrógenos, dependiendo a que clase de carbono están unidos (1o, 2o, 3o). Es así que la cloración o bromación de propano produce dos productos isoméricos en proporciones bien diferentes . Esto pone de manifiesto algunos conceptos básicos de reactividad y selectividad que podrían aplicarse a cualquier tipo de reacción.. El propano tiene 6 hidrógenos primarios y 2 hidrógenos secundarios. A pesar de un factor estadístico de 6:2, las reacciones 3.8 y 3.9 nos muestran que es mas favorable sustraer un hidrógeno 2o que uno 1o y que el bromo es mas selectivo que el cloro ya que en la bromación del propano, prácticamente se forma el 2-Bromopropano (97%). De hecho, el bromo es menos reactivo que el cloro y esta propiedad lo hace a su vez mas selectivo hacia el hidrógeno secundario. Luz Marina Jaramillo Ph. D. Depto de Química 132 Por su parte la cloración (Ec 3.10) y bromación (Ec 3.11) del 2-metil-propano (isobutano) produce la siguiente distribución de isómeros: Estadísticamente hubiésemos esperado en ambos casos una razón de isómeros de 9:1 pero se observa en la cloración una relación de productos de 2:1 y en la bromación prácticamente un solo producto. Se evidencia aquí la selectividad del bromo sobre el cloro por el hidrógeno terciario. Aquí otra vez se evidencia notablemente la selectividad del hidrógeno terciario. Ya que la etapa lenta en la halogenación por radicales libres es la formación de un intermediario radical, la distribución de los productos dependerá de la facilidad con que se forme el intermediario. A continuación se observan los valores de las energías de disociación de enlace, requeridas para formar radicales vía rompimiento homolítico del enlace C-H Luz Marina Jaramillo Ph. D. Depto de Química 133 Se puede observar que es más fácil formar un radical terciario que uno secundario y en el mismo sentido, es más fácil formar un radical secundario que uno primario. El radical metilo es el más difícil de formar. 3o > 2o > 1o > metilo Orden decreciente de facilidad de formación de radicales libres Si se necesita menos energía para formar un radical que otro, esto solo puede significar que, en relación con el alcano que lo origina, un radical contiene menos energía que otro, es decir es mas estable. Por tanto el orden de estabilidad de radicales libres es: 3o > 2o > 1o > metilo Orden decreciente de estabilidad de radicales libres Ejercicio 3.6 Cuál es el producto principal esperado de la bromación de 2,2,3trimetiIbutano, a 80 °C y en presencia de luz UV? Explique su respuesta. 3.4.5 Combustión La combustión es el proceso de quemar un compuesto orgánico (combustible) en presencia de oxígeno, está acompañada por el desprendimiento de calor, lo que se ha aprovechado en las máquinas de combustión interna cuya importancia práctica es evidente. La combustión Luz Marina Jaramillo Ph. D. Depto de Química 134 completa de un hidrocarburo lo convierte en CO2 y H2O. Siendo la ecuación general: Ejemplo: La combustión incompleta ocurre si el suministro de oxigeno no es suficiente, además de agua se produce monóxido de carbono (CO), un contaminante de la atmósfera, la ecuación general es: Ejemplo: El mecanismo de la reacción de combustión es sumamente complejo y aun no se conoce bien. Parece tratarse de una reacción en cadena por radicales libres, que requiere para su iniciación temperaturas muy elevadas, aunque el proceso global es exotérmico. La Energía liberada cuando un compuesto se oxida completamente a CO2 y H2O, se denomina calor de combustión. Bajo condiciones controladas de laboratorio puede medirse el ΔHcomb. Los valores para calores de combustión (Tabla 3.4) dependen principalmente del número de átomos de carbono e hidrógeno en una molécula. En una serie homologa, la energía liberada aumenta alrededor de 157.4 kcal/mol por cada metileno (-CH2-) adicional. Luz Marina Jaramillo Ph. D. Depto de Química 135 Tabla 3.4 Calores de Combustión de algunos Alcanos. Nombre Estructura ΔH comb Metano CH4 -210 (-157.6) Etano CH3CH3 -368.4 (-157.9) Propano CH3 CH2 CH3 -526.3 (-157.7) n-Butano CH3(CH2)2CH3 -684.0 (-154.3) n-Pentano CH3(CH2)3CH3 -838.3 (-151.5) n-Hexano CH3(CH2)4CH3 -989.8 (-160.1) n-Heptano CH3(CH2)5CH3 -1149.9 (-152.8) n-Octano CH3(CH2)6CH3 kcal/mol(ΔH/-CH2) 1302.7 3.5 Cicloalcanos Sobre los hidrocarburos cíclicos ya se estudió su nomenclatura (Sec. 2.3.5), sus propiedades físicas (Sec. 3.2) y que se representan mediante figuras geométricas poligonales (Sec. 2.3.5) 3.5.1 Isomería cis-trans en Cicloalcanos Disustituidos Los hidrógenos de un cicloalcano pueden sustituirse por otros átomos o grupos de átomos ( por ej: -CH3, -OH, -Cl, etc). Cuando dos hidrógenos en posiciones diferentes del anillo son reemplazados, los sustituyentes pueden adoptar dos orientaciones en el espacio dando lugar a la existencia de los denominados isómeros geométricos cis y trans. Esta clase de isómeros que solamente difieren entre si por su orientación en el espacio, también han recibido el nombre genérico de estereoisómeros (griego: stereos, sólido). Como ejemplo ilustrativo se muestra en la Figura 3.6 dos representaciones ( V y V’) para el 1,2-diclorociclopropano con los átomos de cloro colocados a un mismo lado (del plano del anillo) generando el isómero o estereoisómero cis y dos representaciones ( VI y VI') para el estereoisómero trans con los átomos de cloro en lados opuestos. Luz Marina Jaramillo Ph. D. Depto de Química 136 Figura 3.6 Representaciones (o proyecciones) del cis y trans 1,2-Dicloropropano Observe que las proyecciones V y VI' hacen uso de trazos gruesos e interrumpidos para designar enlaces hacia adelante y atrás del plano del papel. Los estereoisómeros cis y trans de los cicloalcanos son compuestos aislables, con propiedades físicas únicas. Ejercicio 3.7 Escriba las estructuras de los estereoisómeros cis y trans de: a) 1,3-Dimetilciclohexano b) 1,2-Dibromociclobutano c) 2-Bromo-1-metilciclopentano Solución a) cis- 1,3-Dimetilciclohexano (HagaUd. el estereoisómero trans) b) trans- 1,2-Dibromociclobutano (HagaUd. el estereoisómero cis) Luz Marina Jaramillo Ph. D. Depto de Química 137 trans- 2-Bromo-1-metilciclopentano (Haga Ud. el estereoisómero cis). 3.5.2 Estructuras: Tensiones y Calores de Combustión Si suponemos que todas las moléculas de los cicloalcanos son planares de acuerdo a su representación geométrica, los ángulos de enlace de estos anillos, se apartarían del valor 109.5° (ángulo tetraédrico), debido a que el ciclopropano (un triángulo), el ciclobutano (un cuadrado), el ciclohexano (un hexágono) tendrían ángulos de enlace de 60°, 90° y 120° respectivamente. El ciclopentano (un pentágono) con un ángulo de 108° no se desviaría tanto del ángulo tetrahédrico. La diferencia de los ángulos mencionados con el tetraédrico crearía un tipo de tensión conocida como tensión angular. Esta consideración llevó a Adolf von Baeyer (1885) a concluir que el ciclopentano era el más estable de los cicloalcanos. Pero la evidencia experimental demostró que excepto para el ciclopropano, la suposición de von Baeyer de la planaridad de los anillos era incorrecta y las desviaciones de los ángulos que se predecían para anillos de 6 o mas miembros eran también erróneas. Parte de esta conclusión provino de los calores de combustión de los cicloalcanos. Recordemos que el calor de combustión para la serie homologa de los aléanos, entre miembros inmediatos, tiene una variación constante de 157.4 kcal/mol que corresponde al metileno (-CH2-) que los diferencia. Los cicloalcanos que Luz Marina Jaramillo Ph. D. Depto de Química 138 también constituyen una serie homologa, no exhiben la misma regularidad que los aléanos de cadena abierta, con respecto a sus calores de combustión (Tabla 3.5). De tal comportamiento se desprende el siguiente análisis: 1) El valor del calor de combustión para ciclopropano y ciclobutano por grupo metileno, se desvía apreciablemente de aquel para los aléanos correspondientes. Sus valores difieren en 9.2 y 6.6 kcal/mol respectivamente. 2) El ciclohexano y no el ciclopentano como predijo von Baeyer, es el cicloalcano mas estable, tiene el menor calor de combustión por grupo -CH2- y no difiere de aquel de los n-alcanos. 3) Los anillos de siete miembros o mas, no son excepcionalmente inestables sugiriendo que la tensión angular en estos anillos grandes es baja. Así, para el ciclopropano con tres grupos -CH2- en su molécula se esperaba un calor de combustión ΔHcomb. = 3 x 157.4 = 472.2 kcal/mol. Si el observado es : 499.83 kcal/mol, la energía de tensión es: (499.83 - 472.2) = 27.6 kcal/mol y la energía de tensión por -CH2- es: 27.6/3 = 9.2 kcal/mol. Tabla 3.5 Calores de Combustión de algunos Cicloalcanos. Ciclopropano 3 ΔH Comb. (kcal/mol) -499.83 Ciclobutano 4 -655.86 (-164.0) Ciclopentano 5 -793.52 (-158.7) Ciclohexano 6 -944.48 (-157.4) Cicloheptano 7 -1108.2 (-158.3) Ciclooctano 8 -1269.2 Cicloalcano C-n (AH Comb. / -CH2-) (kcal/mol) (-166.6) En conclusión, los dos anillos mas pequeños son los mas tensionados porque estructuralmente solo pueden ser planares con ángulos de enlace 60° y 90° los cuales se apartan mucho del valor 109.5°. Pero los anillos mas grandes (a partir del ciclohexano) pueden doblarse (o plegarse) fácilmente para aproximarse al ángulo tetraédrico. Es el caso del ciclohexano y ciclodecano que tienen ángulos de 109.5° Luz Marina Jaramillo Ph. D. Depto de Química 139 Ejercicio 3.8 Calcule la energía de tensión para el ciclopentano. 3.5.3 Conformaciones del Ciclohexano El anillo de ciclohexano solo o en sistemas de varios anillos que comparten conjuntamente dos átomos de carbono, es el mas importante de todos los sistemas cíclicos. Hay muchas formas o conformaciones que el anillo de ciclohexano puede adoptar y cualquier molécula de ciclohexano está en un estado continuo de flexión. Pero hay muchas pruebas de que la forma mas estable del anillo de ciclohexano es la denominada conformación "silla" la cual visualizamos con un modelo de bolas y varillas o con la representación donde no se muestran los carbonos pero si los hidrógenos (Figura 3.7). Observando cuidadosamente la conformación silla vemos que todos los enlaces C-H y C-C están alternados. En consecuencia, esta conformación no sólo está libre de tensión angular sino de tensión torsional. H H ^5M^H Figura 3.7 Representaciones de la forma "Silla" del Ciclohexano. Luz Marina Jaramillo Ph. D. Depto de Química 140 Aunque la molécula de ciclohexano está en continua flexión y pasa por las otras conformaciones (que no se discutieron) se ha calculado que en cualquier momento, el 99.9% de las moléculas del ciclohexano están en la forma silla. Enlaces Axiales y Ecuatoriales Aunque el anillo del ciclohexano en conjunto no es plano se considera que los átomos de carbono del anillo reposan rudamente en el plano. Así resulta que los hidrógenos ocupan dos clases de posición: seis de ellos están en el plano, definido por el anillo y son los llamados hidrógenos ecuatoriales porque forman un cinturón alrededor del "ecuador" del anillo. Los otros seis hidrógenos restantes se orientan en una dirección que es perpendicular al plano promedio del anillo, son los hidrógenos axiales. Hay tres hidrógenos axiales en cada cara del anillo del ciclohexano y en orientación (hacia arriba o hacia abajo); se alterna de un carbono al siguiente, (Figura 3.8): Hidrógenos Ecuatoriales Hidrógenos Axiales Figura 3.8 Hidrógenos Ecuatoriales y Axiales del ciclohexano conformación Silla El ciclohexano existe en un equilibrio dinámico entre dos conformaciones silla, los cuales difieren en que los hidrógenos axiales de una conformación estarán ecuatoriales en la otra: Podríamos hacernos la siguiente pregunta: ¿Cuál es la conformación mas estable de un ciclohexano monosustituido? Luz Marina Jaramillo Ph. D. Depto de Química 141 Si se trata de grupos alquilo empezando desde metilo la conformación mas estable es aquella donde el grupo alquilo quede en posición ecuatorial ya que colocado en posición axial interaccionaría con los hidrógenos axiales vecinos: H H Metilo axial Si el metilo está axial, las interacciones (o repulsiones) con el hidrógeno vecino se minimizan porque ambos no están en el mismo plano: Metilo ecuatorial Ciclohexanos Disustituidos: Isomerismo Geométrico Representando las moléculas en forma planar vimos que los cicloalcanos disustituidos dan lugar a la existencia de los isómeros geométricos cis y trans, es así que el 1,2-dimetilciclohexano podría corresponder dimetilciclohexano o al trans-1,2-dimetilciclohexano. cis-1,2-Dimetilciclohexano Luz Marina Jaramillo Ph. D. Depto de Química trans-1,2-Dimetilciclohexano al cis-l,2- 142 Dependiendo de si el ciclohexano disustituido es cis o trans, en cuales posiciones relativas ecuatorial o axial estarán los grupos metilos? trans-1,2-Dimetilciclohexano ecuatorial-ecuatorial más estable!!! cis-1,2-Dimetilciclohexano axial-ecuatorial Igual pregunta tenemos que hacernos al referirnos al cis o trans 1,3 dimetilciclohexano y 1,4 dimetilciclohexano. La Tabla 3.6 alista las posiciones relativas axial o ecuatorial que ocuparían ambos sustituyentes según se trate del isómero cis o del isómero trans. Tabla 3.6. Posiciones axiales y ecuatoriales en derivados disustituidos del Ciclohexano Posición relativa Isomería Tipo de posición 1,2 cis e,a-a,e trans e,e-a,a cis a,a-e,e trans a,e-e,a cis e,a-a,e trans e,e-a,a 1,3 1,4 Ejemplos: a) cis-l,2-Dibromociclobutano representaciones planares Luz Marina Jaramillo Ph. D. Depto de Química conformaciones "Silla" (igual estabilidad) 143 b) trans-4-Metilciclohexanol representaciones planares conformaciones " Silla" (desigual estabilidad) c) trans-3-Cloroetilciclohexano representaciones planares conformaciones " Silla" (estabilidad desigual) Ejercicio 3.9 Represente las conformaciones silla mas estables de: a) t-Butilciclohexano b) trans-3-Etil-butilciclohexano c) cw-4-Clorometilciclohexano En general, la conformación e,e es mas estable que la a,a. Cuando la conformación es a,e, la estabilidad dependerá de la clase de sustituyente: si uno de los grupos es alquilo, la mas estable es aquella donde este grupo queda ecuatorial (ver ejemplo c). Por simplificación no usaremos las conformaciones silla (a lo largo del curso) para ilustrar las reacciones donde participen anillos de ciclohexano. Los anillos de 6 miembros y a veces los de 5 miembros aparecen en sistemas de familias de compuestos haciendo parte de esqueletos carbonados que integran varios de estos anillos a través de dos uniones C-C, o fusión de anillos. Luz Marina Jaramillo Ph. D. Depto de Química 144 La fusión de dos anillos de 6 miembros genera el sistema conocido como decalina La fusión de dos anillos en decalina puede ser cis o trans: representación planar trans-Decalina p.e. 190 °C representación planar cis-Decalina p.e. 195 °C El sistema conocido como perhidrofenantreno VII es una fusión de tres anillos y el llamado El perhidrociclopentanoperhidrofenantreno VIII es el sistema de cuatro anillos fusionados que hace parte del esqueleto básico de los esferoides, un grupo de compuestos biológicamente activos que se obtienen de las fracciones de los lípidos de plantas y animales. VII Luz Marina Jaramillo Ph. D. Depto de Química VIII 145 Entre estos importantes compuestos se encuentran las hormonas sexuales masculinas y femeninas, la vitamina D, los ácidos biliares y algunos venenos cardíacos. Para distinguir el sistema esteroidal se designan los anillos A, B, C y D. No debemos olvidar que aquí también los anillos son doblados y los ciclos de seis miembros estarán en sus conformaciones silla. Las uniones entre los anillos A, B puede ser cis o trans y los anillos B, C y C, D presentan fusión trans. Un ejemplo muy conocido de la familia de los esteroides es el colesterol (IX): que se encuentra en casi todos los tejidos del cuerpo y aparentemente sirve como precursor de las hormonas esteroidales. Como se observa, no es exactamente un hidrocarburo ya que tiene la función hidroxilo de los alcoholes. 3.5.4 Reacciones de los Cicloalcanos Con excepción del ciclopropano y el ciclobutano, los cicloalcanos presentan la misma actividad química que sus análogos de cadena abierta. Es así que ellos reaccionan vía radicales libres con halógenos en presencia de luz o calor. Luz Marina Jaramillo Ph. D. Depto de Química 146 La tensión anular hace que el ciclopropano y el ciclobutano sean diferentes a los otros cicloalcanos sufriendo reacciones de adición, en las cuales hay obviamente apertura de anillo. Son ejemplos las siguientes reacciones: Ejercicio 3.10 En la reacción de metilciclopropano con Br2 / FeBr3 se forman dos productos, escriba sus estructuras. Luz Marina Jaramillo Ph. D. Depto de Química BIBLIOGRAFÍA Ref. 1. Morrison, T.M. y Boyd, N.B. "Química Orgánica", 4a. Ed. , Fondo Educativo Interamericano, 1985. Ref. 2. Fessenden, R.J. y Fessenden, J.S., "Química Orgánica", Wadsworth Internacional/Iberoamericana, 1983. Ref. 3. Solomons, T.W.G., "Química Orgánica", Editorial Limusa, México, 1985. Ref. 4. Pine, S.H. , Hendrickson, J.B., Cram, D.J. y Hammond, G.S., "Química Orgánica", 4a. Ed., Mc Graw-Hill, México, S.A., 1982. Ref. 5. Baum, S.J., "Introducción a la Química Orgánica y Biológica", la. Ed., Editorial Continental, S.A., México, 1981. Ref. 6. Wingrove, A.S. y Caret, R.L., "Organic Chemistry", Harper & Row, Publishers, New York, 1981. Ref. 7. Reusch, W.H., "Química Orgánica", Mc Graw-Hill, México, Bogotá, 1979. Ref. 8. Allinger, N.L., Cava, M. P., De Jongh, D.C., Johnson, C.R., Lebel, N.A. y Stevens, C.L., "Química Orgánica", Editorial Reverté, S.A., Barcelona, 1976. Ref. 9. Oullette, R.J., "Introducción a la Química Orgánica", Harper & Row Latinoamericana, 1973. Ref. 10. Holum, J.R., "Organic and Biological Chemistry", John Wiley & Sons, New York, 1978. Ref . 11. Neckers, D.C. y Doyle, M.P. "Organic Chemistry", John Wiley & Sons, New York, 1977. Luz Marina Jaramillo Ph. D. Depto de Química BIBLIOGRAFÍA RECOMENDADA - Ref. 1, p.: 43-119; 326-336; 346-375; 384-390; 402-408; 410-418; 424-434; 559-560; 561-571; 574-591; 594-608; 630-643 - Ref. 2, p.: 123-137; 224-242; 384-405; 409-414; 417-426; 428-431; 459-462; 466-469; 473-484 - Ref. 3, p.: 106-118; 125-161; 171-174; 201-228; 331-342; 348-354; 363382; 426-433; 437-443; 471-499 - Ref. 8, p. : 1110-1120 - Ref. 11, p.: 30-31; 48-54; 119-128; 164-182; 191-193 - Ref. 9, p.: 136-139 - Doyle, M.P. y Mungall, W.S., "Experimental Organic Chemistry", John Wiley & Sons, 1980, 63-66. - Powrie, W.D. , "Chemical Effects During Storage of Frozen Foods", J. Chem. Ed. 1984, 61, 344. - Berk, Z., "Introduction to Biochemistry of Foods", Elsevier Science Publishing Co. Inc., 3a. Ed., 1976; Cap. 13, p. 195-208. - Viski, P., Szevernyi , Z. y Simandi ,, L.I., J. Org. Chem., 1986, 51., 3213. Luz Marina Jaramillo Ph. D. Depto de Química