Document
Anuncio

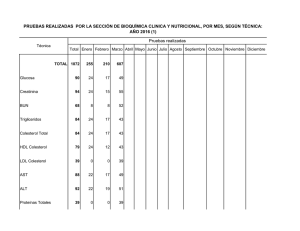
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 Proteínas Proteínas Dr.Mynor MynorA. A. Leiva LeivaEnríquez Enríquez Dr. PROTEÍNAS: • Las proteínas son macromoléculas que contienen pesos moleculares entre 6,000 a 11,000,000 o más. • Están formadas por Aminoácidos, que constituyen la unidad estructural, caracterizados por estar formados con un ácido carboxílico y un grupo amino (--NH2), enlazados al carbono alfa. • La fórmula general de los aminoácidos se muestra a la derecha: Aminoácidos con cadenas alifáticas GLICINA (Gli) No esencial H—CH—COO| NH3+ ALANINA (Ala) No esencial CH3—CH—COO| NH3+ VALINA (Val) ESENCIAL CH3—CH—CH—COO| | CH3 NH3+ LEUCINA (Leu) ESENCIAL CH3—CH—CH2—CH—COO| | CH3 NH3+ ISOLEUCINA (Ile) ESENCIAL CH3—CH2—CH—CH—COO| | CH3 NH3+ Aminoácidos con grupos hidroxílicos (OH) SERINA (Ser) No esencial TREONINA (Tre) ESENCIAL TIROSINA (Tir) No esencial CH2—CH—COO| | OH NH3+ CH3—CH—CH—COO| | OH NH3+ Véase adelante Aminoácidos con Azufre CISTEÍNA (Cis) No esencial CH2—CH—COO| | SH NH3+ METIONINA (Met) ESENCIAL CH2—CH2—CH—COO| | S—CH3 NH3+ Aminoácidos con ácidos o sus amidas ÁCIDO ASPÁRTICO (Asp) No esencial ASPARAGINA (Asn) No esencial ÁCIDO GLUTÁMICO (Glu) No esencial GLUTAMINA (Gln) No esencial -OOC—CH —CH—COO2 | NH3+ H2N—C—CH2—CH—COO|| | O NH3+ -OOC—CH —CH —CH—COO2 2 | NH3+ H2N—C—CH2—CH2—CH—COO|| | O NH3+ Aminoácidos con Grupos Básico ARGININA (Arg) ESENCIAL en el crecimiento LISINA (Lis) ESENCIAL HISTIDINA (His) ESENCIAL en el crecimiento Incluirla también en el siguiente grupo. H—N—CH2—CH2—CH2—CH—COO| | C==NH2+ NH3+ | NH2 CH2—CH2—CH2—CH2—CH—COO| | NH3+ NH3+ Aminoácidos con Anillos Aromáticos FENILALANINA (Fen) ESENCIAL TIROSINA (Tir) No esencial TRIPTÓFANO (Trp) ESENCIAL Aminoácido con grupo Imidazólico • PROLINA (Pro) No ESENCIAL Formación del enlace peptídico Fuente: Bioquímica de Mathews & Holden 3ª. Ed. Estructura Primaria de las proteínas Orden secuencial de los aminoácidos, determinado por los enlaces peptídicos. Fuente: Bioquímica de Mathews & Holden 3ª. Ed. Estructura Secundaria de las proteínas • Forma que adopta en el espacio la cadena en función de la formación de puentes de hidrógeno: • a) puede formarse un puente entre un grupo carboxilo de una unión peptídica y el grupo N—H del enlace peptídico de otro segmento proteico de la misma cadena formando una hélice alfa, • b) puede formarse el puente entre grupos N—H y C==O (carbonilo) de residuos separados de la cadena formando las hojas plegadas beta. Estas cadenas se encuentras completamente estiradas a partir de su terminal amino hasta su terminal carboxi y se denominan hebras . Estructura Secundaria de las Proteínas Forma que adopta en el espacio la cadena en función de la formación de puentes de hidrógeno: a) hélice alfa, o b) hojas plegadas beta. Fuente: Bioquímica de Mathews & Holden 3ª. Ed. Estructura Secundaria de las Proteínas Forma que adopta en el espacio la cadena en función de la formación de puentes de hidrógeno: a) hélice alfa, o b) hojas plegadas beta. Estructura terciaria de las proteínas (mioglobina) • Ordenamiento tridimensional de los diferentes componentes (hélices o hebras ) de una proteína, que les hace formar un conjunto esférico, elipsoide, globular irregular, elongado, etc... • Algunas proteínas como la albúmina o la mioglobina solo hasta este nivel pueden llegar porque están formadas por una sola cadena peptídica. Fuente: Bioquímica de Mathews & Holden 3ª. Ed. Estructura Cuaternaria de las proteínas (Hemoglobina) manera como se acoplan las subunidades de una proteína formada por varias cadenas independientes. Cada cadena es un monómero en una proteína polimérica (o multimérica). Por ejemplo, la hemoglobina que está formada por 4 subunidades y la acomodación tridimensional que presentan, determina Fuente: Bioquímica de Mathews & Holden 3ª. Ed. su función de transferencia de Oxígeno a los tejidos. Resumen Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Digestión de Proteínas • Boca: No hay enzimas bucales • Estómago: pepsina A y B, renina. • Intestino Delgado: • Proteasas pancreáticas: Tripsina, Quimotripsina, Elastasa, Carboxipeptidasa, • Proteasas intestinales: Aminopeptidasas, Dipeptidasas DIGESTIÓN DE PROTEÍNAS A DIFERENTES NIVELES DEL APARATO DIGESTIVO. Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier DIGESTIÓN DE PROTEÍNAS A DIFERENTES NIVELES DEL APARATO DIGESTIVO. Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier DIGESTIÓN DE PROTEÍNAS A DIFERENTES NIVELES DEL APARATO DIGESTIVO. Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier DIGESTIÓN DE PROTEÍNAS A DIFERENTES NIVELES DEL APARATO DIGESTIVO. Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier DIGESTIÓN DE PROTEÍNAS A DIFERENTES NIVELES DEL APARATO DIGESTIVO. Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Organización del tracto gastrointestinal (GI) Según requerimientos funcionales ÓRGANO FUNCIÓN PRIMARIA EN LA ABSORCIÓN DE LOS NUTRIENTES Producción de líquidos y enzimas digestivas para la homogenización, Glándulas Salivales lubricación y digestión de los hidratos de carbono (amilasa) y lípidos (lipasa lingual) Estómago Secreción de HCL y proteasas para iniciar la digestión hidrolítica de proteínas Páncreas Secreción de HCO3- proteasas y lipasa para continuar la digestión de proteínas y lípidos. Amilasa para completar la digestión del almidón. Mecanismo de activación (autocatálisis + cascada) de las enzimas proteasas pancreáticas. Fuente: Bioquímica de Mathews & Holden 3ª. Ed. Organización del tracto gastrointestinal (GI) Según requerimientos funcionales ÓRGANO Hígado / Vesícula Biliar Intestino Delgado Intestino Grueso FUNCIÓN PRIMARIA EN LA ABSORCIÓN DE LOS NUTRIENTES Secreción y almacenamiento de ácidos biliares para su liberación en el intestino delgado. Digestión intraluminal final de los alimentos: dímeros de hidratos de carbono y vías de absorción específicas para el material digerido. Absorción exclusiva de líquidos y electrolitos y productos de acción bacteriana en el Colon. Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Activación Del Quimotripsinógeno Formación de -quimotripsina La TRIPSINA es la responsable del corte incial y la activación de la forma . Los demás cambios son autocatalíticos hasta llegar la forma . -quimotripsina Fuente: Bioquímica de Mathews & Holden 3ª. Ed. Carboxipeptidasa Fuente: Bioquímica de Mathews & Holden 3ª. Ed. Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Proteasas digestivas Enzima Pepsina Tripsina Quimotripsina Proenzima Pepsinógeno Tripsinógeno Quimotripsinógeno Lugar de síntesis Activador Enlace Mucosa gástrica HCl, autoactivación Endopep Tir, Len, Leu Enteropeptidasa tripsina Endo Arg, Lis Enteropeptidasa tripsina Endopep Tir, Fen, trp, met, leu Páncreas Páncreas Proteasas digestivas Enzima Proenzima Elastasa Proelastasa Carboxipeptidasa A Procarboxipeptidasa A Lugar de síntesis Páncreas Páncreas Activador Enlace Tripsina Endopep Neutros Tripsina Todos excepto los básicos Carboxipeptidasa B Procarboxipeptidasa B Páncreas Tripsina Exopeptidasa Arg, Lis Aminopeptidasa --------- Mucosa intestinal ------------ Endopeptidasa • Digestión por enzimas de síntesis intestinal 1. Aminopeptidasas, extremo amino-terminal 2. Dipeptidasas par específico de aminoácidos 3. 4. 5. 6. 7. 8. 9. 10. Sacarasa Maltasa Lactasa Trehalasa Isomaltasa Fosfatasas Polinucleotidasas Nucleosidasas sacarosa (glucosa+fructosa) maltosa (glucosa+glucosa) lactosa (glucosa+galactosa) trehalosa (glucosa+glucosa) isomaltosa (glucosa+glucosa) separación de grupos fosfato separación de nucleótidos separa ribosa + base nitrogenada Absorción de Aminoácidos • Todos los aminoácidos son absorbidos por mecanismos de transporte activo. • Son necesarios sistemas de transportador, algunos asociados a Sodio. • En todos los casos es necesaria la presencia y actividad del Fosfato de Piridoxal (B6). • Hay transportadores para aminoácidos ácidos, básicos, pequeños, aromáticos y prolina Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier Fuente: Bioquímica Médica 3ª. Ed. Baynes, Dominiczak Editorial Elsevier