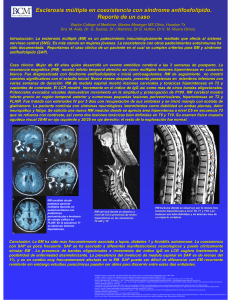
Tratamiento sintomático de la esclerosis múltiple
Anuncio

ESCLEROSIS MÚLTIPLE infección. En el estudio, que incluyó a 24 pacientes, se consideró que el TAPH fue eficaz, pues el 92% de los pacientes con EM SP estaban libres de progresión a los 3 años, mientras que para los pacientes con EM PP sólo el 40% mantendrían una puntuación en la EDSS igual o mejor a la basal al final del estudio. En cualquier caso, el tratamiento no puede considerarse que ‘cure’ la EM ya que la probabilidad de que a los 3 años postrasplante los pacientes no presenten actividad de la enfermedad es del 12% para la EM SP y del 0% para la EM PP. Conclusiones. El TAPH sigue siendo un protocolo experimental. Sólo en los años futuros sabremos si esta terapia aporta algo a los pacientes con esclerosis múltiple. [REV NEUROL 2002; 35: 1136-41] Palabras clave. Esclerosis múltiple. Inmunosupresión. Trasplante. infecção. No estudo que incluiu 24 doentes, considerou-se que o TAPH foi eficaz, pois 92% dos doentes com EM SP estavam livres de progressão aos 3 anos, enquanto que para os doentes com EM PP apenas 40% manteriam uma pontuação na EDSS igual ou melhor à basal no final do estudo. Em qualquer um dos casos, o tratamento não pode considerar-se que ‘cura’ a EM dado que a probabilidade de que aos 3 anos pós-transplante os doentes não apresentem actividade da doença é de 12% para a EM SP e de 0% para a EM PP. Conclusões. O TAPH continua a ser um protocolo experimental. Somente nos anos futuros saberemos se esta terapia proporciona algo aos doentes com esclerose múltipla. [REV NEUROL 2002; 35: 1136-41] Palavras chave. Esclerose múltipla. Imunosupressão. Transplante. Tratamiento sintomático de la esclerosis múltiple L. Ayuso-Peralta a, C. de Andrés b SYMPTOMATIC TREATMENT OF MULTIPLE SCLEROSIS Summary. Introduction. Multiple sclerosis is a chronic neurological disorder which affects middle aged adults. It usually means serious physical, psychological, social and employment problems for the patients concerned. Method. From the anatomo-pathological point of view, it is characterized by demyelination and axon damage in the central nervous system. The clinical features are variable, depending on the course of the disease, its clinical form and the sites of the lesions. Symptoms may appear in bouts, as relapses of the disorder or as a result of incomplete recovery from these episodes and cause severe disability. Conclusion. We review the physiopathology and most widely used treatment for management of the commonest symptoms of multiple sclerosis. [REV NEUROL 2002; 35: 1141-53] Key words. Ataxia. Cognitive changes. Fatigue. Intestinal changes. Multiple sclerosis. Nystagmus. Pain. Psychiatric changes. Sexual dysfunction. Sleep disorders. Spasticity. Tremor. Urinary dysfunction. Vertigo. INTRODUCCIÓN La esclerosis múltiple (EM) es una enfermedad neurológica crónica con expresión y curso clínico variables. La edad de mayor incidencia es entre los 20 y los 40 años, por lo que conlleva un importante impacto social, económico y familiar. Sus síntomas varían según el momento evolutivo de la enfermedad, su forma clínica y la topografía de las lesiones. Hay zonas del sistema nervioso central (SNC) muy expresivas, como el tronco cerebral o la médula espinal, y otras, como los centros semiovales, cuyo trastorno puede manifestarse sólo bajo tests específicos cognitivos o mediante incrementos de temperatura. Se piensa que los síntomas permanentes, debidos a la recuperación incompleta tras un brote o por evolución progresiva de la enfermedad, pueden ser producidos por lesión funcional del axón a consecuencia de un fallo de los mecanismos reparadores de la mielina, por distrofia axonal secundaria a ausencia o adelgazamiento en determinadas Recibido: 05.11.01. Aceptado: 12.11.01. a Sección de Neurología. Hospital Universitario Príncipe de Asturias. Alcalá de Henares, Madrid. b Servicio de Neurología. Hospital Universitario Gregorio Marañón. Madrid, España. Correspondencia: Dra. Lucía Ayuso Peralta. Sección de Neurología. Hospital Universitario Príncipe de Asturias. Ctra. Alcalá-Meco, s/n. E-28805 Alcalá de Henares, Madrid. E-mail: layusop@meditex.es 2002, REVISTA DE NEUROLOGÍA REV NEUROL 2002; 35 (12): 1141-1153 zonas de la misma, o bien a una pérdida crítica del número de axones y a fallo de los mecanismos compensatorios neurales. En general, los síntomas se pueden clasificar en tres categorías: primarios, secundarios y terciarios [1]. Los síntomas primarios incluyen déficit neurológicos derivados directamente de las lesiones del sistema nervioso central (espasticidad, debilidad, ataxia, temblor, parestesias, etc.); los síntomas secundarios son las complicaciones de los anteriores (contracturas, úlceras cutáneas, infecciones urinarias, etc.), y por último, los terciarios o discapacidades, son las consecuencias psicológicas, sociales y económicas derivadas de la enfermedad. El correcto abordaje de los síntomas de la EM es complejo y depende de varios factores. Es importante determinar si en la expresión de un síntoma pueden estar influyendo agentes distintos de la enfermedad. Por ejemplo, los fármacos sedantes pueden incrementar la fatiga, los antiespásticos la debilidad; cambios en la temperatura pueden modificar síntomas persistentes o poner de manifiesto síntomas subclínicos [2]. Antes de la instauración de un tratamiento es aconsejable una explicación individualizada al paciente acerca de la fisiopatología de los síntomas, de los posibles efectos secundarios y de las limitaciones médicas y científicas. Por otra parte, con frecuencia el tratamiento requiere de la participación multidisciplinaria integrada de diversos especialistas. En este artículo revisaremos el tratamiento actual de los síntomas primarios más comunes de la EM. 1141 L. AYUSO-PERALTA, ET AL ESPASTICIDAD La espasticidad es uno de los síntomas más comunes de la EM en estadios evolucionados. Desde el punto de vista fisiopatológico, se caracteriza por un incremento velocidad-dependiente de la resistencia a los movimientos, activos o pasivos, de los músculos. Se cree que puede estar producida por una desinhibición central del arco reflejo miotático [3]. De esta manera, las motoneuronas α están hiperexcitables como resultado de la reducción de la inhibición presináptica de las fibras del grupo Ia [4] y se activan por estímulos que normalmente no provocarían respuesta. Existe también una incoordinación entre músculos sinérgicos o un fallo en la relajación de los antagonistas. En el caso de la EM, las placas pueden inhibir el control supraespinal de la actividad refleja medular, siendo responsables del deterioro de los movimientos de los músculos de las extremidades [5]. Desde el punto de vista exploratorio, se caracteriza por hipertonía de los movimientos pasivos (velocidad-dependientes) de las articulaciones e hiperreflexia (incluido clono). Puede asociarse o no debilidad, falta de destreza, incapacidad para producir movimientos aislados [6], o espasmos musculares dolorosos [7]. En casos graves puede complicarse con úlceras cutáneas, contracturas fibrosas y dificultades para la higiene personal y la sedestación [2]. El tratamiento de la espasticidad debe valorarse teniendo en cuenta sobre todo la asociación de debilidad, la presencia de síntomas cerebelosos y de contracturas articulares fijas. Simultáneamente, deben corregirse situaciones que pueden incrementarla como distensiones vesicales o intestinales, infecciones urinarias, irritaciones cutáneas, alteraciones de la temperatura [2], contracturas, estímulos sensoriales (incluso el uso de ropa ajustada), catéteres urinarios [8] o fármacos como el interferón-β [9]. Sin embargo, a menudo es necesario el uso de tratamiento farmacológico, a pesar de que los efectos secundarios pueden limitar su utilidad [10]. Están indicados preferentemente en pacientes ambulatorios sin debilidad importante de los flexores de la cadera, en los espasmos dolorosos, y para facilitar los cuidados personales (cateterización intermitente, higiene personal, etc.) [8]. Los fármacos más usados en el tratamiento de la espasticidad, con efectividad variable, están reflejados en la tabla I. Para mejorar su tolerancia se recomienda comenzar con dosis bajas e ir incrementándolas lentamente, maximizar la dosis del descanso nocturno, e incluso usar bajas dosis de dos fármacos en lugar de altas de uno solo. Deben vigilarse los efectos secundarios en la función cognitiva, el lenguaje, la deglución y en la función respiratoria. El baclofeno es uno de los fármacos más empleados en el tratamiento de la espasticidad en la EM [1,5,6]. Actúa como agonista de los receptores del grupo B del principal neurotransmisor inhibidor en la médula espinal, el ácido γ-aminobutírico (GABA). Inhibe la liberación de calcio en las terminales presinápticas, disminuye los neurotransmisores excitadores y suprime la transmisión mono y polisináptica [11,12]. La dosis oral habitual es entre 40 y 80 mg/día repartidos en tres o cuatro tomas; es raro que se tolere más de 120 mg/día. Se recomienda comenzar con 5 mg, dos o tres veces al día, e ir incrementando 5 mg cada tres días [2,8,13]. Los efectos secundarios más frecuentes son el incremento de la debilidad, sedación, depresión respiratoria, náuseas, vértigo, confusión y aumento de las transaminasas [14]. En los pacientes con insuficiencia renal puede ser necesario ajustar la dosis. Su suspensión brusca puede producir agitación, ideación paranoide y crisis epilépticas [7,13,15]. El uso de baclofeno intratecal representa una alternativa razonable para pacientes con espasticidad grave y que no responden 1142 al resto de opciones terapéuticas. Se puede conseguir una mejoría significativa en los espasmos musculares dolorosos y facilitar la realización de los cuidados de enfermería. Los criterios de selección para dicho tratamiento figuran en la tabla II [16]. Antes del tratamiento con baclofeno intratecal se deben realizar test con dosis crecientes para ver el efecto individualizado. Generalmente se inicia con 25 µg en bolo a través de punción lumbar (Figura). Si se confirman resultados positivos, la aplicación continua del fármaco se realiza mediante la implantación de un reservorio subcutáneo, generalmente colocado en la pared abdominal y conectado al espacio intratecal [17]. La dosis habitual es de 100-400 µg/día; con ella un 95% de los pacientes experimentan una disminución o desaparición de la espasticidad [18]. Ocasionalmente, su uso prolongado disminuye el tono muscular después de la suspensión del tratamiento [6]. Los efectos secundarios sistémicos son menores que con la administración oral [19], aunque pueden ocurrir sedación y depresión respiratoria [14]. Se deben tener especiales precauciones en pacientes con debilidad, bloqueo de LCR, síntomas o signos bulbares, insuficiente masa muscular para colocación de la bomba de infusión o déficit mental o cognitivo [16]. Las complicaciones técnicas son la mala función de la bomba, problemas relacionados con el catéter (desplazamiento, ruptura, torsión), inflamación local y meningitis [8]. En la actualidad su uso está limitado por el coste de implantación y el mantenimiento del sistema; sin embargo, si su indicación es correcta, el procedimiento puede resultar más económico a la larga para los sistemas públicos de salud que las complicaciones de la espasticidad [20]. Con frecuencia es útil, al inicio del tratamiento, la reeducación de la marcha mediante rehabilitación. Recientemente, se ha introducido la tizanidina como agente antiespástico [21]. Es un derivado imidazólico relacionado con la clonidina. Actúa por estimulación de los receptores adrenérgicos α2 en la médula espinal, produciendo una disminución de la liberación de aminoácidos excitadores como el glutamato y de la sustancia P [22,23]. Este mecanismo de acción puede explicar su efecto analgésico no opioide, la disminución de los reflejos flexores y de los espasmos [8]. Por este motivo tiene una indicación específica en los espasmos paroxísticos [14]. Los efectos secundarios más frecuentes son sedación, mareo e hipotensión ortostática. La debilidad es infrecuente. El dantroleno sódico, actualmente en desuso, actúa a nivel periférico en el mecanismo de excitación-contracción, al disminuir la liberación de calcio en el retículo sarcoplásmico de la fibra muscular [14]. Es muy eficaz para reducir la espasticidad, pero no suele ser bien tolerado, ni de fácil manejo en pacientes ambulatorios. Produce debilidad muscular y respiratoria, sedación, delirio y hepatotoxicidad (sobre todo en mujeres y mayores de 35 años) [2,6]. Las dosis recomendadas son de 25-100 mg tres o cuatro veces al día. La dosis de 25-50 mg/día puede ser de utilidad para aliviar el dolor dorsal nocturno secundario a rigidez axial [2]. Las benzodiacepinas (diacepam, clonacepam y tetracepam) reducen la espasticidad al activar los receptores del GABA del SNC. De esta manera, incrementan la inhibición presináptica espinal y reducen la excitabilidad espontánea de las neuronas del tronco, las cuales influyen sobre la actividad medular. Sin embargo, su uso se ve limitado por la dependencia y la tolerancia que producen y por sus efectos secundarios como debilidad, mareo, alteraciones de la memoria, trastornos del sueño, ataxia y confusión [7,14]. La ciproheptadina es un agente antiserotoninérgico que puede ser eficaz en el tratamiento de la espasticidad en la EM y es bien REV NEUROL 2002; 35 (12): 1141-1153 ESCLEROSIS MÚLTIPLE Tabla I. Fármacos más empleados en el tratamiento sintomático en EM. Indicación Temblor Principio activo Acetazolamida Nombre comercial Edemox ® ® Presentación Dosis Comprimidos 250 mg Vía oral: 125-750 mg/día Disinergia vesical Alfuzosina Benestan Benestan Retard® Comprimidos 2,5 mg Comprimidos 5 mg Vía oral: 2,5 mg/8 h Vía oral: 5 mg/12 h Fatiga Amantadina Amantadine® Comprimidos 100 mg Vía oral: 100-300 mg/día Dolor agudo y crónico. Alteraciones afectivas y emocionales Amitriptilina Tryptizol® Deprelio® Comprimidos 10, 25, 75 y 100 mg Cápsulas 25 mg Vía oral: 25-100 mg/día Espasticidad. Nistagmo. Neuralgia del trigémino Baclofeno Lioresal® Comprimidos 10 y 25 mg Ampollas 0,05 mg/mL, 10 mg/20 mL, 10 mg/5 mL Vía oral: 5-120 mg/día Intratecal: 100-400 µg/día Espasticidad. Neuralgia del trigémino. Dolor Carbamacepina Tegretol® Comprimidos 200 y 400 mg Vía oral: 200-1.200 mg/día Espasticidad Ciproheptadina Periactín® Comprimidos 4 mg Vía oral: 8-32 mg/día ® Espasticidad. Nistagmo. Temblor. Vértigo. Dolor Clonacepam Rivotril Comprimidos 0,5 y 2 mg Gotas 2,5 mg/mL Ampollas 1 mg/mL Vía oral: 0,5-20 mg/día Vértigo Clorpromacina Largactil® Comprimidos 25 y 100 mg Gotas 40 mg/mL Ampollas 25 mg/5 mL Vía oral: 25 mg/8 h Vía parenteral: 25-50 mg/6-8 h Urgencia miccional, incontinencia Cloruro de trospio Uraplex® Comprimidos 20 mg Vía oral: 20 mg/12 h Nicturia Desmopresina Minurín® Gotas 10 mg/dosis (0,1 mL= 10 mg) Aerosol 10 µg/dosis Comprimidos 0,2 mg 0,1-0,2 mL/12-24 h 10-20 µg/24 h 0,1-0,2 mg/día en dos o tres dosis Espasticidad Diacepam Diazepam Leo® Diazepam Prodes® Valium Roche® Comprimidos 2 y 5 mg Comprimidos 2,5, 5, 10, 25 mg Comprimidos 5 y 10 mg Vía oral: 10-20 mg/día Espasticidad. Neuralgia del trigémino. Dolor Difenilhidantoína Neosidantoína® Vía oral: 100-300 mg/día Epanutin Comprimidos 100 mg Ampollas 250 mg Cápsulas 100 mg Urgencia miccional, incontinencia Flavoxato Uronid® Comprimidos 200 mg Vía oral: 200 mg/8-12 h Alteraciones afectivas y emocionales Fluoxetina Adofen® Cápsulas 20 mg Comprimidos dispersables 20 mg Solución oral 20 mg/5 mL Cápsulas 20 mg Comprimidos disp. 20 mg Solución oral 20 mg/5 mL Sobres 20 mg Cápsulas 20 mg Comprimidos disp. 20 mg Solución oral 20 mg/5 mL Vía oral: 10-20 mg/día Comprimidos 300 y 400 mg Vía oral: 1.200 mg/día ® Prozac® Reneuron® Espasticidad Gabapentina Neurontin® tolerada [1,24,25]. Se ha utilizado sobre todo en el trauma medular [14]. Los efectos secundarios más frecuentes son debilidad, sedación y aumento de peso. Otro fármaco, que puede ser beneficioso para la espasticidad en esta enfermedad, es la clonidina. Actúa sobre las monoaminas, bloqueando los receptores α2 [26] e inhibe los reflejos polisinápticos responsables de los espasmos REV NEUROL 2002; 35 (12): 1141-1153 flexores. Suele utilizarse como terapia adyuvante, asociada a ciproheptadina o baclofeno. El principal efecto secundario, que limita su uso, es la hipotensión postural [2]. Se ha descrito que la clonidina y el baclofeno asociados y administrados intratecalmente pueden mejorar no sólo la espasticidad, sino también el dolor neuropático y el vaciado vesical [27]. 1143 L. AYUSO-PERALTA, ET AL Tabla I. Fármacos más empleados en el tratamiento sintomático en EM (cont.). Indicación Principio activo Nombre comercial ® Presentación Dosis Comprimidos 300 y 400 mg Vía oral: 1.200 mg/día Espasticidad. Temblor. Neuralgia del trigémino. Dolor Gabapentina Neurontin Temblor. Vértigo Hidroxicina Atarax® Comprimidos 25 mg Solución 10 mg/5 mL Vía oral: 150-400 mg/día Incontinencia urinaria Imipramina Tofranil® Comprimidos 10 y 25 mg Vía oral: 10-75 mg/día Temblor. Nistagmo Isoniacida Cemidon® o Cemidon B6 Comprimidos 50, 150 o 300 mg. Asocia 25 mg de piridoxina Vía oral: 300-1.200 mg/día Estreñimiento Lactulosa Belmalax® Duphalac® Solución 3,33 g/5 mL Solución 10 g/15 mL Sobres 10 g/sobre Vía oral: 15 mL/12 h Vía oral: 15-30 mL/día Vía oral: 20 g/día Incontinencia fecal Loperamida Fortasec® Vía oral 2 mg o 10 mL después de cada deposición Salvacolina® Cápsulas 2 mg Solución 0,2 mg/mL Comprimidos 2 mg Suspensión 1 mg/5 mL Fatiga Metilfenidato Rubifen® Comprimidos 10 mg Vía oral: 10-30 mg/día Fatiga Modafinilo Modiodal® Comprimidos 100 mg Vía oral: 200-400 mg/día Comprimidos 4 y 8 mg Inyectable 4 mg Intravenoso 8 mg Vía oral intramuscular Vía intravenosa: 4-8 mg/8-12 h ® Temblor. Vértigo Ondasetrón Zofran Urgencia miccional, incontinencia Oxibutinina Ditropan® Comprimidos 5 mg Vía oral: 2,5-5 mg/6-8 h Fatiga Pemolina Dynamin® (Asociación) Cylert® Grageas 10 mg Vía oral: 10-30 mg/día Comprimidos 18,75 mg Vía oral: 18,75-75 mg/día Comprimido 250 mg Vía oral: 125-750 mg/día Temblor Primidona ® Mysoline ® Temblor. Alteraciones de los movimientos oculares Propanolol Sumial Sumial Retard® Comprimidos 10 y 40 mg Cápsulas 160 mg Vía oral: 40-160 mg/día Disfunción eréctil Sildenafilo Viagra® Comprimidos 25, 50, 100 mg Vía oral: 25-100 mg/día Urgencia miccional, incontinencia Tolterodina Detrusitol® Comprimidos 2 mg Vía oral: 2 mg/12 h Espasticidad Tetracepam Myolastan® Comprimidos 50 mg Vía oral: 25-150 mg/día Sirdalud Comprimidos 2 y 4 mg Vía oral: 12-36 mg/día ® Comprimidos 2 y 5 mg Vía oral: 4-10 mg/día Espasticidad Temblor. Nistagmo Tizanidina Trihexifenidilo ® Artane Se están empleando otros fármacos en el tratamiento de la espasticidad en la EM con resultados variables. Se ha sugerido que la gabapentina (400 mg tres veces al día) podría ser de utilidad [28,29], aunque los estudios son muy limitados. La L-treonina es un aminoácido que actúa potenciando la inhibición glicinérgica del arco reflejo motor espinal. La dosis recomendada es de 500-100 mg/día [14]. La carbamacepina y la difenilhidantoína pueden reducir los espasmos musculares que se asocian a la espasticidad [2]. Los corticosteroides intravenosos en altas dosis reducen la espasticidad en las formas secundarias progresivas, pero el efecto es de escasa duración y disminuye con los sucesivos tratamientos [7]. Otros fármacos ensayados en diferentes estudios son proga- 1144 bide –retirado recientemente por hepatotoxicidad–, vigabatrina –no aconsejable por producir defectos visuales campimétricos–, mexiletina, memantina e ivermectina [4,8,30-33]. Una alternativa al tratamiento oral e intratecal de la espasticidad es la inyección local periódica de toxina botulínica A [34]. Produce una debilidad dosisdependiente, al interferir en la liberación de acetilcolina en la placa motora. Se trata de un procedimiento seguro y puede ser útil en los raros casos de espasticidad focal, fundamentalmente en adductores de extremidades inferiores y en los espasmos [2,8,35,36]. Sin embargo, la respuesta al tratamiento en el caso de EM suele ser menor que en otras patologías neurológicas (ictus, parálisis cerebral infantil, etc.) [37]. REV NEUROL 2002; 35 (12): 1141-1153 ESCLEROSIS MÚLTIPLE Tabla II. Criterios de selección de pacientes para tratamiento de la espasticidad con baclofeno intratecal [16]. 1.er ía µg Enfermedad crónica de causa conocida (esclerosis múltiple, trauma espinal,...) en fase estable No respuesta + respuesta 2.º día µg No respuesta Implantación 3.er día Bolo: 75 µg + respuesta Implantación + respuesta Implantación No respuesta 4.º día Bolo: 100 µg + respuesta Paciente no seleccionable para implantación Espasticidad grave y discapacitante (Ashworth ± 3) que interfiere en la movilidad, las actividades de la vida diaria y/o cuidados de enfermería Espasticidad refractaria a tratamiento oral o intolerancia a fármacos orales Espasmos dolorosos Implantación Posibilidad de valoración y seguimiento por un equipo de salud multidisciplinar Figura. Test de dosificación de baclofeno intratecal [16]. Capacidad de autorizar un consentimiento informado y posibilidad de realizar un seguimiento para el mantenimiento del sistema de infusión Respuesta positiva al test de baclofeno intratecal En casos refractarios a tratamiento médico se emplean distintos procedimientos neuroquirúrgicos y ortopédicos [7]. En su mayoría están dirigidos a interrumpir el arco reflejo, como la rizotomía anterior o posterior, la destrucción selectiva de la zona de entrada de la raíz posterior o el bloqueo del nervio periférico con alcohol o fenol. En general no son bien aceptados por la posibilidad de secuelas graves, tales como úlceras cutáneas, debido a pérdida sensorial en los correspondientes dermatomas [38]. En caso de deformidades articulares focales fijas se pueden realizar tenotomías. Hay que considerar que todos estos procedimientos son irreversibles. Recientemente, se ha sugerido que la estimulación magnética puede mejorar la espasticidad. Sin embargo, es necesario la realización de un mayor número de estudios para confirmar estos datos [39]. TEMBLOR Y ATAXIA El temblor y la incoordinación son frecuentes en la EM. Se presentan en aproximadamente un 75% de los enfermos en algún momento de la evolución de la enfermedad. Son muy discapacitantes y de difícil manejo al no existir un tratamiento eficaz. El mecanismo de producción de la incoordinación es difícil de precisar; probablemente sea multifactorial y esté producida por alteración cerebelosa y sus conexiones, debilidad, espasticidad, vértigo y por la pérdida sensorial propioceptiva que con frecuencia se asocian [7]. El temblor de acción o de intención es el más frecuente en los pacientes, seguido por el postural [40]. En su producción se implican la desmielinización de las conexiones entre el núcleo dentado y el tálamo contralateral, en el pedúnculo cerebeloso superior o el núcleo rojo [7]. En el tratamiento del temblor se han propuesto numerosos fármacos (Tabla I), empleados muchos de ellos en el manejo del temblor esencial, fundamentados en ensayos clínicos escasos y con resultados poco alentadores. Uno de los fármacos más empleados es el propanolol oral en dosis de 20-40 mg dos o tres veces al día [1,7,13]. Otros betabloqueadores empleados son metoprolol, nadolol y sotalol [7]. La isoniacida se considera de escaso beneficio. Se ha sugerido que podría ser de alguna utilidad en caso de temblor postural con componente intencional y no en el intencional puro [41]. Su mecanismo de acción es desconocido, pero se cree que puede estar relacionado con un incremento del GABA, a través de la inhibición de la GABAaminotransferasa. Se emplea en dosis altas, más de 1.200 mg/día, y se recomienda asociarla a piridoxina (50-100 mg). Se suele co- REV NEUROL 2002; 35 (12): 1141-1153 menzar gradualmente con 300 mg al día para alcanzar la dosis total en aproximadamente 15 días. No siempre es bien tolerada, y produce alteraciones gastrointestinales, diarrea, hepatotoxicidad y polineuropatía [8]. La primidona, comenzando en bajas dosis e incrementando lentamente, puede resultar útil para disminuir la amplitud del temblor. El clonacepam es considerado de elección, según algunos autores, para el temblor cerebeloso [6]. Igual que el anterior, el principal efecto secundario es la sedación. La glutetimida, un derivado de la piperidinediona, y la gabapentina podrían ser de utilidad según estudios recientes [14,42], pero no se emplean de forma habitual. Estudios preliminares con ondasetrón, un antagonista de los receptores HT3 de la serotonina, oral e intravenoso, han mostrado que puede reducir el temblor [43], aunque el beneficio suele ser escaso y los efectos secundarios, como el estreñimiento agudo y el coste, pueden limitar su uso [44,45]. Al tetrahidrocanabinol, de momento en investigación, se le ha atribuido un efecto simultáneo antiespástico y antiatáxico. Otros fármacos empleados son carbamacepina, hidroxicina, trihexifenidilo y acetazolamida. En este momento está en investigación el empleo de fármacos antiepilépticos de nueva generación y antagonistas del calcio [46]. La fisioterapia no está indicada para el tratamiento del temblor y la incoordinación. Sin embargo, el empleo de ortesis y otros dispositivos pueden emplearse con resultados aceptables. Así, el uso de muñequeras lastradas, con pesos de 400-600 g, pueden aumentar la inercia del movimiento y disminuir hasta el 60% por este mecanismo, el temblor [47]. En caso de temblor cefálico muy intenso se pueden utilizar sillas de ruedas con soporte rígido para inmovilizar la cabeza. Igualmente, el empleo de objetos básicos para la vida diaria adaptados, más pesados y con agarraderos sobredimensionados, pueden facilitar su manejo por los enfermos. En fase experimental se encuentran ortesis de resistencia variable, que integran sensores de movimiento controlados electrónicamente y eliminan las oscilaciones del temblor. En el caso, no infrecuente, de fracaso con las medidas anteriores, determinados pacientes pueden ser candidatos a tratamiento neuroquirúrgico. Los procedimientos quirúrgicos se realizan en el tálamo y son la talamotomía estereotáxica y la estimulación talámica. En la talamotomía la diana es la porción medial del núcleo ventrolateral del tálamo contralateral al temblor. Sus indicaciones serían el temblor de acción unilateral, sin 1145 L. AYUSO-PERALTA, ET AL temblor ortostático y la disinergia cerebelosa. El porcentaje de pacientes que mejoran del temblor es del 25-80% según las distintas series. Las complicaciones son frecuentes (30%), e incluyen empeoramiento de la ataxia, disartria, hemiplejía, trastornos de la mirada, confusión, alteraciones esfinterianas y hematoma subdural. El riesgo de que la cirugía desencadene un brote es de un 10%. El procedimiento bilateral, que puede inducir alteraciones del lenguaje y la atrofia cerebral secundaria a pérdida axonal, no infrecuente en estos pacientes, pueden incrementar el riesgo de complicaciones. La estimulación talámica emplea dispositivos con mono o multielectrodos implantados en el núcleo ventrolateral o en las áreas adyacentes (determinadas por estimulación electrofisiológica durante la intervención) contralaterales al temblor, conectados a un estimulador que se coloca en la región supraclavicular [48-50]. En general, comparadas ambas técnicas, se prefiere la estimulación en términos de complicaciones y resultados. Las indicaciones serían el mismo tipo de pacientes para ambas, quizá con preferencia por la última en caso de afectación bilateral. En un tercio de los pacientes se produce tolerancia con disminución de la eficacia tras estimulación crónica. Por otra parte, en la actualidad su alto coste podría ser un factor limitante para su uso [14]. NISTAGMO Y VÉRTIGO La presencia de movimientos oculares anormales son un síntoma frecuente de la EM: todos los tipos de nistagmos adquiridos y las alteraciones en los movimientos sacádicos oculares pueden ocurrir en esta enfermedad [51]. Las alteraciones en los movimientos oculares pueden interferir la visión al producir un excesivo arrastre de la imagen en la retina o un desplazamiento de los objetos de interés fuera de la fóvea. En la actualidad se conocen mejor los mecanismos fisiopatológicos y neurofarmacológicos de los trastornos de los movimientos oculares, lo que está favoreciendo el desarrollo de nuevas estrategias terapéuticas, farmacológicas (Tabla I) o técnicas, mediante dispositivos ópticos [52]. Así, el nistagmo alternante periódico responde al baclofeno, el nistagmo vertical, hacia arriba o hacia abajo, puede resolverse con clonacepam, baclofeno, escopolamina o gabapentina, y el nistagmo pendular con anticolinérgicos como trihexifenidilo, barbitúricos, isoniacida y memantina [14,53]. Las alteraciones de los movimientos oculares sacádicos se han tratado exitosamente con clonacepam, fenobarbitona, anfetaminas o propanolol. El empleo de determinados dispositivos, como prismas o sistemas ópticos, pueden estabilizar la imagen en la retina y reducir así la oscilopsia [14]. Por otra parte, la inyección de toxina botulínica selectivamente en los músculos extraoculares puede disminuir la amplitud del nistagmo pendular [54]. El vértigo intenso puede responder a antieméticos como dimenhidrinato, clorpromacina, benzodiacepinas (clonacepam, loracepam u oxacepam) u ondasetrón [14]. Este último, en dosis de 4-8 mg intravenoso cada 8-12 horas, es altamente eficaz, ya que los síntomas desaparecen en 1 o 2 días [55]. De más difícil manejo es el mareo inespecífico o vértigo leve continuo, que con frecuencia refieren los pacientes. En muchas ocasiones la hipotensión ortostática y los propios fármacos pueden ser los causantes. La hipotensión postural puede requerir tratamiento con tabletas de sal, fludrocortisona o midodrine [56]. También, las benzodiacepinas, hidroxicina, difenhidramina, meclicina o escopolamina, pueden ayudar a hacer tolerables estos síntomas [14]. 1146 DOLOR El dolor es un síntoma frecuente en la EM, presentándose en un 55% de los pacientes [57]. El sexo femenino y la edad mayor de 40 años aumentan el riesgo de padecerlo. Es muy discapacitante y causa un importante impacto en el paciente, particularmente en términos de salud mental y social [58]. Puede existir interacción con otros síntomas de la enfermedad, como por ejemplo la disfunción cognitiva que puede alterar la percepción del mismo y la manera en la que es descrito, y otros síntomas como la espasticidad pueden contribuir directamente en su producción [59]. Se presenta como consecuencia directa de lesiones desmielinizantes en las vías ascendentes o descendentes, que controlan la transmisión y regulación del estímulo doloroso, o como consecuencia de otro daño producido por la enfermedad [14]. El dolor se puede clasificar en agudo, paroxístico, subagudo o crónico. De los síndromes dolorosos agudos, el más común es el relacionado con la neuritis óptica, que característicamente aparece o se incrementa con los movimientos del globo ocular. El tratamiento de elección son los corticoides. La neuralgia del trigémino se considera un síntoma paroxístico frecuente. Afecta a un 1-2% de los pacientes, a veces de forma bilateral, en algún momento de la enfermedad [60]. Su producción se relaciona con fenómenos de transmisión efáctica transversal de los estímulos dolorosos [61]. Generalmente responde bien a carbamacepina (100-200 mg orales dos o tres veces al día), difenilhidantoína (100-200 mg orales dos o tres veces al día) o baclofeno (10-30 mg/día oral), aunque en casos resistentes se ha descrito algún beneficio con misoprostol (análogo de prostaglandina E-1) [61] y gabapentina, sola o asociada a lamotrigina o carbamacepina [62,63]. En casos refractarios a tratamiento médico se puede recurrir a técnicas quirúrgicas como la termocoagulación, la instilación de glicerol o la rizotomía del nervio trigémino. Sin embargo, la descompresión microvascular no está indicada [14]. Otros síntomas dolorosos agudos, como las disestesias dolorosas o el signo de Lhermitte, responden generalmente a carbamacepina, clonacepam o amitriptilina [57]. El dolor subagudo suele ser síntoma de algún evento intercurrente o inmovilización prolongada. Las causas más comunes son retención urinaria, infección de úlcera cutánea, cambios degenerativos vertebrales por osteoporosis o por efecto secundario de los corticoides, parálisis de los nervios periféricos. El tratamiento depende de la causa (analgésicos, rehabilitación, calcitonina, calcio, antibióticos, etc.) [14]. El dolor crónico es más común, más complejo y más difícil de manejar que el resto de síndromes dolorosos en la EM. Las disestesias dolorosas de extremidades, referidas como sensación quemante en los miembros inferiores o en los pies, más raramente en brazos y tronco, son las más frecuentes. El dolor suele incrementarse por la noche o después de un esfuerzo [13,14]. Su mecanismo de producción está en relación con una hiperexcitabilidad generada por conducción efáctica en los fascículos espinotalámicos o cordón posterior desmielinizados [64]. El tratamiento de elección son los antidepresivos tricíclicos, como la amitriptilina en dosis de 25-75 mg/día, que es eficaz en un 40-66% de los casos [65]. Otras alternativas utilizadas son la carbamacepina o la difenilhidantoína, solas o asociadas a la amitriptilina, y recientemente se ha descrito beneficio con gabapentina [66,67]. El dolor de espalda crónico es otro problema frecuente en la EM y suele ser causado por alteraciones posturales inducidas por la debilidad y la espasticidad. La fisioterapia y los AINE pueden ayudar a aliviar los síntomas. Es importante vigilar la presencia de signos suges- REV NEUROL 2002; 35 (12): 1141-1153 ESCLEROSIS MÚLTIPLE tivos de radiculopatía, por la elevada frecuencia de patología degenerativa discal asociada en estos pacientes [57]. En casos de dolor crónico resistente a tratamiento médico puede resultar eficaz la electroestimulación neurogénica transcutánea (TENS), o implantes quirúrgicos de estimuladores eléctricos en la columna dorsal [7,65]. ALTERACIONES COGNITIVAS Y PSIQUIÁTRICAS Las alteraciones cognitivas han sido siempre reconocidas en la EM, pero es en la actualidad cuando están siendo caracterizadas por la repercusión funcional que tienen sobre los pacientes [68]. Su frecuencia oscila entre un 40-65% de los casos [69,70]. Se afectan preferentemente la atención [69,71], la memoria [71-73], la nominación [74], la percepción visuoespacial [69,75] y se produce una ralentización del procesamiento mental [76,77]. Existen muy pocos estudios específicos que evalúen tratamientos para el deterioro cognitivo en esta patología y hasta ahora no se han encontrado fármacos claramente eficaces. Estudios con amantadina, pemolina, 4-aminopiridina y acetato de glatiramer no han demostrado efecto en la función cognitiva comparados con placebo [78-80]. En algunos trabajos, utilizando series muy reducidas, el empleo de campos electromagnéticos, la fisostigmina intravenosa y la lecitina, han demostrado un leve beneficio en determinados aspectos cognitivos [81,82]. Por otra parte, un estudio reciente, cuyos resultados deben interpretarse cautelosamente por su metodología, demuestra mejoría de la memoria visual tras tratamiento con interferón-β 1b [83], y Fischer et al [84] describen un beneficio significativo en el procesamiento de la información y las capacidades de memoria y aprendizaje con interferón-β 1a. Asimismo, Greene et al [85], en un estudio abierto, sugieren que el inhibidor reversible de la acetilcolinesterasa, donecepilo, mejora varios aspectos cognitivos, entre ellos la atención, la memoria, las funciones ejecutivas y diferentes esferas del comportamiento. Los trastornos afectivos bipolares, la ansiedad y la depresión son más frecuentes en la EM que en la población general [86,87]. Se desconoce si estas alteraciones son debidas a la enfermedad, a su tratamiento (interferón-β, corticoides) o al estrés psicológico asociado a la misma, aunque parecen ser más comunes en pacientes con afectación cerebral que en aquellos con lesiones medulares, lo que podría sugerir una etiología orgánica [88]. El tratamiento de la depresión en estos pacientes es similar al resto de la población. La amitriptilina en dosis inicial de 25 mg con aumentos semanales de 25 mg hasta 75-100 mg de mantenimiento puede ser una buena opción, además sus efectos anticolinérgicos pueden ser beneficiosos en caso de vejiga espástica. En caso de no tolerar estos efectos se puede usar nortriptilina (100-150 mg al acostarse) o desipramina [6]. Los pacientes con fatiga tienden a tolerar mal este fármaco si bien pueden responder a fluoxetina (10-20 mg/día) [13]. Aproximadamente un 10% de los pacientes presentan expresiones emocionales inapropiadas, como risa o llanto patológico, que en ocasiones pueden representar un verdadero problema [89]. En general, suelen responder a amitriptilina (10-75 mg/día) o fluoxetina [13]. TRASTORNOS DEL SUEÑO Las alteraciones del sueño son infradiagnosticadas en la EM, ya que pueden ser hasta tres veces más frecuentes en los enfermos que en el resto de la población [90]. Algunos pacientes presentan REV NEUROL 2002; 35 (12): 1141-1153 más somnolencia diurna, latencias del sueño mayores y más despertares nocturnos [91]. Por otra parte, en algunos casos, estudios polisomnográficos han demostrado la presencia de un incremento de los movimientos periódicos nocturnos de miembros inferiores y de hallazgos sugestivos de apnea del sueño, obstructiva, central y de narcolepsia [2]. Las causas de estas alteraciones son múltiples. Hay que considerar efectos secundarios de medicación, alteraciones psicopatológicas como ansiedad, depresión, agitación, psicosis, y problemas derivados de las secuelas de la enfermedad como disfunción vesical, espasmos, etc. [2]. Los movimientos periódicos de extremidades durante el sueño, normalmente dorsiflexión del talón o flexión de rodilla y cadera alternativos, o en ambas extremidades inferiores simultáneamente, tienen una duración de 0,5-5 segundos, se presentan con una periodicidad de cada 4 a 90 segundos y pueden ser una causa de insomnio y de hipersomnia diurna [92]. Si se sospecha o se asocia fatiga refractaria a tratamiento, se deben realizar estudios polisomnográficos. Una vez identificado el problema se puede instaurar tratamiento comenzando con levodopa (50 mg/día al acostarse, se puede incrementar si es necesario). Otras alternativas serían bromocriptina, pergolida, trazodona, clonacepam, valproato o gabapentina, así como reducir la cafeína y la nicotina [2]. La apnea obstructiva aparece en pacientes con disfunción bulbar y se asocia a ronquido nocturno, sueño no reparador con hipersomnia diurna y cefaleas matutinas. La apnea central igualmente se puede relacionar con lesiones en el bulbo o en la médula cervical. El tratamiento con oxigenoterapia continua a presión positiva puede ser necesario. DISFUNCIÓN URINARIA Varias manifestaciones clínicas de los pacientes con EM causan discapacidad permanente. Los trastornos vesicales son uno de ellos. Aparecen en el 70-80% de los pacientes a lo largo de la evolución de la enfermedad. Suponen un problema higiénico y su impacto sociolaboral nos da una idea de la magnitud y de la importancia de este problema [93-96]. Aunque los síntomas urinarios en los pacientes con EM pueden ser transitorios en relación con un brote, lo habitual es que sean permanentes; por lo general se asocian a signos piramidales de miembros inferiores y a altos grados de discapacidad en la EDSS [97]. Debido a la escasa correlación entre la fisiopatología y los síntomas clínicos [98,99], para un mejor manejo de estos problemas se recomienda la realización de estudios urodinámicos. Éstos cuantifican la velocidad del flujo miccional, la presión intravesical y la intraabdominal, la relación presión/flujo durante la micción y, mediante la electromiografía, el registro de la actividad eléctrica de diferentes estructuras implicadas en la función vesicourinaria. Control neural de la función urinaria La micción se produce cuando la vejiga ha alcanzado su capacidad fisiológica y la persona se encuentra en lugar apropiado. Incluye dos fases: fase de llenado y fase de vaciado. La fase de llenado es inconsciente y, durante la misma, la uretra se mantiene cerrada mediante la contracción del esfínter externo e interno para impedir el escape de la orina al exterior. La fase de vaciado es consciente, el esfínter externo de la uretra se relaja voluntariamente y se inicia la contracción del detrusor. Simultáneamente se abre de forma involuntaria el cuello vesical o esfínter interno, produciéndose el vaciado de la orina. La frecuencia de las miccio- 1147 L. AYUSO-PERALTA, ET AL nes depende de la cantidad de líquidos ingeridos, generalmente se produce cada 3-4 horas. La micción dura 2-3 minutos. Los trastornos urinarios se deben a la interrupción de las vías de conexión entre el córtex, los centros pontinos de la micción y las raíces sacras, cuyos núcleos metaméricos se encuentran a nivel de S2-S4 (correspondientes con el nivel vertebral D12-L1). Los estímulos aferentes esteroceptivos (dolor, temperatura, tacto), procedentes de la mucosa vesical y uretral, ascienden por los haces espinotalámicos hasta el tálamo y los estímulos propioceptivos (presión), procedentes de los receptores del detrusor de la vejiga y del periné, ascienden por los cordones posteriores. En el centro pontino de la micción (coordinador del almacenamiento y de la eliminación de la orina) se integran las conexiones desde el cerebelo, ganglios basales, córtex frontal mesial, hipotálamo y sistema límbico. También el cerebelo recibe aferencias propioceptivas del suelo de la pelvis y del detrusor, y parece que su función es moduladora. Los ganglios basales realizan una función inhibitoria del reflejo miccional, a la vez que el tálamo y el sistema límbico conectan entre sí, integran las aferencias y eferencias en la esfera emocional. Las áreas del córtex sensitivomotor también coordinan el control voluntario del reflejo de la micción. Es decir, en el comienzo y en el mantenimiento de la micción en las personas normales participan estructuras corticales y subcorticales [100,101]. En la EM puede haber desmielinización y lesión axonal subsecuente, en varios lugares del SNC, afectando a las vías implicadas en la función urinaria. Los síntomas más comunes son aumento de la frecuencia y urgencia urinaria, y en menor proporción dificultades para iniciar la micción, retención, vacilación, goteo urinario y sensación de micción incompleta. Hay que considerar que en condiciones normales pueden existir síntomas urinarios en personas sanas. Se estima que el 25% de las mujeres normales entre los 30 y 50 años tienen alguna dificultad para la contención de la orina, especialmente durante la actividad física, al estornudar, al toser y al reír. Esto se acentúa en obesas, multíparas, mujeres sometidas a cirugía vaginal y después de la posmenopausia. En los varones hay que tener en cuenta los problemas prostáticos. En la EM puede darse detrusor hiper o arrefléxico, esfínteres hiperactivos o hipoactivos, falta de coordinación entre esfínteres y detrusor, o ausencia de sensibilidad vesical (en este caso vejiga atónica y vaciado por rebosamiento). Un 70-80% de los problemas urinarios se deben a hiperreflexia del detrusor y un 30% a disinergia vesicoesfinteriana. Es importante medir el volumen residual, ya que un volumen residual persistente actúa como un estímulo que induce hiperreflexia y facilita las infecciones urinarias. Debe cuantificarse el volumen residual tras la micción y tras el efecto de determinados fármacos para ver su efecto. Si se sobrepasan los 100 mL es patológico. Tratamiento de los problemas urinarios El objetivo del tratamiento es aliviar los síntomas derivados de la disfunción urinaria, prevenir y tratar las infecciones del tracto urinario, eliminar sus factores contribuyentes y preservar la función renal. Debido a las características fluctuantes de la historia natural de la enfermedad, el tratamiento debe ser flexible e individualizado en función de la independencia funcional, capacidad intelectual, condiciones sociales y motivación. Básicamente se centran en tratamientos neurofarmacológicos y manipulaciones físicas como maniobras de Credé, cateterización intermitente (cada 4-6 horas), y uso de pañales y reservorios (en hombres con hiperreflexia del detrusor). 1148 Se debe recomendar una serie de medidas generales, como evitar determinados fármacos (antihipertensivos tales como los bloqueantes adrenérgicos), la cafeína y el alcohol, la realización de ejercicios de músculos perineales, contracción-relajación, sesiones de biofeedback supervisadas por un fisioterapeuta y de entrenamiento vesical. En casos con afectación moderada es necesario advertirles que traten de evitar orinar durante 5-10 minutos tras el deseo de orinar, que se habitúen a orinar de forma habitual cada 3 horas y a emplear técnicas de distracción [102-104]. Existen estimuladores de músculos pélvicos que aumentan el esfuerzo de las contracciones voluntarias durante la micción. Los tratamientos farmacológicos empleados en los problemas urinarios (Tabla I) son distintos según sea el síntoma predominante. La vejiga espástica se caracteriza por problemas de almacenamiento por hiperreflexia del músculo detrusor de la vejiga. Los tratamientos antiespásticos (baclofeno, diacepam) pueden mejorar el llenado vesical. Los antagonistas muscarínicos vesicales tales como la oxibutinina oral, con efectos anticolinérgicos y de acción directa sobre el músculo liso de la pared vesical, en dosis de 2,5-5 mg oral 3-4 veces día, suelen ser útiles. Sin embargo, pueden producir sequedad de boca y ojos, motivo por el que algunos pacientes abandonan el tratamiento. En un subgrupo de pacientes puede ser eficaz y segura su administración intravesical (15 mg disuelta en 15 mL de suero fisiológico). Se instilan 15-20 mL, antes de dormir o de salir al trabajo o a algún acto social [105]. La tolterodina es otro anticolinérgico; produce menos sequedad de boca y tiene un efecto terapéutico similar a la anterior en la reducción de la frecuencia de las micciones y en los episodios de incontinencia. Otros fármacos de utilidad son el cloruro de trospio (derivado de la atropina), con menos efectos secundarios que la oxibutinina, la probantelina (7,5-30 mg/día), cuyos efectos secundarios son sequedad de boca, visión borrosa, náuseas, estreñimiento, taquicardia, somnolencia y confusión, los antidepresivos tricíclicos, imipramina y nortriptilina, fundamentalmente en incontinencia de estrés, y el flavoxato. También se han utilizado la lidocaína y el verapamil. Algunos autores recomiendan la instilación intravesical de capsaicina 1-2 mM disuelta en alcohol, ya que reduce los reflejos evocados aferentes vehiculizados por las fibras C de la vejiga. Su efecto puede durar 3-6 meses. En caso de hiperreflexia del detrusor y vaciado vesical incompleto se aconseja la combinación de preparaciones de agentes antimuscarínicos con agentes bloqueantes de los canales de calcio, o combinación de anticolinérgicos y cateterización intermitente. Si no existe respuesta podría aplicarse la estimulación del nervio sacro mediante electrodos colocados en el foramen sacro (S3). Su mecanismo de acción se basa en la estimulación de los nervios somáticos eferentes y la inhibición de los reflejos vesicales en la médula espinal. En la nicturia puede ser útil, en algunos casos, el derivado sintético de la hormona antidiurética, la desmopresina intranasal [106]. Su acción se mantiene durante 6-8 horas. Se aconseja usar una vez al día por la noche, aunque también se puede indicar durante el día, cuando el paciente quiere asistir a un acto social o actividad personal, para evitar la urgencia urinaria durante dicho período. Se debe realizar determinación de iones antes de iniciar el tratamiento y repetirla si el paciente refiere malestar, cefalea o náuseas. Hay que excluir insuficiencia cardíaca o renal, diabetes, hipertensión o tratamiento concomitante para la misma. Cuando se sospecha alteración en el vaciado de la vejiga, se debe confirmar mediante sondaje tras la micción (normal <150 cm3). En algunos pacientes es útil la maniobra de Credé o masaje vesi- REV NEUROL 2002; 35 (12): 1141-1153 ESCLEROSIS MÚLTIPLE cal, aplicando presión con ambas manos de arriba abajo en la porción inferior del abdomen, estando sentado en posición para orinar. Con la cateterización intermitente, o autosondaje, se vacía más la vejiga que con el método anterior. Consiste en la inserción en la vejiga de un tubo fino y flexible, a través de la uretra, para drenar la orina. Se suele realizar cada 4-8 horas. Su utilización depende de la discapacidad física del paciente y de su actitud ante el mismo. En cualquier caso su empleo debe enseñarlo personal entrenado. Se puede utilizar un catéter de plástico que puede ser reutilizado tras lavarlo, pueden ser rígidos (Nelaton) o semirígidos (Scott). No se recomienda mantenerlos en soluciones antisépticas porque pueden causar uretrocistitis química. Estos catéteres pueden durar una semana, se cambiarán más frecuentemente si hay infección. Si no se controla con medicación ni con sondaje intermitente, se coloca una sonda permanente (Foley), siendo más frecuentes las infecciones. En los hombres, como alternativa, se puede utilizar un catéter tipo preservativo vigilando la aparición de úlceras [107]. También se han utilizado estimuladores cuyo estímulo puede ayudar a iniciar la micción y mejorar el flujo urinario y, por lo tanto, a disminuir el volumen residual posmiccional. Sólo es efectivo en pacientes con moderada discapacidad espinal (puntuación de 3 o menos en la EDSS), con preservación de la sensibilidad suprapúbica y residuo inferior a 400 mL. No es útil en vejigas disinérgicas porque la orina puede refluir al riñón. La vejiga disinérgica es difícil de tratar. Se aconseja la clonidina, la alfuzosina y los agonistas α-adrenérgicos ya que la vejiga y la uretra tienen dichos receptores. Están contraindicados en hipertensión, hipertiroidismo y arritmia cardíaca. El tratamiento con estimulación eléctrica intravesical es controvertido [108]. Algunos autores han utilizado toxina botulínica en hipertonías del esfínter externo. Las infecciones urinarias son más frecuentes en las vejigas con residuo, causadas por los cateterismos intermitentes o por el catéter continuo y en mujeres por la cortedad de la uretra. Se debe tratar siempre la bacteriuria sintomática. Igualmente, para evitar las infecciones urinarias, se recomienda tomar abundantes líquidos durante el día (6-8 vasos de agua), orinar con frecuencia y de forma completa, lavarse de adelante hacia atrás tras defecar, usar ropa interior de algodón, orinar antes y después del acto sexual y tomar zumos de naranja o vitamina C, que acidifica la orina e inhibe el crecimiento bacteriano. ALTERACIONES INTESTINALES La defecación implica una serie de acciones controladas neurológicamente que se desencadenan en respuesta a una sensación consciente de plenitud del recto y ganas de defecar. Se inicia voluntariamente aumentando la presión intraabdominal y empujando hacia abajo, causando un descenso del suelo de la pelvis. El recto se abre mediante la relajación del esfínter interno y el esfínter anal estriado externo debido al reflejo inhibitorio rectoanal. No se correlaciona estrictamente con las anomalías vesicales, las cuales suelen deberse a lesiones espinales en estos pacientes. El estreñimiento o la incontinencia fecal ocurren en el 39-73% de los pacientes con EM, dependiendo de la definición de dichos trastornos y de la selección de pacientes [109]. En ocasiones pueden coexistir ambos síntomas. El estreñimiento puede estar asociado a prolongación del tiempo del tracto del colon, o a disfunción o incoordinación del suelo pélvico. Por otra parte, fármacos como los relajantes musculares o los anticolinérgicos (oxibutinina, antidepresivos tricíclicos, etc.) pueden producir estreñimiento. REV NEUROL 2002; 35 (12): 1141-1153 Los tratamientos realizados en estos pacientes han sido empíricos y presentan una falta de soporte evidente (Tabla I). Se suele recomendar en el estreñimiento una dieta rica en fibra, bebida adecuada de líquidos, ejercicio físico, evacuación intestinal con un horario regular rutinario y mediante el uso de laxantes con lactulosa, enemas matutinos o extracción manual de heces. En casos no graves y de curso no progresivo, las técnicas de biofeedback [110] pueden ser útiles, e incluyen atención consciente de los procesos fisiológicos del cuerpo, atención hacia la función rectal y del suelo pélvico, y ejercicios encaminados a modificar y mejorar la función del suelo de la pelvis. La incontinencia fecal puede ser debida a alteraciones en el intestino, disfunción del esfínter anal, aumento del umbral de sensación rectal y, menos frecuente, a alteraciones de la sensibilidad anorrectal. Durante la contracción intestinal se pueden generar altas presiones, cuyo resultado es la urgencia y la incontinencia intestinal. Si el esfínter anal está débil, el canal anal no mantiene la presión y se pierden las heces sin poderlo evitar. Pueden contribuir a ello la fatiga, la debilidad muscular y la espasticidad. Deben descartarse las hemorroides y la fístula anal, que pueden contribuir al mismo. En casos aislados, como por ejemplo la asistencia a actos sociales, puede ser útil la loperamida. DISFUNCIÓN SEXUAL Los órganos sexuales, al igual que el tracto urinario inferior, están inervados por el parasimpático sacro (pélvico), el simpático toracolumbar (cadena simpático hipogastrio y lumbar) y el somático (pudendo). El reflejo de erección del pene y del clítoris representa el reflejo espinal parasimpático sacro; la erección supraespinal es de origen psicológico. La secreción glandular está bajo control simpático y parasimpático y la eyaculación y las contracciones perianales en el orgasmo femenino son estimuladas por impulsos excitatorios desde la inervación somática. La depresión, frecuente en la EM y en tratamientos para la misma, pueden contribuir a los trastornos sexuales. En general se debe explicar al paciente y a su pareja las dificultades sexuales que pueden surgir en relación con la enfermedad y el posible manejo de la misma para que puedan decidir. Tratamiento de los trastornos sexuales en el varón (Tabla I) Entre un 60-65% de los varones con EM refieren trastornos de la erección, especialmente cuando avanza la discapacidad neurológica. Se suele relacionar con afectación de miembros inferiores, por disfunción piramidal, y alteraciones vesicales [111]. La disfunción eréctil se define como la incapacidad persistente para lograr o mantener una erección suficiente para una capacidad sexual satisfactoria. La erección del pene requiere la relajación del músculo liso del cuerpo cavernoso. Existe experiencia de la utilización del inhibidor 5 fosfodiesterasa (PDE5), sildenafilo, en los trastornos de erección de estos pacientes [112]. Debe tomarse una hora antes de la actividad sexual. Debido a que el PDE5 no sólo se expresa en la musculatura del cuerpo cavernoso, sino que también en el sistema vascular, cardiovascular, tracto gastrointestinal y en los conos y bastones del sistema de percepción visual, algunos pacientes han referido efectos adversos como cefalea, congestión nasal, trastornos en la percepción de los colores azul y verde, sensación de mareo, palpitaciones (probablemente debidas a que aumenta el consumo cardíaco de O2 y por arritmia), enrojecimiento, dispepsia y diarrea. Generalmente, estos trastornos se resuelven en pocas horas. En varones con enferme- 1149 L. AYUSO-PERALTA, ET AL dad coronaria, enfermedad cardíaca congestiva, o miocardiopatía, puede suponer un riesgo particular que contraindique su uso. La inyección de prostaglandina E-1 y la papaverina son otras alternativas indicadas por los urólogos. La colocación de prótesis peneal rígida o inflable no es recomendable en enfermos con trastornos urinarios graves. Tratamiento de los trastornos sexuales en las mujeres Los problemas en las mujeres suelen deberse a disminución de la libido y en la consecución del orgasmo. Suelen quejarse de falta de lubricación vaginal, alteración de la sensibilidad sacra, ansiedad por la incontinencia urinaria y espasticidad. Su incidencia se estima en un 50% [113]. Estos problemas son causa de separación en un 60% de los casos con dichos problemas. No hay estudios sobre su tratamiento, parece que el tratamiento de la espasticidad, de los trastornos urinarios y posiblemente del sildenafilo podrían ser útiles. FATIGA Hay que considerar que el concepto subjetivo de fatiga, utilizado en la mayoría de los estudios de medida y tratamiento de los pacientes con EM, puede implicar problemas diversos [114]. Para el manejo de la fatiga conviene recordar algunos de los conocimientos sobre este tema. La fatiga en la EM puede ocurrir en los brotes y entre los mismos de forma crónica en el 70-90% de los pacientes, lo que da una idea de su repercusión en la calidad de vida [115]. Se han propuesto diversas hipótesis patogénicas para explicar la fatiga: disminución de la capacidad de conducción de las fibras desmielinizadas [116], de la capacidad oxidativa de las fibras musculares [117], descondicionamiento físico, factores psicológicos, disminución del metabolismo de glucosa en el córtex frontal y en los cuerpos estriados [118] y disfunción inmune con liberación de citocinas proinflamatorias [119], aunque no se ha encontrado una correlación entre la fatiga y las anomalías de la barrera hematoencefálica mediante estudios de resonancia magnética [120]. Desde el punto de vista fisiológico, la fatiga se define como el fallo para realizar un esfuerzo sostenido, o bien la incapacidad de realizar un esfuerzo específico, o una velocidad durante el ejercicio. En los pacientes con EM puede existir una disociación entre la fuerza y la fatiga, por lo que algunos autores aconsejan cuantificar independientemente la fatiga física y la fuerza [121]. Algunos pacientes de EM se quejan de fatiga mental. Para explicar este fenómeno, Chauddhuri et al [122] aplican el concepto de ‘fatiga central’. Definen la fatiga mental como el fallo para iniciar o mantener tareas de atención sostenida, y fatiga física como la dificultad para realizar tareas físicas mantenidas. Proponen que se debe a fallos en la integración de los circuitos límbicos y de las funciones motoras dentro de los ganglios basales [120]. La mayoría de los pacientes con fatiga física crónica asocian un síndrome piramidal en grados variables, con o sin síndrome cerebeloso [123]. En la evaluación clínica de estos pacientes la mayoría refieren que, al caminar una cierta distancia o al realizar otro ejercicio mantenido con los miembros superiores, se fatigan hasta tener necesariamente que pararse; durante 3-10 minutos pueden volver a caminar y el mismo fenómeno ocurre de nuevo a menor distancia. Este fenómeno lo denominamos claudicación intermitente central [124] por semejar al síndrome de claudicación intermitente neural debido a afectación de la cola de caballo, 1150 pero, a diferencia de éste, al explorar a nuestros pacientes, con frecuencia observamos un incremento del síndrome piramidal. También se denomina fatigabilidad. Es conocido que con la espasticidad durante la marcha, los músculos de las pantorrillas se activan prematuramente, y registros electromiográficos han mostrado un solapamiento entre músculos agonistas y antagonistas. La generación de fuerza voluntaria se reduce de manera marcada en pacientes con espasticidad. No obstante, en muchos de estos pacientes existe una disociación entre el grado de fatigabilidad subjetiva y la gravedad del síndrome piramidal. Los pacientes referían que este trastorno se acentuaba en situaciones de estrés emocional, cambios en la temperatura (en general el incremento de la misma), nicturia, alteraciones del sueño, situaciones de estrés emocional y depresión. También podía oscilar a lo largo del día, generalmente peor por las tardes. Por lo tanto, conviene medir varios de los componentes que contribuyen en la fatiga para un mejor manejo pluridimensional. Los tratamientos antiespásticos, al mejorar la coordinación de los músculos durante los movimientos, pueden ser beneficiosos en algunos pacientes. Sin embargo, por su acción sobre las propiedades musculares al disminuir la fuerza muscular, en los pacientes con debilidad de fondo no resultan beneficiosos. Tratamientos sintomáticos de la fatiga El manejo de la fatigabilidad crónica requiere en primer lugar programas de ejercido gradual y el mantener una actividad física continuada (por ejemplo, ejercicios de aeróbic combinados con movimientos de pedaleo; por otra parte, es beneficioso reducir el gasto de energía mediante la utilización de ayudas técnicas, mecánicas o no), cortos períodos de reposo de 20-45 minutos dos veces al día, siesta, evitar períodos prolongados de inactividad física, planificación y fraccionamiento de las tareas, ejercicios de relajación y de psicoterapia [125,126]. Se deben corregir, además, los factores que la acentúan, tales como alteraciones del sueño, los espasmos dolorosos, la espasticidad, el incremento de temperatura, las infecciones, las situaciones de estrés o la depresión. Tratamiento farmacológico (Tabla I) Su eficacia es limitada en la mayoría de los pacientes. La amantadina, estimulante central, posiblemente incrementa la hormona beta-endorfina y las catecolaminas. Según nuestra experiencia es poco útil en la fatiga física. Puede producir insomnio. Otros agentes empleados son los bloqueantes de los canales de potasio tales como la 4-aminopiridina, y la 3-4 diaminopiridina. Su acción podría deberse a su capacidad para prolongar la duración del potencial de acción y revertir parcialmente el bloqueo de la conducción. Su dispensación es hospitalaria y se emplean en dosis de 25-60 mg/día en tres tomas. Los efectos secundarios más frecuentes son las parestesias y las crisis epilépticas (sobre todo la 3-4 diaminopiridina). La pemolina podría ser otra alternativa. Sus efectos secundarios son irritabilidad, insomnio, mareo y cefalea. En España se presenta asociada a otros principios activos (Dynamin®, laboratorios ERN); fuera de España se comercializa como pemolina sola (Cylert®, laboratorios Abbot, etc.). El metilfenidato también se ha utilizado en algunos casos. Recientemente, se ha señalado que el modafinilo podría ser útil en el tratamiento de la fatiga en la EM. No se conoce con exactitud su mecanismo de acción, aunque se le atribuye un efecto adrenérgico central. Los efectos secundarios son ansiedad, insomnio, anorexia, y hay que tener especial precaución en pacientes hipertensos [127-129]. REV NEUROL 2002; 35 (12): 1141-1153 ESCLEROSIS MÚLTIPLE BIBLIOGRAFÍA 1. Schapiro RT. Symptom management in multiple sclerosis. Ann Neurol 1994; 36 (Suppl): 123-9. 2. Metz L. Multiple sclerosis: symptomatic therapies. Semin Neurol 1998; 18: 389-95. 3. Lance JW. Symposium synopsis. In Feldman RG, Young RR, Koella WP, eds. Spasticity: disordered motor control. Chicago: Yearbook Publisers; 1980. p. 485-95. 4. Faist M, Mazevet D, Dietz V, Pierrot-Deseilligny E. A quantitative assessment of presynaptic inhibition of Ia afferent in spastics: differences in hemiplegics and paraplegics. Brain 1994; 117: 1449-55. 5. Davies PM. Right in the middle. Selective trunk activity in the treatment of adult hemiplegia. Heidelberg: Springer; 1990. 6. Rudick TA, Goodking DE, Ransohoff RM. Pharmacotherapy of multiple sclerosis: current status. Cleve Clin J Med 1992; 59: 267-77. 7. Compston A. Treatment and management of multiple sclerosis. In Compston A, Ebers G, Lassman H, McDonald I, Matthews B, Hartmut W, eds. Multiple sclerosis. Livingstone: Churchill; 1998. p. 454-6. 8. Kesselring J, Thompson AJ. Spasticity, ataxia and fatigue in multiple sclerosis. Baillieres Clin Neurol 1997; 6: 429-45. 9. Lublin FD, Whitaker JN, Eidelman BH, Miller AE, Arnason BG, Burks JS. Management of patients receiving interferon-β 1b for multiple sclerosis: report of a consensus conference. Neurology 1996; 46: 12-8. 10. Alonso RJ, Mancall EL. The clinical management of spasticity. Semin Neurol 1991; 11: 215-9. 11. Jones RF, Burke D, Marosszeky JE, Gillies JD. A new agent for the control of spasticity. J Neurol Neurosurg Psychiatry 1970; 33: 464-8. 12. Sawa GM, Paty DW. The use of baclofen in the treatment of spasticity in multiple sclerosis. J Neurol Sci 1979; 6: 353-6. 13. Anderson PB, Goodkin DE. Current pharmacologic treatment of multiple sclerosis symptoms. West J Med 1996; 165: 313-7. 14. Clanet MG, Brassat D. The management of multiple sclerosis patients. Curr Opin Neurol 2000; 13: 263-70. 15. Terence CF, Fromm GH. Complications of baclofen withdrawal. Arch Neurol 1981; 38: 588-9. 16. Ochs G, Naumann C, Dimitrijevic M, Sindou M. Intrathecal baclofen therapy for spinal origin spasticity: spinal cord injury, spinal cord disease, and multiple sclerosis. Neuromodulation 1999; 2: 108-19. 17. Ochs G, Struppler A, Meyerson BA, Linderoth B, Gybels J, Gardner BP, et al. Intrathecal baclofen for long-term treatment of spasticity: a multi-centre study. J Neurol Neurosurg Psychiatry 1989; 52: 933-9. 18. McLean BN. Intrathecal baclofen in severe spasticity. Br J Hosp Med 1993; 49: 262-7. 19. Penn RD. Intrathecal baclofen for spasticity of spinal origin: seven years of experience. J Neurosurg 1992; 77: 236-40. 20. Nance P, Schryvers O, Schmidt B, Dubo H, Loveridge B, Fewer DA. Intrathecal baclofen therapy for adults with spinal spasticity: therapeutic efficacy and effect on hospital admission. Can J Neurol Sci 1995; 22: 22-9. 21. Wagstaff AJ, Bryson HM. Tizanidine. A review of its pharmacology, clinical efficacy and tolerability in the management of spasticity associated with cerebral and spinal disorders. Drugs 1997; 49: 923-6. 22. Coward DM. Tizanidina: neuropharmacology and mechanism of action. Neurology 1994; 44: 6-11. 23. Ono H, Mishima A, Ono S, Fukuda H, Vasko MR. Inhibitory effects of clonidine and tizanidina on release of substance P from slices of rat spinal cord and antagonism by alpha-adrenergic receptor antagonists. Neuropharmacology 1991; 30: 585-9. 24. Barbeau H, Richards CI, Bedard PJ. Action of cyproheptadine in spastic paraparetic patients. J Neurol Neurosurg Psychiatry 1982; 45: 923-6. 25. Nance PW. A comparison of clonidine, cyproheptadine and baclofen in spastic spinal injured patients. J Am Paraplegia Soc 1994; 17: 150-6. 26. Nance PW, Shears AH, Nance DM. Reflex changes induced by clonidine in spinal cord injured patients. Paraplegia 1989; 27: 296-301. 27. Middleton JW, Siddall PJ, Walker S, Molloy AR, Rutkowski SB. Intrathecal clonidine and baclofen in the management of spasticity and neuropathic pain following spinal cord injury: a case study. Arch Phys Med Rehabil 1996; 77: 824-6. 28. Mueller ME, Gruenthal M, Olson WL, Olson WH. Gabapentin for relief of upper motor neuron symptoms in multiple sclerosis. Arch Phys Med Rehabil 1997; 78: 521-4. 29. Priebe MM, Sherwood AM, Graves DE, Mueller M, Olson WH. Effectiveness of gabapentin in controlling spasticity: a quantitative study. Spinal Cord 1997; 35: 171-5. 30. Rudick RA, Breton D, Krall RL. The GABA-agonist progabide for spasticity in multiple sclerosis. Arch Neurol 1987; 44: 1033-6. 31. Hauser SL, Doolittle TH, Lopez-Bresnahan M, Shahani B, Schoenfeld D, Shih VE, et al. Antispasticity effect of threonine in multiple sclerosis. Arch Neurol 1992; 49: 923-6. REV NEUROL 2002; 35 (12): 1141-1153 32. Jimi T, Wakayama Y. Mexilitine for the treatment of spasticity due to neurological disorders. Muscle Nerve 1993; 16: 885. 33. Costa JL, Diazgranados JA. Ivermectin for spasticity in spinal cord injury. Lancet 1994; 343: 739. 34. Borodic GE, Ferrante R, Wiegener AW, Young RR. Treatment of spasticity with botulinum toxin. Ann Neurol 1992; 31: 113. 35. Snow BJ, Tsui JKC, Bhatt MH, Varelas M, Hashimoto SH, Calne DB. Treatment of spasticity with Botulinum toxin: a double-blind study. Ann Neurol 1990; 28: 512-5. 36. Borg-Stein J, Pine ZM, Miller JR, Brin MF. Botulinum toxin for treatment of spasticity in multiple sclerosis. Am J Neurol Sci 1993; 72: 219-32. 37. Borg-Stein J, Pine ZM, Miller JR, Brin MF. Botulinum toxin for the treatment of spasticity in multiple sclerosis. New observations. Am J Phys Med Rehabil 1993; 72: 364-8. 38. Dietz V, Young RR. The syndrome of spastic paresis. In Brandt T, Dichigans J, eds. Neurological disorders: course and treatment. New York: Academic Press; 1996. p. 861-71. 39. Nielsen JF, Sinkjaer T, Jakobsen J. Treatment of spasticity with repetitive magnetic stimulation: a double-blind placebo-controlled study. Mult Scler 1996; 2: 227-32. 40. Management of tremor in MS. In the symptoms of MS and their management. Proceedings of the MS Forum Modern Management Workshop. Edited by Professional Postgraduate Services Europe Ltd, UK; 1994. p. 26-29. 41. Duquette P, Pleines J, du Souich P. Isoniazid for tremor in multiple sclerosis: a controlled trial. Neurology 1985; 35: 1772-5. 42. Aisen ML, Holzen M, Rosen M, Detz M, McDowen F. Glutethimide treatment of disabling action tremor in patients with MS and traumatic brain injury. Arch Neurol 1991; 48: 513-5. 43. Rice GPA, Dickey C, Lesaux J, Vandervoort P, MacEwan L, Ebers GC. Ondasetron for disabling cerebellar tremor. Ann Neurol 1995; 38: 973. 44. Rice GP, Lesaux J, Vandervoort P, Macewan L, Ebers GC. Ondasetron, a 5-HT3 antagonist, improves cerebellar tremor. J Neurol Neurosurg Psychiatry 1997; 62: 282-4. 45. Metz LM, Hinrichs J, Harris C. Assessment of oral ondasetron in the treatment of cerebellar tremor in MS using the Canadian Occupational Performance Measure. Multiple Sclerosis Clin Lab Res 1996; 2: 116. 46. Wasielewski PG, Burns JM, Koller WC. Pharmacologic treatment of tremor. Mov Disord 1998; 13 (Suppl 3): 90-100. 47. Aisen ML, Arnold A, Baiges I, Maxwell S, Rosen M. The effect of mechanical damping loads on disabling action tremor. Neurology 1993; 43: 1346-50. 48. N’guyen JP, Degos JD. Thalamic stimulation and proximal tremor: a specific target in the nucleus ventro intermedius thalam. Arch Neurol 1993; 50: 498-500. 49. Hooper J, Whittle IR. Long term outcome after thalamotomy for movement disorders in MS. Lancet 1998; 352: 1984. 50. Montgomery EB, Baker KB, Kinkel PR, Barnett G. Chronic thalamic stimulation for tremor of MS. Neurology 1999; 53: 625-8. 51. Frohman EM, Solomon D, Zee DS. Nuclear, supranuclear and internuclear eye movement abnormalities in MS. Int MS J 1996; 2: 79-89. 52. Leigh RJ, Averbuch-Heler L, Tomsak RL, Remler BF, Yanighos SS, Dell’osso LF. Treatment of abnormal eye movements that impair vision: strategies based on current concept of physiology and pharmacology. Ann Neurol 1994; 36: 129-41. 53. Starck M, Albrecht H, Pollmann W, Straube A, Dieterich M. Drug therapy for acquired pendular nystagmus in multiple sclerosis. J Neurol 1997; 244: 9-16. 54. Lee J, Elston J, Vickers S, Powell C, Ketley J, Hogg C. Botulinum toxin therapy for squint. Eye 1988; 2: 24-8. 55. Rice GP, Ebers GC. Ondasetron for intractable vertigo complicating acute brain stem disorders. Lancet 1995; 345: 1182-3. 56. Jankovic J, Gilden JL, Hiner BC, Kaufmann H, Brown DC, Coghlan CH, et al. Neurogenic orthostatic hypotension: a double-blind, placebo-controlled study with midodrine. Am J Med 1993; 95: 38-48. 57. Moulin DE, Foley KM, Even GC. Pain syndromes in multiple sclerosis. Neurology 1988; 38: 1830-4. 58. Archibald CJ, McGrath PJ, Ritvo PG, Fisk JD, Bhan V, Maxner CE, et al. Pain prevalence, severity and impact in a clinic sample of multiple sclerosis patients. Pain 1994; 58: 89-93. 59. Thompson AJ. Symptomatic treatment in multiple sclerosis. Curr Opin Neurol 1998; 11: 305-9. 60. Brisman R. Trigeminal neuralgia and multiple sclerosis. Arch Neurol 1987; 44: 379-81. 61. Reder AT, Arnarson BG. Trigeminal neuralgia in multiple sclerosis relieved by a prostaglandin E analogue. Neurology 1995; 45: 1097-100. 62. Sist T, Filadora V, Miner M, Lema M. Gabapentin for idiopathic trigeminal neuralgias: report of two cases. Neurology 1997; 48: 1467-8. 1151 L. AYUSO-PERALTA, ET AL 63. Solaro C, Messmer M, Uccelli A, Leandri M, Mancardi GL. Low-dose gabapentin combined with either lamotrigine or carbamazepine can be useful therapies for trigeminal neuralgia in multiple sclerosis. Eur Neurol 2000; 44: 45-8. 64. Grupo de estudio de enfermedades desmielinizantes de la Sociedad Española de Neurología. Tratamiento sintomático. En Hernández MA, ed. Guía de tratamiento de la esclerosis múltiple. 1 ed; 1998. 65. Clifford DB, Trotter JL. Pain in multiple sclerosis. Arch Neurol 1984; 41: 1270-2. 66. Samkoff LM, Daras M, Tuchman AJ, Koppel BS. Amelioration of refractory dysesthetic limb pain in multiple sclerosis by gabapentin. Neurology 1997; 49: 304-5. 67. Houchens MK, Richert JR, Sami A, Rose JW. Open label gabapentin treatment for pain in multiple sclerosis. Mult Scler 1997; 3: 250-3. 68. Langdon DW. Cognitive dysfunction in multiple sclerosis. What are we measuring and why does it matter? In Thompson AJ, Polman C, Hohfeld R, eds. Multiple sclerosis: clinical challenges and controversies. London: Martin Dunitz Ltd; 1997. p. 253-63. 69. Rao SM, Leo GJ, Bernardin L, Unverzagt F. Cognitive dysfunction in multiple sclerosis patients. I: frequency, patterns and prediction. Neurology 1991; 41: 685-91. 70. Ron MA, Callanan MM, Warrington EK. Cognitive abnormalities in multiple sclerosis: a psychometric and MRI study. Psychol Med 1991; 21: 59-68. 71. Beaty WW, Goodkin DE, Monson N, Beauty PA. Cognitive disturbances in patients with relapsing remitting multiple sclerosis. Arch Neurol 1989; 46: 113-9. 72. Rao SM, Hammeke TA, McQuillen MP, Khatri BO, Lloyd D. Memory disturbance in chronic progressive multiple sclerosis. Arch Neurol 1984; 41: 625-31. 73. Litvan I, Grafmen J, Vendrell P, Martínez JM, Junqué C, Vendrell JM, et al. Multiple memory deficits in patients with multiple sclerosis. Arch Neurol 1988; 45: 607-19. 74. Kujala P, Portin R, Ruutiainen J. Language functions in incipient cognitive decline in multiple sclerosis. J Neurol Sci 1996; 141: 79-86. 75. Beatty WW, Goodkin DE, Monson N, Beatty PA, Hertsgaard D. Anterograde and retrograde amnesia in patients with chronic progressive multiple sclerosis. Arch Neurol 1988; 45: 611-9. 76. Litvan I, Grafman J, Vendrell P, Martínez JM. Slowed information processing in multiple sclerosis. Arch Neurol 1988; 45: 281-5. 77. De Luca J, Johnson SK, Natelson BH. Information processing efficiency in chronic fatigue syndrome and multiple sclerosis. Arch Neurol 1993; 50: 301-4. 78. Geisler MW, Sliwinski M, Coyle PK, Masur DM, Doscher C, Krupp LB. The effects of amantadine and pemoline on cognitive functioning in multiple sclerosis. Arch Neurol 1996; 53: 185-8. 79. Smits RCF, Emmen HH, Berterlsmann FW, Kulig BM, van Loenen AC, Polman CH. The effects of 4-aminopyridine on cognitive function in patients with multiple sclerosis: a pilot study. Neurology 1994; 44: 1701-5. 80. Weinstein A, Schwid SR, Schiffer RB, McDermott MP, Giang DW, Goodman AD. Neuropsychological status in patients with multiple sclerosis after treatment with glatiramer acetate. Arch Neurol 1999; 56: 319-24. 81. Sandyk R. Progressive cognitive improvement in multiple sclerosis from treatment with electromagnetic fields. Int J Neurosci 1997; 89: 39-51. 82. Leo GJ, Rao SM. Effects of intravenous physostigmine and lecithin on memory loss in multiple: report of a pilot study. J Neurol Rehabil 1988; 2: 123-9. 83. Pliskin NH, Hamer DP, Goldstein DS, Towle VL, Reder AT, Noronha A, et al. Improved delayed visual reproduction test performance in multiple sclerosis patients receiving interferon-b 1b. Neurology 1996; 47: 1463-8. 84. Fischer JS, Priore RL, Jacobs LD, Cookfair DL, Rudick RA, Herndon RM, et al. Neuropsychological effects of interferon beta-1a in relapsing multiple sclerosis. Multiple Sclerosis Collaborative Research Group. Ann Neurol 2000; 48: 885-92. 85. Greene YM, Tariot PN, Wishart H, Cox C, Holt C, Schwid S, et al. A 12-week, open trial of donezepil hydrochloride in patients with multiple sclerosis and associated cognitive impairments. J Clin Psychopharmacol 2000; 20: 350-5. 86. Joffe RT, Lippert GP, Gray TA, Sawa G, Horvath Z. Mood disorders and multiple sclerosis. Arch Neurol 1987; 44: 376-8. 87. Sadovnick AD, Remick RA, Allen J, Swartz E, Yee IM, Elsen K, et al. Depression and multiple sclerosis. Neurology 1996; 46: 628-32. 88. Schiffer RB, Caine ED, Bamford KA, Levy S. Depressive episodes in patients with multiple sclerosis. Arch Neurol 1983; 140: 1498500. 89. Minden SL, Schiffer RB. Affective disorders in multiple sclerosis: re- 1152 view and recommendations for clinical researches. Arch Neurol 1990; 47: 98-104. 90. Clark CM, Fleming JA, Li D, Oger J, Klonoff H, Paty D. Sleep disturbances, depression and lesion site in patients with multiple sclerosis. Arch Neurol 1992; 49: 641-3. 91. Leo GL, Rao SM, Bernardin L. Sleep disturbances in multiple sclerosis. Neurology 1991; 41 (Suppl 1): 727. 92. Tachibana N, Howard RS, Hirsch NP, Miller DH, Moseley IF, Fish D. Sleep problems in multiple sclerosis. Eur Neurol 1994; 34: 320-3. 93. Hennessey A, Robertson NP, Swingler R, Compston DAS. Urinary, faecal and sexual dysfunction in patients with multiple sclerosis. J Neurol 1999; 246: 1027-32. 94. Burguera-Hernández JA. Alteraciones urinarias en la esclerosis múltiple. Rev Neurol 2000; 30: 989-92. 95. Conejero J, Sarrias F, Martínez Argulló E. Alteraciones miccionales. En Fernández O, ed. Esclerosis múltiple: una aproximación multidisciplinaria. Madrid: Arké; 1994. p. 53-70. 96. Ruis Cerdá JL, Broseta E, Martínez Argulló E. Alteraciones urológicas en la esclerosis múltiple. En Martínez Argulló E, ed. Incontinencia urinaria. Conceptos actuales. Madrid: Indas; 1990. p. 511-28. 97. Betts CD, D’Mellow MT, Fowler CJ. Urinary symptoms and the neurological features of bladder dysfunction in multiple sclerosis. J Neurol Neurosurg Psychiatry 1993; 56: 245-50. 98. Patti F, Ventimiglia B, Failla G, Genazzani AA, Reggio A. Micturition disorders in multiple sclerosis patients: neurological, neurourodynamic and magnetic resonance findings. Eur J Neurol 1997; 4: 259-65. 99. Martín C, Salinas J, Fernández Durán A, Fernández-Gómez J, Jiménez N, Gangoiti L. Alteraciones genitourinarias en la esclerosis múltiple: la necesidad de un estudio urodinámico. Rev Neurol 2000; 30: 643-8. 100. Nour S, Svarer C, Kristensen JK, Paulson OB, Law I. Cerebral activation during micturition in normal men. Brain 2000; 123: 781-9. 101. Athwal BS, Berkeley KJ, Hussain I, Brennan A, Craggs M, Sakakibara R, et al. Brain responses to changes in bladder volume and urge to void in healthy men. Brain 2001; 124: 369-77. 102. Bagunyá-Durich J. Tratamiento de los trastornos de la micción en la esclerosis múltiple. Neurologia 1996; 11: 182-91. 103. Fowler CJ. Bladder dysfunction in multiple sclerosis: causes and treatment. Mult Scler J 1994; 1: 99-107. 104. Fowler CJ, Kerrebroek Ph EV, Nordenbo A, Poppel HV. Treatment of lower urinary tract dysfunction in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry 1992; 55: 986-9. 105. Pannek J, Sommerfeld HJ, Bötel U, Senge T. Combined intravesical and oral oxybutynin chloride in adult patient with spinal cord injury. Urology 2000; 55: 358-62. 106. Valiquette G, Herbert J, Meade-Dálisera P. Desmopressin in the management of nicturia in patients with multiple sclerosis. Arch Neurol 1996; 53: 1270-5. 107. Hussain I, Fowler C. The cause and management of bladder, sexual and bowel symptoms. In Hawkins CP, Wolinsky JS, eds. Principles of treatments in multiple sclerosis. Heinemann: Butterworth; 2000. p. 258-81. 108. Kaplan WE. Intravesical electrical stimulation of the bladder. Pro Urol 2000; 56: 2-4. 109. Chia YW, Fowler CJ, Kamm MA, Henry MM, Lemieux MC, Swash M. Prevalence of bowel dysfunction in patients with multiple sclerosis and bladder dysfunction. J Neurol 1995; 242: 105-8. 110. Wiesel PH, Norton C, Roy AJ, Bowers J, Kamm MA. Gut focused behavioural treatment (biofeedback) for constipation and faecal incontinence in multiple sclerosis. J Neurol Neurosurg Psychiatry 2000; 69: 240-3. 111. Betts CD, Jones SJ, Fowler CG, Fowler CJ. Erectile dysfunction in multiple sclerosis. Associated neurological and neurophysiological deficits, and treatment of the condition. Brain 1994; 117: 1303-10. 112. Derry FA, Dinsmore WW, Fraser M, Gadner BP, Glass CA, Maytom MC, et al. Efficacy and safety of oral sildenafil (Viagra) in men with erectile dysfunction caused by spinal cord injury. Neurology 1998; 51: 1629-63. 113. Hulter BM, Lundberg PO. Sexual function in women with advanced multiple sclerosis. J Neurol Neurosurg Psychiatry 1995; 59: 83-6. 114. Krupp LB, LaRoca NG, Muir Nash J, Steinberg AD. The fatigue scale application to patients with multiple sclerosis and systemic lupus erythematous. Arch Neurol 1989; 46: 1121-3. 115. Casanova B, Coret F, Landete L. Estudio de diversas escalas de fatiga e impacto en la calidad de vida de los pacientes afectos de esclerosis múltiple. Rev Neurol 2000; 30: 1235-41. 116. Sheean GL, Murray NM, Rothwell JC, Miller DH, Thompson AL. An electrophysiological study of the mechanism of fatigue in multiple sclerosis. Brain 1997; 120: 299-315. 117. Haan A, Ruiter C, Woude L, Jongen P. Contractile proprieties and fatigue of cuadriceps muscles in multiple sclerosis. Muscle Nerve 2000; 23: 1534-41. REV NEUROL 2002; 35 (12): 1141-1153 ESCLEROSIS MÚLTIPLE 118. Roelcke U, Kappos L, Lechner-Scott J, Brunnschweiler H, Huber S, Ammann W, et al. Reduced glucose metabolism in the frontal cortex and basal ganglia of multiple sclerosis patients with fatigue: a 18F-fluorodeoxyglucose position emission tomography study. Neurology 1997; 48: 1566-71. 119. Cozon GJ. Mechanismes immunologiques de la fatigue au cours de la sclérose en plaques. Rev Neurol (Paris) 2000; 156: 1042-3. 120. Mainero C, Faroni J, Gasperini C, Filippi M, Giugni E, Ciccarelli O, et al. Fatigue and magnetic resonance activity in multiple sclerosis. J Neurol 1999; 246: 454-8. 121. Schwid SR, Thornton CA, Pandya S, Manzur KL, Sanjak M, Petrie MD, et al. Quantitative assessment of motor fatigue and strength in MS. Neurology 1999; 53: 743-50. 122. Chaudhuri A, Behan PO. Fatigue and basal ganglia. J Neurol Sci 2000; 179: 34-42. 123. Iriarte J, de Castro P. Correlation between symptom fatigue and muscular fatigue in multiple sclerosis. Eur J Neurol 1998; 5: 579-85. 124. de Andrés C, Guillem A, Navarro E. Intermittent central motor claudication in multiple sclerosis patients. Mult Scler 1998; 4: 312. 125. Fisher NM, Lenox J, Granger CV, Brownscheidle C, Jacobs L. Effects of an anti-fatiguing exercise program on fatigue and physiological function in patients with multiple sclerosis. Neurology 220; 45: 338. 126. Young C. Symptomatic management: ataxia, tremor and fatigue. In Hawkins CP, Wolinsky JS, eds. Principles of treatments in multiple sclerosis Butterworth: Heinemann; 2000. p. 228-57. 127. Roullet E. Perspectives de prise en charge de la fatigue. Rev Neurol (Paris) 2000; 156: 1046-7. 128. Sheean GL, Murray NM, Rothwell JC, Miller DH, Thompson AJ. An open-labelled clinical and electrophysiological study of 3,4 diaminopyridine in the treatment of fatigue in multiple sclerosis. Brain 1998; 121: 967-75. 129. Rammoham KW, Columbus OH, Rosemberg JH, et al. Modafinil. Efficacy and safety for the treatment of fatigue in patients with multiple sclerosis. Neurology 2000; 45: 24. TRATAMIENTO SINTOMÁTICO DE LA ESCLEROSIS MÚLTIPLE Resumen. Introducción. La esclerosis múltiple es una enfermedad neurológica crónica que afecta a los adultos en la edad media de la vida y que supone, por lo general, un importante efecto físico, psicológico y sociolaboral a los individuos que la padecen. Desarrollo. Desde el punto de vista anatomopatológico, se caracteriza por desmielinización y daño axonal en el sistema nervioso central. Sus manifestaciones clínicas son variables y derivan del momento evolutivo de la enfermedad, de su forma clínica y de la topografía de las lesiones. Por otra parte, la aparición de síntomas puede estar en relación con brotes o reagudizaciones de la enfermedad, o con recuperación incompleta de los mismos, produciendo una grave discapacidad. Conclusión. Revisamos la fisiopatología y los tratamientos más empleados en el manejo de los síntomas más comunes de la esclerosis múltiple. [REV NEUROL 2002; 35: 1141-53] Palabras clave. Alteraciones cognitivas. Alteraciones intestinales. Alteraciones psiquiátricas. Ataxia. Disfunción sexual. Disfunción urinaria. Dolor. Esclerosis múltiple. Espasticidad. Fatiga. Nistagmo. Temblor. Trastornos del sueño. Vértigo. TRATAMENTO SINTOMÁTICO DA ESCLEROSE MÚLTIPLA Resumo. Introdução. A esclerose múltipla é uma doença neurológica crónica que afecta os adultos de meia-idade, e que apresenta, em geral, importantes efeitos físicos, psicológicos e sócio-laborais nos indivíduos afectados. Desenvolvimento. Sob um ponto de vista anatomopatológico, caracteriza-se por desmielinização e lesão axonal no sistema nervoso central. As suas manifestações clínicas são variáveis, e resultam do momento evolutivo da doença, da sua forma clínica e da topografia das lesões. Por outro lado, o aparecimento dos sintomas pode estar relacionado com surtos, ou agudizações da doença, ou com a recuperação incompleta dos mesmos, produzindo uma grave incapacidade. Conclusão. Revemos a fisiopatologia e os tratamentos mais utilizados na terapêutica dos sintomas mais comuns da esclerose múltipla. [REV NEUROL 2002; 35: 1141-53] Palavras chave. Alterações cognitivas. Alterações do sono. Alterações intestinais. Alterações psiquiátricas. Ataxia. Disfunção sexual. Disfunção urinária. Dor. Esclerose múltipla. Espasticidade. Fadiga. Nistagmo. Tremor. Vertigens. REV NEUROL 2002; 35 (12): 1141-1153 1153