oxidacion parcial de o
Anuncio

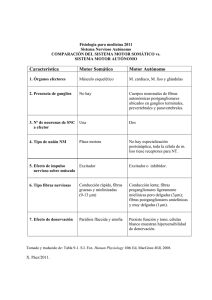
“OBTENCION DE ANHIDRIDO FTALICO A PARTIR DE LA OXIDACION PARCIAL DE O-XILENO” Y. Batista Fong1 , J. Núñez Monreal1 , J. Medina-Valtierra2 , J. Ramírez-Ortiz1∗ . 1. Unidad Académica de Ciencias Químicas UAZ, Km. 0.5 Carr. Cd. Cuauhtémoc, Gpe, Zac. 98600. e- mail: jramirez@cantera.reduaz.mx 2. Instituto Tecnológico de Aguascalientes. Av. A. López Mateos #182 Ote. Aguascalientes, Ags. 20256. RESUMEN En este trabajo se presentan los resultados preliminares del proyecto del título, se sintetizaron fibras con diferentes relaciones molares de SiO 2 -TiO 2 , para determinar la actividad catalítica de las fibras se utilizó la obtención de anhídrido ftálico a partir de la oxidación parcial de o- xileno y se llevó a cabo en una microplanta construida en el laboratorio. La caracterización de los productos de reacción se hizo utilizando un sistema acoplado cromatógrafo de gases- masas HP 6890. PALABRAS CLAVES: anhídrido ftálico, o-xileno, fibras, catálisis. ∗ Autor para correspondencia 2 INTRODUCCIÓN. El anhídrido ftálico (AF) es una materia prima importante para la preparación de diésteres, los cuales se emplean como plastificantes para el PVC [1]. El AF también se utiliza en la preparación de resinas alkidicas y de poliéster y en pigmentos. El primer proceso comercial de manufactura de AF se basó en la oxidación de naftaleno en fase líquida y a éste siguió el desarrollo del proceso en fase gas [2]. Inicialmente este proceso involucró la oxidación de naftaleno sobre óxidos de vanadio, pero con el incremento de la demanda de AF se estimulo la investigación para materia primas alternas y el o- xileno disponible en grandes cantidades de las refinerías de petróleo ha sido el preferido desde 1963 [2]. La oxidación de o-xileno ha sido objeto de muchos estudios cinéticos y se han propuesto una serie de mecanismos de reacción[3], estos mecanismos involucran una sucesión de especies adsorbidas, las cuales pueden formar productos intermediarios detectables en la fase gas, aunque algunos autores sugieren que el AF también puede obtenerse desde o-xileno y o-tolualdehído, involucrando reacciones sólo entre especies adsorbidas. Los productos de oxidación no selectivos, se consideran como resultado no solo de la oxidación directa de o-xileno, si no también de especies intermediarias y de AF. Un estudio más reciente sugiere que la ruta que conduce a anhídrido maleico y a anhídrido ftálico son competitivas, que incluye a o-tolualdehído, ftalactona, anhídrido maleico y CO2 [4]. Por otra parte también han sido detectados otros productos secundarios a bajas concentraciones tales como anhídrido metilmaleico, benzofurano, ácido o-toluico y CO. A la fecha, la oxidación catalítica de o-xileno sobre catalizadores de V2 O5 es el proceso industrial más importante para la producción de anhídrido ftálico dentro de los cuales los catalizadores más empleados en la contienen V2 O5 soportado en TiO 2 (anatasa), 0 4-26 y 0 4-28 hechos por la compañía BASF. 3 En este trabajo nos proponemos obtener anhídrido ftálico mediante una reacción de oxidación parcial de o-xileno en fase gas, utilizando como catalizador fibras de SiO 2 -TiO 2 sintetizadas en nuestro laboratorio. PARTE EXPERIMENTAL Para sintetizar las fibras de SiO 2 se siguió una técnica reportada en la literatura [5] se pone en un matraz de 100 mL con agitador magnético 40 mL de etanol anhidro (Merck) y 50 mL de tetraetilortosilicato TEOS (Aldrich), aparte en un vaso de precipitados se prepara otra mezcla, la cual se requiere para catalizar la gelación de la solución previa, 35 mL de etanol, 70 mL de H2 O destilada, 0.8 mL de solución de HCl 2M y sin dejar de agitar se agrega a la primer solución hasta que ocurra una homogenización completa. Al evaporarse el alcohol se forma un gel viscoso, sumerja una varilla de vidrio en el gel espeso y tire hasta formar una fibra, repita este procedimiento hasta obtener las fibras. Para preparar las fibras de SiO 2 -TiO 2 se siguió un procedimiento similar, sólo que al gel se sílice se agrega tetra- isopropoxido de titanio Ti(OC3 H7 )4 (ALdrich) y para obtener fibras porosas se adiciona una solución acuosa de bromuro de cetiltrimetilamonio CTAB (ALdrich). Una vez que las fibras se han secado se someten a calcinación a una temperatura de 550 ºC por 3 Hrs. Estas se caracterizan utilizando técnicas como espectroscopia Raman, Difracción de rayos X (XRD), Microscopia Electrónica de Barrido (SEM), Microscopia de Fuerza Atómica (AFM), también se determina el área superficial utilizando técnica de fisisorción de nitrógeno. En la figura 1 se muestra un esquema de la microplanta empleada para llevar a cabo la evaluación catalítica de las fibras. Las reacciones fueron llevadas a cabo en un reactor tubular de vidrio de 8 4 mm DI (diámetro interno), al cual se le hizo pasar un fluido de relación molar de 79 O2 /o-xileno. El o-xileno se introduce por medio de un saturador y la velocidad de flujo es controlada vía el control de flujo de N2 . El flujo de los gases (O 2 + N2 ) (INFRA) pasa a través del lecho de catalizador con un total de 60 mL/min que da una velocidad espacial de reactivo de 0.73 Hr- 1. Para controlar la temperatura del reactor se colocó un termopar en la pared exterior del reactor. En todos los experimentos se utilizaron 200 mg de catalizador (fibras) cargados en el reactor. Los gases que salen del reactor pueden pasar directamente al cromatógrafo de gases para su análisis o pasar a un condensador y recuperarse para un análisis posterior. Las muestras fueron analizadas por cromatografía de gases utilizando un cromatógrafo marca Buck modelo 910 con detector de ionización de flama (FID) y columna capilar a una temperatura de 90 ºC. La identificación de los productos de la reacción se llevo a cabo en un sistema de cromatógrafo de gases acoplado a un espectrómetro de masas HP6890 con columna capilar y utilizando un barrido de temperatura. Fig. 1. Esquema de la microplanta 5 RESULTADOS Y DISCUSION En la figura 2 se muestran fotografía (10X) de fibras planas y cilíndricas después de calcinadas, las fibras de SiO 2 -TiO 2 tienen un color transparente y dimensiones de 2X0.1 cm y son flexibles pero quebradizas. Fig. 2. Fotografías de fibras (a) plana (b) cilíndrica. Como puede observarse en la figura 3 (cromatógrama de los productos a la salida del reactor) sobresale el pico correspondiente a o-xileno con un tiempo de retención de 3.52 min, enseguida se encuentra un conjunto de 4 picos a tiempos de retención 6.77, 6.95, 7.15 y 7.37 min, los cuales corresponden a 2- hidroxibenzaldehído, 2- metil fenol, 2-metil benzaldehído y benzofurano los compuestos que identificamos como o-tolualdehído, anhídrido ftálico y ftalactona los encontramos a tiempos de retención de 9.3, 10.0 y 10.32 respectivamente, finalmente un pico 6 ancho a 11.48 min caracterizado como ácido ftaldehidico, 13.37 min el 1,1’-(1,2-etenodil)bis (2 metil)benceno. Fig. 3. Cromatógrama de los productos de la reacción de oxidación parcial de o-xileno. Nuestro catalizador presenta una gran actividad a la temperatura de 275 ºC en la reacción de oxidación parcial de o- xileno ya que obtenemos muchos productos entre los que destacan los reportados por C. R. Dias et al. [4] quien utilizó un catalizador de V2 O5 soportado en TiO 2 . Es decir anhídrido ftálico y ftalactona. Cuando se aumenta la temperatura el pico correspondiente a anhídrido ftálico disminuye y aumenta el pico correspondiente a ftalactona, está reportado que éste último es un intermediario en la formación del anhidro ftálico y de hecho es una impureza en el anhídrido ftálico comercial. Nuestros resultados preliminares están de acuerdo con los productos de reacción para la oxidación de o-xileno propuesto en el esquema de reacción general que se muestra en la figura 4. 7 O O CH3 CHO O CH3 o-xileno O CHO O o-tolualdehído ftalactona anhídrido ftálico CO x Fig. 4. Esquema de reacción de o- xileno. Cabe señalar que cuando se utilizaron sólo fibras de SiO 2 no hubo reacción en el rango de temperaturas. AGRADECIMIENTOS Agradecemos a la Dra. Olga Y. Barbosa C. por las fotografías de las fibras, así como al MC. Jorge Núñez Monreal por los análisis de GC-MS. REFERENCIAS 8 1. P. H. Towel, R. H. Bald win, D. H. Meyer, Encyclopedia of Chemical Technology, 2nd ed. (H.F. Mark, J. J. McKeltajr, and D. F. Othmer, eds.), John Wiley and Sons, New York, 15 (1968) 444. 2. V. Nicolov, D. Klissurki, a. Anastasov, Cat. Rev. Sci. Eng. 33 (1991) 319. 3. C. R. Dias, M. F. Portela, G. C. Bond, Journal of Catalysis 164 (1996b) 276-287. 4. C. R, Dias, M. F. Portela, G. C Bond, Catal. Rev.-Sci. Eng. 39 (1997) 169. 5. A. Celzard, J. F. Marêché J. Chem Educ. 79 (2002) 854-859