Choque eficaz Choque no eficaz H2 I2 Reactivos
Anuncio

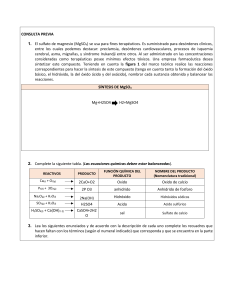
COLEGIO JORGE ELIÉCER GAITÁN QUÍMICA I: ECUACIONES QUÍMICAS 1a parte (Clases de ecuaciones - balanceo por tanteo). NOMBRE___________________________________________________________________ CURSO_______________ CONTEXTUALIZACIÓN: En la naturaleza ocurren a diario numerosos cambios llamados reacciones químicas. Podemos encontrar muchos ejemplos: los alimentos se convierten en energía en nuestro cuerpo; el nitrógeno y el hidrógeno se combinan para formar amoniaco que se utiliza como fertilizante; una batería adecuada produce la energía necesaria para encender un carro. Hay reacciones que son instantáneas, como la detonación de un explosivo o la formación del cuajo de la leche cuando se le agrega jugo de limón. Hay reacciones que ocurren lentamente, como la degradación de los alimentos en un organismo que sigue el proceso de digestión o la oxidación del hierro en presencia del aire húmedo, conocida con el nombre de corrosión. Toda reacción química, sea natural o provocada por el hombre, se lleva a cabo dentro de un medio determinado y bajo ciertas condiciones de temperatura, presión y luz. Si se altera una o varias de estas condiciones es posible conseguir que la reacción se detenga o que, por el contrario, se desarrolle con una mayor rapidez. Las Reacciones químicas tienen lugar cuando las sustancias sufren cambios fundamentales de identidad; una o más sustancias se consumen mientras se forman otras sustancias. A las sustancias presentes al inicio de una reacción, es decir, los materiales de partida, se les llama reactivos, y las sustancias que produce la reacción se conocen como productos. Cuando se comprende lo que está ocurriendo, se encuentra que las reacciones son predecibles. En toda reacción química no se crean ni se destruyen átomos, sino que se reorganizan para formar sustancias distintas. En todos los casos la materia se conserva y no hay cambios en la masa total. PERFIL DE UNA REACCIÓN Para que una reacción química suceda, las partículas (reactantes) envueltas en la reacción deberán interactuar. No todas las colisiones resultan en reacciones químicas. Las partículas que chocan deberán tener suficiente energía cinética para romper las uniones existentes de manera que nuevas uniones se formen. La energía mínima requerida para que se dé una reacción química es la energía de activación. Cuando más energía es liberada con los producto que la que es absorbida para romper las uniones de los reactantes, la reacción es exotérmica (se libera más energía). Cuando se necesita más energía para romper las uniones de los reactantes que la que se ha liberado con los productos, se dice que la reacción es endotérmica (se absorbe energía). Productos HI HI H2 I2 Complejo Reactivos activado H2 Choque eficaz I2 H2 Choque no eficaz Orientación en el choque. Entalpía Complejo activado Complejo activado Energía de activación productos reactivos reactivos productos Reacción exotérmica Entalpía de reacción (H) Reacción endotérmica La entalpía se representa con la letra H mayúscula, cuya variación expresa una medida de la cantidad de energía absorbida es decir, la cantidad de energía que un sistema puede intercambiar con su entorno. FACTORES QUE AFECTAN LA VELOCIDAD DE UNA REACCIÓN QUÍMICA 1. Naturaleza de las sustancias. 2. Estado físico. 3. Superficie de contacto o grado de pulverización (en el caso de sólidos) 4. Concentración de los reactivos. 5. Temperatura. LOS CATALIZADORES Intervienen en alguna etapa de la reacción pero no se modifican, pues se recuperan al final y no aparecen en la ecuación global ajustada. Modifican el mecanismo y por tanto la E A de la reacción. Pueden ser: 1. Positivos: hacen que “v” aumente, pues consiguen que E A disminuya. 2. Negativos: hacen que “v” disminuya, pues consiguen que E A aumente. 1. Escribir, clasificar y balancear las ecuaciones a los siguientes procesos: A. En ocasiones el ácido clorhídrico producido en el estómago alcanza a los nervios de la mucosa gastrointestinal, llega al sistema nervioso central un signo de dolor. Esta sensación desagradable de dolor ocurre cuando los nervios están expuestos a la agresión de los ácidos gástricos, llegando incluso a poder generar úlceras pépticas. El ácido gástrico puede llegar a alcanzar igualmente el esófago o el mismo duodeno. Algunas de las reacciones más conocidas de neutralización con antiácidos, como pueden ser - El hidróxido de aluminio, reacciona con el ácido clorhídrico, para producir cloruro de aluminio y agua. _________________________________________________________________________________________________________ - La reacción del bicarbonato ácido de sodio con el ácido clorhídrico, es conocida por liberar ciertas cantidades de gas carbónico que finalmente se disipan en forma de un suave eructo, además se produce cloruro de sodio y agua. _________________________________________________________________________________________________________ B. La combustión del gas propano, (C3H8) o de cocina implica la reacción entre el propano y el oxígeno del aire para producir dióxido de carbono, agua y calor. ________________________________________________________________________________________________ C. Al quemar carbón sólido reacciona con oxígeno para formar dióxido de carbono gaseoso. _________________________________________________________________________________________________________ D. La formación de la lluvia ácida implica la reacción del trióxido de azufre con el agua para producir ácido sulfúrico. _________________________________________________________________________________________________________ E. Cuando el gas butano, (C4H10) de un encendedor de bolsillo arde en el aire, se producen dióxido de carbono y agua. ________________________________________________________________________________________________ F. La acetona, (C3H6O) es un componente importante del removedor barniz de uñas. Escriba la ecuación que describa la combustión de la acetona con producción de dióxido de carbono y agua. ________________________________________________________________________________________________ Orden de actividad de los metales: Mayor reactividad← → menor reactividad Li – K – Ba – Na – Mg – Al – Zn – Fe – Cd – Ni – Sn – Pb – H - Cu – Hg – Ag – Au. 2. Teniendo en cuenta la anterior información, completar las ecuaciones (escribir la fórmula de los productos) donde se pueda realizar el desplazamiento, si no es posible escribir no reacciona: A) H Cl + Ni → --------------- + ----------- B) H NO3 + Fe → --------------- + ----------- C) Mg SO4 + Zn → + ----------- D) Cu NO3 + Al → --------------- + ----------- E) H Cl + Mg → --------------- + ----------- F) K Cl + Na → --------------- + ----------- G) Hg Cl + K → --------------- + ----------- H) H ClO4 + Ag → --------------- + ----------- → --------------- + ------------ I) H2SO4 + Cu --------------- 3. Balancear por tanteo las siguientes ecuaciones: A) N2 + H2 → NH3 B) CaCl2 + C) NaHCO3 D) NO E) FeCL3 + H2SO4 → F) H2SO4 + NaOH → G) C6H12O6 → H) K NO3 + NaOH → + → Ca(OH)2 Na2CO3 + O2 → + H 2O + NaCl CO2 NO2 Fe2 (SO4)3 Na2SO4 + C2H5OH + K → → I) P4 O6 + Br2 J) Se F6 + H2 O K) Fe (OH)3 + L) Mg CO3 + + H2 SO4 H3PO4 HCl H2O CO2 K2 O + P2 Br4 → N2 + HF → → P4 O10 + Fe2 (SO4)3 Mg3 (PO4)2 H6 Se O6 + + H 2O C O2 + H 2O