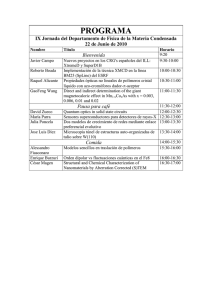
Repositorio Académico - Universidad de Chile
Anuncio

UNIVERSIDAD DE CHILE Facultad de Ciencias Químicas y Farmacéuticas BIOCOMPATIBILIZACIÓN DE NANOPARTÍCULAS METÁLICAS CON COPOLÍMEROS DE QUITOSANO Tesis para optar al grado académico de Magíster en Bioquímica, área de especialización Toxicología y Diagnóstico Molecular y Memoria para optar al Título de Bioquímica por: CLAUDIA MACARENA MOLINA PELAYO Directores de Tesis Dr. Marcelo Kogan Dr. Andrónico Neira-Carrillo Santiago, Chile 2010 UNIVERSIDAD DE CHILE Facultad de Ciencias Químicas y Farmacéuticas BIOCOMPATIBILIZACIÓN DE NANOPARTÍCULAS METÁLICAS CON COPOLÍMEROS DE QUITOSANO CLAUDIA MACARENA MOLINA PELAYO Directores de Tesis Dr. Marcelo Kogan Dr. Andrónico Neira-Carrillo Santiago, Chile 2010 II UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS QUÍMICAS Y FARMACÉUTICAS INFORME DE APROBACIÓN TESIS DE MAGÍSTER Se informa a la Dirección de Postgrado de la Facultad de Ciencias Químicas y Farmacéuticas que la Tesis de Magíster presentada por la candidata: CLAUDIA MACARENA MOLINA PELAYO Ha sido aprobada por la Comisión Informante de Tesis como requisito para optar al grado de Magíster en Bioquímica área de especialización Bioquímica Toxicológica y Diagnóstico Molecular y al título de Bioquímica, en el examen de defensa de Tesis rendido el día _____________________del 2010. Directores de Tesis: Dr. Marcelo Kogan ___________________________ Dr. Andrónico Neira ___________________________ Comisión Informante de Tesis: Dr. Yedi Israel (Presidente) ___________________________ Dr. Mehrdad Yazdani ___________________________ Dr. José Luis Arias ___________________________ III A mi familia… IV AGRADECIMIENTOS. En primer lugar, quiero expresar mis más profundos agradecimientos a mi familia, por quienes estoy aquí en este momento, muchas gracias por su constante apoyo y comprensión. Han sido el pilar fundamental durante todo este proceso y no encuentro las palabras para agradecer todo lo que han hecho por mí, mamá, papá, Jorge, Marta, Rafaela, Romina, tía Pilar y abuelita Marta: estas son las personas que más me han acompañado. Por supuesto mis padres han sido los principales responsables, con la crianza, los valores y el apoyo que me han dado. Mis hermanos son mis compañeros de vida, siempre hemos compartido buenos y malos momentos y mi tía Pilar es muy especial para mí, ya que siempre ha estado presente en mi vida estimulándome a desarrollarme como persona y como científica. Y, a pesar que mi abuelita ya no esté con nosotros, fue muy importante para mí. Sé que siempre podré contar con todos ustedes y, por supuesto, espero que sepan que siempre pueden contar conmigo también. Los amo mucho. V También quiero destacar a una persona muy especial para mí, que me ha acompañado bastante desde hace un tiempo, Carlos. Probablemente sea una de las personas que más ha tenido que soportar mis crisis de estrés, los momentos difíciles, las frustraciones, etc., pero debo agradecerle que me haya acompañado y ayudado todo lo posible. Carlos, eres un gran apoyo y compañero para mí, te amo y espero ser también un apoyo para ti, cuando lo necesites. No puedo dejar de mencionar a mis amigos!! Han sido demasiado importantes en mi vida académica y sé que no habría disfrutado tanto mis días de colegio y/o universidad sin ustedes: Estefanía, Valentirijilla, Alonso, Blanca, Matías, Juanito, Cataldo, Mitzy, Naty, Cristian, Nico. Muchas gracias a todos, ya que muchas veces (la mayoría) ustedes eran el motivo por el que iba a clases, gracias por hacerlas más agradables y, por supuesto, por todos los momentos que disfrutamos fuera de ellas, en especial con el grupo de “Los de atrás”. También quiero agradecer a mis profesores, en especial a los Dres. Andrónico Neira y Marcelo Kogan, por guiarme en el largo camino de tesis. En especial quisiera agradecer al profesor Marcelo Kogan por abrirme la puerta a un nuevo y fascinante mundo, la nanotecnología, no conocía nada al respecto y me alegro de haber trabajado con usted, muchas gracias. Al mismo tiempo, quiero agradecer a la Dra. Marcela VI Urzúa, por su gran aporte durante el desarrollo de mi tesis, y por sus amables consejos. Además, quisiera destacar a los Dres. Dante Miranda y Margarita Montoya, a quienes conocí al principio de mi carrera, y con quienes siempre me he mantenido en contacto. Muchas gracias, no sólo por todo lo que me enseñaron en el ámbito académico, sino también por sus consejos, su apoyo personal, las conversaciones que muchas veces tuvimos, las comidas y todas las vivencias, fueron siempre un agrado y espero no perder el contacto con ustedes. Al mismo tiempo, quiero agradecer a quienes son o han sido parte de este laboratorio y con quienes también compartí y pasé muy buenos momentos también, el profesor Javier Puente, la profesora Jacqueline Pezoa y Gladys. No puedo dejar de mencionar a mis compañeros del laboratorio de Nanobiotecnología, en especial a Luis Medel, Carolina Henríquez y Juan Mena a quienes conocí más cercanamente y con quienes disfruté muy buenos momentos. También quiero agradecer a Carolina Adura y Simón Guerrero, con quienes también compartí bastante en el laboratorio y a Nataly Silva, a quien no conozco mucho, pero que me ayudó y me acogió muy amablemente desde el principio. VII ÍNDICE. Contenido AGRADECIMIENTOS. ........................................................................................................... V ÍNDICE. .................................................................................................................................. VIII ABREVIATURAS..................................................................................................................... X RESUMEN. ............................................................................................................................ XII SUMMARY. ............................................................................................................................ XV INTRODUCCIÓN. ................................................................................................................... 1 Nanotecnología y su aplicación en biomedicina. ........................................................... 1 Distribución y toxicidad de nanopartículas de oro.......................................................... 5 Biocompatibilización de nanopartículas de oro. ............................................................. 9 Efectos de materiales sobre la coagulación sanguínea: influencia de la carga y de la energía superficial......................................................................................................... 12 Energía superficial. ........................................................................................................... 14 Una estrategia para reducir la energía superficial del quitosano. ............................. 16 Entrecruzamiento y caracterización de polímeros. ...................................................... 19 Obtención de nanopartículas de oro. ............................................................................. 22 Síntesis de nanocompósitos............................................................................................ 23 Efecto de tamaño y carga sobre la biodistribución de nanocompósitos. ................. 24 Evaluación de toxicidad. .................................................................................................. 25 Hipótesis. ............................................................................................................................ 28 Objetivos. ............................................................................................................................ 28 METODOLOGÍA .................................................................................................................... 30 1.- Síntesis de polímeros biocompatibles...................................................................... 30 VIII 2.- Síntesis de nanopartículas de oro ............................................................................ 32 3.- Conjugación con el péptido CLPFFD ....................................................................... 32 4.- Formación y caracterización de los nanocompósitos ............................................ 33 5.- Evaluación de la toxicidad .......................................................................................... 33 RESULTADOS. ..................................................................................................................... 38 1.- Síntesis de polímeros biocompatibles...................................................................... 38 2.- Síntesis y caracterización de nanopartículas de oro. ............................................ 46 3.- Conjugación y caracterización de las nanopartículas de oro con el péptido CLPFFD. ............................................................................................................................. 47 4.- Obtención y caracterización de nanocompósitos. .................................................. 48 5.- Evaluación de la toxicidad de los polímeros y de los nanocompósitos. ............. 52 DISCUSIÓN. .......................................................................................................................... 60 Obtención y caracterización de polímeros entrecruzados .......................................... 60 Obtención y caracterización de nanocompósitos......................................................... 61 Evaluación de la toxicidad ............................................................................................... 64 Efecto tamaño/carga ......................................................................................................... 65 Posible mecanismo de degradación del quitosano...................................................... 68 CONCLUSIONES. ................................................................................................................ 70 PROYECCIONES. ................................................................................................................ 72 REFERENCIAS. .................................................................................................................... 73 ANEXOS. ................................................................................................................................ 79 IX ABREVIATURAS. Aβ Péptido β-amiloide Au-NPs Nanopartículas de oro BSA Albúmina bovina (del inglés Bovine Serum Albumin) CLPFFD Cys-Leu-Pro-Phe-Phe-Asp (secuencia aminoacídica cisteína-leucinaprolina-fenilalanina-fenilalanina-ácido aspártico) CSFE Éster succinimidil de carboxifluoresceína diacetato (del inglés Carboxyfluorescein diacetate, Succinimidyl Ester) CTAB Bromuro de cetiltrimetilamonio (del inglés Cetyl Trimethyl Ammonium Bromide) DLS Dispersión Dinámica de la luz (del inglés Dynamic Light Scattering) EA Enfermedad de Alzheimer EDC N- Etil- dimetil aminopropil carbodiimida HAuCl4 Ácido cloro aúrico IR Espectroscopía Infrarroja MPS Sistema Fagocítico Mononuclear (del inglés Mononuclear Phagocyte System) MTS 3-(4,5-dimetiltiazol-2-il)-5-(3-carboximetoxifenil)-2-(4-sulfofenil)-2Htetrazolio NaBH4 Borohidruro de sodio X NC Nanocompósito PBS Buffer fosfato (del inglés Phosphate Buffered Saline) PS Polisiloxano PT Tiempo de Protrombina (del inglés Prothrombin time) PTT Tiempo de tromboplastina parcial (del inglés Partial Thromboplastin Time) Qo Quitosano SDS Dodecil sulfato sódico (del inglés Sodium Dodecyl Sulfate) TEM Microscopía Electrónica de Transmisión (del inglés Transmission Electron Microscopy) TGA Análisis Termogravimétrico (del inglés Thermogravimetric Analysis) UV Ultravioleta 1 Polímero entrecruzado 1, corresponde a una proporción de Qo:PS de 1:1 y equivale a un 50 % de Qo 2 Polímero entrecruzado 2, corresponde a una proporción de Qo:PS de 2:1 y equivale a un 67 % de Qo 3 Polímero entrecruzado 3, corresponde a una proporción de Qo:PS de 5:1 y equivale a un 83 % de Qo 4 Polímero entrecruzado 4, corresponde a una proporción de Qo:PS de 10:1 y equivale a un 90 % de Qo 5 Polímero entrecruzado 5, corresponde a una proporción de Qo:PS de 100:1 y equivale a un 99 % de Qo XI RESUMEN. A pesar de los grandes adelantos científicos y tecnológicos, hoy en día aún hay diversas enfermedades que no poseen un método de diagnóstico y/o de tratamiento temprano y efectivo. Es por ello que actualmente se está explorando el uso de nuevos materiales y tecnologías para resolver tales problemas. En este sentido, cabe mencionar el desarrollo de la nanotecnología, área de la ciencia que se dedica al control y desarrollo de materiales en la escala nanométrica (que incluye a materiales que posean al menos en una de sus dimensiones, tamaños de entre 1 y 100 nm). Los nanomateriales presentan interesantes propiedades que los convierten en una herramienta útil para la biomedicina. Un ejemplo de ello son las nanopartículas de oro (Au-NPs) que absorben la energía que se les suministra y la disipan de manera local, pudiendo además, por su tamaño, distribuirse por todo el organismo llegando a diferentes sitios de acción. Es por ello que en nuestro laboratorio se investiga el posible uso de las mismas para el tratamiento y diagnóstico de la Enfermedad de Alzheimer. Un ejemplo de ello es la conjugación de Au-NPs con el péptido CLPFFD, que reconoce agregados tóxicos de la proteína Aβ, presentes en pacientes que padecen la enfermedad de Alzheimer, para dirigirlas selectivamente a los mencionados agregados y así destruirlos. XII Sin embargo, tales nanopartículas presentan efectos adversos, debido a su carga superficial negativa, pudiendo generar trombogenicidad y/o opsonización, siendo fácilmente capturadas por el Sistema Fagocítico Mononuclear (MPS, del inglés Mononuclear Phagocyte System), lo que impediría su llegada al blanco terapéutico. Es por ello que al administrar las nanopartículas in vivo, llega al cerebro una muy pequeña proporción de la dosis inyectada acumulándose las mismas en hígado y bazo lo cual debe evitarse considerando futuras aplicaciones farmacéuticas. En la presente tesis, para evitar tales efectos, nanopartículas de oro fueron recubiertas con polímeros derivados del quitosano (Qo). No obstante, es importante destacar que el Qo presenta una elevada energía superficial, lo que se traduce en un efecto trombogénico, por lo que el Qo se entrecruzó con un polisiloxano (PS), polímero de baja energía superficial, con la finalidad de disminuir la energía superficial en el Qo. Dicha reacción de entrecruzamiento se realizó mediante el uso de un agente entrecruzante, EDC, que es capaz de activar el grupo carboxilo del PS para que reaccione con el grupo amino del Qo. Los polímeros derivados del Qo fueron caracterizados por termogravimetría, espectroscopía infrarroja y por medidas de ángulo de contacto. Posteriormente, se evaluó la trombogenicidad de los mismos mediante ensayos de coagulación, como así también sus efectos a nivel de la viabilidad celular en células de neuroblastoma humano, mediante ensayos con MTS. XIII En resumen, se obtuvieron polímeros entrecruzados derivados del Qo que presentaron una menor energía superficial respecto a la obtenida para el Qo solo. A partir de la disminución en la energía superficial se logró eliminar el efecto trombogénico y, al mismo tiempo, se disminuyó el efecto tóxico presentado a nivel de la viabilidad celular. Dichos polímeros se emplearon para recubrir las AuNPs, formándose así los nanocompósitos (NC) correspondientes que no presentaron efectos sobre la coagulación ni sobre la viabilidad celular, respecto del Qo. Los nanocompósitos obtenidos presentaron carga neta positiva, lo cual contribuirá a reducir la interacción con el MPS siendo esto muy relevante para futuras aplicaciones farmacéuticas. XIV SUMMARY. Despite of the great scientific and technological advances, there are several diseases that still doesn´t have an early and effective method of diagnosis and treatment. Because of that, today it is exploring about the use of new materials and technologies to solve this issue. In this sense, it is important to mention the development in nanotechnology which is an area of the science dedicated to control and develop materials on nanometric scale (include materials with at least one dimension of size between 1 to 100 nm). This nanomaterials exhibit new properties, an example are the gold nanoparticles (Au-NPs), that are capable of absorbing energy supplied and dissipate it locally, beside its capacity of distribute easily by all the organism due to their small size. For this reason in our laboratory it is investigated the potential use of AuNPs for the treatment and diagnosis of Alzheimer´s disease. One example is the conjugation of AuNPs with the peptide CLPFFD that recognizes the toxic aggregates of Aβ present in the brain of patients that suffer Alzheimer’s disease with the propose to destroy the mentioned aggregates. XV However, such nanoparticles show adverse effects, because of the negative superficial charge present in them, that could generate thrombogenicity and opsonisation, been easily captured by Mononuclear Phagocytic System (MPS), impeding their arrival to the therapeutic target. For this reason after an injection of nanoparticles the percentage of the injected dose that reaches the brain is very low being necessary to improve the drug delivery for future pharmaceutical applications. In the present thesis, to avoid these side effects, the nanoparticles will be capped polymers derivated from chitosan (Qo). Nevertheless, this polymer shows a high value of superficial energy, involving a thrombogenic effect. That´s why, in this thesis work, Qo was cross-linked with polysiloxane (PMS), a polymer with low superficial energy, expecting a decreasing in this energy, and use it to recover the Au-NPs. This reaction was possible by the use of a cross-linking agent, EDC, whom is capable to activate the carboxyl group of the PMS, to react with the amine group of Qo. The obtained copolymers were characterized by thermogravimetry, infrared spectroscopy and contact angle measures. On the other hand, the thrombogenic effects of the polymers were evaluated by means of a coagulation assay and their effects on cell viability on human neuroblastome cells were evaluated using MTS assay. XVI In summary, in this work it was obtained crosslinked derivates polymers from chitosan that shows a lower surface energy with respect to Qo. The copolymerization of Qo with PMS lead to the elimination of the thrombogenic effects and to a diminution of the effects on the cell viability. These copolymers were used for capping the AuNPs, obtaining nanocomposites, that did not show thrombogenic effects and neither a reduction of cell viability. These nanocomposites presented a positive charge which could contribute to avoid interaction with MPS which is very relevant for future pharmaceutical applications. XVII INTRODUCCIÓN. Nanotecnología y su aplicación en biomedicina. En la actualidad hay diversas enfermedades que aún no pueden diagnosticarse y/o tratarse de una manera que sea efectiva y temprana, como algunos tipos de cáncer y diversas enfermedades neurodegenerativas, tales como el Parkinson y la Enfermedad de Alzheimer (EA). Es por esto que se ha comenzado a investigar el uso de nuevas tecnologías con posibles aplicaciones en este tipo de enfermedades, y una de estas es la nanotecnología, área de la ciencia que se dedica al control y manipulación de la materia en una escala nanométrica. Un nanomaterial es aquel que posee, por lo menos en una de sus dimensiones, medidas nanométricas (de 1 a 100 nm) [Silva, 2008]. Desde hace algunos años, la nanotecnología ha cobrado gran importancia debido al desarrollo de nuevos materiales para su aplicación en diversas áreas. Un ejemplo de sus aplicaciones es el desarrollo de nanopartículas elaboradas a partir de distintos materiales para utilizarlas en biomedicina. El hecho de que las nanopartículas sean tan pequeñas permite que lleguen de manera más fácil a distintos sitios del organismo [Silva, 2008], y al mismo tiempo, son capaces de interactuar de manera única con los sistemas biológicos a nivel molecular [Wang, 2008], presentando mecanismos especiales de ingreso a las células pudiendo así atravesar diferentes barreras, como la hematoencefálica. 1 Las nanopartículas desarrolladas pueden otorgar capacidades nuevas y únicas para diversas aplicaciones biomédicas debido a que, en esta escala, los materiales (polímeros, metales, liposomas, entre otros) presentan interesantes y únicas propiedades. Algunos materiales, como los metales, en la escala nanométrica presentan especiales propiedades ópticas, electrónicas y magnéticas, las que no se presentan en el mismo material a escala mayor [Jain, 2007]. Todas estas propiedades permiten que las nanopartículas sean muy apreciadas para utilizarlas en el diagnóstico de enfermedades e incluso para el desarrollo de novedosas terapias. En particular, las nanopartículas de oro (Au-NPs) presentan propiedades ópticas y de contraste que han brindado diversas aplicaciones, como la detección por inmunobloting y la citometría de flujo, entre otras [Tan, 2005]. Asimismo, se ha reportado que las Au-NPs mejoran el contraste de imágenes en métodos radiográficos [Hainfeld, 2006] y por estos motivos se han vuelto muy útiles en diversas aplicaciones como la liberación controlada de fármacos (drug delivery), la biodetección y el diagnóstico por imagen. Una potencial aplicación de las Au-NPs es en el diagnóstico y tratamiento de la EA, un desorden neurodegenerativo que lleva a alteraciones progresivas de las funciones cognitivas incluyendo la memoria, el juicio, la toma de decisiones y el lenguaje, entre otras características [Klafki, 2006]. En dicha enfermedad se produce la acumulación de agregados tóxicos del péptido β-amiloide (Aβ), los que juegan un rol crucial en los eventos neurodegenerativos subyacentes a la EA. Dichos agregados son considerados por algunos científicos como los responsables directos del desarrollo de la EA [Walsh, 2007], por lo que se han intentado utilizar como un blanco para una intervención inmunoterapéutica, la que lamentablemente no ha tenido resultados muy prometedores [Taguchi, 2008], debido a las reacciones inflamatorias secundarias. En estudios recientes, realizados en nuestro laboratorio, se demostró que es posible la desagregación in vitro de agregados tóxicos de la proteína amiloide (Figura 1) a través 2 del empleo de Au-NPs conjugadas al péptido CLPFFD, las que son irradiadas mediante el uso de microondas de bajas potencias (0.1 W) [Kogan, 2006]. En este caso, el uso de las Au-NPs se debe a que estas son especies capaces de absorber la energía que se les suministra, disipándola de manera local (nanométricamente), lo que afectaría sólo a aquellas moléculas o células que estén directamente unidas a estas Au-NPs. Se ha observado que a pesar de haber suministrado pequeñas dosis de energía, es posible desagregar in vitro agregados tóxicos de Aβ y también evitar su re-agregación [Kogan, 2006]. Para que este tratamiento sea efectivo y selectivo, estas Au-NPs son conjugadas con el péptido CLPFFD (Figura 2), que reconoce una parte de la secuencia de Aβ [Olmedo, 2008] y se une a este mediante interacciones hidrofóbicas con uno de los núcleos o centros de agregación de Aβ, como LVFFA, secuencia a la que se une LPFF (Figura 3). Una vez unido CLPFFD a los agregados de Aβ se impide la unión de otra molécula del mismo, deteniendo el proceso de agregación. Esto ocurre porque se sustituye una valina (V) por prolina (P), generando así un efecto disruptor en la secuencia. Además, este péptido posee un ácido aspártico (D) al final de la secuencia con lo que se logra solubilizar el péptido CLPFFD, debido a un aumento en su polaridad. La cisteína (C) agregada al inicio de la secuencia se utiliza debido a que este aminoácido posee en su estructura un grupo sulfhidrilo (SH), que favorece la unión con la Au-NP. El azufre reacciona con el oro generándose un enlace de tipo covalente entre ambos. 3 Figura 1: Microfotografía de microscopía electrónica de transmisión (TEM) de agregados de Aβ en presencia de Au-NPs antes y después de la irradiación (abajo). Arriba: imágenes de AuNPCLPFFD unidas a los agregados Aβ después de una incubación de Aβ 10 µM y AuNP-CLPFFD por 48 h. Abajo: imágenes de AuNP-CLPFFD previamente unido a Aβ después de 8 h de irradiación. Las flechas horizontales indican la presencia de dímeros y trímeros, las flechas verticales indican la presencia de partículas aisladas, y los círculos, la presencia de fibras pequeñas. Las barras son 500 nm. Nano Letters, 2006; 6 (1): 110-115. Figura 2: Au-NP conjugada con el péptido CLPFFD. 4 Figura 3: Secuencia del péptido Aβ. Se destaca en rojo la secuencia que interacciona con CLPFFD. En azul se representan los aminoácidos hidrofóbicos (L y F), en amarillo la prolina (P) y en celeste el ácido aspártico (D), aminoácido con una cadena lateral polar. Distribución y toxicidad de nanopartículas de oro Ahora bien, en un escenario biológico hay algunas consideraciones importantes para el uso de las nanopartículas en aplicaciones biomédicas como son la estabilidad y la potencial toxicidad. En estudios recientes llevados a cabo en nuestro laboratorio, se demostró que las Au-NPs recubiertas con el péptido CLPFFD son más estables en medios biológicos y menos tóxicas que las Au-NPs sin recubrir, siendo este hecho muy relevante de cara a futuras aplicaciones biomédicas [Olmedo, 2008]. Asimismo, considerando el uso de las Au-NPs para el tratamiento y diagnóstico de la EA, es necesario que las mismas sean capaces de llegar al cerebro para así actuar sobre los agregados tóxicos característicos de tal enfermedad. La biodistribución y eliminación de las nanopartículas es absolutamente dependiente del tamaño de las mismas, observándose que cuanto mayor es el tamaño, menor es la proporción que llega al cerebro. Al respecto, se ha observado que Au-NPs de 10 nm se distribuyen por todo el organismo, llegando al cerebro, aunque en una muy baja proporción respecto de la dosis inyectada. Sin embargo, se acumulan mayoritariamente en hígado, riñón y bazo [Lasagna-Reeves, 2010; Sonavane, 2008]. 5 Este hecho no es sorprendente, ya que en estudios de biodistribución de fármacos, se ha observado que las cantidades de éstos, que efectivamente son capaces de atravesar la barrera hematoencefálica y llegar al cerebro son muy bajas. Por ejemplo, sólo llega al cerebro un 0,02% de una dosis de morfina, administrada periféricamente, pero tal cantidad es suficiente para producir el efecto farmacológico deseado. De hecho, para la mayoría de los fármacos dirigidos al Sistema Nervioso Central, la cantidad que llega al cerebro es de menos de un 0,2% con una dosis suministrada de manera periférica. Por lo tanto, a partir de estos datos, se puede concluir que se requiere muy poca cantidad de un fármaco en el SNC para que se produzca un efecto terapéutico [Banks, 2008]. En estudios recientes llevados a cabo en nuestro laboratorio se demostró que al conjugar Au-NPs de 13 nm de diámetro con el péptido CLPFFD, un 0.05% de la dosis administrada del correspondiente conjugado llega al cerebro de ratas luego de una inyección intraperitoneal [Guerrero, 2010] (Figura 4), mientras que sólo un 0.01% de la dosis inyectada llega al cerebro para el caso de Au-NPs sin conjugar con dicho péptido. En ambos casos, la mayor concentración de nanopartículas se encontró en bazo e hígado siendo los niveles en el cerebro muy bajos (Figura 5). Interesantemente, la conjugación de las Au-NPs con CLPFFD contribuyó a disminuir la retención en órganos como bazo, lo cual puede atribuirse a una disminución de la carga negativa de la partícula. Considerando futuras aplicaciones terapéuticas se debe aumentar la llegada de las Au-NPs al cerebro, lo que se puede lograr disminuyendo la captura de las mismas por algunos de estos órganos e incrementándose así los niveles de nanopartículas que lleguen al cerebro. Respecto a la eliminación de las nanopartículas, se ha observado que para aquellas partículas que no pueden ser eliminadas por el sistema renal (límite de 5 nm de diámetro), son eliminadas por el sistema biliar, pero aquellas que poseen un radio hidrodinámico mayor a 200 nm muestran una tasa de eliminación más rápida que partículas que poseen un radio hidrodinámico menor a 200 nm (pero mayor a 5 nm) [Owens, 2006]. 6 Figura 4: Concentraciones de Au-NP-CLPFFD-carboxifluoresceína en cerebro de rata después de una inyección intraperitoneal de nanopartículas en una concentración de 20 nM. (Extraído de Guerrero y cols, Nanomedicine, 5:897 -913, 2010). Figura 5: Distribución de Au-NPCLPFFD, unidas a carboxifluoresceína, en bazo, hígado y riñón después de una inyección intraperitoneal de nanopartículas en una concentración de 20 nM. (Extraído de Guerrero y cols, Nanomedicine, 5:897 -913, 2010). 7 Una de las principales razones por las cuales las Au-NPs no alcanzan a llegar al sitio de acción es debido a procesos como la opsonización o remoción de éstas por el Sistema Fagocítico Mononuclear (MPS) [Owens, 2006; Li, 2008], o también a la interacción con diversas moléculas presentes en el medio, como proteínas o elementos figurados de la sangre [Lasagna-Reeves, 2010], lo que dificultaría en gran medida la llegada al sitio de acción, que en el caso de la EA es el cerebro. Los macrófagos del MPS tienen la capacidad de remover, en unos pocos segundos, de la circulación sanguínea a las Au-NPs luego de que éstas sean administradas intravenosamente. Tales macrófagos se encuentran principalmente en el hígado, siendo denominados células de Kupffer, los que no reconocen directamente a las nanopartículas, pero sí a las opsoninas adheridas a su superficie, y una vez que las reconocen ocurre la fagocitosis. A partir de estos datos, lo que se busca es evitar que las opsoninas se unan a la superficie de la nanopartícula para así impedir que sean fagocitadas, aumentando su tiempo de vida media en el torrente sanguíneo para favorecer así la llegada al sitio de acción deseado. Respecto a esto, se ha observado que la opsonización ocurre más rápidamente en las partículas hidrofóbicas que en las hidrofílicas, debido a un aumento en la adsorción de proteínas en tales superficies. También se ha demostrado una correlación entre la carga superficial y la opsonización, observándose que las partículas neutras presentan una menor opsonización que aquellas cargadas [Guerrero, 2010; Fontana, 2001]. Respecto a esto, un grupo de investigadores analizó la tasa de opsonización de liposomas de aproximadamente 200 nm con distintas cargas superficiales, observándose que la tasa de eliminación de los liposomas cargados negativamente (potencial zeta de - 40 mV) fue significativamente más alta que para los liposomas neutros (± 10 mV) y aumentándose su captura por el MPS en el hígado, lo que estaría indicando que las células fagocíticas favorecen la captura de partículas cargadas negativamente y de esta forma se aumentaría la tasa de eliminación del torrente sanguíneo [Owens, 2006; Levchenko, 2002]. 8 Ahora bien, como se mencionó previamente, las nanopartículas también se pueden unir a diversas proteínas plasmáticas y respecto a esto, se ha reportado que los complejos nanopartícula-proteína forman la denominada corona de proteínas [Neus, 2009]. Dicha corona está formada por diferentes proteínas como fibrinógeno, globulinas, histonas, insulina, y se mantiene estable por 24 horas. El control de las propiedades físicas, químicas y biológicas de la adsorción de proteínas sobre las nanopartículas define en gran medida el destino de la nanopartícula en los sistemas vivos [Lacerda, 2010]. Entonces, se tiene claro que el uso de las Au-NPs ofrece múltiples ventajas debido a su tamaño y propiedades únicas. Sin embargo, su principal desventaja es la captura por el sistema inmune, lo que incluso podría generar cierta toxicidad. Actualmente, se sabe que ciertas propiedades de las nanopartículas, tales como su tamaño, su carga superficial, la hidrofobicidad/hidrofilicidad pueden tener influencia directa sobre la compatibilidad de estas con el sistema inmune. En base a esto, una de las formas de aumentar la funcionalidad de las nanopartículas es cambiar sus propiedades fisicoquímicas como su tamaño y/o carga [Zolnik, 2010], por ejemplo a través del recubrimiento con biomoléculas como péptidos o polímeros orgánicos. Biocompatibilización de nanopartículas de oro. Una de las formas de reducir la interacción de las nanopartículas con especies endógenas es recubrirlas con polímeros que posean cargas positivas de manera tal de evitar que las mismas sean capturadas por el MPS [Dobrovolskaia, 2008]. En este sentido, en la literatura existen algunos ejemplos de biocomptaibilización de Au-NPs con polímeros como alginato o quitosano [Manca 2008]. Al recubrir las nanopartículas con los polímeros se obtiene un nanocompósito (Figura 6). 9 Figura 6: Esquema del recubrimiento de Au-NP previamente conjugadas con el péptido CLPFFD. Idealmente, el material polimérico debe ser biocompatible y con capacidad para interactuar con las nanopartículas, formando complejos estables. Un material que cumple muy bien con estas características es el quitosano (Figura 7), un polímero natural, obtenido a partir de la desacetilación de quitina; cuando el nivel de desacetilación de la quitina es mayor al 50%, el polímero se denomina quitosano (Qo). Entre sus características más importantes se puede mencionar que es un polímero lineal de D-glucosamina (por lo que posee grupos amino primarios), es biodegradable, biocompatible, antibacteriano, no antigénico, biofuncional, de bajo costo, con una excelente capacidad para formar films, alta fuerza mecánica, susceptible a modificaciones químicas y catiónico, siendo ideal para aplicaciones biológicas, ya que también es hidrofílico. Sin embargo, el uso de Qo posee un inconveniente, ya que este polímero presenta un efecto trombogénico, debido a su elevada energía superficial, la que promueve una alta capacidad adhesiva de las plaquetas, induciendo de esta manera la aceleración en la formación del trombo [Kweon, 1998]. Respecto a esto, varios estudios demuestran que el Qo tiene efectos sobre la coagulación sanguínea in vitro y en la activación plaquetaria (Figura 8). Sin embargo, la hemostasis causada por el Qo no posee una explicación clara sobre a qué nivel estaría actuando, aunque se ha 10 indicado que el Qo tiene la capacidad de activar los sistemas del complemento y de la coagulación sanguínea [Benesch, 2002; Minami, 1998; Brandenberg, 1984]. También se ha reportado que la densidad de carga que posee el quitosano incidirá en su toxicidad, indicándose que a mayor densidad de carga aumentaría su efecto tóxico, por lo que una modificación en este polímero que disminuya la densidad de carga, disminuiría o eliminaría su posible toxicidad [Kean, 2010]. En resumen, desafortunadamente el Qo promueve la adsorción de proteínas plasmáticas, la adhesión plaquetaria y la activación y desarrollo del trombo [Banks, 2008]. Figura 7: Estructura del Quitosano. 11 Efectos de materiales sobre la coagulación sanguínea: influencia de la carga y de la energía superficial. A fin de simplificar su entendimiento, la cascada de la coagulación ha sido dividida en dos vías: la intrínseca y la extrínseca, las que convergen finalmente en una sola vía que lleva a la formación completa del trombo (Figura 8). Tales vías son iniciadas por el factor XII y el VIIa/TF, respectivamente. Varias de las etapas de la coagulación requieren calcio (Ca) y fosfolípidos para su actividad y secuencialmente se van activando los distintos factores o células a medida que son requeridos en cada una de las vías mencionadas [Monroe, 2006]. Como se ha mencionado previamente, el Qo ejerce un efecto trombogénico en la sangre, lo que puede deberse a los grupos amino que posee, ya que a pH fisiológico presenta una carga neta positiva y alta hidrofilicidad, lo que puede traducirse en una alta energía superficial (tema analizado más adelante) y debido a esto, el Qo estaría actuando en la vía extrínseca de la coagulación (Figura 8), y más específicamente, a nivel de la activación plaquetaria activándose así el proceso trombogénico, debido a que las plaquetas poseen en su superficie una carga negativa, por lo que interactuarían con el Qo por unión electrostática y al unirse el Qo a esta superficie promovería más rápidamente la unión de más plaquetas y/o diversas otras moléculas presentes en el medio, para comenzar la formación del trombo. Por otro lado, las Au-NPs, debido a su carga negativa, podrían actuar al principio de la vía intrínseca de la cascada de la coagulación, particularmente en la activación del factor XII, debido a que este reconoce superficies extrañas (preferencialmente aquellas con carga superficial negativa) y se une a ellas, adsorbiéndose sobre la superficie cargada negativamente (que en este caso sería la Au-NP). 12 Figura 8: Cascada de la coagulación. En resumen, los efectos sobre la coagulación pueden darse por la energía superficial o por la presencia de cargas en el nanomaterial. 13 Energía superficial. Se denomina así a la tensión superficial crítica (γc) de una superficie sólida y se mide en unidades de fuerza por área de superficie (en el Sistema Internacional, N/m). Este dato se obtiene a partir de datos de ángulo de contacto con distintos solventes y permite caracterizar los materiales de acuerdo a las energías superficiales que presenten, esto se debe a que la tensión superficial crítica es una característica única de la superficie de un sólido y está relacionada con la constitución química más externa de tales superficies. Por ejemplo, las superficies de los fluorocarbonos son intrínsecamente de baja energía superficial, por lo que poseen valores de γc bajos y muestran pobres cualidades adhesivas, contrario a lo que ocurre con aquellas superficies que presentan alta energía superficial [Baierm, 1970]. La medida de energía superficial se utiliza ampliamente en el rubro de la industria minera, esto se debe a que en este rubro se emplea un proceso denominado flotación para separar los minerales de interés de la ganga. La flotación de una partícula sólida (como un mineral) en un líquido, depende del ángulo de contacto entre la partícula y el líquido y debido a que el ángulo de contacto puede modificarse a través de factores como grasa superficial (lo que aumentaría el ángulo de contacto), entonces la flotación de las partículas también puede ser regulada o controlada [Toral, 1973; Adamson, 1990]. Esto se debe a que los diversos componentes de los minerales tienen distintas tendencias a flotar en la superficie del agua y estas tendencias pueden aumentarse por la presencia de aditivos, como aceites colectores, los que se adsorben fuertemente en la superficie del mineral, con lo que aumenta el ángulo de contacto y se hace posible así la flotación; en cambio, tales aceites no se adsorben sobre la ganga, que sí se moja por el agua y por lo tanto no flota [Baierm, 1970]. 14 Respecto a los estudios de ángulo de contacto mencionados, estos son datos indicativos sobre la mojabilidad y reactividad de los distintos materiales, tanto de interés industrial como de interés biológico [Monroe, 2006]. Ahora, en relación con el efecto de la energía superficial de los distintos materiales sobre la coagulación sanguínea, se han realizado estudios sobre la pared de vasos sanguíneos y se ha determinado que estos están constituidos principalmente por lipoproteínas de baja energía cuya capa más externa se encuentra principalmente compuesta de hidrocarburos. El daño a esta capa superficial puede exponer proteínas de la matriz, de mayores energías, lo que podría generar una trombosis intravascular [Monroe, 2006]. Es por esto que es necesario caracterizar los polímeros obtenidos, determinando su energía superficial, y comparar tales resultados con el Qo para así determinar si disminuye o no la energía superficial al entrecruzarlo con un polímero hidrofóbico (como el polisiloxano) y, a su vez, evaluar si disminuye o se elimina el efecto trombogénico. Este procedimiento probablemente debiera realizarse sobre cualquier material que se quiera utilizar en posibles aplicaciones biomédicas, ya que permite determinar si estos interferirán o no con la cascada de la coagulación, lo que puede ser deseable en algunos casos. 15 Una estrategia para reducir la energía superficial del quitosano. Como se ha mencionado, una de las formas de reducir la energía superficial del Qo es entrecruzándolo con polímeros de baja energía superficial, como los polisiloxanos, polímeros que además poseen una alta estabilidad térmica y son hidrofóbicos. Con el entrecruzamiento entre estos polímeros se pretende eliminar su efecto trombogénico, al disminuir su energía superficial [Depan, 2008; Huntmacher, 2001; Senthil, 2005]. Los polisiloxanos (PS), Figura 9A, son materiales atractivos que han sido utilizados extensamente para fabricar aparatos de bajo costo y desechables. Entre sus principales características ventajosas se pueden mencionar: transparencia óptica, biocompatibilidad, bajo costo, durabilidad, alta flexibilidad, permeabilidad a los gases y química superficial versátil, entre otras. El hecho de que presente tantas ventajas, lo hace un sustrato útil para diversas aplicaciones, y por lo tanto, también lo convierte en un polímero valioso para uso en dispositivos biomédicos, tales como catéteres y dentaduras postizas, entre otros. Sin embargo, los PS aún tienen algunos defectos como adsorción fuerte de moléculas hidrofóbicas pequeñas, biomoléculas y células, las cuales limitan enormemente su aplicación posterior, lo que se podría solucionar al entrecruzarlo con Qo [Owens, 2006; Zhao, 2008]. Para que este tipo de polímero pueda entrecruzarse con el Qo, requiere algún grupo funcional (o reactivo) en su estructura que pueda interaccionar con el grupo amino del Qo. Es por esto que una buena estrategia es utilizar un PS funcionalizado (Figura 9B) con un grupo como el carboxílico (COOH), para que así pueda reaccionar con el grupo NH2 del Qo, formando así un enlace covalente entre ambos polímeros. 16 Figura 9: A) Estructura general de un polisiloxano (PS) y B) Estructura de un derivado, funcionalizado con un grupo carboxílico (COOH). La unión de un polímero sintético como el PS funcionalizado con un grupo carboxilo (Figura 9B) y uno natural, como el Qo (Figura 7), conservando las cualidades del polímero natural, como la biodegradación y la bioactividad, entre otras, se puede lograr mediante la copolimerización por injerto [Kim, 2002]. De esta manera, se incorporan al Qo nuevas propiedades, como la reducción de su energía superficial, de forma simple y efectiva. Por todos estos motivos, es que en el presente trabajo se empleará esta estrategia para obtener un copolímero que comparta las ventajas de cada uno de los polímeros mencionados (Qo y PS), mientras que al mismo tiempo, disminuya o corrija sus efectos no deseados de una forma que podría denominarse “mutualismo” (Figura 10). 17 Posteriormente, este nuevo polímero entrecruzado se utilizó para recubrir las AuNPs y formar los nanocompósitos (NCs), evitando así los efectos trombogénicos del Qo y al mismo tiempo aumentando la llegada de las Au-NPs al cerebro, dado que estaría disminuyendo la captación de las nanopartículas por el MPS, ya que su carga negativa quedaría recubierta por el polímero, debido a que tales cargas negativas contribuyen a la interacción electrostática con las cargas positivas del Qo, disminuyendo así la probabilidad de ser capturadas por dicho sistema. De esta misma forma, también se inhibiría la adsorción de proteínas en su superficie. Todo esto aumentaría el tiempo de circulación de las Au-NPs, incrementando así la probabilidad de que lleguen al cerebro. Figura 10: Reacción de entrecruzamiento de Qo y un derivado de PS. 18 Entrecruzamiento y caracterización de polímeros. El entrecruzamiento de polímeros se puede realizar por diversos métodos, uno de ellos es mediante el fotoentrecruzamiento, en ausencia de catalizador, para lo cual, ambos polímeros son sometidos a radiación ultravioleta (UV) por un tiempo y en condiciones determinadas hasta que se forma el entrecruzado entre ambos polímeros [Depan, 2008]. Otra forma de entrecruzar polímeros es mediante el uso de un agente entrecruzante, y como en el presente caso se dispone de un PS funcionalizado con un grupo carboxilo, que es el polímero que se pretende entrecruzar con Qo, se busca un agente entrecruzante que sea capaz de activar algunas de las moléculas funcionales de estos polímeros. Una vez obtenido tal entrecruzado, se puede caracterizar por diversas técnicas para así determinar si efectivamente se formó dicho entrecruzado, entre estas técnicas se pueden mencionar el Análisis Termogravimétrico (TGA), la Espectroscopía Infrarroja (IR) y medidas de ángulo de contacto. A continuación se detallarán las técnicas aquí utilizadas, para la caracterización de los entrecruzados obtenidos. - Análisis Termogravimétrico (TGA): esta técnica se basa en medir la variación en la masa de una muestra (en este caso, un polímero) al ser sometida a un aumento progresivo de la temperatura, en una atmósfera controlada. Los cambios en la masa de la muestra se van registrando e informan de la temperatura a la que se descompone. Así, se puede determinar si una muestra es más o menos termorresistente que otra [Depan, 2008]. Esta técnica también se utiliza para determinar si una muestra polimérica es pura, es una mezcla física de polímeros o son polímeros entrecruzados unidos covalentemente. 19 Para determinar si existe o no un polímero entrecruzado, el copolímero deberá presentar una temperatura de descomposición distinta para tal polímero a la de los polímeros originales, lo que significará que el entrecruzado es más o menos resistente que los polímeros originales. - Espectroscopía Infrarroja (IR): Esta técnica aprovecha el hecho de que las moléculas absorben a frecuencias específicas que son características de su estructura. Esto se debe a que cada molécula posee un modo vibratorio en particular, que es lo que se mide finalmente, y a medida que presenta una mayor cantidad de enlaces, mayor será el número de señales o picos que se observarán en el espectro infrarrojo obtenido. El espectro se obtiene al hacer pasar un haz de luz infrarroja a través de la muestra. Luego, se examina la cantidad de luz transmitida y esto indica cuánta energía fue absorbida a cada longitud de onda. El análisis del espectro y por lo tanto de sus características de absorción revela detalles de la estructura molecular de la muestra. Cuando la frecuencia del IR es la misma que la frecuencia vibratoria de un enlace, ocurre la absorción. Esta técnica funciona por lo tanto, para muestras con enlaces covalentes. Entonces, al utilizar esta técnica se puede analizar si efectivamente se forma el compuesto o molécula que se esperaba, ya que aparecerían o desaparecerían ciertos enlaces, o bien pueden ocurrir ambas situaciones de manera simultánea [Kweon, 1998; Depan, 2008], produciéndose la aparición o desaparición de señales en el espectro. - Medición de ángulo de contacto: Esta determinación permite conocer la mojabilidad de una superficie sólida (polimérica, en este caso), la que se 20 relaciona con su energía superficial de tal superficie. El ángulo que se mide corresponde al que se muestra en la Figura 11. Posteriormente, a partir de la obtención del ángulo de contacto y conociendo las tensiones superficiales de los líquidos utilizados para determinar dicho ángulo, se puede obtener la energía superficial del polímero en cuestión. Esto se hace utilizando la ecuación de la recta que se obtiene al graficar el coseno del ángulo de contacto versus la tensión superficial [Fox, 1952]. Figura 11: Medición del ángulo de contacto de un líquido sobre una superficie sólida. Así, se pueden obtener conclusiones acerca de cómo interactuarían los polímeros con el medio en que se encuentre, si son más o menos hidrofílicos, poseen mayor o menor energía superficial y por lo tanto mayor o menor reactividad con el medio. 21 Obtención de nanopartículas de oro. La síntesis de Au-NPs se realiza principalmente mediante la reducción de una sal de oro, como HAuCl4. Esta reducción puede realizarse de diversas formas como se menciona a continuación. Una de las formas más comunes para la reducción del oro es con citrato de sodio, en este caso, la solución de oro es sometida a reflujo y posteriormente se le agrega el citrato de sodio. De esta manera, según la relación de sales de oro/citrato se logra controlar el tamaño de las nanopartículas. Otro método para reducir el oro y obtener posteriormente las nanopartículas es mediante el uso de bromuro de cetiltrimetilamonio (CTAB) con la sal de oro mencionada previamente, adicionando también borohidruro de sodio (NaBH4) [Guerrero, 2008]. Finalmente, se puede mencionar un método fotoquímico para reducir y obtener las Au-NPs, este es mediante la irradiación con rayos X. Para esto, se utiliza el detergente tritón, que se mezcla con la solución de la sal de oro (HAuCl4). Esta solución se irradia con 40 kV y 40 mA, por 40 ó 60 minutos para completar la reducción del precursor de oro en la solución [Long, 2009]. Una vez obtenidas las nanopartículas, estas pueden ser caracterizadas por diversas técnicas como Microscopía Electrónica de Transmisión (TEM), Espectroscopía UV/Visible, Microscopía de Fuerza Atómica, medidas de potencial zeta, entre otras [Minami, 1998]. 22 En este trabajo se utilizó el primer método mencionado para la síntesis de AuNPs, que consiste en la reducción de la sal de oro con citrato de sodio. Síntesis de nanocompósitos. Los nanocompósitos (NCs) también pueden ser obtenidos de distintas formas y, al mismo tiempo, también pueden estar constituidos de distintos materiales, pueden ser sólo mezclas de polímeros o metales recubiertos por polímeros u otros materiales de interés. En este caso, nos interesa recubrir las Au-NPs con polímeros derivados del Qo (entrecruzados con un PS funcionalizado con el grupo carboxilo). Respecto a esto, Tan y Zhang proponen como metodología utilizar Au-NPs de 5 nm de diámetro y Qo al 1%, que se agrega gota a gota sobre la solución de nanopartículas bajo agitación constante y posteriormente la solución es lavada y centrifugada repetidas veces [Tan, 2005], obteniéndose los correspondientes nanocompósitos. Otra metodología propuesta es más simple y para esto se utilizan nanopartículas previamente centrifugadas, a las que se les agrega una cantidad determinada de Qo y de agua milli-Q. Esta mezcla se deja a temperatura ambiente por 24 horas, para posteriormente caracterizar el producto obtenido. En este caso, el grado de agregación entre las nanopartículas y los polímeros dependerá de las cantidades que se agreguen de cada uno, lo que dependerá de las aplicaciones deseadas [Hong, 2009]. 23 Efecto de tamaño y carga sobre la biodistribución de nanocompósitos. Como se ha mencionado previamente, es muy importante determinar las propiedades físicoquímicas superficiales de cualquier partícula o molécula que se quiera aplicar en medios biológicos. Entre tales propiedades, las más importantes son el tamaño, la carga superficial, lo grupos funcionales que recubran la partícula y la hidrofilicidad, esto se debe a que ambas características son las que más influyen en el destino final de la partícula y/o su captura por el MPS [Zahr, 2006]. Por ejemplo, ya se ha explicado que las partículas que poseen cargas negativas son más susceptibles de ser capturadas por el MPS, por lo tanto es ideal el utilizar partículas neutras o cargadas positivamente para evadir tal sistema o bien utilizar partículas cargadas negativamente si lo que se pretende es dirigirlas al sistema inmune. Esto está demostrado, ya que se ha reportado que al reducir la carga negativa de las Au-NPs (- 40 mV aprox.) recubriéndolas con un polímero neutro (llega a - 8 mV aprox.) conlleva a una disminución en su captura por el MPS [Zhang, 2009], aunque también en dicha captura tiene gran influencia el tamaño. Con respecto al tamaño, ya se ha mencionado que a menor tamaño, mayor es la biodistribución de estas por todo el organismo, incluso llegando al cerebro, lo que es claramente observable con partículas de unos 10 nm de diámetro [Lasagna-Reeves, 2010; Sonavane, 2008]. Mientras que partículas más grandes (más de 250 nm) tienden a quedar atrapadas en órganos del MPS, como bazo o hígado. Es por esto que si se desea llegar a un blanco específico, como el cerebro en este caso, es importante utilizar partículas muy pequeñas (10 – 15 nm) o bien partículas más grandes que se puedan degradar en el trayecto al cerebro. Este es el caso de los nanocompósitos (NCs), como los preparados en el presente trabajo de tesis, donde las Au-NPs están 24 recubiertas por un polímero entrecruzado de Qo y PS, que debe ser biocompatible y biodegradable, por lo que, a pesar que el tamaño sea mayor a los 250 nm, se espera que estos NCs se degraden en el trayecto para liberar las Au-NPs y así permitir su llegada al cerebro. Al respecto, hay evidencia de nanopartículas basadas en Qo de unos 250-300 nm de diámetro, son capaces de atravesar barreras y acumularse en un tejido específico, como un tumor, lo que se debe probablemente a su capacidad deformable y su alta capacidad de ser incorporado en las células [Kim, 2010]. Evaluación de toxicidad. Como se mencionó previamente, para poder considerar las aplicaciones biomédicas, es necesario evaluar la potencial toxicidad que presentan los polímeros y los NCs para lo cual se realizarán los ensayos toxicológicos a nivel hematológico y a nivel de viabilidad celular. Esto se realiza previo al recubrimiento de las Au-NPs con el polímero entrecruzado y también una vez formados los NCs. Como se ha mencionado anteriormente, el Qo es capaz de inducir un efecto trombogénico siendo entonces necesario realizar ensayos de coagulación sanguínea para evaluar si los nuevos copolímeros obtenidos perdieron la capacidad trombogénica. Mientras que el ensayo de viabilidad en neuronas también es requerido debido a que se ha descrito que el Qo puede atravesar la barrera hematoencefálica llegando al cerebro y los NCs a obtener en el presente trabajo serán utilizados para ser dirigidos a ese órgano [Yao, 2008; Aktas, 2005]. Asimismo, es importante considerar que la incorporación del PS al Qo aporta un componente que aumenta la hidrofobicidad del copolímero, incrementando así la posibilidad de que el Qo modificado llegue al cerebro. Entonces, en los ensayos de citotoxicidad se evaluará la viabilidad de una línea celular de neuroblastoma (SHSY5Y), ya que los nanocompósitos se utilizarán para el posible desarrollo de una terapia contra la enfermedad de Alzheimer. 25 Otros grupos ya han realizado ensayos de citotoxicidad utilizando diversas nanopartículas y se ha reportado, por ejemplo, que las nanopartículas de plata presentan citotoxicidad, genotoxicidad y además, son antiproliferativas, conclusiones obtenidas a partir de la evaluación de la morfología y la viabilidad celular, la actividad metabólica, el estrés oxidativo y el ensayo de micronúcleos [AshaRani, 2009]. Por otro lado, también se ha evaluado la toxicidad de Au-NPs en ratas y se ha observado que estas no presentan toxicidad, pero si observaron un ingreso a los tejidos de manera eficiente, llegando también al cerebro, aunque en baja cantidad, indicando que serían capaces de atravesar la barrera hematoencefálica. Los estudios realizados incluyen sobrevida, conducta, peso, morfología de los órganos, bioquímica de la sangre, e histología de los órganos [Lasagna-Reeves, 2010]. Como se ha mencionado, hay diversos ensayos para determinar o evaluar la viabilidad celular y algunas alternativas posibles son las siguientes: bromuro de 3-(4,5 dimetiltiazol-2-il)2,5 difeniltetrazolio (MTT), carboximetoxifenil)-2-(4-sulfofenil)-2H-tetrazolio 3-(4,5-dimetiltiazol-2-il)-5-(3- (MTS), (4-[3-(4-Iodofenil)-2-(4- nitrofenil) -2H-5-tetrazol-1,3-benceno disulfonato (WST-1), entre otros. En los ensayos mencionados, se determina la actividad mitocondrial por la reducción de los colorantes utilizados, los que varían su color al estar en presencia de células viables y por lo tanto, pueden medirse a nivel de su absorbancia por espectrofotometría, la que será directamente proporcional al metabolismo celular, aspecto que se relacionará directamente con su viabilidad. La metodología utilizada en el presente trabajo se basó en la reducción del MTS. Además, debido a que las células de neuroblastoma (SH-SY5Y) que se utilizaron son adherentes, es necesario evaluar si los polímeros obtenidos impiden o alteran de alguna forma la adherencia de estas células. Para ello se utilizó fluorescencia, empleando como sonda marcadora carboxifluoresceína éster succinidil 26 diacetato (CFSE). En este ensayo, las células son marcadas con esta sonda y posteriormente se incuban con los distintos polímeros, dejando un grupo control. Por otro lado, para determinar la hemocompatibilidad de los polímeros entrecruzados, hay diversos métodos aceptados para su evaluación in vitro, como por ejemplo: tiempo de protrombina, tiempo de tromboplastina parcial activada, tiempo de retracción de coágulo, tiempo de recalcificación de plasma y tiempo de coagulación de sangre completa, entre otros [Lacerda, 2010]. Se ha postulado previamente, que el Qo actuaría en la vía extrínseca de la coagulación, mientras que las Au-NPs podrían hacerlo en la vía intrínseca, ambas acelerando el tiempo de coagulación (Figura 8). Para evaluar la vía extrínseca se utiliza principalmente el tiempo de protrombina (PT), mientras que para evaluar la vía intrínseca se utiliza el tiempo de trombina parcial o activada (PTT) y para evaluar la cascada de coagulación en general se utiliza el tiempo de coagulación de sangre completa, ensayo que se utilizó en el presente trabajo de tesis. En resumen, esta memoria tiene como objetivo la obtención de nuevos Qo modificados que no presenten efectos tóxicos, como neurotoxicidad y/o trombogenicidad, los que se utilizarán para recubrir Au-NPs con el fin de incrementar su paso a través de la barrera hematoencefálica, evitando así el Sistema Fagocítico Mononuclear y los posibles efectos trombogénicos. En trabajos posteriores a esta memoria se evaluarán factores como la toxicidad y distribución de los nanocompósitos in vivo para futuras aplicaciones en terapia y diagnóstico de la enfermedad de Alzheimer. 27 Hipótesis. Dado que el quitosano presenta un efecto trombogénico y que el polisiloxano presenta un efecto anticoagulante, un copolímero de ambos no tendrá efectos sobre la coagulación. Además, debido a que ambos polímeros son biocompatibles, el copolímero tampoco será citotóxico, por lo que se utilizará para obtener nanocompósitos de nanopartículas que sean no citotóxicos y hemocompatibles. Objetivos. Objetivo general: Obtener copolímeros derivados de quitosano (Qo-PS) y nanocompósitos de tales copolímeros con nanopartículas de oro (Au-NPs), con y sin conjugar al péptido CLPFFD, que no sean citotóxicos y sean hemocompatibles. 28 Objetivos específicos 1.- Obtener y caracterizar nuevos polímeros derivados del quitosano (quitosano entrecruzados con un polisiloxano funcionalizado, Qo-PS). 2.- Sintetizar y caracterizar las Au-NPs. 3.- Conjugar las Au-NPs con el péptido CLPFFD y caracterizar el conjugado. 4.- Obtener y caracterizar los nanocompósitos, utilizando los polímeros derivados, Qo-PS, para recubrir las Au-NPs. 5.- Evaluar la toxicidad de los polímeros derivados del quitosano (Qo-PS) y de los nanocompósitos formados por los conjugados Au-NPs-CLPFFD y los polímeros derivados del quitosano. 5.1: Ensayos de coagulación: determinar los efectos en el tiempo de coagulación de los distintos polímeros derivados de quitosano (Qo-PS) en estudio. 5.2: Ensayos de viabilidad celular. 29 METODOLOGÍA 1.- Síntesis de polímeros biocompatibles. Estos polímeros se formaron mediante una reacción de entrecruzamiento entre quitosano (Qo) de alto peso molecular y un polisiloxano (PS) funcionalizado con un grupo carboxilo, para así permitir su activación por un agente entrecruzante, denominado N-etil-N,N (dimetilaminopropil) carbodiimida (EDC) y, una vez activado, su posterior reacción con el grupo amino del Qo, para formar un enlace amida entre ambos polímeros; el EDC se agregó al 1 % del volumen total de reacción. El medio de reacción también contenía Imidazol 0,1 M a pH 6.0, con la finalidad de estabilizar el intermediario y favorecer el entrecruzamiento (Adaptado del protocolo “Modify and label oligonucleotide 5´ phosphate groups”, detallado por ©Pierce Biotechnology, Inc., 12/2006). Posteriormente, el tubo de reacción se incubó a 37 °C y se mantuvo toda la noche con agitación constante. La reacción se detuvo al día siguiente mediante la utilización de Tris-HCl y posteriormente se purificó el producto obtenido, para esto, primero se evaporaron los solventes presentes utilizando un rotavapor y posteriormente el producto sólido obtenido se secó en una estufa al vacío y con temperatura ambiente. Una vez seco, el producto se masó para disolverlo posteriormente en ácido acético (al 2%) a una concentración final de 0,5 %, al igual que el Qo. Estos polímeros se formaron en distintas proporciones de Qo:PS, las que serán 1:1 (denominada en adelante 1), 2:1 (2), 5:1 (3), 10:1 (4) y finalmente 100:1 (5), las que corresponden a un porcentaje de Qo de 50, 67, 83, 90 y 99%, respectivamente. 30 1.2.- Caracterización de los polímeros. 1.2.1 Análisis termogravimétrico y Espectroscopía infrarroja: Para la caracterización por análisis termogravimétrico (TGA) [Rodríguez-Baeza, 2003], los polímeros deben secarse muy bien, para eliminar lo máximo posible la contaminación con el agua, mientras que para caracterizar los polímeros por espectroscopía infrarroja (IR), primero se secaron y una vez bien secos, se molieron finamente, mezclándose con bromuro de potasio. Esta mezcla pulverizada posteriormente se prensó mecánicamente para formar un pellet, a través del cual pasa el haz IR. 1.2.2 Energía superficial: otra caracterización realizada en el presente trabajo es la medición de los ángulos de contacto de los distintos polímeros entrecruzados y del Qo solo, para calcular posteriormente la energía superficial de cada uno de estos polímeros y así evaluar si hay o no disminución en ésta. Para ello, primero se formaron los films de cada polímero. Los mismos fueron neutralizados con NaOH 0,1 M, lavados con agua milli-Q hasta que el pH de la solución fue alrededor de 6,5 a 7 y puestos a secar en una estufa al vacío y a temperatura ambiente, para eliminar lo máximo posible el ácido acético (solvente de estos polímeros), que podría alterar los resultados. Posteriormente, se agregaron 8 µL del solvente correspondiente (agua destilada, anilina o cloroformo) en cada film de polímero y se proyectó la imagen de la gota en una pared blanca, a la que se le sacaron varias fotografías para medir el ángulo de contacto que se forma con cada polímero, a través del programa Image J. Por otro lado, también se midió la tensión superficial de los solventes utilizados, para emplearlos junto con los otros datos recolectados de ángulo de contacto y realizar el gráfico de Zisman, donde se grafica el coseno del ángulo de contacto versus la tensión superficial de los solventes, para cada polímero, luego se obtuvo la ecuación de la recta y a partir de esto la energía superficial de cada polímero (cuando el coseno del ángulo es igual a 1). 31 2.- Síntesis de nanopartículas de oro Las nanopartículas de oro (Au-NPs) se prepararon por reducción de una sal de oro (HAuCl4) con citrato de sodio. Para esto, 100 mL de HAuCl4 1 mM se colocaron en un balón y se sometieron a reflujo constante por unos 5 a 10 minutos, luego se agrega rápidamente la solución de citrato de sodio 38,8 mM, calentada previamente a 50 – 60 °C, dejándose a reflujo por 30 minutos, hasta obtener una solución roja y posteriormente se dejó enfriar a temperatura ambiente. Después, la solución obtenida se filtró y almacenó a 4 °C. El tamaño de las nanopartículas pudo ser controlado modificando la razón citrato/ HAuCl4 [Zharov, 2005]. Las Au-NPs fueron caracterizadas por Espectrofotometría UV/Vis y Microscopía Electrónica de Transmisión (TEM) [Klafki, 2006]. Para la caracterización por TEM, se prepararon las rejillas de la siguiente forma: se colocaron 10 µL de la solución de Au-NPs, dejándose secar durante toda la noche y observándose al día siguiente por TEM. 3.- Conjugación con el péptido CLPFFD Esta se realizó mezclando Au-NPs 5 nM con una solución de péptido stock (1mg/mL), en una proporción de volumen de 10:1. Esta conjugación se realizó en presencia de un exceso de moléculas de péptido para lograr el máximo recubrimiento posible. Después de la incubación, se obtuvo una monocapa del péptido y con el fin de eliminar el péptido libre, la muestra se dializó por 3 noches frente a citrato [Olmedo, 2008], almacenándose posteriormente a 4 °C. El péptido fue sintetizado por el estudiante Simón Guerrero durante el desarrollo de su tesis de pregrado. Los conjugados obtenidos se caracterizaron por UV-Vis y TEM. 32 4.- Formación y caracterización de los nanocompósitos Para formar los nanocompósitos (NCs), se centrifugó 1 mL de Au-NPs (con y sin conjugar) a 16000 x g por 7 minutos para luego extraer el volumen correspondiente del solvente, que va a depender de la proporción Au-NP: polímero que se pretenda formar. Posteriormente, se agregó el volumen de la solución de polímero elegida (Qo o entrecruzado), luego se completó a 1,5 mL con agua milli-Q y se dejó a temperatura ambiente por 24 horas [Hong, 2009]. Estos NCs se caracterizaron por espectrofotometría UV-Vis, TEM, medidas de potencial zeta y de Dynamic Light Scattering (DLS) [Kim, 2008; Murthy, 2008]. 5.- Evaluación de la toxicidad 5.1 Ensayo de coagulación: para esto se utilizó sangre completa humana (donante sano) en 0,109 M de citrato de sodio 3,2%, la que se incubó por 5 minutos a 37 °C con la muestra que corresponda en una proporción 1:1 (500 µL de sangre y 500 µL de muestra). En todos los casos se añadió cloruro de sodio (NaCl), para mantener la osmolaridad adecuada (150 mM en que debe estar la sangre para impedir la lisis de los glóbulos rojos), pero en el caso del control, se agregó sólo NaCl 300 mM (500 µL), en lugar de la muestra. Es por esto que, en el caso de los tubos que llevan muestras, se les agregó también un volumen de NaCl de mayor concentración para así evitar la hemólisis (si el medio posee mayor concentración de sales, entonces el agua presente dentro del eritrocito tiende a salir (fenómeno conocido crenación), produciéndose la destrucción celular, por el contrario, si la concentración del medio es menor, entonces tiende a entrar agua a la célula (fenómeno conocido hemólisis), provocando la ruptura celular. Posteriormente, para activar la coagulación, se utilizó 250 µL de cloruro de calcio 50 mM; en el instante en que agregó el cloruro de calcio, se comenzó a medir el tiempo que tarda en formarse el trombo, el que se detuvo cuando estuvo completamente formado (cuando no escurra líquido por las paredes del tubo) [Koziara, 33 2005; Okamoto, 2003]. A continuación se presenta un esquema simplificado (Esquema I) del procedimiento para realizar el ensayo de coagulación sanguínea. Polímero Esquema I: Procedimiento para determinar el tiempo de coagulación. En el caso de la evaluación de los polímeros, estos se depositaron en el fondo del tubo donde se realizó el ensayo, se dejaron secar allí, en una estufa al vacío y a temperatura ambiente y posteriormente fueron neutralizados con hidróxido de sodio (NaOH) 0,1 M y lavados con agua milli-Q para descartar los posibles efectos del ácido acético que podría haber quedado presente sobre el polímero (recordar que los polímeros utilizados están disueltos en ácido acético al 2%, para quedar a una concentración final de 0,5 %). En cada tubo se agregaron 400 µL de la solución del polímero correspondiente, el cual una vez seco, corresponde a 2 mg del polímero. 34 Por otro lado, al utilizar los NCs obtenidos, estos se encontraron en solución, pero como en este caso el principal solvente es agua milli-Q, no se ve alterado el proceso de coagulación. Sin embargo, de todas maneras se utilizó NaCl, en cada tubo, para mantener constante la presión osmótica (150 mM). 5.2 Ensayo de viabilidad: Se empleó la técnica de 3-(4,5-dimethylthiazol-2- yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium (MTS). En este ensayo, se evaluó la viabilidad celular mediante la determinación de su actividad mitocondrial. Para ello se utilizó el MTS, reactivo que en presencia de células viables llega a la mitocondria donde es reducido, originando un compuesto coloreado (formazán) [Hiebl, 2010]. Para determinar las diferencias en la coloración, se utilizó un espectrofotómetro y se midió a 490 nm de longitud de onda, mientras mayor fue la absorbancia (intensidad del color azul), mayor es la viabilidad celular en ese pocillo. 35 5.3 Por otro lado, se realizó un ensayo de fluorescencia para determinar si la presencia de los polímeros, induce o no algún efecto sobre la adherencia de las células a tales polímeros (o copolímeros). Para realizar este experimento, se utilizó CSFE (éster succinimidil de carboxifluoresceína diacetato) como marcador celular fluorescente, y se realizó de la siguiente manera: primero se contaron las células a utilizar (en este caso, células de neuroblastoma humano, SH-SY5Y), una vez obtenida la cantidad de células que se necesitan, estas se centrifugaron a 2100 x g por 4 minutos y se resuspendieron en PBS, suplementado con BSA al 1 %, en este medio se marcaron con la sonda fluorescente, CSFE, dejándolas a 37 °C por 15 minutos. Una vez marcadas, se volvieron a centrifugar, se lavaron con PBS, se resuspendieron en medio y posteriormente se sembraron 10000 células por pocillo en una placa de 96 pocillos. Luego del tiempo determinado (en este caso 0.5, 1, 2 y 72 horas) se removió todo el medio del pocillo y se agregó medio nuevo. Entonces, al quitar el medio antiguo, se retiraron también las células que no lograron adherirse a la superficie. Finalmente, la fluorescencia detectada es proporcional al número de células. De esta manera se comparó las muestras con el control. En el caso de la evaluación de los polímeros, esta se realizó de manera similar a lo hecho en el ensayo de coagulación, ya que antes de sembrar las células, los polímeros se agregaron a placas de 96 pocillos (100 µL de cada polímero). Posteriormente se dejaron secando en una estufa al vacío, a temperatura ambiente, para que se evaporara el solvente (ácido acético). Una vez secos, cada pocillo fue lavado y neutralizado con NaOH 0,1 M y agua Milli-Q y secado nuevamente. Debido a que estas placas ya han sido manipuladas, como se mencionó, perdieron su esterilidad, por lo que es necesario esterilizarlas nuevamente y para esto se utilizó óxido de etileno, gas muy tóxico, ampliamente utilizado para este fin, ya que destruye cualquier tipo de organismo vivo. Las placas a esterilizar se introdujeron en una bolsa que también contiene una ampolla de óxido de etileno, luego de sellarla, se rompió la ampolla y se dejaron por 12 horas aproximadamente (el óxido de etileno ya se ha evaporado completamente), luego de esto, la bolsa fue abierta, pero dejada bajo la 36 campana de extracción por 24 horas, para permitir su ventilación completa y asegurar que no queden rastros de óxido de etileno [Terragno, 2004]. Este procedimiento también se realizó para evaluar la viabilidad celular frente a los polímeros utilizando como técnica el MTS y una vez teniendo las placas estériles nuevamente, se sembraron las células y se procedió con los ensayos de viabilidad y de fluorescencia, como se han mencionado previamente. 37 RESULTADOS. 1.- Síntesis de polímeros biocompatibles. Los polímeros entrecruzados derivados de quitosano, formados por quitosano (Qo) y polisiloxano (PS), fueron obtenidos como se detalló en la metodología, empleando un agente entrecruzante que produce la activación del grupo carboxilo (que se encuentra en el PS funcionalizado), facilitando la formación del enlace amida con el grupo amino del Qo como se observa en la Figura 12, y estos entrecruzados fueron caracterizados, con el fin de determinar si realmente se formaron tales entrecruzados y cuáles serían sus características superficiales principales. La caracterización se realizó mediante análisis termogravimétrico (TGA), espectroscopía infrarroja (IR) y por medición de ángulos de contacto para la obtención de la energía superficial. Posteriormente se compararon todos los resultados obtenidos entre las distintas proporciones de los polímeros entrecruzados con los polímeros originales, Qo y PS. Estos resultados se detallan en las Figuras 13 a 16. En los termogramas (Figuras 13 y 14), se observó que los entrecruzados obtenidos presentaron diferente estabilidad térmica respecto a los polímeros originales. En base a estos resultados, se puede apreciar que los copolímeros obtenidos presentan una menor resistencia a la temperatura, respecto al Qo y al PS, lo que se evidencia en la disminución en la temperatura a la que se degradan. El Qo lo hace a 313°C y el PS a 475°C aproximadamente (Figura 13), mientras que los entrecruzados presentan una estabilidad térmica que alcanza entre los 215 y 255°C (Figura 14). Estos 38 resultados indican que efectivamente, en las muestras analizadas se obtienen los nuevos derivados Qo-PS. Figura 12. Reacción mediante la cual EDC activa el grupo carboxilo de PS para que reaccione con el grupo amino del Qo, para formar finalmente el entrecruzado. Por otra parte, en los espectros FT-IR de los 5 entrecruzados, se observó una banda característica que corresponde a la presencia del enlace amida (Figura 15), y es justamente mediante este enlace que se forma el entrecruzado de los polímeros (grupo amino, NH2, del Qo al reaccionar con el grupo carboxilo, COOH, del PS), y que no se observa en los espectros de los polímeros Qo y PS (Figura 15). También se puede observar que en los copolímeros aparecen las bandas características, tanto del Qo como del PS, que pertenecen a los grupos amino libre y a los grupos siloxanos (Si-OSi), respectivamente (Figura 16). Todo esto confirma la formación de los entrecruzados, que presentan espectros muy similares entre ellos. Es importante destacar que Kweon [Kweon, 1998] obtuvo resultados IR similares a los obtenidos en el presente trabajo. 39 Figura 13. Termogramas de A) quitosano (Qo) y B) polisiloxano (PS) funcionalizado con grupo carboxilo. Figura 14:. Termogramas de los polímeros entrecruzados obtenidos a partir de las cinco proporciones formadas. Las proporciones corresponden a las siguientes: A) entrecruzado 1 (proporción de Qo:PS = 1:1, 50% de Qo), B) entrecruzado 2 (proporción Qo:PS = 10:1, 90% de Qo) y E) entrecruzado 5 (proporción de Qo:PS = 100:1, 99% de Qo). En cada gráfico se indica la temperatura de descomposición. 40 Figura 15: Espectros IR de PS funcionalizado con el grupo carboxilo (A) y Qo de alto peso molecular (B), con sus señales características indicadas en cada espectro. Figura 16: Espectros IR de los distintos polímeros entrecruzados y de los polímeros originales, con sus bandas características destacadas. Las distintas proporciones de Qo:PS son las siguientes: A) 1:1, B) 2:1, C) 5:1, D) 10:1 y E) 100:1, correspondientes al 50, 67, 83, 90 y 99% de Qo respectivamente. 41 Además, con el objetivo de determinar la energía superficial de los polímeros se realizaron medidas de ángulo de contacto (Figura 17) del Qo sin entrecruzar y de cada una de las proporciones obtenidas de los polímeros entrecruzados y con solventes de polaridades distintas. Determinar la energía superficial es importante ya que cuanto menor es esta, existe un menor efecto trombogénico [Kweon, 1998]. Para esto se prepararon films de Qo y de los polímeros entrecruzados obtenidos, a los cuales se les agregó 8µL del solvente correspondiente sobre las distintas superficies poliméricas, esta gota se posó sobre la superficie, más o menos expandida, dependiendo de la polaridad del solvente y de la energía superficial del polímero, observándose una imagen como la que se muestra en la Figura 17. La finalidad de esto fue evaluar si los entrecruzados efectivamente presentan una disminución en la energía superficial, respecto del Qo, al entrecruzarlo con el PS funcionalizado. En este estudio, se graficó el coseno del ángulo de contacto versus la tensión superficial de los solventes utilizados (Figura 19), obteniéndose así la ecuación de la recta, a partir de la cual se calcula la energía superficial. Este procedimiento se realizó tanto a 25, como a 37 °C, siendo esta última la temperatura que más se asemeja a las condiciones fisiológicas. Los resultados obtenidos se detallan en las Figuras 18 a 20, apreciándose que sí hay una disminución en la energía superficial del Qo, al entrecruzarlo con el PS, observando resultados muy similares en ambas temperaturas estudiadas (25 y 37 °C) y en las distintas proporciones obtenidas de los polímeros entrecruzados, por lo que sólo se muestran los resultados obtenidos a 37 °C, ya que los experimentos de toxicidad también fueron realizados a esta temperatura. No se realizó este procedimiento con el PS debido a que es soluble en agua, por lo que no fue posible determinar los ángulos de contacto. 42 Figura 17: Fotografía utilizada para medir el ángulo de contacto de los distintos polímeros entrecruzados, agregando el solvente respectivo. Este ejemplo corresponde a una gota de anilina sobre un film de entrecruzado con un porcentaje de Qo de 99%. Solvente Tensión superficial a 25 °C Tensión superficial a 37 °C (dyn/cm) (dyn/cm) Agua 71,5 67,5 Anilina 39 37 Cloroformo 27,5 25 Figura 18: Datos de tensión superficial para cada solvente, a 25 y 37 °C. 43 Figura 19: Gráficos de Zisman, utilizados para obtener la energía superficial de los polímeros entrecruzados en sus distintas proporciones (A a E) y para el Qo (F). Las proporciones de Qo:PS son las siguientes: A) 1:1, B) 2:1, C) 5:1, D) 10:1 y E) 100:1, correspondientes al 50, 67, 83, 90 y 99% de Qo, respectivamente. 44 La energía superficial es la que se obtiene a partir de las ecuaciones de la línea de tendencia de los gráficos en la Figura 19. La energía superficial corresponde a la que se obtiene cuando cos θ = 1. Así, se obtuvieron los siguientes resultados: Polímero Ángulo de contacto Energía superficial -1 % Qo Θ agua Θ anilina Θ cloroformo (mNm ) 100 % (Qo) 54,6 35,2 9,1 20,9 99 % (5) 53,8 34,5 9,7 20,5 90 % (4) 51,9 34,4 10,5 19,8 83 % (3) 49,6 31,4 12,8 19,8 67 % (2) 49,1 31,6 13,0 19,4 50 % (1) 44,4 30,0 14,1 17,2 Figura 20: Tabla con resultados de energía superficial obtenidos para cada polímero a 37 °C. A partir de la tabla de resultados mostrada en la Figura 20, podemos ver que existe una clara correlación entre los polímeros con distinto porcentaje de Qo en su composición con la energía superficial obtenida, la que se ve disminuida con un mayor contenido de PS, ya que este le confiere mayor carácter hidrofóbico al film polimérico, por lo que tiene menor capacidad de interaccionar con el medio. Resultados similares ya han sido reportados previamente por Dong Kweon [Kweon, 1998] y si bien la disminución en la energía superficial no es muy grande, es suficiente para eliminar el efecto trombogénico que presenta el quitosano por sí solo (resultados que se describen más adelante), por lo que en base a estos resultados se podría concluir que se obtuvo un polímero entrecruzado que a priori será más hemocompatible que el Qo. 45 2.- Síntesis y caracterización de nanopartículas de oro. Las nanopartículas de oro (Au-NPs) se prepararon por reducción de una sal de oro (HAuCl4) con citrato de sodio. Estas nanopartículas poseen un tamaño promedio de 12 nm de diámetro y fueron caracterizadas mediante espectrofotometría UV/Visible, Microscopía Electrónica de Transmisión (TEM), potencial zeta y Dynamic Light Scattering (DLS), con el fin de confirmar su presencia, tamaño, carga y concentración. Los resultados de TEM y UV/Vis se presentan en la Figura 21, A y B, y concuerdan con los obtenidos por Guerrero y colaboradores [Guerrero, 2010]. Mientras que las determinaciones de DLS y potencial zeta indicaron que las Au-NPs tienen un diámetro hidrodinámico de 12 ± 2 nm y un potencial zeta de – 54,3 ± 2,9 mV. Figura 21: A) Micrografía de TEM, donde se observan Au-NPs de 12 nm de diámetro (se incluye un histograma para indicar la dispersión de tamaño, que se correlaciona con el ancho en la señal de absorbancia). B) Espectro de absorbancia de Au-NPs de 10 nm, la absorbancia máxima es a los 519 nm de longitud de onda. 46 3.- Conjugación y caracterización de las nanopartículas de oro con el péptido CLPFFD. La conjugación se realizó mezclando Au-NPs con una solución de péptido. Luego de la síntesis descrita en la metodología, los conjugados se caracterizaron mediante las mismas técnicas utilizadas para la caracterización de las Au-NPs solas (TEM, UV/Vis, Potencial zeta y DLS). Los resultados de TEM y UV/Vis se muestran en las Figuras 22, A y B, respectivamente. Al observar estas imágenes, se puede apreciar que en el espectro UV/visible hay un desplazamiento en la absorbancia máxima, respecto al de las Au-NPs sin recubrir, lo que se debe al recubrimiento de las Au-NPs con el péptido CLPFFD, lo que genera un desplazamiento en la banda del plasmón de resonancia. Estos resultados son similares a lo observado por Olmedo y colaboradores [Olmedo, 2008]. Asimismo, dichos autores determinaron que cada Au-NP se encuentra funcionalizada con alrededor de 400 moléculas de péptido. Respecto al tamaño y carga, se determinó que estas Au-NPs conjugadas al péptido CLPFFD presentan un diámetro hidrodinámico de 17 ± 2 nm y una carga de – 43,7 ± 1,5 mV. 47 Figura 22: A) Micrografía de TEM, donde se observan Au-NPs conjugadas al péptido CLPFFD. B) Espectro de absorbancia de Au-NPs conjugadas, la absorbancia máxima es a los 526 nm de longitud de onda, debido al desplazamiento del plasmón de resonancia. 4.- Obtención y caracterización de nanocompósitos. Esto se realizó con las nanopartículas con y sin conjugar al péptido CLPFFD, como se explica en la metodología. La caracterización de estos nanocompósitos (NCs) se realizó por TEM, espectrofotometría UV/Vis, DLS y potencial zeta. Estos NCs se formaron utilizando todos los copolímeros obtenidos, pero se seleccionó aquel que presenta mayor estabilidad siendo el que posee un porcentaje de quitosano de 83% (y 17% de PS) correspondiendo a la proporción de Qo:PS = 5:1. Los NCs se caracterizaron por espectrofotometría UV/Vis analizados. Los resultados obtenidos se detallan en las Figuras 23 y 24, respectivamente. En ellas es posible observar un desplazamiento en la banda del plasmón de resonancia, debido al recubrimiento de las nanopartículas con los polímeros ya mencionados. También se obtuvieron NCs con distintas proporciones de Au-NP:polímero, para así seleccionar los que presentaran mayor estabilidad, en la Figura 25 se observa un caso de inestabilidad, observado en 48 todos los polímeros utilizados, que se evidencia en la desaparición de la banda del plasmón de resonancia, debido a la excesiva agregación de las nanopartículas en tales casos (en el anexo se presentan otros espectros UV/visibles, a partir de los cuales se seleccionó la proporción de Au-NPs : polímero y el derivado de Qo más estables). En las imágenes de TEM podemos observar que los polímeros tienen un efecto agregante en las nanopartículas. Respecto a esto, Tan y colaboradores, al igual que Hong y colaboradores han demostrado que esta agregación dependerá de la cantidad de polímero que se mezcle con las nanopartículas proporción nanopartícula-polímero [Hong, 2009; Tan, 2005]. Figura 23: A) Micrografía de TEM, donde se observan los nanocompósitos (NCs) formados con el polímero entrecruzado 3, que corresponde a la proporción 5:1 de Qo:PS (83% de Qo) y en una proporción de Au-NP:polímero de 1:9. B) Espectro de absorbancia de los mismos NCs, en este caso la absorbancia máxima es a los 546 nm de longitud de onda, debido a un desplazamiento mayor en el plasmón de resonancia, debido al recubrimiento de las Au-NPs y al aumento de tamaño. 49 Figura 24: A) Micrografía de TEM, donde se observan los NCs formados sólo con Qo en una proporción de Au-NP:Qo de 1:9. B) Espectro de absorbancia de los mismos NCs, en este caso la absorbancia máxima es a los 627 nm de longitud de onda, debido también al desplazamiento en el plasmón de resonancia, aunque en este caso es mayor. Figura 25: Espectro UV/Vis de NCs con una proporción de NP:Polímero de 1:4,5. Se utilizaron los polímeros entrecruzados 1 (50% de Qo), 2 (67% de Qo), 3 (83% de Qo), 4 (90% de Qo) y 5 (99% de Qo) y también se utilizó el quitosano solo (Q). 50 Polímero que recubre Au-NPs Tamaño (nm) Potencial Zeta (mV) 100 % (Qo) 456,2 ± 10,8 64,79 ± 0,59 99 % (5) 309,6 ± 11,2 39,92 ± 2,44 90 % (4) 274,4 ± 4,3 43,2 ± 1,07 83 % (3) 347,2 ± 17,2 49,93 ± 1,17 67 % (2) 274,6 ± 9,3 46,0 ± 1,05 50 % (1) 319,8 ± 40,6 43,11 ± 0,76 (% Qo) Au-NP 12,0 ± 2 -54,3 ± 2,910 Figura 26: Tabla que muestra los resultados de tamaño de los NCs formados con los distintos polímeros entrecruzados obtenidos y con el Qo sin funcionalizar. En este caso las Au-NPs utilizadas no se encuentran conjugadas al péptido CLPFFD. Polímero que recubre Tamaño (nm) Au-NP-CLPFFD (% Qo) Potencial Zeta (mV) 100 % (Qo) 1777,9 ± 645,5 53,44 ± 0,98 99 % (5) 363,3 ± 32,7 36,36 ± 0,87 90 % (4) 314,1 ± 18,4 34,43 ± 0,77 83 % (3) 295,0 ± 5,5 34,23 ± 0,57 67 % (2) 303,9 ± 8 41,72 ± 1,31 50 % (1) 460,3 ± 23,3 46,52 ± 1,42 Au-NP-CLPFFD 12,0 ± 2 -43,7 ± 1,510 Figura 27: Tabla que muestra los resultados de la medición del potencial zeta de los NCs formados con los distintos polímeros entrecruzados obtenidos y con el Qo solo. En este caso, las Au-NPs utilizadas se encuentran recubiertas por el péptido CLPFFD. 51 A partir de los resultados presentados, se concluye que al recubrir las nanopartículas, con y sin conjugar al péptido CLPFFD, con los distintos polímeros el potencial zeta es positivo, con lo que se esperaría una disminución considerable en la captura por el MPS, y al mismo tiempo aumenta el tamaño de tales partículas. 5.- Evaluación de la toxicidad de los polímeros y de los nanocompósitos. Para evaluar la toxicidad de los polímeros así como de los nanocompósitos (NCs), se realizaron ensayos de toxicidad a nivel hematológico, donde se evaluó el posible efecto trombogénico de los distintos polímeros o NCs y también efectos sobre la viabilidad celular. 5.1: Ensayos de coagulación: En primer lugar, se evaluó el efecto que podrían presentar los polímeros sobre el tiempo de coagulación sanguínea, los resultados se pueden observar en la Figura 28. Al observar estos resultados se puede concluir que los polímeros entrecruzados (derivados del Qo) no presentaron un efecto significativo en el tiempo de coagulación, respecto al control, mientras que al hacer el mismo experimento con el Qo sin entrecruzar con el PS, se observó un efecto trombogénico, que se evidencia por la disminución en el tiempo de coagulación respecto al control, diferencia que es significativa estadísticamente, con un P<0,5, obtenido utilizando el test de Student. Para realizar este experimento, se formaron films de los polímeros en los tubos de borosilicato que se utilizan para hacer el ensayo, debido a que estos polímeros sólo son solubles en ácido acético y este interfiere en la coagulación, produciendo la lisis 52 del glóbulo rojo. Además, cada ensayo se realizó en un medio con NaCl, para mantener la osmolaridad adecuada. Figura 28: Efectos de los distintos polímeros en el tiempo de coagulación sanguínea. La muestra 1 corresponde al polímero entrecruzado en una proporción de Qo:PS = 1:1 (50 % de Qo); de la misma forma siguen las muestras que continúan, la muestra 2 corresponde a la proporción 2:1 (67% de Qo), la 3 corresponde a la proporción 5:1 (83 % de Qo), la 4 corresponde a la proporción 10:1 (90 % de Qo) y la muestra 5 corresponde a la proporción 100:1 (99 % de Qo), mientras que la última muestra, Qo, corresponde a Qo sin recubrir con PS. * La diferencia entre el Qo y el control (CT), es significativa, con un P < 0,5. Posteriormente, se evaluó el posible efecto que tendrían las Au-NPs sobre la coagulación sanguínea, debido a que, como se ha mencionado previamente, estas poseen carga superficial negativa, lo que podría inducir la activación de la coagulación por la vía intrínseca. Para esto, se determinaron los efectos de las Au-NPs con y sin conjugar al péptido CLPFFD. En este caso, se utilizó como control, el citrato de sodio a una concentración de 1,2 mM, debido a que las nanopartículas se encuentran disueltas en este medio. Una vez analizado esto, se puede observar, en la Figura 29, que ni las nanopartículas sin conjugar, ni las conjugadas al péptido, alteran el tiempo que tarda en formarse el trombo, respecto al control, lo que nos indica que no presentan un 53 efecto trombogénico (ni anticoagulante). Siendo este resultado muy interesante de cara a futuras aplicaciones de las Au-NPs. Figura 29: Coagulación de Au-NPs solas y con el péptido CLPFFD, comparadas con el control citrato. La concentración de las nanopartículas usadas es de 5 mM. Por otro lado, se realizó este ensayo de coagulación para evaluar los posibles efectos de los NCs formados (Figura 30). Para formar los NCs se utilizaron nanopartículas sin conjugar al péptido CLPFFD y nanopartículas conjugadas al péptido. En ambos casos se observó que no hubo efecto significativo en el tiempo de coagulación, ni siquiera con los NCs formados con el Qo sin entrecruzar con el PS. 54 Figura 30: Resultados del ensayo de hemocompatibilidad con los nanocompósitos (NC) obtenidos, en la primera barra se ve el control, sólo con NaCl, la segunda corresponde a los NCs formados a partir de nanopartículas sin conjugar al péptido CLPFFD y recubiertas con el polímero entrecruzado 3 (proporción de Qo:PS = 5:1, que corresponde a un 83 % de Qo), en la tercera barra se ve el NC formado con nanopartículas conjugadas a CLPFFD y recubiertas con el polímero 3 (5:1, 83% de Qo), en la cuarta barra se ve el efecto de nanopartículas sin conjugar recubiertas con Qo y en la última barra se ve el efecto de las nanopartículas conjugadas y recubiertas con Qo. 5.2: Ensayos de viabilidad celular: En los gráficos detallados en la figura a continuación (Figura 31), se representa la viabilidad celular frente a los distintos polímeros aquí analizados. A las 24 horas, ni el Qo ni los Qo modificados producen efectos apreciables sobre la viabilidad, mientras que a las 48 y 72 horas se producen efectos marcados, reduciéndose la misma. Notablemente, en el caso de los Qo modificados, dicho efecto es considerablemente menor que el presentado por el Qo. Este fenómeno podría deberse a la disminución en la energía superficial que estos presentan respecto al Qo. La disminución en la viabilidad celular podría estar dada por un aumento en la muerte celular al estar en presencia de los polímeros o por una disminución en la proliferación celular, lo que a su vez podría deberse a una detención en el ciclo celular o a un problema de las células para adherirse a la superficie polimérica. 55 Viabilidad de polímeros en células de neuroblastoma humano Figura 31: Resultados de los ensayos de viabilidad celular, para determinar la posible citotoxicidad de los distintos polímeros, a 24, 48 y 72 horas. Se indica entre paréntesis el porcentaje de Qo que presenta cada muestra polimérica. El hecho de que todos los polímeros presentaron una disminución en la viabilidad celular respecto del control, podría deberse a que, como las células son adherentes y requieren de la adhesión a una superficie para replicarse, es posible que estos polímeros no formen una superficie adecuada para ello y por lo tanto, que esta sea la causa de la disminución en la viabilidad celular presentada. Es por esto que se realizó el experimento de fluorescencia, ya que para esto las células se marcan con una sonda fluorescente (CSFE), previo a sembrarlas. Así, se mide la fluorescencia a distintos tiempos y se compara con el control, para determinar si esta es o no la causa de la disminución en la viabilidad celular, ya que antes de medir, se cambia el medio de cada pocillo. Si disminuye la fluorescencia se deberá a que hay una disminución de células adheridas a la superficie polimérica. Sin embargo, en los resultados obtenidos a 0.5, 1, 2 y 72 horas no se observó diferencias en la fluorescencia (Figura 32), lo que indica que la disminución en la viabilidad celular no se debe a un problema de adhesión celular, y podría deberse entonces a una disminución en la proliferación celular (que podría ser por una detención en el ciclo celular) o a un aumento en la muerte celular. 56 Por otro lado, los nanocompósitos (NCs) formados con nanopartículas sin conjugar al péptido CLPFFD, así como aquellas que sí lo estaban, no presentan alteración en la viabilidad celular a ningún tiempo, incluyendo en el caso de los NCs preparados con Qo sin entrecruzar al PS (Figuras 33 y 34). Es interesante notar que los NCs no disminuyen la viabilidad celular, en comparación a los polímeros solos, esto podría deberse a que los grupos expuestos del polímero se encuentran interactuando con las Au-NPs, evitando así que haya efectos tóxicos sobre las células, además que en el caso de los polímeros, estos estaban formando un film sobre la placa, mientras que los NCs están en solución, siendo este último caso lo más cercano a lo que ocurriría fisiológicamente. Figur a 32: Resul tados de los ensay os de fluore scenc ia, para determinar algún efecto sobre la adherencia de las células a los polímeros, a 1/2, 1, 2 y 72 horas. Las muestras corresponden a las distintas proporciones de Qo:PS, siendo estas las siguientes: 1 = 1:1, 2 = 2:1, 3 = 5:1, 4 = 10:1 y 5 = 100:1 (50, 67, 83, 90 y 99% de Qo, respectivamente) y CT corresponde al control sólo con medio. 57 Viabilidad de nanocompósitos, utilizando las nanopartículas sin conjugar Figura 33: Resultados de viabilidad celular frente a nanopartículas sin conjugar (Au-NPs), nanocompósitos (NC) utilizando el polímero entrecruzado 3 (83 % de Qo) para recubrir las nanopartículas (NC 3) y NCs utilizando sólo Qo para recubrir las nanopartículas (NC Q). Se muestran los resultados a 24, 48 y 72 horas. El control (CT +) lleva medio de cultivo en lugar de muestra y el control de muerte lleva SDS al 10%. 58 Viabilidad de nanocompósitos, utilizando las nanopartículas conjugadas al péptido CLPFFD Figura 34: Resultados de los ensayos de viabilidad celular frente a Au-NPs recubiertas con el pépttido CLPFFD (NP-CLPFFD), NCs con el entrecruzado 3 (83% de Qo) recubriendo las nanopartículas (NC-NPCLPFFD 3) y NCs de Qo recubriendo las nanopartículas (NC-NP-CLPFFD Q). Se muestran los resultados a 24, 48 y 72 horas. El control (CT+) lleva medio de cultivo en lugar de muestra y el control de muerte lleva SDS al 10%. 59 DISCUSIÓN. Obtención y caracterización de polímeros entrecruzados Respecto a la obtención y caracterización de los polímeros entrecruzados de polisiloxano (PS) y quitosano (Qo), estos fueron efectivamente formados en 5 proporciones distintas de Qo:PS, 1:1, 2:1, 5:1, 10:1 y 100:1, denominadas 1, 2, 3, 4 y 5, las que corresponden a los porcentajes de Qo de 50, 67, 83, 90 y 99% respectivamente, la cual se verificó a través de la caracterización por TGA y por IR de los copolímeros obtenidos. También se analizaron el Qo y PS por separado, para determinar las semejanzas y diferencias que podrían presentar con los entrecruzados obtenidos. En el caso de los resultados de TGA, estos indican que los polímeros entrecruzados presentan efectivamente una nueva temperatura de descomposición, que es distinta tanto a la del Qo, como a la del PS, lo que nos indica que efectivamente hubo una mezcla de polímeros en todas las muestras analizadas, vale decir, la aparición de un compuesto nuevo. Para confirmar que los polímeros entrecruzados de Qo y PS están unidos mediante una unión covalente se pueden emplear diferentes estrategias: 1) se podría disolver tal mezcla en un solvente que sea capaz sólo de disolver al PS, y posteriormente hacer un nuevo análisis termogravimétrico al residuo, teniendo que observarse la misma temperatura de descomposición, si se trata de un copolímero formado por unión covalente entre PS y Qo y no de una mezcla física, y 2) otra forma de corroborar la formación de un enlace covalente es mediante el análisis IR, donde se puede observar claramente si aparece o desaparece alguna señal, correspondiente a determinado enlace. En el presente caso, se observó que efectivamente aparecieron nuevas señales en los polímeros entrecruzados, al compararlos con el Qo y con el PS por separado, por ejemplo, los 5 entrecruzados presentaron la señal característica del grupo amino del Qo y la señal característica del grupo siloxano, perteneciente al PS, lo que nuevamente nos indica que ambos 60 polímeros están presentes en la muestra analizada, pero la característica que indica que efectivamente existe una unión covalente entre ambos polímeros es la aparición de una nueva señal en los 5 polímeros entrecruzados, la que corresponde al enlace amida, formado entre el grupo amino del Qo y el carboxilo del PS, señal que no se observa en los espectros IR del Qo ni del PS. Posteriormente, al analizar el efecto que tendría la introducción de un polímero hidrofóbico, como el PS, sobre la energía superficial del Qo, se observaron diferencias tanto a nivel de ángulo de contacto, como de energía superficial, para los 5 entrecruzados obtenidos. Lo más destacable de estos resultados es que las diferencias observadas en tales valores eran dependientes del grado de entrecruzamiento, o porcentaje de Qo que poseía cada muestra. Efectivamente, al entrecruzar ambos polímeros se obtuvo una disminución en la energía superficial, respecto a la del Qo, la cual es máxima con aquel entrecruzado que posee la mayor cantidad de PS en su estructura (50% de Qo), sin embargo, cabe destacar que incluso aquella muestra que posee un 99% de Qo presenta una leve disminución en la energía superficial, al comprarla con la energía superficial del Qo. Obtención y caracterización de nanocompósitos Estos se obtuvieron utilizando nanopartículas de oro (Au-NPs) con y sin conjugar al péptido CLPFFD y sólo con dos polímeros, el Qo y uno de los entrecruzados. El entrecruzado seleccionado corresponde al número 3, que tiene una proporción de Qo:PS de 5:1, o bien un 83% de Qo. La selección del polímero a utilizar se basó en el análisis de la caracterización por espectrofotometría UV/Vis, donde se observó un desplazamiento y ensanchamiento de la banda del plasmón de resonancia, y se realizó sobre los nanocompósitos (NCs) formados con todas las proporciones de entrecruzados obtenidas, este análisis reveló que los NCs obtenidos no eran muy 61 estables en solución, lo que se demuestra claramente en tales espectros (ver anexo) al observar un corrimiento a longitudes de onda mayores, que indica excesiva agregación de las partículas en solución. De hecho, en un espectro que ejemplifica tal inestabilidad de los NCs (Figura 25), se observan dos máximos de absorción, lo que indica probablemente que sólo unas pocas nanopartículas se recubrieron con los polímeros correspondientes, y que se agregan bastante, lo que se evidencia en la absorbancia a longitudes de onda considerablemente mayores, mientras que otras nanopartículas continúan absorbiendo a la longitud de onda adecuada a su tamaño (520 nm). En uno de los casos no se observó un máximo de absorbancia en el espectro obtenido (entrecruzado que posee un 90% de Qo), lo que se debe a que la agregación fue tan extrema, que indujo la precipitación de los agregados (como se observa en la Figura 35). Tal agregación no es conveniente para aplicaciones farmacéuticas, ya que se necesita que los NCs obtenidos, aparte de ser estables, tengan un tamaño relativamente pequeño, para poder utilizarlos en una posible terapia para la Enfermedad de Alzheimer, que no presenten demasiada agregación, para que no alteren el medio en que se encuentran, ya que al agregarse, podrían estar induciendo trombogenicidad. Esta agregación no se observó en el caso del entrecruzado seleccionado. Figura 35: Espectro UV/Vis de nanocompósito 4 (NC 4), que corresponde a una proporción de NP:Polímero de 1:4,5. Se utilizó el polímero entrecruzado 4 (90% de Qo). En este espectro no se observa ningún máximo de absorbancia, debido a la excesiva agregación de las nanopartículas con el polímero, generando la precipitación de ambos. 62 Al analizar las micrografías obtenidas por TEM, se observa que el recubrimiento de las Au-NPs con polímeros generó un efecto agrupante en éstas, lo que se observó tanto en las nanopartículas conjugadas al péptido CLPFFD, como en aquellas que no lo estaban y también con ambos polímeros utilizados (Qo y el entrecruzado con un 83% de Qo), pero tal efecto es controlado por la cantidad de polímero que las esté rodeando, tal como lo indica un estudio de Hong y colaboradores [Hong, 2009]. Esto permitiría, eventualmente, controlar el tamaño de tales NCs al modificar las cantidades de polímero con las que se biocompatibilizarán. Respecto al tamaño de los NCs obtenidos, se observó que al comparar tales NCs formados con los distintos polímeros entrecruzados, estos presentaron valores muy similares, cercanos a 300 nm. Sin embargo, los NCs de nanopartículas con Qo presentan tamaños muy grandes, que incluso se salen del rango de medición, lo que puede deberse a su gran capacidad adhesiva, que estaría induciendo mayor agregación. A pesar de que los tamaños de los NCs obtenidos con los polímeros entrecruzados son bastante altos, al entrar en circulación dentro del organismo, el Qo comenzaría a ser degradado principalmente por una enzima ubicua en el organismo como la lisozima, por lo que el tamaño comenzaría a disminuir a medida que avanza. Sin embargo, esto debe ser demostrado mediante ensayos de degradación de tales NCs. También se determinó el potencial zeta de los mismos, observándose que los valores obtenidos son muy cercanos entre los polímeros entrecruzados, siendo cercanos a +35 mV, mientras que en el caso de Qo sin entrecruzar, este alcanza mayor valor siendo aproximadamente + 65 mV. Este hecho es muy favorable al considerar la distribución de tales partículas, debido a que se vería disminuida su captura por el MPS in vivo. En el caso de los NCs formados con los polímeros entrecruzados comparados con los formados por Qo, los primeros presentan una carga bastante menor a este último, debido probablemente a la reacción del grupo amino con el carboxilo del PS, hecho que disminuye la exposición de este grupo, con la consecuente disminución de la carga positiva, lo que indica otra ventaja de utilizar los 63 polímeros entrecruzados ya que, como se ha mencionado en la introducción, también es deseable utilizar partículas lo más neutras posibles para evitar o disminuir su interacción con sistemas biológicos, mientras que también estaría reduciendo la capacidad trombogénica del Qo. Evaluación de la toxicidad Para evaluar la posible toxicidad de cada uno de los materiales obtenidos en el presente trabajo, se realizaron ensayos de coagulación sanguínea y de viabilidad celular. El primero se realizó con el fin de determinar si efectivamente la disminución en la energía superficial, al entrecruzar el Qo con PS, se traduce en una disminución o eliminación del efecto trombogénico que presenta el Qo, o si surge alguna otra alteración a nivel sanguíneo que se pueda detectar. La evaluación de la toxicidad a nivel celular, se debe a que es muy probable que tales NCs, polímeros y nanopartículas, entren en contacto con neuronas, por lo que es conveniente determinar cuáles serían los posibles efectos sobre ellas. En los resultados obtenidos a partir de los ensayos de coagulación sanguínea se observó que ni los polímeros entrecruzados, ni las Au-NPs conjugadas y sin conjugar, ni los NCs obtenidos presentaron efectos significativos sobre el tiempo de coagulación sanguínea, este sólo se vio alterado cuando se utilizó Qo sin entrecruzar con PS, lo que era de esperarse ya que está ampliamente reportada su capacidad de inducir trombogenicidad. Lo que sí llama la atención es el hecho de que cuando el Qo está recubriendo las nanopartículas no presenta efectos trombogénicos, lo que podría deberse a que algunos grupos cargados positivos (amino) de esta molécula están interaccionado con la nanopartícula (de carga negativa). De esta forma, el Qo estaría exponiendo menos grupos reactivos, lo que estaría solapando su efecto trombogénico, lo que también altera la energía superficial, como se ha mencionado previamente. En base a esto, se puede concluir entonces, que la distinta exposición de grupos, de una 64 molécula en particular, será un componente esencial para determinar el efecto que tendrá con el medio que la rodea. Respecto a la viabilidad celular, se observó que disminuyó con todos los polímeros utilizados, pero esta disminución se ve atenuada al utilizar los polímeros entrecruzados, que cuando se utiliza sólo Qo. Para determinar si esta disminución en la viabilidad celular es debida a un problema de adhesión celular, ya que estas se encuentran sobre un film del polímero correspondiente, se realizó un ensayo de fluorescencia, el que determinó que ninguno de los polímeros utilizados genera un problema de adhesión para las células, por lo que las posibles causas para esta disminución en la viabilidad serían un aumento en la muerte celular, ya sea por apoptosis o necrosis, o bien a una disminución en su replicación, por una detención en el ciclo celular. Al parecer, lo más probable es que se deba a una disminución en la replicación celular, ya que se ha reportado que superficies poliméricas promueven la detención en el ciclo celular y mientras más hidrofílico sea el polímero, mayor será la detención en G1 [Miller, 2010], y justamente en este caso el Qo solo, que es el polímero más hidrofílico de todos los analizados, es el que presenta un menor porcentaje de viabilidad celular en todos los tiempos. Efecto tamaño/carga Con respecto a la influencia de la carga y el tamaño de una partícula sobre su destino final en el organismo, está demostrado que estas son las principales características que se deben tener en cuenta al diseñar una formulación que se quiera utilizar para dirigir a un lugar específico del organismo. Esto se debe a que ambos factores, carga y tamaño, son fundamentales para determinar si la especie será capturada o no por el MPS, o si tendrá un tiempo de vida medio más largo y estará más tiempo en circulación. 65 En el caso de la influencia por la carga de la partícula, se ha observado en repetidas ocasiones [Dash, 2010] que aquellas con carga superficial negativa son más susceptibles de ser capturadas por el MPS, debido a una mayor interacción que presentan tales partículas con proteínas plasmáticas, como las opsoninas, recubriéndose así por una capa de proteínas que inducen finalmente, la fagocitosis de la partícula unida a las proteínas. Mientras que aquellas partículas que poseen una carga neutra o cercana a la neutralidad, pasan más bien desapercibidas frente al MPS, teniendo así un tiempo de vida medio mayor que las de carga negativa. Algo similar sucede con aquellas partículas que poseen una superficie cargada positivamente, pero en este caso tal efecto se debe más bien a la repulsión que se genera entre la partícula extraña y las proteínas plasmáticas, evitándose así su recubrimiento y por lo tanto se impide también la fagocitosis. Sin embargo, una superficie con una carga positiva también puede generar toxicidad, la que dependerá de la medida del potencial zeta, ya que cuanto mayor sea este, mayor será la toxicidad, debido a una posible interacción con membranas celulares (de carga negativa) que finalmente podría generar un daño en tal membrana, aumentando su permeabilidad, debido a la generación de poros. Por otro lado, el tamaño de las partículas también es de gran importancia para la distribución de las partículas en el organismo, ya que se ha observado que hay una relación inversa entre tamaño y biodistribución de partículas en el organismo [LasagnaReeves, 2010; Sonavane, 2008]. Esto se debe a que las partículas más pequeñas tienen un tiempo de vida medio en circulación más grande que aquellas partículas de mayor tamaño, lo que es debido a que las partículas más pequeñas pueden evadir más fácilmente el MPS (menores a 100 nm y mayores a 50 nm) y no son fagocitadas, contrario a lo que ocurre con las más grandes que son rápidamente capturadas por tal sistema. 66 Con respecto a los resultados obtenidos en el presente trabajo, se observó que las Au-NPs, al tener un tamaño tan pequeño como 12 nm de diámetro, fácilmente podrían distribuirse por todo el organismo, llegando incluso al cerebro. Sin embargo, el hecho de que estas nanopartículas presenten una carga superficial negativa, genera que sean fácilmente por recubiertas por diversas proteínas plasmáticas, entre las que se encuentran las opsoninas, con lo que facilitan la fagocitosis de tales nanopartículas, por lo que quedan retenidas principalmente en órganos del MPS, como el hígado y el bazo. Es por este motivo que en el presente trabajo se realizó un recubrimiento de tales nanopartículas con polímeros de carga positiva, para evitar la opsonización y posterior fagocitosis de tales nanocompósitos. Al evaluar el potencial zeta de tales NCs se observó que efectivamente los polímeros entrecruzados presentan carga positiva, lo que evitaría entonces la captura de tales NCs por el MPS, y así aumentaría su tiempo de vida media en circulación. Por otro lado, hay que considerar el tamaño de tales NCs, ya que también es un factor muy importante para determinar el destino de éstos en el organismo. Al respecto, se ha reportado que nanopartículas de menos de 100 nm se distribuyen fácilmente por todo el organismo y presentan un bajo porcentaje de captura por el MPS, comparadas con partículas de mayor tamaño. Sin embargo, se ha observado que nanopartículas de 300 y 500 nm también se distribuyen ampliamente, pero aumentan el porcentaje de las que quedan retenidas en órganos del MPS, como el hígado. Esto podría contrarrestar los beneficios que se obtienen al obtener NCs con carga superficial positiva, haciendo que el tiempo de vida media no sea tan largo como podría ser. Sin embargo, al ser el Qo un polímero biodegradable, y debido a que se ha mostrado que es degradado por enzimas como la lisozima, se espera que este sea degradado en el trayecto hacia el cerebro, con lo que el tamaño de tales NCs disminuya conforme avanza por el organismo. Ahora bien, si los NCs de aproximadamente 300 nm, como los obtenidos en el presente trabajo, son capturados por el MPS al ingresar al organismo, el Qo podría comenzar a degradarse dentro de la célula (como la célula de Kupffer, por ejemplo), y posteriormente eliminarse, con una 67 menor cantidad de polímero recubriendo las nanopartículas y por lo tanto, un menor tamaño aumentando así las posibilidades de que lleguen al cerebro. Posible mecanismo de degradación del quitosano Se ha reportado que el Qo es degradado por una enzima presente ampliamente en todo el organismo, la lisozima. Sin embargo, también se ha observado que la cinética de degradación de este polímero es relativamente lenta, lo que es conveniente en el presente caso, en que se desea que el polímero recubra por suficiente tiempo a las nanopartículas y así evitar su captura por el MPS. Estudios previos han reportado que la degradación de un quitosano con 90% de desacetilación se tarda aproximadamente 25 días [Dai, 2009]. Se ha observado que tal cinética va a depender de su peso molecular y de su grado de desacetilación. Al respecto, se ha reportado que a mayor porcentaje de desacetilación, más lentas son las tasas de degradación del Qo [Aggarwal, 2009]. Por otro lado, también se ha observado que si se introducen cambios en su arquitectura molecular, tales modificaciones pueden actuar imitando una alteración en el peso molecular o en el grado de desacetilación, lo que también puede alterar propiedades como la adsorción de proteínas en su superficie. Se ha reportado que Qo ramificados presentan niveles significativamente menores de adsorción de proteínas en su superficie, al compararlos con Qo lineal, pero al mismo tiempo, mostraron una menor tasa de crecimiento celular al analizar la viabilidad celular en el tiempo, mediante análisis por MTT, comparado con el Qo lineal, diferencia que también es significativa. Estos resultados pueden relacionarse con los obtenidos en el presente trabajo, ya que se observó que el Qo presentó una mayor disminución en la viabilidad celular, al compararlo con los entrecruzados Qo-PS. Asimismo, el hecho de que aquellos Qo ramificados presenten una menor adsorción de proteínas, se esperaría 68 entonces que los entrecruzados Qo-PS presenten una conducta similar, con lo que se disminuiría su captura por el MPS in vivo. Por otro lado, como la lisozima está ubicua en nuestro organismo, lo más probable es que, al llegar al cerebro ya no existan los nanocompósitos como tales, quedando con una pequeña capa de polímero recubriendo las Au-NPs o bien, que sólo queden las nanopartículas para ingresar a este órgano. 69 CONCLUSIONES. En base a lo descrito en la presente tesis, se puede concluir que se obtuvieron nuevos polímeros entrecruzados derivados de quitosano (Qo), que presentaron una disminución en los efectos que éste presentó sobre la viabilidad celular y no presentaron alteración en el tiempo de coagulación. Es por esto que se puede especular que los entrecruzados nuevos son “más biocompatibles” que el Qo solo, o bien, que presentan una menor toxicidad, tanto a nivel celular como sanguíneo. Sin embargo, hacen falta más ensayos, tanto in vitro como in vivo, para asegurar que estos copolímeros son efectivamente biocompatibles. La mayor biocompatibilidad que presentan los entrecruzados, respecto del Qo, se puede deber principalmente, a la disminución en la energía superficial de estos polímeros, comparados con la alta energía superficial del Qo y a pesar de que esta diferencia no es tan grande, es suficiente como para que desaparezca el efecto trombogénico de Qo. También se sintetizaron las nanopartículas de oro (Au-NPs) y se conjugaron con el péptido CLPFFD, evaluando en ambos casos (con y sin conjugar) su viabilidad celular y sus efectos en la coagulación sanguínea, donde se observó que en ninguno de los dos casos se presentó toxicidad, dato muy relevante para tener en cuenta en posibles aplicaciones que se les quiera dar a estas nanopartículas en el área de la biomedicina. 70 Posteriormente, se obtuvieron los nanocompósitos (NCs) de las nanopartículas con los polímeros, los que se presentaron un tamaño cercano a los 300 nm de diámetro, tamaño bastante grande, sin embargo se espera que el polímero derivado del Qo que recubra la nanopartícula sea degradado en el trayecto, con lo que se reduciría su tamaño. Además, estos NCs presentaron una carga positiva, alrededor de 30 mV, con lo que debieran ser capaces de evadir el sistema fagocítico mononuclear (MPS), aumentando así su tiempo de vida media en circulación. Una vez obtenidos tales NCs, se evaluó su efecto sobre la viabilidad celular y la coagulación sanguínea, a partir de lo cual se determinó que los NCs formados con Qo sin entrecruzar con polisiloxano (PS) no presentaron toxicidad en ningún caso, contrario a lo que ocurría cuando el Qo interactuaba directamente con las células o la sangre. Lo mismo se observó al evaluar los NCs obtenidos al recubrir las Au-NPs con el polímero entrecruzado de proporción de Qo:PMS = 5:1, que corresponde a un 83% de Qo (y un 17% de PS). Todo esto nos indica que estos nuevos polímeros tienen una mejor proyección en sus posibles aplicaciones como moléculas a utilizar para mejorar la entrega selectiva de fármacos, no sólo a utilizar para recubrir Au-NPs, ni como una posible forma de optimizar el diagnóstico y la terapia de la Enfermedad de Alzheimer, sino que podrían utilizarse para la entrega de fármacos en el caso de otras enfermedades como cáncer. 71 PROYECCIONES. A partir del trabajo aquí presentado se sugieren experimentos o estrategias que podrían establecer de mejor manera la compatibilidad biológica que podrían presentar los polímeros entrecruzados, respecto al quitosano, para utilizarlos en el área de la biomedicina. En cuanto a la caracterización de los polímeros sería interesante analizar la exposición de los distintos grupos funcionales que poseen los polímeros analizados. Para esto un estudio interesante sería el análisis de tales polímeros mediante Microscopía de Fuerza Atómica (AFM), también podría analizarse si los films utilizados están constituyendo o no una monocapa del polímero, lo que podría analizarse por elipsometría y también determinar si el film está distribuido homogéneamente, lo que se determinaría mediante el análisis del ángulo de histéresis. Con respecto a la distribución de los nanocompósitos obtenidos, sería muy interesante analizar la distribución que podrán presentar in vivo, a distintos tiempos para así determinar si efectivamente son capaces de evitar el MPS y, al mismo tiempo, aumentar la llegada de las Au-NPs al cerebro. 72 REFERENCIAS. Adamson A. Physical Chemistry of surfaces; Quinta edición, 4-8, 294, 379-406, 493506, 1990. Aggarwal, Matthew. Branched chitosans II: Effects of branching on degradation, protein adsorption and cell growth properties. Acta Biomater; 5: 1575-1581, 2009. AshaRani et al. Cytotoxicity and genotoxicity of silver nanoparticles in human cells. ACSnano, 3: 279-290, 2009. Aktaş Y, Yemisci M, Andrieux K, Gürsoy RN, Alonso MJ, Fernandez-Megia E, NovoaCarballal R, Quiñoá E, Riguera R, Sargon MF, Celik HH, Demir AS, Hincal AA, Dalkara T, Capan Y, Couvreur P. Development and brain delivery of chitosan – PEG nanoparticles functionalized with the monoclonal antibody OX26. Bioconjug Chem; 16: 1503-1511, 2005. Baierm R, Dutton R, Gott V. Surface chemical features of the blood vessel walls and of syntethic materials exhibition thromboresistance (del libro Surface Chemistry of Biological Systems), 235-260, 1970. Banks W. Developing drugs that can cross the blood-brain barrier: applications to Alzheimer´s disease. BMC Neuroscience, 9: Suppl 3-S2, 2008. Benesch J, Tengvall P. Blood protein adsorption onto chitosan. Biomaterials; 23: 25612568, 2002. Brandenberg G, Leibrock LG, Shuman R, Malette WG, Quigley H. Chitosan: a new topical hemostatic agent for diffuse capillary bleeding in brain tissue. Neurosurgery; 15: 9–13, 1984. 73 Dai, Zheng, Xu, Kong, Li, Guo, Luo, Zhao, Wei, qian. Chitosan-alginate sponge: preparation and application in curcumin delivery for dermal wound healing in rat. J Biomed Biotechnol; 2009. Depan D, Kumar B, Singh R. Preparation and characterization of novel hybrid of chitosan-g-PDMS and Sodium Montmorrilonite. J Biomed Mater Res B Appl Biomater; 84: 184-190, 2008. Dobrovolskaia MA, Aggarwal P, Hall JB, McNeil SE. Preclinical studies to understand nanoparticle interaction with the immune system and its potential effects on nanoparticle biodistribution. Mol Pharm; 5: 487-495, 2008. Fontana G, Licciardi M, Mansueto S, Schillaci D, Giammona G. Amoxicillin-loaded polyethylcyanoacrylate nanoparticles: Influence of PEG coating on the particle size, drug release rate and phagocytic uptake. Biomaterials; 22: 2857-2865, 2001. Fox and Zisman. The spreading of liquids on low energy surfaces I, II y III, 1950, 1951 y 1952. Guerrero, Araya, Fiedler, Arias, Adura, Albericio, Giralt, Arias, Fernández, Kogan. Improving the brain delivery of gold nanoparticles by conjugation with an amphipathic peptide. Nanomedicine; 5: 897-913, 2010. Guerrero, Ariel. Tesis para optar a título de Químico Farmacéutico, 2008. Hainfeld JF, Slatkin DN, Focella TM, Smilowitz HM. Gold nanoparticles: a new X-ray contrast agent. Br J Radiol; 79: 248-253, 2006. Hiebl, Cytocompatibility testing of cell culture modules fabricated from specific candidate biomaterials using injection molding. J Biotechnol. 2010 Jul 1;148(1):76-82. Epub 2010 Jan 21. Jain, El-Sayed. Au nanoparticles target cancer. Nanotoday; 2: 18-29, 2007. Hong y cols. Controlled assembly of Au, Ag and Pt nanoparticles with chitosan. Chemistry, 15: 5935-5941, 2009. 74 Hutmacher DW, Goh JC, Teoh SH. An introduction to biodegradable materials for tissue engineering applications. Ann Acad Med Singapore; 30: 183–191, 2001. Kean T, Thanou M. Biodegradation, biodistribution and toxicity of chitosan. Advanced Drug Delivery, 62: 3-11, 2010. Kim IY, Kim SJ, Shin MS, Lee YM, Shin D, Kim SI. pH- and thermal characteristics of graft hydrogels based on chitosan and poly(dimethylsiloxane). Journal of Applied Polymer Science; 85: 2661 – 2666, 2002. Kim JH, Bryan WW, Lee TR. Preparation, characterization, and optical properties of gold, silver, and gold-silver alloy nanoshells having silica cores. Langmuir; 24:1114711152, 2008. Kim K, Kim J, Paark H, Kim Y, Park K, Nam H, Lee S, Park J, ark R, Kim I, Choi K, Kim S, Park, K, Kwon I. Tumor-homing multifunctional nanoparticles for cancer theragnosis: Simultaneous diagnosis, drug delivery, and therapeutic monitoring. J of Controlled Release; 146: 219-227, 2010. Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J. Therapeutic approaches to Alzheimer's disease. Brain; 129: 2840-2855, 2006. Kogan MJ, Bastus NG, Amigo R, Grillo-Bosch D, Araya E, Turiel A, Labarta A, Giralt E, Puntes VF Nanoparticle-mediated local and remote manipulation of protein aggregation. Nano Lett; 6: 110-115, 2006. Koziara JM, Oh JJ, Akers WS, Ferraris SP, Mumper RJ. Blood compatibility of cetyl alcohol/polysorbate-based nanoparticles. Pharm Res; 22: 1821-1828, 2005. Kweon. Preparation and characteristics of chitosan-g-PDMS Copolymer. Polymer Bulletin; 41: 645–651, 1998. Lacerda, Park, Meuse, Pristinski, Matthew, Becker, Karim, Douglas. Interaction of gold nanoparticles with common human blood proteins. ACS Nano, 4: 365 – 379, 2010. 75 Lasagna-Reeves C, Gonzalez-Romero D. Barria MA, Olmedo I, Clos A, Sadagopa VM, Urayama A, Vergara L, Kogan M, Soto C. Bioaccumulation and toxicity of gold nanoparticles after repeated administration in mice. Biochemical and Biophysical Research Communicationss 393: 649-655, 2010. Levchenko T, Rammohan R, Lukyanov A, Whiteman K, Torchilin V. Liposome clearance in mice: The effect of a separate and combined presence of surface charge and polymer coating. Int. J. Pharm; 240: 95-102, 2002. Li S, Huang L. Pharmacokinetics and biodistribution of nanoparticles. Molecular Pharmaceutics; 5: 496– 504, 2008. Long y cols. Synthesis and optical properties of colloidal gold nanoparticles. Journal of Physics, 187: 1-9, 2009. Manca, Mourtas, Dracopoulos, Fadda, Antimisiaris. PLGA, chitosan or chitosan-coated PLGA microparticles for alveolar delivery? A comparative study of particle stability during nebulization. Colloids and Surfaces B: Biointerfaces; 62: 220-231, 2008. Minami S, Suzuki H, Okamoto Y, Fujinaga T, Shigemasa Y. Chitin and chitosan activate complement via the alternative pathway. Carbohydr Polym; 36: 151–155, 1998. Min Hong, Linlin Wu, Liangfei Tian, and Jin Zhu. Controlled Assembly of Au, Ag, and Pt Nanoparticles with Chitosan. Chemistry Eur.; 15 (24): 5935-2941, 2009. Monroe D, Hoffman M. What does it take to make the perfect clot? Arterioscler Thromb Vasc Biol; 26: 41-48, 2006. Murthy PS, Murali Mohan Y, Varaprasad K, Sreedhar B, Mohana Raju K. First successful design of semi-IPN hydrogel-silver nanocomposites: a facile approach for antibacterial application. J Colloid Interface Sci; 318: 217-224, 2008. Neus, Sánchez-Tilló, Pujals, Farrera, López, Giralt, Celada, Lloberas, Puntes. Homogeneous conjugation of peptides onto gold nanoparticles enhances macrophage response. ACS Nano; 3: 1335-1344, 2009. 76 Okamoto, Yano, Miyatake, Tomohiro, Shigemasa, Minami. Effects of chitin and chitosan on blood coagulation. Carbohidrate polymers; 53: 337-342, 2003. Olmedo I, Araya E, Sanz F, Medina E, Arbiol J, Toledo P, Alvarez-Lueje A, Giralt E, Kogan MJ. How changes in the sequence of the peptide CLPFFD-NH2 can modify the conjugation and stability of gold nanoparticles and their affinity for beta-amyloid fibrils. Bioconjug Chem;19:1154-1163, 2008. Owens D, Peppas N. Opsonization, biodistribution, and pharmacokinetics of polymeric nanoparticles. Int J Pharm; 307: 93-102, 2006. Rodriguez-Baeza, Mario, Neira C., Andrónico y Aguilera J., Carlos. thermogravimetric study of the formation of cross-linked structures in the synthesis of poly(methylsiloxane). J. Chil. Chem. Soc; 48:.75-77, 2003. Senthil KU, Rajini R, Reddy BSR. Gas permeation and sorption properties of non-ionic and cationic amino-hydroxy functionalized poly(dimethyl siloxane) membranes. J Membrane Sci; 254: 169–177, 2005. Sonavane G, Tomoda K, Makino K. Biodistribution of colloidal gold nanoparticles after intravenous administration: Effect of particle size. Colloids Surf B Biointerfaces; 66: 274-280, 2008. Silva, GA. Nanotechnology approaches to crossing the blood-brain barrier and drug delivery to the CNS. BMC Neuroscience; 9: Supl 3-S4, 2008. Taguchi H, Planque S, Nishiyama Y, Szabo P, Weksler ME, Friedland RP, Paul S. Catalytic antibodies to amyloid beta peptide in defense against Alzheimer disease. Autoimmun Rev; 7:391-397, 2008. Tan WB, Zhang Y Surface modification of gold and quantum dot nanoparticles with chitosan for bioapplications. J Biomed Mater Res A; 75:56-62, 2005. Terragno, R., Cerdá, N., López, O., Valdés, I. Esterilización con óxido de etileno. Bol. AAM 163, 2004. 77 Toral M. Fisicoquímica de superficies y sistemas dispersos; Primera edición, 68-86, 1973. Walsh DM, Selkoe DJ. A beta oligomers – a decade of discovery. J Neurohem; 101: 1172-1184, 2007. Wang, Yang, Chen, Shin. Application of nanotechnology in cancer therapy and imaging. CA Cancer J Clin; 58: 97-110, 2008. Yao J, Zhou JP, Ping QN, Lu Y, Chen L. Distribution of nobiletin chitosan-based microemulsions in brain following i.v. injection in mice. Int J Pharm; 352: 256-262, 2008. Zahr A, Davis Ch, Pishko M. Macrophage uptake of core-shell nanoparticles surface modified with poly(ethylene glycol). Langmuir; 22: 8178-8185, 2006. Zhang G, Yang Z, Lu W, Zhang R, Huang Q, Tian M, Li L, Liang D, Li D. Influence of anchoring ligands and particle size on the colloidal stability and in vivo biodistribution of polyethylene glycol-coated gold nanoparticles in tumor-xenografted mice. Biomaterials; 30: 1928-1936, 2009. Zhao W, Sun SX, Xu JJ, Chen HY, Cao XJ, Guan XH. Electrochemical identification of the property of peripheral nerve fiber based on a biocompatible polymer film via in situ incorporating gold nanoparticles. Anal Chem; 80: 3769-3976, 2008. Zharov V, Galitovskaya E, Johnson C and Kelly T. Synergistic Enhancement of SelectiveNanophotothermolysis with Gold Nanoclusters: Potential for Cancer Therapy Lasers in Surgery and Medicine; 37: 219, 2005. Zolnik B, González-Fernández A, Sadrieh N, Dobrovolskaia M. Minireview: Nanoparticles and the Immune System. Endocrinology; 151: 458-465, 2010. 78 ANEXOS. Volumen NP Volumen polímero Proporción NP:polímero 10 µL 0 µL - 10 µL 45 µL 1 : 4,5 10 µL 90 µL 1:9 20 µL 225 µL 1 : 12,5 20 µL 90 µL 2:9 50 µL 90 µL 5:9 Tabla 1: Proporciones de NP:polímero. Estas proporciones se probaron con los distintos polímeros entrecruzados Qo-PS. En la tabla 1 se presentan las distintas proporciones de NP:polímero utilizadas para formar los nanocompósitos. Mientras que en la figura 1 se observa que en algunas de las proporciones de NP:polímero (presentadas en la tabla 1) también se produce un efecto de agregación de las Au-NPS, que es más notorio en el caso de las proporciones de NP:polímero como la B y D, que corresponden a 1:4.5 y 1:12.5, respectivamente. Este hecho indica que tales nanocompósitos no son estables en solución, por lo que se descarta su utilización en los ensayos biológicos. Por otro lado, aquellas proporciones de NP:polímero E y F, que corresponden a 2:9 y 5:9, respectivamente, fueron descartadas en base a bibliografía [Hong, 2009], debido a que está reportado que aquellas proporciones presentan mayor índice de agregación, resultando en un tamaño mayor de los agregados, lo que no es conveniente en este caso. 79 NCB3 NCD3 NCC3 NCE3 NCF3 AuNP 0,65 0,60 0,55 0,50 Absorbancia 0,45 0,40 0,35 0,30 0,25 0,20 0,15 0,10 0,05 0,00 -0,05 300 400 500 600 700 800 900 Longitud de onda (nm) Figura 1: Espectro UV/Vis de nanocompósito formado con el polímero 3 (corresponde a un 83% de Qo) y distintas proporciones de NP:polímero, siendo A aquella que no posee polímero, B la proporción de 1:4.5, C la proporción de 1:9, D la proporción de 1:12.5, E la proporción de 2:9 y F la proporción de 5:9. En base a estas observaciones, se decide entonces utilizar la proporción de NP:polímero de 1:9 para formar los nanocompósitos. Posteriormente, se realiza un experimento similar, pero esta vez utilizando ya la proporción 1:9 de NP:polímero y cambiando los polímeros entrecruzados utilizados. 80 C1 C2 C3 C4 C5 CQ 0,6 0,5 Absorbancia 0,4 0,3 0,2 0,1 0,0 300 400 500 600 700 800 900 Longitud de onda (nm) Figura 3: Espectro UV/Vis de nanocompósito formado con los distintos polímeros y una proporción de NP:polímero de 1:9. Los números 1, 2, 3, 4 y 5 corresponden a las distintas proporciones de Qo:PS, las que corresponden a 50, 67, 83, 90 y 99% de Qo, respectivamente. En la figura 3, se puede apreciar que varios de los polímeros utilizados para formar los nanocompósitos presentan inestabilidad, la que se ve evidenciada por la aparición de “hombros” en el espectro, alrededor de los 700 nm de longitud de onda. De hecho, en el caso del nanocompósito formado con el entrecruzado polimérico 4 (90% de Qo) no aparece ningún máximo de absorbancia, lo que indica que en este caso la agregación de las nanopartículas fue tanta, que estas precipitaron. También se observa agregación en aquellos nanocompósitos formados con los polímeros Qo y entrecruzado polimérico 5 (este último corresponde a un 99% de Qo). Mientras que cuando disminuye aún más el porcentaje de Qo y aumenta el de PS, se evita tal agregación, lo que se observa a partir de los nanocompósitos formados con el polímero 81 3, que corresponde a un 83% de Qo. Hecho que se mantiene en el caso de los polímeros 1 y 2 (50 y 67% de Qo, respectivamente). Sin embargo, en base a los resultados obtenidos de energía superficial y compararlos con resultados encontrados en bibliografía [kweon, 1998], se determinó elegir el entrecruzado polimérico 3 (83% de Qo), debido a que está reportado que el valor de energía superficial obtenido en tal caso era suficiente para eliminar su efecto trombogénico. Solvente Constante dieléctrica (e) Agua 78,5 Anilina 7,2 Cloroformo 5,0 Tabla 2: Constantes dieléctricas para los distintos utilizados en las mediciones de ángulo de contacto. Tales constantes están directamente relacionadas con la polaridad de estos solventes. 82 En la tabla 2 se presentan los valores de las constantes dieléctricas de los distintos solventes utilizados para las mediciones de ángulo de contacto. Estos valores indican la distinta polaridad de los solventes, hecho necesario para calcular posteriormente una energía superficial constante, siendo la constante dieléctrica del agua (78,5) la que presenta el mayor valor, lo que indica que este es el solvente más polar utilizado, mientras que el menos polar corresponde al cloroformo (5,0), seguido por la anilina (7,2). 83