Descargar (Archivo Word)
Anuncio
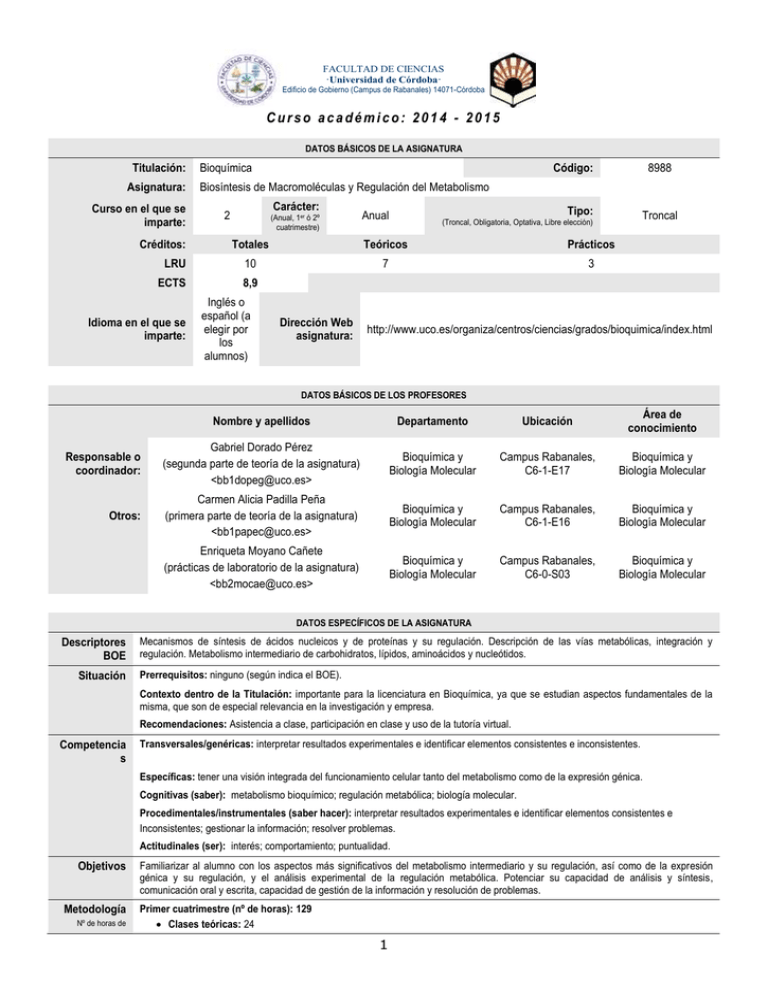
FACULTAD DE CIENCIAS ·Universidad de Córdoba· Edificio de Gobierno (Campus de Rabanales) 14071-Córdoba Curso académico: 2014 - 2015 DATOS BÁSICOS DE LA ASIGNATURA Titulación: Asignatura: Curso en el que se imparte: Créditos: Bioquímica Código: Biosíntesis de Macromoléculas y Regulación del Metabolismo Carácter: 2 (Anual, 1er ó 2º cuatrimestre) Tipo: Anual Teóricos Prácticos LRU 10 7 3 ECTS 8,9 Inglés o español (a elegir por los alumnos) Dirección Web asignatura: Troncal (Troncal, Obligatoria, Optativa, Libre elección) Totales Idioma en el que se imparte: 8988 http://www.uco.es/organiza/centros/ciencias/grados/bioquimica/index.html DATOS BÁSICOS DE LOS PROFESORES Nombre y apellidos Departamento Ubicación Área de conocimiento Responsable o coordinador: Gabriel Dorado Pérez (segunda parte de teoría de la asignatura) <bb1dopeg@uco.es> Bioquímica y Biología Molecular Campus Rabanales, C6-1-E17 Bioquímica y Biología Molecular Otros: Carmen Alicia Padilla Peña (primera parte de teoría de la asignatura) <bb1papec@uco.es> Bioquímica y Biología Molecular Campus Rabanales, C6-1-E16 Bioquímica y Biología Molecular Enriqueta Moyano Cañete (prácticas de laboratorio de la asignatura) <bb2mocae@uco.es> Bioquímica y Biología Molecular Campus Rabanales, C6-0-S03 Bioquímica y Biología Molecular DATOS ESPECÍFICOS DE LA ASIGNATURA Descriptores BOE Situación Mecanismos de síntesis de ácidos nucleicos y de proteínas y su regulación. Descripción de las vías metabólicas, integración y regulación. Metabolismo intermediario de carbohidratos, lípidos, aminoácidos y nucleótidos. Prerrequisitos: ninguno (según indica el BOE). Contexto dentro de la Titulación: importante para la licenciatura en Bioquímica, ya que se estudian aspectos fundamentales de la misma, que son de especial relevancia en la investigación y empresa. Recomendaciones: Asistencia a clase, participación en clase y uso de la tutoría virtual. Competencia s Transversales/genéricas: interpretar resultados experimentales e identificar elementos consistentes e inconsistentes. Específicas: tener una visión integrada del funcionamiento celular tanto del metabolismo como de la expresión génica. Cognitivas (saber): metabolismo bioquímico; regulación metabólica; biología molecular. Procedimentales/instrumentales (saber hacer): interpretar resultados experimentales e identificar elementos consistentes e Inconsistentes; gestionar la información; resolver problemas. Actitudinales (ser): interés; comportamiento; puntualidad. Objetivos Metodología Nº de horas de Familiarizar al alumno con los aspectos más significativos del metabolismo intermediario y su regulación, así como de la expresión génica y su regulación, y el análisis experimental de la regulación metabólica. Potenciar su capacidad de análisis y síntesis, comunicación oral y escrita, capacidad de gestión de la información y resolución de problemas. Primer cuatrimestre (nº de horas): 129 Clases teóricas: 24 1 FACULTAD DE CIENCIAS ·Universidad de Córdoba· Edificio de Gobierno (Campus de Rabanales) 14071-Córdoba trabajo del alumno Clases prácticas: 21 Exposiciones y seminarios: 0 Tutorías especializadas (presenciales o virtuales): 1 virtual y 2 presenciales A) Colectivas: 1 B) Individuales: 2 Realización de actividades académicas dirigidas: 13 A) Con presencia del profesor: B) Sin presencia del profesor: 13 Otro trabajo personal autónomo: 65 A) Horas de estudio: 32 hora para teoría y 16 horas para prácticas B) Preparación de trabajo personal: 17 Realización de exámenes: 2 A) Examen escrito: 2 B) Exámenes orales (control del trabajo personal): C) Examen práctico: Segundo cuatrimestre (nº de horas): 109 Clases teóricas: 28 Clases prácticas: Exposiciones y seminarios: Tutorías especializadas (presenciales o virtuales): 4 A) Colectivas: 4 B) Individuales: Realización de actividades académicas dirigidas: 10 A) Con presencia del profesor: B) Sin presencia del profesor: 10 Otro trabajo personal autónomo: 63 A) Horas de estudio: 42 B) Preparación de trabajo personal: 21 Realización de exámenes: 4 A) Examen escrito: B) Exámenes orales (control del trabajo personal): 4 C) Examen práctico: Técnicas Docentes Señalar con una X las técnicas que va a utilizar en el desarrollo de la asignatura Bloques temáticos Dividir el temario en bloques (sin nº máximo ni mínimo) Bibliografía Sesiones académicas teóricas Sesiones académicas prácticas Exposición y debate Visitas y excursiones Tutorías especializadas Otras (indicar) Búsqueda de información, análisis crítico de la misma, elaboración de informes y resolución de problemas. Desarrollo y justificación: se llevará a cabo según la normativa del Sistema Europeo de Transferencia y Acumulación de Créditos (ECTS) del Espacio Europeo de Educación Superior (EEES). BLOQUE 1. REGULACIÓN DEL METABOLISMO. Prof. Carmen Alicia Padilla Peña. BLOQUE 2. BIOSÍNTESIS DE MACROMOLÉCULAS Y REGULACIÓN DE LA EXPRESIÓN GÉNICA. Prof. Gabriel Dorado Pérez. BLOQUE 3. PRÁCTICAS DE LABORATORIO. Prof. Enriqueta Moyano Cañete General: Libros (marcados con asterisco en el primer autor los libros recomendados para el primer bloque) Alberts* B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007): “Molecular Biology of the Cell”, 5ª ed. Garland Science (Abingdon). Baumberg S (1999): “Prokaryotic Gene Expression”. Oxford University Press (Oxford). Berg JM, Tymoczko JL, Stryer L (2011): “Biochemistry”, 7th ed. Freeman (New York). Devlin* TM (2006): “Bioquímica. Libro de Texto con Aplicaciones Clínicas”, 4ª ed. (Reverté, Barcelona). Devlin TM (2010): “Textbook of Biochemistry with Clinical Correlations”, 7th ed. Wiley (Hoboken). Eisenthal R, Danson MJ (2002) : “Enzyme Assays. A Practical Approach”, 2nd ed. IRL Press (Oxford). 2 FACULTAD DE CIENCIAS ·Universidad de Córdoba· Edificio de Gobierno (Campus de Rabanales) 14071-Córdoba Fell* DM (1997): “Understanding the Control of Metabolism”. Portland Press (Colchester). Garret RH, Grisham CM (2012): “Biochemistry”, 5th ed. Brooks/Cole (Belmont). Heath JK (2001): “Principles of Cell Proliferation”. Blackwell (Oxford). Keith* NF (1998): “Regulación del Metabolismo. Una Perspectiva Humana”, 1ª ed. Omega (Barcelona). Kim CH, Ozawa, T (1991): “Bioenergetics: Molecular Biology, Biochemistry and Pathology”. Springer (New York). Klug WS, Cummings MR, Spencer C, Palladino MA (2011): “Concepts of Genetics”, 10th ed. Cummings (London). Krebs JE, Goldstein ES, Kilpatrick ST (2012): "Lewin's Genes XI", 11th ed. Jones & Bartlett (Sudbury). Latchman DS (2008): “Gene Regulation: A Eukaryotic Perspective”, 2nd ed. Springer (New York). Lawrence PA (1995): “The Making of a Fly”. Blackwell (Oxford). Lodish H, Berk A, Kaiser CA, Krieger M, Bretscher A, Ploegh H, Amon A, Scott MP (2012): “Molecular Cell Biology”, 7th ed. Freeman (New York). Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M (2008): “Biología Celular y Molecular”, 5ª ed. Editorial Médica Panamericana (Buenos Aires). Lozano JA, Galindo JD, García-Borrón JC, Martínez-Liarte JH, Peñafiel R, Solano F (2005): “Bioquímica y Biología Molecular para Ciencias de la Salud”, 3ª ed. McGraw-Hill-Interamericana (Madrid). Mathews* CK, VanHolde KE, Appling DR, Anthony-Cahill SJ (2012): "Biochemistry", 4th ed. Prentice-Hall (Nueva Jersey). Murray RK, Bender DA, Botham KM, Kennelly PJ, Rodwell VW, Weil PA, (2012): "Harper&rsquo;s Illustrated Biochemistry", 29th ed. McGraw-Hill (Columbus). Nelson* DL, Cox MM (2009): “Lehninger. Principios de Bioquímica”, 5ª ed. Omega (Barcelona). Nelson DL, Cox MM (2012): "Lehninger Principles of Biochemistry", 6th ed. Freeman (New York). Newsholme E, Leech A (2012): "Functional Biochemistry in Health and Disease", 2nd ed. Wiley (Hoboken). Ptashne MA (2004): “Genetic Switch: Phage Lambda Revisited”, 3rd ed. Cold Spring Harbor Laboratory Press (Woodbury). Snyder L, Peters JE, Henkin TM, Champness W (2012): “Molecular Genetics of Bacteria”, 4th ed. ASM Press (Washington). Stryer* L, Berg JM, Tymoczko JL (2008): “Bioquímica”, 6ª ed. Reverté (Barcelona). Voet D, Voet JG (2010): "Biochemistry", 4th ed. Wiley (Hoboken). Voet* D, Voet JG, Pratt CW (2007): “Fundamentos de Bioquímica. La Vida a Nivel Molecular”, 2ª ed. Médica Panamericana (Madrid). Voet D, Voet JG, Pratt CW (2012): “Fundamentals of Biochemistry: Life at the Molecular Level”, 4th ed. Wiley (Hoboken). Watson JD, Baker TA, Bell SP, Gann A, Levine M, Losick R (2007): “Biología Molecular del Gen”, 5ª ed. Editorial Médica Panamericana (Buenos Aires). Watson JD, Witkowski JA, Myers RM, Caudy AA (2007): “Recombinant DNA: Genes and Genomics: A Short Course”, 3rd ed. Freeman (New York). White RJ (2001): “Gene Transcription. Mechanisms and Control”. Blackwell (Oxford). Específica: Publicaciones periódicas Investigación y Ciencia, Mundo Científico, Science, Nature, etc. Trends in Biochemical Sciences, Trends in Genetics, Annual Review Biochemistry, etc. Técnicas de evaluación Enumerar, tomando como referencia el catálogo de la guía común. NINGUNA, YA QUE LA ASIGNATURA SE EXTINGUIÓ EL CURSO 2013/14 Y TODOS LOS ALUMNOS APROBARON EN JUNIO DE 2014. ESTE PROGRAMA ES POR TANTO INNECESARIO, PERO SE HA GENERADO POR REQUERIMIENTO PURAMENTE BUROCRÁTICO. Incluir criterios de evaluación y calificación (referidos a las competencias trabajadas durante el curso) Organización Docente Semanal Distribución del número de horas que se especifican en el apartado de Metodología en 18 semanas para una asignatura cuatrimestral y 36 para una anual (clases + periodo de exámenes). Indicar el número de horas que, a cada tipo de sesión, va a dedicar el estudiante cada semana. Semanas Primer cuatrimestre 2ª semana 3ª semana 4ª semana 5ª semana 6ª semana 7ª semana 8ª semana Nº de horas sesiones teóricas Nº de horas sesiones prácticas 24 2 2 1 2 2 2 2 21 Nº de horas exposiciones y seminarios Nº de horas visita y excursiones Nº de horas tutorías especializadas 3 1 11 10 3 Nº de horas control de lecturas obligatorias Exámenes (resolución de preguntas) Temas del temario a tratar 2 Temas 1 y 2 Temas 3 y 4 Tema 5 y CL1 Temas 5 y 6 Tema 6 Tema 7 Tema 7 FACULTAD DE CIENCIAS ·Universidad de Córdoba· Edificio de Gobierno (Campus de Rabanales) 14071-Córdoba 9ª semana 10ª semana 11ª semana 12ª semana 13ª semana 14ª semana 17ª semana 18ª semana 20ª semana Segundo cuatrimestre 1ª semana 2ª semana 3ª semana 4ª semana 5ª semana 6ª semana 12ª semana 13ª semana 14ª semana 15ª semana 1 2 2 0 2 1 1 2 0 28 3 3 3 3 3 3 3 3 3 1 1 Tema 8 y CL2 Tema 8 Temas 8 y 9 1 4 2 4 1 1 1 1 1 1 1 1 Tema 9 Tema 9 Tema 10/Probl. Tema 11 Examen Bloque 2 Introducción 1y2 3y4 5y6 7y8 9 y 10 Temas 1 a 10 Temas 1 a 10 Temas 1 a 10 Temas 1 a 10 BLOQUE 1. REGULACIÓN DEL METABOLISMO Prof. Carmen Alicia Padilla Peña Programa de contenidos Teóricos: Con indicación de las competencias que se van a trabajar en cada lección 1. Introducción a la regulación metabólica. Visión global del metabolismo. Definición y funciones. Estrategias tróficas. Rutas metabólicas y su regulación. Regulación y control. Aproximaciones experimentales al estudio de la regulación metabólica. Mecanismos de regulación y control. Consideraciones termodinámicas en la regulación del metabolismo. 2. Regulación de las rutas metabólicas. Visión general de la regulación de las rutas metabólicas. Regulación de la concentración de enzima (síntesis y degradación). Regulación de la actividad enzimática: inhibición, alosterismo, modificación covalente (irreversible o proteolisis controlada y reversible o interconversión). Regulación hormonal. Disponibilidad de sustrato. Ciclos de sustrato. 3. Comunicación intercelular. Introducción a la comunicación celular. Tipos de receptores: intracelulares y de membrana plasmática. Mecanismos de señalización intercelular: dependiente de contacto, paracrina, sináptica, endocrina y autocrina. Respuestas celulares frente a distintas señales: diferenciación, división, supervivencia o muerte. Diferentes tipos celulares responden de forma diferente frente a la misma señal. Señalización del óxido nítrico. 4. Comunicación intracelular. Vías de transducción de señales (I). La superfamilia de los receptores intracelulares. Mecanismos moleculares de la interacción DNA-proteína. Bases moleculares de la acción de los receptores intracelulares. Tipos de receptores de membrana. Receptores unidos a canales iónicos. Receptores serpentina y proteínas G (Gs, Gi y Gq). Transducción de señales mediante S/T-quinasas (S/T PK). La PK dependiente de AMPc. Las PK dependientes de Ca2+. La PK dependiente de DAG. La PK dependiente de AMP. Otras S/T PK. Fosfatasas de proteínas. 5. Comunicación intracelular. Vías de transducción de señales (y II). Receptores ligados a enzima. Transducción de señales mediante fosforilación de proteínas en residuos de tirosina (YPK). Receptores tirosina quinasa: activación de la proteína Ras y la vía de las MAP quinasas. Fosforilación de factores de transcripción, proliferación celular y desarrollo embrionario. Receptores asociados a tirosinas quinasas. “Receptores” tirosina fosfatasa. Receptores serina/treonina quinasa. Receptores guanilato ciclasa: la PK dependiente de GMPc. Receptores asociados a histidina quinasa. 6. Regulación del ciclo de Krebs, cadena respiratoria y fosforilación oxidativa. Funciones del ciclo de Krebs. Formación de citrato e isomerización. Descarboxilaciones oxidativas. Fosforilación a nivel de sustrato. Regeneración de oxalacetato. Balance energético y regulación del ciclo de Krebs. Carácter anfibólico y reacciones anapleróticas. Cadena de transporte de electrones: complejos y proteínas transportadoras. Estructura y mecanismo de la ATP sintasa. Fosforilación oxidativa y control respiratorio. Desacoplantes. Mecanismo quimiosmótico. 7. Metabolismo glucídico y su regulación. Visión global de metabolismo glucídico. La glucolisis y su regulación. Entrada de otros azúcares y del glicerol a la glucolisis. El piruvato como encrucijada metabólica. Fermentación láctica y alcohólica. Descarboxilación oxidativa del piruvato: complejo de la piruvato deshidrogenasa y su regulación. La gluconeogénesis a partir de piruvato. La gluconeogénesis a partir de lactato, alanina, glicerol y propionato. Regulación de glucolisis y gluconeogénesis. Ruta de las pentosas fosfato: interrelación con la glucolisis y gluconeogénesis. Multivalencia de la vía de las pentosas fosfato. Metabolismo del glucógeno: síntesis y degradación. Glucógeno fosforilasa y glucógeno sintasa: regulación a varios niveles. 8. Metabolismo lipídico y su regulación. Visión global de metabolismo lipídico. Catabolismo de los triacilgliceroles: reservas grasas, lipolisis y su regulación. Activación, entrada en la mitocondria y β-oxidación de los ácidos grasos. Balance energético. Metabolismo de los cuerpos cetónicos. Biosíntesis de ácidos grasos y triacilgliceroles. Regulación de la síntesis de ácidos grasos. Metabolismo de esteroides y lipoproteínas. Clasificación y funciones de las lipoproteínas. Entrada del colesterol en las células. Biosíntesis del colesterol y su regulación. Biosíntesis de ácidos biliares y hormonas esteroideas y su regulación. 9. Metabolismo de biomoléculas nitrogenadas y su regulación. Visión global de metabolismo de biomoléculas nitrogenadas. Catabolismo de aminoácidos: destino del nitrógeno y destino del esqueleto carbonado. Biosíntesis de aminoácidos: incorporación del nitrógeno a esqueletos carbonados. Regulación de la glutamina sintetasa. Aminoácidos esenciales. Metabolismo de los nucleótidos. Biosíntesis de nucleótidos de purina y su regulación. Biosíntesis de nucleótidos de pirimidina y su regulación. Biosíntesis de desoxirribonucleótidos y su regulación. Ruta de rescate de bases púricas. Degradación de nucleótidos y bases nitrogenadas. Excreción del nitrógeno. Ciclo de la urea: descripción, regulación y relación con el ciclo de Krebs. 10. Integración del metabolismo de glúcidos, lípidos y compuestos nitrogenados en el organismo completo. Principales puntos de 4 FACULTAD DE CIENCIAS ·Universidad de Córdoba· Edificio de Gobierno (Campus de Rabanales) 14071-Córdoba conexión entre el metabolismo de glúcidos, lípidos y proteínas. Características metabólicas de los órganos y tejidos (hígado, cerebro, músculo esquelético, corazón, tejido adiposo, riñón). Regulación hormonal del metabolismo energético. Visión integrada del metabolismo. 11. Respuesta y regulación metabólica en situaciones extremas. Respuesta y regulación metabólica frente al ayuno. Respuesta y regulación metabólica frente al ejercicio. Alteraciones del metabolismo de las lipoproteínas. Alteraciones metabólica en la diabetes mellitus. Balance energético y regulación del peso corporal. Competencias que se trabajan en cada tema: Específicas: tener una visión integrada del funcionamiento celular (metabolismo). Cognitivas (saber): metabolismo bioquímico; regulación metabólica. Procedimentales/instrumentales (saber hacer): gestionar la información; resolver problemas. Actitudinales (ser): interés; comportamiento; puntualidad. BLOQUE 2. BIOSÍNTESIS DE MACROMOLÉCULAS Y REGULACIÓN DE LA EXPRESIÓN GÉNICA Prof. Gabriel Dorado Pérez 1. Material genético. DNA y RNA. Número de tipos celulares vs tamaño de genomas. DNA repetitivo. Superenrollamiento. Histonas. 2. Replicación. Tipo de replicación. Inicio. Elongación. Terminación. Telómeros y telomerasa. 3. Regulación de la expresión génica. Dogma central. Procariotas vs eucariotas. Transcripción en procariotas. Transcripción en eucariotas. Ayustamiento. Código genético. Traducción en procariotas. Traducción en eucariotas. 4. Expresión génica en procariotas (I). Introducción. Operón. Control positivo/negativo de inducción/represión. Operón lac, ara y gal. Regulón SOS. Esporulación. Fagos: lisis/lisogenia. 5. Expresión génica en procariotas (y II). Atenuación. RNA antisentido. Zona codificante. Autorregulación. Respuesta severa. Ayustamiento de proteínas. 6. Expresión génica en eucariotas (I). Amplificación génica. Reorganización génica. Regulación transcripcional y postranscripcional. Factores de transcripción (TF). Fosforilación/desfosforilación de TF. Estructura de los TF. 7. Expresión génica en eucariotas (y II). Histonas. Metilación. Ayustamiento alternativo. Extremos 5’ y 3’ del mRNA. Transporte del mRNA. Degradación del mRNA. Traducción. 8. Plegamiento y transporte de proteínas. Plegamiento. Chaperonas. Chaperoninas. Chaperonas intramoleculares. Enfermedades. Transporte. 9. Ciclo celular. Procariotas: metilación. Eucariotas: factor promotor de la mitosis (MPF) (kinasas y ciclinas). P53 y apoptosis. Transducción de señales: kinasas de MAP (MAPK). Control del ciclo celular en vertebrados: MAPK (kinasa); CDK (kinasa) y ciclinas A, E y D; cdc2 (kinasa) y ciclinas B. 10. Desarrollo embrionario. Pérdida de núcleo y cromosomas. Totipotencia. Desarrollo embrionario: genes de efecto materno y genes zigóticos (genes de segmentación y genes homeóticos). Comunicación celular. Apoptosis. Competencias que se trabajan en cada tema: Específicas: tener una visión integrada del funcionamiento celular (expresión génica). Cognitivas (saber): biología molecular. Procedimentales/instrumentales (saber hacer): gestionar la información; resolver problemas. Actitudinales (ser): interés; comportamiento; puntualidad. BLOQUE 3. PRÁCTICAS DE LABORATORIO Prof. Enriqueta Moyano Cañete Programa de contenidos Prácticos: Con indicación de las competencias que se van a trabajar: Mecanismo de Control y Seguimiento: Sistema de un híbrido en levaduras para el estudio de la activación de factores de transcripción. Caracterización de interacciones DNA-proteínas. Competencias que se trabajan en la práctica: Transversales/genéricas: interpretar resultados experimentales e identificar elementos consistentes e inconsistentes. Procedimentales/instrumentales (saber hacer): interpretar resultados experimentales e identificar elementos consistentes e inconsistentes. Actitudinales (ser): interés; comportamiento; puntualidad. Interacción diaria con los alumnos (retroalimentación) en clase, tutorías presenciales y virtuales. Evaluación del progreso semanal, mensual y cuatrimestral. Encuestas a los alumnos. Al margen de las contempladas a nivel 5 FACULTAD DE CIENCIAS ·Universidad de Córdoba· Edificio de Gobierno (Campus de Rabanales) 14071-Córdoba general para toda la experiencia piloto, se recogerán aquí los mecanismos concretos que los docentes propongan para el seguimiento de cada asignatura 6 FACULTAD DE CIENCIAS ·Universidad de Córdoba· Edificio de Gobierno (Campus de Rabanales) 14071-Córdoba Distribución ECTS (a) 1 ECTS = 26,67 horas trabajo. (b) Estudio personal del alumno durante el curso 18 (cuatrimestral) o 36 (anual) semanas: 1,5 horas de estudio por cada hora de teoría y 0,75 horas de estudio por cada hora de prácticas. (c)Las tutorías se encuentran incluidas en el total de Actividades Académicamente Dirigidas. Actividad Actividad Docente Evaluación Horas presenciales Horas no presenciales Horas ECTS a 24% 52 h 74 h b 126 h Problemas numéricos. Se valorarán razonamientos, unidades y convenios, resultados, lenguaje, etc. % nº h nhb nh Exposición del seminario en el aula Se valorará contenido, exposición, presentación, etc. % nº h nº h b nº h Presentación de normas. Explicación de las prácticas Cuaderno de laboratorio, anotaciones, experimentos, ejercicios, informe, etc. Evaluación continuada, cuaderno, ejercicios, informes, actitud 10% 21 h 16 h b 37 h Prácticas de campo Explicación de las prácticas Cuaderno de campo, anotaciones, ejercicios, informe, etc. Evaluación continuada, cuaderno, ejercicios, informes, actitud % nº h nº h b nº h Ejercicios y problemas, realización de trabajos, informes, seminarios, etc. Preparar colección base de cuestiones teóricas y problemas Resolver cuestiones y problemas propuestos por el profesor y por el alumno Ejercicios, trabajos, informes, etc. 66% 4h 30 h 34 h Preparación de examen (nº horas) Realización de examen (nº horas) 6h 38 h 44h Preparación de examen (nº horas) Realización de examen (nº horas) nº h nº h nº h 83 h 158 h 241h Materia Profesor Alumno Procedimiento Peso en la nota final Teoría Exposición de la Teoría. Apoyo con audiovisuales Tomar apuntes, copiar el material audiovisual Tipo de preguntas. Se valorará razonamiento y capacidad de síntesis Ejercicios y problemas Respuestas y soluciones Apuntes. Formulación de preguntas y dudas Seminarios Distribución de los trabajos, recomendar bibliografía, orientar Clases en laboratorio Prácticas de laboratorio Clases en campo Actividades dirigidasc Clases en aula Teoría y/o problemas Poner, vigilar y corregir el examen. Calificar globalmente al alumno Exámenes Prácticas TOTAL CARGA DOCENTE DEL ALUMNO 7 100 %