Curso 07-08 - Universidad Politécnica de Madrid
Anuncio

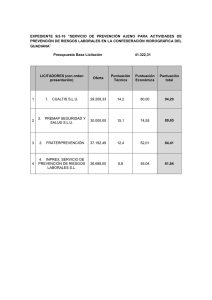
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) MODELO Modelo 2007-2008 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos partes. En la primera parte se propone un conjunto de cinco cuestiones de las que el alumno resolverá únicamente tres. La segunda parte consiste en dos opciones de problemas, A y B. Cada una de ellas consta de dos problemas; el alumno podrá optar por una de las opciones y resolver los dos problemas planteados en ella, sin que pueda elegir un problema de cada opción. Cada cuestión o problema puntuará sobre un máximo de dos puntos. No se contestará ninguna pregunta en este impreso. TIEMPO: una hora y treinta minutos PRIMERA PARTE Cuestión 1.- Para cada uno de los elementos con la siguiente configuración electrónica en los niveles de energía más externos: A=2s2 2p4; B=2s2; C= 3s2 3p2; D= 3s2 3p5 a) Identifique el símbolo del elemento, el grupo y el periodo en la Tabla Periódica. b) Indique los estados de oxidación posibles para cada uno de esos elementos. c) Justifique cuál tendrá mayor rádio atómico, A o B. d) Justifique cuál tendrá mayor electronegatividad, C o D. Puntuación máxima por apartado: 0,5 puntos. Cuestión 2.- Dados los siguientes compuestos: H2S, BCl3 y N2. a) Escriba sus estructuras de Lewis b) Deduzca la geometría de cada molécula por el método RPECV o a partir de la hibridación. c) Deduzca cuáles de las moléculas son polares y cuáles no polares. d) Indique razonadamente la especie que tendrá un menor punto de fusión. Puntuación máxima por apartado: 0,5 puntos. Cuestión 3.- Un componente A se descompone según la reacción 2 A ' B + C que es exotérmica, espontánea a temperatura ambiente y tiene una energía de activación alta. a) Indique, en un diagrama entálpico, entalpía de reacción y energía de activación. b) Justifique si la reacción de descomposición es rápida o lenta a temperatura ambiente. c) Justifique qué proceso es más rápido, el directo o el inverso. d) Justifique si un aumento de temperatura favorece la descomposición desde el punto de vista del equilibrio y de la cinética. Puntuación máxima por apartado: 0,5 puntos. Cuestión 4.- Sea una disolución acuosa 1 M de un ácido débil monoprótico cuya Ka = 10-5 a 25 ºC. Justifique si las siguientes afirmaciones son verdaderas o falsas. a) Su pH será mayor que 7. b) El grado de disociación será aproximadamente 0,5. c) El grado de disociación aumenta si se diluye la disolución. d) El pH aumenta si se diluye la disolución. Puntuación máxima por apartado: 0,5 puntos. 1 Cuestión 5.- Escriba un ejemplo representativo para cada una de las siguientes reacciones orgánicas, considerando únicamente compuestos reactivos con 2 átomos de carbono. Formule y nombre los reactivos implicados: a) Reacción de sustitución en derivados halogenados por grupos hidroxilo. b) Reacción de esterificación. c) Reacción de eliminación (Alcoholes con H2SO4 concentrado) d) Reacción de oxidación de alcoholes Puntuación máxima por apartado: 0,5 puntos. 2 SEGUNDA PARTE OPCIÓN A Problema 1.- En el espectro del átomo hidrógeno hay una línea situada a 434,05 nm. a) Calcule ΔE para la transición asociada a esa línea expresándola en kJ·mol-1. b) Si el nivel inferior correspondiente a esa transición es n=2 , determine cuál será el nivel superior. Datos: h= 6,62·10-34J·s ; NA= 6,023·1023 ; RH= 2,180·10-18 J ; c=3·108m·s-1 Puntuación máxima por apartado: 1,0 punto. Problema 2.- Una disolución 0,1 M de un ácido monoprótico, HA, tiene un pH de 4,8. Calcule: a) Las concentraciones en el equilibrio de todas las especies presentes en la disolución (incluir la concentración de OH–). b) La constante de disociación del ácido HA y el grado de disociación del ácido. Dato. Kw = 1·10─14 Puntuación máxima por apartado: 1,0 punto. OPCIÓN B Problema 1.- La urea, H2N(CO)NH2, es una sustancia soluble en agua, que sintetizan multitud de organismos vivos, incluyendo los seres humanos, para eliminar el exceso de nitrógeno. A partir de los datos siguientes, calcule: a) Ajuste la reacción de formación de la urea, H2N(CO)NH2 (s), a partir de amoniaco, NH3 (g), y dióxido de carbono, CO2 (g), sabiendo que en la misma también se produce H2O(l). Obtenga la entalpía de formación de la misma. b) Calcule la entalpía del proceso de disolución de la urea en agua. c) Razone si un aumento de temperatura favorece o no el proceso de disolución de la urea. Entalpías de formación estándar (en kJ/mol): NH3 (g) = -46,11; H2N(CO)NH2 (s) = -333,19; H2NCONH2 (aq) = -319,2; CO2 (g) = -393,51; H2O (l) = -285,83. Puntuación máxima por apartado: a) 1,0 punto; b) y c) 0,5 puntos. Problema 2.- Dada la reacción en la que el ión permanganato (tetraoxomanganato (VII)) oxida, en medio ácido, al dióxido de azufre, obteniéndose ión tetraoxosulfato (VI) e ion manganeso (II), a) Ajuste la reacción iónica por el método del ion-electrón. b) Calcule el potencial estándar de la pila y justifique sí la reacción será o no espontánea en esas condiciones. c) Calcule el volumen de una disolución de permanganato 0,015M necesario para oxidar 0,32g de dióxido de azufre. Datos: Potenciales estándar de electrodo: MnO4-,H+/Mn2+ = +1,51V; SO42-,H+/SO2(g) = +0,17V; Pesos atómicos: S = 32 y O = 16 Puntuación máxima por apartado: a) y b) 0,75 puntos y c) 0,5 puntos. 3 QUÍMICA CRITERIOS ESPECÍFICOS DE CORRECCIÓN Cada cuestión se podrá calificar con un máximo de 2 puntos; por ello, la máxima puntuación que se podrá alcanzar en la PRIMERA PARTE será de 6 puntos. Cada problema se podrá calificar igualmente con un máximo de dos puntos, por lo que la SEGUNDA PARTE podrá tener una puntuación máxima de 4 puntos. Si se han contestado más de tres cuestiones, únicamente deberán corregirse las tres que se encuentren en primer lugar. Si se resuelven problemas de más de una opción, únicamente se corregirán los de la opción a la que corresponda el problema resuelto en primer lugar. Se tendrá en cuenta en la calificación de la prueba: 1.- Claridad de comprensión y exposición de conceptos. 2.- Uso correcto de formulación, nomenclatura y lenguaje químico. 3.- Capacidad de análisis y relación. 4.- Desarrollo de la resolución de forma coherente y uso correcto de unidades. 5.- Aplicación y exposición correcta de conceptos en el planteamiento de los problemas. Distribución de puntuaciones máximas para este ejercicio: CUESTIONES Cuestión 1.- 0,5 puntos cada uno de los apartados. Cuestión 2.- 0,5 puntos cada uno de los apartados. Cuestión 3.- 0,5 puntos cada uno de los apartados. Cuestión 4.- 0,5 puntos cada uno de los apartados. Cuestión 5.- 0,5 puntos cada uno de los apartados. PROBLEMAS Opción A Problema 1.- 1,0 punto cada uno de los apartados. Problema 2.- 1,0 punto cada uno de los apartados. Opción B Problema 1.- 1,0 punto apartado a) y 0,5 puntos apartados b) y c). Problema 2.- 0,75 puntos apartados a) y b), y 0,5 puntos apartado c). SOLUCIONES (ORIENTACIONES PARA EL CORRECTOR) Cuestión 1.- Puntuación máxima por apartado: 0,5 puntos. a) A= O; 2º periodo, grupo 16 (VIA o anfígenos) B= Be; 2º periodo, grupo 2 (IIA o alcalinotérreos) C= Si; 3er periodo, grupo 14 (IVA o carbonoideos) D= Cl; 3er periodo, grupo 17 (VIIA o halógenos) b) A: -2, -1 y 0; B: +2 y 0; C: +2, +4 y 0 ; D: -1, +1, 0, +3, +5 y +7 c) El elemento de mayor rádio es B (Be) porque al irse completando la capa (periodo) se reduce el radio. d) El elemento más electronegativo es el D (Cl) porque únicamente necesita un electrón para completar su configuración de capa completa (está más a la derecha en la tabla y en el mismo periodo). Cuestión 2.- Puntuación máxima por apartado: 0,5 puntos. _ _ _ a) H-S-H :Cl-B-Cl: :N≡N: | :Cl: b) H2S: 2 átomos unidos al átomo central y dos pares sin compartir (hibridación sp3). Molécula angular, ángulos algo menores de 109º. BCl3: 3 átomos unidos al átomo central y ningún par sin compartir (hibridación sp2). Molécula plana triangular, ángulos de 120º. N2: 2 átomos unidos (hibridación sp). Molécula lineal. c) N2 y BCl3 son apolares. Enlaces apolares para N2 y y geometría triangular plana para BCl3 en la que se anulan los dipolos de enlace por su geometría; H2S es polar por tener enlaces polares y no ser lineal. d) N2<BCl3<H2S El N2 y el BCl3 presentan fuerzas intermoleculares débiles, tipo London (dipolo instantáneo-dipolo inducido). Estas fuerzas son menores para N2 por ser menor su masa molecular. En el H2S las fuerzas intermoleculares son dipolo permanente, que es más fuerte. Cuestión 3.- Puntuación máxima por apartado: 0,5 puntos. a) b) La reacción de descomposición será lenta a temperatura ambiente ya que la energía de activación es alta. Ea c) La energía de activación del proceso inverso es mayor que la del directo por tratarse de una reacción exotérmica, por tanto el proceso inverso es aún más lento. 2A d) Por Le Chatelier, un aumento de temperatura en un proceso exotérmico ΔHr desplaza el equilibrio hacia el reactivo A, se favorece el proceso inverso y la B+C descomposición se desfavorece. Pero por la ecuación de Arrhenius un aumento de temperatura aumenta la velocidad de descomposición y favorece la cinética. Cuestión 4.- Puntuación máxima por apartado: 0,5 puntos. a) Falsa. Por ser disolución de ácido el pH debe ser ácido, es decir menor que 7. b) Falsa. Por ser débil, con una Ka de 10-5 y su concentración 1 M será muy inferior a 0,5 (aprox 0,01). c) Verdadera. Al ser un ácido débil monoprótico Ka = cα2/(1-α) y como Ka es cte a T=cte, si c disminuye α aumenta d) Verdadera. Al diluir la disolución la [H+] disminuye luego disminuye la acidez de la disolución por lo que el pH aumenta. Cuestión 5.- Puntuación máxima por apartado: 0,5 puntos. Algunos ejemplos válidos como respuesta pueden ser los siguientes: OHa) CH3-CH2Cl (cloruro de etilo) CH3-CH2OH (etanol) b) CH3-COOH(ácido acético)+CH3-CH2OH(etanol) CH3-COOCH2-CH3 (acetato de etilo) H2SO4 c) CH3-CH2OH (etanol) CH2=CH2 (eteno) KMnO4 d) CH3-CH2OH (etanol) CH3-COOH(ácido acético) Soluciones 1/2 Soluciones a los problemas: OPCIÓN A Problema 1.- Puntuación máxima por apartado: 1,0 punto. a) ΔE= h c/λ ΔE= 276 kJ·mol-1 2 n=5 b) ΔE= RH( 1/2 – 1/n2) Problema 2.- Puntuación máxima apartado: 1,0 punto. HA ' H+ + A– (o también HA + H2O ' H3O+ + A–) (0,1 − x) x x x = [H+] = 10–4,8 = 1,58·10–5 M [H+] = [A–] = 1,58·10–5 M [HA] = 0,1 – 1,58·10–5 M ≈ 0,1 M [OH–] = Kw / [H+] = 10–14 / 1,58·10–5 = 6,33·10–10 M b) Ka = (1,58·10–5)2 / 0,1 = 2,5·10–9 Grado de ionización = 1,58·10–5/ 0,1 = 1,58·10–4 a) OPCIÓN B Problema 1.- Puntuación máxima por apartado: a) 1,0 puntos; b) y c) 0,5 puntos. a) Reacción ajustada: 2NH3 (g) + CO2 (g) → H2N(CO)NH2 (s) + H2O(l) Para la reacción de formación, aplicamos la metodología clásica de ver las entalpías de reacción de productos y reactivos, restándolas entre sí con sus correspondientes coeficientes estequiométricos: ΔHR = ΔHf (urea(s)) + ΔHf (H2O (l)) – 2 ΔHf (NH3 (g)) – ΔHf (CO2 (g)) = –333,19 – 285,83 – ( 2 × –46,11 –393,51) = –133,29 kJ/mol b) El proceso es ahora H2N(CO)NH2 (s)→ H2N(CO)NH2 (aq) Y aplicando la misma metodología, ΔHdis = ΔHf (urea(aq)) – ΔHf (urea(s)) = –319,2 – (–333,19) = 13,99 kJ/mol. c) El proceso de disolución es endotérmico, al tener un cambio de entalpía positivo, por lo tanto la solubilidad aumentará al aumentar la temperatura. Problema 2.- Puntuación máxima por apartado: a) y b) 0,75 puntos y c) 0,5 puntos. a) Reducción: MnO4- + 8H+ + 5e- Mn2+ + 4H2O x2 2+ Oxidación: SO2 + 2H2O SO4 + 4H + 2e x5 2MnO4- + 16H+ + + 10H2O 2Mn2+ + 8H2O + + 20H+ ; 2MnO4- + 5SO2 + 2H2O 2Mn2+ + 5SO42-+ 4H+ b) Eº = 1,51V- 0,17V = 1,34V. Si será espontánea al ser E0>0 y por tanto UG0<0 c) n(SO2) = 0,32g/64g·mol-1 n(MnO4-) = 0,005moles(SO2)·2moles(MnO4-)/5moles(SO2) = 0,002 moles V(MnO4-) = 0,002moles/0,015moles·L-1 = 0,1333L = 133,3mL Soluciones 1/2